-
Medical journals
- Career
Belimumab v terapii systémového lupus erythematodes a v dalších indikacích
Authors: H. Ciferská 1; D. Tegzová 1; J. Vachek 2
Authors‘ workplace: Revmatologický Ústav, Praha a Revmatologická klinika 1. LF UK, Praha 1; Nefrologická klinika, Všeobecná fakultní nemocnice 1. LF UK, Praha 2
Published in: Čes. Revmatol., 22, 2014, No. 4, p. 124-132.
Category: Original Papers
Overview
Belimumab je plně humánní rekombinantní IgG1λ monoklonální protilátka, která blokuje vazbu solubilního BLyS (soluble B lymphocyte stimulator) na B lymfocyty. Belimumab je první lék biologické povahy schválený FDA (U. S. Food and Drug Administration) a EMA (European Medicines Agency) k terapii systémového lupus erythematodes (SLE). Zatím je určen pro pacienty bez nefrologických či neurologických manifestací SLE. Belimumab byl a je rovněž zkoušen i u jiných autoimunitních onemocnění (Sjögrenův syndrom, ANCA asociované vaskulitidy) a dalších stavů. Tato práce si klade za cíl podat přehledné informace o belimumabu (farmakologické vlastnosti, indikace a klinické studie) a demonstrovat jeho efektivitu v terapii SLE na kazuistickém příkladu.
Klíčová slova:
Belimumab, biologická terapie, systémový lupus erythematodes, BLyS, revmatoidní artritida, Sjögrenův syndrom, ANCA asociované vaskulitidyÚvod
Belimumab je rekombinantní lidský imunoglobulin (Ig) G1-λ s molekulární hmotností 147 kDa, který dokáže vytvořit komplex se solubilní formou BLys. Blokádou vazby BLyS na jeho receptory dojde ke snížení aktivace, diferenciace a přežíváni B lymfocytů. Dochází tím i ke snížení tvorby autoprotilátek a aktivace T lymfocytů. Belimumab se neváže přímo na B lymfocyty, ale působí prostřednictvím vazby na solubilní formu BLyS (1). Belimumab je první lék biologické povahy schválený FDA (U. S. Food and Drug Administration) a EMA (European Medicines Agency) v roce 2011 k terapii systémového lupus erythematodes (SLE).
BLyS (B Lymphocyte Stimulator /stimulátor B lymfocytů) nebo také BAFF (B-cell activating factor/ B lymfocyty aktivující faktor) je jeden z klíčových cytokinů ovlivňujících maturaci a přežívání různých diferenciačních stadií B lymfocytů, včetně jejich autoreaktivních klonů. BLyS je protein obsahující 285 aminokyselin, který patří do rodiny tumor nekrotizujícího faktoru (TNF) společně s ligandem indukujícím proliferaci (APRIL). BLyS se exprimuje na povrchu buněk, kde dochází k jeho štěpení na solubilní proteinový fragment. Vyšší vyplavovaní solubilní formy BLyS je podpořeno dalšími zánětlivými cytokiny (interleukin-2, interferon-γ, TNFα) (2, 3).
BLyS má schopností se vázat se třemi receptory na povrchu B lymfocytů – BLyS receptor 3 (BR3), transmembránový aktivátor-1 modulátor vápníku a cyklofilin ligand-interaktor (TACI) a antigen maturace B lymfocytů (BCMA). Receptory se liší v síle vazby k BLyS, nejsilnější vazbu má na receptor BR3. Inhibice vazby BLyS na BR3 receptor vede k přerušení maturace a vyvolá apoptózu B lymfocytů. Hyperaktivita B lymfocytů má důležitou úlohu v patogenezi SLE, revmatoidní artritidy (RA), Sjögrenova syndromu (SS), vaskulitid, při vzniku rejekce transplantovaného orgánu a hematologických onemocnění (4–7).
SLE je autoimunitní multiorgánové onemocnění se závažnou prognózou. Onemocnění nemá jednotnou manifestaci a jednotlivé projevy se u různých pacientů projevují s odlišnou závažností. SLE může probíhat pod obrazem mírné kožně kloubní formy, provázené nevýraznými laboratorními odchylkami, až po těžké multiorgánové, často život ohrožující manifestace zpravidla s výraznými imunologickými nálezy (lupusová nefritida, postižení centrálního nervového systému, hematologické abnormality a další) (tab. 1) (8).
Table 1. Stručný přehled manifestací systémového lupus erythematodes (SLE). 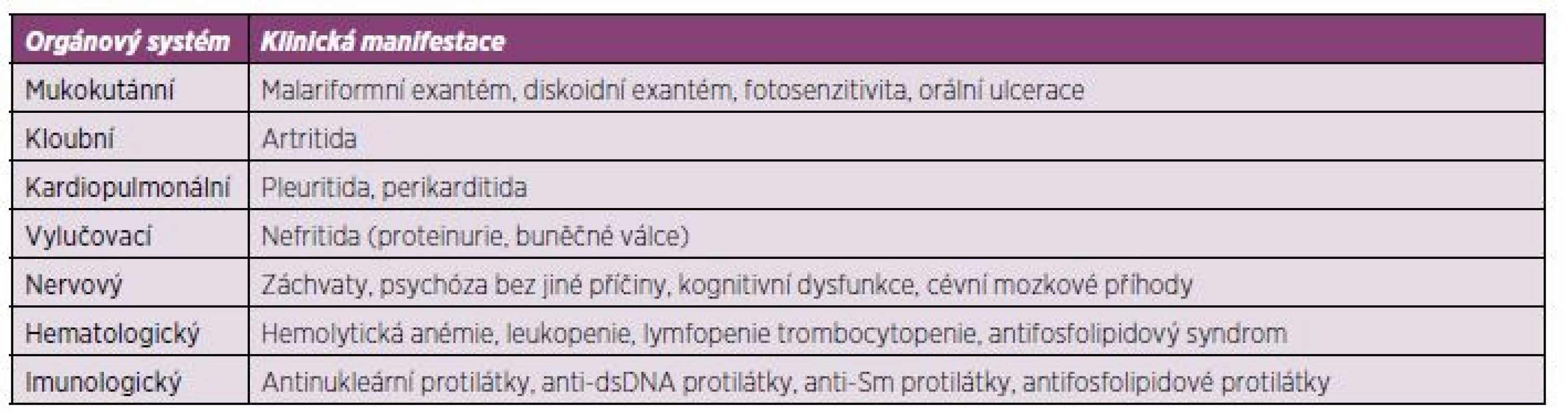
Je zřejmé, že se na rozvoji SLE podílí řada faktorů (genetická predispozice, imunologické abnormality, hormonální dysbalance, léky, zevní prostředí a další), nicméně přesný patogenetický mechanismus jeho vzniku nebyl dosud zcela objasněn (8,9).
Je zřejmé, že dochází k porušení vztahu mezi T a B lymfocyty (defektní apoptóza, přežívání autoreaktivních klonů, nadprodukce autoprotilátek, porucha signálních molekul a jejich receptorů a další). Autoreaktivní B lymfocyty se podílejí na tvorbě protilátek a ovlivňují negativně aktivaci imunitního systému prostřednictvím prezentace antigenu a kostimulačních molekul, které vedou k aktivaci a diferenciaci T lymfocytů (6, 10).
Sjögrenův syndrom (SS) je autoimunitní onemocnění postihující především žlázy s exokrinní exkrecí. Dochází k jejich lymfocytární infiltraci, přičemž T lymfocyty (CD4+) tvoří největší část lymfocytárního infiltrátu exokrinních žláz. Naopak populace B lymfocytů je zvýšena v periferní krvi, ale podílí se jen nepatrně na infiltraci tkáně. Nejčastěji jsou postiženy slinné a slzné žlázy, ale dle tíže onemocnění může být narušena funkce i dalších exokrinních žláz (potní a poševní žlázy, pankreas, hlenové žlázy střev a bronchů). Dalším charakteristickým rysem choroby je přítomnost autoprotilátek anti-Ro (anti-SS-A) a anti-La (anti-SS-B) či revmatoidních faktorů. Onemocnění se vyskytuje ve dvou formách, a to primární a sekundární doprovázející jiné autoimunitní onemocnění (SLE, revmatoidní artritidu a další) (11, 12).
Vysoké hladiny solubilního BLyS korespondují s jeho zvýšenou membránovou expresí a byly dokumentovány u pacientů s autoimunitními onemocněními (SLE, SS a dalších). Blokáda vazby solubilní části BLyS na jeho receptory s inhibicí jeho aktivity, byla potvrzena jako dobrý terapeutický nástroj u SLE a zdá se, že bude mít efekt i u SS (4, 7).
Farmakologické vlastnosti
Farmakodynamické vlastnosti. Studie na myších modelech s podáváním belimumabu prokázala zvýšenou akumulaci zralých forem B lymfocytů ve slezině. Hmotnost myší sleziny se statisticky signifikantně lišila mezi skupinami s belimumabem v závislosti na dávce léčiva proti kontrolní skupině (p < 0,05, p < 0,0005, resp.).
Belimumab podávaný jednou za 7 dní ve 4 cyklech opicím Cynomolgus vedl k depleci populace B lymfocytů ve slezině a lymfatických uzlinách. V další studii prováděné na opicích Cynomolgus byl prokázán postupný pokles B lymfocytů (CD20+) v periferní krvi, slezině a lymfatických uzlinách proti stavu před zahájením podávání belimumabu (1, 13–15).
U pacientů léčených belimumabem byly v klinických studiích zjištěny výrazně snížené hladiny cirkulujících C19+, CD20+, aktivovaných B lymfocytů. Při dlouhodobém klinickém sledování byly statisticky signifikantně snížené hladiny B lymfocytů v 52. týdnu léčby (p = 0,008). Studie prokázaly, že belimumab ovlivňuje nejdříve (v týdnu 12 a 14) pokles nově aktivovaných B lymfocytů (p < 0,05), později (v týdnu 76) až pokles plazmatických buněk (p < 0,01) a paměťových buněk (p < 0,05). Nemá však vliv na dlouho žijící plazmatické buňky, které jsou zodpovědné za tvorbu autoprotilátek. Ve studii byly zaznamenány i změny dalších imunologických parametrů, u pacientů s hypergamaglobulinémií došlo k normalizaci hladin IgG až u 49 % nemocných do 52. týdne léčby. Reverze hypokomplementémie byla shledána u 44 % pacientů léčených belimumabem proti 19 % v placebové skupině. Rovněž bylo pozorováno vymizení protilátek proti dvouvláknové DNA (anti-dsDNA) u 16 % pacientů v 52. týdnu ve srovnání se 7 % pacientů dostávajících placebo (14,16,17).
Farmakokinetické vlastnosti. Farmakokinetické vlastnosti belimumabu jsou obdobné jako u jiných intravenózních imunoglobulinů, nebo rekombinantních humánních IgG monoklonálních protilátek. Belimumab v intravenózní dávce 10 mg/kg dosahoval maximálních sérových koncentrací (rozmezí: 173–573 µg/ml) v průběhu konce, či krátce po dokončení podávání. Sérová koncentrace belimumabu klesala biexponenciálním způsobem s distribučním poločasem 42 hodin a s terminálním poločasem 19,4 dne. Clearance byla v rozmezí 69–622 ml/den. Celkový distribuční objem belimumabu byl 5,29 l. Přesná degradace belimumabu není přesně známa, nicméně se předpokládá, že se rozkládá na malé peptidy a následně aminokyseliny proteolytickými enzymy. Dosud chybí podrobnější data o farmakokinetických vlastnostech belimumabu u pacientů s renálním či hepatálním postižením, u dětí a pacientů starších 65 let. Nicméně na opičích modelech bylo zjištěno, že belimumab má schopnost procházet placentární bariérou a byl detekován u novorozených mláďat. Rovněž má schopnost procházet v nízkých hladinách do mateřského mléka (16, 17, 18).
Interakce. V klinických studiích u pacientů se SLE nebyly prokázány výraznější interakce, či změny farmakokinetických vlastností souběžně podávaných léčiv (antimalarika, glukokortikoidy, azathioprin, methotrexát, mykofenolát mofetil, ACE inhibitorů, nesteroidních antirevmatik a statinů). Není doporučována kombinace s dalšími léky biologické povahy, jejichž cílem jsou B lymfocyty (anti-CD20 – rituximab) kvůli nárůstu rizika závažných infekcí, stejně tak není vhodná souběžně probíhající terapie cyklofosfamidem. Rovněž není výrobcem doporučována vakcinace živými vakcínami při probíhající léčbě belimumabem. Nicméně podrobnější studie lékových interakcí stále chybí (14, 18).
Bezpečnost. Klinické studie vykazovaly poměrně dobré výsledky stran bezpečnosti a výskytu nežádoucích účinků.
U celkem 2 133 pacientů se SLE sledovaných ve studiích fáze II a III byl hlášen výskyt nežádoucích příhod, bez ohledu na závažnost u 93 % pacientů léčených placebem a u 92 % pacientů na belimumabu. Nejčastěji byly hlášeny: nevolnost (15 %), průjem (12 %), pyretická reakce (10 %), nazofaryngitida (9 %), bronchitida (9 %), nespavost (7 %), deprese (5 %), bolesti hlavy (5 %), cystitida (4 %), leukopenie (4 %) a virová gastroenteritida (3 %).
V průběhu klinických sledování hodnotících účinnost belimumabu u SLE bylo zaznamenáno celkem 10 případů malignit, z toho 5 nádorů solidních orgánů (dva nádory prsu a po jednom nádor žaludku, děložního čípku a ovaria) a 5 nemelanomových nádorů kůže. Hematologické malignity ve sledované skupině zaznamenány nebyly. Dokumentováno bylo 15 úmrtí v průběhu sledování, z toho tři úmrtí v placebové skupině (u BLISS-52) v důsledku infekční komplikace, kardiovaskulární příhody a jedno z neobjasněné příčiny. Ve skupině pacientů léčených belimumabem v dávce 1 mg/kg bylo celkem 6 úmrtí (malignita, cévní mozková příhoda, sebevražda, infekce a jedenkrát z neobjasněné příčiny), ve skupině 10 mg/kg bylo rovněž 6 úmrtí (jedno v důsledků SLE, tři pro infekci, jedna sebevražda a jedna z kardiovaskulárních příčin). Závažné infekční komplikace se vyskytovaly ve skupině pacientů léčených belimumabem (6,0 %) i u placeba (5,2 %). Hypersenzitivní reakce po podání infuze (od anafylaktického šoku až po lokální kožní reakce) se vyskytly celkem u 13 % pacientů dostávajících belimumab u 11 % ve skupině placeba (19–21).
Indikace
Belimumab (BenlystaTM) byl registrován k terapii SLE. Úspěšná registrace proběhla i v České republice pro terapii pacientů se SLE, úhrada belimumabu zdravotními pojišťovnami však dosud uzavřena není.
V doporučených postupech České revmatologické společnosti (ČRS) pro terapii SLE jsou mimo jiné uvedena indikační kritéria léčby belimumabem, vycházející z doporučení FDA a EMA. Belimumab není zatím indikován a jeho podání není doporučeno u pacientů s těmito orgánovými manifestacemi choroby: aktivní neurolupus s postižením centrálního nervového systému, aktivní lupusová nefritida III., IV. a V. typu vyžadující standardní léčbu dle protokolu, proteinurie > 6 g/24 h, zvýšení kreatininu > 220 µmol/l. Nesmí být přítomna hypogamaglobulinémie (IgG < 400 mg/dl) nebo deficience IgA (IgA < 10 mg/dl). Vylučujícím kritériem pro terapii je přítomnost hepatitidy B a C, HIV pozitivita či závažná probíhající infekce.
U pacientů indikovaných k terapii belimumabem musí být přítomna klinická i humorální aktivita SLE: Laboratorně musí být přítomna pozitivita antinukleárních protilátek (ANA) nebo anti-dsDNA protilátek či snížení hladin komplementu. Aktivita choroby hodnocená skórovacím systémem SELENA-SLEDAI musí být ≥ 6 (tab. 2)
Table 2. Skórovací systémy aktivity a kvality života využívané v klinických studiích s belimumabem. 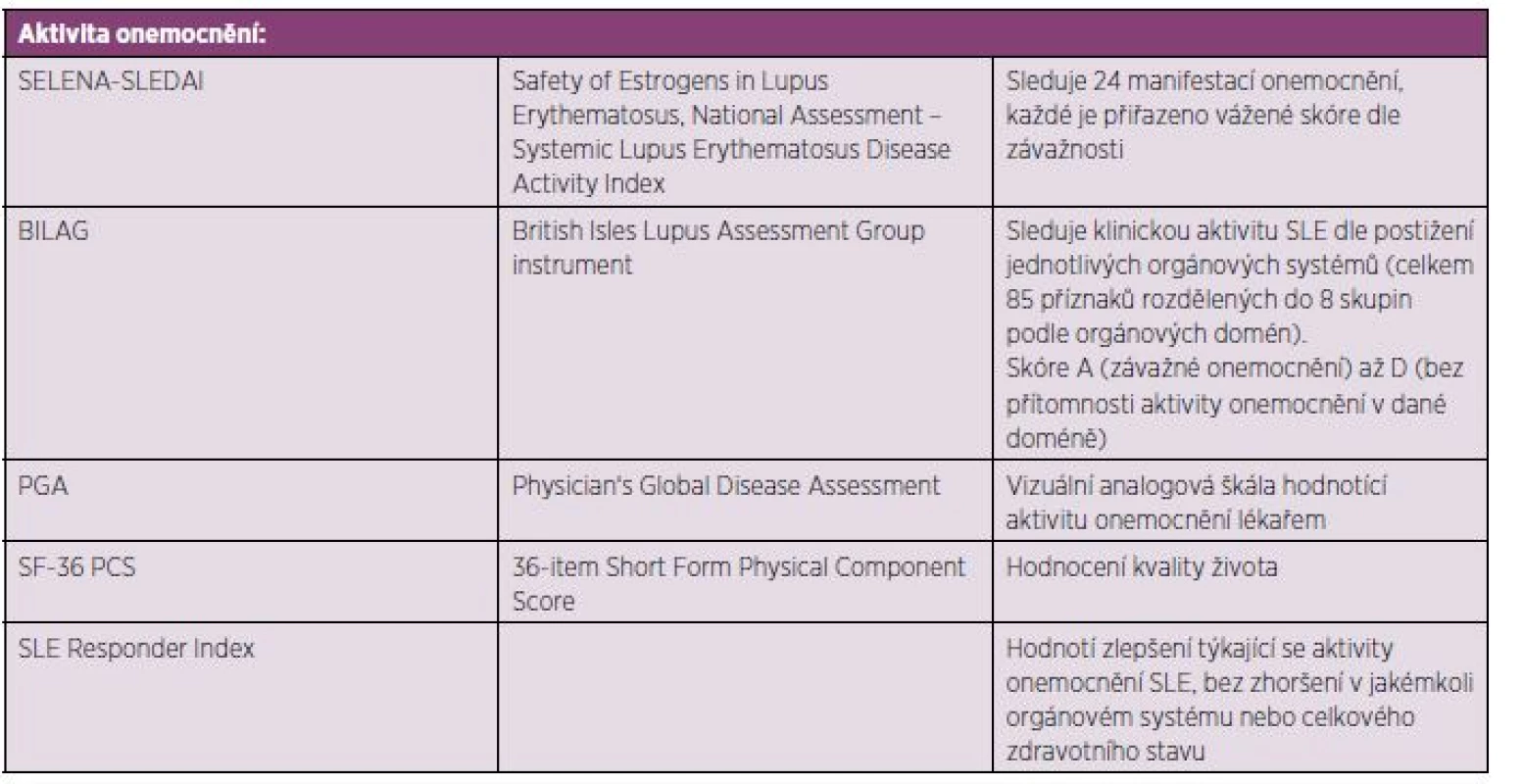
Pokud po 6 měsících léčby belimumabem nedojde ke zlepšení laboratorního nálezu nebo poklesu aktivity onemocnění (pokles skóre SELENA-SLEDAI o nejméně 4), je nutno terapii hodnotit jako neúčinnou a léčba belimumabem by měla být ukončena (22).
Dávkovací schéma je u pacientů se SLE zahajováno indukční dávkou 10 mg/kg ve dnech 0, 14 a 28 následované udržovací terapií, kdy je infuze podávána ve čtyřtýdenních intervalech. Před podáním infuze belimumabu se doporučuje podat antihistaminikum s antipyretikem k minimalizaci poinfuzních reakcí (14, 21).
Klinické studie
Systémový lupus erythematodes. Belimumab prokázal svou poměrně dobrou účinnost a bezpečnost v terapii pacientů se SLE v řadě již ukončených klinických studií, a to v jedné studii fáze I a II a dvou studiích fáze III trvající 52 respektive 76 týdnů (tab. 3), jež budou probrány detailněji. Belimumab byl zkoušen u SLE i v jiných formách podávání (subkutánní).
Table 3. Přehled již ukončených klinických studií s belimumabem u pacientů se SLE. 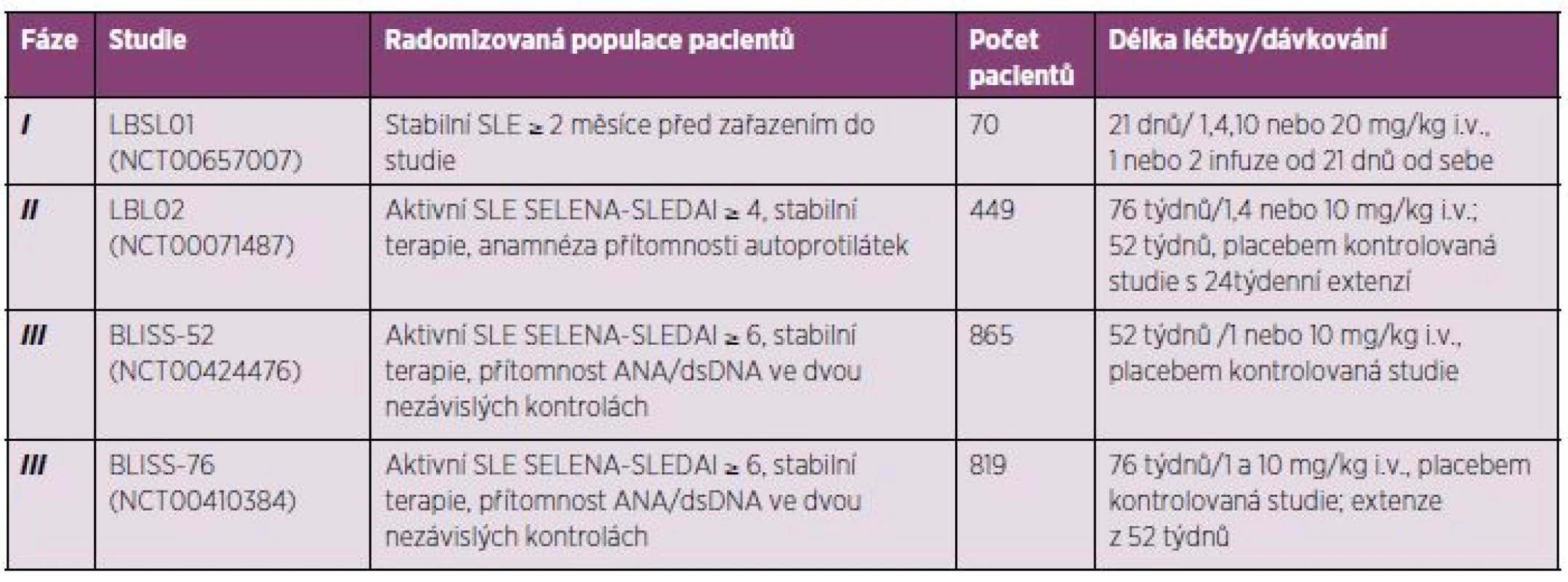
Randomizovaná, multicentrická a dvojitě slepá klinická studie fáze I (LBSL01) měla za primární cíl stanovení bezpečnosti a snášenlivosti belimumabu u pacientů se SLE. Belimumab byl podáván dle schématu 1, 4, 10 a 20 mg/kg, a to v jedné nebo dvou dávkách (den 0 a následně den 21). Ve skupině bylo celkem 70 pacientů se stabilní klinickou aktivitou SLE (57 na účinné dávce a 13 v placebové skupině). Ze sledování byli vyloučeni nemocní s aktivní lupusovou nefritidou, s bezprostředně probíhajícím postižením centrálního nervového systému, rovněž nebyli zařazeni pacienti s anamnézou podání cyklofosfamidu. Belimumab byl dobře tolerován a incidence nežádoucích příhod se statisticky signifikantně nelišila mezi skupinami pacientů léčených belimumabem a placebem. Byl zjištěn statisticky signifikantní pokles CD20+ B lymfocytů již po jedné dávce belimumabu (den 42 p = 0,0042; den 84 p = 0,0036) a po dvou dávkách (den 105 p = 0,0305). Toto klinické sledování neprokázalo terapeutické ovlivnění SLE belimumabem, ale poskytlo data pro studie fáze II a III (23).
Randomizovaná, multicentrická a dvojitě slepá klinická studie fáze II (LBL02) měla za cíl stanovit snášenlivost a efektivitu belimumabu v terapii SLE. Celkem se zúčastnilo 449 pacientů se SLE (s klinickou aktivitou onemocnění – SELENA-SLEDAI > 4, další kritéria byla obdobná jako ve studii fáze I), randomizovaných, do skupin dostávající belimumab dle předem určeného dávkování (1, 4 a 10 mg/kg) a placebo. Odpověď na terapii hodnocená pomocí SELENA-SLEDAI byla u léčených belimumabem 19,5% proti původním hodnotám. Medián doby do vypuknutí první exacerbace byl 83 dní ve skupině dostávající belimumab a 67 dní u skupiny placeba. V průběhu 24. až 52. týdne byl výskyt exacerbací ve skupině pacientů léčených belimumabem statisticky signifikantně nižší (154 vs. 108 dní, p = 0,0361). Ve skupině pacientů léčených belimumabem byl pozorován v týdnu 52 i pokles CD20+ buněk a pokles titrů anti-dsDNA protilátek. Výskyt nežádoucích příhod se ve skupinách nelišil.
Primárního cíle nebylo dosaženo, efektivita belimumabu proti placebu nebyla prokázána. Jako jedna z možných příčin se jeví samotná účinná souběžná terapie ve všech skupinách. Studie fáze II umožnila plynulý přechod ke studiím fáze III (tab. 4) (16, 24).
Table 4. Klinická studie s belimumabem fáze II (BLISS 52) – placebem kontrolované sledování u pacientů s aktivním SLE – 52. týden. 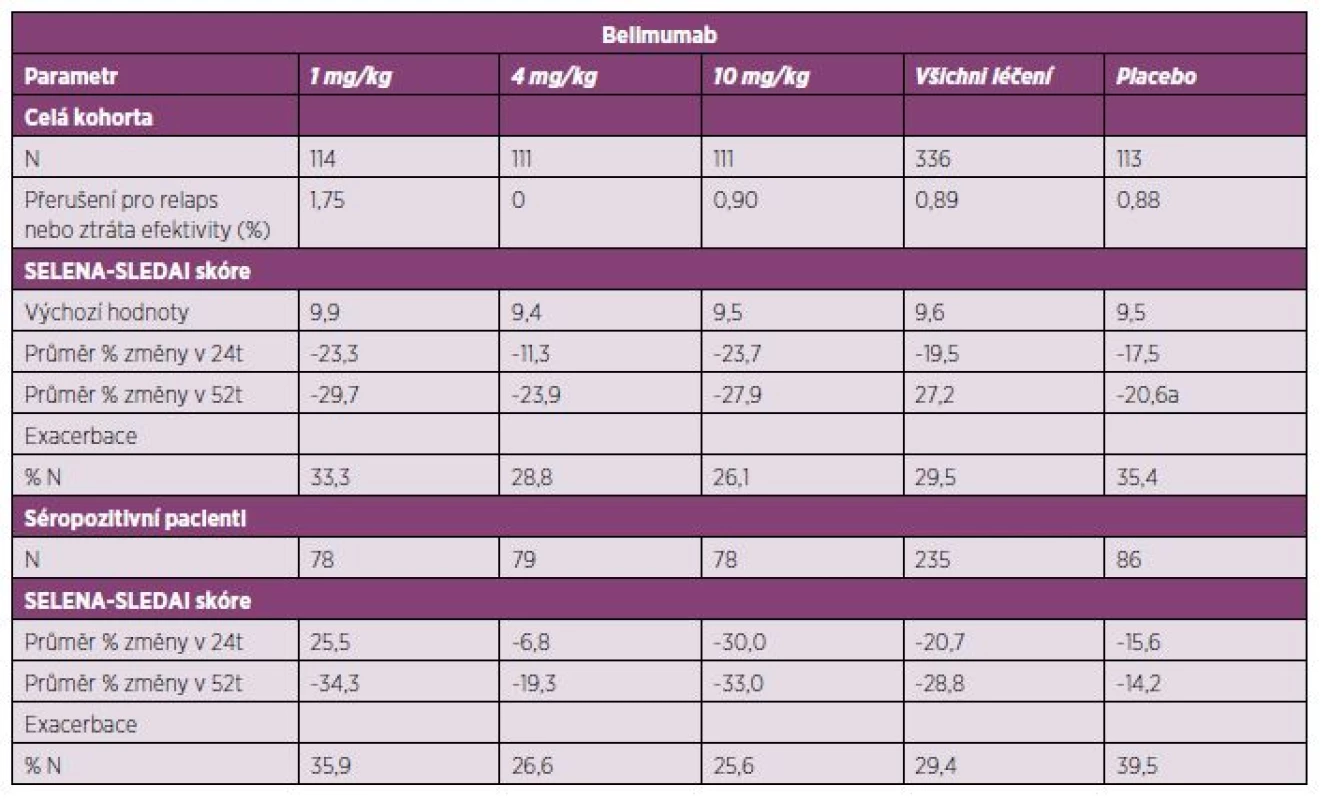
SELENA – Safety of Estrogens in Lupus Erythematosus – National Assessment, SLEDAI – Systemic Lupus Erythematosus Disease Activity Index, t – týden, séropozitivní pacienti – přítomnost antinukleárních protilátek, nebo anti-dsDNA protilátek Klinické studie fáze III byly randomizované, multicentrické a dvojitě zaslepené (BLISS-52, BLISS-76) s cílovou skupinou zaměřenou na pacienty s aktivním SLE (skóre ≥ 6 dle SELENA-SLEDAI), se sérologickou pozitivitou ANA (v titru ≥ 1 : 80) a anti-dsDNA protilátek (≥ 30 IU/ml), podmínkou byla rovněž stabilní imunosupresivní terapie, alespoň 30 dnů před zahájením terapie belimumabem. Mezi vylučovací kritéria patřila aktivní lupusová nefritida, aktivní postižení CNS v rámci SLE a těhotenství. Vyřazeni byli rovněž nemocní s anamnézou předchozí terapie ovlivňující B lymfocyty (rituximab), terapie cyklofosfamidem v posledních 6 měsících, podávání intravenózních imunoglobulinů nebo vysokých dávek glukokortikoidů (> 100 mg/den) v posledních 3 měsících.
Cílem studií BLISS-52 a BLISS-76 bylo porovnávat účinnost, efekt a toleranci belimumabu ve srovnání s placebem, podávaného v dávkách 1 a 10 mg/kg v intravenózním podání a to ve dnech 0, 14 a 28, dále pak každých 28 dnů. Ve studii BLISS-52 byla léčba ukončena týdnem 48, ve studii BLISS-76 bylo podávání ukončeno v 72. týdnu.
Primárními cílem bylo hodnocení SRI (SLE Responder Index) v průběhu a na konci klinického sledování oproti výchozím hodnotám, dále porovnání výsledků SELENA-SLEDAI skóre a sledování výskytu nových či zhoršení stávávajících manifestací SLE pomocí skóre BILAG (25, 26) (tab. 2).
Celkem 865 pacientů splňující zařazovací kritéria BLISS-52 bylo rozděleno do skupin podle dávky belimumabu 1 mg/kg (n = 288) a 10 mg/kg (n = 290) a do placebové skupiny (n = 287). Belimumab byl účinnější proti placebu, nicméně nebyl nalezen statisticky signifikantní rozdíl mezi procentem pacientů, kteří ukončili studii z důvodu neefektivity proti placebu (4,17 % u dávky 1mg/kg, 4,14 % u dávky 10 mg/kg proti 5,57 % u placeba). Terapeutická odpověď hodnocena indexem SRI v týdnech 28 a 52 byla statisticky signifikantně vyšší ve skupinách léčených belimumabem než v placebové skupině (p < 0,05).
Belimumab vykazoval též zlepšení SELENA-SLEDAI (pokles o > 4 body) v týdnu 52 proti placebu. Ke vzplanutí choroby došlo ve skupině s nižší dávkou u 70 % (p = 0,0026), u 71 % s vyšší dávkou (p = 0,0036) a u 80 % v placebové skupině. Průměrná doba do první exacerbace byla 126 dní u nižší a 119 dní u vyšší dávky belimumabu, kdežto u placeba byla jen 84 dní. V laboratorním hodnocení byl zaznamenán statisticky významný pokles anti-dsDNA protilátek až jejich vymizení u pacientů na belimumabu ve srovnání s placebem (p < 0,02). Byla zjištěna normalizace hladin C4 komplementu při terapii belimumabem proti placebu (p < 0,03), u hladin C3 bylo zaznamenáno statisticky signifikantní zvýšení jen ve skupině s dávkou 10mg/kg (p = 0,0005). Belimumab se jevil účinnější než placebo při hodnocení aktivity a laboratorních parametrů v 52. týdnu léčby. Rozdíly v účinnosti u obou dávek belimumabu nebyly statisticky významné. Výskyt nežádoucích příhod byl obdobný ve skupinách léčených belimumabem v dávkách 1 mg/kg a 10 mg/kg a v placebové skupině. Byly pozorovány závažné infekce v jednotlivých skupinách u 22, 13 a 17 pacientů. Hypersenzitivní reakce na podání infúze byly u stejně časté (n = 2 v obou belimumabových skupinách) (25).
Ve studii BLISS-76 bylo sledováno 819 pacientů, kteří byli randomizovaně rozděleni do skupin: belimumab 1 mg/kg (n = 271), 10 mg/kg (n = 273) a placebo (n = 275). Belimumab byl ve studii celkově účinnější než placebo, nicméně procento pacientů, kteří ukončili studii z důvodu neefektivity, se ve srovnání s placebem významně nelišilo (4,43 % u dávky 1 mg/kg; 6,23 % u dávky 10 mg/kg vs. 7,27 % u placeba). Terapeutická odpověď hodnocena indexem SRI v týdnu 52 a 76 byla lepší ve skupinách léčených belimumabem než v placebové skupině, nicméně rozdíl nebyl statisticky signifikantně významný. Skupina pacientů léčených belimumabem vykazovala zlepšení proti placebu při hodnocení indexu SELENA-SLEDAI (pokles o > 4 body) v týdnu 52, rozdíl však nebyl statisticky významný. Při hodnocení v týdnu 76 byl rozdíl mezi belimumabem v dávce 1 mg/kg a placebem již statisticky významný (42,1 % vs. 33,8 %; p < 0,05). Rozdíl u skupiny s dávkou 10 mg/kg proti placebu významný nebyl (41,4 %, p > 0,05).
Odpověď hodnocená pomocí skóre BILAG u pacientů s 1mg/kg byla v 52. týdnu 74,9 % proti 65,5 % u placeba (p < 0,05) a v 76. týdnu 69,0 % proti 58,9 % (p < 0,05). Bylo též zaznamenáno statisticky významné zlepšení skóre SF-36 (36-item Short Form Physical Component Score) ve skupině 1 mg/kg (+ 4,37 vs. + 2,85 u placeba) v týdnu 52 (p = 0,012) (tab. 4). Výskyt závažných exacerbací byl ve skupinách léčených belimumabem statisticky signifikantně nižší než u placeba.
Byl rovněž zaznamenán statisticky významný pokles anti-dsDNA protilátek až jejich vymizení u pacientů na terapii belimumabem (1 mg/kg) proti placebu v týdnech 52 a 76 (p < 0,01, respektive i pro dávku 10 mg/kg (p < 0,001). U belimumabu došlo dále k normalizaci hladin komplementu C4 (p < 0,03). Hladina C3 komplementu se rovněž v týdnech 52 a 76 zvýšila, avšak signifikantně pouze u dávky 10 mg/kg (43,5 %, resp. 51,3 %, p < 0,01, resp. p < 0,001). Dobrá terapeutická odpověď ve skupině s belimumabem umožnila částečnou detrakci steroidní terapie. Rozdíly v účinnosti dvou dávek belimumabu nebyly statisticky signifikantní. Výskyt nežádoucích příhod byl ve všech třech skupinách obdobný (26).
Ve fázi klinických hodnocení je subkutánní podávání belimumabu (27). Plánuje se rovněž prospektivní sledování pacientek se SLE léčených belimumabem v průběhu těhotenství či prospektivní sledování dlouhodobého podávání belimumabu u pacientů se SLE. Otázkou je ovlivnění účinnosti vakcinace (tetanus, pneumokoková vakcína) při terapii belimumabem, tato studie v současné době probíhá.
Ostatní indikace
BELLIS bylo otevřené prospektivní jednoleté klinické sledování pacientů se Sjögrenovým syndromem (SjS) ve dvou centrech. Do sledování bylo zařazeno celkem 30 pacientů splňujících americko-evropská kritéria pro SjS s protilátkovou aktivitou, buď se systémovými komplikacemi, nebo zduřením příušních žláz nebo s časným onemocněním trvajícím méně než pět let. Belimumab v dávce 10 mg/kg byl podán v týdnu 0, 2 a 4 následně každé 4 týdny, celkem 24 týdnů. Ve 28. týdnu byly zhodnoceny primární cíle studie, a to redukce o více než 30 % na vizuální analogové škále (VAS): pocitu suchosti sliznic, únava, bolest, aktivita onemocnění a zlepšení o 25 % markerů aktivizace B lymfocytů. Primárních cílů bylo dosaženo celkem u 19 z 30 pacientů. Pouze u jednoho pacienta se vyskytla nežádoucí příhoda v podobě pneumokokové meningitidy. Tyto výsledky jsou pro terapii SjS poměrně slibné (7).
BREVAS je multicentrické, randomizované dvojitě slepé klinické sledování III. Fáze, které hodnotí účinnost a bezpečnost podávání belimumabu v kombinaci s azathioprinem k udržení remise u pacientů s granulomatózou s polyangiitidou (dříve Wegenerova granulomatóza) a mikroskopickou polyangiitidou. Studie byla zahájena v březnu 2013, předpokládá se, že bude ukončena v roce 2016.
Ve fázi klinických studií jsou rovněž další potenciální indikace belimumabu, a to v transplantologii k prevenci rejekce ledvinného štěpu, v nefrologii u idiopatické membranózní nefropatie nebo u myasthenia gravis (28).
Popis případu
Uvádíme kazuistiku mladší nemocné, narozené 1977, se SLE, s lupusovou nefritidou a dalšími závažnými manifestacemi, která byla úspěšně léčena belimumabem.
Pacientce se známým antifosfolipidovým syndromem byla v roce 1995 na základě biopsie ledviny diagnostikována membranoproliferativní glomerulonefritida III. typu. Po tři roky trvající kombinované imunosupresivní léčbě pulzním cyklofosfamidem (500 mg měsíčně, kumulativní dávka 18g) a glukokortikoidy byla specifická terapie vysazena a ponechána byla jen antikoagulační léčba warfarinem. Nemocná byla stabilizována až do roku 2005, kdy byla vyšetřena pro vysoké horečky a kašel, dále byla zjištěna těžká hemolytická anémie a byla stanovena diagnóza SLE (autoimunní hemolytická anémie – AIHA, trombocytopenie, renální postižení, artritida, pozitivní protilátky ANA, anti ds-DNA, antinukleozomální a anti-C1q, hypokomplementémie) (obr. 1).
Image 1. Přehled vývoje hladin C3 složky komplementu a proteinurie u pacientky léčené belimumabem 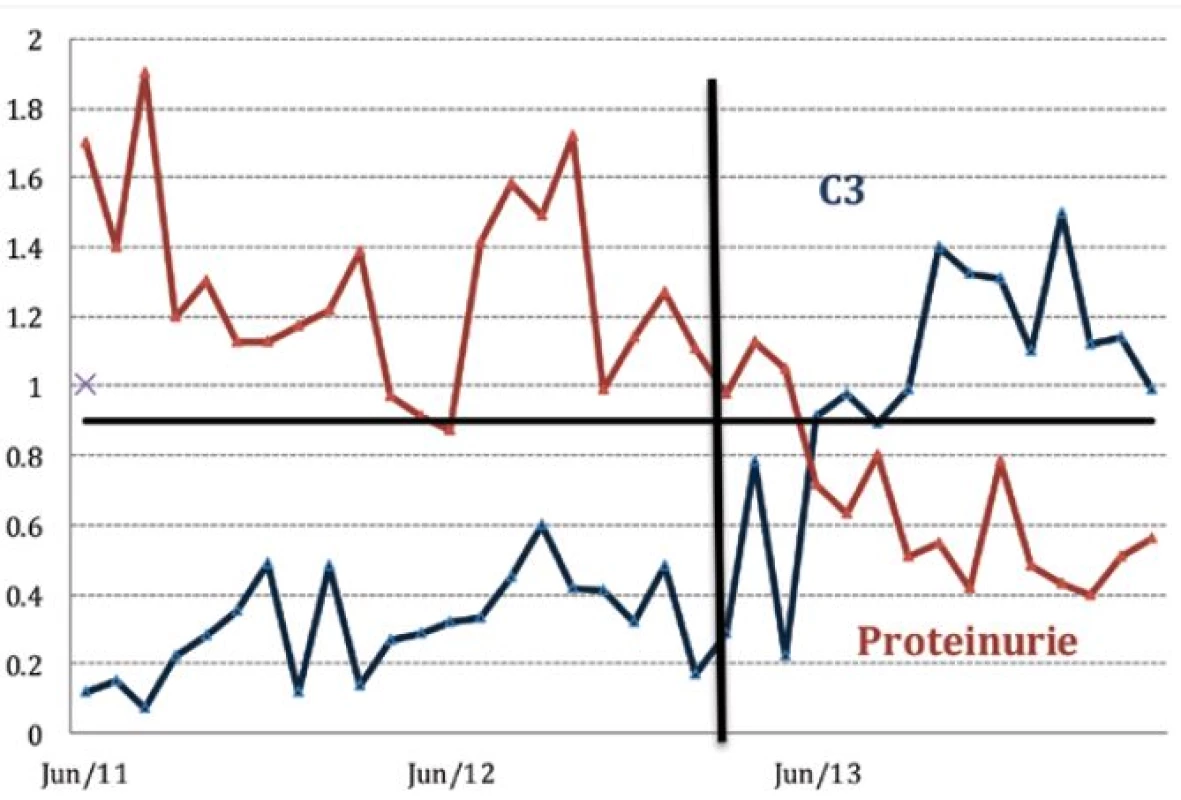
Hemolytickou anémii se podařilo zvládnout vysokými dávkami glukokortikoidů, při pokusu o jejich detrakci však došlo k aktivaci artritidy. Remisi navodila až kombinace glukokortikoidů s mykofenolát mofetilem (MMF). K další aktivaci glomerulonefritidy došlo v roce 2008, tj. po třech letech této terapie, kdy pacientka plánovala graviditu, a byla jí snížena dávka mykofenolátu. Po změně mykofenolátu na azathioprin, který v graviditě lze užít, byla pacientka v roce 2009 dvakrát hospitalizována pro ataku AIHA s nutností aplikace vysokých dávek glukokortikoidů (methylprednisolon první den 500 mg, následující dva dny 250 mg/ den). Přestože se pacientce v krátkém období remise podařilo spontánně otěhotnět, gravidita skončila spontánním abortem. Vzhledem k nutnosti akcentovat terapii a vysoké hladině CD19 pozitivních lymfocytů, bylo začátkem roku 2010 přistoupeno k podávání rituximabu s dobrým klinickým efektem. Následně však pacientka prodělala těžkou perimyokarditidu a sérologickým vyšetřením byla prokázána cytomegalovirová (CMV) a aspergilová infekce. Proto bylo od dalšího podávání rituximabu do vyřešení infekčních komplikací ustoupeno a pacientce byla vrácena terapie MMF.
V roce 2011 si celkový stav nemocné s častými relapsy SLE vynutil pokračování terapie rituximabem. Tato intenzivní terapie však již nevedla k dlouhodobější remisi onemocnění, jako problematické se ukázalo obtížné navození dlouhodobé deplece B lymfocytů. V krátké době po aplikacích rituximabu docházelo ke kompletní repleci B lymfocytů a k renální i extrarenální exacerbaci onemocnění, přičemž extrarenální projevy (artralgie, kožní exantém, hemolytická anémie) dominovaly. Navíc se po rituximabu objevil kožní exantém, který po jeho vysazení regredoval. Terapie rituximabem tedy přestala být efektivní a pro pacientku byla i potenciálně nebezpečná. Pro vyčerpání ostatních léčebných možností jsme pacientce od března 2013 začali podávat belimumab v kombinaci s MMF a malou dávkou glukokortikoidů. Na této terapii nastalo výrazné zlepšení celkového stavu. Krevní obraz se zcela normalizoval, laboratorní známky hemolýzy zcela vymizely, stejně tak kožní projevy i artralgie. Léčbou se podařilo dosáhnout jen zcela minimální imunologické aktivity, protilátky anti-ds-DNA jsou zcela negativní a hladina komplementu je v normě.
Při poslední kontrole (prosinec 2014) je pacientka již 21. měsíc léčena kombinací belimumabu, mykofenolát-mofetilu a malou dávkou glukokortikoidů (5 mg prednisonu denně). Do ambulance dochází jedenkrát měsíčně, léčbu toleruje výborně a od začátku této terapie nebyla ani jedenkrát hospitalizována. Její stav je nyní zcela stabilizován, pracuje na plný pracovní úvazek a je bez infekčních komplikací. Má steroidní kataraktu, která byla indikována k operaci. Při předoperačním vyšetření před oční operací bylo možno shrnout všechny laboratorní výsledky jako nevybočující z normy. Vdala se za rozvedeného muže s malými dětmi, graviditu již neplánuje.
Belimumab může být účinnou alternativou terapie SLE i u komplikovaných případů s multiorgánovým postižením. V našem případě byl belimumab účinný u SLE i přes neúčinnost řady imunosupresiv, včetně jejich kombinace. Mohl by být tedy účinným prostředkem závažných forem SLE, refrakterních ke standardní imunosupresivní terapii. Léčba se jeví jako bezpečná a u naší pacientky je zatím ze všech terapií tolerována nejlépe.
Závěr
Belimumab (BenlystaTM) je nyní primárně určen pro terapii středně aktivního SLE bez závažných vylučujících orgánových komplikací (lupusová nefritida, postižení CNS). Belimumab prokázal v řadě klinických studií svou dobrou účinnost, toleranci i bezpečnost v léčbě SLE.
Z dostupných dat je zřejmé, že belimumab není určen jako lék první volby, ale je vhodný u probíhajícího středně aktivního SLE. Bohužel dosud chybí data o účinnosti a bezpečnosti belimumabu u lupusové nefritidy či postižení CNS. Vzhledem k cílové skupině s převahou žen ve fertilním věku zůstává otázka bezpečnosti podávání v těhotenství a laktaci. Jako velmi zajímavé se proto jeví prospektivní sledování podávání belimumabu u těhotných, jež by mohlo významně rozšířit terapeutické možnosti lupusu v graviditě.
I přes všechny kontroverzní otázky je belimumab první z nových léků v terapii SLE, který přináší další terapeutické možnosti a otevírá cestu k rozvoji cíleného ovlivnění patogenetických mechanismů lupusu.
Belimumab se jeví jako potenciálně slibný lék i v dalších indikacích a to nejen u revmatologických onemocnění (Sjögrenův syndrom a ANCA pozitivní vaskulitidy), ale i v transplantologii či neurologii (myasthenia gravis).
Podpořeno projektem Ministerstva zdravotnictví České republiky koncepčního rozvoje výzkumné organizace 023728 (Revmatologický ústav).
Sources
1. Baker KP, Edwards BM, Main SH, Choi GH, Wager RE, Halpern WG et al. Generation and characterization of LymphoStat-B, a human monoclonal antibody that antagonizes the bioactivities of B lymphocyte stimulator. Arthritis Rheum 2003; 48 (11): 3253–65.
2. Stohl W. BlySfulness does not equal blissfulness in systemic lupus erythematosus: a therapeutic role for BLyS antagonists. Curr Dir Autoimmun 2005; 8 : 289–304.
3. Treml JF, Hao Y, Stadanlick JE, Cancro MP. The BLyS family: toward a molecular understanding of B cell homeostasis. Cell Biochem Biophys 2009; 53 (1): 1–16.
4. Cancro MP. The BLyS/BAFF family of ligands and receptors: key targets in the therapy and understanding of autoimmunity. Ann Rheum Dis 2006; 65 (Suppl 3): 34–6.
5. Elsawa SF, Novak AJ, Grote DM, Ziesmer SC, Witzig TE, Kyle RA et al. B-lymphocyte stimulator (BLyS) stimulates immunoglobulin production and malignant B-cell growth in Waldenstrom macroglobulinemia. Blood 2006; 107(7): 2882–8.
6. Webber A, Hirose R, Vincenti F. Novel strategies in immunosuppression: issues in perspective. Transplantation 2011; 91 (10): 1057–64.
7. Mariette X1, Seror R, Quartuccio L, Baron G, Salvin S, Fabris M et al. Efficacy and safety of belimumab in primary Sjogren’s syndrome: results of the BELISS open-label phase II study. Ann Rheum Dis 2013 doi:10.1136/annrheumdis-2013-203991
8. Domsic RT, Ramsey-Goldman R, Manzi S. Epidemiology and classification of systemic lupus erythematosus. In: Hochberg MC, Silman AJ, Smolen JS, Weinblatt ME, Weisman MH. Rheumatology. 4th ed. Philadelphia (PA): Mosby-Elsevier; 2008 : 1211–6.
9. Hochberg MC. Updating the American College of Rheumatology revised criteria for the classification of systemic lupus erythematosus. Arthritis Rheum 1997; 40 (9): 1725.
10. Jacob N, Stohl W. Cytokine disturbances in systemic lupus erythematosus. Arthritis Res Ther 2011; 13(4): 228.
11. Tengner P, Halse AK, Haga HJ. Detection of anti-Ro/SSA and antiLA/SSB. autoantibody-producing cells in salivary glans of patients with Sjögren’s syndrome. Arthtitis Rheum 1998; 41 : 2238–2248.
12. Vitali C1, Bombardieri S, Jonsson R, Moutsopoulos HM, Alexander EL, Carsons SE at al. Classification criteria for Sjögren ’s syndrome: A revised version of the European criteria proposed by the American-European Consensus Group. Ann. Rheum 2002; 61 : 554–558.
13. Baker KP, Edwards BM, Main SH, Choi GH, Wager RE, Halpern WG et al. Generation and characterization of LymphoStat-B, a human monoclonal antibody that antagonizes the bioactivities of B lymphocyte stimulator. Arthritis Rheum 2003; 48 (11): 3253–65.
14. Lamore R 3rd, Parmar S, Patel K, Hilas O. Belimumab (Benlysta). A breakthrough therapy for systemic lupus erythematosus. PT 2012; 37(4): 212–26.
15. Halpern WG1, Lappin P, Zanardi T, Cai W, Corcoran M, Zhong J. Chronic administration of belimumab, a BLyS antagonist, decreases tissue and peripheral blood B-lymphocyte populations in cynomolgus monkeys: pharmacokinetic, pharmacodynamic, and toxicologic effects. Toxicol Sci 2006; 91 (2): 586–99.
16. Jacobi AM1, Huang W, Wang T, Freimuth W, Sanz I, Furie R et al. Effect of long-term belimumab treatment on B cells in systemic lupus erythematosus: extension of a phase II, double-blind, placebo-controlled, dose-ranging study. Arthritis Rheum 2010; 62(1): 201–10.
17. Furie R, Stohl W, Ginzler EM, Becker M, Mishra N, Chatham W et al. Belimumab Study Group.Biologic activity and safety of belimumab, a neutralizing anti-B-lymphocyte stimulator (BLyS) monoclonal antibody: a phase I trial in patients with systemic lupus erythematosus. Arthritis Res Ther 2008; 10(5): 109.
18. Dennis GJ. Belimumab: A BLyS-specific inhibitor for the treatment of systemic lupus erythematosus. Clin Pharmacol Ther 2012; 91 (1): 143–9.
19. Merrill JT, Ginzler EM, Wallace DJ, McKay JD, Lisse JR, Aranow C et al. Long-term safety profile of belimumab plus standard therapy in patients with systemic lupus erythematosus. Arthritis Rheum. Arthritis Rheum 2012; 64 (10): 3364–73.
20. Wallace DJ, Navarra S, Petri M et al. Safety profile of belimumab, a B-lymphocyte stimulator–specific inhibitor, in phase 2 and 3 clinical trials of patients with active systemic lupus erythematosus. Abstrakt. Arthritis Rheum 2010; 62 (10 Suppl.): S 491.
21. Human Genome Science BENLYSTATM (belimumab) http://www.hgsi.com/belimumab.html
22. Horák P, Tegzová D, Závada J, Olejárová M, Skácelová M, Smržová A, Žurek M. Doporučení ČRS pro léčbu nemocných se SLE. Čes Revmatol 2013; 21 (3): 110–22.
23. Furie R, Stohl W, Ginzler EM, Becker M, Mishra N, Chatham W et al. Belimumab Study Group.Biologic activity and safety of belimumab, a neutralizing anti-B-lymphocyte stimulator (BLyS) monoclonal antibody: a phase I trial in patients with systemic lupus erythematosus. Arthritis Res Ther 2008; 10 (5): R109.
24. Wallace DJ1, Stohl W, Furie RA, Lisse JR, McKay JD, Merrill JT et al. A phase II, randomized, double-blind, placebo-controlled, dose-ranging study of belimumab in patients with active systemic lupus erythematosus. Arthritis Rheum 2009; 61 (9): 1168–78.
25. Navarra SV, Guzmán RM, Gallacher AE, Hall S, Levy RA, Jimenez RE et al. BLISS-52 Study Group. Efficacy and safety of belimumab in patients with active systemic lupus erythematosus: a randomised, placebo-controlled, phase 3 trial. Lancet 2011; 377 (9767): 721–31.
26. Furie R, Petri M, Zamani O, Cervera R, Wallace DJ, Tegzová D et al. A phase III, randomized, placebo-controlled study of belimumab, a monoclonal antibody that inhibits B lymphocyte stimulator, in patients with systemic lupus erythematosus. BLISS-76 Study Group. Arthritis Rheum 2011; 63 (12): 3918–30.
27. Shida Y, Takahashi N, Sakamoto T, Ino H, Endo A, Hirama T. The pharmacokinetics and safety profiles of belimumab after single subcutaneous and intravenous doses in healthy Japanese volunteers. J Clin Pharm Ther 2014; 39 (1): 97–101.
28. http://www.gsk-clinicalstudyregister.com/compounds/belimumab#ps
Labels
Dermatology & STDs Paediatric rheumatology Rheumatology
Article was published inCzech Rheumatology

2014 Issue 4
Most read in this issue- Belimumab v terapii systémového lupus erythematodes a v dalších indikacích
- Faktory ovlivňující účinnost anti-TNF terapie v klinické praxi: zkušenosti z národního registru ATTRA
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

