-
Medical journals
- Career
Nejnovější poznatky o placentě z pohledu imunologie, tolerance a mezenchymálních kmenových buněk
Authors: K. Macholdová 1; E. Macháčková 1; V. Prošková 1; I. Hromadníková 2; R. Klubal 1
Authors‘ workplace: Medicínské centrum Praha, vedoucí pracoviště MUDr. R. Klubal 1; Oddělení molekulární biologie a patologie buňky, 3. LF UK a Ústav pro péči o matku a dítě, Praha, přednosta doc. MUDr. J. Feyereisl, CSc. 2
Published in: Ceska Gynekol 2019; 84(2): 154-160
Category:
Overview
Cíl studie: Přehled současných poznatků o placentě z pohledu imunologie, tolerance a mezenchymálních kmenových buněk.
Typ studie: Přehledový článek.
Název a sídlo pracoviště: Medicínské centrum Praha, s.r.o.; Oddělení molekulární biologie a patologie buňky, 3. lékařská fakulta, Univerzita Karlova, Praha.
Závěr: Placenta je důležitý orgán zajišťující během těhotenství spojení mezi matkou a vyvíjejícím se plodem. Pro nekomplikovaný průběh těhotenství a vývoj plodu je stěžejní správná funkce placenty. Placenta zajišťuje nejen výměnu dýchacích plynů, živin a odpadních látek, ale vytváří také imunologické rozhraní mezi matkou a plodem. Díky molekulárním interakcím, které se odehrávají na fetomaternálním rozhraní, je navozena tolerance matky vůči plodu, který nese antigeny otce. Imunitní tolerance na rozhraní placenty a decidui je zajišťována zejména díky expresi HLA-C, HLA-E, HLA-F, a HLA-G na trofoblastu a jejich interakci s receptory na uterinních NK buňkách. Ze strany matky hrají významnou roli na fetomaternálním rozhraní také regulační T-lymfocyty a DC 10 buňky. Avšak na navození tolerance matky vůči plodu se částečně podílejí i některé buňky plodu, např. Hofbauerovy buňky či tzv. granulocytic myeloid-derived suppressor cells. V poslední době je značná pozornost rovněž věnována mezenchymálním kmenovým buňkám pocházejícím z tkáně placenty i pupečníku. Tyto mezenchymální kmenové buňky hrají důležitou roli při navození imunitní tolerance a vykazují lepší imunomodulační vlastnosti než mezenchymální kmenové buňky izolované z tkání dospělého člověka.
Klíčová slova:
placenta – pupečník – tolerance – imunologie – mezenchymální kmenové buňky – fetomaternální rozhraní
ÚVOD
Placenta je důležitý orgán zajišťující během těhotenství spojení mezi matkou a vyvíjejícím se plodem. Zastává nenahraditelnou transportní funkci, jelikož zásobuje plod kyslíkem, slouží k dodávání živin od matky a zároveň odvádí plodu škodlivé odpadní látky zpět do těla matky. Má významnou endokrinologickou funkci, jelikož produkuje celou řadu hormonů nutných k udržení těhotenství (např. lidský choriogonadotropin – hCG, z angl. human chorionic gonadotropin, nebo progesteron) [3].
Placenta je zároveň důležitým a pozoruhodným orgánem s imunologickou funkcí. Po 20. týdnu těhotenství začíná přes placentu procházet imunoglobulin třídy IgG zajišťující plodu pasivní imunitu. Hodnoty IgG se s pokračujícím těhotenstvím v cirkulaci plodu stále zvyšují a dosahují svého maxima ve třetím trimestru [27, 37]. Placenta se během těhotenství podílí i na navození imunitní tolerance matky vůči semialogennímu vyvíjejícímu se plodu. Přestože se buňky plodu a matky nacházejí v těsné interakci, je plod nesoucí paternální antigeny chráněn před aloimunitní reakcí matčina imunitního systému. Za fyziologických podmínek tak nedochází k nežádoucím imunitním reakcím, které by mohly vést k potratu [22].
EVOLUCE PLACENTY
V průběhu evoluce savců došlo v rozmnožování k přechodu od kladení vajec k živorodosti a březosti/těhotenství, tedy vývoji plodu ve vnitřním prostředí samice/matky. Živorodost je spojena s těsným kontaktem plodu a matky a mládě je plně odkázáno na výživu mateřským organismem. Výhody březosti/těhotenství však dodnes nejsou přesně známy, diskutuje se o ochraně před teplotními extrémy, osmotickým stresem či ochraně vůči nebezpečí v podobě predátorů. Na druhou stranu je jasné, že pro mateřský organismus těhotenství přináší významnou zátěž (např. vyšší energetický výdej, omezenou pohyblivost či zranitelnost) [2].
Placenta je považována za specifický savčí orgán. Může se rozdělovat podle různých parametrů. Jedním ze základních rozdělení je typ placenty podle morfologie. Difuzní typ placenty se vyskytuje u koní, prasat či kytovců; zonární typ je přítomný například u psů, koček, slonů nebo medvědů, kotyledonární typ placenty mají přežvýkavci a diskoidní typ se vyskytuje u primátů (spolu s nimi i u lidí) nebo u hlodavců [29].
Dále může být placenta rozdělována podle struktury (uspořádání choriových membrán v kontaktu s mateřskou tkání), nebo podle histologických parametrů na tzv. epiteliochoriální typ (neinvazivní, trofoblast vůbec neproniká do stěny dělohy), endoteliochoriální typ (trofoblast dosahuje k buňkám a kapilárám mateřské dělohy, avšak neproniká do ní) a hemochoriální typ (trofoblast prorůstá děložní stěnou a je v plném kontaktu s mateřským krevním oběhem) [17, 33]. Není žádný vzor, podle kterého by byla struktura placenty u jednotlivých druhů savců určena. Morfologie a struktura placenty se může výrazně lišit i u relativně příbuzných druhů. Například u paviánů je fetomaternální rozhraní ostře odděleno a trofoblast neproniká tak hluboko do stěny dělohy jako u lidí [30]. Vzhledem k tomu, že živorodost je spojena s těsným kontaktem zárodku a matky, u všech placentálních savců musí být navozena a udržována imunitní tolerance matky vůči semialogennímu plodu.
Avšak živorodost se vyskytuje i u některých druhů ryb, tyto druhy musí mít tedy jistou modifikaci placenty taktéž. U čeledi ryb gudeovití byla popsána tzv. pseudoplacenta (z angl. trophotaenial pseudoplacenta). U embrya je možno tuto pseudoplacentu pozorovat jako strukturu podobající se stuze, nacházející se v perianální části zárodku a postupně se rozšiřující. Tato pseudoplacenta živorodých ryb slouží k dodávání živin zárodku matkou, avšak nepředstavuje homologní orgán k savčí placentě. Navíc bylo zjištěno, že se jedná jen o přechodný orgán, který s narozením zaniká apoptózou [18].
Skutečnost, že placenta se nachází u všech savců, také neplatí univerzálně. U vejcorodých (např. ptakopysk nebo ježura) se stále vyskytuje kladení vajec, výživa plodu pomocí žloutkového vaku, ale i útvar, který slouží trochu jako primitivní placenta – zajišťující výměnu živin a dýchacích plynů. U vačnatců a placentálních savců je již přítomna živorodost, ačkoliv dlouho převládal názor, že vačnatci placentu nemají [14].
FETOMATERNÁLNÍ ROZHRANÍ
Z pohledu tolerance matky vůči plodu jsou nejdůležitější imunologické interakce na fetomaternálním rozhraní, což je oblast, kde se setkává pronikající placentální trofoblast (vnější buněčná vrstva placenty) a mateřské endometrium. Takto přeměněná děložní sliznice se označuje jako decidua [10]. Zde se vyskytuje nejvyšší množství buněk interagujících mezi sebou a podílejících se na navození tolerance, neboť díky invazi trofoblastu se matka dostává do přímého kontaktu s paternálními antigeny plodu (obr. 1). Leukocyty mohou tvořit až 40 % ze všech buněk přítomných v decidui [44]. Jedná se zejména o NK buňky (tzv. uterinní NK (uNK) buňky), T-lymfocyty (zejména regulační T-lymfocyty, Treg), dendritické buňky a makrofágy. Všechny tyto buněčné komponenty se podílejí na tvorbě homeostatického prostředí důležitého pro správný vývoj plodu [23].
Image 1. Zjednodušené schéma imunitních buněk vyskytujících se na fetomaternálním rozhraní 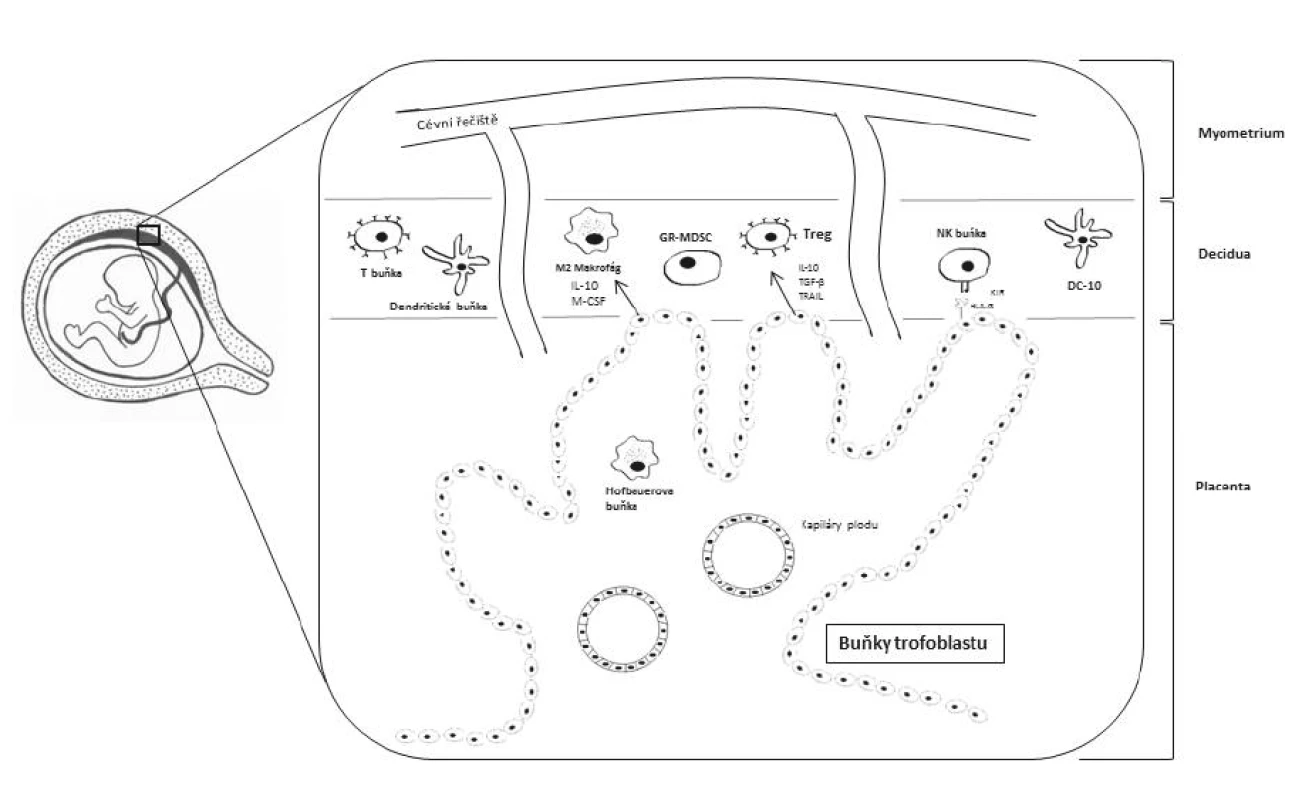
IL-10 - interleukin 10, M-CSF - faktor stimulující kolonie makrofágů, GR-MDSC - granulocytic myeloid derived suppressor cells, Treg - regulační T lymfocyt, TGF-β - transformující růstový faktor beta, TRAIL - TNF-related apoptosis-inducing ligand, KIR - killercell immunoglobulin-like receptor, DC-10 - tolerogenní dendritická buňka Placentální trofoblast je charakteristický absencí exprese klasických HLA molekul I. třídy lokusu A a B a HLA molekul II. třídy. V prvním trimestru těhotenství exprimují buňky trofoblastu HLA-C, avšak následně dochází k internalizaci této molekuly dovnitř trofoblastových buněk [15]. Zároveň jsou trofoblastem exprimovány neklasické HLA molekuly I. třídy – HLA-E, HLA-F a hlavně HLA-G. Tyto neklasické HLA molekuly I. třídy slouží jako ligandy pro receptory uNK buněk. HLA-E se váže na receptorový heterodimer CD94/NKG2A [24] a HLA-F se váže na uNK buněčné receptory KIR3DL2 a KIR2DS4 [12]. HLA-G se vyskytuje ve formě membránově vázané (HLA-G1) nebo solubilní (HLA-G5) a váže se na inhibiční receptory uNK buněk (např. KIR, ILT nebo NKG2A receptory). Vazbou HLA-G na inhibiční receptory a převahou inhibičních signálů pro uNK buňky nad signály aktivačními je zabráněno potenciálnímu vzniku NK buněčné cytotoxické reakce [8]. uNK buňky mohou tvořit 50–70 % ze všech leukocytů přítomných v decidui. Mají však odlišný fenotyp od klasických NK buněk, uNK buňky jsou CD56brightCD16 buňky [10]. HLA-G se váže i na ILT receptory exprimované na antigen prezentujících buňkách (APC, z angl. antigen presenting cells), čímž je HLA-G schopno modulovat aktivitu APC [4].
V decidui se ve zvýšeném množství nacházejí tzv. DC10 buňky, ačkoliv dendritické buňky obecně tvoří pouze 1–2 % ze všech deciduálních leukocytů [43]. DC10 buňky mohou být považovány za regulační či tolerogenní dendritické buňky. Produkují IL-10 a na svém povrchu exprimují HLA-G a ILT4. Navíc mají schopnost přimět buňky ve svém okolí k expresi HLA-G i ILT4, a tím jim udělovat tolerogenní vlastnosti. Těmito svými vlastnostmi jsou DC10 buňky považovány za další subpopulaci imunitních buněk podílejících se na navození imunitní tolerance matky vůči plodu [1].
T-lymfocyty se v decidui nevyskytují v takové míře jako NK buňky. Uvádí se, že T-lymfocyty tvoří 10–15 % z deciduálních leukocytů [49]. Ze všech T-lymfocytů však mají během těhotenství nesporně nejdůležitější roli Treg. Uplatňují se při správné nidaci oplodněného vajíčka a při vývoji placenty. Treg se starají o vytváření pravého tolerogenního prostředí na fetomaternálním rozhraní. Treg rozpoznávají paternální antigeny na buňkách trofoblastu a inhibují funkce matčiných efektorových T buněk [34]. Počet Treg se během těhotenství zvyšuje jak na fetomaternálním rozhraní, tak i v periferní krvi matky. Nejvyššího počtu Treg dosahují během druhého trimestru a následně počty klesají [38]. Snížený počet Treg je naopak spojován s předčasným porodem a těhotenskými komplikacemi (riziko spontánních potratů a rozvoj preeklampsie) [9, 41, 47]. Nežádoucí je migrace lymfocytů T s T buněčnými receptory (TCR, z angl. T cell receptor) specifickými pro paternální antigeny plodu na fetomaternální rozhraní [49].
V nedávné době bylo zjištěno, že na navození imunitní tolerance během těhotenství se podílí i tzv. granulocytic myeloid-derived suppressor cells (GR-MDSCs). GR-MDSCs jsou buňky myeloidního původu vykazující supresivní vlastnosti vůči ostatním buňkám imunitního systému, zejména vůči T-lymfocytům a NK buňkám. Imunosupresivního efektu dosahují eliminací argininu z okolí díky expresi arginázy I a produkcí reaktivních kyslíkových radikálů (ROS, z angl. reactive oxygen species). Jsou mateřského původu a bylo zjištěno, že se hromadí v placentě. Navíc jsou schopny indukovat diferenciaci T-lymfocytů na Th2 typ [21].
Na fetomaternálním rozhraní se nevyskytují pouze imunitní buňky matky. Deciduální makrofágy tvoří 20–25 % z deciduálních leukocytů [43]. Bylo zjištěno, že se na fetomaternálním rozhraní vyskytují i tzv. Hofbauerovy buňky, což jsou makrofágy fetálního původu vyznačující se fenotypem alternativně aktivovaných M2 makrofágů. M2 makrofágy jsou známé svými protizánětlivými účinky, tudíž i ony se podílejí na tvorbě správného homeostatického a tolerogenního prostředí na rozhraní matka-plod. Významnou roli zastávají samotné buňky trofoblastu, jelikož produkují solubilní faktory M-CSF, IL-10, TGF-β a TRAIL (TNF-related apoptosis-inducing ligand). Tyto faktory na fetomaternálním rozhraní indukují polarizaci M2 makrofágů a rozvoj Treg (CD25highCD127lowFoxP3+ buněk) [39]. K polarizaci makrofágů na M2 typ napomáhá i exprese chemokinu CXCL16 buňkami trofoblastu v časných fázích těhotenství, což opět vede k navození protizánětlivého prostředí a eliminaci NK buněčné cytotoxicity [48].
IMUNITNÍ TOLERANCE V PRŮBĚHU GRAVIDITY
První trimestr těhotenství je stěžejní pro zdárný vývoj plodu. Během prvního trimestru je vytvářeno prozánětlivé prostředí, které zřejmě vede k úspěšné nidaci oplodněného vajíčka a započetí těhotenství. V prvním trimestru má trofoblast unikátní repertoár HLA molekul (exprimuje jedinou klasickou molekulu HLA I. třídy – HLA-C a neklasické HLA molekuly I. třídy – HLA-E, HLA-F, HLA-G). Nejhojnějšími buňkami v prvním trimestru jsou uNK buňky. Na přelomu prvního a druhého trimestru (12. až 14. gestační týden) je na buňkách extracelulárního trofoblastu exprimována molekula CD24 – glykoprotein podobný mucinu přítomný na povrchu hematopoetických buněk (a případně nádorových buněk). CD24 se váže na tzv. sialic acid-binding immunoglobulin-type lectin 10 (Siglec 10). Interakce těchto dvou molekul je pravděpodobně jedním z mechanismů zodpovědných za navození tolerance matky vůči plodu [35]. Navíc T-lymfocyty přítomné v periferní krvi těhotných žen podléhají více apoptóze než T-lymfocyty žen, které těhotné nejsou [5]. Poruchy v toleranci plodu mohou vést k závažným problémům, jedním z nich je např. preeklampsie. V současné době nejsou jasně stanovené predikční markery preeklampsie, avšak těmi běžně používanými jsou např. placentární proteiny PP13 nebo PIGF, dále indikátory oxidačního stresu a inhibice angiogeneze a také markery měřené v rámci screeningu vrozených vývojových vad v prvním trimestru těhotenství [16]. Zajímavým přístupem v predikci preeklampsie je také stanovení placentárně specifických mikroRNA v periferní krvi matky [45]. Zvýšené hladiny IL-12 v prvním trimestru jsou spojovány s rozvojem preeklampsie. Vyšší hladiny IFN-γ, IL-1β, IL-5 a TNF-α byly pozorovány u pacientek s preeklampsií, které porodily před 37. gestačním týdnem [40].
Ve druhém a třetím trimestru těhotenství je naopak podporováno a vytvářeno protizánětlivé prostředí, aby nedošlo k nežádoucím imunitním reakcím a aby byla vytvořena fetomaternální tolerance. Nakonec, porod sám o sobě je opět zánětlivou reakcí, což je potřeba ke správnému průběhu vaginálního porodu. V druhém trimestru dosahuje svých nejvyšších počtů populace Treg, hlavní imunoregulační buněčná populace. Bylo zjištěno, že buňky trofoblastu jsou schopné navozovat diferenciaci indukovaných Treg (iTreg) z matčiných naivních T-lymfocytů periferní krve, a významně tak přispívat k toleranci plodu [32]. Zvýšené hladiny IL-1β byly pozorovány u žen s preeklampsií a preeklampsií s ukončeným těhotenstvím před 37. gestačním týdnem [40].
Oproti výraznému navození tolerance v druhém trimestru, v průběhu třetího trimestru dochází ke stále větší aktivaci adaptivní složky imunitního systému (zvláště pak CD8+ a CD4+ T-lymfocytů, ale i Treg). Zároveň však stále musí být funkčně inhibovány T-lymfocyty specifické vůči paternálním antigenům plodu [36].
PLACENTÁLNÍ MEZENCHYMÁLNÍ KMENOVÉ BUŇKY A NAVOZENÍ TOLERANCE
Mezenchymální kmenové buňky (MSCs, z angl. mesenchymal stem cells) jsou zajímavé svými multipotentními a imunomodulačními vlastnostmi. Aby buňky mohly být považovány za MSCs, musí splňovat minimální kritéria, která vydala International Society for Cellular Therapy – při kultivaci musí být MSCs schopné adherence na plastový podklad (viz kultivační lahve). Všechny MSCs musí exprimovat znaky CD105, CD73 a CD90 a naopak by neměla exprimovat CD45, CD34, CD14, CD11b, CD79α, CD19 a HLA II. třídy. Po stimulaci in vitro musí být MSCs schopné diferenciace v osteoblasty, chondrocyty a adipocyty [6]. Díky těmto svým vlastnostem představují MSCs možnost využití v dnešních terapeutických přístupech/klinickém použití, např. při léčbě roztroušené sklerózy či reakce štěpu proti hostiteli (GvHD, angl. Graft versus Host Disease). Nejvíce MSCs obsahuje kostní dřeň, avšak je snaha o nalezení jiných, snáze dostupných zdrojů, ze kterých by MSCs mohly být získávány (např. pupečníková krev, tuková tkáň, plodová voda nebo placenta). Navíc bylo prokázáno, že fetální MSCs mají vyšší proliferační kapacitu než MSCs izolované z tkáně dospělého člověka [13].
Tkáně fetálního původu zřejmě představují slibný materiál pro získávání MSCs. Nedávno bylo zjištěno, že MSCs izolované z plodové vody, kostní dřeně a placenty mají inhibiční efekt na mononukleární buňky izolované z periferní krve (PBMC, angl. peripheral blood mononuclear cells) a stimulované fytohemaglutininem (PHA, angl. phytohaemagglutinin). Inhibiční efekt vůči Th1/Th2 efektorovým buňkám u MSCs nebyl pozorován. Při kultivaci PBMC (stimulovaných PHA) s MSCs došlo k významnému posunu v poměru počtu paměťových T buněk (CD45RA+CD3+CD4/8+) a naivních T buněk (CD45RO+CD3+CD4/8+). Kultivace mononukleární frakce leukocytů s MSCs indukovala zvýšení počtu naivních T buněk v buněčné kultuře. Zároveň byl celkově pozorován nárůst počtu Treg po kultivaci PBMC-PHA s MSCs, zejména u MSCs získaných z plodové vody a placenty. U těchto MSCs byla také pozorována zvýšená produkce IL-4 a IL-10, cytokinů podporujících Th2 imunitní odpověď [28]. Na úrovni mRNA, MSCs získané z plodové vody a placenty ve srovnání s MSCs z kostní dřeně po kultivaci s PBMC-PHA indukují zvýšenou expresi STAT5b a FOXP3. V porovnání s MSCs získanými z plodové vody a placenty, MSCs z kostní dřeně samy o sobě nevykazují expresi indolamin-2,3-dioxygenázy (IDO), avšak po kultivaci s PBMC ano. IDO je enzym známý svou významnou rolí při supresi proliferace a funkčnosti T-lymfocytů eliminací tryptofanu z okolí, avšak zároveň podporující funkci Treg. Tím hraje IDO významnou roli při imunoregulačních mechanismech. Jsou známé dva enzymy IDO (IDO-1 a IDO-2). Na rozdíl od IDO-1 je aktivita IDO-2 nižší, má menší afinitu k tryptofanu avšak může fungovat jako negativní regulátor IDO-1. MSCs z plodové vody a placenty exprimují IDO-1 v klidovém stavu a po kultivaci se stimulovanými PBMC se exprese IDO-1 ještě zvýší. Exprese IDO-2 byla pozorována po pěti dnech kultivace pouze u MSCs získaných z placenty. Zdá se tedy, že MSCs získané z fetálního biologického materiálu (plodová voda, placenta) by mohly být dokonce účinnější při navození tolerogenního prostředí než MSCs izolované z kostní dřeně dospělého člověka [28].
Při třídenní kultivaci samotných T-lymfocytů z periferní krve s MSCs izolovanými z placenty a kostní dřeně vzrostlo procentuální zastoupení Treg (CD4+CD25+FoxP3+) z 3,54 % (T-lymfocyty samotné) na 10,89 % (MSCs z placenty) a 6,37 % (kostní dřeň). U FoxP3 knock down T-lymfocytů bylo zjištěno, že MSCs v buněčných kulturách indukují diferenciaci Treg z naivních T-lymfocytů mechanismem závislým na transkripčním faktoru FoxP3. MSCs z placenty a kostní dřeně navíc indukují produkci imunoregulačního cytokinu TGF-β [19].
PUPEČNÍK
Pupečník spojuje vyvíjející se plod s placentou. Slouží k ochraně cév, které vedou od placenty k plodu a naopak. K jeho vzniku dochází v pátém až osmém týdnu těhotenství. Běžně pupečník obsahuje dvě pupečníkové tepny a jednu pupečníkovou žílu. Během vzniku však obsahuje pupečník dvě tepny a dvě žíly. Pravá pupečníková žíla poté přibližně v osmém týdnu zaniká a zůstává pouze jedna (levá) pupečníková žíla [31]. V pupečníku se může nacházet i jedna tepna, avšak tento stav je v některých případech spojován s kardiovaskulárními anomáliemi [25]. Pupečníkové cévy jsou obalené v tzv. Whartonově rosolu – pojivové tkáni bohaté na proteoglykan. Tento obal má především fyzikální roli, je odolný vůči překroucení a stlačení, a tím jsou cévy v pupečníku chráněny před případným poškozením [20]. Pupečníkové cévy ve Whartonově rosolu jsou zvnějšku ještě pokryté amniovým epitelem.
Délka pupečníku je různorodá. Většinou se pohybuje kolem 50–70 cm v době porodu, avšak již na konci druhého trimestru se přestává prodlužovat. Pupečník se prodlužuje v závislosti na pohybech plodu, čím intenzivnější pohyby, tím větší délka pupečníku, a naopak. Intrauterinní pohyby ovlivňují také zkroucení pupečníku [20].
MEZENCHYMÁLNÍ KMENOVÉ BUŇKY Z TKÁNĚ PUPEČNÍKU
Velká pozornost se v poslední době věnuje mezenchymálním kmenovým buňkám izolovaným z fetálních tkání. Bylo zjištěno, že mezi MSCs dospělých lidí a MSCs plodu jsou jisté rozdíly (např. fetální MSCs rychleji proliferují a chybí jim exprese některých molekul typických pro MSCs dospělých lidí). Pupečník je jedním ze zdrojů těchto fetálních MSCs. Kmenové buňky z pupečníkové tkáně jsou multipotentní, mají vysokou proliferační kapacitu a jsou imunologicky naivní (nízká imunogenicita) – nemají expresi MHC II. třídy (HLA-DR) a neexprimují kostimulační molekuly (CD80/86), tudíž představují nízké riziko nežádoucích reakcí při jejich klinickém použití a jsou buňkami s vysokým potenciálem využití při alogenní transplantaci hematopoetických kmenových buněk [42]. Zisk MSCs z pupečníkové tkáně má navíc tu výhodu, že metoda je neinvazivní a eticky přijatelná z toho hlediska, že pupečník (i placenta) jsou po porodu běžně likvidovány. MSCs z pupečníkové tkáně je možné izolovat z amniotické membrány, pupečníkové výstelky, Whortonova rosolu a perivaskulární oblasti s tím, že častěji jsou popisovány metody izolace MSCs z Whortonova rosolu [7]. MSCs z pupečníkové tkáně mají schopnost diferencovat v adipocyty, osteocyty a chondrocyty. MSCs z pupečníkové tkáně exprimují membránové receptory CD44 a CD105, integrin 1β (CD29) a integrin α V (CD51) a molekuly SH2 (Src-homology 2 domain) a SH3. Naopak jim chybí exprese znaků CD34 a CD45, tedy klasických povrchových znaků hematopoetické buněčné linie [46]. Tímto splňují všechna minimální kritéria stanovená pro MSCs. Zdá se, že při izolaci MSCs z pupečníkové tkáně hraje důležitou roli, z jaké části pupečníku jsou MSCs získávané. Lim et al. popisují rozdíl v MSCs izolovaných z tří různých částí pupečníku – z části „mateřské“, tedy nejblíže placentě, ze střední části pupečníku a z části „fetální“, tedy z části nejblíž plodu. Zjistili, že mezi MSCs získanými z těchto tří částí pupečníku je markantní rozdíl. MSCs z pupečníkové tkáně izolované ze strany od matky a plodu vykazují nejlepší vlastnosti na buněčné i genové úrovni charakteristické pro MSCs [26].
ZÁVĚR
Placenta je orgán, který vytváří funkční rozhraní mezi matkou a plodem, kde dochází k navození tolerance imunitního systému matky vůči plodu. Na tomto fetomaternálním rozhraní se vyskytují důležité imunitní buňky, a to nejen matky, ale i buňky plodu. Tudíž i plod sám o sobě přispívá k navození tolerance matky vůči vlastním antigenům. Během těhotenství mají placenta i pupečník nenahraditelnou roli. Ukázalo se, že tkáně, jako je právě placenta či pupečník, jsou cenným zdrojem mezenchymálních kmenových buněk. A navíc mezenchymální kmenové buňky izolované z placenty a tkáně pupečníku vykazují lepší imunotolerantní vlastnosti než mezenchymální kmenové buňky z tkání dospělého člověka. Do budoucna tak placenta či pupečník představují velice slibný zdroj mezenchymálních kmenových buněk pro účely buněčné terapie a regenerativní medicíny.
Mgr. Kateřina Macholdová
Medicínské centrum
Mezi Vodami 205/29
143 00 Praha 4
e-mail: katerina.macholdova@mc-praha.cz
Sources
1. Amodio, G., et al. HLA-G expressing DC-10 and CD4+ T cells accumulate in human decidua during pregnancy. Human Immunol, 2013, 74, 4, p. 406–411.
2. Blackburn, DG. Evolution of vertebrate viviparity and specializations for fetal nutrition: a quantitative and qualitative analysis. J Morphol, 2015, 276, 8, p. 961–990.
3. Burton, GJ., Jauniaux, E. What is the placenta?. Am J Obstet Gynecol, 2015, 213, 4, p. S6–e1.
4. Colonna, M., et al. Cutting edge: human myelomonocytic cells express an inhibitory receptor for classical and nonclassical MHC class I molecules. J Immunol, 1998, 160, 7, p. 3096–3100.
5. Darmochwal-Kolarz, D., et al. T CD3+CD8+ lymphocytes are more susceptible for apoptosis in the first trimester of normal human pregnancy. J Immunol Res, 2014.
6. Dominici, MLBK., et al. Minimal criteria for defining multipotent mesenchymal stromal cells. The International Society for Cellular Therapy position statement. Cytotherapy, 2006, 8, 4, p. 315–317.
7. El Omar, R., et al. Umbilical cord mesenchymal stem cells: the new gold standard for mesenchymal stem cell-based therapies? Tissue Engineering Part B: Reviews, 2014, 20, 5, p. 523–544.
8. Ferreira, LMR, et al. HLA-G: At the interface of maternal-fetal tolerance. Trends in Immunol, 2017, 38, 4, p. 272–286.
9. Figueiredo, AS., Schumacher, A. The T helper type 17/regulatory T cell paradigm in pregnancy. Immunology, 2016, 148, 1, p. 13–21.
10. Fu, Binqing, Haiming, Wei. Decidual natural killer cells and the immune microenvironment at the maternal-fetal interface. Science China Life Sciences, 2016, 59, 12, p. 1224–1231.
11. Gellersen, B., Brosens, J. Cyclic decidualization of the human endometrium in reproductive health and failure. Endocrine Rev, 2014, 35, 6, p. 851–905.
12. Goodridge, JP., et al. HLA-F and MHC class I open conformers are ligands for NK cell Ig-like receptors. J Immunol, 2013, p. 1300081.
13. Götherström, C., et al. Immunomodulatory effects of human foetal liver-derived mesenchymal stem cells. Bone Marrow Transplant, 2004, 33, 11, p. 1167.
14. Guernsey, MW., et al. Molecular conservation of marsupial and eutherian placentation and lactation. eLife, 2017, 6, p. e27450.
15. Hackmon, R., et al. Definitive class I human leukocyte antigen expression in gestational placentation: HLA-F, HLA-E, HLA-C, and HLA-G in extravillous trophoblast invasion on placentation, pregnancy, and parturition. Am J Reprod Immunol, 2017, 77, 6, p. e12643.
16. Hromadníková, I., et al. Detekce placentárně specifických mikroRNA v mateřské cirkulaci. Čes Gynek, 2010, 75, 3, p. 252–256.
17. Chavatte-Palmer, P., Tarrade, A. Placentation in different mammalian species. Ann d‘endocrinologie, Elsevier Masson, 2016, 77, 2.
18. Iida, Atsuo, Toshiyuki Nishimaki, Atsuko Sehara-Fujisawa. Prenatal regression of the trophotaenial placenta in a viviparous fish, Xenotoca eiseni. Sci Reports, 2015, 5, p. 7855.
19. Kim, Soo-Hwan, et al. Immunomodulatory effects of placenta-derived mesenchymal stem cells on t cells by regulation of FoxP3 expression. Placenta, 2018, 267, p. 15.
20. Kliman, HJ. Umbilical cord. Encyclopedia of Reproduction, 1998,4 , p. 915–923.
21. Köstlin, N., et al. Granulocytic myeloid-derived suppressor cells accumulate in human placenta and polarize toward a Th2 phenotype. J Immunol, 2016, 196, 3, p. 1132–1145.
22. Kumpel, BM., Manoussaka, MS. Placental immunology and maternal alloimmune responses. Vox Sanguinis, 2012, 102, 1, p. 2–12.
23. Lash, GE. Molecular cross-talk at the feto-maternal interface. Cold Spring Harbor Perspectives in Medicine, 2015, p. a023010.
24. Lee, N, et al. HLA-E is a major ligand for the natural killer inhibitory receptor CD94/NKG2A. Proceedings of the National Academy of Sciences, 1998, 95, 9, p. 5199–5204.
25. Lide, B., et al. Intrahepatic persistent right umbilical vein and associated outcomes: a systematic review of the literature. J Ultrasound Med, 2016, 35, 1, p. 1–5.
26. Lim, J., et al. MSCs can be differentially isolated from maternal, middle and fetal segments of the human umbilical cord. Cytotherapy, 2016, 18, 12, p. 1493–1502.
27. Lozano, NA., et al. Expression of FcRn receptor in placental tissue and its relationship with IgG levels in term and preterm newborns. Am J Reprod Immunol, 2018, p. e12972.
28. Mareschi, K., et al. Immunoregulatory effects on T-lymphocytes by human mesenchymal stromal cells isolated from bone marrow, amniotic fluid, and placenta. Experimental Hematol, 2016, 44, 2, p. 138–150.
29. Moffett, A., Loke, C. Immunology of placentation in eutherian mammals. Nat Rev Immunol, 2006, 6, 8, p. 584.
30. Pijnenborg, R., et al. Evaluation of trophoblast invasion in placental bed biopsies of the baboon, with immunohistochemical localisation of cytokeratin, fibronectin, and laminin. J Med Primatol, 1996, 25, 4, p. 272–281.
31. Predanic, M. Sonographic assessment of the umbilical cord. Ultrasound Rev Obstet Gynecol, 2005, 5, 2, p. 105–110.
32. Ramhorst, R., et al. Modulation and recruitment of inducible regulatory T cells by first trimester trophoblast cells. Am J Reprod Immunol, 2012, 67, 1, p. 17–27.
33. Roberts, RM., Green, J., Schulz, LC. Evolution of the placenta. Reproduction, 2016, p. REP–16.
34. Robertson, SA., et al. Seminal fluid drives expansion of the CD4+ CD25+ T regulatory cell pool and induces tolerance to paternal alloantigens in mice. Biol Reprod, 2009, 80, 5, p. 1036–1045.
35. Sammar, M., et al. Expression of CD24 and Siglec-10 in first trimester placenta: implications for immune tolerance at the fetal-maternal interface. Histochem Cell Biol, 2017, 147, 5, p. 565–574.
36. Shah, NM., et al. Changes in T cell and dendritic cell phenotype from mid to late pregnancy are indicative of a shift from immune tolerance to immune activation. Frontiers Immunol, 2017, 8, p. 1138.
37. Simister, NE. Placental transport of immunoglobulin G. Vaccine, 2003, 21, 24, p. 3365–3369.
38. Somerset, DA., et al. Normal human pregnancy is associated with an elevation in the immune suppressive CD25+ CD4+ regulatory T-cell subset. Immunology, 2004, 112, 1, p. 38–43.
39. Svensson-Arvelund, J., et al. The human fetal placenta promotes tolerance against the semiallogeneic fetus by inducing regulatory T cells and homeostatic M2 macrophages. J Immunol, 2015, p. 1401536.
40. Taylor, BD., et al. First and second trimester immune biomarkers in preeclamptic and normotensive women. Pregnancy Hypertension. Inter JWomen‘s Cardiovasc Health, 2016, 6, 4, p. 388–393.
41. Toldi, G., et al. The frequency of peripheral blood CD4+ CD25high FoxP3+ and CD4+ CD25? FoxP3+ regulatory T cells in normal pregnancy and pre?eclampsia. Am J Reprod Immunol, 2012, 68, 2, p. 175–180.
42. Troyer, DL., Weiss, ML. Concise review: Wharton‘s jelly-derived cells are a primitive stromal cell population. Stem Cells, 2008, 26, 3, p. 591–599.
43. Trundley, A., et al. Methods for isolation of cells from the human fetal-maternal interface. Placenta and trophoblast. Humana Press, 2006, p. 109–122.
44. Vince, GS., et al. Flow cytometric characterisation of cell populations in human pregnancy decidua and isolation of decidual macrophages. J Immunol Methods, 1990, 132, 2, p. 181–189.
45. Vokroj, J., Arnoštová, L. Preeklampsie – některé možnosti predikce. Čes Gynek, 2009, 74, 4, p. 256–261.
46. Wang, Hwai-Shi, et al. Mesenchymal stem cells in the Wharton‘s jelly of the human umbilical cord. Stem Cells, 2004, 22, 7, p. 1330–1337.
47. Wang, WJ., et al. Increased prevalence of T helper 17 (Th17) cells in peripheral blood and decidua in unexplained recurrent spontaneous abortion patients. J Reprod Immunol, 2010, 84, 2, p. 164–170.
48. Wang, XQ., et al. Trophoblast-derived CXCL16 induces M2 macrophage polarization that in turn inactivates NK cells at the maternal-fetal interface. Cellular Molecular Immunol, 2018, p. 1.
49. Zenclussen, AC., et al. Abnormal T-cell reactivity against paternal antigens in spontaneous abortion: adoptive transfer of pregnancy-induced CD4+ CD25+ T regulatory cells prevents fetal rejection in a murine abortion model. Am J Pathol., 2005, 166, 3, p. 811–822.
Labels
Paediatric gynaecology Gynaecology and obstetrics Reproduction medicine
Article was published inCzech Gynaecology

2019 Issue 2-
All articles in this issue
- Porodnické vaginální extrakční operace a jejich vliv na traumatismus matky a dítěte – prospektivní studie
- Střednědobé výsledky chirurgické léčby recidivující cystokély po hysterektomii s využitím transvaginálního implantátu
- Sakrospinální fixace sec. Miyazaki – komplikace a dlouhodobé výsledky
- Pilotní studie srovnávající snášenlivost transperineálního a endoanálního ultrazvukového vyšetření svěrače konečníku
- Je korelace mezi hodnotami maximálního uzavíracího uretrálního tlaku a sestupem uretry?
- Ruptura dělohy v těhotenství a při porodu: rizikové faktory, příznaky a perinatální výsledky – retrospektivní analýza
- Materská morbidita a mortalita v Slovenskej republike v rokoch 2007–2015
- Sakrokokcygeální teratom
- Embolická příhoda v šestinedělí s tragickým koncem
- Gynekologické a urologické aspekty pánevních vaskulitid
- Nejnovější poznatky o placentě z pohledu imunologie, tolerance a mezenchymálních kmenových buněk
- Bisfenoly v patologii reprodukce
- Korelace mezi integrací genomu vysoce rizikových HPV do lidské DNA detekované molekulárním combingem a závažností cervikální léze: první výsledky EXPL-HPV-002 studie
- Czech Gynaecology
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Ruptura dělohy v těhotenství a při porodu: rizikové faktory, příznaky a perinatální výsledky – retrospektivní analýza
- Sakrokokcygeální teratom
- Porodnické vaginální extrakční operace a jejich vliv na traumatismus matky a dítěte – prospektivní studie
- Nejnovější poznatky o placentě z pohledu imunologie, tolerance a mezenchymálních kmenových buněk
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

