-
Medical journals
- Career
Hereditární časná forma Alzheimerovy nemoci v důsledku zárodečné mutace p.M139V v genu PSEN1 – kazuistika
Authors: P. Bártová 1; S. Walczysková 2; P. Plevová 2; L. Ratajová 3; J. Havelka 4; E. Šilhánová 2; P. Ressner 1; D. Školoudík 1,5
Authors‘ workplace: Neurologická klinika OU a FN Ostrava 1; Oddělení lékařské genetiky, OU a FN Ostrava 2; Neurologická ambulance, Mladá Boleslav 3; Radiodiagnostické oddělení, OU a FN Ostrava 4; Neurologická klinika LF UP a FN Olomouc 5
Published in: Cesk Slov Neurol N 2011; 74/107(5): 569-574
Category: Case Report
Overview
Alzheimerova demence je nejčastější demence u pacientů ve starším věku. V některých rodinách může být geneticky podmíněna. Naše kazuistika ukazuje případ 43letého muže, v jehož rodině se vyskytlo dalších šest členů rodiny s manifestací demence ve věku 40–50 let. Genetickým vyšetřením byla u pacienta prokázána patogenní mutace c.415A>G (p.M139V) v exonu 5 genu PSEN1 v heterozygotním stavu. Stejná mutace byla zjištěna u demencí postiženého bratrance. V rodině tak byla potvrzena hereditární predispozice k časné formě Alzheimerovy demence s autozomálně dominantní dědičností na molekulární úrovni. Vývoj onemocnění byl u pacienta sledován po dobu osmi let. Postupně dochází k deterioraci kognitivních funkcí a vývoji atrofických změn mozku dle magnetické rezonance. Obdobné změny jsou pozorovány u jeho bratrance. Genetické vyšetřování v rodinách zasažených demencí může být do budoucna důležité především pro možnost včasné léčby pacientů v riziku.
Klíčová slova:
Alzheimerova demence – hereditární onemocnění – gen PSEN1 – genová mutaceÚvod
Demence postihuje přibližně 5,4 % osob ve věku nad 65 let a její prevalence narůstá s věkem [1]. V přibližně 5–10 % všech případů Alzheimerovy nemoci se jedná o familiární výskyt onemocnění [2]. Zatímco rizikovým faktorem pozdní formy onemocnění je varianta E4 v genu pro apolipoprotein E (chromozomální lokus 19q13.2), časná forma onemocnění s nástupem příznaků před 65. rokem věku může být způsobena patogenními mutacemi v jednom ze tří genů: v genech pro amyloidový prekurzorový protein (gen APP, chromozomální lokus 21q21), pro presenilin 1 (gen PSEN1, chromozomální lokus 14q24.3) nebo presenilin 2 (gen PSEN2, chromozomální lokus 1q31–42) [3]. V tomto případě se jedná o hereditární predispozici k časné formě onemocnění dědičnou autozomálně dominantně, kdy potomci nemocné osoby mají 50% pravděpodobnost, že vlohu k onemocnění zdědí. Většinu mutací v genech PSEN1 a APP charakterizuje manifestace onemocnění mezi 25. a 65. rokem života a úplná penetrance, kdy onemocní všechny geneticky predisponované osoby. Mutace v genu PSEN2 jsou spojeny s pozdějším věkem nástupu onemocnění (45 až 88 let) a penetrance je neúplná, kdy u některých osob, ačkoli genetickou vlohu k onemocnění nesou, se onemocnění nemusí vůbec klinicky manifestovat [4]. Tyto hereditární formy s autozomálně dominantním typem dědičnosti nejsou početné a v celé populaci nemocných tvoří sotva několik procent [5].
Existují dvě teorie týkající se patogeneze demence u pacientů s mutacemi v genech PSEN1, PSEN2 a APP. Podle první z nich, tzv. amyloidové hypotézy, je příčinou tvorba amyloidních plaků v mozkové tkáni. Hlavní komponentou amyloidních plaků je amyloid β (Aβ). Nejčastější forma amyloidu β u člověka má 40 aminokyselin (tzv. Aβ40). Méně častá forma je amyloid o 42 aminokyselinách, který se liší od předchozího pouze dvěma aminokyselinovými zbytky navíc (tzv. Aβ42), a právě ukládání této formy amyloidu v placích je spojeno s rozvojem Alzheimerovy choroby. Amyloid β vzniká štěpením transmembránového proteinu APP (amyloidový prekurzorový protein) sekretázami. Protein APP může být štěpen dvěma způsoby. Při prvním dojde k rozštěpení APP α-sekretázou, což je „standardní“ štěpení bez neurotoxického účinku. Při druhém probíhá štěpení APP nejprve β sekretázou a poté komplexem γ sekretázy. Proteinový komplex γ sekretázy je tvořen preseniliny 1 a 2 spolu s nikastrinem, PEN-2 a APH-1. Při tomto druhém způsobu štěpení mohou vznikat Aβ peptidy o variabilní délce řetězce 39 až 42 aminokyselin v závislosti na místě štěpení, nejčastěji však Aβ40 nebo Aβ42 (obr. 1). Podíl těchto forem je důležitý v patogenezi Alzheimerovy choroby, neboť Aβ42 má větší tendenci k agregaci, oligomerizaci a tvorbě fibril než Aβ peptidy o kratší délce [4,6,7]. V případě mutací v genech PSEN1 nebo PSEN2 dochází ke změně proteolytické aktivity komplexu γ sekretázy a selektivnímu zvýšení produkce amyloidu β, případně ke změně podílu kratších/delších forem Aβ peptidů [8,9]. Podle druhé, tzv. presenilinové hypotézy dochází v důsledku mutací genů ke ztrátě zásadních funkcí presenilinů, což vede přímo k neuronální degeneraci a ztrátě paměti bez tvorby amyloidních plaků [9].
Image 1. Jednotlivé kroky vedoucí k vzniku amyloidu β z APP. 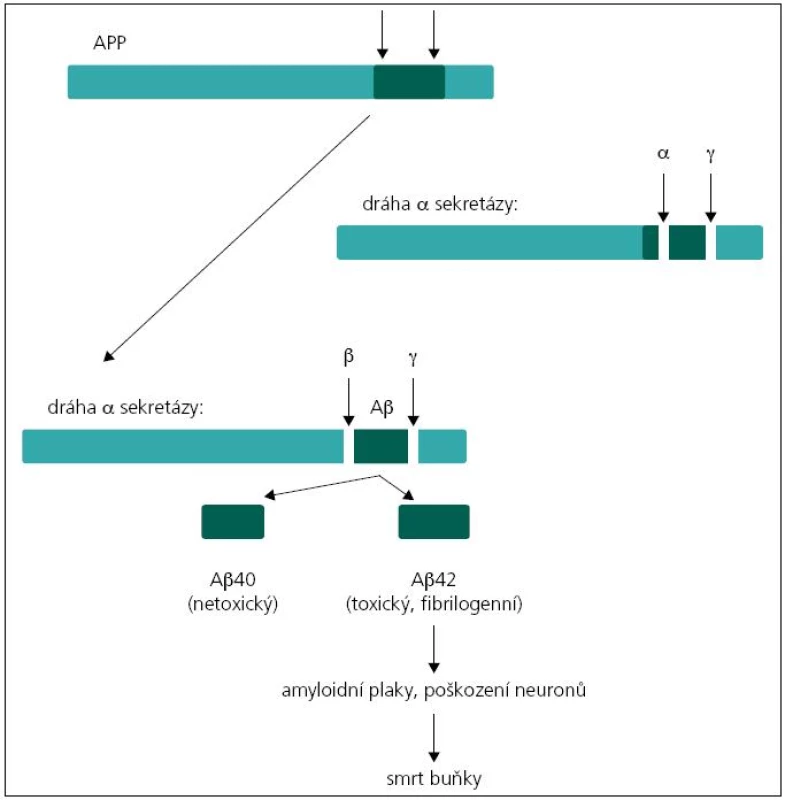
V naší kazuistice popisujeme poprvé v České republice případ rodiny s hereditární predispozicí k časné formě Alzheimerovy choroby způsobenou patogenní mutací v genu PSEN1.
Popis případu
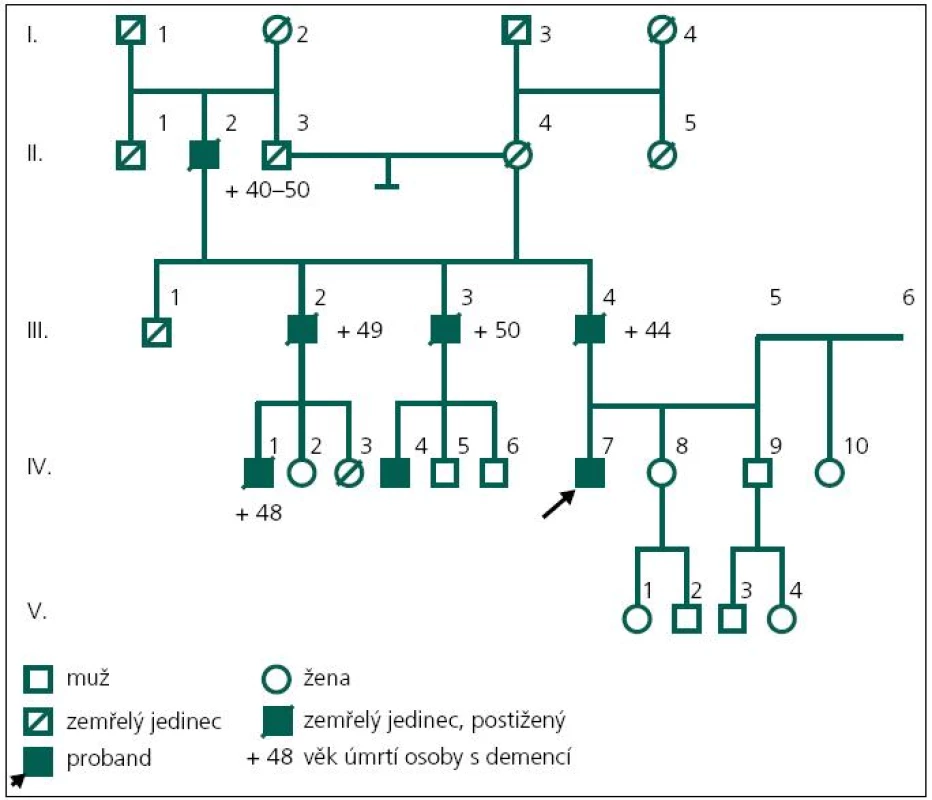
Pacient (obr. 2, IV-7) ve věku 43 let byl přiveden matkou k hospitalizaci na Neurologickou kliniku Fakultní nemocnice Ostrava v roce 2003 pro poruchy paměti a poruchy chování, jejichž pozvolný počátek byl patrný již od 37 let věku. Byla to především úzkostná porucha s prvky paranoidního chování, toulání, později i agresivita. Pacient netrpěl žádným jiným sledovaným onemocněním a žil ve společné domácnosti s matkou. Absolvoval pouze základní vzdělání. V té době ztratil i práci, protože selhával i v dělnických profesích – zapomínal posloupnost dějů a podobně.
Matka pacienta zároveň poukazuje na určité podobné rysy v rodinné anamnéze; otec pacienta (obr. 2, III-4) byl opakovaně za svého života hospitalizován na psychiatrické klinice, byl agresivní, podlehl etylizmu a zemřel ve 44 letech na demenci. Provedený sekční nález z roku 1979 ukazoval atrofii mozku zejména frontálních laloků, hydrocefalus externus et internus e vacuo, především laterálních komor. Histologicky byl popsán úbytek korové hmoty, především vrstvy 1–3, úbytek neuronů i astroglií, atroficko-degenerativní změny pyramidových neuronů, změny odpovídající Alzheimerovým změnám neurofibril. Závěrečná diagnóza byla Alzheimerova demence.
Otec otce (obr. 2, II-2) také zemřel na demenci. Dva ze tří sourozenců otce (jeden muž a jedna žena; obr. 2, III-2 a III-3) byli také postiženi rozvojem demence a každý z nich má jednoho syna s manifestací demence ve 44 a 45 letech věku (obr. 2, IV-1, IV-4).
V objektivním neurologickém vyšetření v roce 2003 byly u pacienta popsány prvky mimovolných pohybů typu chorey, zvláště na horních končetinách, která se projevovala hlavně v sociálních kontaktech při anxietě. Při vyšetření Mini-Mental State Examination (MMSE) dosáhl pacient 20 bodů [10]. Toto vyšetření odhalilo hrubé poruchy orientace, pozornosti, počítání, výbavnosti, vizuospaciálních funkcí a písma. Psychologické vyšetření prokázalo oslabení intelektových schopností. Globální intelektový výkon odpovídal pásmu lehké mentální retardace – demenci. Byl zjištěn výrazný rozdíl mezi jednotlivými složkami, s dominancí verbálních složek nad performačními. Výrazně oslabena byla schopnost vštípivosti a retence z krátkodobých a dlouhodobých složek paměti. Hodnota MQ byla 64. Byly oslabeny symbolické funkce a celkově došlo k výraznému oslabení abstraktního myšlení a uvažování. Snížena byla také schopnost kognitivní flexe a organizace výbavnosti z dlouhodobých složek paměti. Výsledek vyšetření nasvědčuje exekutivnímu oslabení. S ohledem na zjištěné skutečnosti odpovídal aktuální stav stavu mírné až středně těžké demence se suspektním progredujícím charakterem a se sekundárním úzkostně depresivním prožíváním a agresivními projevy v emocionální zátěži.
V roce 2003 bylo provedeno také první vyšetření mozku magnetickou rezonancí (MR), které ukázalo nevýrazná nespecifická ložiska demyelinizačního charakteru v bílé hmotě frontoparietálně oboustranně, bez známek atrofie mozku (obr. 3 a 4). Zároveň provedené elektroencefalografické vyšetření (EEG) ukázalo hrubě abnormní záznam pro nevyjádřenou hemisferální a areální organizaci, difuzní theta-beta aktivitu. Pacient se podrobil také vyšetření likvoru, kde však veškeré nálezy biochemické, cytologické, virologie, průkaz oligoklonálních pásů i protilátek proti boreliím byly negativní.
Image 3. Magnetická rezonance mozku pacienta IV-7. Sagitální řezy v T1 vážených obrazech – vývoj atrofie: (A) rok 2003, (B) rok 2010. 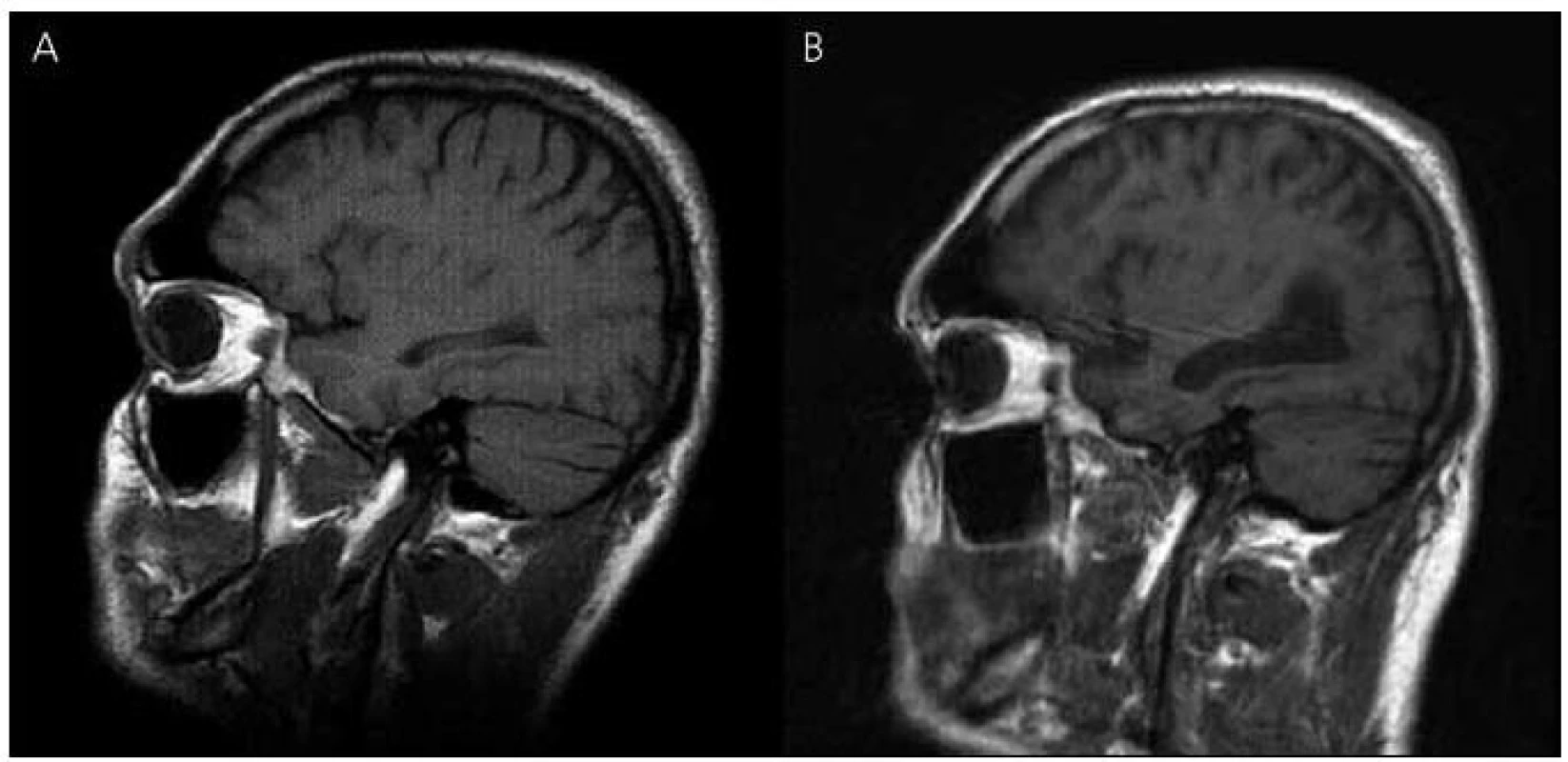
Image 4. Magnetická rezonance mozku pacienta IV-7. Transverzální řezy v T2 vážených obrazech – vývoj atrofie: (A) rok 2003, (B) rok 2010. 
První genetické vyšetření bylo provedeno v témže roce. Vzhledem k choreatickým dyskinezám v úvodu byla u pacienta vyšetřována a zároveň vyloučena Westphalova forma Huntingtonovy choroby. Dále byla zvažována demence s autozomálně dominantním přenosem v rodině, a to frontotemporální demence (mutace genu MAPT 17q21), Alzheimerova nemoc (mutace genů APP, PSEN1 a PSEN2) a Creutzfeldtova-Jakobova nemoc (mutace genu PRNP), molekulárně genetické vyšetření těchto genů však nebylo v té době dostupné.
U pacienta byla stanovena diagnóza Alzheimerovy demence, dle diagnostických kritérií NINCDS-ADRDA [11,12]. Zároveň byla zahájena léčba inhibitory acetylcholinesterázy (rivastigmin do dávky 12 mg za den). Pacient začal na léčbě rivastigminem lépe spolupracovat s rodinou a začal se více zapojovat do aktivit v domácím prostředí. V testovém hodnocení kognitivních funkcí pacienta nedošlo ke zlepšení, pouze se zlepšila ochota komunikovat s lékařem.
Později byl nasazen pro neklid a agresivitu tiaprid 100 mg na noc. Matka byla poučena o nutnosti tréninku paměti s pacientem, který se snažila po celou dobu provádět.
V roce 2008 bylo indikováno druhé genetické vyšetření. Byla při něm indikována molekulárně genetická analýza genů pro časnou formu Alzheimerovy choroby PSEN1 a APP. DNA byla izolována z leukocytů periferní krve standardním postupem. Intronické primery byly použity k amplifikaci a sekvenaci exonů 3.–12. genu PSEN1 a exonů 16 a 17 genu APP [13]. Přímá sekvenace byla provedena na genetickém analyzátoru ABI3130. U vyšetřeného byla nalezena patogenní mutace c.415A>G v exonu 5 genu PSEN1 v heterozygotním stavu (tj. na jedné alele genu) (obr. 5). Jedná se o missense mutaci, tedy mutaci se změněným smyslem, která vede na úrovni proteinu k záměně původní aminokyseliny metioninu v kodónu 139 za valin (p.M139V). Tím byla u vyšetřeného potvrzena hereditární predispozice k časné formě Alzheimerovy choroby s autozomálně dominantním typem dědičnosti.
Image 5. DNA sekvence části exonu 5 genu PSEN1 s mutací c.415A>G (p.M139V) a bez ní. DNA: deoxyribonukleová kyselina; A: adenin; C: cytosin; G: guanin; T: tymin; AMK: aminokyselina; Ile: izoleucin; Val: valin; Met: metionin. 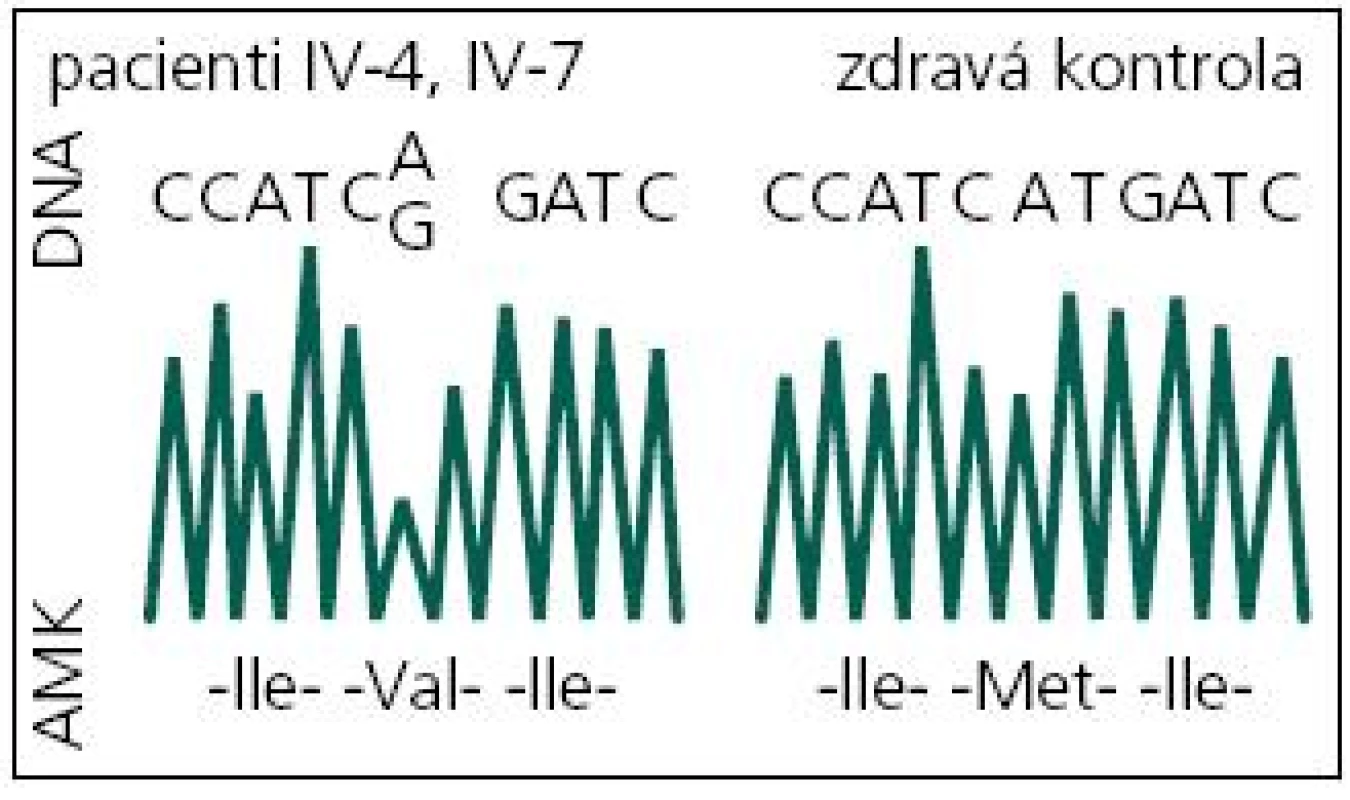
Zároveň byl nalezen genotyp APO-E*E2/4 v genu pro apolipoprotein E. Bylo zjištěno, že alelu E4 vyšetřený zdědil od své mentálně zcela zdravé matky, které je nyní 72 let (obr. 1, III-5; genotyp matky byl APOE*E3/4).
U pacienta dochází k postupné progresi demence i přes včasné nasazení léčby. MMSE klesá na 13 bodů, ale stále zůstává schopnost pacienta provádět aktivity v domácím prostředí s dopomocí rodiny, v jejíž péči pacient nadále setrvává. Po dvou letech průběhu choroby ustoupily dyskinetické pohyby horních končetin při sociálních kontaktech a začala převládat spíše apatie se zpomalenými psychomotorickými projevy. V této době byl přidán memantin, který však způsoboval výraznou žaludeční nevolnost u pacienta, proto byl vysazen. MR mozku v roce 2005 byla bez vývoje v porovnání s nálezem z roku 2003. Opakované vyšetření likvoru na hladiny specifických proteinů (tau proteinu, fosforylovaného tau proteinu a β-amyloidu) bylo v normě.
V roce 2010 se začíná objevovat apatie, progredují poruchy paměti, především anterográdní s poruchou vštípivosti a výbavnosti, porucha řeči s poklesem verbální fluence, agrafie a poruchy čtení textu. Zhoršuje se také fungování v aktivitách denního života. Pacient nezvládá posloupnost oblékání, nechce vycházet z domu, neumí používat příbor, objevují se poruchy příjmu potravy a občasné problémy s užíváním léků. Z důvodu nízké compliance při užívání léků byl přechodně převeden na rivastigmin náplasti 9,5 mg/den, které ale strhával. Proto byl převeden zpět na tabletovou formu. Nadále zůstává v péči matky. Kontrolní vyšetření MR v roce 2010 ukazuje rozvoj výrazné atrofie mozku, rozšíření komorového systému a subarachnoideálních prostorů konvexit (obr. 3, 4).
V roce 2011 se podařilo zajistit dokumentaci od dalšího žijícího stejně postiženého bratrance pacienta (obr. 1, IV-4). U pacienta začínaly první změny v chování v roce 2006 ve věku 45 let, kdy se toulal, ztrácel se při cestě domů, selhával v zaměstnání apod. Psychologické vyšetření ve 47 letech ukázalo poruchu orientace v čase, poruchu počtů, výbavnosti. V MMSE vyšetření dosáhl 20 bodů. Při vyšetření likvoru byl zjištěn normální nález, vyšetření specifických proteinů (tau protein, fosforylovaný tau protein a β amyloid) nebylo provedeno. MR mozku v roce 2008 ukazuje širší subarachnoideální prostory, difuzní atrofii mozku, ložiska gliózy v bílé hmotě obou mozkových hemisfér nespecifického charakteru (obr. 6). Byla nasazena léčba rivastigminem. Postupně i u tohoto pacienta dochází k progresi poruchy kognitivních funkcí. Nyní ve věku 50 let je již přítomna porucha řeči, obslužnosti, porucha koordinace a pády. Pacient zůstává v péči rodiny. Bylo u něho provedeno molekulárně genetické vyšetření exonu 5 genu PSEN1 metodou přímé sekvenace na genetickém analyzátoru ABI3130. Byla nalezena patogenní mutace c.415A>G (p.M139V).
Image 6. Magnetická rezonance mozku pacienta IV-4. Atrofie mozku, megacisterna magna, průchodný mokovod a normální kmenové struktury v T2 vážených obrazech – rok 2008 (A) sagitální řezy (B) transverzální řezy. 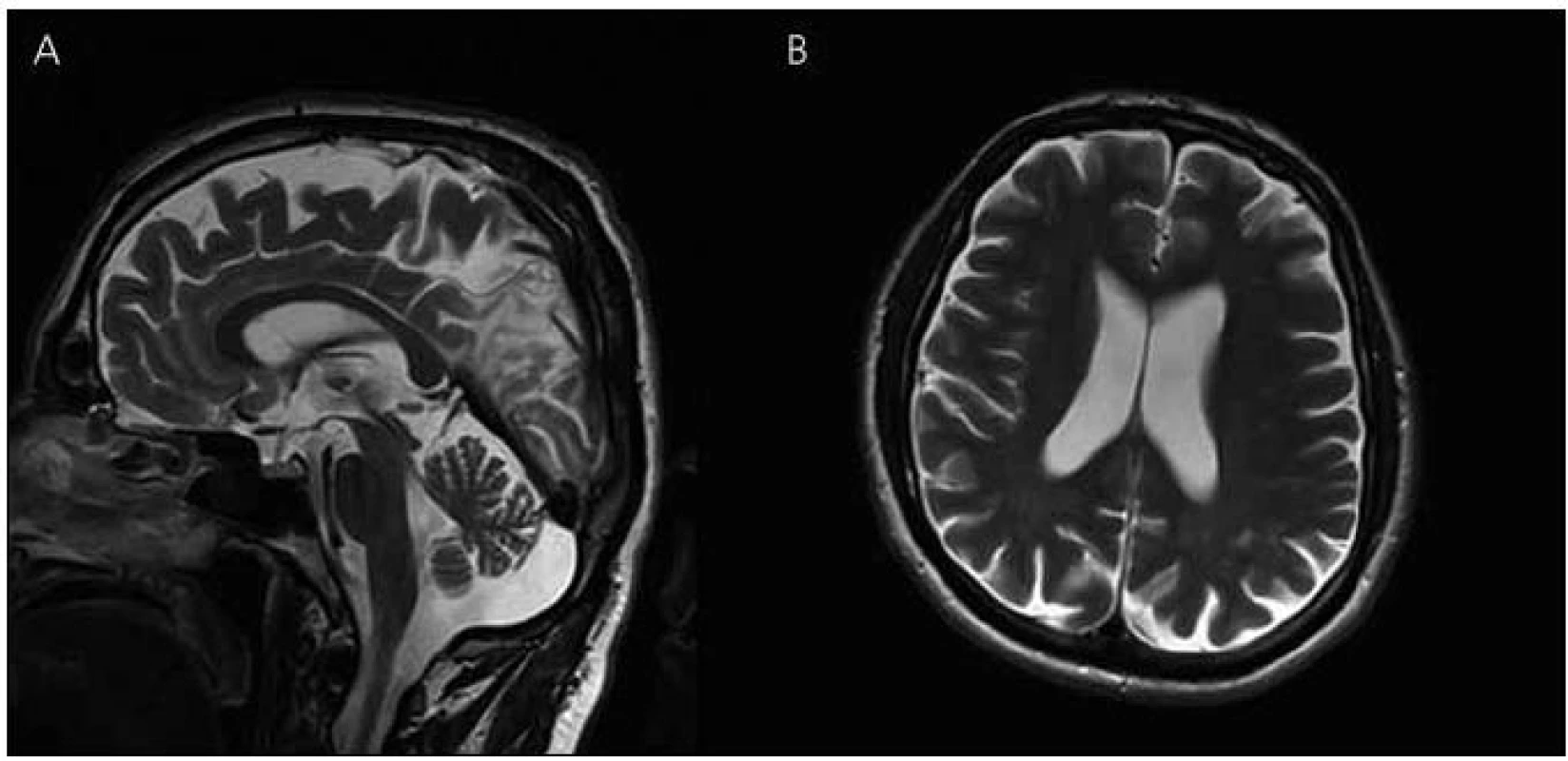
Diskuze
Mutace v genu pro presenilin 1 (PSEN1) patří mezi nejčastější genetickou příčinu familiární časné formy Alzheimerovy choroby [3]. Dosud bylo popsáno v zahraniční literatuře 178 mutací v genu PSEN1 u 370 rodin s úplnou penetrancí a nástupem onemocnění mezi 25 až 65 lety (viz AD&FTD databáze mutací, www.molgen.ua.ac.be/admutations). Co se týká české populace, byla publikována jediná studie, v níž Mazura et al pátrali po mutacích v kodonu 717 exonu 17 genu APP v post mortem získaných mozkových tkáních u pacientů, u kterých se demence manifestovala před 60. rokem věku. Mutaci nalezli u dvou pacientů z 18 [14].
U probanda nalezená mutace p.M139V v genu PSEN1 byla popsána v zahraniční literatuře již u mnoha pacientů s časnou formou Alzheimerovy choroby, lze ji proto jednoznačně považovat za patogenní mutaci s autozomálně dominantním způsobem dědičnosti [13,15–17]. Nález mutace u obou bratranců je důkazem, že jejich oba otcové, kteří zemřeli v důsledku časné formy Alzheimerovy demence, nesli také tuto mutaci, stejně jako další postižení rodinní příslušníci. Z výsledků sekčního nálezu otce pacienta, jenž byl proveden v roce 1979, se dochoval pouze morfologický a histologický popis se závěrem „Alzheimerova choroba“. K upřesnění histologického nálezu na základě současných poznatků se nepodařilo získat materiál. Naše molekulárně genetické nálezy dokazují, že se u všech členů rodiny jedná o geneticky shodnou formu onemocnění, a můžeme tedy jednoznačně vyloučit možné úvahy o jiné formě demence, např. z okruhu frontotemporálních demencí, ke kterým by mohl svádět nález atrofie mozku zejména ve frontálních lalocích [18].
Mezi pacienty s různými mutacemi v genu PSEN1 existují rozdíly v nástupu příznaků onemocnění. Např. mutace p.M146V mívá nástup příznaků kolem 40 let; mutace p.M233T před 35. rokem života [16]. V literatuře najdeme rovněž publikace o de novo vzniku mutací v genu PSEN1 u sporadických časných forem Alzheimerovy choroby – např. mutace p.S170F před 30. rokem života [19]. U pacientů s mutací p.M139V jsou v závěrečných fázích onemocnění popisovány poruchy chůze, myoklonické křeče a epileptiformní stavy. Nicméně se obecně fenotyp této časné formy AD kromě věku nástupu příznaků neodlišuje od sporadické pozdní formy [2,19–21].
Náš pacient začal trpět obtížemi ve 37 letech, přičemž skutečnost, že absolvoval pouze základní vzdělání, lze považovat za rizikový faktor demence. U jeho bratrance se onemocnění manifestovalo náhle ve 45 letech. U ostatních postižených členů rodiny neznáme přesný věk nástupu onemocnění, avšak z věku úmrtí lze předpokládat jistou variabilitu věku manifestace onemocnění. Věk manifestace demence u pacientů s mutací p.M139V v literatuře kolísá mezi 32 a 48 lety [13,15–17]. Jak je z naší rodiny patrné, existuje variabilita věku nástupu onemocnění také u pacientů se stejnou mutací v rámci jedné rodiny. Jedná se o jev, který je pozorován u genetických onemocnění obecně a je způsoben tím, že v rodině se sice dědí tatáž mutace, ale jednotliví nosiči mutace se liší v jiných, tzv. modifikujících genech, jež pak mohou ovlivnit věk nástupu příznaků a průběh onemocnění. Bez vlivu jistě není ani zevní prostředí, které mají jednotliví členové odlišné. Co se týká modifikujících genů, u našeho pacienta se nabízí otázka, zda skutečnost, že je nosičem alely APOE*E4, může mít vliv na průběh onemocnění. Tuto alelu pacient zdědil od své zdravé matky. Literární údaje nasvědčují, že genotyp APOE*E4 není modifikujícím faktorem u hereditární formy Alzheimerovy choroby [21], a proto je nejpravděpodobnější, že nález alely APOE*E4 u pacienta lze považovat za náhodný, bez souvislosti s onemocněním.
Zastoupení alely APOE*E4 v kavkazské populaci je přibližně 13–17 % (přičemž frekvence homozygotů se pohybuje kolem 1 %), zatímco frekvence alely APOE*E4 u pacientů s pozdní formou Alzheimerovy choroby dosahuje 32 až 42 % i více [22,23]. Pozdní forma onemocnění (definována jako věk nástupu nad 65. roku věku) má komplexní genetický základ, kdy kromě alely APOE*E4 se zde uplatňují další nezávisle působící geny s neúplnou penetrancí, mnoho interagujících genů a také faktory zevního prostředí [24]. Nosičství alely APOE*E4 je rizikový faktor jak pro sporadickou, tak pro familiární pozdní formu onemocnění. Nosičství jedné alely APOE*E4 zvyšuje celoživotní riziko Alzheimerovy choroby přibližně trojnásobně a může způsobovat nástup onemocnění o 5–10 let dříve než u osob bez alely APOE*E4. Osoby homozygotní pro tuto alelu (APOE*E4/4) mají až 10–20 krát vyšší riziko vzniku demence oproti obecné populaci a onemocnění u nich nastupuje o 10–20 let dříve oproti osobám bez alely APOE*E4. Avšak ne všichni nosiči alely APOE*E4 onemocní, a to i v případě homozygotního stavu [23,25]. Právě proto je využití testování zdravých osob v riziku na nosičství alely APOE*E4 sporné, neboť pozitivní výsledek je spojen s psychickým stresem u testované osoby a výpovědní hodnota o riziku je nízká. Je proto obecně doporučováno testování zdravých osob na nosičství alely APOE*E4 v klinické praxi neprovádět [25].
Vyšetření genotypu APOE u zdravé matky našeho pacienta bylo provedeno po náležitém poučení s cílem zjistit, od kterého rodiče zdědil alelu APOE*E4 a zda její nosičství segreguje v rodině s onemocněním.
Znalost příčiny onemocnění v rodině nabízí možnost vyšetření zdravých osob v riziku, zda nesou vlohu k onemocnění či nikoli, tedy tzv. prediktivní či presymptomatické testování. Toto je v případě neurodegenerativních onemocnění z etického hlediska velmi složitá otázka, neboť zdravá osoba se může dozvědět, že vlohu nese, a tedy že v budoucnosti s velmi vysokou pravděpodobností onemocní, avšak tomu nelze předejít, neboť v současnosti neznáme účinnou prevenci demence. To bývá spojeno se značnou psychickou zátěží. V České republice prozatím nebylo provedeno testování zdravých osob v riziku onemocnění na nosičství mutace v genu PSEN1 (v dané rodině o toto příbuzní neprojevili zájem), avšak bylo by vhodné se v případě zájmu řídit pravidly, která platí pro Huntingtonovu choreu [26]. Zde je možné zdravé osoby prediktivně testovat až poté, co prošly mezinárodně unifikovaným protokolem vyšetření, který zahrnuje opakovaná vyšetření neurologická, psychologická, psychiatrická a genetická [27]. Vyšetření mutace je možné provést až poté, co jsou psychologem a psychiatrem uznáni za způsobilé k prediktivnímu testování na nosičství vlohy k neurodegenerativnímu onemocnění.
U našeho případu bylo důležité, že se matka pacienta, která tušila možný rozvoj demence u svého syna vzhledem k rodinné anamnéze, sama dožadovala časného neurologického vyšetření syna a upozorňovala na možnou rodinnou zátěž. Před neurologickým vyšetřením byl pacient už opakovaně vyšetřován pro projevy kognitivního deficitu v psychiatrické ambulanci. Přesto byla léčba inhibitory acetylcholinesterázy nasazena až při projevech výrazného kognitivního postižení. Nicméně lze předpokládat, že léčba pacienta inhibitory acetylcholinesterázy zpomalila další progresi demence a umožnila lepší úroveň aktivit denního života pacienta.
V objektivním neurologickém vyšetření v roce 2003 byly u pacienta popsány prvky mimovolních pohybů typu chorey, zvláště na horních končetinách. Bylo proto indikováno vyšetření Huntingtonovy chorey, s negativním výsledkem. Tyto projevy určitě nelze považovat za abnormální manifestaci demence v souvislosti s mutací v genu PSEN1. Těmito pohyby pacient na počátku choroby maskoval anxietu a úzkost, která se projevovala hlavně v sociálních kontaktech.
Zobrazovací metody, jako je počítačová tomografie (CT) nebo lépe MR, pomáhají v diferenciální diagnostice demencí k vyloučení strukturálních lézí mozku typu expanzivních procesů a cévních změn vedoucích k syndromu demence. Tato vyšetření mohou prokázat atrofii mozku především v oblasti temporální a rozšíření mozkových komor, které jsou výraznější než u fyziologického procesu stárnutí. Mohou zde být i známky mírné angiopatie v bílé hmotě hemisfér a v podkoří, protože amyloid se může ukládat i do cévní stěny [28]. Také v námi popisovaném případě došlo během osmiletého průběhu onemocnění k výrazné atrofii mozku a rozšíření mozkových komor, které provázelo deterioraci kognitivních funkcí. Uvedené demyelinizační změny v bílé hmoty jsou nespecifického charakteru. Naše zobrazení MR má své limitace, protože první vyšetření bylo provedeno ještě na přístroji MR, kde nebylo možné některé sekvence včetně volumometrie hippokampu provést. U druhého vyšetření mají koronární řezy pro neklid pacienta pohybové artefakty, proto nebyly použity. Vyšetření muselo být předčasně ukončeno pro neklid pacienta. U druhého vyšetřovaného pacienta v rodině byly nalezeny na MR mozku také atrofické změny mozku.
Závěr
Hereditární predispozice k časné formě Alzheimerovy demence způsobená zárodečnými mutacemi v genu PSEN1 je vzácné genetické onemocnění přenášené autozomálně dominantně v postižených rodinách. Genetické vyšetření při výskytu časné formy demence v rodině je možné také v České republice (v případě zájmu o vyšetření je možné se obrátit na Laboratoř DNA diagnostiky Oddělení lékařské genetiky ve Fakultní nemocnici Ostrava). V současné době je jeho význam především diagnostický. Pravděpodobně však až v budoucnosti bude mít toto testování větší význam vzhledem k momentálně omezeným možnostem preventivní léčby v postižených rodinách.
MUDr. Petra Bártová, Ph.D.
Neurologická klinika
OU a FN Ostrava
tř. 17. listopadu 1790
708 52 Ostrava
e-mail: petrabartova@seznam.czPřijato k recenzi: 30. 11. 2010
Přijato do tisku: 8. 3. 2011
Sources
1. Ferri CP, Prince M, Brayne C, Brodaty H, Fratiglioni L, Ganguli M et al. Global prevalence of dementia: a Delphi consensus study. Lancet 2005; 366(9503): 2112–2117.
2. Jirák R, Koukolík F. Demence. Praha: Galén 2002 : 106–144.
3. Bertram L, Lill CM, Tanzi RE. The genetics of Alzheimer disease: back to the future. Neuron 2010; 68(2): 270–281.
4. Bekris LM, Yu CE, Bird TD, Tsuang DW. Genetics of Alzheimer disease. J Geriatr Psychiatry Neurol 2010; 23(4): 213–227.
5. Kowalska A. Genetics of dementias. Part 4: a spectrum of mutations responsible for the familial autosomal dominant form of Alzheimer’s disease. Postepy Hig Med Dosw 2009; 63 : 583–591.
6. Vetrivel KS, Zhang YW, Xu H, Thinakaran G. Pathological and physiological functions of presenilins. Mol Neurodegener 2006; 1 : 4.
7. Vetrivel KS, Thinakaran G. Membrane rafts in Alzheimer’s disease beta-amyloid production. Biochim Biophys Acta 2010; 1801(8): 860–867.
8. Jozwiak K, Zekanowski C, Filipek S. Linear patterns of Alzheimer’s disease mutations along α-helices of presenilins as a tool for PS-1 model construction. J Neurochem 2006; 98(5): 1560–1572.
9. Das HK. Transcriptional regulation of the presenilin-1 gene: implication in Alzheimer’s disease. Front Biosci 2008; 13 : 822–832.
10. Folstein MF, Folstein SE, McHugh PR. Mini-mental state: a practical method for grading the cognitive state of patients for the clinician. J Psychiatr Res 1975; 12(3): 189–198.
11. Dubois B, Feldman HH, Jacova C, Dekosky ST, Barberger-Gateau P, Cummings J et al. Research criteria for the diagnosis of Alzheimer’s disease: revising the NINCDS-ADRDA criteria. Lancet Neurol 2007; 6(8): 734–746.
12. Ressner P, Hort J, Rektorová I, Bartoš A, Rusina R, Línek V et al. Doporučené postupy pro diagnostiku Alzheimerovy nemoci a dalších nemocí spojených s demencí. Cesk Slov Neurol N 2008; 71/104(4): 494–501.
13. Finckh U, Müller-Thomsen T, Mann U, Eggers C, Marksteiner J, Meins W et al. High prevalence of pathogenic mutations in patients with early-onset dementia detected by sequence analyses of four different genes. Am J Hum Genet 2000; 66(1): 110–117.
14. Mazura I, Koukolík F, Jirák R. Molecular genetic analysis of Alzheimer’s dementia in the Czech population. The APP-717 mutation in the gene for amyloid protein precursor. Cas Lek Cesk 1999; 138(3): 75–77.
15. Hüll M, Fiebich BL, Dykierek P, Schmidtke K, Nitzsche E, Orszagh M et al. Early-onset Alzheimer’s disease due to mutations of the presenilin-1 gene on chromosome 14: a 7-year follow-up of a patient with a mutation at codon 139. Eur Arch Psychiatry Clin Neurosci 1998; 248(3): 123–129.
16. Zekanowski C, Styczyńska M, Pepłońska B, Gabryelewicz T, Religa D, Ilkowski J et al. Mutations in presenilin 1, presenilin 2 and amyloid precursor protein genes in patients with early-onset Alzheimer’s disease in Poland. Exp Neurol 2003; 184(2): 991–996.
17. Fox NC, Kennedy AM, Harvey RJ, Lantos PL, Roques PK, Collinge J et al. Clinicopathological features of familial Alzheimer’s disease associated with the M139V mutation in the presenilin 1 gene. Pedigree but not mutation specific age at onset provides evidence for a further genetic factor. Brain 1997; 120(Pt 3): 491–501.
18. Rektorová I. Frontotemporální lobární degenerace – diagnosa z neuro-psychiatrického pomezí. Neurol pro praxi 2006; 4 : 199–202.
19. Golan MP, Styczyńska M, Jóźwiak K, Walecki J, Maruszak A, Pniewski J et al. Early-onset Alzheimer’s disease with a de novo mutation in the presenilin 1 gene. Exp Neurol 2007; 208(2): 264–268.
20. Koukolík F, Jirák R. Alzheierova nemoc a další demence. Praha: Grada 1998 : 89–90.
21. Hort J, O’Brien JT, Gainotti G, Pirttila T, Popescu BO, Rektorová I et al. EFNS Scientist Panel on Dementia. EFNS guidelines for the diagnosis and management of Alzheimer’s disease. Eur J Neurol 2010; 17(10): 1236–1248.
22. Styczyńska M, Strosznajder JB, Religa D, Chodakowska-Zebrowska M, Pfeffer A, Gabryelewicz T et al. Association between genetic and environmental factors and the risk of Alzheimer’s disease. Folia Neuropathol 2008; 46(4): 249–254.
23. Hsiung GY, Sadovnick AD, Feldman H. Apolipoprotein E ε4 genotype as a risk factor for cognitive decline and dementia: data from the Canadian Study of Health and Aging. CMAJ 2004; 171(8): 863–867.
24. Nussbaum RL, McInnes RR, Willard HF. Thompson & Thompson: Genetics in Medicine. 6th ed. Philadelphia: WB Sounders Company 2001 : 203–247.
25. Firth HV, Hurst JA. Oxford Desk Reference: Clinical Genetics. Oxford: Oxford University Press 2005 : 296–297.
26. International Huntington Association (IHA) and the World Federation of Neurology (WFN) Research Group of Huntington’s Chorea. Guidelines for the molecular genetics predictive test in Huntington’s disease. Neurology 1994; 44(8): 1533–1536.
27. Coustasse A, Pekar A, Sikula A, Lurie S. Ethical considerations of genetic presymptomatic testing for Huntington’s disease. J Hosp Mark Public Relations 2009; 19(2): 129–141.
28. Hort J, Rusina J. Paměť a její poruchy. Praha: Maxdorf 2007 : 158–177.
Labels
Paediatric neurology Neurosurgery Neurology
Article was published inCzech and Slovak Neurology and Neurosurgery

2011 Issue 5-
All articles in this issue
- Vývojová porucha koordinace – vývojová dyspraxie
- „Awake“ resekcia supratentoriálnych low-grade gliómov lokalizovaných vo vnútri alebo v priamom kontakte s elokventnými oblasťami
- Kognitivní evokované potenciály
- Hereditární časná forma Alzheimerovy nemoci v důsledku zárodečné mutace p.M139V v genu PSEN1 – kazuistika
- Oboustranná ischemická retinopatie a neuropatie optiku jako izolovaný oční projev vysokohorské nemoci – kazuistika
- Progredující spasticita, kognitivní deficit a nevýbavné kortikální motorické evokované potenciály jako klinické příznaky pravděpodobné primární laterální sklerózy – kazuistika
- Kvalita života po hluboké mozkové stimulaci u pacientů s pokročilou Parkinsonovou nemocí
- Prevence žilní trombózy a plicní embolizace v neurochirurgii
- Zkušenosti s evakuací chronického subdurálního hematomu z návrtu kalvy
- Kognitivní dysfunkce u pacientů s klinickým izolovaným syndromem a roztroušenou sklerózou
- Agregometrie v sekundární prevenci cévních mozkových příhod. Aspirinová rezistence
- Vyšetření očních pohybů v neurologické praxi
- Kalcifikující pseudoneoplazma nervového systému – tři kazuistiky
- Czech and Slovak Neurology and Neurosurgery
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Vývojová porucha koordinace – vývojová dyspraxie
- Kognitivní evokované potenciály
- Progredující spasticita, kognitivní deficit a nevýbavné kortikální motorické evokované potenciály jako klinické příznaky pravděpodobné primární laterální sklerózy – kazuistika
- Zkušenosti s evakuací chronického subdurálního hematomu z návrtu kalvy
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career