-
Medical journals
- Career
Rosai-Dorfman-Destombesova choroba – histiocytární onemocnění se zánětlivými projevy
Authors: Z. Adam 1; Z. Adamová 2; L. Pour 1; Z. Řehák 3; R. Koukalová 3; Z. Král 1
Authors‘ workplace: Interní hematologická a onkologická klinika LF MU a FN Brno 1; Chirurgické oddělení, Vsetínská nemocnice a. s. 2; Oddělení nukleární medicíny, MOU Brno 3
Published in: Klin Onkol 2022; 35(4): 262-170
Category: Review
doi: https://doi.org/10.48095/ccko2022262Overview
Východiska: Rosai-Dorfman-Destombesova choroba (Rosai-Dorfman-Destombes disease – RDD) je vzácné histiocytární onemocnění charakterizované akumulací aktivovaných histiocytů v ložisku choroby se zánětlivou reakcí. Ačkoliv imunofenotyp patologických buněk je znám, etiopatogeneze této nemoci není stále objasněna. Původně byla nemoc považována za reaktivní, v posledních letech byly identifikovány četné mutace provázející RDD: NRAS, KRAS, MAP2K1 a ARAF, což zase svědčí pro klonální (maligní) etiologii této nemoci. RDD je heterogenní onemocnění s velmi odlišnými klinickými průběhy. Izolované nodální či kožní postižení má podstatně lepší prognózu než případy s extranodálním postižením, které jsou spojené se závažnou morbiditou i mortalitou. Nemoc se vyskytuje izolovaně anebo v asociaci s maligními či autoimunitními chorobami. Terapie je odvislá od lokalizace choroby. Při nevelkém rozsahu nemoci se používá monoterapie glukokortikoidy. V případech pokročilejšího onemocnění je nutná intenzivní léčba. Ve starších publikacích byly popsány léčebné odpovědi po antimetabolitech, vinka alkaloidech a prednisonu, v novějších pak po kladribinu, příp. thalidomidu, lenalidomidu či sirolimu, ale také rituximabu. V několika případech byl prokázán efekt kobimetinibu. Cíl: Text přináší přehled současných znalostí o tomto raritním onemocnění a uvádí dosavadní zkušenosti s léčbou RDD.
Klíčová slova:
sirolimus – rituximab – lenalidomid – kladribin – cyklosporin – Rosai-Dorfman-Destombesova choroba – kobimetinib
Úvod
Nomenklatura
Správný anglický název této vzácné choroby je kombinací tří jmen: „Rosai-Dorfman-Destombes disease“. Třetí jméno (Destombes) je často neprávem opomíjeno, možná pro délku názvu. V odborné literatuře lze najít také kratší označení nemoci „Rosai-Dorfman disease“ se zkratkou RDD. Do češtiny pak překládáme jako Rosaiova-Dorfmanova choroba. Lze však použít i další název Rosaiova-Dorfmanova-Destombesova (příp. Rosai-Dorfman-Destombesova) choroba. V dalším textu budeme používat tedy zkratku RDD. V české literatuře je této nemoci věnováno dle databáze Medvik 20 publikací. Vít Caprt ve svém článku zdůrazňuje, aby klinici na tuto nemoc mysleli, a pokud je to dle klinických projevů možné, provedli odběr na histologii a patologa na tuto možnost upozornili [1]. Z pražského pracoviště v Motole vyšla morfologická práce věnovaná histopatologii této nemoci [2]. Dětské formy RDD popsal kolektiv profesora Štěrby [3]. Kožní formu popsal Drlík et al [4] a Mazánek popsal projevy této nemoci v ORL oblasti [5]. To znamená, že tato nemoc byla u pacientů v ČR opakovaně diagnostikována a s jejím sporadickým výskytem je nutno počítat. Jedná se o vzácné onemocnění ze skupiny histiocytóz, u něhož stále není jasno, zda jde o klonální, či reaktivní onemocnění. Nakonec podobný vývoj názorů známe u ložiskové formy Castlemanovy nemoci.
Historie
První popis RDD byl zveřejněn v roce 1965 francouzským patologem jménem Pierre-Paul Louis Lucien Destombes, který popsal čtyři mladé pacienty s lymfadenopatií a sinusovou histiocytózou [6]. O 4 roky později patologové ze Standfordu Juan Rosai a Ronald Dorfman analyzovali 34 případů stejné choroby a použili pro ni termín „sinusová histiocytóza s masivní lymfadenopatií“ [7]. Ložiska nemoci byla tvořena histiocyty, které byly S100+, CD68+ a CD1a − a byla v nich patrná variabilní frekvence jevu jménem emperipoléza. Choroba byla původně považována na neagresivní onemocnění nejasné etiologie.
Juan Rosai spolu s Ronaldem Dorfmanem a Kathryn Foucarovou z University Albuquerque v New Mexiku založili první registr této nemoci, v němž shromažďovali nejen morfologické popisy, ale také klinické informace o průběhu RDD. Při počtu 423 pacientů se jedná o dosud největší analyzovaný soubor [8].
Za klasický projev byla původně [6,7] považována bilaterální krční lymfadenopatie. Na základě výše uvedeného souboru však vyšlo najevo, že ve 43 % případů byla přítomna i extranodální lokalizace, a ne všechny případy měly příznivý průběh [8]. Tato publikace jako první upozornila na velmi divergentní průběh RDD, od spontánně regredující formy až po progredující onemocnění vedoucí ke smrti nemocného.
Záhy byla popsána obtížně diagnostikovatelná intrakraniální lokalizace této nemoci [9].
Dnes je RDD považována za heterogenní jednotku, která může být tvořena solitárním anebo multifokálním onemocněním. Tato nemoc se v některých případech vyskytuje izolovaně, bez přítomnosti dalších chronických onemocnění, ale v jiných případech je asociována s hereditárními chorobami predisponujícími vznik RDD nebo se získanými chorobami autoimunitního nebo maligního charakteru.
Epidemiologie
RDD je vzácná nemoc a její prevalence v USA je odhadována na 5 : 1 000 000. Ročně je v USA nově diagnostikováno jen asi 100 nových případů [8]. Dle prvních názorů vyplývajících ze společné práce Foucarové, Rosaie a Dorf - mana měla tato choroba typicky postihovat osoby mladšího věku. V jejich souboru byla diagnostikována u dětí a mladých dospělých; medián výskytu byl 20,6 roku, ale výjimečně byla diagnostikována i u pacientů starších. Počet registrovaných případů byl v roce 1990 celkem 423 [8]. V roce 2018 publikované doporučení pro léčbu této nemoci uvádí počet popsaných případů do jednoho tisíce. Tato nemoc tedy pořád zůstává velmi vzácnou chorobou, ale přesto byla opakovaně českými lékaři léčena a popsána [2–5].
Etiopatogeneze
Etiologie zůstává od popisu této nemoci zahalena tajemstvím. Je možná, že označení RDD je skupinovým označením pro několik forem této nemoci se společnými morfologickými rysy, ale s odlišným biologickým chováním i lokalizací a možná i odlišnou etiopatogenezí. Starší studie klonality prokazovaly, že ložiska RDD jsou tvořena polyklonálními reaktivními nenádorovými buňkami [10]. Četné studie popisovaly asociaci s virovými infekty, herpetickými viry, EB-virem, cytomegalovirem a HIV, ale etiopatogenetická vazba na virové infekce nebyla zatím prokázána. Novější analýzy se u pacientů s RDD zaměřily na průkaz mutací NRAS, KRAS, MAP2K1 a ARAF. Molekulárněbiologický výzkum této nemoci prokázal přítomnost četných mutací, a to i u pacientů, u nichž nebyla prokázána další maligní choroba. Sumarizaci popsaných mutací u RDD lze nalézt v přehledové práci z roku 2020 [11] a v dalších publikacích [12–14]. O mutaci BRAF se soudilo, že je typická pro Langerhansovu histiocytózu a Erdheimovu-Chesterovu chorobu a že u RDD se nevyskytuje. Ale nic neplatí absolutně, v jednom případě byla popsána mutace BRAF také u RDD [15].
V případě asociace RDD s dalším maligním onemocněním se podařilo v několika studiích popsat mutaci společnou pro RDD a další přítomné, obvykle hematologické maligní onemocnění [16]. Práce prokazující mutace patologických histiocytů mluví ve prospěch klonální (maligní) etiologie nemoci. A tak otázka reaktivní či maligní etiologie je stále diskutována a umíme si představit, že v některých případech to bude klonální onemocnění a v jiných reaktivní.
Nemoci asociované s RDD
Vrozené genetické poruchy s predispozicí ke vzniku RDD
Mutace genu SLC29A3 je podkladem několika geneticky definovaných hereditárních chorob. Jedna z nich je familiární histiocytóza, zvaná též „Faisalabad histiocytosis“, dále „H-syndrom“ a „pigmentová hypertrichotická dermatóza s diabetem dependentním na inzulinu“. Všechny vrozené nemoci jsou řazeny k histiocytózám. A u všech těchto nemocí byl prokázán výskyt RDD [17]. Taktéž u geneticky podmíněného autoimunitního lymfoproliferativního syndromu se může v průběhu let objevit RDD. Tento autoimunitní lymfoproliferativní syndrom souvisí s heterozygotní zárodečnou mutací FAS genu TNFRSF. Postižené osoby mají celoživotně vyšší pravděpodobnost vzniku lymfomu či autoimunit, ale i RDD [18–20].
RDD asociovaná se získanými autoimunitami
Autoimunitní choroby jsou u RDD přítomny asi v 10 %. Byly popsány u pacientů s lupus erythematodes, idiopatickou juvenilní artritidou, autoimunitní hemolytickou anemií a s autoimunitním lymfoproliferativním onemocněním [21–23].
RDD asociovaná s neoplaziemi
Ložiska histologicky odpovídající RDD byla nalézána u pacientů s Hodgkinovými a nehodgkinskými lymfomy, přičemž RDD může předcházet, či následovat lymfom. Dále byla RDD pozorována u pacientů s myelodysplastickým syndromem, po transplantaci kostní dřeně a příp. provázela pacienty s maligními histiocytárními chorobami. Takže Rosai-Dorfman-Destombesova choroba může být asociovaná s neoplastickými dominantně krevními chorobami [24–28].
RDD asociovaná s „IgG4-related disease“
Publikovaná definice nemoci asociované s imunoglobulinem IgG4 (IgG4-related disease – IgG4-RD) zkomplikovala diagnostiku RDD. Při imunohistochemickém průkazu IgG4 pozitivních plazmocytů u pacientů s RDD se zjistilo, že u této choroby, zvláště u extranodálních ložisek, jsou poměrně často zastoupeny. Bylo to prokázáno v extranodálních formách RDD s postižením jater, plic, střev. V posledních desetiletích existuje v odborné morfologické literatuře hodně publikací, které popisují přítomnost IgG4 pozitivních plazmocytů v ložiscích RDD a kladou si otázku, zda je to průnik dvou chorob, anebo zda tyto nemoci mají společný základ. Tuto skutečnost záměrně ilustrujeme více citacemi, abychom doložili, že průkaz IgG4 pozitivních plazmocytů v ložisku RDD vůbec není výjimečným jevem [29–38]. Dokonce v jednom tumorózním ložisku při histologické analýze byly popsány jak struktury RDD, tak i IgG4 pozitivní plazmatické buňky a současně i znaky sarkoidózy [39]. Dle poslední klasifikace histiocytárních nemocí, kterou Jean-François Emile se spoluautory publikoval v roce 2016, nejsou zatím důkazy pro společnou etiologii těchto chorob. Nicméně autoři klasifikace histiocytárních chorob z roku 2016 doporučují u každého případu RDD provádět barvení na IgG4 pozitivní plazmatické buňky a stanovit poměr IgG4 pozitivních/IgG plazmocytů. Barvení na fibrózu je standardem, takže vlastně při každém potvrzení diagnózy RDD je třeba se vyjádřit k možnosti, že se jedná o IgG4-RD [40].
Klasické asociace – RDD s hereditárními nebo získanými chorobami typu autoimunit či malignit – signalizují vždy závažnější průběh. Jaký prognostický význam má přítomnost IgG4 pozitivních plazmocytů v ložisku této nemoci, zatím není jasné. Klasické asociace RDD s dalšími nemocemi znázorňuje schéma 1. Prognóza i léčba se odvíjejí od skutečnosti, zda je RDD sporadickým onemocněním, nebo zda je z familiárních poruch imunity nedefinovaných či definovaných, jako je autoimunitní lymfoproliferativní syndrom (ALPS), nebo zda je nemoc asociována s maligními chorobami, tj. (histiocytóza z Langerhansových buněk nebo Erdheimova-Chesterova choroba). Tato výchozí situace ovlivňuje další léčbu. Prognóza pacienta závisí dále na lokalizaci; izolovaná kožní či nodální forma má dobrou prognózu, zatímco extranodální forma již tak příznivou prognózu nemá.
Schéma 1. Klasické asociace Rosai-Dorfman-Destombovy choroby s dalšími nemocemi. 
Morfologie
Přítomnost pomalu progredující choroby s bioptickým vzorkem, který odpovídá nespecifickému zánětu (preparát obsahuje agregáty plazmocytů a lymfocytů s výraznou příměsí histiocytů), a některé z projevů RDD by měly vzbudit podezření na možnost RDD a další analýza by měla být předána do rukou odborníků se zkušeností s rozpoznáváním této nemoci. Pokud klinik na tuto nemoc pomyslí, měl by provést další vyšetření zaměřená na průkaz jiných maligních chorob či autoimunity.
Klasickými histologickými znaky této nemoci je sinusová expanze velkých histiocytů, s velkým hypochromatickým jádrem a prominentními nukleoly. Nodální forma RDD je často provázena přítomností četných plazmatických buněk s variabilním zastoupením IgG4/IgG v plazmocytech. Pro stanovení diagnózy pomáhá vždy průkaz jevu emperipoléza, což je termín pro průchod intaktních leukocytů přes cytoplazmu těchto buněk, aniž by došlo k jejich destrukci. Naproti tomu je fagocytóza jev, kdy jedna buňka pohltí druhou, ale pohlcená buňka již z ní živá nevyjde, neboť je intracelulárně destruována. Průkaz emperipolézy však není jednoznačným znakem této nemoci, protože může být přítomen u dalších histiocytárních onemocnění. Odborníci z Histiocytosis Working Group při Mayo Clinic definovali další znak tohoto onemocnění s označením OCT2, který spojuje RDD s monocytární linií [41]. Extranodální ložiska obsahují více fibrózy, méně RDD histiocytů a méně buněk s emperipolézou. Proto je vždy nutný histochemický průkaz patologických histiocytů. Velké RDD histiocyty mají svůj definovaný imunofenotyp, který je charakteristický přítomností cytoplazmatického a nukleárního proteinu S100 a fascinu, pozitivitou CD68 a variabilitou CD163 a pozitivitou CD14. Histiocytární buňky u RDD jsou CD1a−/CD207−, na rozdíl od Langerhansovy choroby, kde jsou tyto znaky pozitivní.
Diagnostika tohoto onemocnění je zkrátka velmi obtížná a patolog by měl od klinika slyšet podezření na tuto nemoc, zvláště při extranodální lokalizaci.
Klinické projevy
Nemoc postihuje jak uzliny, tak i parenchymové orgány. Nodální postižení může probíhat současně s postižením jiných orgánů, takže tuto situaci nazveme nodální a extranodální formou. Pokud se bude jednat o izolované postižení uzlin, použijeme termín izolovaná nodální forma. Rozdělení na izolované nodální formy, příp. na kombinovanou nodální a extranodální formu anebo na čistě extranodální formu RDD má prognostický význam. Nejlepší prognózu mají pacienti s izolovaným nodálním postižením a pak pacienti s izolovaným kožním postižením. Diagnostika extranodálních ložisek je vždy obtížnější než diagnostika nodálních ložisek a je vždy nutno udělat širší diferenciální diagnostiku dalších histiocytóz, které se v této lokalizaci taktéž manifestují, jako je histiocytóza z Langerhansových buněk a Erdheimova-Chesterova choroba [42]. V první velké analýze z roku 1990 mělo 43 % pacientů extranodální lokalizaci. Multisystémové postižení bylo diagnostikováno v 19 % všech případů a prognóza korelovala s rozsahem nemoci [8].
Nodální forma RDD
Většina pacientů s RDD přichází s bilaterální masivní nebolestivou krční lymfadenopatií, kterou mohou, ale nemusejí provázet B-symptomy (intermitentní horečky, noční pocení a úbytek hmotnosti). Mediastinální a axilární uzliny bývají infiltrovány méně často než uzliny krční a zcela neobvyklá je infiltrace retroperitoneálních uzlin, i když taktéž byla popsána [43]. Čím více nodálních skupin je postiženo, tím je prognóza závažnější, a naopak [42].
Kožní forma RDD
Kožní forma RDD tvoří asi 10 % případů extranodální formy RDD, ale izolovaná kožní forma je vzácná. Ložiska se obvykle v průběhu času pomalu zvětšují, nebolí a nesvědí. Makroskopicky tvoří plaky a papuly se zbarvením, které se pohybuje od typicky žluté do červenohnědé. RDD může postihnout kteroukoliv část kožního povrchu. Diferenciální diagnóza zahrnuje akné vulgaris, projevy varicella zoster, sarkoidózu, kožní lymfomy a kožní metastázy [44].
Neurologická forma (intrakraniální, spinální a oční RDD)
Postižení CNS je popisováno v < 5 % případů. Podstatně častější je intrakraniální lokalizace – 75 % všech těchto CNS případů, zatímco pouze 25 % případů tvoří spinální lokalizace.
Neurologická forma RDD byla k datu 2017 popsána ve > 300 případech a obvykle postihuje starší pacienty bez lymfadenopatie [45,46]. Pacienti přicházejí s bolestmi hlavy, paresteziemi, poruchou stability, motorickými a senzorickými abnormalitami a také s poruchami funkce hlavových nervů. Tyto potíže se obvykle vyvíjejí měsíce. Familiární případy jsou asociovány s poškozením sluchového nervu a hluchotou [47]. Nejčastějším projevem této nemoci na zobrazovacích vyšetřeních je solitární intrakraniální masa s homogenním enhancementem v oblasti tvrdé mozkové pleny (dury), která může dělat dojem meningeomu [48,49].
RDD může ale také způsobit difuzní pachymeningitidu. Pokud se objeví parenchymové ložisko, tak to bývá často lokalizováno infratentoriálně v mozkovém kmeni a ve Varolově mostu, zatímco supratentoriální či intraventrikulární lokalizace ložisek a mnohočetná ložiska jsou vzácná, ale jsou také popsána [50,51]. Vyšetření mozkomíšního moku je obvykle nenápadné, někdy vykazuje lymfocytární pleocytózu, zvýšenou hodnotu bílkoviny, nižší glukózu a emperipolézu [49]. Manifestace v tvrdé pleně krční páteře či v dalších oblastech páteře jsou méně časté. V těchto případech se může nemoc projevit známkami myelopatie či míšní kompresí. Forma RDD postihující CSN může mít rychle progresivní průběh, a pokud se nepodaří chorobu operačně odstranit, tak může skončit i smrtí nemocného [15,52,53].
Oční manifestace tvoří asi 11 % případů RDD. Oční forma RDD vytváří patologické masy v měkkých částech orbity, očním víčku, slzných žlázách, spojivce a v rohovce. Může se také manifestovat jako uveitida anebo způsobí kompresi optického nervu [54].
RDD v oblasti hlavy a krku
Postižení nosních dutin a paranazálních sinů je popisováno v 11 % případů RDD a je častější u Asiatů. Tato lokalizace RDD způsobuje pocit ucpaného nosu, epistaxi, deformitu nosu a obličeje. RDD v dutině ústní tvoří noduly na měkkém a tvrdém patře a na gingivě, způsobuje otok sliznice dutiny ústní, příp. i zesílení jazyka. Lokalizace RDD v tonzilách způsobí jejich zbytnění. Vzácněji RDD postihuje příušní a podčelistní slinné žlázy, příp. larynx, farynx a tymus. Ale i ve štítné žláze může RDD vytvořit masivní infiltrát a tomu odpovídající příznaky [55,56], tedy vlastně podobné příznaky, jaké v oblasti hlavy a krku způsobuje nemoc IgG4-RD.
Intratorakální forma RDD
Intratorakální projevy jsou popsány jen u 2 % pacientů, obvykle ve formě lymfadenopatie. Choroba se zde však může projevit jako intersticiální plicní postižení, plicní nodularity, tracheobronchiální infiltráty, příp. pleurální výpotek. Podobně jako jiné choroby v oblasti hrudníku i tyto ohlašuje suchý dráždivý kašel, progresivní dušnost a respirační selhávání. Plicní forma může připomínat plicní karcinom, intersticiální plicní záněty, sarkoidózu, granulomatózní polyangiitis, postižení plicní při revmatoidní artritidě, příp. TBC. Pouze odběr materiálu k morfologickému vyšetření může pomoci s diferenciální diagnózou. Forma RDD, která postihuje plíce, mívá agresivní chování a mortalita zde dosahuje až 45 % [57,58]. Postižení srdce je velmi vzácné, jen 0,1–0,2 %, ale taktéž bylo popsáno [59].
Retroperitoneální a urologická forma RDD
Ledviny jsou postiženy ve 4 % RDD případů dle analýzy z roku 1990. RDD v ledvině může nabýt formy masivního ložiska či difuzní infiltrace. V této lokalizaci se RDD, podobně jako jiné nemoci ledvin, projevuje hematurií, bolestí v bedrech, pocitem plnosti, příp. nefrotickým syndromem způsobeným sekundární amyloidózou či trombózou renální žíly. Takže opět nespecifické příznaky, a tedy jedině morfologie pomůže v diferenciální diagnostice, protože podobné příznaky mohou mít i četné další nemoci ledvin. Prognóza pacientů při postižení ledvin je závažná, mortalita v těchto případech dosahuje až 40 % [8,60–65]. V jednom popsaném případě byla infiltrace ledviny RDD původcem nadprodukce kalcitriolu, který způsobil hyperkalcemii [66]. Zcela výjimečně může RDD tvořit nebolestivý tumor v oblasti varlete či nadvarlete [67] anebo infiltrát v nadledvině [68].
Postižení trávicího traktu RDD
Gastrointestinální trakt bývá postižen vzácně (< 1 % všech případů), obvykle ve formě lymfadenopatie či extranodální formy nemoci. Choroba byla identifikována v těchto oblastech: ileocekum, apendix a distální kolon. Příznaky odpovídají opět funkčnímu poškození této oblasti a jsou to: zácpa, bolesti břicha, hmatná abdominální masa, intestinální okluze. Někdy byla tato diagnóza RDD překvapením při histologickém vyšetření materiálu odebraného při apendektomii anebo při kolonoskopii. Pankreatická či hepatální lokalizace nemoci je sice také popisována, ale je extrémně vzácná [69–73].
Kostní manifestace
Postižení kostí je popsáno v 5–10 % případů RDD a je typicky asociováno s uzlinovou formou. Choroba bývá lokalizována kdekoliv v kosti a mívá osteolytický či smíšený lyticko-sklerotický charakter. Může mít přesah i do měkkých tkání, podobně jako se manifestuje histiocytóza z Langerhansových buněk. Bolesti kostí jsou časté a výjimečně může dojít až k patologické fraktuře. Opět je zde široká diferenciální diagnostika od fibrózní dysplazie, lymfomů, Ewingova sarkomu po mnohočetný myelom. Pokud jsou ale ložiska ve femuru a v tibii, mělo by to vzbudit podezření na Erdheimovu-Chesterovu chorobu. Prognóza kostního postižení je relativně příznivá [74,75].
Hematologické projevy RDD
Typickými hematologickými projevy je normochromní normocytární anemie (v 67 % případů), leukocytóza (v 60 % případů), typicky neutrofilní, trombocytopenie, eozinofilie, hypergamaglobulinemie a zvýšená hodnota sedimentace erytrocytů. Postižení kostní dřeně je výjimečné, ale také bylo popsáno [76].
Rozložení postižení dle studie z Mayo Clinic (2021)
V letech 1994–2017 diagnostikovali na Mayo Clinic 64 pacientů s touto nemocí, medián věku byl 50 (2–79) let. Symptomy nemoci trvaly před zjištěním diagnózy 0 až 128 měsíců. Stanovení diagnózy si v průměru vyžádalo 2 (1–6) biopsií, než se podařilo nemoc morfologicky pojmenovat. Nejčastější formou nemoci byla podkožní ložiska (40 %). Z 64 pacientů mělo jen 8 % klasickou formu postihující pouze uzliny; 92 % nemocných mělo extranodální postižení, z toho 67 % mělo pouze extranodální postižení. Nejčastěji postiženým orgánem byla kůže a podkoží (52 %), následovaná lymfatickými uzlinami (33 %). U tří pacientů zjistili překryv s Erdheimovou-Chesterovou chorobou a dva z nich měli mutaci MAP2K1. Nejčastěji použitá léčba 1. linie byla excize (38 %) a systémová léčba glukokortikoidy (27 %). Glukokortikoidy vedly k léčebné odpovědi u 56 % pacientů, ale u 15 (30 %) z nich choroba po ukončení podávání glukokortikoidů zrecidivovala. V 2. linii byl nejčastěji použit kladribin (n = 6) s 67 % léčebných odpovědí [79]. Rozložení projevů nemoci v souboru z Mayo Clinic ilustruje graf 1.
Graph 1. Rozložení projevů Rosai-Dorfman-Destombovy choroby v souboru pacientů na Mayo Clinic [79]. ![Rozložení projevů Rosai-Dorfman-Destombovy choroby v souboru pacientů na Mayo Clinic [79].](https://pl-master.mdcdn.cz/media/image_pdf/86c776397d417a3128a5b22a4e9a905c.jpg?version=1660664094)
Základní vyšetření
Zjištění rozsahu choroby je vždy základem pro plánování léčby. V případě RDD je však vyšetření cíleno ještě na dvě další otázky: je přítomná další malignita, je přítomná nějaká virová infekce či autoimunita, s níž by nemoc byla asociována? Ložiska RDD jsou známá vysokou akumulací fluorodeoxyglukózy (FDG), a proto FDG-PET/CT je zde vhodným vyšetřením. V případě RDD se doporučuje vyšetření celotělové, podobně jako u Erdheimovy-Chesterovy choroby anebo u mnohočetného myelomu, aby byly zachyceny případné změny v kostech či měkkých tkáních dolních končetin.
V případě orbitálních či neurologických symptomů se doporučuje MR vyšetření s aplikací gadolinia cílené na mozek a orbity, a pokud jsou symptomy, tak i na míchu.
Screeningová MR mozku a páteře s aplikací kontrastu se doporučuje k identifikaci asymptomatických ložisek, která by později mohla působit neurologické problémy. Cílené orgánové MRI vyšetření (např. MR srdce či břicha) může být nutné ke strukturálnímu vyhodnocení ložisek zvýšené akumulace při FDG-PET/CT vyšetření, které sice prokáže zvýšenou akumulaci, ale celotělové nízkodávkové CT nepodá bližší informaci o struktuře ložiska se zvýšenou akumulací FDG.
V klasickém laboratorním vyšetření chceme zdůraznit vyšetření sérologií na hepatitidy, HIV a pak vyšetření antinukleárních protilátek a revmatoidního faktoru, příp. dalších autoprotilátek, jako screening potenciálních asociovaných autoimunit.
Morfologické a molekulárně-biologické vyšetření tkáně
Histologická diagnóza by měla být potvrzena patologem se zkušeností s rozpoznáváním této nemoci. Ve vzorku je vždy nutno pomocí průtokové cytometrie, cytogenetiky a imunofenotypizace vyloučit lymfoproliferativní onemocnění. Současně se vždy doporučuje provést imunohistochemické vyšetření počtu IgG4 pozitivních plazmocytů a jejich poměru s IgG pozitivními plazmocyty, protože zde existuje určitý nejasný překryv s IgG4-RD.
V případě závažného poškození či rezistence na léčbu by v materiálu z ložiska RDD měla být provedena analýza mutací genů signální cesty MAPK, přičemž za minimální rozsah jsou považována tato vyšetření: mutace KRAS, NRAS, HRAS, ARAF, BRAF a MAP2K1. Prokázání některé z těchto mutací otevírá cestu k cílené léčbě.
Pro přesný rozsah vhodných vyšetření je užitečné otevřít si poslední doporučení pro diagnostiku a léčbu této nemoci, ať již mezinárodní [78], nebo guidelines histiocytární skupiny z Mayo Clinic publikovaná v roce 2019 [79], příp. guidelines National Comprehensive Cancer Network (NCCN) z roku 2021 [80].
Léčba
Informace o léčbě jsou pouze z popisů případů, nikoliv z klinických studií, proto léčbu 1. a 2. linie nelze definovat [78–80].
Sledování bez léčby
Nepodání léčby a prosté sledování je alternativa pro nevelká nodální a příp. kožní ložiska, protože dvě práce uvádějí, že tito pacienti mívají spontánní remisi ve 20–50 % případů. Tento postup je možný u pacientů s nekomplikovanou lymfadenopatií anebo asymptomatickou kožní formou RDD [81,82].
Operace
Operační výkony jsou obvykle prováděny jen s cílem získat biopsii. V případě kompresivních syndromů může být operace použita k odstranění většiny ložiska (debulking), a tedy k odstranění symptomů. V případě izolovaného ložiska může být kurativní operace definitivní léčbou. Dlouhodobě dobré výsledky resekční léčby byly popsány u izolovaných intrakraniálních ložisek [83]. Také pro léčbu kožních forem je operační excize optimální léčbou. Endoskopická resekce RDD v oblasti nosu a paranazálních dutin pomůže odstranit symptomy a obnovit průchodnost dýchacích cest. V případě multifokální choroby je operační resekce možná s cílem zmenšení velké masy patologické tkáně (debulkingová operace), pokud zlepší stav nemocného [78–80].
Glukokortikoidy
Glukokortikoidy jsou přínosem pro redukci velikosti nodálního postižení a symptomů, ale výsledky monoterapie glukokortikoidy nejsou jednoznačné. Prednison v dávce 40–70 mg denně vedl k rychlé kompletní či parciální remisi v příp. orbitální manifestace, příp. CNS a kostní manifestace. Ve srovnání s jinými chorobami se používají vyšší dávky prednisonu, tj. > 0,5 mg/kg/den [84,85]. Dalším použitým glukokortikoidem je dexametazon (8–20 mg denně), tato léčba byla účinná v případě ložiska v CNS se zvětšením hilových uzlin [86,87]. Délka léčby není definována, doporučuje se léčit do maximální léčebné odpovědi a pak dávku glukokortikoidu postupně snižovat. Zcela výjimečné jsou popisy nitroložiskové aplikace glukokortikoidů u pacientů s orbitální manifestací s kompresí optického nervu [88].
V dalších případech orbitální, tracheální, renální a jiné měkkotkáňové lokalizace však glukokortikoidy selhaly [89,90]. Nevýhodou glukokortikoidní terapie je, že ložiska často po ukončení léčby recidivují. A tak autoři doporučení uvádějí, že extranodální ložiska reagují na glukokortikoidy špatně, a pokud ano, tak remise po ukončené monoterapii glukokortikoidy jsou krátké [78–80].
Cyklosporin a sirolimus
Imunosupresivně působící cyklosporin byl použit ve dvou případech s velmi dobrým výsledkem [91,92]. V posledním desetiletí se však neobjevila další práce potvrzující efekt cyklosporinu.
Produkce cytokinů je v případě RDD obvykle dysregulovaná; sirolimus tlumí produkci cytokinů imunitními buňkami. První práce popisující úspěšnou léčbu sirolimem se objevila v roce 2012 [93] a v pozdějších letech byly zveřejněny další dvě práce s pozitivním hodnocením sirolimu [94,95].
V rámci klinické studie byl sirolimus testován na deseti pacientech s Erdheimovou-Chesterovou chorobou, což je příbuzné histiocytární onemocnění. Při léčbě sice nemoc u dvou pacientů progredovala, ale u 8 (80 %) pacientů v průběhu léčby sirolimem a prednisonem Erdheimova-Chesterova nemoc ustupovala. Erdheimova-Chesterova choroba a RDD mají jednu společnou charakteristiku: zánětlivou reakci indukovanou přítomností patologických histiocytárních buněk neboli zánět, v jehož pozadí je nádor. A na tuto patologickou zánětlivou reakci cílí léčba cyklosporinem anebo sirolimem a prednisonem [96].
Z těchto ojedinělých zkušeností vyplynula snaha dále testovat sirolimus u RDD, zvláště pak u rezistentních forem RDD asociovaných s autoimunitami, jako je např. RDD a imunitní cytopenie nebo RDD a autoimunní lymfoproliferativní syndrom [78–80].
Chemoterapie
Léčba RDD pomocí chemoterapie měla střídavé úspěchy a neúspěchy. Ačkoliv chemoterapie je obvykle rezervována pro refrakterní či relabující případy RDD, někdy byla u pokročilého onemocnění použita jako léčba první linie. Antracykliny a alkylační léky měly malou účinnost, zatímco po podávání vinka alkaloidů byly popsány variabilní výsledky [67]. Nízké dávky metotrexátu a 6-merkaptopurinu byly účinné jen u několika pacientů [67,97]. Dlouhodobější remise byly popsány po režimu složeném z vinblastinu, metotrexátu, 6-merkaptopurinu a thioguaninu [98], příp. po kombinaci vinblastinu, prednisonu, metotrexátu a 6-merkaptopurinu [99], nebo vinorelbinu a metotrexátu [100]. S cílem udržet remisi byl podáván 6-merkaptopurin v monoterapii a dle jednoho popisu případu byla tato léčba úspěšná u dospělého pacienta s orbitální a intrakraniální RDD [101]. Dlouhodobé remise intrakraniální formy RDD byly popsány při použití léčby kombinací cyklofosfamid, doxorubicin, vinkristin a prednison – CHOP [102]. U jednoho pacienta s opakovanými relapsy RDD se situace zlepšila po aplikaci cytosin-arabinosidu, prednisonu a vinkristinu s následnou udržovací léčbou metotrexátem a merkaptopurinem [103]. Při léčbě pacienta s refrakterní kožní formou byla úspěšná kombinace vinkristinu a nízké dávky metotrexátu [104,105]. Další použitou kombinací byl azathioprin a interferon alfa; ve dvou případech byla léčba účinná [106,107]. V dalším případě ale interferon alfa v kombinaci s chemoterapií nedosáhl žádné léčebné odpovědi [105]. Uvedené léky ze skupiny antimetabolitů a ze skupiny vinka alkaloidů mají tedy určitou, ale limitovanou účinnost.
Kladribin
Výraznější účinnost je opakovaně popsána po kladribinu (2-chlorodeoxyadenosinu) a klofarabinu. Nukleosidová analoga poškozují funkci monocytů, to vede ke snížené tvorbě cytokinů: interleukinu (IL) -6, IL-1b a tumor nekrotizujícího faktoru alfa (tumor necrosis factor a – TNF-a) a to zřejmě přispívá k úspěchu léčby. Oba tyto léky ze skupiny nukleosidových analog (kladribin a klofarabin) mají potenciál dosáhnout kompletní remise, což bylo potvrzeno ve čtyřech citovaných publikacích [62,108–111]. Vyjma těchto popisů jednotlivých případů je k dispozici hodnocení celého souboru z Mayo Clinic, v jejichž souboru pacientů bylo kladribinem léčeno 6 pacientů a výsledkem bylo 67 % dlouhodobých léčebných odpovědí [79]. Kladribin byl podáván v dávce od 2,1–5 mg/m2 denně po dobu 5 dnů, každých 28 dní, celkem 6 měsíců. V tomto dávkování navodil dlouhodobou remisi u pacientů s refrakterní či relabující RDD. Další používané nukleosidové analogum je klofarabin [112,113]. Na našem pracovišti jsme léčili jednu pacientku kladribinem a remise její choroby zatím trvá [114], což dokumentují obr. 1 a 2.
Image 1. Vstupní PET CT. 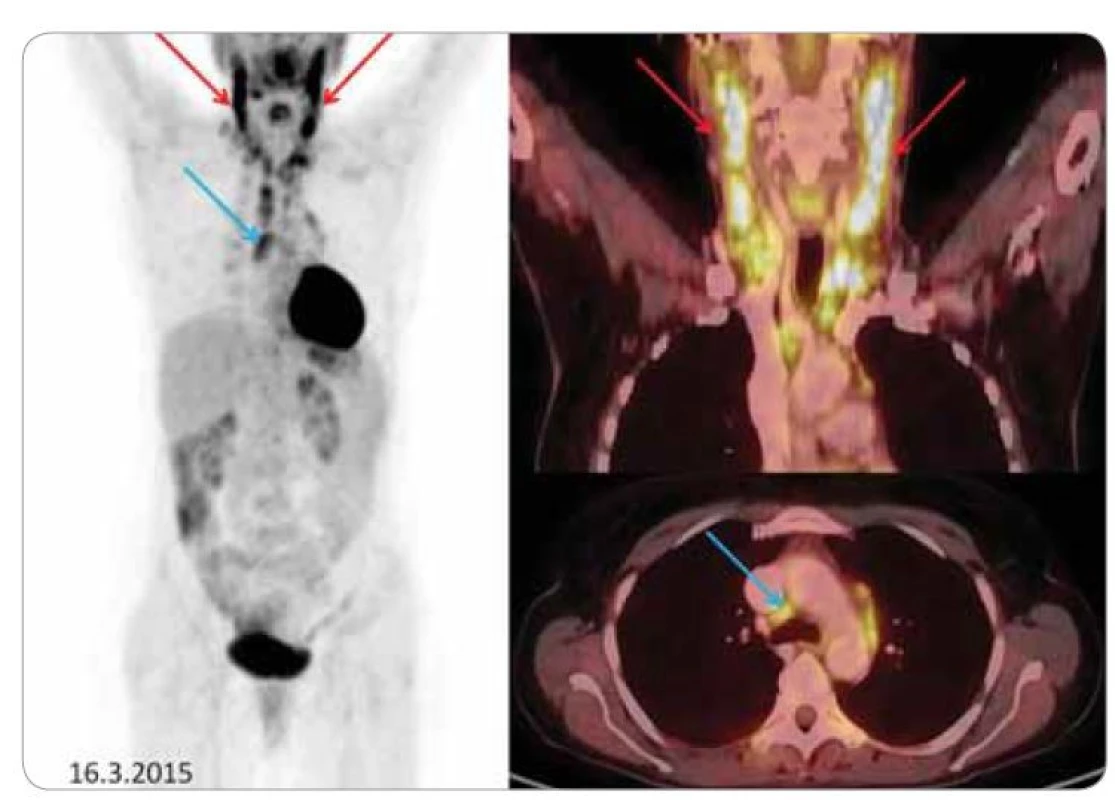
Vlevo sumované obrázky, vpravo fúzované FDG-PET/CT koronární řezy (krk) a axiální řezy (mediastinum). Patologickým nálezem je zvýšená akumulace 18F-fluorodeoxyglukózy v četných, místy zvětšených uzlinách: na krku bilaterálně (červené šipky) – nález je výraznější vlevo, uzliny zde splývají v pakety, v obou nadklíčcích a v mediastinu (modré šipky). Image 2. Kontrolní PET CT. 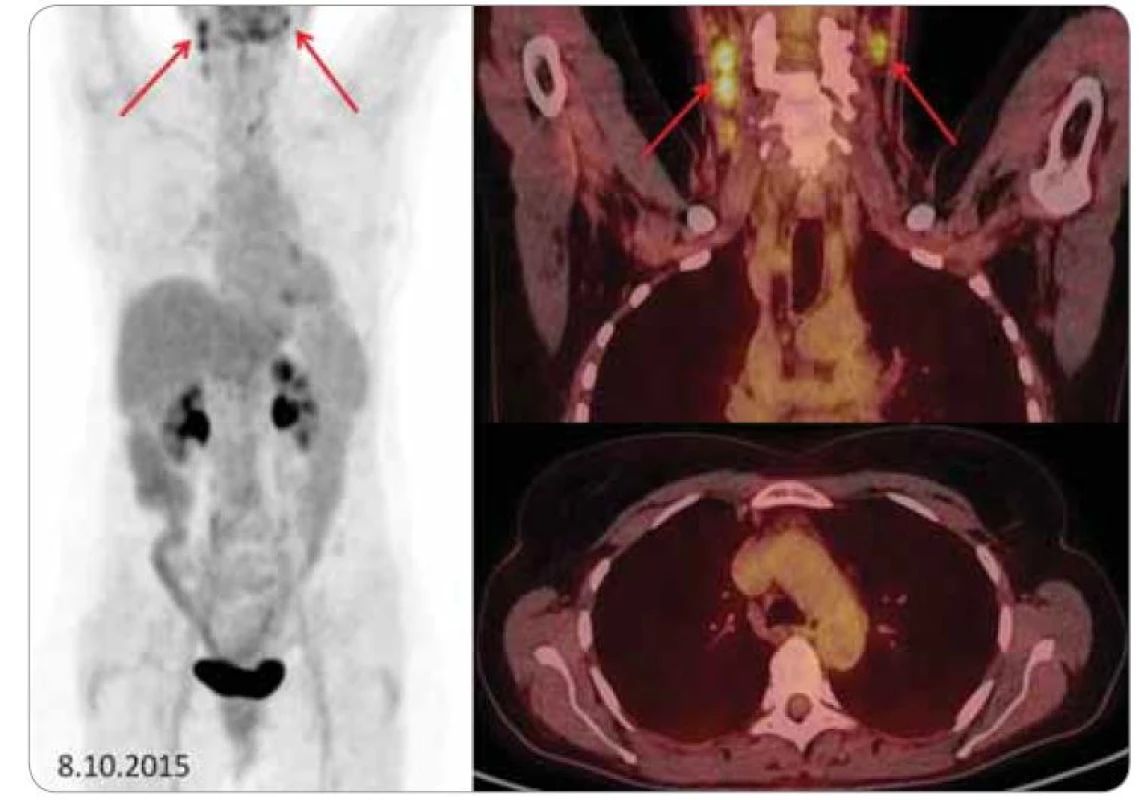
Vlevo sumované obrázky, vpravo fúzované FDG-PET/CT koronární řezy (krk) a axiální řezy (mediastinum). Po léčbě dochází k výrazné regresi počtu, velikosti a metabolické aktivity uzlin. Přetrvávají jen nevýrazná rezidua postižení v podobě jednotlivých patologických uzlin na krku bilaterálně (červené šipky). Imunomodulační léčba
Thalidomid, lenalidomid a příp. pomalidomid mimo jiné inhibují tvorbu TNF-a a odborná literatura o nich píše, že mají „promising results in RDD“ neboli že to párkrát vyšlo, ale na definitivní zhodnocení je málo zkušeností. Léčba nízkými dávkami thalidomidu v dávce 100 mg denně byla účinná u pacienta s kožní formou RDD [115]. Podle našich zkušeností s léčbou thalidomidem u pacientů s myelomem tolerance tohoto léku není bezproblémová (neuropatie, spavost, deprese). A tak bychom upřednostnili lenalidomid, který má podstatně lepší toleranci než thalidomid. Úspěch léčby RDD lenalidomidem byl popsán v několika popisech případů [116–118].
Z MD Anderson Cancer center publikovali soubor 10 pacientů s mediánem věku 56 (20–81) let. Pět z nich bylo léčeno kladribinem, ostatní byli léčeni klofarabinem a lenalidomidem. Pacienti léčení kladribinem se dostali v 80 % do remise s mediánem bezpříznakového intervalu 29 měsíců. Přínos měla i léčba klofarabinem nebo lenalidomidem [119].
Rituximab
Rituximab zasahuje také do imunity; tím, že ničí četné B-buňky, dochází k poklesu cytokinů a to může mít pozitivní vliv na četné nemoci se zánětlivými projevy. Rituximab má potvrzenou účinnost u Castlemanovy nemoci, IgG4-RD a taktéž u RDD.V pensylvánské studii v letech 2019 a 2020 evidovali 15 pacientů s RDD, z nichž 87 % mělo extranodální postižení. Rituximabem léčili celkem 7 pacientů a z nich 64 % zůstalo bez progrese 24 měsíců od ukončení léčby [120]. Další publikace zmiňují rituximab jako účinnou léčbu u jednotlivých pacientů, zvláště při souběhu RDD a autoimunity [121].
V jednom případě byla použita kombinace rituximabu, cyklofosfamidu a vinkristinu s prednisonem, bylo podáno 8 cyklů této léčby s následnou radioterapií v dávce 10 Gy [122].
Rituximab je tedy dalším účinným lékem pro pacienty s RDD a je obzvláště vhodný, pokud je RDD spojena s autoimunitou [123–126]. Ale jsou popsány i případy progrese po rituximabu [127].
Cílená léčba
Tyrozinkinázový inhibitor imatinib mesylát měl efekt u jednoho pacienta s refrakterní RDD. Histiocyty v ložiscích obsahovaly proteiny PDGFRB a KIT dle imunohistochemické analýzy a tyto proteiny je imatinib schopen blokovat [128,129]. V dalším případě, kde byl imatinib také testován, byla léčba neúspěšná [130].
U RDD bylo také pátráno po přítomnosti mutace BRAF-V600E, která je občas přítomna v buňkách histiocytózy z Langerhansových buněk a Erdheimovy-Chesterovy choroby [131]. Napřed se odborníci domnívali, že tato mutace u RDD vůbec neexistuje a tím pádem nelze použít léky typu vemurafenib. Ale v medicíně nic neplatí absolutně a v roce 2018 byla mutace BRAF popsána u pacienta s formou RDD postihující CNS [15].
Podobně jako u dalších histiocytóz také u RDD byla testována léčba inhibitorem signální cesty MEK, kobimetinibem. Tato léčba byla účinná u jednoho pacienta s nemutovanou formou RDD a pak u dospělého pacienta s RDD, jehož histiocytární buňky v ložisku RDD obsahovaly mutaci KRAS [132,133]. V roce 2021 bylo publikováno poměrně dost odborných publikací, v nichž je popsán léčebný účinek kobimetinibu u pacientů s RDD [134–138], takže tento lék představuje další variantu léčby.
Radioterapie
Radioterapie je u RDD jen částečně účinná, přínosem může být u refrakterních infiltrátů v měkkých tkáních a orbitě nebo při obstrukci dýchacích cest. Pro léčbu není definována optimální dávka záření. V jednotlivých případech, které byly publikovány, se použitá dávka pohybovala od 30 do 50 Gy [139,140].
Léčba a průběh nemoci
Pokud se používá léčba glukokortikoidy, tak obvykle po dobu 6–12 měsíců s následnými kontrolami a příp. nižší udržovací dávkou. To vše za předpokladu, že léčba je dobře tolerována, neindukuje diabetes mellitus anebo nevede k jeho zhoršení a nemá ani jiné známé nežádoucí účinky glukokortikoidů (žaludeční vředy, častější infekce, dekompenzace psychiky, poruchy spánku). Nemoc na léčbu reaguje jen pomalu, a tak první vyhodnocení je doporučováno po 4 měsících.
Průběh nemoci je divergentní, příznivý je v případech limitovaných na uzliny a kůži. U pacientů s extranodálními ložisky RDD má nemoc nepredikovatelný průběh a často se střídají remise a reaktivace nemoci, které trvají roky. Největší soubor v dějinách této nemoci zatím popsali Foucar et al v roce 1990, kdy 17 pacientů (7 %) zemřelo následkem této nemoci, průvodních infekcí či amyloidózy, zřejmě typu AA [8].
Další velký soubor popsali Pulsoni et al v roce 2002; jednalo se celkem o 80 pacientů, z nichž 10 (12 %) zemřelo v důsledku RDD. Nepříznivý průběh měla tato choroba při postižení ledvin, jater a dolních dýchacích cest. Proto u těchto typů postižení je třeba snažit se najít účinnou léčbu [81].
Závěr
RDD je dobře definována svým histologickým obrazem. Biologické chování nemoci je však velmi divergentní. Mimouzlinové formy RDD mají nepříznivou prognózu. Je možné otestovat terapie, které jsou výše uvedeny jako účinné, ale je také vhodné s odstupem času od této publikace znovu ověřit v Medline PubMed, zda nejsou nové účinné léky. Z popsaných léčebných postupů se zdá nejúčinnější léčba kladribinem, příp. rituximabem v kombinaci s dalšími léky a nově kobimetinibem. Neexistují však srovnávací studie léčebných alternativ z důvodu malého počtu nemocných. V individuálních případech lze otestovat všechny výše vyjmenované léčebné postupy, které alespoň v některých případech přinesly pacientovi prospěch.
Autoři deklarují, že v souvislosti s předmětem studie nemají žádné komerční zájmy.
The authors declare they have no potential conflicts of interest concerning drugs, products, or services used in the study.
Redakční rada potvrzuje, že rukopis práce splnil ICMJE kritéria pro publikace zasílané do biomedicínských časopisů.
The Editorial Board declares that the manuscript met the ICMJE recommendation for biomedical papers.MUDr. Zuzana Adamová
Chirurgické oddělení
Vsetínská nemocnice a.s.
Nemocniční 955
Vsetín 755 01
e-mail: adamova@nemocnice-vs.cz
Obdrženo/Submitted: 17. 12. 2021
Přijato/Accepted: 6. 3. 2022
Sources
1. Camprt V. Monitor aneb nemělo by Vám uniknout, že existuje Rosai-Dorfmanova nemoc (i když je poměrně vzácná). [online]. Dostupné z: https: //www.prolekare.cz/casopisy/cesko-slovenska-patologie/2021-3-14/hematopatologie-128074.
2. Kodeová D, Kodet R, Syrůček M et al. Sinus histiocytosis with massive lymphadenopathy – a disseminated form of the Rosai-Dorfman syndrome. Cesk Patol 1996; 32 (2): 53–59.
3. Křenová Z, Bajčiová V, Štěrba J. Histiocytózy u dětí a dospívajících. Onkologie 2016; 10 (5): 206–209.
4. Drlík L, Pock L. Rosai-Dorfmanova nemoc – kožní forma. Čes-slov Derm 2017; 92 (4): 180–183.
5. Mazánek J, Povýšil C. Rosai-Dorfmanova nemoc v oblasti hlavy a krku. Choroby hlavy a krku 2006; 15 (1): 39–43.
6. Destombes P. Adenitis with lipid excess, in children or young adults, seen in the Antilles and in Mali (4 cases). Bull Soc Pathol Exot Filiales 1965; 58 (6): 1169–1175.
7. Rosai J, Dorfman RF. Sinus histiocytosis with massive lymphadenopathy. A newly recognized benign clinicopathological entity. Arch Pathol 1969; 87 (1): 63–70.
8. Foucar E, Rosai J, Dorfman R. Sinus histiocytosis with massive lymphadenopathy (Rosai-Dorfman disease): review of the entity. Semin Diagn Pathol 1990; 7 (1): 19–73.
9. Mahzoni P, Zavareh MH, Bagheri M et al. Intracranial Rosai Dorfman disease. J Res Med Sci 2012; 17 (3): 304–307.
10. Paulli M, Bergamaschi G, Tonon L et al. Evidence for a polyclonal nature of the cell infiltrate in sinus histiocytosis with massive lymphadenopathy (Rosai-Dorfman disease). Br J Haematol 1995; 91 (2): 415–418. doi: 10.1111/j.1365-2141.1995.tb05313.x.
11. Bruce-Brand C, Schneider JW, Schubert P. Rosai-Dorfman disease: an overview. J Clin Pathol 2020; 73 (11): 697–705. doi: 10.1136/jclinpath-2020-206733.
12. Shanmugam V, Margolskee E, Kluk M et al. Rosai-Dorfman disease harboring an activating KRAS K117N missense mutation. Head Neck Pathol 2016; 10 (3): 394–399. doi: 10.1007/s12105-016-0709-6.
13. Garces S, Medeiros LJ, Patel KP et al. Mutually exclusive recurrent KRAS and MAP2K1 mutations in Rosai-Dorfman disease. Mod Pathol 2017; 30 (10): 1367–1377. doi: 10.1038/modpathol.2017.55.
14. Matter MS, Bihl M, Juskevicius D et al. Is Rosai-Dorfman disease a reactive process? Detection of a MAP2K1 L115V mutation in a case of Rosai-Dorfman disease. Virchows Arch 2017; 471 (4): 545–547. doi: 10.1007/s00428-017-2173-4.
15. Richardson TE, Wachsmann M, Oliver D et al. BRAF mutation leading to central nervous system rosai-dorfman disease. Ann Neurol 2018; 84 (1): 147–152. doi: 10.1002/ana.25281.
16. Bonometti A, Ferrario G, Parafioriti A et al. MAP2K1-driven mixed Langerhans cell histiocytosis, Rosai-Dorfman-Destombes disease and Erdheim-Chester disease, clonally related to acute myeloid leukemia. J Cutan Pathol 2021; 48 (5): 637–643. doi: 10.1111/cup.13918.
17. Morgan NV, Morris MR, Cangul H et al. Mutations in SLC29A3, encoding an equilibrative nucleoside transporter ENT3, cause a familial histiocytosis syndrome (Faisalabad histiocytosis) and familial Rosai-Dorfman disease. PLoS Genet 2010; 6 (2): e1000833. doi: 10.1371/journal.pgen.1000833.
18. Xie Y, Pittaluga S, Price S et al. Bone marrow findings in autoimmune lymphoproliferative syndrome with germline FAS mutation. Haematologica 2017; 102 (2): 364–372. doi: 10.3324/haematol.2015.138081.
19. Maric I, Pittaluga S, Dale JK et al. Histologic features of sinus histiocytosis with massive lymphadenopathy in patients with autoimmune lymphoproliferative syndrome. Am J Surg Pathol 2005; 29 (7): 903–911. doi: 10.1097/01.pas.0000157997.61177.08.
20. Matson DR, Yang DT. Autoimmune lymphoproliferative syndrome: an overview. Arch Pathol Lab Med 2020; 144 (2): 245–251. doi: 10.5858/arpa.2018-0190-RS.
21. Ragotte RJ, Dhanrajani A, Pleydell-Pearce J et al. A somatic mutation in KRAS causing pediatric Rosai-Dorfman syndrome and systemic lupus erythematosus. Clin Immunol 2017; 175 : 143–146. doi: 10.1016/j.clim.2016.12. 006.
22. Lopetegui-Lia N, Asad SD, Jafri SI et al. Autoimmune diseases and Rosai-Dorfman disease coexist more commonly than expected: two case reports. Am J Case Rep 2019; 20 : 770–772. doi: 10.12659/AJCR.915627.
23. Meindl A, Rao MS, Yang GY. Extranodal Rosai-Dorfman disease with mucosal involvement of the stomach in a background of autoimmune atrophic gastritis. Int J Surg Pathol 2018; 26 (7): 671–675. doi: 10.1177/ 1066896918773399.
24. Ambati S, Chamyan G, Restrepo R et al. Rosai-Dorfman disease following bone marrow transplantation for pre-B cell acute lymphoblastic leukemia. Pediatr Blood Cancer 2008; 51 (3): 433–435. doi: 10.1002/pbc.21 606.
25. Hassani J, Porubsky C, Berman C et al. Intraperitoneal Rosai-Dorfman disease associated with clear cell sarcoma: first case report. Pathology 2016; 48 (7): 742–744. doi: 10.1016/j.pathol.2016.07.015.
26. Garces S, Yin CC, Patel KP et al. Focal Rosai-Dorfman disease coexisting with lymphoma in the same anatomic site: a localized histiocytic proliferation associated with MAPK/ERK pathway activation. Mod Pathol 2019; 32 (1): 16–26. doi: 10.1038/s41379-018-0152-1.
27. Garg KK, Singh H. Sinus histiocytosis with massive lymphadenopathy (Rosai-Dorfman disease) and anaplastic large cell lymphoma. Eur J Case Rep Intern Med 2017; 4 (5): 000605. doi: 10.12890/2017_000605.
28. Bezerra Lima L, Alves Sobreira-Neto M, Braga-Neto P et al. Isolated central nervous system Rosai-Dorfman disease and breast cancer: an unusual presentation. Int J Neurosci 2019; 129 (4): 393–396. doi: 10.1080/ 00207454.2018.1533823.
29. Menon MP, Evbuomwan MO, Rosai J et al. A subset of Rosai-Dorfman disease cases show increased IgG4-positive plasma cells: another red herring or a true association with IgG4-related disease? Histopathology 2014; 64 (3): 455–459. doi: 10.1111/his.12274.
30. Liu L, Perry AM, Cao W et al. Relationship between Rosai-Dorfman disease and IgG4-related disease: study of 32 cases. Am J Clin Pathol 2013; 140 (3): 395–402. doi: 10.1309/AJCPFH0SJ6YILXJU.
31. Emile JF, Vaglio A, Cohen-Aubart F et al. IgG4-related disease and Rosai-Dorfman-Destombes disease – authors‘ reply. Lancet 2021; 398 (10307): 1214–1215. doi: 10.1016/S0140-6736 (21) 01811-0.
32. Hasegawa M, Sakai F, Okabayashi A et al. Rosai-Dorfman disease of the lung overlapping with IgG4-related disease: the difficulty in is differential diagnosis. Intern Med 2017; 56 (8): 937–941. doi: 10.2169/internalmedicine.56.7609.
33. Hoffmann JC, Lin CY, Bhattacharyya S et al. Rosai-Dorfman disease of the breast with variable IgG4+ plasma cells: a diagnostic mimicker of other malignant and reactive entities. Am J Surg Pathol 2019; 43 (12): 1653–1660. doi: 10.1097/PAS.0000000000001347.
34. Iyengar NS, Golub D, McQuinn MW et al. Orbital Rosai-Dorfman disease initially diagnosed as IgG4-related disease: a case report. Acta Neuropathol Commun 2020; 8 (1): 113. doi: 10.1186/s40478-020-00995-6.
35. Kurahashi S, Toda N, Fujita M et al. Acute tubulointerstitial nephritis in Rosai-Dorfman disease mimicking IgG4-related disease. Intern Med 2022; 61 (7): 1027–1032. doi: 10.2169/internalmedicine.8046-21.
Kompletní seznam lietratury naleznete v online verzi článku na www.linkos.cz
Labels
Paediatric clinical oncology Surgery Clinical oncology
Article was published inClinical Oncology

2022 Issue 4-
All articles in this issue
- Onkologická léčba 21. století a Kaplan-Meierovy křivky
- Rosai-Dorfman-Destombesova choroba – histiocytární onemocnění se zánětlivými projevy
- Pacienti s karcinomy prezentujícími genovou fúzi neuregulinu 1 (NRG1) jsou kandidáty na teranostický přístup k výběru cílené léčby
- Olanzapin v onkologické paliativní péči
- Imunoterapia nádorových ochorení
- Jak únava ovlivňuje návrat do práce u pacientek s karcinomem prsu
- Informace z České onkologické společnosti
- Pozvolný vzestup bilirubinu v průběhu léčby mnohočetného myelomu lenalidomidem, bortezomibem a dexametazonem (demaskování dříve nediagnostikovaného Gilbertova syndromu) a vymizení nekrobiotického xantogranulomu po dosažení kompletní remise myelomu
- Regulační síť kompetitivně interagujících RNA a účinnost radioterapie u nádorů rekta
- Současné podávání cisplatiny jednou týdně a radioterapie s modulovanou intenzitou svazku s využitím simultánního integrovaného boostu při léčbě pokročilého skvamocelulárního karcinomu hlavy a krku
- Mikrovlnná ablace solitární jaterní metastázy kolorektálního karcinomu komplikované perforací žaludku a gastrokutánní píštělí – kazuistika
- Clinical Oncology
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Olanzapin v onkologické paliativní péči
- Imunoterapia nádorových ochorení
- Rosai-Dorfman-Destombesova choroba – histiocytární onemocnění se zánětlivými projevy
- Jak únava ovlivňuje návrat do práce u pacientek s karcinomem prsu
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

