-
Medical journals
- Career
Nemalobuněčný karcinom plic – od imunobiologie k imunoterapii
Authors: O. Bílek 1,2; L. Bohovicová 1; R. Demlová 2,3; A. Poprach 1; R. Lakomý 1; L. Zdražilová-Dubská 2,4
Authors‘ workplace: Klinika komplexní onkologické péče, Masarykův onkologický ústav, Brno 1; Regionální centrum aplikované molekulární onkologie, Masarykův onkologický ústav, Brno 2; Oddělení klinických hodnocení, Masarykův onkologický ústav, Brno 3; Oddělení laboratorní medicíny, Masarykův onkologický ústav, Brno 4
Published in: Klin Onkol 2016; 29(Supplementum 4): 78-87
Category: Review
doi: https://doi.org/10.14735/amko20164S78Overview
Východiska:
Základem léčby časných nebo lokálně pokročilých stadií nemalobuněčného karcinomu plic (non-small cell lung cancer – NSCLC) je chirurgická resekce, event. radioterapie. V případě inoperabilního či metastatického postižení je léčba paliativní systémová. Celosvětově představuje NSCLC nejčastější příčinu úmrtí v souvislosti s nádorovým onemocněním a dlouhodobě vyvstává potřeba nových terapeutických přístupů. Důkazy o úloze protinádorové aktivity imunitního systému vyvolaly v posledních letech nový zájem o imunoterapii, a to i v léčbě NSCLC. Předmětem vývoje a klinického hodnocení jsou různé strategie vakcinace s cílem posílení imunitní odpovědi a antigen-nespecifická imunomodulace. V této oblasti se dostávají do klinické praxe tzv. checkpoint inhibitory blokující inhibiční imunologické synapse jak cytotoxického T lymfocytárního antigenu 4 (CTLA-4) či proteinu programované buněčné smrti a jeho ligandu (PD-1, PD-L1). Mimo vývoj inovativních léčiv je významným cílem v oblasti imunoterapie solidních malignit identifikace a klinická aplikace efektivních biomarkerů odpovědi na protinádorovou imunoterapii a hodnocení přínosu kombinace imunoterapie s klasickými léčebnými metodami jako chemoterapie, radioterapie a s cílenou léčbou.Cíl:
Cílem tohoto sdělení je 1. popsat základní imunobiologii NSCLC v kontextu inovativních imunomodulačních terapeutik, 2. popsat strategii a shrnout terapeutické výsledky protinádorových vakcín u NSCLC z klinických hodnocení fáze III, 3. shrnout výsledky terapie checkpoint inhibitory u NSCLC a 4. nastínit aktuální výzvy v oblasti imunoterapie NSCLC.Klíčová slova:
nemalobuněčný karcinom plic – imunoterapie – protinádorové vakcíny – biomarkery léčebné odpovědiÚvod
Incidence karcinomu plic v ČR je 38/ /100 000 žen a 87/100 000 mužů. Celosvětově představuje nejčastější příčinu úmrtí v souvislosti s nádorovým onemocněním. Základem léčby nemalobuněčného karcinomu (non-small cell lung cancer – NSCLC) stadia I a II je resekční výkon, event. radioterapie, není-li operace indikována. Stadium IIIA je rovněž považováno za operabilní, ale s výrazně horší prognózou nepřesahující 15% 5leté přežití, zvláště při N2 postižení. Adjuvantní chemoterapie je indikována u stadia II a III, přínos u stadia IB zůstává sporný, u stadia IA není žádný. Adjuvantní radioterapie má přínos jen u stadia III s uzlinovým postižením N2. Léčba metastatického bronchogenního karcinomu je paliativní systémová. Analytické možnosti posledních let přinesly zásadní informace o biologii a patofyziologii NSCLC, které svědčí o tom, že molekulární podstata této diagnózy je heterogenní a na základě přítomnosti kauzálních onkogenních mutací/aberací se rozpadá do několika molekulárně definovaných podjednotek [1]. Jednotlivé kauzální aberace se pak stávají cílem protinádorové terapie (tab. 1) [2–34]. V závislosti na přítomnosti aktivačních mutací EGFR či translokace EML4-ALK je volena cílená léčba kinázovým inhibitorem nebo chemoterapií.
Table 1. Nejčastější dosud známé aberace u NSCLC jako cíle stávající a potencionální protinádorové terapie. 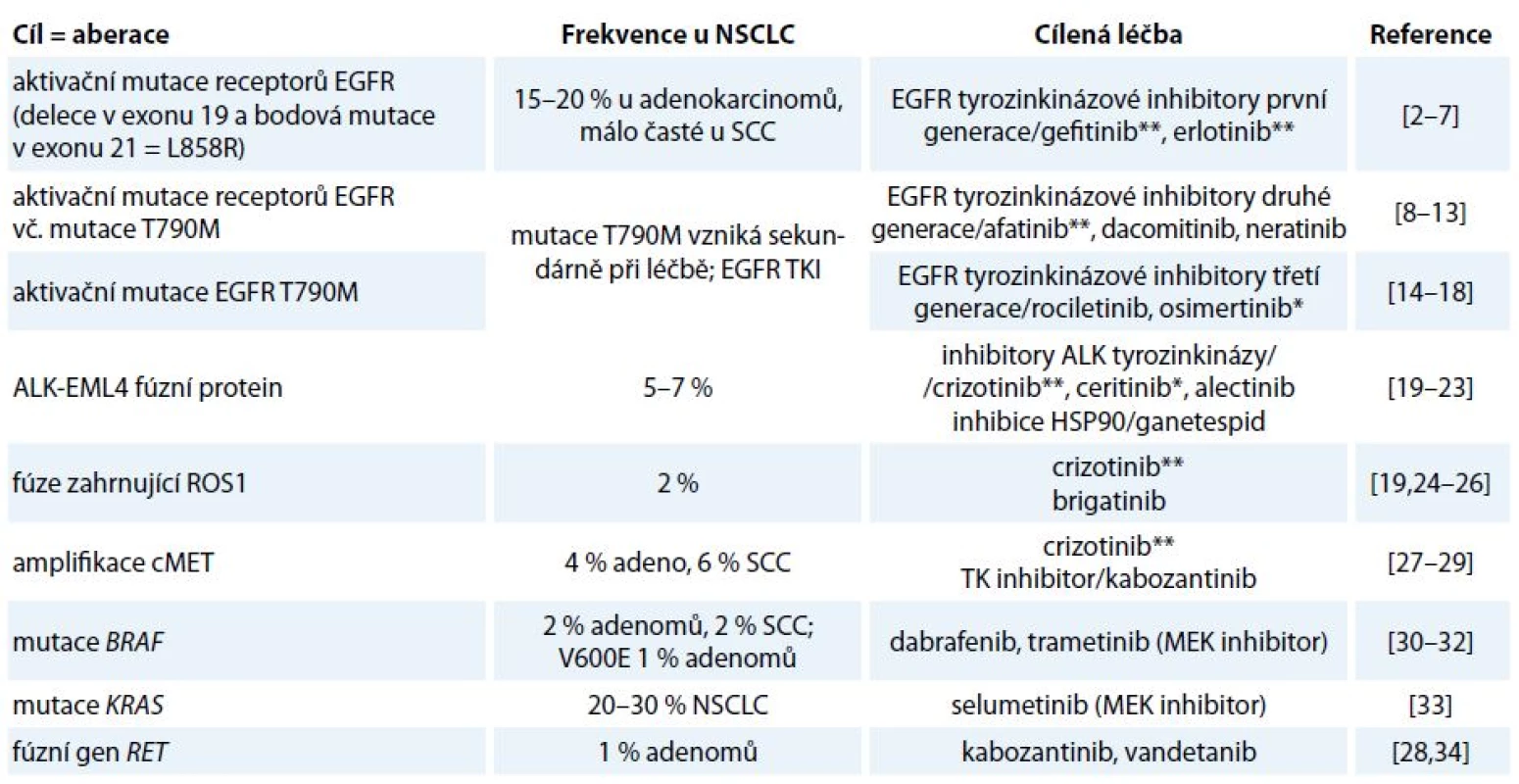
* V současnosti je registrováno pro léčbu NSCLC v rámci EU. ** V současnosti je registrováno pro léčbu NSCLC v rámci EU a současně hrazeno ze zdravotního pojištění v rámci ČR. Imunobiologie NSCLC
Počátky hypotézy předpokládající schop - nost imunitního systému eliminovat či kontrolovat maligní buňky se datují na přelom 19. a 20. století [35–38]. Existuje řada nástrojů imunitního systému, které mohou atakovat maligní buňky; příkladem je generace efektorových T lymfocytů namířených proti nádorovým antigenům (obr. 1) či cytolytická aktivita NK buněk. Na druhou stranu existuje řada imunosupresivních mechanizmů, jimiž může disponovat maligní buňka či spíše nádorové mikroprostředí a které odvrací protinádorovou aktivitu imunitních buněk. Koncept imunitního dohledu nad nádorovým bujením je v dnešní době rozpracován do konceptu nádorové imunoeditace (cancer immunoediting) popisujícího vzájemnou interakci nádorových buněk a imunitního systému. Imunoeditace spočívá ve vývoji protinádorových mechanizmů imunitního systému, ale také prvků úniku nádorových buněk imunitnímu dohledu. Během imunoeditingu se tedy selektují klony nádorových buněk s nižší imunogenicitou nebo s antigenním spektrem, proti němuž nebyla namířena imunitní reakce. Vzájemná interakce nádorových buněk a imunitního systému může být rozdělena do tří fází (3Es), z anglického elimination, equilibrium, escape. Fáze eliminace je charakterizována převahou imunitního dohledu, tedy protinádorovými mechanizmy imunitního systému, které vedou k eliminaci tumoru či efektivní kontrole jeho růstu. V rovnovážné fázi nádorové imunoeditace udržuje imunitní systém maligní tkáň z klinického hlediska v klidovém stadiu (dormancy). Nicméně v nádorové tkáni dochází ke genetickým a epigenetickým změnám a díky konstantnímu selekčnímu tlaku imunitního systému dále progredují klony buněk málo imunogenních, rezistentních k imunitní odpovědi a navozujících imunosupresi, což představuje nádorovou imunoeditaci v pravém slova smyslu. Jako únik/escape se označuje stav, kdy mechanizmy rezistence a navození imunosuprese nádorovými buňkami převládnou, vzniká imunosupresivní nádorové mikroprostředí, dochází k růstu nádoru a ten se začíná klinicky manifestovat. Ke vzniku imunosupresivního nádorového mikroprostředí přispívá celková imunosuprese jedince. Mezi konkrétní imunosupresivní mechanizmy nádoru patří exprese PD-L1 na membránách maligních buněk či antigen-prezentujících buněk (APC) navozující supresi efektorových T lymfocytů. K dalším mechanizmům rozvoje imunologické tolerance patří snížená exprese antigenů, MHC (major histocompability complex) I. třídy a kostimulačních molekul na povrchu nádorových buněk, sekrece cytokinů jako např. TGF-β, která interferuje s vyzráváním dendritických buněk a zvyšuje podíl myeloidních supresorových buněk (myeloid-derived suppresor cells – MDSC) a regulačních T lymfocytů (Tregs) v nádorovém stromatu (obr. 2). Konečně může být příčinou imunologické rezistence odolnost nádorových buněk vůči navození apoptózy CD8 lymfocyty.
Image 1. Základní mechanizmus antigen-dependentní stimulace T lymfocytů. Na počátku buněčné (i protilátkové) imunitní odpovědi je internalizace antigenu dendritickou případně jinou antigen-prezentující buňkou (APC), následný rozklad antigenu na malé peptidy a prezentace na povrchu buňky v kontextu proteinů hlavního histokompatibilního komplexu (MHC) I. a II. třídy. Dendritické buňky s antigenním peptidem cirkulují do lymfatických uzlin, po zrání umožní aktivaci naivních T lymfocytů na pomocné (Th1, Th2) CD4+ kostimulační reakcí mezi receptory B7.1 (CD80) a B7.2 (CD86) přítomnými na APC a receptorem CD28 přítomným na Th buňkách. Prezentaci antigenu dendritickou buňkou potencuje signalizace z TLR receptorů pro PAMP molekuly, což vede v dendritické buňce k signalizaci stimulující expresi MHC II i kostimulačních molekul CD80/CD86. Signalizace mezi dendritickou buňkou a T lymfocytech je modulována řadou inhibičních a aktivačních signálů. Mezi aktivační signály dendritických buněk patří mimo CD80/CD86 také OX40L či CD70, jež vazbou na příslušné molekuly na T lymfocytech potencují jejich aktivaci, proliferaci a získání efektorových funkcí. Cross-prezentace antigenů dendritickou buňkou je potencována tzv. licencování (licensing) CD4+ Th lymfocytů se stejnou antigenní specificitou. V procesu licencování se uplatňuje např. signalizace z CD40 po interakci s CD40L Th lymfocytů, která vede k up-regulaci kostimulačních molekul na dendritické buňky a toto potažmo k aktivaci efektorovývh CD8+ cytotoxických T lymfocytů. Sekrece cytokinů jako IL-2 (Th1 lymfocyty), IL-12 (dendritické buňky), IFN-γ (Th1 lymfocyty) usnadňuje aktivaci CD8+ lymfocytů na cytotoxické T lymfocyty, které získávají a) schopnost rozpoznat nádorové buňky, prostřednictvím komplexu peptid – MHC I a b) efektorové funkce k indukci buněčné smrti maligních buněk. Proteiny z usmrcených maligních buněk jsou opět pohlceny APC buňkami, což navozuje antigen-dependentní stimulaci T lymfocytů. 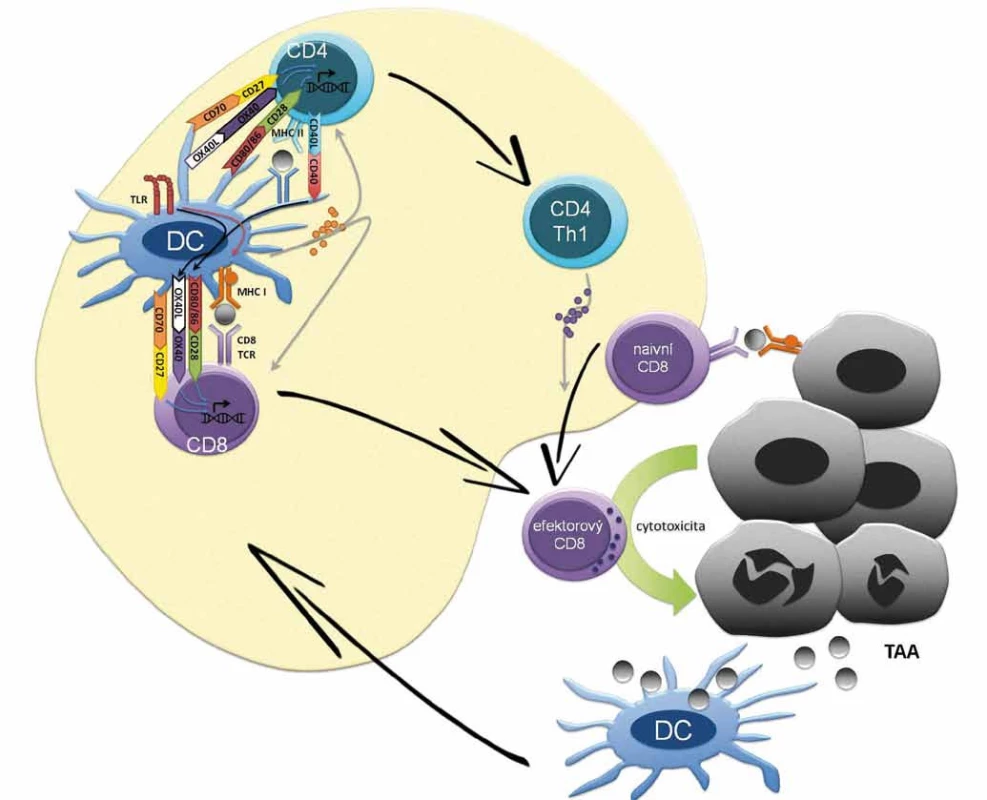
TAA – antigen asociovaný s nádorem, TLR – toll-like receptor, DC – dendritická buňka Image 2. Imunomodulační mechanizmy checkpoint inhibitorů v sekundárních lymfatických orgánech a nádorovém mikroprostředí. CTLA-4 (CD152) je exprimována na T lymfocytech a slouží k supresi imunitní reakce. CTLA-4 kompetuje s aktivační molekulou CD28 o vazbu s kostimulačním komplexem dendritických buněk CD80/CD86. Vazba CTLA-4 a CD80/CD86 vede k navození tolerogenní/imunosupresivní signalizace v dendritických buňkách vedoucí k produkci imunosupresivních působků např. TGF-β či IDO. Terapeutické protilátky interferující s vazbou CTLA-4 a CD80/CD86 jsou ipilimumab a tremelimumab. Imunosupresivní systém PD-1/PD-L1 se uplatňuje v potlačení funkce efektorových T lymfocytů v místě zánětu [52]. Povrchová molekula PD-1 (CD279) je exptrimována T, B lymfocyty, NK buňkami, dendritickými buňkami, monocyty. Vazba PD-L1 (CD274) či PD-L2 (CD275) na PD-1 vede ke snížení produkce cytokinů a proliferace a navození apoptózy PD-1+ buněk. PD-L1 je exprimován řadou buněk vč. maligních buněk, fibroblastů asociovaných s nádorem, T regulačních lymfocytů, myeloidních supresorových buněk MDSC či M2 s nádorem asociovaných makrofágů. Terapeuticky se využívá blokace PD-1/PD-L1 vazby, jak prostřednictvím anti-PD-1 mAb (nivolumab, pembrolizumab) tak anti-PD-L1 protilátek (avelumab, atezolizumab, durvalumab). CD27 je stimulační molekula na povrchu T lymfocytů, jejíž interakce s CD70 APC přispívá k antigen-dependentní klonální expanzi a získání efektorových funkcí T lymfocytů. Předmětem klinického hodnocení aktuálně časných fázi je agonista CD27 varlilumab. Signální molekula OX-40 je exprimována na efektorových T lymfocytech. Interakce OX-40 a OX-40L exprimovaného zralými dendritickými buňkami vede k signalizaci důležité pro přežití efektorových T lymfocytů a tvorbu a reaktiveci paměťových T lymfocytů. Na stimulaci OX-40 cílí agonistická protilátka anti-OX-40 či fúzní protein imunoglobulinu a OX-40L; v současnosti v klinických hodnoceních časných fází. CD40 je exprimován na APC a na řadě buněk mimo imunitní systém vč. maligních buněk. Aktivace CD40 stimuluje antigen-prezentační schopnosti dendritických buněk např. prostřednictví upregulace ko-stimulačních molekul CD80/CD86 poskytujících 2. signál pro aktivaci T lymfocytů. Mimo to anti-CD40 agonistické protilátky potencují protinádorvou aktivitu makrofágů a navozují ADCC maligních buněk exprimujících CD40 (popsáno především u hematoonkologických malignit). Předmětem klinického hodnocení jsou agonistické anti-CD40 protilátky a rekombinantní CD-40L. ![Imunomodulační mechanizmy checkpoint inhibitorů v sekundárních lymfatických orgánech a nádorovém mikroprostředí.
CTLA-4 (CD152) je exprimována na T lymfocytech a slouží k supresi imunitní reakce. CTLA-4 kompetuje s aktivační molekulou CD28 o vazbu s kostimulačním komplexem dendritických buněk CD80/CD86. Vazba CTLA-4 a CD80/CD86 vede k navození tolerogenní/imunosupresivní signalizace v dendritických buňkách vedoucí k produkci imunosupresivních působků např. TGF-β či IDO. Terapeutické protilátky interferující s vazbou CTLA-4 a CD80/CD86 jsou ipilimumab a tremelimumab. Imunosupresivní systém PD-1/PD-L1 se uplatňuje v potlačení funkce efektorových T lymfocytů v místě zánětu [52]. Povrchová molekula PD-1 (CD279) je exptrimována T, B lymfocyty, NK buňkami, dendritickými buňkami, monocyty. Vazba PD-L1 (CD274) či PD-L2 (CD275) na PD-1 vede ke snížení produkce cytokinů a proliferace a navození apoptózy PD-1<sup>+</sup> buněk. PD-L1 je exprimován řadou buněk vč. maligních buněk, fibroblastů asociovaných s nádorem, T regulačních lymfocytů, myeloidních supresorových buněk MDSC či M2 s nádorem asociovaných makrofágů. Terapeuticky se využívá blokace PD-1/PD-L1 vazby, jak prostřednictvím anti-PD-1 mAb (nivolumab, pembrolizumab) tak anti-PD-L1 protilátek (avelumab, atezolizumab, durvalumab). CD27 je stimulační molekula na povrchu T lymfocytů, jejíž interakce s CD70 APC přispívá k antigen-dependentní klonální expanzi a získání efektorových funkcí T lymfocytů. Předmětem klinického hodnocení aktuálně časných fázi je agonista CD27 varlilumab. Signální molekula OX-40 je exprimována na efektorových T lymfocytech. Interakce OX-40 a OX-40L exprimovaného zralými dendritickými buňkami vede k signalizaci důležité pro přežití efektorových T lymfocytů a tvorbu a reaktiveci paměťových T lymfocytů. Na stimulaci OX-40 cílí agonistická protilátka anti-OX-40 či fúzní protein imunoglobulinu a OX-40L; v současnosti v klinických hodnoceních časných fází. CD40 je exprimován na APC a na řadě buněk mimo imunitní systém vč. maligních buněk. Aktivace CD40 stimuluje antigen-prezentační schopnosti dendritických buněk např. prostřednictví upregulace ko-stimulačních molekul CD80/CD86 poskytujících 2. signál pro aktivaci T lymfocytů. Mimo to anti-CD40 agonistické protilátky potencují protinádorvou aktivitu makrofágů a navozují ADCC maligních buněk exprimujících CD40 (popsáno především u hematoonkologických malignit). Předmětem klinického hodnocení jsou agonistické anti-CD40 protilátky a rekombinantní CD-40L.](https://www.prolekare.cz/media/cache/resolve/media_object_image_small/media/image/d83a94013d54c522f8ff73be6f440941.jpg)
Treg – regulační T lymfocyt, CAF – fibroblast asociovaný s malignitou, MDSC – myeloidní supresorová buňka, M2 – M2 polarizovaný makrofág Pro rozeznání maligní buňky a efektivní protinádorou odpověď imunitního systému jsou zásadní nádorové neoantigeny, jež jsou produkty translace mutovaných genů, intronových sekvencí, translace z alternativních čtecích rámců, pseudogenů, antisense řetězců, translokovaných genů či genů se začleněným virovým genomem. Množství nádorových antigenů/neoantigenů, které nádorová buňka produkuje, souvisí s množstvím somatických mutací dané buňky a nádory s vysokým podílem somatických mutací jsou více imunogenní v porovnání s nádory s malým množstvím mutací. Obecně nacházíme nejvíce somatických mutací v nádorech, které jsou spojené s fyzikálně, chemicky či biologicky indukovanou kancerogenezí – tj. v maligním melanomu, skvamobuněčném karcinomu plic, bronchogenním adenokarcinomu, karcinomu močového měchýře a malobuněčném karcinomu plic [39]; díky mutagenně podmíněné karcinogenezi jsou tyto typy malignit nejvíce imunodependentní a imunoresponzivní. Z pohledu jednotlivých případů NSCLC je vysoká proporce nádorových neoantigenů spojena s delším celkovým přežitím (overall survival – OS) a naopak heterogenita nádoru ve smyslu přítomnosti více subklonů se specifickým neoantigenním repertoárem je spojena s horším OS [40]. Popsaný mechanizmus pravděpodobně souvisí s klinickým pozorováním lepší léčebné odpovědi na terapii checkpoint inhibice PD-1/PD-L1 u kuřáků s NSCLC oproti nekuřákům s NSCLC [41].
Imunoterapie NSCLC
Z hlediska přístupu je možné obecně rozdělit imunoterapeutické postupy na pasivní a aktivní a dále na antigen-specifické či nespecifické a výsledkem jsou pak čtyři základní subkategorie imunoterapie, do kterých spadá: 1. aktivní nespecifická imunoterapie humorálními působky, která v případě léčby NSCLC cytokiny IL-2 či IFN-α nepřinesla úspěch [42]; 2. pasivní imunoterapie aplikací monoklonálních protilátek cílených proti tumorem-asociovaným antigenům s cílem vyvolání protilátkami indukované cytotoxicity (antibody-dependent cellular cytotoxicity – ADCC). Příkladem tohoto typu protinádorové terapie je herceptin (anti-Her2) či cetuximab (anti-EGFR). Nicméně pro léčbu NSCLC není aktuálně žádný přípravek pasivní imunoterapie registrován; 3. protinádorová vakcinace stimulující protinádorovou imunitní odpověď CD8+ cytotoxických lymfocytů a CD4+ Th lymfocytů proti nádorovým antigenům a tvorbu antigen specifických protilátek. Některé z těchto přístupů jsou ve vývoji a ty, které byly předmětem klinického hodnocení fáze III, jsou popsány v následující podkapitole; 4. modulace imunitního systému bez antigenní specificity, např. stimulace efektorových funkcí T lymfocytů imunomodulačními monoklonálními protilátkami (tzv. checkpoint inhibitory), které jsou v současné době největším předmětem zájmu v oblasti imunoterapie nádorů plic.
Terapeutické protinádorové vakcíny
Jako zdroj antigenů, proti němuž se vyvolá protinádorová imunitní odpověď, mohou sloužit imortalizované nádorové buňky, lyzáty z nádorových buněk, definované nádorové peptidy, které jsou spolu s adjuvans aplikovány onkologickým pacientům. Jako adjuvans jsou používány mikrobiální látky, např. inkompletní Freundovo adjuvans, CpG, cytokiny, jako je GM-CSF, IL-2, IL-12, IFN-α či fosfolipidy a sloučeniny hliníku. Nádorové antigeny mohou být aplikovány přímo či spolu s vektorem, který může zároveň poskytovat imunostimulační kontext. Příkladem jsou virové vektory či dendritické buňky. Mechanizmus účinku protinádorových vakcín předpokládá, že aplikace nádorových antigenů spolu s adjuvans spustí přirozenou imunitní odpověď, tedy správnou prezentaci antigenů prostřednictvím APC efektorovým T lymfocytům, což způsobí cytolýzu nádorových buněk v primárním ložisku i v metastázách. Vývoj protinádorových vakcín je technologicky náročný a nákladný a následně je pak v klinických hodnoceních zpravidla limitovaný počet pacientů, což prakticky znemožňuje identifikaci prediktivních faktorů a subkohort jedinců, kteří by z léčby protinádorovými vakcínami benefitovali. Nicméně některá léčiva typu protinádorových vakcín se dostala do fáze III klinického zkoušení léčby NSCLC.
Tecemotide (L-BLP25)
L-BLP25 je lipozomální vakcína proti antigenu MUC1 exprimovanému u většiny nádorů vč. NSCLC a jeho vysoká exprese je spojena s horší prognózou [43]. Vakcína byla zkoušena ve studii START v léčbě pacientů s neresekabilním NSCLC v klinickém stadiu III po léčbě chemoterapií a radioterapií. U celkového souboru pacientů nebylo dosaženo primárního cíle prodloužení OS. U subpopulace pacientů, kteří absolvovali léčbu v konkomitantní podobě a nikoli sekvenčně, však došlo k signifikantnímu prodloužení mediánu OS (30,8 vs. 20,6 měsíce; HR 0,78; p = 0,016). Analýza nežádoucích účinků nezaznamenala klinicky významné rozdíly mezi léčebnými rameny [44]. Na základě výsledků klinického hodnocení fáze III, které probíhalo v Japonsku (EMR 63325-021) a které neprokázalo efektivitu L-BLP25, byly další zkoušky a vývoj preparátu zastaveny ve prospěch checkpoint inhibitorů.
TG4010 (MVA-MUC1-IL2)
Další vakcínou zaměřenou proti antigenu MUC1 je TG4010. Jejím základem je atenuovaný virový vektor exprimující sekvenci MUC1 a IL-2 [45]. V randomizované studii fáze IIb/III zahrnující 222 dříve neléčených pacientů klinického stadia IIIB/IV byl hodnocen efekt přidání vakcíny k paliativní chemoterapii 1. linie v režimu cisplatina/gemcitabin. V rameni s TG4010 došlo k signifikantnímu prodloužení doby přežití bez progrese (progression-free survival – PFS) (5,9 vs. 5,1 měsíce; HR 0,74; p = 0,019). V mediánu OS však nebylo dosaženo významného rozdílu. Léčba nebyla spojena se závažnými nežádoucími účinky [46].
Melanom asociovaný antigen (MAGE-A3)
MAGE-A3 patří do rodiny tumorspecifických antigenů a je exprimován výlučně nádorovými buňkami. Pozitivita je uváděna v 35–55 % případů NSCLC [47]. Hodnocený imunoterapeutický přípravek využívající imunogenicity tohoto antigenu obsahoval rekombinantní protein MAGE-A3 a komplexní adjuvans AS15. Rozsáhlá studie MARGIT (NCT00480025) neprokázala významné prodloužení PFS proti placebu v adjuvantním podání pacientům klinického stadia IB–III (60,5 vs. 57,9 měsíce; HR 0,970; p = 0,7572). Tolerance léčby byla dobrá, závažné nežádoucí účinky stupně 3, 4 nebyly zaznamenány [48]. Vzhledem k tomu, že adjuvantní podání této vakcíny nevedlo k prodloužení celkového bezpříznakového přežití (disease--free survival – DFS) v porovnání se standardním chemoterapeutickým režimem v adjuvanci, není tato vakcína dále vyvíjena.
Rekombinantní lidský epidermální růstový faktor (CimaVax-EGF)
Antigenně specifická vakcína je tvořená rekombinantním EGF fúzovaným s nosným proteinem a adjuvans. Mechanizmem účinku je tvorba anti-EGF protilátek a tím navození blokace signální dráhy z receptorů EGFR na maligních buňkách. Ve studii fáze III bylo léčeno a sledováno 405 pacientů s NSCLC stadia IIIB/IV pro stanovení benefit maintenence podání CimaVax-EGF po absolvování 1. linie paliativní chemoterapie proti nejlepší podpůrné léčbě. Studie prokázala signifikantní prodloužení mediánu OS oproti nejlepší podpůrné léčbě (12,43 vs. 9,43 měsíce; HR 0,77; p = 0,04). Nežádoucí účinky stupně 3 byly hlášeny u 3,6 % pacientů (nejčastěji bolest hlavy, dušnost, eozinofilie), stupně 4 pozorovány nebyly. Vysoké hladiny EGF před zahájením léčby byly prediktorem léčebné odpovědi [49].
Belagenpumatucel-L
Jedná se o celobuněčnou alogenní vakcínu připravovanou transfekcí čtyř různých buněčných linií odvozených od NSCLC antisense TGF-β2 transgenem a ozářením před aplikací. Mechanizmus účinku je navození imunitní odpovědi proti nádorovým antigenům a potlačení imunosupresivní aktivity nádorového mikroprostředí. Vakcína byla testována v rámci maintenance aplikace pacientům v klinickém stadiu IIIB/IV, u kterých nebyla zaznamenána progrese onemocnění po absolvování 1. linie paliativní chemoterapie na bázi platiny (NCT00676507). V celkovém souboru nebylo prokázáno prodloužení mediánu OS (20,3 vs. 17,8 měsíce; HR 0,94; p = 0,594), ani prodloužení PFS. Benefit v mediánu OS byl pouze u pacientů s jinou histologií než adenokarcinom a u těch, kteří absolvovali radioterapii (28,4 vs. 16,0 měsíce; HR 0,61; p = 0,032). Vakcína byla dobře tolerována, závažné nežádoucí účinky nebyly hlášeny [50].
Racotumomab
Racotumomab je protilátková vakcína, jejímž cílovým antigenem jsou N-glycolilneuraminovou kyselinu (NeuGc) obsahující gangliosidy. Tyto gliolipidy nejsou přítomny na cytoplazmatické membráně normálních lidských buněk, byly však zachyceny u některých typů nádorů vč. NSCLC. Racotumomab je myší protilátka proti NeuGc obsahujícím gangliosidům, která vyvolává tvorbu IgG a IgM protilátek proti těmto epitopům. V rámci testování na myších modelech byla zaznamenána schopnost vyvolání vysoké protinádorové odpovědi. Aktuálně probíhá randomizovaná studie fáze III k ověření léčebného efektu u pacientů ve stadiu pokročilého neresekabilního nebo metastatického NSCLC, u kterých byl zaznamenán minimálně efekt stabilizace onemocnění po absolvování 1. linie paliativní léčby [51].
Nespecifická imunoterapie
Hlavním předmětem zájmu vývoje protinádorové imunoterapie jsou antigen-independentní modulátory imunitního systému, jejichž mechanizmus působení je založen na eliminaci imunosupresivních mechanizmů nádoru a/nebo nespecifické stimulaci imunitní odpovědi (obr. 2) [52]. Nejvíce prozkoumaný a popsaný je mechanizmus působení a klinické výsledky inhibice CTLA-4 a interakce PD-1/PD-L1.
Anti-CTLA-4 protilátky
Ipilimumab
Ipilimumab je humanizovaná IgG1 monoklonální protilátka. V současné době je součástí standardní léčby např. maligního melanomu, kde jsou zaznamenány případy dlouhodobých léčebných odpovědí. Efekt je zkoušen i v rámci jiných diagnóz vč. NSCLC. Výsledky studie fáze II srovnávající efekt přidání ipilimumabu k chemoterapii v kombinaci karboplatina/paclitaxel pacientům se skvamózním NSCLC klinického stadia III/IV prokázaly prodloužení PFS ve skupině s ipilimumabem, a to v případě sekvenčního podání chemoterapie a imunoterapie. Prodloužení mediánu OS nebylo statisticky signifikantní (12,2 vs. 8,3 měsíce; HR 0,87; p = 0,23) [53]. V současné době probíhají studie fáze III hodnotící efekt 1. přidání ipilimumabu k chemoterapii u pacientů s pokročilým skvamózním NSCLC (NCT02279732) a 2. hodnotící efekt přidání ipilimumabu do kombinace s anti-PD-1 protilátkou nivolumabem v 1. linii léčby NSCLC (CheckMate 227, NCT02477826).
Četnost vedlejších účinků ipilimumabu se v registrační studii pro léčbu maligního melanomu s dávkou 3 mg/kg pohybuje kolem 80–90 %. Ve většině případů šlo o mírnou až střední toxicitu (stupeň 1, 2). Závažná (stupeň 3) a život ohrožující toxicita (stupeň 4) byla zaznamenána u cca 20–25 % pacientů. K vedlejším účinkům může dojít již v průběhu infuze nebo po ní. Více obávané jsou však imunitně podmíněné vedlejší účinky (immune related adverse events – ir-AE), které jsou nejčastější a rostou s dávkou. Při dávce 3 mg/kg se objevují až u 60 % pacientů, vážná ir-AE toxicita stupně 3 a 4 byla zaznamenána u 10–15 % pacientů. K nejčastějším ir-AEs patří kožní toxicita (vyrážka, svědění kůže), enterokolitida a průjmy, endokrinopatie (hypofyzitida, tyreoiditida) a elevace jaterních testů. Imunitní systém však může napadnout jakýkoliv orgán v těle (srdce, plíce, ledviny, nervový systém, oči, hematopoetický systém a další). Je třeba důsledný management toxicity léčby [54].
Tremelimumab
Tremelimumab je humanizovaná monoklonální protilátka proti CTLA-4. Ve studii fáze II [55] nebyl prokázán efekt maintenance aplikace proti nejlepší podpůrné péči pacientům s metastatickým NSCLC, u kterých nebyla zaznamenána progrese onemocnění po 1. linii paliativní chemoterapie (NCT02000947). Probíhá studie fáze III ověřující přínos kombinace tremelimumabu s anti-PD-L1 protilátkou darvalumab (MEDI4736) vs. standardní chemoterapie (NCT02352948).
Anti-PD-1, anti-PD-L1 protilátky
Nivolumab
Nivolumab je plně humanizovaná monoklonální IgG4 anti-PD-1 protilátka standardně používaná např. v léčbě maligního melanomu (NCT01721772) [56]. Studie fáze III srovnávaly benefit podání nivolumabu pacientům s metastatickým NSCLC ve 2. linii paliativní léčby proti standardní chemoterapii docetaxelem. Studie CheckMate 017 týkající se skvamózního karcinomu plic prokázala statisticky významné prodloužení PFS a zejména mediánu OS (9,2 vs. 6,0 měsíce; HR 0,59; p = 0,0004). Tato studie neprokázala korelaci mezi přítomností PD-L1 na nádorových buňkách a léčebnou odpovědí (NCT01642004). U adenokarcinomu byl rovněž prokázán léčebný benefit nivolumabu studií fáze III CheckMate 057 (NCT01673867), která srovnávala monoterapii nivolumabem v dávce 3 mg/m2 každé dva týdny s podáním docetaxelu 75 mg/m2 jednou za tři týdny. Monoterapie nivolumabem vedla k prodloužení mediánu OS (12,2 vs. 9,4 měsíce; HR 0,73; p = 0,002), rozdíly v PFS nebyly v celém souboru statisticky významné (medián PFS 2,3 vs. 4,2 měsíce; HR 0,92; p = 0393). U této studie však byla zjevná signifikantní závislost mezi procentuálně vyjádřeným zastoupením PD-L1 na buněčné membráně nádorové buňky a mírou buněčné odpovědi. Na základě údajů o možném zlepšení léčebné odpovědi kombinací anti-CTLA-4 a anti-PD-1 protilátek probíhá studie CheckMate 227 hodnotící efekt v 1. linii paliativní léčby NSCLC (NCT02477826).
Toxicita anti-PD-1 a anti-PD-L1 protilátek je obecně menší než u ipilimumabu. Vážná kožní toxicita stupně 3 a 4 se vyskytuje výjimečně (2 %). Také průjem stupně 3 a 4 je málo častý (1–2 %), podobně jako hepatotoxicita (do 3 %) a vážné endokrinopatie (< 1 %). Na rozdíl od ipilimumabu se ale častěji po anti-PD-1 protilátkách objevuje pneumonitida (< 5 %). Podstatně vyšší četnost ir-AEs byla popsána ve studiích s kombinací anti-PD-1 a anti-CTLA-4 protilátkou (nivolumab + ipilimumab). Zde se výskyt vážných ir-AEs stupně 3 a 4 pohyboval kolem 50 %, s významným zastoupením gastrointestinální toxicity (15 %) a hepatotoxicity (19 %) [54,57].
Pembrolizumab
Jedná se opět o anti-PD-1 protilátku, jejíž účinnost u NSCLC byla hodnocena ve studii fáze III Keynote 010 (NCT01905657). Do studie byli zařazováni pacienti po selhání předchozí 1. linie s platinou a současně s prokázanou expresí PD-L1 min. v 1 % nádorových buněk s randomizací do jednoho ze tří léčebných ramen, pembrolizumab 2 mg/kg, 10 mg/kg nebo standardní rameno s docetaxelem 75 mg/m2 každé tři týdny. OS bylo signifikantně delší v obou ramenech s pembrolizumabem (dávka 2 mg/kg medián OS 12,7 vs. 8,5 měsíce; HR 0,71; p = 0,0008, resp. 10 mg/kg HR 0,61; p < 0,0001). Přítomnost PD-L1 ligandu na nádorových buňkách měla významný vliv na míru léčebné odpovědi s dopadem i na prodloužení OS [58]. U pacientů s přítomností PD-L1 vyšší než v 50 % nádorových buněk byl medián OS 14,9 vs. 8,2 měsíce; HR 0,54; p = 0,0002 v dávce 2 mg/kg a 17,3 vs. 8,2 měsíce; HR 0,5; p < 0,0001 při dávkování 10 mg/kg. FDA udělila pro tuto indikaci v říjnu 2015 na základě publikovaných výsledků tzv. accelerated approval, na evropské úrovni EMA je pembrolizumab v procesu posuzování.
Avelumab
Avelumab je anti-PD-L1 protilátka, ovlivňuje tedy nádorovou buňku a nikoli přímo lymfocyt. Aktuálně probíhají studie Javelin Lung 100 (NCT02576574) a Javelin Lung 200 (NCT02395172) fáze III hodnotící efekt u pacientů s metastatickým NSCLC v 1. a 2. linii léčby. V 1. linii léčby je avelumab v dávce 10 mg/kg jednou za dva týdny srovnáván se standardní chemoterapií na bázi platiny, primárním cílem je hodnocení PFS a sekundárně i celkového přežití. Klinická studie Javelin Lung 200 ve 2. linii léčby hodnotí podání avelumabu oproti standardnímu podání docetaxelu v dávce 75 mg/m2 jednou za tři týdny, primárním cílem je hodnocení OS a první výsledky jsou očekávány ke konci roku 2017. U obou studií je současně prospektivně hodnocena přítomnost PD-L1 v nádoru.
Atezolizumab
Jedná se o anti-PD-L1 protilátku zkoušenou u řady onkologických diagnóz. Recentně publikované výsledky studie POPLAR fáze II prokazují prodloužení OS proti docetaxelu v 2. linii paliativní léčby (OS 12,6 vs. 9,7 měsíce; HR 0,73; p = 0,004). Výsledky byly v korelaci s mírou exprese PD-L1 nádorovou buňkou [59]. Obdobné výsledky přinesla i další studie BIRCH fáze II, kde byla pozorována odpověď na léčbu u 27 % pacientů s vyšší expresí PD-L1 [60]. V současnosti probíhají studie fáze III hodnotící přínos atezolizumabu v 1. linii paliativní léčby ve srovnání se standardní chemoterapií (NCT02409342, NCT02409355), zde jsou první výsledky očekávány v roce 2019.
Výzvy v imunoterapii NSCLC
Nádorová imunologie a imunoterapie maligních onemocnění jsou v současné době v popředí zájmu onkologického výzkumu a podstatné místo zaujímají i v klinické praxi. Z hlediska klasifikace a managementu léčby časnějších stadií maligních onemocnění je významným počinem posledních let koncept imunoskóre/immunoscore, který je nejvíce rozpracován a aktuálně validován u kolorektálního karcinomu [61], nicméně je předmětem klinického výzkumu také u jednotlivých stadií NSCLC [62].
Vzhledem k tomu, že imunoterapie současnosti vstupuje především do léčby pokročilých nádorových onemocnění, jejichž charakteristikou je repertoár imunosupresivních vlastností prostředí nádoru, je nadějí pro pacienty s pokročilými onemocněními identifikace opodstatněných kombinací imunoterapie (stávající protilátky, nové protilátky, vakcíny) se standardními léčebnými modalitami (chemoterapie, radioterapie, cílená léčba), kde se jistě uplatní i „drug repositioning“. Kombinací léčebných metod by mohlo být dosaženo komplementárního, či dokonce synergického působení [63]. Je však nutno zvažovat míru toxicity léčby, např. v případě maligního melanomu sice přinesla kombinace dakarbazinu s ipilimumabem (10 mg/kg) prodloužení OS z 9,1 na 11,2 měsíce, ale závažné nežádoucí účinky stupně 3, 4 byly zaznamenány v 56 % [64]. Při hledání konkomitantních a sekvenčních protinádorových postupů je racionální kombinovat imunoterapii především s terapeutickými postupy dosahujícími léčebného efektu nejen na základě cytotoxických účinků, ale vyvolávajícími i tzv. imunogenní buněčnou smrt, kdy dochází ke stimulaci imunitního systému proti antigenům uvolněným z imunogenně likvidované maligní buňky. Imunogenní buněčnou smrt navozují některá chemoterapeutika, termické ablace či radioterapie. Klinicky pozorovatelnou konsekvencí popsaného způsobu buněčné smrti je abskopální efekt radioterapie vedoucí k regresi nádorového onemocnění i mimo ozařované pole a kombinace radioterapie s checkpoint inhibitory by mohla vést k podpoře tohoto efektu [65]. V souvislosti s kombinací imunoterapie s cílenou léčbou je zmiňována např. podpora vyzrávání dendritických buněk či aktivace a diferenciace T lymfocytů, přičemž četné studie již probíhají [66]. V rámci kombinací se testuje i současné podání checkpoint inhibitorů (tab. 2), jejichž relevance pro klinickou praxi je vzhledem k toxicitě a nákladovosti bez znalosti prediktivního biomarkeru limitovaná.
Table 2. Aktuálně probíhající studie fáze III/IV s checkpoint inhibitory u NSCLC. 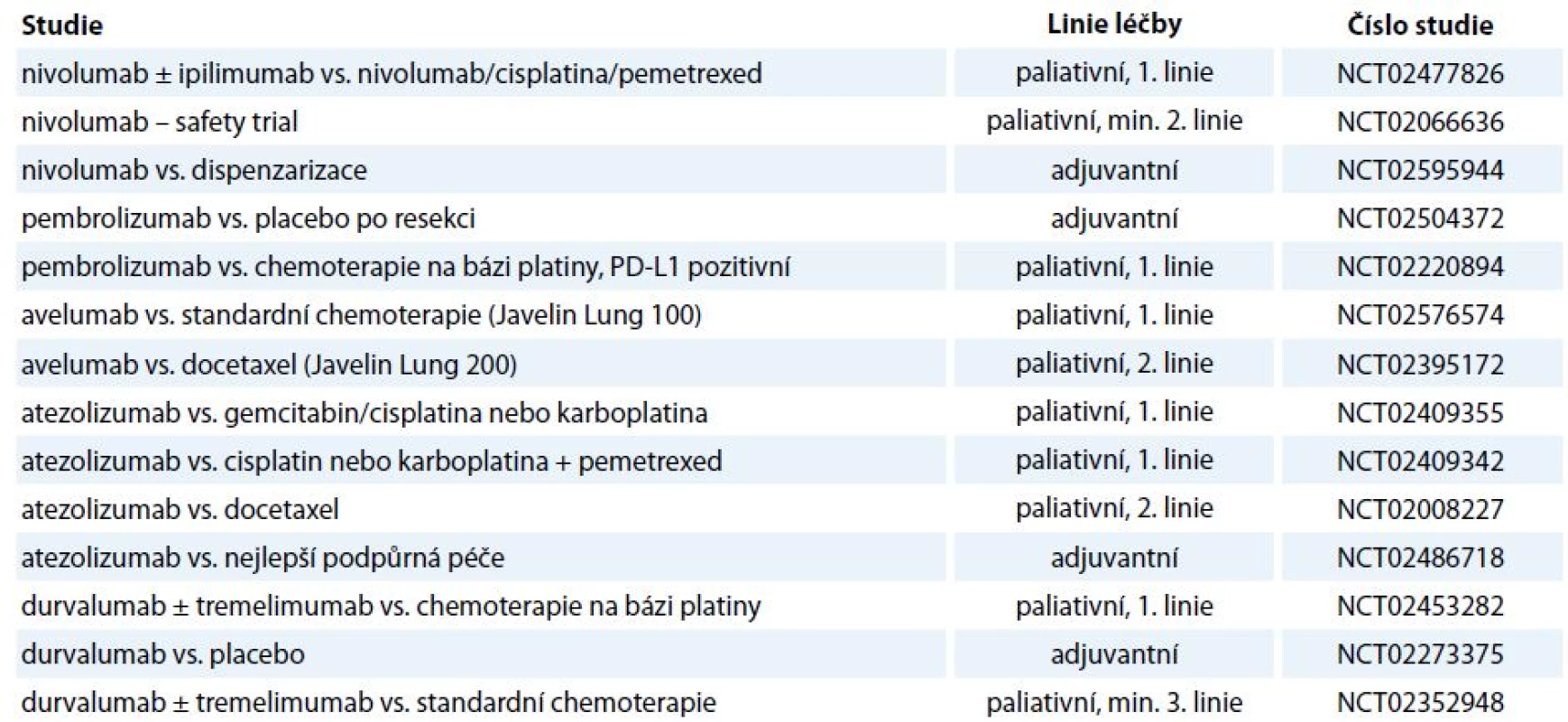
anti-CTLA-4 – ipilimumab, tremelimumab, anti-PD-1 – nivolumab, pembrolizumab, anti-PD-L1 – avelumab, atezolizumab, durvalumab Přestože jsou dosavadní data získaná z klinických hodnocení imunoterapie checkpoint inhibitory povzbudivá ve smyslu dosažení déle trvajících odpovědí u metastatických onemocnění (především u maligního melanomu), je proporce léčených pacientů, u kterých je dosaženo významné dlouhotrvající klinické odpovědi, malá [67]. Podstatnou výzvou je tedy identifikace prediktivních biomarkerů jednotlivých modalit protinádorové imunoterapie. V případě inhibice interakce PD-1/PD-L1 se jako prediktivní biomarker nabízí, v analogii na prediktivní vlastnosti míry exprese Her-2 buňkami karcinomu prsu, kvantifikace míry exprese PD-L1 v maligní tkáni. Ve studiích jako CheckMate 017 hodnotící efekt nivolumabu u skvamózního NSCLC nebyla úloha exprese PD-L1 v maligní tkáni jako prediktoru léčby potvrzena; naopak v případě bronchogenního adenokarcinomu korelovala míra exprese ligandu PD-L1 s mírou léčebného efektu (např. CheckMate 057). Mimo roztříštěnost projektů hodnotících expresi PD-L1 s ohledem na použitý detekční systém (typ diagnostických protilátek, hodnota cut-off, hodnocení exprese na maligních buňkách vs. nádorovém stroma) je podstatným úskalím v ustanovení míry PD-L1 pozitivity jako prediktivního biomarkeru inducibilní exprese tohoto ligandu, jež nemusí být pouze reflexí imunosupresivních vlastností nádorových buněk, ale může být naopak navozena parakrinní stimulací T lymfocytárního infiltrátu [68].
Na příkladu maligního melanomu se ukazuje, že prediktorem léčby checkpoint inhibitory mohou být i cirkulující parametry hodnotitelné z periferní krve, kde jsou významnými biomarkery – mimo hladinu LDH (laktátdehydrogenázy) spojenou s aktivitou onemocnění – také parametry reflektující míru imunosuprese resp. efektorových funkcí imunitního systému, jako je proporce lymfocytů, absolutní počet eozinofilů a monocytů, ale také zastoupení Tregs a MDSC [69,70]. Je racionální předpokládat, že mimo baselinové hladiny parametrů imunitního systému poskytuje určitou informaci o úspěšnosti léčby také dynamika vývoje jednotlivých imunitních parametrů. Tímto způsobem je možné sledovat např. dynamiku efektorových T lymfocytů či jiných leukocytárních subpopulací; při znalosti konkrétního nádorového antigenu (např. v případě peptidových vakcín) je možno sledovat dynamiku T lymfocytární frakce se specificitou k danému antigenu.
Hledání vhodných prediktorů odpovědí na léčbu checkpoint inhibitory je významné nejen z výzkumného hlediska a z hlediska reality klinické praxe s ohledem na optimalizaci efektivity při minimalizaci toxicity léčby, ale rovněž může zásadně přispívat k finanční udržitelnosti těchto terapeutických postupů. Dnes je již více než zřejmé, že pravděpodobně žádný zdravotnický systém, tedy nejen v ČR, nebude schopen absorbovat zvyšující se finanční zátěž spojenou s cílenou protinádorovou terapií vč. nákladné moderní imunoterapie. Pokud je během výzkumu v časných fázích zřejmé, že se bude jednat o inovativní léčivo s významným budoucím finančním dopadem do rozpočtu, a rovněž bude zřejmé, že profitovat z nákladné léčby bude jen určité procento pacientů, je nezbytně nutné, aby klinické studie pozdější fáze III byly designovány již souběžně s vývojem a ověřením diagnostické metody pro stanovení vhodného biomarkeru. Tím by došlo k ideálnímu stavu, kdy případná registrace léčiva bude souběžně doprovázena i „registrací“ diagnostické metody tak, jak je již delší dobu v FDA guidelines [71,72]. Jedním z příkladů takto FDA chválených léčiv s diagnostickým kitem může být olaparib a BRACAnalysis CDxTM nebo crizotinib a VENTANA ALK (D5F3) CDx AssayTM [73]. Přestože nejsou na evropské úrovni zatím tyto validované prediktivní testy při registraci léčiv Evropskou lékovou agenturou vyžadovány, je diskuze na toto téma evropskými regulátory vedena a pravděpodobně se v blízké době stane realitou. Tento způsob regulace inovativních a cílených protinádorových terapeutik patří k těm smysluplnějším a má reálný potenciál povzbudit farmaceutické firmy, aby intenzivněji implementovaly hledání vhodných biomarkerů již během klinického výzkumu nového léčiva, nikoliv až následně retrospektivně při hledání „vhodných podskupin“ pacientů v případě, kdy se neprokáže superiorní efekt hodnoceného léčivého přípravku v celé kohortě testovaných subjektů, případně po registraci léčiva, kdy je identifikace a implementace prediktorů léčby v rozporu s komerčními zájmy držitelů registrací.
Práce byla podpořena grantem MŠMT – NPU I – LO1413.
Autoři deklarují, že v souvislosti s předmětem studie nemají žádné komerční zájmy.
Redakční rada potvrzuje, že rukopis práce splnil ICMJE kritéria pro publikace zasílané do biomedicínských časopisů.
RNDr. Lenka Zdražilová-Dubská, Ph.D.
Regionální centrum aplikované molekulární onkologie
Oddělení laboratorní medicíny
Masarykův onkologický ústav
Žlutý kopec 7
656 53 Brno
e-mail: dubska@mou.cz
Obdrženo: 10. 6. 2016
Přijato: 16. 6. 2016
Sources
1. Chen Z, Fillmore CM, Hammerman PS et al. Non-small - -cell lung cancers: a heterogeneous set of diseases. Nat Rev Cancer 2014; 14 (8): 535–546. doi: 10.1038/nrc3775.
2. Lee DH, Park K, Kim JH et al. Randomized phase III trial of gefitinib versus docetaxel in non-small cell lung cancer patients who have previously received platinum-based chemotherapy. Clin Cancer Res 2010; 16 (4): 1307–1314. doi: 10.1158/1078-0432.CCR-09-1903.
3. Han JY, Park K, Kim SW et al. First-SIGNAL: first-line single-agent iressa versus gemcitabine and cisplatin trial in never-smokers with adenocarcinoma of the lung. J Clin Oncol 2012; 30 (10): 1122–1128. doi: 10.1200/JCO.2011.36.8456.
4. Mitsudomi T, Morita S, Yatabe Y et al. Gefitinib versus cisplatin plus docetaxel in patients with non-small-cell lung cancer harbouring mutations of the epidermal growth factor receptor (WJTOG3405): an open label, randomised phase 3 trial. Lancet Oncol 2010; 11 (2): 121–128. doi: 10.1016/S1470-2045 (09) 70364-X.
5. Mok TS, Wu YL, Thongprasert S et al. Gefitinib or carboplatin-paclitaxel in pulmonary adenocarcinoma. N Engl J Med 2009; 361 (10): 947–957. doi: 10.1056/NEJMoa0810699.
6. Zhou C, Wu YL, Chen G et al. Erlotinib versus chemotherapy as first-line treatment for patients with advanced EGFR mutation-positive non-small-cell lung cancer (OPTIMAL, CTONG-0802): a multicentre, open-label, randomised, phase 3 study. Lancet Oncol 2011; 12 (8): 735–742. doi: 10.1016/S1470-2045 (11) 70184-X.
7. Rosell R, Carcereny E, Gervais R et al. Erlotinib versus standard chemotherapy as first-line treatment for European patients with advanced EGFR mutation-positive non-small-cell lung cancer (EURTAC): a multicentre, open-label, randomised phase 3 trial. Lancet Oncol 2012; 13 (3): 239–246. doi: 10.1016/S1470-2045 (11) 70393-X.
8. Katakami N, Atagi S, Goto K et al. LUX-Lung 4: a phase II trial of afatinib in patients with advanced non-small-cell lung cancer who progressed during prior treatment with erlotinib, gefitinib, or both. J Clin Oncol 2013; 31 (27): 3335–3341. doi: 10.1200/JCO.2012.45.0981.
9. Janjigian YY, Smit EF, Groen HJ et al. Dual inhibition of EGFR with afatinib and cetuximab in kinase inhibitor-resistant EGFR-mutant lung cancer with and without T790M mutations. Cancer Discov 2014; 4 (9): 1036–1045. doi: 10.1158/2159-8290.CD-14-0326.
10. Sequist LV, Besse B, Lynch TJ et al. Neratinib, an irreversible pan-ErbB receptor tyrosine kinase inhibitor: results of a phase II trial in patients with advanced non-small-cell lung cancer. J Clin Oncol 2010; 28 (18): 3076–3083. doi: 10.1200/JCO.2009.27.9414.
11. Oxnard GR, Arcila ME, Sima CS et al. Acquired resistance to EGFR tyrosine kinase inhibitors in EGFR-mutant lung cancer: distinct natural history of patients with tumors harboring the T790M mutation. Clin Cancer Res 2011; 17 (6): 1616–1622. doi: 10.1158/1078-0432.CCR-10-2692.
12. Reckamp KL, Giaccone G, Camidge DR et al. A phase 2 trial of dacomitinib (PF-00299804), an oral, irreversible pan-HER (human epidermal growth factor receptor) inhibitor, in patients with advanced non-small cell lung cancer after failure of prior chemotherapy and erlotinib. Cancer 2014; 120 (8): 1145–1154. doi: 10.1002/cncr.28561.
13. Lee JS, Hirsh V, Park K et al. Vandetanib versus placebo in patients with advanced non-small-cell lung cancer after prior therapy with an epidermal growth factor receptor tyrosine kinase inhibitor: a randomized, double-blind phase III trial (ZEPHYR). J Clin Oncol 2012; 30 (10): 1114–1121. doi: 10.1200/JCO.2011.36.1709.
14. Sequist LV, Soria JC, Camidge DR. Update to rociletinib data with the RECIST confirmed response rate. N Eng J Med 2016; 374 (23): 2296–2297. doi: 10.1056/NEJMc1602688.
15. Sequist LV, Soria JC, Goldman JW et al. Rociletinib in EGFR-mutated non-small-cell lung cancer. N Eng J Med 2015; 372 (18): 1700–1709. doi: 10.1056/NEJMoa1413654.
16. Cross DA, Ashton SE, Ghiorghiu S et al. AZD9291, an irreversible EGFR TKI, overcomes T790M-mediated resistance to EGFR inhibitors in lung cancer. Cancer Discov 2014; 4 (9): 1046–1061. doi: 10.1158/2159-8290.CD-14-0337.
17. Yver A. Osimertinib (AZD9291) -a science-driven, collaborative approach to rapid drug design and development. Ann Oncol 2016; 27 (6): 1165–1170. doi: 10.1093/annonc/mdw129.
18. Janne PA, Yang JC, Kim DW et al. AZD9291 in EGFR inhibitor-resistant non-small-cell lung cancer. N Eng J Med 2015; 372 (18): 1689–1699. doi: 10.1056/NEJMoa1411817.
19. Costa DB, Shaw AT, Ou SH et al. Clinical experience with crizotinib in patients with advanced ALK-rearranged non-small-cell lung cancer and brain metastases. J Clin Oncol 2015; 33 (17): 1881–1888. doi: 10.1200/JCO.2014.59.0539.
20. Ou SH, Janne PA, Bartlett CH et al. Clinical benefit of continuing ALK inhibition with crizotinib beyond initial disease progression in patients with advanced ALK-positive NSCLC. Ann Oncol 2014; 25 (2): 415–422. doi: 10.1093/annonc/mdt572.
21. Gadgeel SM, Gandhi L, Riely GJ et al. Safety and activity of alectinib against systemic disease and brain metastases in patients with crizotinib-resistant ALK-rearranged non-small-cell lung cancer (AF-002JG): results from the dose-finding portion of a phase 1/2 study. Lancet Oncol 2014; 15 (10): 1119–1128. doi: 10.1016/S1470-2045 (14) 70362-6.
22. Li S, Qi X, Huang Y et al. Ceritinib (LDK378): a potent alternative to crizotinib for ALK-rearranged non-small-cell lung cancer. Clin Lung Cancer 2015; 16 (2): 86–91. doi: 10.1016/j.cllc.2014.09.011.
23. Gainor JF, Tan DS, De Pas T et al. Progression-free and overall survival in ALK-positive NSCLC patients treated with sequential crizotinib and ceritinib. Clinical Cancer Res 2015; 21 (12): 2745–2752. doi: 10.1158/1078-0432.CCR-14-3009.
24. Bergethon K, Shaw AT, Ou SH et al. ROS1 rearrangements define a unique molecular class of lung cancers. J Clin Oncol 2012; 30 (8): 863–870. doi: 10.1200/JCO.2011.35.6345.
25. Rosell R, Gettinger SN, Bazhenova LA et al. 1330: Brigatinib efficacy and safety in patients (Pts) with anaplastic lymphoma kinase (ALK) -positive (ALK+) non-small cell lung cancer (NSCLC) in a phase 1/2 trial. J Thorac Oncol 2016; 11 (4 Suppl): S114. doi: 10.1016/S1556-0864 (16) 30245-3.
26. Chin LP, Soo RA, Soong R et al. Targeting ROS1 with anaplastic lymphoma kinase inhibitors: a promising therapeutic strategy for a newly defined molecular subset of non-small-cell lung cancer. J Thorac Oncol 2012; 7 (11): 1625–1630. doi: 10.1097/JTO.0b013e31826baf83.
27. Zou HY, Li Q, Lee JH et al. An orally available small-molecule inhibitor of c-Met, PF-2341066, exhibits cytoreductive antitumor efficacy through antiproliferative and antiangiogenic mechanisms. Cancer Res 2007; 67 (9): 4408–4417.
28. Drilon A, Wang L, Hasanovic A et al. Response to Cabozantinib in patients with RET fusion-positive lung adenocarcinomas. Cancer Discov 2013; 3 (6): 630–635.
29. Padda S, Neal JW, Wakelee HA. MET inhibitors in combination with other therapies in non-small cell lung cancer. Transl Lung Cancer Res 2012; 1 (4): 238–253. doi: 10.3978/j.issn.2218-6751.2012.10.08.
30. Dabrafenib active in rare NSCLC subtype. Cancer Discov 2016; 6 (7). OF4. doi: 10.1158/2159-8290.CD-NB2016-062.
31. Blumenschein GR Jr, Smit EF, Planchard D et al. A randomized phase II study of the MEK1/MEK2 inhibitor trametinib (GSK1120212) compared with docetaxel in KRAS-mutant advanced non-small-cell lung cancer (NSCLC) dagger. Ann Oncol 2015; 26 (5): 894–901. doi: 10.1093/annonc/mdv072.
32. Planchard D, Kim TM, Mazieres J et al. Dabrafenib in patients with BRAF (V600E) -positive advanced non-small - -cell lung cancer: a single-arm, multicentre, open-label, phase 2 trial. Lancet Oncol 2016; 17 (5): 642–650. doi: 10.1016/S1470-2045 (16) 00077-2.
33. Janne PA, Shaw AT, Pereira JR et al. Selumetinib plus docetaxel for KRAS-mutant advanced non-small-cell lung cancer: a randomised, multicentre, placebo-controlled, phase 2 study. Lancet Oncol 2013; 14 (1): 38–47. doi: 10.1016/S1470-2045 (12) 70489-8.
34. Heymach JV, Lockwood SJ, Herbst RS et al. EGFR biomarkers predict benefit from vandetanib in combination with docetaxel in a randomized phase III study of second-line treatment of patients with advanced non-small cell lung cancer. Ann Oncol 2014; 25 (10): 1941–1948. doi: 10.1093/annonc/mdu269.
35. Coley WB. II. Contribution to the Knowledge of Sarcoma. Ann Surg 1891; 14 (3): 199–220.
36. Coley WB. The treatment of malignant tumors by repeated inoculations of erysipelas. With a report of ten original cases. Clin Orthop Relat Res 1893; 1991 (262): 3–11.
37. Ehrlich P. The partial function of cells. (Nobel Prize address given on 11 December 1908 at Stockholm). Int Arch Allergy Appl Immunol 1954; 5 (2): 67–86.
38. Ehrlich P. Address in pathology, on chemiotherapy: delivered before the Seventeenth International Congress of Medicine. Br Med J 1913; 2 (2746): 353–359.
39. Alexandrov LB, Nik-Zainal S, Wedge DC et al. Signatures of mutational processes in human cancer. Nature 2013; 500 (7463): 415–421. doi: 10.1038/nature12477.
40. McGranahan N, Furness AJ, Rosenthal R et al. Clonal neoantigens elicit T cell immunoreactivity and sensitivity to immune checkpoint blockade. Science 2016; 351 (6280): 1463–1469. doi: 10.1126/science.aaf1490.
41. Gettinger SN, Horn L, Gandhi L et al. Overall survival and long-term safety of nivolumab (anti-programmed death 1 antibody, BMS-936558, ONO-4538) in patients with previously treated advanced non-small-cell lung cancer. J Clin Oncol 2015; 33 (18): 2004–2012. doi: 10.1200/JCO.2014.58.3708.
42. Jansen RL, Slingerland R, Goey SH et al. Interleukin-2 and interferon-alpha in the treatment of patients with advanced non-small-cell lung cancer. J Immunother 1992; 12 (1): 70–73.
43. Agrawal B, Gendler SJ, Longenecker BM. The biological role of mucins in cellular interactions and immune regulation: prospects for cancer immunotherapy. Mol Med Today 1998; 4 (9): 397–403.
44. DeGregorio M, Soe L, Wolf M. Tecemotide (L-BLP25) versus placebo after chemoradiotherapy for stage III non-small cell lung cancer (START): a randomized, double-blind, phase III trial. J Thorac Dis 2014; 6 (6): 571–573. doi: 10.3978/j.issn.2072-1439.2014.05.15.
45. Rochlitz C, Figlin R, Squiban P et al. Phase I immunotherapy with a modified vaccinia virus (MVA) ex - pressing human MUC1 as antigen-specific immunother-apy in patients with MUC1-positive advanced cancer. J Gene Med 2003; 5 (8): 690–699.
46. Quoix E, Lena H, Losonczy G et al. TG4010 immunotherapy and first-line chemotherapy for advanced non-small-cell lung cancer (TIME): results from the phase 2b part of a randomised, double-blind, placebo-controll - ed, phase 2b/3 trial. Lancet Oncol 2016; 17 (2): 212–223. doi: 10.1016/S1470-2045 (15) 00483-0.
47. Jang SJ, Soria JC, Wang L et al. Activation of melanoma antigen tumor antigens occurs early in lung carcinogenesis. Cancer Res 2001; 61 (21): 7959–7963.
48. Vansteenkiste JF, Cho BC, Vanakesa T et al. Efficacy of the MAGE-A3 cancer immunotherapeutic as adjuvant therapy in patients with resected MAGE-A3-positive non-small - -cell lung cancer (MAGRIT): a randomised, double-blind, placebo-controlled, phase 3 trial. Lancet Oncol 2016; 17 (6): 822–835. doi: 10.1016/S1470-2045 (16) 00099-1.
49. Rodriguez PC, Popa X, Martinez O et al. A Phase III clinical trial of the epidermal growth factor vaccine CIMAvax-EGF as switch maintenance therapy in advanced non-small cell lung cancer patients. Clin Cancer Res 2016; 22 (15): 3782–3790. doi: 10.1158/1078-0432.CCR-15-0855.
50. Giaccone G, Bazhenova LA, Nemunaitis J et al. A phase III study of belagenpumatucel-L, an allogeneic tumour cell vaccine, as maintenance therapy for non-small cell lung cancer. Eur J Cancer 2015; 51 (16): 2321–2329. doi: 10.1016/j.ejca.2015.07.035.
51. Alfonso S, Valdes-Zayas A, Santiesteban ER et al. A randomized, multicenter, placebo-controlled clinical trial of racotumomab-alum vaccine as switch maintenance therapy in advanced non-small cell lung cancer patients. Clin Cancer Res 2014; 20 (14): 3660–3671. doi: 10.1158/1078-0432.CCR-13-1674.
52. Keir ME, Butte MJ, Freeman GJ et al. PD-1 and its ligands in tolerance and immunity. Annu Rev Immunol 2008; 26 : 677–704. doi: 10.1146/annurev.immunol.26.021607.090331.
53. Lynch TJ, Bondarenko I, Luft A et al. Ipilimumab in combination with paclitaxel and carboplatin as first-line treatment in stage IIIB/IV non-small-cell lung cancer: results from a randomized, double-blind, multicenter phase II study. J Clin Oncol 2012; 30 (17): 2046–2054. doi: 10.1200/JCO.2011.38.4032.
54. Lakomy R, Poprach A. Side effects of modern immunotherapy and how to solve them in the clinics. Klin Onkol 2015; 28 (Suppl 4): 4S103–4S114. doi: 10.14735/amko20154S103.
55. Zatloukal P, Heo DS, Park K et al. Randomized phase II clinical trial comparing tremelimumab (CP-675,206) with best supportive care (BSC) following first-line platinum-based therapy in patients (pts) with advanced non-small cell lung cancer (NSCLC). J Clin Oncol 2009; 27 (Suppl 15): abstr. 8071.
56. Robert C, Long GV, Brady B et al. Nivolumab in previously untreated melanoma without BRAF mutation. N Eng J Med 2015; 372 (4): 320–330. doi: 10.1056/NEJMoa1412082.
57. Topalian SL, Hodi FS, Brahmer JR et al. Safety, activity, and immune correlates of anti-PD-1 antibody in cancer. N Eng J Med 2012; 366 (26): 2443–2454. doi: 10.1056/NEJMoa1200690.
58. Herbst RS, Baas P, Kim DW et al. Pembrolizumab versus docetaxel for previously treated, PD-L1-positive, advanced non-small-cell lung cancer (KEYNOTE-010): a randomised controlled trial. Lancet 2016; 387 (10027): 1540–1550. doi: 10.1016/S0140-6736 (15) 01281-7.
59. Fehrenbacher L, Spira A, Ballinger M et al. Atezolizumab versus docetaxel for patients with previously treated non-small-cell lung cancer (POPLAR): a multicentre, open-label, phase 2 randomised controlled trial. Lancet 2016; 387 (10030): 1837–1846. doi: 10.1016/S0140-6736 (16) 00587-0.
60. Besse B, Johnson M, Janne PA. Phase II, single-arm trial (BIRCH) of atezolizumab as first-line or subsequent therapy for locally advanced or metastatic PD-L1-selected non-small cell lung cancer (NSCLC). Ann Oncol 2015; 26 (Suppl 6): 16LBA.
61. Galon J, Mlecnik B, Bindea G et al. Towards the introduction of the ‚Immunoscore‘ in the classification of malignant tumours. J Pathol 2014; 232 (2): 199–209. doi: 10.1002/path.4287.
62. Donnem T, Kilvaer TK, Andersen S et al. Strategies for clinical implementation of TNM-Immunoscore in resected nonsmall-cell lung cancer. Ann Oncol 2016; 27 (2): 225–232. doi: 10.1093/annonc/mdv560.
63. Antonia SJ, Larkin J, Ascierto PA. Immuno-oncology combinations: a review of clinical experience and future prospects. Clin Cancer Res 2014; 20 (24): 6258–6268. doi: 10.1158/1078-0432.CCR-14-1457.
64. Robert C, Thomas L, Bondarenko I et al. Ipilimumab plus dacarbazine for previously untreated metastatic melanoma. N Eng J Med 2011; 364 (26): 2517–2526. doi: 10.1056/NEJMoa1104621.
65. Formenti SC, Demaria S. Combining radiotherapy and cancer immunotherapy: a paradigm shift. J Natl Cancer Inst 2013; 105 (4): 256–265. doi: 10.1093/jnci/djs629.
66. Schilling B, Sucker A, Griewank K et al. Vemurafenib reverses immunosuppression by myeloid derived suppressor cells. Int J Cancer 2013; 133 (7): 1653–1663. doi: 10.1002/ijc.28168.
67. Wolchok JD, Neyns B, Linette G et al. Ipilimumab monotherapy in patients with pretreated advanced melanoma: a randomised, double-blind, multicentre, phase 2, dose-ranging study. Lancet Oncol 2010; 11 (2): 155–164. doi: 10.1016/S1470-2045 (09) 70334-1.
68. Gowrishankar K, Gunatilake D, Gallagher SJ et al. Inducible but not constitutive expression of PD-L1 in human melanoma cells is dependent on activation of NF-κB. PloS One 2015; 10 (4): e0123410. doi: 10.1371/journal.pone.0123410.
69. Weide B, Martens A, Hassel JC et al. Baseline biomarkers for outcome of melanoma patients treated with pembrolizumab. Clin Cancer Res. In press 2016.
70. Martens A, Wistuba-Hamprecht K, Geukes Foppen M et al. Baseline peripheral blood biomarkers associated with clinical outcome of advanced melanoma patients treated with ipilimumab. Clin Cancer Res 2016; 22 (12): 2908–2918. doi: 10.1158/1078-0432.CCR-15-2412.
71. Hinman LM, Huang SM, Hackett J et al. The drug diag - nostic co-development concept paper: commentary from the 3rd FDA-DIA-PWG-PhRMA-BIO pharmacogenomics workshop. Pharmacogenomics J 2006; 6 (6): 375–380.
72. Fda.gov [homepage on the Internet]. Drug-diagnostic co-development concept paper. U.S. Food and Drug Administration, MD; [updated 2016 June 22; cited 2016 June 23]. Available from: www.fda.gov/downloads/Drugs/ScienceResearch/ResearchAreas/Pharmacogenetics/ucm116689.pdf.
73. Fda.gov [homepage on the Internet]. List of cleared or approved companion diagnostic devices (in vitro and imaging tools). U.S. Food and Drug Administration, MD; [updated 2016 June 22; cited 2016 June 23]. Available from: www.fda.gov/MedicalDevices/ProductsandMedicalProcedures/InVitroDiagnostics/ucm301431.htm.
Labels
Paediatric clinical oncology Surgery Clinical oncology
Article was published inClinical Oncology

2016 Issue Supplementum 4-
All articles in this issue
- Chaperony endoplazmatického retikula na povrchu nádorové buňky a v extracelulárním prostředí
- Proteiny Rab, vnitrobuněčný transport a nádorová onemocnění
- Vplyv inhibície HSP90 na viabilitu a bunkový cyklus v závislosti od stavu p53
- Molekulární podstata kancerogeneze epiteliálních ovariálních karcinomů
- Tvorba hmotnostne spektrometrických spektrálnych knižníc nádorových bunečných línií
- Využití metody vodík/deuteriové výměny v biofarmaceutickém průmyslu
- Nové metody studia metylace DNA – MS-HRM analýza a elektrochemie
- Úloha PD-1/PD-L1 signalizace v protinádorové imunitní odpovědi
- Nemalobuněčný karcinom plic – od imunobiologie k imunoterapii
- Nové technologie používané pro in vivo diagnostiku nádorů
- Pokroky ve vývoji PET radiofarmak pro pacienty v České republice
- Nádorové buňky jako dynamický systém – molekulární a fenotypové změny v průběhu vzniku, progrese a šíření nádoru
- Vícestupňový proces vzniku vzdálených metastáz u karcinomů
- Mechanizmy regulace proteinové homeostázy ve vývoji nádorových onemocnění
- Clinical Oncology
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Úloha PD-1/PD-L1 signalizace v protinádorové imunitní odpovědi
- Nemalobuněčný karcinom plic – od imunobiologie k imunoterapii
- Nádorové buňky jako dynamický systém – molekulární a fenotypové změny v průběhu vzniku, progrese a šíření nádoru
- Nové metody studia metylace DNA – MS-HRM analýza a elektrochemie
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

