-
Medical journals
- Career
Duální inhibice receptoru angiotenzinu a neprilysinu – revoluční princip léčby chronického srdečního selhání se sníženou ejekční frakcí levé komory
Authors: F. Málek
Authors‘ workplace: Kardiocentrum, Nemocnice Na Homolce, Praha
Published in: Kardiol Rev Int Med 2016, 18(4): 281-286
Overview
V roce 2014 byly prezentovány a publikovány výsledky studie PARADIGM-HF (Prospective Comparison of ARNI with ACEI to Determine Impact on Global Mortality and Morbidity in Heart Failure Trial), která prokázala příznivý efekt nové lékové skupiny představované sakubitril-valsartanem na přežívání pacientů s chronickým srdečním selháním a redukovanou ejekční frakcí levé komory. Lék s původním kódovým označením LCZ696 se skládá ze sakubitrilu (inhibitoru neprilysinu) a valsartanu (AT1 blokátoru receptoru angiotenzinu II). Obě látky tvoří komplex v molárním poměru 1 : 1. Nejedná se tedy o fixní kombinaci dvou samostatných léčiv v jedné tabletě, ale o skutečnou chemickou vazbu mezi oběma složkami. Sakubitril-valsartan je představitelem nové lékové skupiny označované jako inhibitory neprilysinu a receptoru angiotenzinu (angiotenzin receptor/neprilysin inhibitor).
Klíčová slova:
chronické srdeční selhání – mortalita – angiotenzin II – neprilysin – sakubitril-valsartanÚvod
Chronické srdeční selhání (CHSS) má navzdory pokrokům v diagnostice, farmakoterapii a nefarmakologické léčbě stále špatnou prognózu. Za rozvoj symptomů a progresi srdeční dysfunkce do stadia srdečního selhání (SS) je odpovědná zvýšená aktivace vazokonstrikčních a antinatriuretických neurohumorálních systémů. Za hlavní systémy, jejichž aktivace je nutná u akutního SS k udržení kardiovaskulární (KV) homeostázy, jsou považovány: systém sympatoadrenální a systém renin-angiotenzin-aldosteronový. U CHSS je aktivace těchto systémů trvalá a nežádoucí. Proti aktivaci těchto systémů stojí systém vazodilatačních a natriuretických hormonů, jejichž syntéza je u CHSS rovněž zvýšena: je to systém natriuretických peptidů (NP), systém kallikrein-kininový, prostaglandiny, systém oxidu dusnatého a další. Jejich hlavní úlohou je udržení kompenzované srdeční dysfunkce a oddálení rozvoje SS. Při již rozvinutém SS však jejich účinek nestačí a rovnováha je narušena ve prospěch vazokonstrikčních systemů.
Cílem terapie nemocných se syndromem CHSS je snížení morbidity a mortality pacientů a zlepšení kvality jejich života. Ve všech případech je nezbytná agresivní terapie KV onemocnění, které je podkladem srdeční dysfunkce: terapie ischemické choroby srdeční, léčba hypertenze nebo chlopenních vad. Terapie nemocných je komplexní a zahrnuje principy dietních a režimových opatření, farmakoterapii a chirurgickou a přístrojovou terapii [1,2].
U nemocných se systolickou srdeční dysfunkcí je strategie farmakoterapie společná, a to bez ohledu na příčinu poškození myokardu. Farmakoterapie se opírá o léky, které příznivě ovlivňují morbiditu a prognózu pacientů, a dále léky, jejichž efekt je k prognóze pacientů neutrální, ale jež zlepšují kvalitu života nemocných (diuretika, digoxin, vazodilatační léčba).
Důkazy o zlepšení prognózy nemocných se SS jsme měli dosud pro inhibitory angiotenzin konvertujícího enzymu (ACEI) [3 – 6], betablokátory [7–10] a antagonisty mineralokortikoidních receptorů (MRA) [11,12]. Portfolio léků pro terapii stabilního CHSS obohatil v posledních letech ivabradin pro pacienty se sinusovým rytmem a tepovou frekvencí ≥ 70/ min navzdory optimální terapii zahrnující maximální tolerovanou dávku betablokátoru [13].
Významným mezníkem ve farmakoterapii SS se systolickou dysfunkcí levé komory byla prezentace výsledků studie PARADIGM-HF (Prospective Comparison of ARNI with ACEI to Determine Impact on Global Mortality and Morbidity in Heart Failure Trial) na kongresu Evropské kardiologické společnosti v Barceloně. Lék s původním kódovým označením LCZ696 se skládá ze sakubitrilu (inhibitoru neprilysinu) a blokátoru AT1 receptoru angiotenzinu II valsartanu. Obě látky tvoří komplex v molárním poměru 1 : 1. Nejedná se tedy o fixní kombinaci dvou samostatných léčiv v jedné tabletě, ale o skutečnou chemickou vazbu mezi oběma složkami. Neprilysin je neutrální endopeptidáza, která degraduje několik vazoaktivních peptidů, zejména NP v krvi. Inhibice neutrální endopeptidázy prodlužuje příznivý diuretický, natriuretický a vazodilatačí účinek zejména B-natriuretického peptidu v krvi. Sakubitril-valsartan je představitelem nové lékové skupiny označované jako inhibitory neprilysinu a receptoru angiotenzinu (angiotenzin receptor/neprilysin inhibitor – ARNI) [14].
Pro pochopení principu duální inhibice receptoru angiotenzinu II a neprilysinu je nutné si uvědomit význam NP v organizmu.
Image 1. Význam natriuretických peptidů při srdečním selhání. 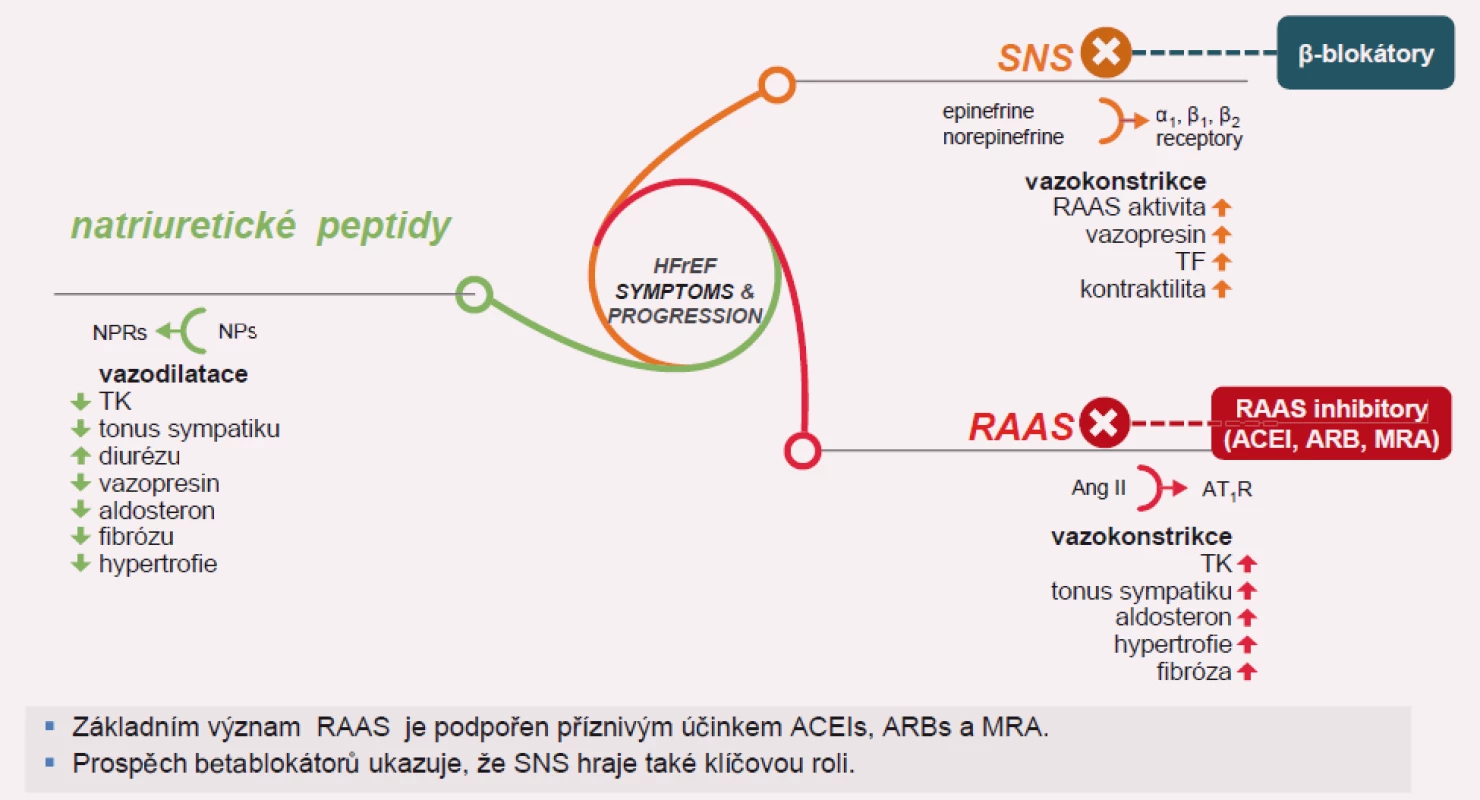
Natriuretické peptidy
V lidském organizmu jsou vyvinuty systémy, které jsou protiváhou efektu nadměrné aktivace vazokonstrikčních neurohormonů. Jsou to endogenní vazodilatační systémy, které zahrnují: systém NP, oxidu dusnatého a prostaglandinů. Tyto peptidové systémy podporují diurézu, natriurézu a inhibují buněčný růst [15 – 17].
Již před více než před 20 lety De Bold ukázal, že intravenózní podání extraktu ze srdečních předsíní vede u potkanů k významnému zvýšení natriurézy [18]. Tato práce zahájila intenzivní výzkum endokrinní aktivity srdce, který vedl k objevu skupiny strukturálně podobných, ale geneticky rozdílných peptidů, které se účastní kardiorenální homeostázy.
Skupinu těchto peptidů tvoří: atriální natriuretický peptid (atrial natriuretic peptide – ANP) a mozkový natriuretický peptid (brain natriuretic peptide – BNP), které jsou produkovány kardiomyocyty, a C-natriuretický peptid (C-type natriuretic peptide – CNP), který je produkován buňkami endotelu cév a renálního epitelu.
BNP byl poprvé izolován z vepřového mozku, ale hlavním místem jeho sekrece jsou kardiomyocyty síní a především komor. BNP má 32 aminokyselin a hlavním stimulem pro jeho sekreci je komorová dilatace a vzestup napětí ve stěně srdečních komor. BNP vzniká z prekurzoru o 108 aminokyselinách, který je štěpen na dva fragmenty: vlastní biologicky aktivní BNP a N-terminální fragment N-BNP. Oba fragmenty cirkulují v plazmě a jejich koncentrace je zvýšená u pacientů s komorovou hypertrofií a s CHSS.
NP mají v organizmu opačný účinek k systému renin-angiotenzin-aldosteron, a představují tedy fyziologické antagonisty efektu angiotenzinu II na cévní tonus, sekreci aldosteronu, renální tubulární reabsorpci sodíku a vaskulární buněčný růst. K vzestupu koncentrací ANP a BNP dochází vždy jako odpověď na volumovou expanzi a tlakové zatížení srdce. Plazmatické koncentrace CNP se při tlakovém nebo volumovém přetížení mění velmi málo. Tento peptid má spíše parakrinní úlohu v regulaci cévního tonu a jeho antitrofický efekt zřejmě slouží k inhibici strukturální cévní remodelace, která provází hypertenzi a vaskulární příhody. Sekrece NP je u pacientů se SS zvýšena.
Hlavní úlohou natriuretických peptidů je při akutní dysfunkci levé komory s předčasnou aktivací systému renin-angiotenzin-aldosteron udržení kompenzované dysfunkce a oddálení rozvoje manifestního SS. Koncentrace ANP a BNP jsou zvýšeny u pacientů s CHSS mimo akutní fázi infarktu myokardu a i u pacientů se SS na podkladě neischemické srdeční dysfunkce. Vzestup koncentrací cirkulujících natriuretických peptidů ANP a BNP je vždy v závislosti na pokročilosti CHSS (funkční klasifikace NYHA) a byl nalezen významný vztah mezi koncentrací cirkulujícího BNP a prognózou pacientů se SS. Koncentrace BNP se ukázaly být významnějším prognostickým ukazatelem u pacientů se SS než koncentrace ANP [21]. BNP je primárně syntetizován a uvolňován z levé komory. Experimentálně navozené akutní SS mimo akutní infarkt myokardu vedlo k okamžitému uvolnění ANP, ale ne BNP. ANP se ukazuje být hormonem akutní odpovědi, kdežto BNP se uvolňuje až při déletrvajícím komorovém přetížení, kdy koncentrace BNP dokonce koncentrace ANP převyšují.
Poznatky o významu NP ve fyziologii a patofyziologii SS byly předpodkladem pro výzkum jejich léčebného použití. Krátkodobé infuze farmakologických dávek ANP a BNP vedly u pacientů se SS k příznivým hemodynamickým účinkům [22,23]. Došlo k poklesu tlaku v pravé síni, tlaku v zaklínění a k vzestupu srdečního výdeje. Došlo k poklesu koncentrací aldosteronu a plazmatické reninové aktivity a k vzestupu diurézy a natriurézy. Podobného účinku bylo dosaženo pomocí rekombinantně připraveného BNP nesiritidu. Šestihodinová infuze nesiritidu vedla u pacientů s těžkým dekompenzovaným SS ke zlepšení hemodynamických ukazatelů a k odstranění symptomů [24].
Nesritid není registrován v EU, protože přes příznivé hemodynamické účinky na tlak v plícnici v zaklínění, byl pokles systémového TK spojen se zhoršením ledvinných funkcí [24].
Poznatky o účinku natriuretických peptidů byly výzvou k použití inhibitorů degradace NP, tzv. inhibitorů neutrální endopeptidázy, v prevenci progrese srdeční dysfunkce do stadia SS [25]. Dosud bylo připraveno několik inhibitorů neutrální endopeptidázy, které zvyšují plazmatické koncentrace natriuretických peptidů a vedou ke zvýšení natriurézy. Například použití inhibitoru neutrální endopeptidázy candoxatrilátu vedlo u pacientů s CHSS k signifikantnímu vzestupu exkrece sodíku. Protože inhibitory neutrální endopeptidázy snižují degradaci angiotenzinu II, jevila se perspektivní buď jejich kombinace s inhibitory angiotenzin-konvertujícího enzymu (ACEI) nebo antagonisty AT1 receptoru angiotenzinu II, anebo použití takzvaných inhibitorů vazopeptidázy, které mají vlastnosti duálních inhibitorů jak neutrální endopeptidázy, tak angiotenzin-konvertujícího enzymu. Zkušenosti byly s inhibitorem vazopeptidázy omapatrilátem, který měl některé výhody v terapii nemocných s CHSS ve srovnání s ACEI lisinoprilem [26].
Potvrzení nebo vývracení teorie o přednosti inhibitorů vazopeptidázy před ACEI v terapii CHSS měla přinést studie OVERTURE, která srovnávala účinek omapatrilátu a enalaprilu u pacientů s CHSS [27]. Omapatrilát snížil riziko úmrtí a hospitalizace ve srovnání s enalaprilem u 5 770 pacientů s CHSS NYHA ve stadiu II – IV, ale nebyl účinnější ve snížení rizika definovaného primárního výsledku: kombinovaný výsledek riziko úmrtí a hospitalizace pro SS vyžadující intravenózní terapii (HR 0,94; p = 0,187).
Sakubitril-valsartan – nový lék pro farmakoterapii SS
Sakubitril-valsartan (Entresto) představuje monokomponentní lék, který v sobě zahrnuje inhibitor neprilysinu a antagonistu receptoru angiotenzinu II. Jeho účinnost ve srovnání s enalaprilem byla prokázána ve studii PARADIGM-HF [14]. Sakubitril-valsartan je indikován pro léčbu stabilního CHSS u pacientů s přetrvávající symptomatologií navzdory optimální farmakoterapii zahrnující betablokátory, ACEI a antagoisty mineralokortikoidních receptorů [1].
Studie PARADIGM-HF sledovala podávání sakubitril-valsartanu oproti enalaprilu u pacientů se stabilním systolickým SS ve funkční třídě NYHA II–IV, s ejekční frakcí pod 40 %, kteří měli hladinu BNP > 150 pg/ml nebo NT-proBNP > 600 pg/ml. Pokud byli pacienti hospitalizováni v posledních 12 měsících, byla hodnota BNP pro zařazení do studie > 100 pg/ml a NT-pro BNP > 400 pg/ml. Studie probíhala v letech 2009 – 2012 ve 47 zemích, v 1 043 centrech a u 10 521 pacientů. Celkově bylo zařazeno 4 187 pacientů na léčbu sakubitril-valsartanem a 4 212 na léčbu enalaprilem. Studie byla předčasně ukončena pro vysoce statisticky pozitivní vliv sakubitril-valsartanu: snížení rizika KV úmrtí a první hospitalizace pro SS (HR 0,80; p < 0,001), snížení KV mortality (HR 0,80; p < 0,001) a snížení rizika první hospitalizace pro SS (HR 0,79; p < 0,001). Významně byla snížena i celková mortalita (HR 0,74; p < 0,001).
Dostupné dávky sakubitril-valsartanu (Entresto) jsou 24/ 26 mg, 49/ 51 mg a 97/103 mg. Úvodní dávka sakubitril-valsartanu je 49 mg/51 mg 2× denně s cílovou dávkou po 2–4 týdnech 97 mg/103 mg 2× denně. V případě hypotenze, hyperkalemie nebo renální dysfunkce v průběhu léčby by měla být dávka sakubitril-valsartanu snížena. Léčbu se nedoporučuje zahajovat u pacientů s hodnotou systolického krevního tlaku < 100 mm Hg nebo u pacientů s koncentrací draslíku > 5,4 mmol/l. Dávkování přípravku Entresto podle úrovně krevního tlaku ukazuje tab. 1.
Image 2. Sakubitril-valsartan (Entresto) inhibuje neprilysil (NEP) a současně blokuje AT<sub>1</sub> receptor. 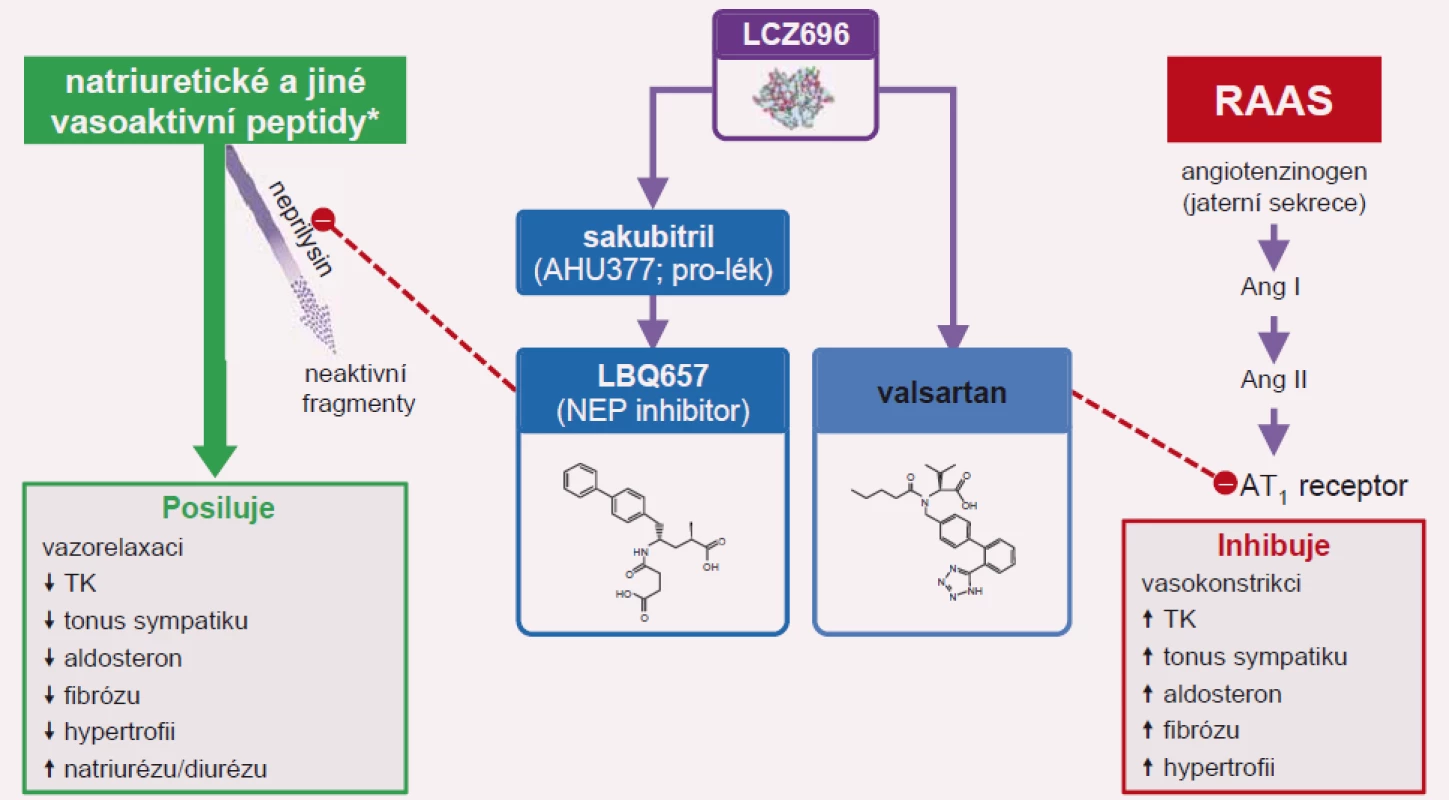
Image 3. Plán studie PARADIGM-HF. 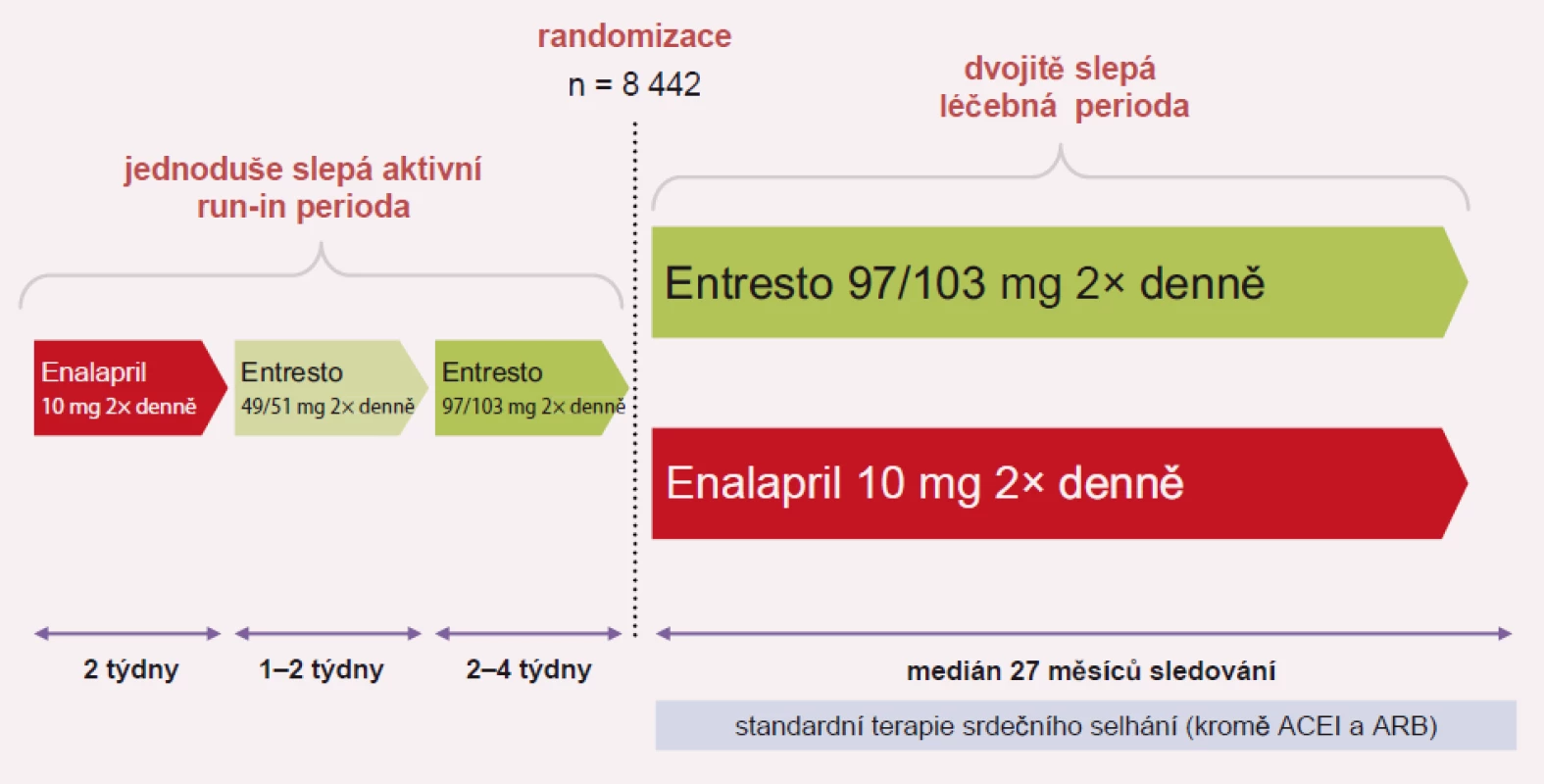
Image 4. Hlavní výsledek studie PARADIGM-HF: KV úmrtí nebo první hospitalizace pro SS. 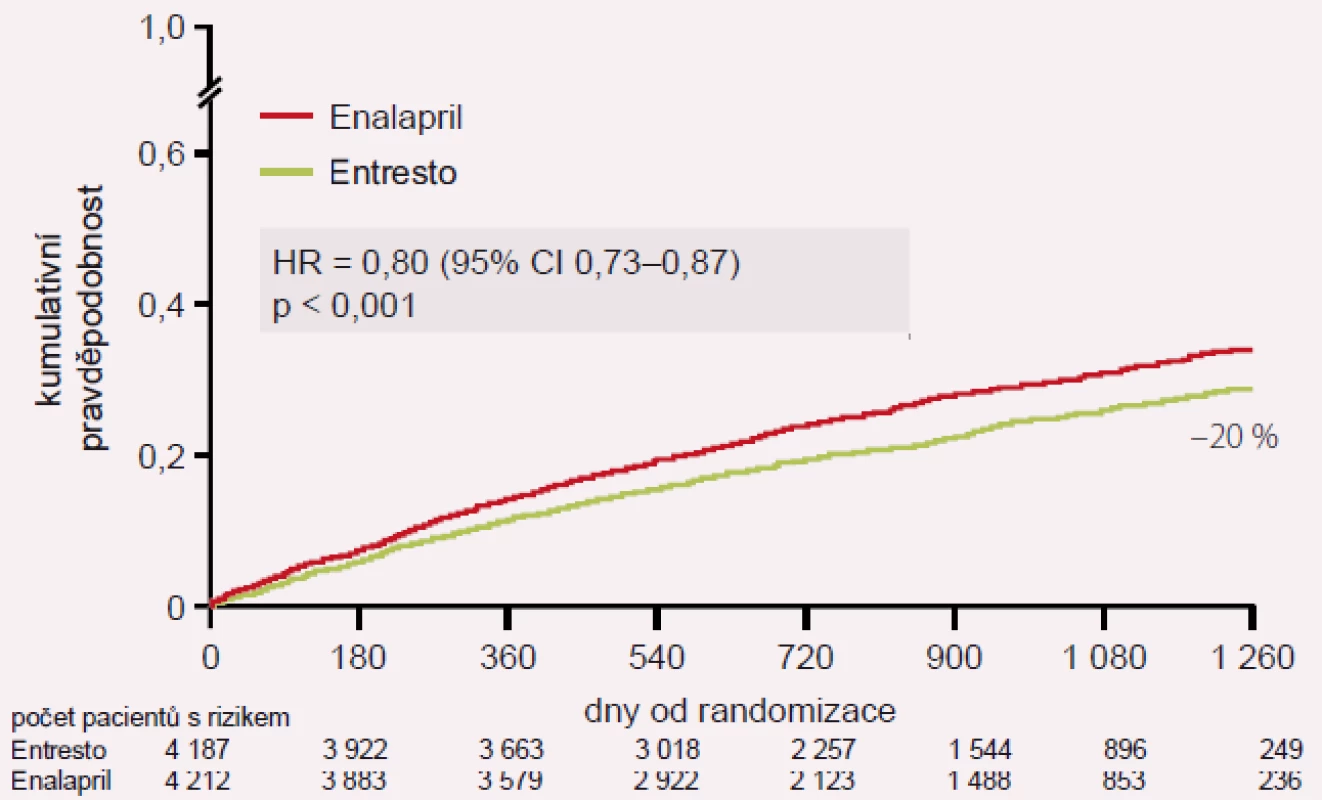
Table 1. Dávkování přípravku Entresto podle úrovně krevního tlaku. 
*titrace dávky zdvojnásobením po 2–4 týdnech **cílová dávka dle úrovně TK (krevní tlak), při poklesu TK v průběhu léčby se dávka snižuje Kontraindikací pro podání sakubitril-valsartanu je anamnéza angioedému po ACEI nebo antagonisty receptoru angiotenzinu II, idiopatický angioedém a dále současná léčba ACEI nebo inhibitorem receptoru angiotenzinu II. Při léčbě ACEI může být léčba sakubitril-valsartanem zahájena až 36 hod od poslední dávky ACEI z důvodu rizika angioedému [28]. Dávku sakubitril-valsartanu není nutné upravovat u mírně snížené funkce ledvin (odhad glomerulární filtrace – eGFR 60–90 ml/min/ 1,73 m2). U pacientů s eGFR 30–60 ml/min/1,73 m2 se doporučuje zahajovací dávka 24 mg/26 mg 2× denně.
U pacientů s eGFR < 30 ml/ min/ 1,73 m2 jsou omezené zkušenosti.
Dávkování přípravku Entresto podle úrovně ledvinných funkcí ukazuje tab. 2. Léčba je dále kontraindikována při těžké poruše funkce jater, u pacientů s cholestázou nebo biliární cirhózou. Dávkování přípravku Entresto dle jaterních funkcí ukazuje tab. 3. Snížení renálních funkcí a poškození jaterních funkcí je u pacientů s CHSS časté, zejména v pokročilém stadiu. Před zahájením léčby přípravkem Entresto je nutné kontrolovat renální a jaterní funkce. Stupně jaterního poškození podle Child-Pugh skóre ukazuje tab. 4.
Table 2. Dávkování přípravku Entresto podle úrovně ledvinných funkcí. 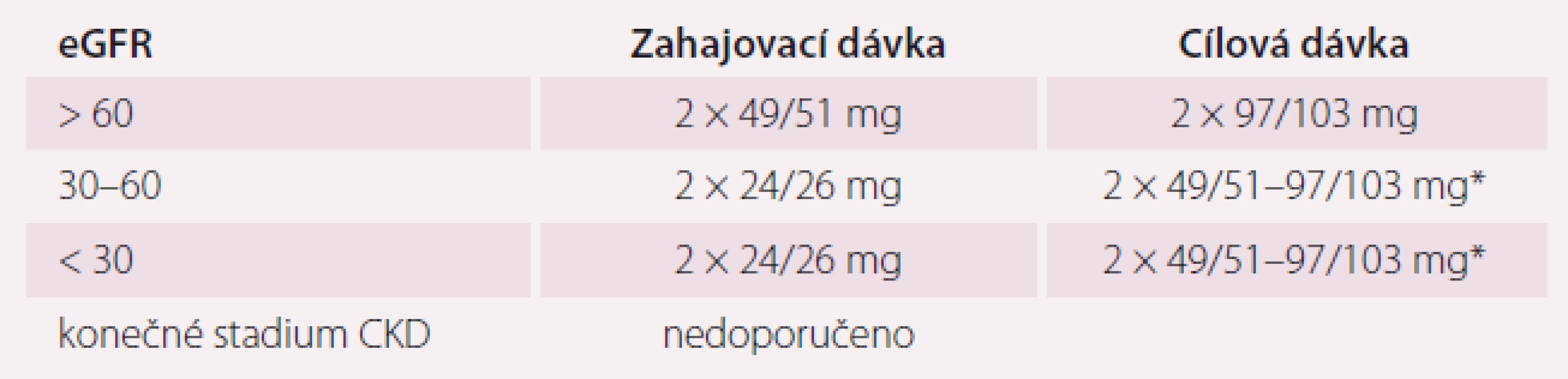
eGFR – odhadovaná glomerulární filtrace v ml/min/1,73 m2 (ideálního tělesného povrchu) *cílová dávka dle úrovně eGFR, K (kalémie) a sTK (systolický tlak) v průběhu léčby Table 3. Dávkování přípravku Entresto podle jaterních funkcí (Child-Pugh skóre – viz tab. 4). 
UNL – dvojnásobek horní hranice normy *cílová dávka dle úrovně eGFR, K (kalémie) a sTK (systolický tlak) v průběhu léčby Table 4. Child-Pugh skóre u jaterního poškození. 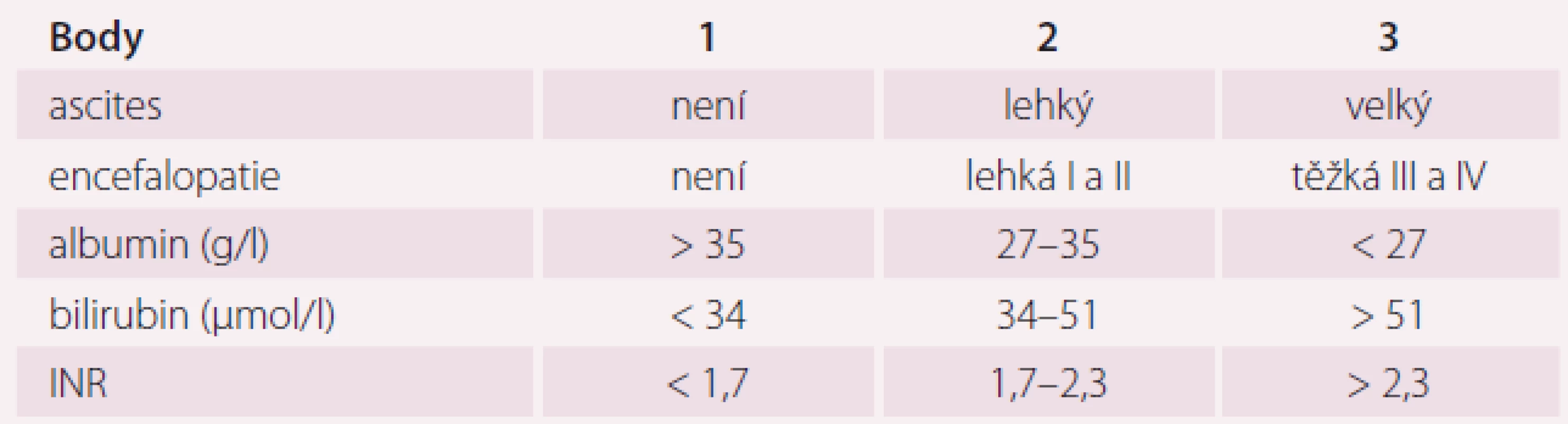
INR – mezinárodní normalizovaný poměr, poměr naměřeného času pacienta a normální hodnoty kontrolní plazmy Encefalopatie I – lehká zmatenost, euforie/deprese, zpomalené tempo, agitovanost, porucha spánkového režimu (spánková inverze) Encefalopatie II – spavost, letargie, změny osobnosti, občasné stavy dezorientace Encefalopatie III – somnolence, zmatenost + dezorientace časem a místem, nesoběstačnost Encefalopatie IV – kóma Child-Pugh A = 5–6 bodů, B = 7–9 bodů, C = 10–15 bodů Nejčastějšími nežádoucími účinky přípravku Entresto jsou hypotenze, hyperkalemie a zhoršení funkce ledvin. Mezi lékové interakce, které vedou ke kontraindikaci, patří: současné podání ACEI, podávání blokátoru angiotenzinu (ARB) (sakubitril-valsartan ARB obsahuje) a podávání přímého inhibitoru reninu aliskirenu. Současné podání těchto léků je spojeno s významným rizikem hyperkalemie, angioedému, hypotenze a renální dysfunkce. Sakubitril je inhibitorem transportérů organických aniontů (organic anion transporting polypeptides – OATPs), proteinů OATP1B1 a OATP1B3, a proto může zvyšovat účinnost substrátů těchto proteinů, jako jsou statiny. Současné podávání sakubitril-valsartanu a inhibitorů fosfodiesterázy 5 včetně sildenafilu může být spojeno s rizikem hypotenze. Současné podávání nesteroidních antirevmatik může být spojeno s rizikem zhoršení ledvinných funkcí. Léky, které zvyšují koncentraci draslíku v krvi, musí být při léčbě sakubitril-valsartanem podávány s opatrností a častou monitorací koncentrace draslíku v krvi. Sakubitril-valsartan není metabolizován prostřednictvím CYP3A4, proto lékové interakce na této metabolické cestě nejsou významné.
Závěr
Sakubitril-valsartan (Entresto) je hlavním přestavitelem moderní léčby CHSS se sníženou ejekční frakcí. Ukazuje se, že duální inhibice neprilysinu a receptoru angiotenzinu II je mnohem efektivnější na snížení rizika úmrtí a hospitalizace pro SS než konvenční léčba ACEI enalaprilem. Tím se liší od duální inhibice neprilysinu a angiotenzin-konverujícího enzymu (představované omapatrilátem).
Sakubitril-valsartan (Entresto) je indikován pro nemocné se stabilním CHSS, kteří zůstávájí symptomatičtí i přes optimalizovanou farmakoterapii. Pro zahájení léčby je nutné dávku titrovat a kontrolovat krevní tlak, koncentraci draslíku v krvi a úroveň renálních parametrů.
Hlavní kontraindikací pro zahájení léčby je kromě hypotenze, hyperkalemie a významné renální insuficience současná léčba ACEI nebo antagonisty receptoru angiotenzinu II, případně přímým inhibitorem reninu aliskirenem. V případě změny terapie z ACEI je léčbu přípravkem Entresto nutné zahájit až 36 hod od poslední dávky.
Sakubitril-valsartan má potenciální budoucnost i v léčbě SS se zachovalou ejekční frakcí. Je známo, že léčebné strategie se pro pacienty se SS a systolickou dysfunkcí levé komory ukázaly být u nemocných se SS a zachovalou ejekční frakcí levé komory neúspěšné. Terapie pomocí léků, které inhibují renin-angiotenzinový systém, tedy ACEI a ARB, měla u pacientů se SS a zachovalou ejekční frakcí levé komory neutrální dopad na morbiditu a mortalitu. Randomizovaná srovnávací studie PARAMOUNT fáze II klinického výzkumu ukázala, že sakubitril-valsartan 97/103 mg 2× denně ve srovnání se samotným valsartanem 160 mg 2× denně významně snížil průměrnou koncentraci NT-proBNP o 23 % (p = 0,005) u 283 pacientů s CHSS NYHA II a III a EF LK ≥ 45 % [29].
V současnosti probíhá randomizovaná studie PARAGON-HF u SS se zachovalou ejekční frakcí, jejímž cílem je zjistit dopad sakubitril-valsartanu na riziko úmrtí z KV příčin a hospitalizace pro SS ve srovnání s valsartanem [30].
Doručeno do redakce: 15. 8. 2016
Přijato po recenzi: 7. 9. 2016
doc. MU Dr. Filip Málek, Ph.D., MBA
www.homolka.cz
filip.malek@homolka.cz
Sources
1. Ponikowski P, Voors AA, Anker SD et al. 2016 ESC Guidelines for the diagnosis and treatment of acute and chronic heart silure The Task Force for the diagnosis and treatment of acute and chronic heart failure of the European Society of Cardiology (ESC). Eur Heart J 2016; 37(27): 2129 – 2200. doi: 10.1093/ eurheartj/ ehw128.
2. Hradec J, Vítovec J, Špinar J. Souhrn Doporučených postupů ESC pro diagnostiku a léčbu srdečního selhání 2012. Cor Vasa 2013; 55: e25 – e40.
3. The CONSENSUS trial study group. Effects of enalapril on mortality in severe congestive heart failure. Results of the Cooperative North Scandinavian Enalapril Survival Study. N Engl J Med 1987; 316(23): 1429 – 1435.
4. Rogers WJ, Johnstone DE, Yusuf S et al. Effect of enalapril on survival in patients with reduced left ventricular ejection fractions and congestive heart failure. N Engl J Med 1991; 325(5): 293 – 302. doi: 10.1056/ NEJM199108013250501.
5. Pfeffer MA, Braunwald E, Moye LA et al. SAVE Investigators. Effect of captopril on mortality and morbidity in patients with left ventricular dysfunction after myocardial infarction. N Engl J Med 1992; 327(10): 669 – 677.
6. The Acute Infarction Ramipril Efficacy (AIRE) study investigators. Effect of ramipril on mortality and morbidity of survivors of acute myocardial infarction with clinical evidence of heart failure. Lancet 1993; 342(8875): 821 – 828.
7. CIBIS Investigators and Commities. The Cardiac Insufficiency Bisoprolol Study II (CIBIS-II). Lancet 1999; 353(9146): 9 – 13.
8. MERIT-HF Study Group. Effect of metoprolol CR/ XL in chronic heart failure. Metoprolol CR/ XL randomised intervention trial in congestive heart failure. Lancet 1999; 353(9169): 2001 – 2007.
9. Packer M, Coats AJ, Fowler MB et al. Effect of carvedilol on survival in severe chronic heart failure. N Engl J Med 2001; 344(22): 1651 – 1658.
10. Flather MD, Shibata MC, Coats AJ et al. SENIORS Investigators. Randomized trial to determine the effect of nebivolol on mortality and cardiovascular hospital admission in elderly patients with heart failure (SENIORS). Eur Heart J 2005; 26(3): 215 – 225.
11. Pitt B, Zannad F, Remme WJ et al. The effect of spironolactone on morbidity and mortality in patients with severe heart failure. Randomized Aldactone Evaluation Study Investigators. N Engl J Med 1999; 341(10): 709 – 717.
12. Zannad F, McMurray JJ, Krum H et al. Eplerenone in patients with systolic heart failure and mild symptoms. N Engl J Med 2011; 364(1): 11 – 21. doi: 10.1056/ NEJMoa1009492.
13. Swedberg K, Komajda M, Bohm M et al. Ivabradin and outcomes in chronic heart failure(SHIFT): a randomised placebo-controlled trial. Lancet 2010; 376(9744): 875 – 885. doi: 10.1016/ S0140-6736(10)61198-1.
14. McMurray JJ, Packer M, Desai AS et al. Angiotensin neprilysin inhibition versus enalapril in heart failure. N Engl J Med 2014; 371(11): 993 – 1004. doi: 10.1056/ NEJMoa1409077.
15. Wilkins MR, Redondo J. The natriuretic peptide-family. Lancet 1997; 349(9061): 1307 – 1310.
16. Bonow RO. New insights into the cardiac natriuretic peptides. Circulation 1996; 93(11): 1946 – 1950.
17. Grantham JA, Burnett JC jr. BNP: Increasing importance in the pathophysiology and diagnosis of congestive heart failure. Circulation 1997; 96(2): 388 – 390.
18. De Bold AJ. Heart atria granularity: effects of changes in water-electrolyte balance. Proc Soc Exp Biol Med 1979; 161(4): 508 – 511.
19. Suga S, Nakao K, Hosoda K et al. Receptor selectivity of natriuretic peptide family, atrial natriuretic peptide, brain natriuretic peptide, and C-type natriuretic peptide. Endocrinology 1992; 130(1): 229 – 239.
20. Maack T, Suzuki M, Almeida FA et al. Physiological role of silent receptors of atrial natriuretic factor. Science 1987; 238(4827): 675 – 678.
21. Tsutamoto T, Wada A, Maeda K et al. Attenuation of compensation of endogenous cardiac natriuretic peptide system inchronic heart failure: prognostic role of plasma brain natriuretic peptide concentration in patients with chronic symptomatic left ventricular dysfunction. Circulation 1997; 96(2): 509 – 516.
22. Yoshimura M, Yasue H, Morita E et al. Hemodynamic, renal and hormonal responses to brain natriuretic peptide infusion in patients with congestive heart failure. Circulation 1991; 84(4): 1581 – 1588.
23. Marcus LS, Hart D, Packer M et al. Hemodynamic and renal excretory effects of human brain natriuretic peptide infusion in patients with congestive heart failure. Circulation 1996; 94(2): 3184 – 3189.
24. Colucci WS, Elkayam U, Horton DP et al. Intravenous nesiritide, a natriuretic peptide, in the treatment of decompensated congestive heart failure. N Engl J Med 2000; 343(4): 264 – 253.
25. Margulies KB, Barclay PL, Burnett JC jr. The role of neutral endopeptidase in dogs with evolving congestive heart failure. Circulation 1995; 91(7): 2036 – 2042.
26. Rouleau JL, Pfeffer MA, Stewart DJ et al. Comparison of vasopeptidase inhibitor, omapatrilat, and lisinopril on exercise tolerance and morbidity in patients with heart failure: IMPRESS randomised trial. Lancet 2000; 356(9230): 615 – 620.
27. Packer M, Califf RM, Konstam MA et al. OVERTURE Study Group. Comparison of omapatrilat and enalapril in patients with chronic heart silure. Circulation 2002; 106(8): 920 – 926.
28. SPC Entresto. Dostupné z: http://www.ema.europa.eu/docs/cs_CZ/document_library/EPAR_Product_Information/human/004062/WC500197536.pdf.
29. Solomon SD, Ziele M, Pieske B et al. Prospective comparison of ARNI with ARB on Management Of heart failUre with preserved ejectioN fracTion (PARAMOUNT) Investigators. The angiotensin receptor neprilysin inhibitor LCZ696 in heart failure with preserved ejection fraction: a phase 2 double-blind randomised controlled trial. Lancet 2012; 380: (9851):1387 – 1395. doi: 10.1016/ S0140-6736(12)61227-6.
30. Efficacy and safety of LCZ696 compared to valsartan, on morbidity and mortality in heart failure patients with preserved ejection fraction (PARAGON-HF) Available from: https://clinicaltrials.gov/ct2/show/NCT01920711.
Labels
Paediatric cardiology Internal medicine Cardiac surgery Cardiology
Article was published inCardiology Review

2016 Issue 4-
All articles in this issue
-
Komentář k Doporučeným postupům ESC/ ČKS
Diagnostika srdečního selhání -
Komentář k Doporučeným postupům ESC/ ČKS
Farmakoterapie srdečního selhání -
Komentář k Doporučeným postupům ESC/ ČKS
Poruchy srdečního rytmu a přidružená onemocnění -
Komentář k Doporučeným postupům ESC/ ČKS
Akutní srdeční selhání - Dlouhodobé levokomorové srdeční podpory v léčbě srdečního selhání
- MikroRNA v kardiologii – přehled pro klinickou praxi
- Aplikace molekulární diagnostiky kardiomyopatií v pediatrické praxi
- Železo a ateroskleróza
- Léčba hypertenze starších nemocných
- Duální inhibice receptoru angiotenzinu a neprilysinu – revoluční princip léčby chronického srdečního selhání se sníženou ejekční frakcí levé komory
- Lipertance® – dva problémy, jedno řešení
-
Komentář k Doporučeným postupům ESC/ ČKS
- Cardiology Review
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Dlouhodobé levokomorové srdeční podpory v léčbě srdečního selhání
-
Komentář k Doporučeným postupům ESC/ ČKS
Diagnostika srdečního selhání - Léčba hypertenze starších nemocných
- Lipertance® – dva problémy, jedno řešení
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

