-
Medical journals
- Career
Léčba anémie z nedostatku železa z pohledu nefrologa
Authors: M. Horáčková
Authors‘ workplace: I. interní klinika 2. LF UK a FN v Motole, Praha
Published in: Kardiol Rev Int Med 2014, 16(5): 374-378
Category: Cardiology Review
Overview
Renální anémie je způsobena v první řadě nedostatečnou tvorbou erytropoetinu. Chronické choroby ledvin jsou většinou spojeny s rozvojem anémie, k níž přispívá zhoršená intestinální absorpce železa a je charakteristická nízkou plazmatickou koncentrací feritinu. Anémie se sideropenickou složkou vyžaduje nejen léčbu erytropoetinem, ale také suplementaci železa. Efektivita léčby perorálně podávanými preparáty železa je limitována jejich zhoršenou absorpcí a vedlejšími nežádoucími gastrointenstinálními účinky. Uvedení preparátů železa druhé generace (komplex oxidu železitého se sacharózou a glukonan sodnoželezitý) přineslo výhodu snížené frekvence anafylaktických reakcí při intravenózní aplikaci. Tyto preparáty však nemohou být aplikovány v požadované větší jednotlivé dávce (1 000 mg), a musí být proto aplikovány vícekrát v krátkém intervalu. Ferikarboxymaltóza nabízí efektivní a rychlou korekci deficitu železa. Může být aplikována v dostatečně velké jednotlivé dávce 1 000 mg v krátké 15 – 30 min trvající infuzi, tedy v množství, které je nutné k úplné úhradě deficitu železa.
Klíčová slova:
renální anémie – deficit železa – režimy terapie železa
Absolutní nebo relativní nedostatek železa (Fe) jsou časté komponenty patogeneze renální anémie (RA). Hlavní příčinou RA je nedostatečná produkce endogenního erytropoetinu [1]. Desítky let jsou k dispozici rekombinantní humánní erytropoetiny (EPO) 1. generace (epoetiny alfa, beta, delta, theta a omega). Delší biologickou účinností se vyznačují EPO 2. generace (darboetin alfa a pegepoetin beta). Ekonomické důvody vedly k rozvoji tzv. biosimilars. Nejde přímo o generika, ale o analogické preparáty, které musí splnit kritéria registrace (kvalitu, preklinické studie a studie fáze I – III). V současné době jsou k dispozici na trhu epoetin alfa a zeta. Kromě epoetinů a jejich biosimilars lze erytropoezu stimulovat ještě dalšími látkami – erythropoiesis stimulating agent (ESAs). Jedná se jednak o malé peptidy schopné aktivovat receptor pro erytropoetin (erythropoietin mimetic peptides) a jednak o inhibitory HIF prolylhydroxylázy (tzv. HIF stabilizátory), které vedou ke zvýšení koncentrace endogenního EPO [2]. EPO i ESAs můžeme považovat za revoluční krok v terapii renální anémie. Je však třeba si uvědomit, že EPO i ESAs léčbou navozené zvýšení hemoglobinu na cílové hodnoty vyžaduje proporcionální přísun Fe k tvorbě morfologicky „zdravých“ erytrocytů. Pro vzestup hodnoty hemoglobinu o 10 g/ l je třeba 150 mg Fe [3]. Tento faktor však není jediným důvodem pro terapii preparáty s Fe u pacientů s chronickými nefropatiemi (Chronic Kidney Disease – CKD). Nedostatek Fe vzniká u CKD pacientů z řady dalších příčin. Důležitou roli při tom hrají komorbidity renálně selhávajících nemocných, ať už jsou v přímé nebo nepřímé souvislosti s nefropatií, která způsobila ledvinové selhávání nebo nezvratné selhání ledvin. Suplementace Fe v podobě enterálně nebo parenterálně podávaných preparátů s Fe se proto stala nedílnou součástí terapie anémie pacientů s CKD.
Důvody anémie a nedostatku železa nefrologických pacientů
Přehled příčin nedostatku Fe je zobrazen na obr. 1. Zásadní roli při vzniku sideropenie hraje chronický zánět nebo infekce. Malý peptid hepcidin syntetizovaný v játrech, který reguluje vstřebávání Fe v tenkém střevě a jeho ukládání v buňkách retikuloendoteliálního systému (RES), je za situace zánětu/ infekce prostředníkem vzniku tzv. funkční hyposideremie. Zánětlivé mediátory, především interleukin‑6, podporují nadprodukci hepcidinu, což má za následek sníženou střevní resorpci Fe a jeho zvýšené ukládání do buněk RES. Významnou roli hepcidinu v homeostáze Fe dokládá fakt, že mutace hepcidinového genu vedou k těžké juvenilní hemochromatóze. Hepcidin‑transgenní myši vyvíjejí těžkou sideropenickou anémii v důsledku neschopnosti střevní resorpce Fe [4]. Chronický zánět má kromě vlivu na hepcidin negativní vliv na tvorbu endogenního erytropoetinu. Dochází tak k redukci erytropoetické aktivity kostní dřeně [5]. V tomto směru má renální anémie rysy anémie chronických chorob.
Image 1. Příčiny sideropenie u nemocných s CKD. 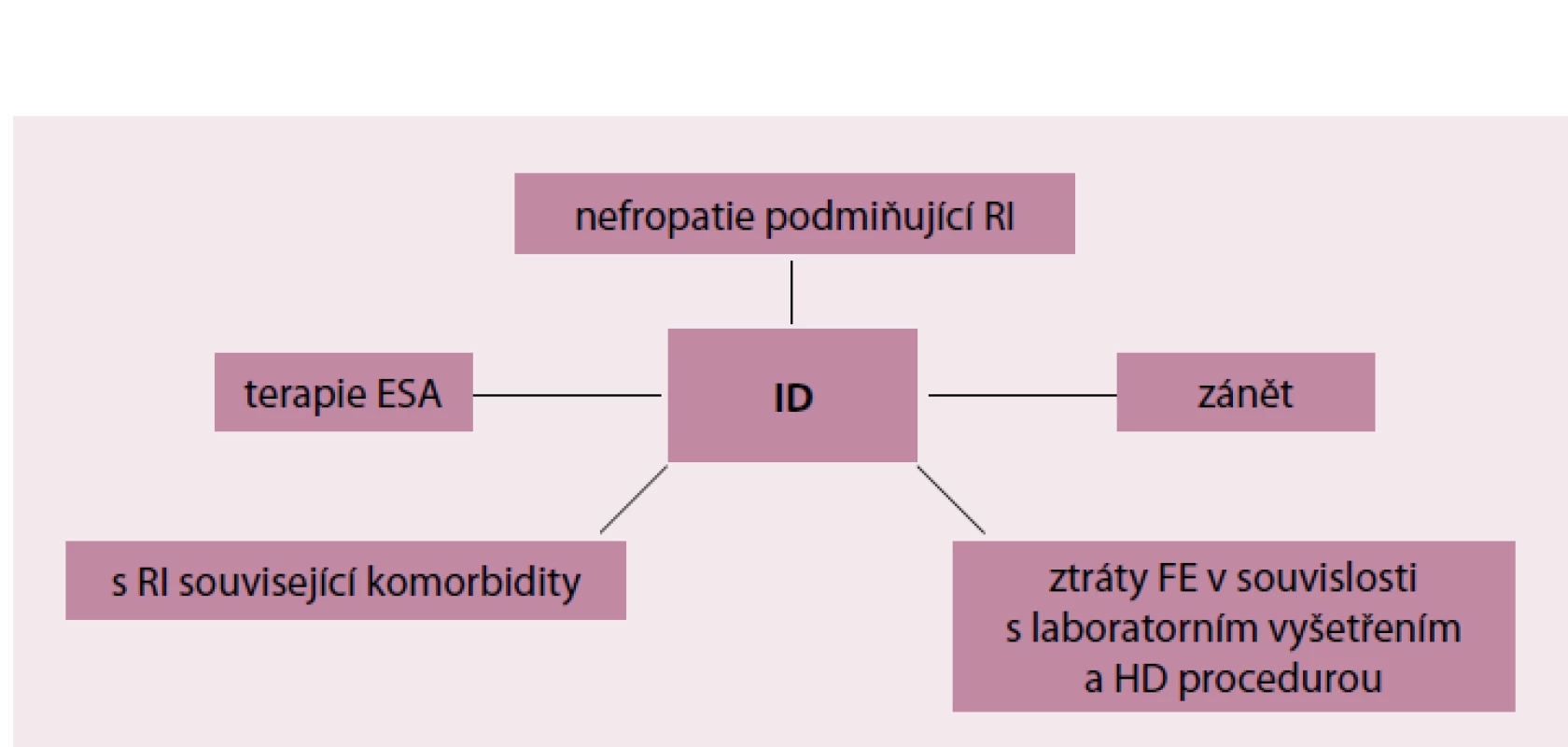
ID – nedostatek železa (Iron Defficiency), RI – renální insuficience, HD – hemodialýza, ESA – erythropoietin stimulating agent V souvislosti s výše uvedenými daty lze předjímat, že nefropatie, které se vyznačují chronickým aktivním zánětem (nefropatie v důsledku sekundární amyloidózy, chronické refluxové, obstruktivní a kalkulózní nefropatie s aktivní pyelonefritidou, aktivní systémová onemocnění a vaskulitidy), jsou častěji spojeny s těžkou funkční sideropenií. U pacientů s aktivním systémovým onemocněním nebo vaskulitidou přispívá imunosupresivy navozený imunodeficit k většímu riziku infekce. Pacienti s diabetes mellitus a diabetickým onemocněním ledvin inklinují ke vzniku funkční sideropenie, protože častěji trpí infekcemi v důsledku sekundárního humorálního imunodeficitu (močové ztráty imunoglobulinů při nefrotickém syndromu). To platí obecně pro všechny nefropatie s nefrotickou proteinurií. Ke vzniku sideropenie přispívají u nemocných s nefrotickou proteinurií také větší močové ztráty železo transportující bílkoviny transferinu. Diabetici a hypertonici, kteří v současné době představují majoritní skupinu nemocných s ledvinovým selháváním, častěji trpí v důsledku těžkých forem vaskulárního postižení ischemií a gangrénou dolních končetin. Neschůdná revaskularizace a otálení s radikálním řešením bývají rovněž spojeny s rychlou anemizací a těžkou sideropenií. Nemocní s chronickou ledvinovou nedostatečností mívají i další infekční komorbidity, které na první pohled s ledvinovým postižením nesouvisejí. U pacientů dialyzovaných na dočasném cévním přístupu hrozí katetrové sepse, jejichž komplikací může být stafylokoková spondylodiscitida [6]. Nemocní s chronickou nefropatií častěji trpí odontogenním mikrozánětem, který je příčinou zvýšené produkce zánětlivých cytokinů (IL‑6 a TNF‑alfa) zodpovědných za funkční hyposideremii a anémii [7].
Důležitou roli v patogenezi sideropenie mají u hemodialyzovaných pacientů chronické krevní ztráty vznikající přímo v souvislosti s hemodialyzační procedurou. Tyto ztráty jsou způsobeny retencí krve v mimotělním oběhu (dialyzátor a dialyzační sety) po ukončení hemodialýzy [8]. K chronickým krevním ztrátám přispívají častější krevní odběry a mnohdy také arteficiální krvácení z krevního přístupu. Nutná terapie kyselinou acetylosalicylovou (zpravidla Anopyrin v denní dávce 100 mg je podáván k udržení průchodnosti arteriovenózního zkratu) a pravidelné podávání nízkomolekulárního heparinu při každé hemodialyzační proceduře vede ke zvýšenému riziku gastrointestinálního slizničního krvácení [9]. Je třeba si uvědomit, že 1 ml krve představuje 0,5 mg Fe. Roční ztráty hemodialyzovaných pacientů se odhadují na 2 000 – 5 000 ml a roční ztráta Fe na 1,2 – 2 g, tj. 100 – 170 mg/ měsíc. Normální ztráta Fe je < 400 mg za rok, tedy 33 mg za měsíc [8,9].
Zásoby Fe jsou zpravidla rychle čerpány za podmínek terapie EPO a ESAs [10,11]. Zásoby Fe v organizmu představují množství 3 – 5 g, přičemž jen malé množství 3 – 4 mg je v plazmě navázáno na transferin [3]. Toto malé množství cirkulujícího Fe se rychle vyčerpá, protože bezprostředně po aplikaci rekombinantního humánního erytropoetinu dochází v následujících 5 – 6 hod k velmi intenzivní erytropoeze [12]. Současně dochází k velmi rychlému vyčerpání zásob Fe z RES, protože potřeba Fe pro etytropoezu začne převyšovat možnosti střevní absorpce, která bývá při 3 – 4 denních jídlech kolem 1 – 2 mg/ den.
Doporučení k terapii renální anémie a sideropenie u nemocných s CKD
Zásadním parametrem při rozhodování o terapii anémie je hodnota hemoglobinu (Hb). Předpoklad, že normalizace hodnoty Hb sníží kardiovaskulární i celkovou mortalitu v populaci nedialyzovaných i dialyzovaných CKD pacientů, se nepotvrdil [13 – 15]. Na základě vyhodnocení validních studií byla doporučena bezpečná trajektorie Hb s rozmezím 9 – 13 g/ dl a optimální hodnotou 10,5 – 11,5 g/ dl. Není vhodné terapií docílit hodnotu Hb > 13,0 g/ dl u CKD pacientů dosud nedialyzovaných i těch léčených hemodialýzou, protože hodnoty nad 13,0 g/ dl jsou spojeny s vyšší frekvencí výskytu kardiovaskulárních komplikací, včetně trombotického uzávěru arteriovenózní fistule. Naopak není doporučen pokles Hb < 9 g/ dl, protože je častěji spojen s nutností krevních transfuzí při zvýšení frekvence příznaků anémie [16,17].
Anémie a sideropenie mají úzký vztah, ale je třeba zdůraznit, že anémie nemusí být se sideropenií spojena, a vice versa sideropenie nemusí být nutně spojena s anémií. Při indikaci terapie preparáty Fe je třeba posoudit množství Fe v zásobách organizmu a jeho disponibilní frakce pro erytropoezu (obr. 2). Jediným laboratorním ukazatelem zásobního Fe je feritin a pro zhodnocení disponibilní frakce Fe pro erytropoezu slouží vyšetření saturace transferinu železem (TSAT). Oba parametry jsou však ovlivněny dalšími faktory, především zánětem a malnutricí.
Image 2. Vztah mezi anemií a sideropenií. 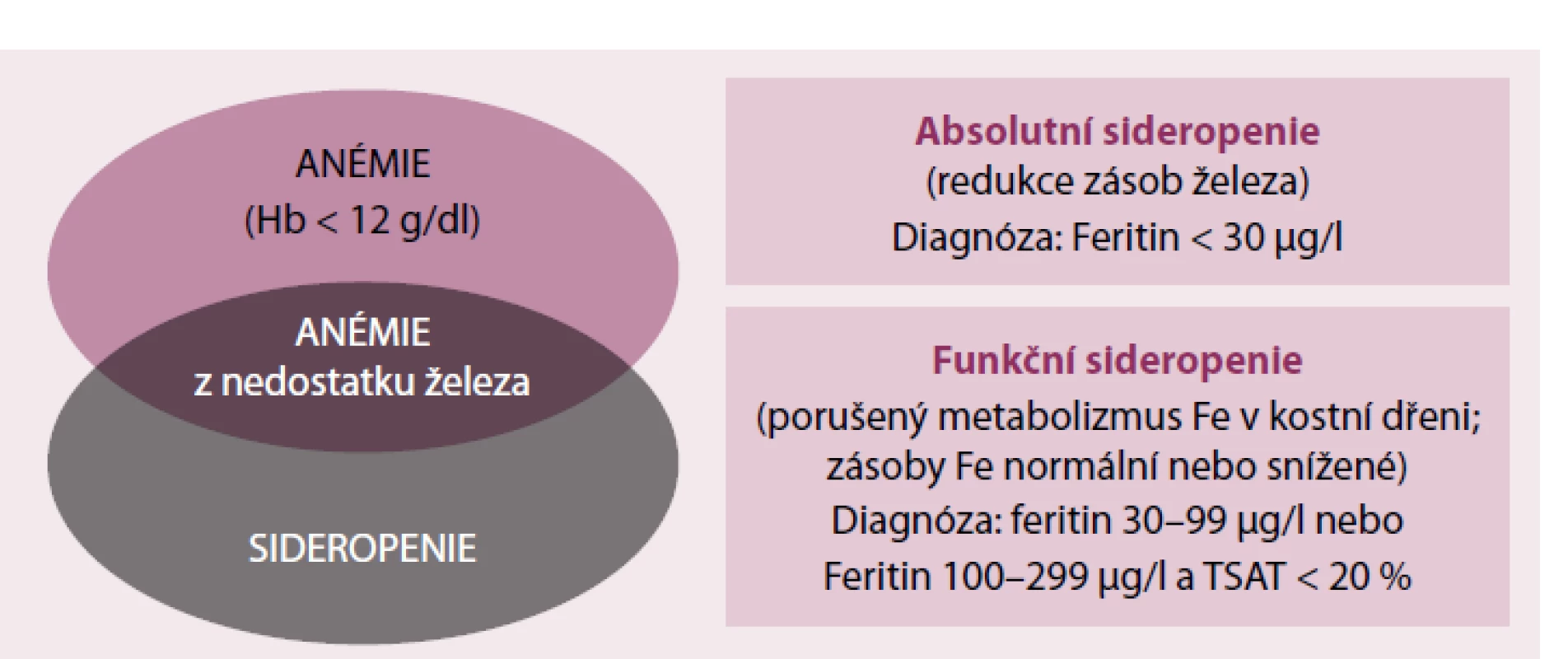
Disponibilní Fe lze hodnotit také podle solubilního transferinového receptou (sTRF). Železo je transportováno navázané na transferin a váže se na buněčnou membránu erytroblastů prostřednictvím receptoru pro transferin a tento komplex je endocytózou internalizován. Po oddělení Fe v endozomech je transferin exocytózou transportován zpět do oběhu a receptor je recyklován, přičemž jeho části se oddělují a dostávají do krve, kde je lze zjistit a kvantifikovat. Sideropenie se vyznačuje zvýšenou hodnotou sTRF, protože na povrchu buňky je vystavováno více receptorů pro transferin. Naopak jeho snížená hodnota svědčí pro poruchu erytropoezy a může sloužit jako nepřímý ukazatel nedostatku erytropoetinu. Solubilní receptor pro transferin je ukazatelem efektivní erytropoezy a vhodným laboratorním parametrem pro posouzení metabolizmu Fe, zejména také proto, že na rozdíl od transferinu nejde o protein akutní fáze.
K posouzení nedostatku Fe může sloužit i procentuální zastoupení hypochromních erytrocytů. Protože přežívání erytrocytů je kolem 120 dnů, nedokáže tento parametr postřehnout aktuální změny. Lépe je proto k posouzení efektivity erytropoezy používat stanovení hemoglobinu v retikulocytech a procentuální zastoupení hypochromních retikulocytů, které lépe odrážejí akutní nedostatek železa pro erytropoezu.
Z celé řady důvodů se v širší klinické praxi etablovaly pouze parametry feritin a TSAT a s nimi je také pracováno ve studiích, které se problematikou sideropenie u nemocných s CKD zabývají.
Laboratorní vyšetření metabolizmu Fe je důležité, protože včasná diagnóza a korekce sideropenie zásadně přispívá k léčbě renální anémie. Neléčená hyposideremie bývá příčinou selhání terapie etrytropoetinem [18,19].
Tyto parametry také slouží k vedení suplementační terapie železem. Cílem je dosažení optimálních hodnot Hb na jedné straně a prevence komplikací, které jsou spojeny s aplikační cestou preparátů Fe, toxickými účinky na bílkovinu nevázaného Fe nebo jeho kumulací na straně druhé. U CKD pacientů jsou uznávanými autoritami KDIGO (Kidney Disease Improving Global Outcome) doporučená kritéria k terapii železem shrnutá v tab. 1. ERBP (European Renal Best Practice) k těmto doporučením připojuje stanovisko k léčbě sideropenie u nedialyzovaných CKD pacientů [17,20]. Těžiště těchto doporučení leží v preferenci terapie sideropenie („iron first“) před případným zahájením terapie RA erytropoetinem.
Table 1. Aktuální mezinárodní doporučení k terapii železem u pacientů s CKD [18,21]. ![Aktuální mezinárodní doporučení k terapii železem u pacientů s CKD [18,21].](https://www.prolekare.cz/media/cache/resolve/media_object_image_small/media/image/78975c3ab64f7db240d28301b0e849f6.png)
KDIGO – Kidney Disease Improving Outcome, ERBP – Eropean Renal Best Practice; Hb – hemoglobin, TSAT – saturace transferinu železem, EPO – erytropoetin Volba preparátů železa, vedlejší účinky léčby, monitorování terapie
Od terapie preparáty Fe očekáváme na jedné straně prevenci vzniku sideropenie u nemocných léčených EPO/ ESAs, vzestup hemoglobinu k cílovým hodnotám u pacientů se sideropenickou anémií dosud neléčených EPO/ ESAs a snížení dávek EPO/ESAs u sideropenických CKD pacientů. Na straně druhé musíme vzít v úvahu u každého individuálního pacienta rizika spojená s léčbou, především anafylaktickou reakci při i.v. aplikaci preparátů Fe, toxický efekt Fe a kumulaci Fe při intravenózní léčbě.
Preparáty Fe k perorálnímu podávání představují vhodnou a nejlevnější alternativu léčby sideropenie a zároveň jsou bezpečné. Účinná léčba vyžaduje 200 mg elementárního železa rozdělenou do dvou denních dávek a doporučuje se podávání mezi jídly, protože řada substancí obsažených v potravě významně ovlivňuje absorpci železa v zažívacím traktu [21]. Studie, jejichž cílem bylo posouzení efektu perorální léčby sideropenie, ukázaly sníženou schopnost absorpce Fe u hemodialyzovaných pacientů a nízkou efektivitu této formy léčby [22 – 24]. K malé efektivitě perorální suplementace Fe přispívá nízká compliance pacientů způsobená nežádoucími účinky této formy terapie. Jde především o gastrointestinální příznaky (zácpa, nadýmání, průjem), které jsou způsobeny vznikem reaktivních oxidačních sloučenin v zažívacím traktu [25,26]. Perorální suplementace se proto doporučuje jen u nedialyzovaných a pacientů léčených peritoneální dialýzou na dobu tří měsíců s následným přehodnocením efektu tohoho způsobu léčby [17,20]. U dialyzovaných pacientů se předpokládá, že perorální léčba dostatečně nepokrývá ztráty a doporučuje se léčba intravenózní [17].
Intravenózní aplikace Fe obcházející bariéru gastrointestinální sliznice je spojena s rizikem vzniku anafylaktické reakce. Toto riziko je závislé na zvoleném preparátu. V našich podmínkách jsou nejčastěji užívány glukogan sodnoželezitý, u kterého se anafylaktická reakce vyskytuje v devíti případech na 10 mil. aplikací; oxid železitý se sacharózou s frekvencí reakce přecitlivělosti 6/ 10 mil. aplikací. Nejvyšší frekvenci anafylaktických reakcí vykazuje oxid železitý s dextranem (33 na 10 mil. aplikací), který však u nás není registrován [27]. Novou molekulou k terapii sideropenie je ferikarboxymaltóza. Bezpečnost ferikarboxymaltózy byla posuzována v metaanalýze 14 studií a bezpečnostní profil této molekuly byl shledán srovnatelným s komplexem oxidu železitého se sacharózou [28].
Diskutována je možnost dlouhodobé toxicity Fe, která vyplývá z předávkování a může být spojena s akcelerací aterosklerotického procesu, se zvýšením frekvence bakteriálních infekcí a celkové i kardiovaskulární morbidity a mortality. Jak se ukazuje, monitorace stavu zásobního Fe je problematická. Jediným laboratorním parametrem, kterého lze k posouzení zásob Fe využít, je feritin. Zejména horní bezpečný limit tohoto parametru není zcela jasný. V materiálech KDIGO i EBPG (European Best Practice Guidance) se doporučený horní limit opírá více o názor expertů, protože chybí dostatečné důkazy opřené o validní studie [29]. Rozmezí hodnot feritinu mezi 300 a 1 200 µg/ l je po adjustaci na faktor malnutrice a zánětu spojen s nejnižším rizikem mortality [30], nicméně v jiné studii DOPPS (Dialysis Outcome and Practice Patterns) byla publikována asociace mezi zvýšenými hodnotami feritinu (≥ 400 ng/ ml) a mortalitou [31]. Hodnoty feritinu > 2 000 µg/ l jsou již asociovány s hemochromatózou u dialyzované populace [32]. Hodnota feritinu v plazmě sice koreluje s Fe v RES, ale je ovlivněna dalšími faktory, jako je infekce, zánět i maligní proces, a tak se někteří autoři domnívají, že bezpečnou horní hranici feritinu vlastně ani stanovit nelze [29].
Recentně je pro měření koncentrace Fe v játrech k dispozici nová metoda neivazivního měření na bázi magnetické rezonance MRI R2 relaxometrie (Ferriscan). Výsledky této metody dobře korelují s přesným měřením obsahu Fe v jaterní tkáni [33]. Při takto měřené koncentraci Fe v játrech si položili autoři australské studie otázku, zda může být predikován obsah Fe v játrech (měřený Ferriscanem) sérovou koncentrací feritinu, TSAT nebo kumulativní dávkou intravenózně podaného Fe u hemodialyzovaných pacientů. Hemodialyzovaní museli být nejméně rok léčeni hemodialýzou a dostávat pravidelně intravenózně Fe. U všech dialyzovaných pak byla vstupní hodnota feritinu vyšší, než je doporučený horní limit (> 500 µg/ l). V další části studie se autoři věnovali změnám koncentrace Fe v játrech (měřeným Ferriscanem) u pacientů v predialýze, kteří byli indikováni k terapii železem a tuto terapii dostali poprvé. Výsledky studie ukázaly u dosud nedialyzovaných pacientů intervenovaných jednou vysokou dávkou Fe (1 g) rychlou normalizaci hodnot Hb (z průměrných 10,7 na 12,0 g/ dl), přičemž hodnota feritinu stoupla jedenáctinásobně a TSAT dvojnásobně. Koncentrace Fe v játrech měřená Ferriscanem přesáhla horní limit u 56 % vyšetřených, což svědčí pro transientní předávkování závislé na jednotlivé dávce intravenózně podaného Fe. V podskupině dialyzovaných pacientů korelovala koncentrace Fe v játrech měřená Ferriscanem pouze s kumulativní dávkou dosud podaného Fe [34].
Z dostupných preparátů Fe k intravenóznímu podávání jsou v České republice k dispozici glukogan sodnoželezitý (Ferrlecit), ferihydroxysacharóza (Venofer) a ferikarboxymaltóza (Ferinject). Jde o dobře tolerovaná léčiva. Nevýhodou prvních dvou je menší stabilita lékové molekuly, což vyžaduje opakovanou intravenózní aplikaci v kratších intervalech a podání menšího množství Fe pro jednu aplikaci. To představuje problém u dosud nedialyzovaných sideropenických pacientů, u nemocných léčených peritoneální dialýzou a pacientů po transplantaci ledvin, protože ambulantní aplikace preparátů s Fe vyžaduje nezbytně logistická opatření, která umožňují zvládnutí nebezpečné anafylaktické reakce, zpravidla se proto léčba sideropenie těmito preparáty řeší hospitalizací. Stabilita komplexu ferikarboxymaltózy umožňuje podání až 1 g i.v. Ve studii FIND ‑ CKD byla porovnána terapie ferikarboxymaltózou a síranu železnatého (podávaného perorálně v dávce 200 mg/ den). Pacienti randomizovaní k intravenózní léčbě se dále dělili na skupinu, u níž bylo dávkování přizpůsobeno dosažení feritinu 100 – 200 µg/ l, a ve druhé skupině byl cílový feritin 400 – 600 µg/ l. Pacienti zařazení do studie měli sideropenickou anémii (Hb < 9 – 11 g/ dl; feritin < 100 µg/ l nebo feritin < 200 µg/ l s poklesem TSAT pod 20 %) a nebyli dosud léčeni preparáty Fe a EPO. Primárním cílem studie bylo posouzení délky doby do nutnosti podání jiné léčby anémie (transfuze, EPO, jiné preparáty Fe) a její porovnání ve všech třech větvích studie. Druhým cílem bylo posouzení efektivity léčby podle úspěšnosti korekce anémie (hodnota Hb). Doba do zahájení jiné terapie anémie byla významně delší (p = 0,026) u skupiny s cílovým feritinem 400 – 600 µg/ l léčených vyššími dávkami ferikarboxymaltózy oproti skupině léčené perorálně. Efektivita léčby daná vzestupem Hb > 1 g/ dl byla statisticky významně vyšší u nemocných s cílovou hodnotou feritinu 400 – 600 µg/ l v porovnání se skupinou s nižší cílovou hodnotou feritinu a perorálně léčené skupiny (p < 0,001). Do nezvratného selhání ledvin progredovalo 2,6 % pacientů a rozložení těchto nemocných bylo stejné ve všech skupinách [35].
Na základě výše uvedených dat lze konstatovat, že z terapie stabilním komplexem ferikarboxymaltózy, která umožňuje podat jednorázově v krátké (15 min trvající) infuzi až 1 g Fe, profitují zejména nemocní se sideropenickou anémií, kteří dosud nejsou dialyzováni, protože léčba je oproti perorálním preparátům efektivnější a přitom jsou intervaly mezi jednotlivými dávkami dlouhé. Pravděpodobně stejný benefit přinese tato léčba pacientům léčeným peritoneální dialýzou a pacientům po transplantaci ledvin. Studie zaměřené na tyto skupiny pacientů porovnávající efektivitu léčby intravenózními a perorálními preparáty Fe však nemáme k dispozici.
Doručeno do redakce: 14. 9. 2014
Přijato po recenzi: 30. 10. 2014
doc. MUDr. Miroslava Horáčková, CSc.
www.fnmotol.cz
horackov@email.cz
Sources
1. Caro J, Brown S, Miller O et al. Erythropoietin levels in uremic nephric an anephric patients. J Lab Clin Med 1979; 93 : 449 – 458.
2. Klener P. Přehled přípravků s erytropoetickopu aktivitou. Remedia 2011; 21 : 265 – 269.
3. Fairbenks VF, Beutler E. Iron metabolism. In: Wiliams Hematology. 5th ed. New York: McGraw ‑ Hill Inc 1995 : 369 – 380.
4. Oates PS, Ahmed U. Molecular regulation of hepatic expression of iron regulatory hormone hepcidin. J Gastroenterol Hepatol 2007; 22 : 1378 – 1387.
5. Weiss G, Goodnough LT. Anemia of chronic disease. N Engl J Med 2005; 352 : 1011 – 1023.
6. Gouliouris T, Aliyu SH, Brown NM. Spondylodiscitis: update on diagnosis and management. J Antimicrob Chemother 2010; 65 (Suppl 3): 11 – 24. doi: 10.1093/ jac/ dkq303.
7. Nidzielska I, Chudek J, Kowol I et al. The odontogenic‑related microinflammation in patients with chronic kidney disease. Ren Fail 2014; 36 : 883 – 888. doi: 10.3109/ 0886022X.2014.894764.
8. Van Wyck DB, Stivelman JC, Ruiz J et al. Iron status in patients receiving erythropoietin for dialysis‑associated anemia. Kidney Int 1989; 35 : 712 – 716.
9. Fishbane S, Mittal SK, Maesaka JK. Beneficial effect of iron therapy in renal failure patients on hemodialysis. Kidney Int Suppl 1999; 69: S67 – S70.
10. Cavill I, MacDougall IC. Erythropoiesis and iron supply in patients treated with erythropoietin. Erythropoiesis 1992; 3 : 50 – 55.
11. Eschbach JW, Egrie JC, Downing MR et al. Correction of the anemia of end‑stage renal disease with recombinant human erythropoietin. N Engl J Med 1987; 316 : 73 – 78.
12. MacDougall IC, Roberts DE, Neubert P et al. Pharmacokinetics of intravenous, intraperitoneal, and subcutaneous recombinant human erythropoietin in patients on CAPD. Contrib Nephrol 1989; 76 : 112 – 121.
13. Singh AK, Szezech L, Tang KL et al. Correction of anemia with epoetin alpha in chronic kidney disease. N Engl J Med 2006; 355 : 2085 – 2098.
14. Drüeke TB, Locatelli T, Clyne N et al. Normalization of hemoglobin level in patients with chronic kidney disease and anemia. N Engl J Med 2006; 355 : 2071 – 2084.
15. Besarab A, Bolton WK, Browne JK et al. The effects of normal as compared with low hematocrit values in patients with cardiac disease who are receiving hemodialysis and epoetin. N Engl J Med 1998; 339 : 584 – 590.
16. National Kidney Foundation. KDOQI Clinical Practice Guideline and Clinical Practice Recommendations for anemia in chronic kidney disease: 2007 update of hemoglobin target. Am J Kidney Dis 2007; 50 : 471 – 530.
17. National Kidney Foundation. KDIGO Clinical Practice Guideline and Clinical Practice Recommendations for anemia in chronic kidney disease. Am J Kidney Dis 2012; 2 : 283 – 287.
18. Fishbane S, Frei GL, Maesaka J. Reduction in recombinant human erythropoietin doses by the use of chronic intravenous iron supplementation. Am J Kidney Dis 1995; 26 : 41 – 46.
19. Sunder ‑ Plassman G, Horl WH. Importance of iron supply for erythropoietin therapy. Nephrol Dial Transplant 1995; 10 : 2070 – 2076.
20. Locatelli F, Bárány P, Covic A et al. Kidney disease: Improving Global Outcome guidelines on anemia management in chronic kidney disease: a European Renal Best Practice position statement. Nephrol Dial Transplant 2013; 28 : 1346 – 1359. doi: 10.1093/ ndt/ gft033.
21. Hallberg L. Bioavailability of dietary iron in man. Annu Rev Nutr 1981; 1 : 123 – 147.
22. Kooistra MP, van Es A, Struyvenberg A et al. Low iron absorption in erythropoietin‑treated Hemodialysis patients. J Am Soc Nephrol 1995; 6 : 543.
23. Donnelly SM, Posen GA, Ali MA. Oral iron absorption in hemodialysis patients treated with erythropoietin. Clin Invest Med 1991; 14 : 271 – 276.
24. Eschbach JW, Cook JD, Finch CA. Iron absorption in chronic renal disease. Clin Sci 1970; 38 : 191 – 196.
25. Schneider W. The fate of iron compounds in the gastrointestinal tract. Arzneimittelforschung 1987; 37 : 92 – 95.
26. Halberg I, Rittinger L, Solvell L. Side effects of oral iron therapy. A double‑blind study of different iron compounds in tablet form. Acta Med Scand Suppl 1966; 459 : 3 – 10.
27. Chertow GM, Mason PD, Vage ‑ Nilsen O et al. Update on adverse events associated with parenteral iron. Nephrol Dial Transplant 2006; 21 : 378 – 382.
28. Moore RA, Gaskell H, Rose P et al. Meta‑analysis of efficacy and safety of intravenous ferric carboxymaltose (Ferinject) from clinical trial and published trial data. BMC Blood Disorders 2011; 11 : 1 – 14. doi: 10.1186/ 1471 ‑ 2326 ‑ 11 ‑ 4.
29. Kalantar ‑ Zadeh K, Lee GH. The fascinating but deceptive ferritin: To measure it or not to measure it in chronic kidney disease? Clin J Am Nephrol 2006; 1 (Suppl 1): S1 – S18.
30. Kalantar Zadeh K, Regidor DL, McAllister CJ et al. Time ‑ dependent association between Fe and mortality in hemodialysis patients. J Am Soc Nephrol 2005; 16 : 3070 – 3080.
31. Bailie GR, Tong L, Li Y et al. Association of intravenous iron dosing with mortality: findings from DOPPS. ASN Kidney Week Abstract 2010. J Am Soc Nephrol 2010; 21: TH ‑ FC041.
32. Kalantar ‑ Zadeh K, Rodriguez RA, Humphreys MH. Association between serum ferritin and measures of inflammation, nutrition and Fe in hemodialysis patients. Nephrol Dial Transplant 2004; 19 : 141 – 149.
33. St Pierre TG, Clark PR, Chua ‑ anusorn W et al. Noninvasive measurement and imaging of liver Fe concentration using proton magnetic resonance. Blood 2005; 105 : 855 – 861.
34. Ferrari P, Kulkarni H, Dheda S et al. Serum iron markers inadequate for guiding iron repletion in chronic kidney disease. Clin J Am Soc Nephrol 2011; 6 : 77 – 83. doi: 10.2215/ CJN.04190510.
35. Macdougal IC, Bock AH, Carrera F et al. FIND ‑ CKD: a randomized trial of intravenous ferric carboxymaltose versus oral iron in patients with chronic kidney disease and iron deficiency anemia. Nephrol Dial Transplant 2014. [In press]
Labels
Paediatric cardiology Internal medicine Cardiac surgery Cardiology
Article was published inCardiology Review

2014 Issue 5-
All articles in this issue
- Ledviny a srdeční selhání
- Léčba anémie a nedostatku železa z pohledu hematologa
- Léčba anémie a nedostatku železa u chronického srdečního selhání
- Léčba sideropenní anémie v gastroenterologii
- Léčba anémie z nedostatku železa z pohledu nefrologa
- Aerobní a specifický trénink nádechových svalů u pacientů s chronickým srdečním selháním – přehledový článek
- Profil nemocných s akutním srdečním selháním léčených v přednemocniční péči
- Ruptura aneuryzmatu nekoronárního Valsalvova sinu jako raritní příčina bolesti na hrudi – kazuistika
- Co nám přináší studie PARADIGM‑HF
- Diagnostika a léčba osteoporózy
- Antifosfolipidový syndrom – diagnostika, manifestace a léčba
- Systémová sklerodermie
- Současné použití biologik v léčbě revmatoidní artritidy
- Nežádoucí účinky biologické léčby v revmatologii
- Srdeční selhání a CHOPN – přehledový článek
- Diabetes mellitus a srdeční selhání
- Cardiology Review
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Léčba anémie a nedostatku železa z pohledu hematologa
- Antifosfolipidový syndrom – diagnostika, manifestace a léčba
- Nežádoucí účinky biologické léčby v revmatologii
- Systémová sklerodermie
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

