-
Medical journals
- Career
Reziduální vaskulární riziko a možnosti jeho ovlivnění
Authors: V. Bláha
Published in: Kardiol Rev Int Med 2012, 14(3): 161-171
Category:
Overview
Reziduálním kardiovaskulárním rizikem rozumíme perzistující reziduální riziko cévní příhody nebo progrese cévního poškození u pacientů, kteří jsou již léčeni podle současných „evidence-based“ postupů, včetně intervence známých rizikových faktorů, jako jsou dyslipidemie, hypertenze, hyperglykemie, zánět, nezdravý životní styl, a včetně intervence rizika nových či nově objevovaných rizikových faktorů, jako jsou snížení HDL-C, zvýšení triglyceridů a apolipoproteinu B, malých denzích LDL a také lipoproteinu (a). Vysoké reziduální riziko je přítomné zejména u pacientů s metabolickým syndromem, diabetes mellitus 2. typu, inzulinorezistencí a abdominální obezitou. V současné době máme důkazy o kauzální asociaci mezi zvýšením lipoproteinů bohatých na triglyceridy a jejich remnant, snížením HDL-C a kardiovaskulárním rizikem. Podkladem jsou data z epidemiologických i intervenčních studií zejména se statiny. Metaanalýza 53 studií s fibráty (16 802 pacientů) a 30 studií s niacinem (4 749 pacientů) prokázala, že průměrné zvýšení HDL-C je o 10 % při léčbě fibráty a o 16 % při léčbě niacinem, snížení triglyceridů o 36 % při léčbě fibráty a o 20 % niacinem a snížení LDL-C o 8 % při léčbě fibráty a o 14 % niacinem. Takové změny lipidogramu vedou ke snížení celkového výskytu významných kardiovaskulárních příhod o 25 % při léčbě fibráty a o 27 % niacinem. Odborné autority předpokládají, že léčba zaměřená na dosažení cílových hodnot při intervenci elevace triglyceridů (≥ 1,7 mmol/l) jako markeru lipoproteinů bohatých na triglyceridy, resp. nízkého HDL-C (< 1,0 mmol/l) je pro pacienty prospěšná. Prvním stupněm v léčbě jsou vždy změny v životním stylu, zhodnocení compliance ve farmakoterapii a vyloučení sekundárních příčin dyslipidemie. Pokud nedosáhneme cíle, kombinujeme léčbu statinem přidáním niacinu nebo fibrátu nebo posilujeme léčbu zaměřenou na snížení LDL-C. Léčba kombinací hypolipidemik spolu se statiny musí zohledňovat bezpečnost a relevantní klinické aspekty, jako jsou riziko zvýšení glykemie, urikemie nebo jaterních enzymů při léčbě niacinem, resp. riziko myopatie, zvýšení kreatininemie a cholelithiasu při léčbě fibráty. Respektování těchto doporučení může významně přispět k podstatnému snížení reziduálního kardiovaskulárního rizika, které zůstává přítomno u pacientů s kardiometabolickými abnormalitami přes dosažení cílových hodnot LDL-C.
Klíčová slova:
reziduální kardiovaskulární riziko – metabolický syndrom – diabetes mellitus 2. typu – aterogenní dyslipidemie – statiny – fibráty – niacinÚvod
Přesto že zaznamenáváme za posledních 25 let podstatné kvalitativní změny v lékařské péči, zůstávají kardiovaskulární onemocnění (KVO) stále jedním z nejpalčivějších problémů současné medicíny. KVO v Evropě odpovídají za prakticky 50 % všech úmrtí a představují ohromnou finanční zátěž vyčíslenou na 192 bilionů eur ročně. Vzhledem ke stoupající incidenci obezity, metabolického syndromu a diabetes mellitus 2. typu (DM2T), očekáváme další eskalaci nákladů spojených s jejich léčbou. Problém se promítá do období finanční krize, která v současné době Evropu sužuje, a vyžaduje snahy o intenzivní řešení. Přístupy, které zahrnují změny životního stylu a farmakoterapii zaměřenou na snížení koncentrace low-density-lipoprotein cholesterolu (LDL-C), léčbu hypertenze a prevenci trombotických příhod, selhávají ve snaze o normalizaci u pacientů s vysokým rizikem (tj. riziko SCORE větší než 5 % pro úmrtí na KVO nebo desetileté Framinghamské rizikové skóre větší než 20 % pro kardiovaskulární příhody) [1]. Riziko rekurence nové příhody se u pacientů s KVO léčených statiny zvyšuje úměrně s vyjádřenými prvky metabolického syndromu [2], což znamená nutnost zaměřit se na další komponenty dyslipidemie kromě LDL-C. Rizikové faktory mohou být ovlivnitelné, což jsou non-LDL-C, dyslipidemie, hypertenze a abdominální obezita, nebo neovlivnitelné, např. věk a pohlaví. Terapeutické intervence zaměřené na ovlivnitelné faktory zcela jasně představují možnost snížení perzistujícího rizika KVO u pacientů, kteří dosáhli optimálního LDL-C. Problematice reziduálního rizika je proto v tuzemské i zahraniční literatuře věnována neutuchající a velká pozornost [3,4]. Post-hoc analýzy prospektivních studií u akutního koronárního syndromu a u stabilní ischemické choroby srdeční dokumentují, že zvýšení plazmatické koncentrace triglyceridů a snížení plazmatické koncentrace high-density lipoprotein cholesterolu (HDL-C) představují vysoké riziko KVO, i když jsme dosáhli cíle LDL-C [5,6]. U pacientů s DM2T studie UKPDS identifikovala HDL-C jako druhý nejdůležitější kardiovaskulární rizikový faktor po LDL-C [7]. Odborná doporučení proto zaměřují stále větší pozornost na koncentraci HDL-C a triglyceridů, zejména u pacientů s vyjádřeným kardiometabolickým rizikem, charakterizovaným souběžným výskytem centrální obezity, inzulinové rezistence, dyslipidemie a hypertenze, současně s rizikem KVO a DM2T.
Holistickou definicí reziduálního kardiovaskulárního rizika (RKVR) rozumíme perzistující reziduální riziko cévní příhody nebo progrese cévního poškození u pacientů, kteří jsou již léčeni podle současných „evidence--based“ postupů, včetně intervence známých rizikových faktorů, jako jsou dyslipidemie, hypertenze, hyperglykemie, zánět, nezdravý životní styl, a intervence rizika nových či nově objevovaných rizikových faktorů [8]. Autoři konceptu poznamenávají, že zatímco standardy postavené na důkazech (evidence-based) de facto reprezentují paradigma, RKVR je dynamický a neustále se vyvíjející koncept, který reflektuje progresivní vývoj, jednotlivé revize a změny v doporučených postupech standardů lékařské péče. Co se týče dyslipidemie, koncept RKVR vychází z poznatků intervenčních studií, zejména se statiny, a je zaměřen na další složky dyslipidemie, zejména na nízké koncentrace HDL-cholesterolu a zvýšené koncentrace triglyceridů.
Lipoproteiny bohaté na triglyceridy a HDL-částice
Lipoproteiny bohaté na triglyceridy a HDL-částice se uplatňují ve všech fázích aterotrombózy, zejména ve spojení se syndromem inzulinové rezistence. Triglyceridy jsou nalačno přenášeny zejména ve formě very-low density lipoproteidů (VLDL) a jejich remnant a postprandiálně ve formě chylomikronů a jejich remnant. Lipoproteiny bohaté na triglyceridy – chylomikrony a VLDL částice – procházejí po resorpci ze střeva (chylomikrony) nebo po uvolnění z jater (VLDL) v plazmě dynamickou remodelací (obr. 1). V důsledku remodelace vzniká celé spektrum poměrně heterogenních částic co do velikosti, hustoty a obsahu lipidů a proteinů. V praxi nemáme k dispozici žádný jednotlivý marker, který by dokázal odlišit remnanty, nově vzniklé chylomikrony, VLDL nebo IDL. Plazmatické triglyceridy tak představují sumu všech triglyceridů, obsaženou v nascentních VLDL a jejich remnantech nalačno, spolu s chylomikrony a jejich remnanty postprandiálně. V současné době již víme, že remodelací chylomikronů a VLDL vznikají aterogenní částice, které jsou důsledkem progresivního obohacení cholesterolem a deplecí o triglyceridy v plazmatickém kompartmentu. Zvýšené koncentrace remnant na triglyceridy bohatých lipoproteinů vedou přímo k formaci plátu a progresi KVO. Na rozdíl od remnant na triglyceridy bohatých lipoproteinů nahlížíme na high-density lipoprotein cholesterol (HDL-C) jako na antiaterogenní a vaskulárně-protektivní lipoprotein. HDL-částice představují vysoce dynamický pool heterogenních látek, které se liší co do složení a obsahu lipidů a proteinů a mají široké spektrum biologických účinků (tab. 1). Klíčovými vlastnostmi HDL je regulace efluxu cholesterolu z buněk, anti-inflamatorní a anti--oxidativní účinky. HDL také přispívá k funkci beta-buněk pankreatu. Z funkčního pohledu je HDL vysoce vaskuloprotektivní. HDL udržuje endoteliální vazoreaktivitu, zeslabuje účinek oxidativního stresu, inhibuje apoptózu buněk endotelu, přispívá k opravě poškození endotelu, inhibuje aktivaci monocytů a redukuje expresi adhezních molekul a výtoků. Veškeré uvedené vlastnosti HDL mají potenciál oslabit klíčové prvky formace aterosklerotického plátu [9].
Image 1. Po vstupu do cirkulace prodělávají chylomikrony (obsahující apo B-48 a tvořené v tenkém střevě) a VLDL (obsahující apo B-100 a tvořené v játrech) lipolýzu za účasti LPL zejména v periferních tkáních (hlavně v tukové tkáni a svalech). K intravaskulární remodelaci na triglyceridy bohatých lipoproteinů dochází za účasti transportních lipidových proteinů (CETP, PLTP) a dalších lipáz (HL a EL) za vzniku remnantních částic. Triglyceridy bohaté lipoproteinové remnanty jsou bohaté na cholesterol a apoE, ale chudé na triglyceridy; jsou katabolizovány převážně v játrech po vazbě na LRP- a LDL-receptor. Triglyceridy bohaté lipoproteinové remnanty přispívají k formaci aterosklerotických plátů buď přímo po penetraci do arteriální stěny na místech se zvýšenou permeabilitou endotelu, nebo pravděpodobně také nepřímo po uvolnění produktů lipolýzy (např. FFA a lysolecithin), které aktivují proinflamatorní signální cesty v buňkách endotelu. 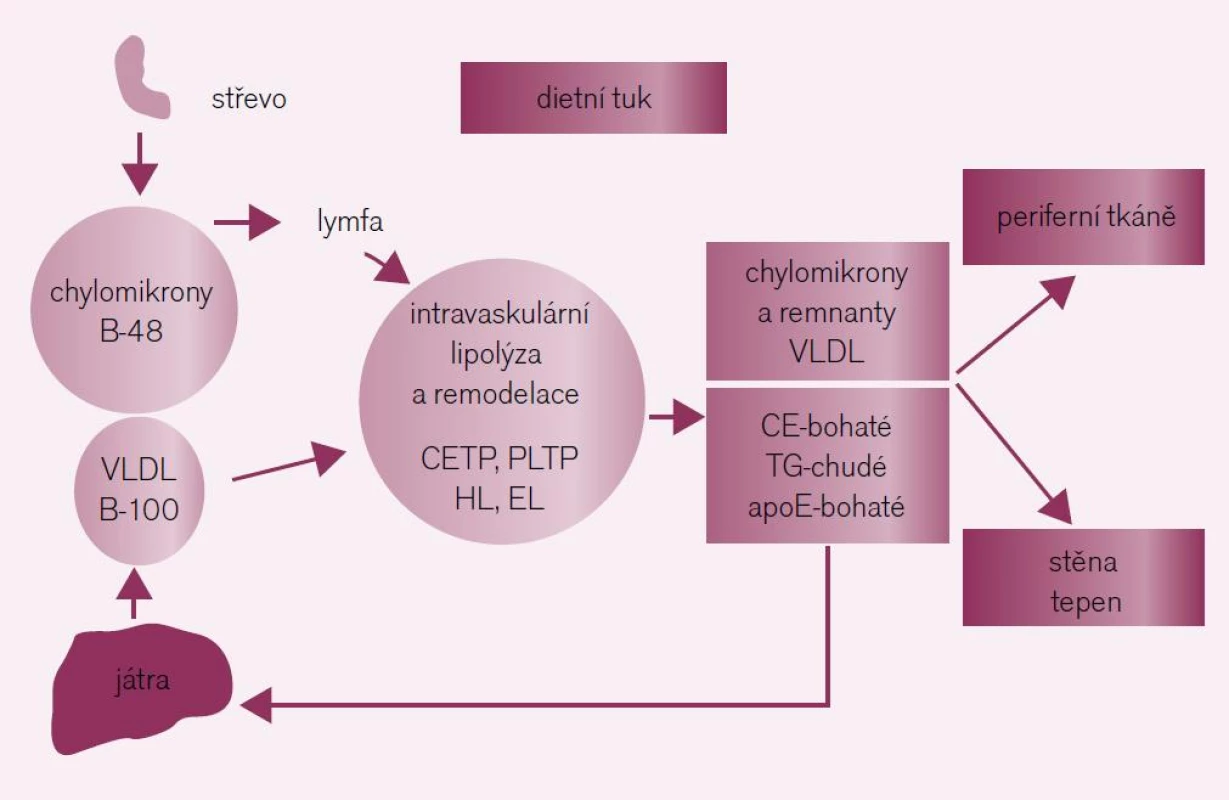
apo – apolipoprotein; CETP – cholesteryl ester transfer protein; EL – endotheliální lipáza; FFA – free fatty acids; HL – hepatální lipáza; LDL – low-density lipoprotein; LPL – lipoproteinová lipáza; LRP – lipoprotein receptor-related protein; PLTP – phospholipid transfer protein; TRL – triglyceride-rich lipoprotein; VLDL – very-low density lipoprotein Table 1. Funkce HDL: relevance k athero/vaskulo-protekci. 
Význam reziduálního kardiovaskulárního rizika
Rozsáhlé observační studie jasně prokázaly, že zvýšení triglyceridů v plazmě (nalačno i postprandiálně) [10] a snížení koncentrace HDL-C v plazmě [11] zvyšují riziko KVO. Robustní důkazy máme z velké metaanalýzy The Emerging Risk Factors Collaboration (ERFC) (obr. 2) [12]. Tato analýza 68 studií zahrnuje 302 430 účastníků bez předcházející anamnézy KVO. HDL-C byl významně asociován s rizikem KVO i po adjustaci na non-HDL-C, triglyceridy a non-lipidové rizikové faktory. Každá jednotlivá jednotka standardní deviace (SD) ve spojení se zvýšením koncentrace HDL-C (0,38 mmol/l) vedla ke snížení rizika ischemické choroby srdeční o 22 %. Projektivní efekt prostupoval napříč různými koncentracemi triglyceridů. Ve vztahu k ischemické chorobě srdeční se non-HDL-C a apoB chovaly obdobně jako HDL-C. Kromě toho byly jak HDL-C, tak non-HDL-C asociovány s ischemickou (nikoliv s hemoragickou) cévní mozkovou příhodou. Koronární riziko se zvyšovalo o 37 % (95% CI 31–42 %) při zvýšení triglyceridů. Vazba byla slabší po adjustaci na HDL-C a vymizela po korekci na non-HDL-C. Triglyceridy nebyly po adjustaci na další lipidové rizikové faktory asociovány s cévní příhodou mozkovou. Lze uzavřít, že zvýšená koncentrace částic bohatých na triglyceridy a remnantů vede ke KVO. Zvýšení koncentrace triglyceridů je markerem zvýšení koncentrace částic bohatých na triglyceridy a je spojeno se zvýšením non-HDL-C a snížením HDL-C. Ve studii Copenhagen City Heart Study (obr. 3) bylo riziko infarktu myokardu, ischemické cévní příhody mozkové a mortality spojeno se zvýšením koncentrace triglyceridů. Vedle LDL-C proto považujeme snížení HDL-C a zvýšení non-HDL-C a triglyceridů za relevantní rizikové faktory KVO [13].
Image 2. <b>Riziko ischemické choroby srdeční a ischemické cévní příhody mozkové – kvantily dle koncentrace triglyceridů, HDL- a non-HDL-cholesterolu.</b> Podle [12]. ![<b>Riziko ischemické choroby srdeční a ischemické cévní příhody mozkové – kvantily dle koncentrace triglyceridů, HDL- a non-HDL-cholesterolu.</b> Podle [12].](https://www.prolekare.cz/media/cache/resolve/media_object_image_small/media/image/b3a0aa899b27ddee29db72a75bbb8ebc.jpg)
Image 3. Vztah koncentrace triglyceridů v plazmě (nelačné) k riziku infarktu myokardu, cévní příhody mozkové a celkového počtu úmrtí (age-adjusted hazard ratio) podle dat z Copenhagen City Heart Study, s následným sledováním za 26–31 let. Podle [13]. ![Vztah koncentrace triglyceridů v plazmě (nelačné) k riziku infarktu myokardu, cévní příhody mozkové a celkového počtu úmrtí (age-adjusted hazard ratio) podle dat z Copenhagen City Heart Study, s následným sledováním za 26–31 let. Podle [13].](https://www.prolekare.cz/media/cache/resolve/media_object_image_small/media/image/5ad7b7a4b5d7e2f7725dd5c8c68138ae.jpg)
Reziduální riziko v intervenčních studiích se statiny
Studie Scandinavian Simvastatin Survival Study (4S) hodnotila pacienty s prokázanou ischemickou chorobou srdeční a zvýšením LDL-C. Léčba simvastatinem vedla k signifikantnímu snížení výskytu KVO; přesto došlo u 20 % léčených nemocných k manifestaci KVO [14]. Signifikantní snížení rizika KVO bylo zaznamenáno také v dalších významných statinových studiích a etablovalo jejich indikaci [15–19]. V následujícím období byly prokázány aditivní přínosy léčby statiny ve vysoké dávce s cílem intenzivního snižování LDL-C u pacientů ve vysokém riziku. Jednalo se o tři studie: Pravastatin or Atorvastatin Evaluation and Infection Therapy-Thrombolysis in Myocardial Infarction 22 (PROVE-IT TIMI), Incremental Decrease in End Points Through Aggressive Lipid Lowering (IDEAL) a Treating to New Targets (TNT). Studie porovnávaly vliv léčby statiny na cílové hodnoty LDL-C 2,6 mmol/l vs intenzivní redukce LDL-C na 1,8 mmol/l pomocí vysoké dávky statinů. Ve všech případech vedla intenzivní léčba 80 mg atorvastatinu denně k významnějšímu snížení rizika KVO, ale i ve větvi s intenzivní léčbou statiny přetrvávalo reziduální kardiovaskulární (KV) riziko: 22,4 % ve studii PROVE-IT TIMI i přes snížení LDL-C na 1,6 mmol/l; 12 % ve studii IDEAL, kde došlo ke snížení LDL-C na 2,1 mmol/l; a 8,7 % ve studii TNT, která doložila snížení LDL-C na 2 mmol/l. Sumárně prokázaly klinické studie se statiny schopnost snížit výskyt hlavních kardiovaskulárních příhod o 21 % na každé snížení LDL-C o 1 mmol/l a tento efekt přetrvával i při snížení LDL-C pod 1,8 mmol/l. I přes agresivní snížení LDL-C však zůstává realitou, že u pacientů s prokázanou ischemickou chorobou srdeční přetrvává reziduální roční riziko 9 % (obr. 4) [15–19].
Image 4. Výskyt reziduálního kardiovaskulárního rizika ve velkých prospektivních studiích s optimální léčbou statiny. 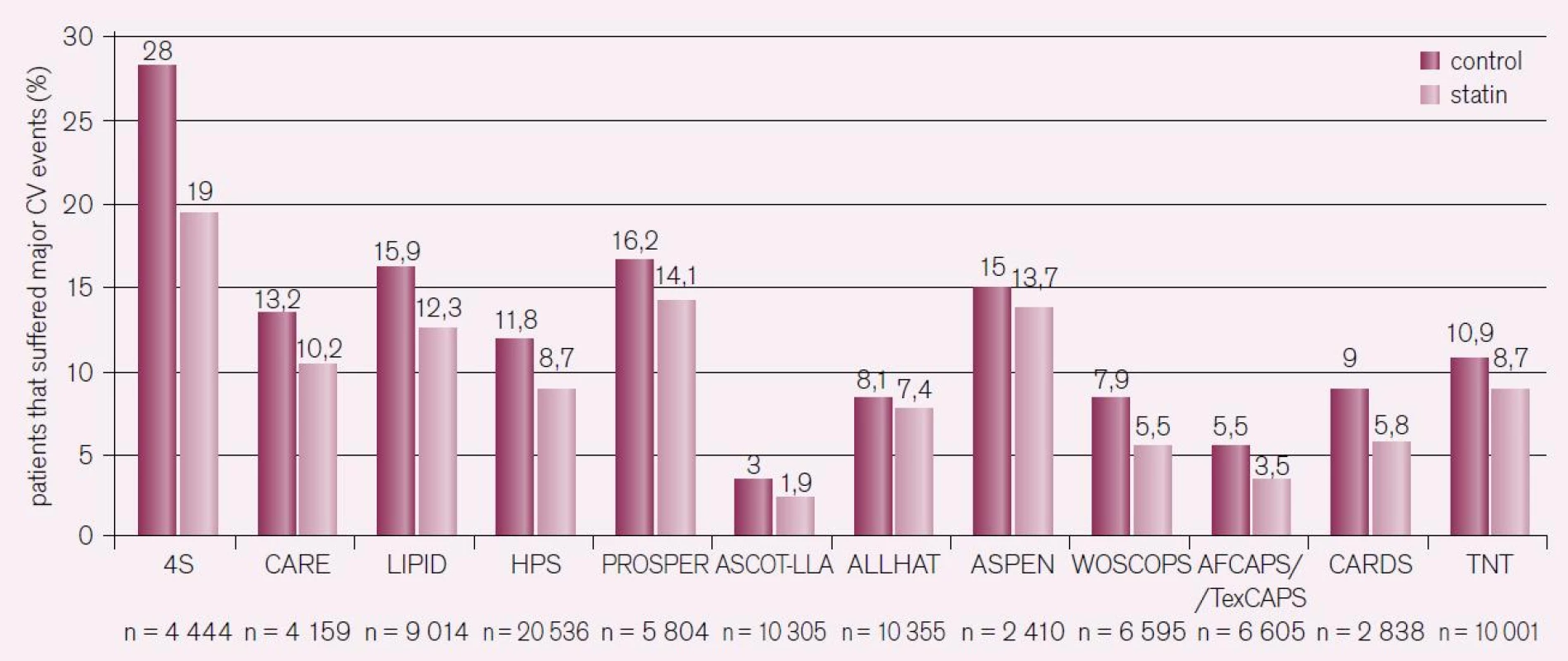
4S – Scandinavian Simvastatin Survival Study; AFCAPS/TexCAPS – Air Force/Texas Coronary Atherosclerosis Prevention Study; ALLHAT-LLT – Antihypertensive and Lipid-Lowering Treatment to Prevent Heart Attack Trial; ASCOT-LLA – Anglo-Scandinavian Cardiac Outcomes Trial-Lipid Lowering Arm; ASPEN – Atorvastatin Study for Prevention of Coronary Heart Disease Endpoints in Non-Insulin-dependent Diabetes Mellitus; CARDS – Collaborative Atorvastatin Diabetes Study; CARE – Cholesterol and Recurrent Events; HPS – Heart Protection Study; LIPID – Long-term Intervention with Pravastatin in Ischaemic Disease; PROSPER – Prospective Study of Pravastatin in the Elderly at Risk; TNT – Treating to New Targets study; WOSCOPS – West of Scotland Coronary Prevention Study Nejenom LDL-C
V poslední době jsme získali řadu poznatků o závislosti KV rizika na dalších lipidových parametrech, zejména na HDL-C a TG. Souběžně s tím se otevírá velký prostor a potenciál k účinnějšímu ovlivnění reziduálního KV rizika u pacientů optimálně léčených statiny pomocí stávajících i nově vyvíjených farmak.
HDL-C
Gordon et al v dnes již historické Framinghamské studii [20] prokázali, že snížení koncentrace HDL-C < 1,03 mmol/l u mužů a < 1,29 mmol/l u žen vede ke zvýšení KV rizika. V jiné práci Gordon et al demonstrovali, že se KV riziko sníží o 2–3 % na každé zvýšení HDL-C o 0,03 mmol/l. Stejné zjištění o vztahu snížení koncentrace HDL-C a KV riziku u mužů i žen potvrdila i řada dalších populačních studií. Proto zahrnula doporučení The National Cholesterol Education Program Adult Treatment Panel III (NCEP-ATP III) [21] nízký HDL-C mezi hlavní nezávislé rizikové faktory a terapeutické cíle KVO. Problém je závažný a nabývá enormních rozměrů, protože prevalence snížení HDL-C v dospělé populaci mužů a žen činí 30–40 %. Recentní metaanalýza 20 randomizovaných kontrolovaných studií, která zahrnula celkem 543 210 paciento-roků následného sledování, popsala, že asociace mezi HDL-C a KV rizikem se během léčby statiny nemění [22]. Vztah mezi koncentrací HDL-C během léčby statiny a KV rizikem je signifikantní, nezávislý na hladině LDL-C během terapie, není také závislý na účinnosti statinu, věku, hypertenzi, diabetes mellitus a užívání tabáku [22]. Post-hoc analýza studie TNT ukázala, že nízká koncentrace HDL předpovídala zvýšení výskytu KV příhod při léčbě 10 mg atorvastatinu, ale tento vztah byl oslaben při léčbě 80 mg atorvastatinu. V téže studii byla však vyhodnocena i podskupina pacientů, kteří dosáhli při léčbě koncentrace LDL < 1,8 mmol/l (průměrná hodnota LDL byla 1,5 mmol/l), a byl zaznamenám zvýšený výskyt KV příhod tam, kde byla koncentrace HDL < 1,1 mmol/l. Význam nízké hodnoty HDL v predikci KV příhod popsaly i další studie – PROVE-IT a Justification for the Use of Statins in Primary Prevention: an International Trial Evaluating Rosuvastatin (JUPITER) [23]. Také zde byl dosažen při léčbě statiny LDL < 1,8 mmol/l. Na základě výše uvedeného se oprávněně domníváme, že u pacientů na optimální léčbě statiny přispívá snížení HDL-C podstatnou měrou k reziduálnímu KV riziku. K ovlivnění HDL-C přispívají také změny životního stylu, jako jsou vynechání kouření, redukce hmotnosti a dietní režim a aerobní cvičení.
Mezi farmaka, která zvyšují HDL-C, patří fibráty, niacin a další vyvíjené přípravky, jako jsou apoA-I mimetika, stimulancia exprese apolipoproteinu (apo)A-1 (RVX208) a cholesteryl ester transfer protein (CETP) inhibitory, např. anacetrapib a dalcetrapib. Využití těchto léků má však i svá úskalí. První známý CETP inhibitor, torcetrapib, neprokázal ve studii Investigation of Lipid Level Management to Understand its Impact in Atherosclerotic Events (ILLUMINATE) snížení KV rizika a dokonce vedl ke zvýšení výskytu KVO – proto byla také studie po deseti měsících předčasně ukončena. Zvýšení výskytu KV příhod při léčbě torcetrapibem bylo vyvoláno „off-target“ účinky, tj. zvýšením krevního tlaku a aldosteronu, a elektrolytovou dysbalancí. Anacetrapib a dalcetrapib tyto účinky nemají; klinické studie s anacetrapibem (REVEAL [Randomized Evaluation of the Effects of Anacetrapib through Lipid modification]) a dalcetrapibem dosud probíhají.
Niacin patří mezi etablovaná farmaka k léčbě dyslipidemie, zejména pro efektivní zvýšení HDL-C. Monoterapie niacinem podle recentní metaanalýzy prokazuje schopnost snížit výskyt KV příhod (obr. 5a, b) [24]. Kombinovaná léčba niacinu se statinem navozuje regresi aterosklerózy. Niacin je proto významným kandidátem v léčbě reziduálního rizika u pacientů s nízkým HDL-C při léčbě statiny. Význam lékové formy s prodlouženým uvolňováním (extended release) niacinu a schopnost niacinu snižovat reziduální KV riziko v kombinované léčbě se statiny u pacientů v sekundární prevenci, kde bylo dosaženo optimálního LDL-C, ale kde přetrvává snížení HDL-C, byl recentně zpochybněn předčasným ukončením studie Atherothrombosis Intervention in Metabolic Syndrome with Low HDL-C/High Triglyceride and Impact on Global Health Outcomes (AIM-HIGH) pro nedostatečný benefit terapie. Ve studii AIM-HIGH bylo léčeno 3 414 pacientů s aterosklerotickým KVO, sníženým HDL-C a zvýšením TG pomocí simvastatinu a randomizovaně buď vysokou dávkou (2 000 mg/d) extended-release niacinu (n = 1 718), nebo placebem (n = 1 696). K tomu dostávalo 515 pacientů inhibitor absorpce cholesterolu ezetimib s cílem udržet hladinu LDL-C mezi 1,03 a 2,07 mmol/l. Vstupní průměrná hodnota lipidů činila u 94 % pacientů při léčbě statinem LDL-C 1,82 mmol/l, HDL-C 0,91 mmol/l a TG 1,8 mmol/l. Ve světle těchto hodnot výsledky studie AIM-HIGH naznačují, že aditivní léčba niacinem nepřináší populaci s dobrou kontrolou LDL-C pomocí simvastatinu během tříletého sledování další prospěch. Lze diskutovat o tom, zda může trvat déle než tři roky, abychom mohli prokázat, že u pacientů s nízkou hodnotou LDL-C povede zvýšení HDL-C pomocí niacinu k prokazatelnému efektu. Uvádíme tato fakta proto, že benefit léčby niacinem na významné KV příhody byl ve studii Coronary Drug Project zaznamenán ve follow-up studii po 15 letech. Bylo by také zajímavé analyzovat, jaký byl vliv léčby niacinem u pacientů se signifikantní hypertriglyceridemií nebo se zvýšením lipoproteinu (a), ačkoliv relativně malý počet sledovaných jedinců ve studii AIM-HIGH může představovat určitou limitaci při výpočtu statistické významnosti v rámci analýzy podskupin. Pro bližší objasnění účinku niacinu a jeho vlivu na reziduální KV riziko při současné léčbě statiny nicméně budeme muset počkat na analýzu podskupin ve studii AIM-HIGH a také na ukončení větší mezinárodní studie s vyšší dávkou extended--release niacinu (HPS2-THRIVE: The Heart Protection Study 2 Treatment of HDL-C to Reduce the Incidence of Vascular Events).
Obr. 5a. Souhrn výsledků metaanalýzy klinický příhod při kombinované léčbě s niacinem. 
(A) významné koronární příhody; (B) cévní mozková příhoda; (C) jakákoli kardiovaskulární příhoda. OR – odds ratio. Podle [24]. Obr. 5b. Souhrn výsledků metaanalýzy koronárních příhod při kombinované léčbě s niacinem. A) koronární stenóza; (B) frekvence regrese; (C) frekvence progrese. RR – relativní riziko. Podle [24]. ![Obr. 5b. Souhrn výsledků metaanalýzy koronárních příhod při kombinované léčbě s niacinem.
A) koronární stenóza; (B) frekvence regrese; (C) frekvence progrese. RR – relativní riziko. Podle [24].](https://pl-master.mdcdn.cz/media/image/e235b28ddf1480b2cc6f156780776254.jpg?version=1537790365)
Nízká hladina HDL-C je dle dostupných klinických a epidemiologických dat asociována s KV rizikem; proto je znepokojivé, že dosavadní snahy o modulaci hladin HDL-C nevedly ke snížení reziduálního KV rizika. Pokud vyjdeme z našich novějších znalostí o významu funkcí HDL-C, které ovlivňují KV riziko nezávisle na koncentraci HDL-C [25], je možné, že právě heterogenita funkcí HDL-C ve sledovaných populacích vedla k takovým výsledkům. Lze také spekulovat o tom, že změny koncentrací HDL navozené farmakologicky nejsou spojeny se stejnou funkční integritou jako zvýšení HDL-C při změně životního stylu. Východiskem by zde bylo vyvinutí a uplatnění metodik k hodnocení klinické funkce HDL-C při aplikaci farmak zaměřených na ovlivnění HDL-C v populaci s vysokým reziduálním rizikem.
TG a non-HDL-C
Vzájemný vztah mezi zvýšením TG a KV rizikem popsala řada studií. Příkladem je metaanalýza dat zahrnující celkem 262 525 pa-cientů v 29 prospektivních studiích, která uvedla, že koncentrace TG je silným a nezávislým prediktorem KV rizika [26]. Sarwar et al [26] shrnují, že asociace mezi zvýšením TG a KV rizikem není závislá na délce follow-up, pohlaví nebo lačnění. Adjustace na hladiny HDL-C částečně zeslabují, ale neeliminují sílu asociace mezi zvýšením TG a KV rizikem [26]. Metaanalýza Sarwara et al [26] předcházela ukončení studie PROVE-IT-TIMI 22. Analýza dat z této studie potvrdila, že hladiny TG, nezávisle na koncentraci LDL-C, mají zcela zásadní vliv na osud pacientů s akutním koronárním syndromem. U pacientů léčených statinem, kde byla hladina TG při léčbě < 1,7 mmol/l, bylo nižší KV riziko nezávisle na koncentraci LDL-C. Prospěch ze snížení LDL-C na hodnoty < 1,8 mmol/l byl nejvyšší právě u těch pacientů, kteří měli hladiny TG < 1,7 mmol/l. Limitujícím faktorem, který brání zhodnocení dopadu léčby zaměřené na snižování TG na KV příhody, je fakt, že žádná velká prospektivní studie nezahrnovala pacienty se středně významnou či vysokou hypertriglyceridemií – takoví pacienti byli ze studií se statiny a fibráty vyloučeni.
Deriváty kyseliny fibrové jsou velice efektivní ve snižování TG, středně účinné při zvyšování HDL-C, ale mají jen omezený vliv na snížení LDL-C. Gemfibrozil byl efektivní jak v primární, tak v sekundární redukci KV rizika. Ve studii Veterans Affairs High-Density Lipoprotein Cholesterol Intervention Trial (VA-HIT) byla léčba gemfibrozilem účinná ve snížení KV příhod v terénu nevýznamných hladin LDL-C (bazální LDL-C 2,8 mmol/l). Naproti tomu ve dvou velkých studiích s fenofibrátem u pacientů s diabetes mellitus 2. typu nebylo prokázáno významné snížení KV příhod. Ve studii Fenofibrate Intervention and Event Lowering in Diabetes (FIELD) bylo randomizováno 9 795 diabetiků s průměrnou hodnotou TG 1,75 mmol/l, HDL-C 1,14 mmol/l a LDL-C 3,1 mmol/l k léčbě placebem nebo fenofibrátem po dobu pěti let a primární kombinovaný cíl kardiovaskulárního rizika nebyl významně ovlivněn [27]. Vyšší počet nemocných léčených statiny v placebové skupině (17 % vs 8 %) mohl benefit léčby fenofibrátem falešně maskovat. FIELD nicméně prokázala bezpečnost léčby kombinační léčbou (fibrát + statin) [27]. Post-hoc analýzy dat ze studie FIELD navíc prokázaly, že u pacientů se zvýšením TG (> 2,3 mmol/l) nebo snížením HDL-C (< 1,03 mmol/l u mužů a < 1,29 mmol/l u žen) dochází při léčbě fenofibrátem k podstatně vyšší redukci KV rizika. Úspěšnost a bezpečnost kombinované léčby statin a fibrát hodnotila také studie Action to Control Cardiovascular Risk in Diabetes Lipid Trial (ACCORD Lipid), která neprokázala žádný vliv na primární složené cíle (nonfatální infarkt myokardu, nonfatální cévní příhoda mozková nebo KV smrt) při léčbě fenofibrátem současně se simvastatinem; nicméně byl zaznamenán všeobecný trend ke zvýšení rizika u žen oproti mužům [28]. Je také nutné zmínit, že při analýze předem specifikovaných podskupin byl prokázán trend k pozitivnímu vlivu léčby fenofibrátem u pacientů s elevací TG ≥ 2,30 mmol/l nebo HDL-C ≤ 0,88 mmol/l [28]. Post-hoc analýzy studií s fibráty prokázaly mimochodem také snížení ve výskytu KV příhod v podskupinách pacientů s metabolickým syndromem, včetně nadváhy, u nemocných se zvýšením TG a snížením HDL-C. Hypotéza, že léčba fibráty vede u pacientů s diabetes mellitus 2. typu s elevací TG a nízkým HDL-C ke snížení reziduálního KV rizika, nebyla ale dosud adekvátně prokázána a k jejímu objasnění by bylo nutné postavit a realizovat velkou prospektivní KV studii.
Non-HDL-C predikuje KV riziko a koreluje s většinou lipidových parametrů spojených s KV rizikem. Důkazy pro vzájemnou vazbu non-HDL-C a KV rizika prokazují epidemiologická data Liu et al [29]. Autoři analyzovali data od 2 693 mužů a 3 101 žen z kohorty Framinghamské studie a popsali silnou asociaci mezi non-HDL-C a KV rizikem napříč spektrem hladin LDL-C [29]. V této studii byl non-HDL-C silnějším prediktorem KV rizika než LDL-C, a to nezávisle na tom, zda byla koncentrace TG < 2,3 mmol/l nebo > 2,3 mmol/l. Systematická analýza studií u pacientů s aterogenní dyslipidemií (HDL-C < 1,03 mmol/l nebo TG > 2,3 mmol/l) v šesti randomizovaných kontrolovaných studiích u 7 389 pacientů prokázala, že u pacientů s elevací TG vedla léčba fibráty ke snížení KV příhod (RR 0,75, 95% CI 0,65–0,86, p < 0,001); a obdobně u 5 068 jedinců s kombinací zvýšení TG a snížení HDL-C (RR 0,71, 95% CI 0,62–0,82, p < 0,001). Menší, ale signifikantní prospěch z léčby mělo 15 303 pacientů s izolovaným snížením HDL-C (RR 0,84, 95% CI 0,77–0,91, p < 0,001). U 9 872 pacientů bez elevace TG nebo bez snížení HDL-C nevedla léčba fibráty k signifikantnímu snížení KV příhod (RR 0,96, 95% CI 0,85–1,09, p = 0,53) (obr. 6) [30].
Image 5. Systematická analýza studií u pacientů s aterogenní dyslipidemií (HDL-C < 1,03 mmol/l nebo TG > 2,3 mmol/l). 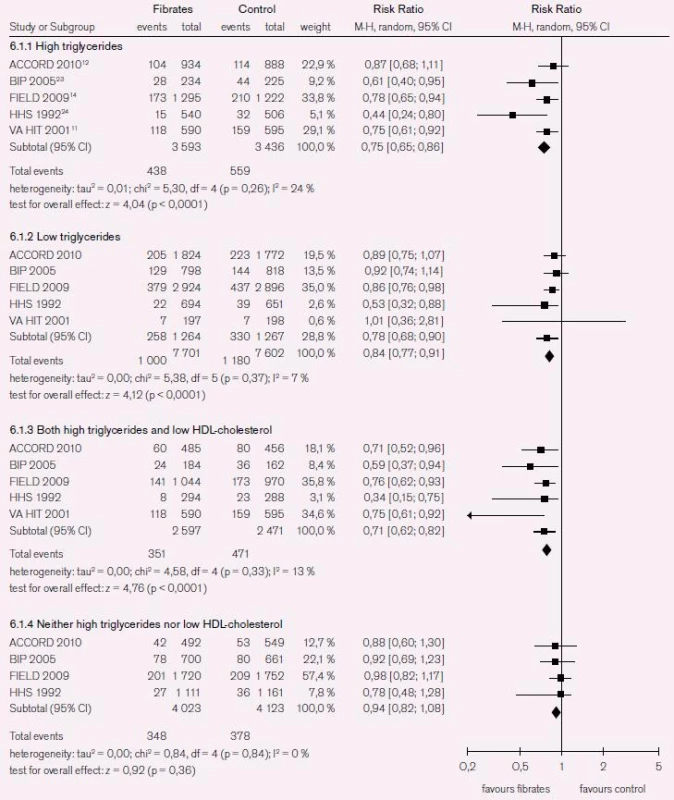
Recentní data ze studie INTERHEART prokázala, že poměr apoB/apoA-I významně asociuje s rizikem infarktu myokardu, zejména u pacientů s diabetem 2. typu a metabolickým syndromem. Reziduální KV riziko bylo při léčbě statiny vysoké zejména u diabetiků. Kearney et al [31] v metaanalýze dat 18 686 pacientů s diabetem ze 14 randomizovaných statinových studií popsali 9% proporcionální snížení celkové mortality při snížení LDL-C o 1 mmol/l u diabetiků (rate ratio [RR] 0,91; 99% CI 0,82–1,01; p = 0,02), a obdobně o 13 % u nediabetiků (RR 0,87; 99% CI 0,82–0,92; p < 0,0001). Reziduální KV riziko bylo však u diabetiků léčených statiny vyšší než u nediabetiků randomizovaných k léčbě placebem [31].
Nejenom lipidy
V současné době považujeme aterosklerózu za stav spojený s chronickým zánětem. Víme také, že nezávisle na hladině lipidů má subklinický systémový zánět, určený elevací high-sensitivity C reaktivního proteinu (hsCRP), lepší prognózu při léčbě statiny [32]. Studie JUPITER prokázala, že zánět a jeho ovlivnění mají zásadní vliv na benefit statinů v léčbě populace s normální koncentrací LDL-C, ale s elevací hsCRP [32]. Nové poznatky potvrzují dřívější zjištění, že i další lipidové parametry, např. poměr cholesterol/HDL-C, závisí na kombinaci s CRP (88). Podobné studie podporují etiopatogenetický význam chronického zánětu jako unifikujícího prvku hypotézy aterosklerotických kardiovaskulárních onemocnění. Vliv chronického zánětu na vznik a průběh KVO je předmětem zahájené studie Cardiovascular Inflammation Reduction Trial (CIRT), která má za cíl sledovat 7 000 pacientů se stabilní ischemickou chorobou srdeční a perzistující elevací hsCRP, kteří budou léčeni placebem oproti nízkodávkovanému metotrexátu (10 mg) (rutinně užívané protizánětlivé farmakum snižující tumor necrosis factor α, interleukin-6 a C reaktivní protein) [33].
Změny v životním stylu
Přesto že některé recentní studie s klasickými či novými hypolipidemiky s cílem ovlivnit HDL-C nebo TG nepřinesly zásadní poznatky či byly dokonce předmětem rozčarování, je třeba si uvědomit, že u celé řady pacientů, u kterých zjistíme zvýšení TG a snížení HDL-C, může intervence životního stylu přinést zcela zásadní změnu. Vynechání kouření vedle všeobecného pozitivního vlivu na snížení KV rizika vede ke zvýšení HDL-C o 0,1 mmol/l a přibližuje HDL-C na hodnoty nekuřáků. Další změny životního stylu, které doporučujeme pacientům, jsou redukce nadváhy, změny diety a zvýšení fyzické aktivity. Snížení hmotnosti o 10 kg může vést ke zvýšení HDL-C až o 20 %. Dieta bohatá na ovoce, zeleninu, nízkotučné mléčné výrobky a snížený obsah jednoduchých cukrů a snížený obsah jak celkového, tak saturovaného tuku vedou ke snížení krevního tlaku, LDL-C a zvyšují HDL-C. Aerobní fyzická aktivita, jako např. rychlá chůze alespoň 30 min denně více než tři dny v týdnu sníží krevní tlak o 4–9 mmHg a zvýší HDL-C o 5–10 %.
Závěr
Léčba statiny, která je spojena s redukcí koncentrace cholesterolu a snížením zánětlivé aktivity, má nepochybný význam v ovlivnění KV morbidity a mortality a je nedílným základem současných doporučení v primární i sekundární prevenci aterosklerotických KV onemocnění. Reziduální KV riziko představuje závažný problém, jehož uchopením lze dosáhnout zlepšení prognózy našich pacientů. Jedním z přístupů v léčbě reziduálního KV rizika je snaha intervenovat nízký HDL-C a vysoké koncentrace TG. S cílem ovlivnit hladiny HDL-C a TG pomocí farmakologické léčby, ať už zavedenými či novými hypolipidemiky, byla uspořádána do současné doby řada i dlouhodobých studií se statiny v kombinaci s niacinem nebo fibráty. V obou případech jsme se setkali s jistým stupněm zklamání, jehož podkladem může být jak komplexita HDL-C a TG jako biomarkerů KVO, tak i design takových klinických studií – zejména při uplatnění reziduálního KV rizika. Recentní předčasné ukončení studie AIM-HIGH z důvodu nedostatečného benefitu nám v současné chvíli nedovoluje učinit bližší závěry o prospěšnosti kombinované farmakoterapie dyslipidemie a budeme nuceni vyčkat prezentace dosud nepublikované detailní analýzy a zejména výsledků studie HPS2-THRIVE, velké mezinárodní studie s vysokou dávkou extended-release niacinu v populaci s různou koncentrací HDL-C. Velké studie s fibráty, které analyzovaly vliv takové léčby v podskupinách pacientů se zvýšením TG a snížením HDL-C, prokázaly snížení KV příhod u jedinců s rysy metabolického syndromu nebo s diabetem a vytvořily východisko k organizaci velké prospektivní studie s kombinací statin a fibrát v populaci s diabetes mellitus 2. typu nebo metabolickým syndromem a současně se signifikantní hypertriglyceridemií a snížením HDL-C cholesterolu. Do té doby představuje intervence na úrovni životního stylu prokazatelný a dostupný účinný prostředek k ovlivnění reziduálního rizika u pacientů léčených statiny, který byl, je a zůstává základem terapie dyslipidemie jedinců s reziduálním KV rizikem.
Práce byla podpořena projekty IGA MZ ČR NT/12287-5 a projektem Univerzity Karlovy PRVOUK P37/12.
Doručeno do redakce 4. 7. 2012
Přijato po recenzi 30. 7. 2012
prof. MUDr. Vladimír Bláha, CSc.
Klinika gerontologická a metabolická
LF UK a FN Hradec Králové
blaha@lfhk.cuni.cz
Sources
1. Grundy SM, Cleeman JI, Merz CN et al. Coordinating Committee of the National Cholesterol Education Program. Implications of recent clinical trials for the National Cholesterol Education Program Adult Treatment Panel III Guidelines. Arterioscler Thromb Vasc Biol 2004; 24: e149–e161.
2. Deedwania P, Barter P, Carmena R et al. Treating to New Targets Investigators. Reduction of low-density lipoprotein cholesterol in patients with coronary heart disease and metabolic syndrome: analysis of the Treating to New Targets study. Lancet 2006; 368 : 919–928.
3. Soška V. Reziduální riziko kardiovaskulárních komplikací a jeho snížení kombinací hypolipidemiky. Vnitř Lék 2011; 57 : 313–316.
4. Chapman MJ, Ginsberg HN, Amarenco P et al. Triglyceride-rich lipoproteins and high-density lipoprotein cholesterol in patients at high risk of cardiovascular disease: evidence and guidance for management. Eu Heart J 2011; 32 : 1345–1361.
5. Miller M, Cannon CP, Murphy SA et al. Impact of triglyceride levels beyond low-density lipoproteid cholesterol after acute coronary syndrome in the PROVE IT--TIMI 22 trial. J Am Coll Cardiol 2008; 51 : 724–730.
6. Barter P, Gotto AM, LaRosa JC et al. Treating to New Targets Investigators. HDL cholesterol, very low levels of LDL cholesterol, and cardiovascular events. N Engl J Med 2007; 357 : 1301–1310.
7. Turner RC, Millns H, Neil HA et al. Risk factors for coronary artery disease in non-insulin dependent diabetes mellitus: United Kingdom Prospective Diabetes Study (UKPDS: 23). BMJ 1998; 316 : 823–828.
8. Hermans MP, Fruchart JC. Reducing Residual Vascular Risk in Patients with Atherogenic Dyslipidemia: Where do we go from here? Clin Lipidology 2010; 5 : 811–826.
9. Rye KA, Bursill CA, Lambert G et al. The metabolism and antiatherogenic properties of HDL. J Lipid Res 2009; 50 (Suppl): S195–S200.
10. Austin MA. Plasma triglyceride and coronary heart disease. Arterioscler Tromb 1991; 11 : 2–14.
11. Gordon DJ, Probstfield JL, Garrison RJ et al. High-density lipoprotein cholesterol and cardiovascular disease. Four prospective American studies. Circulation 1989; 79 : 8–15.
12. Di Angelantonio E, Sarwar N, Perry P et al. Emerging Risk Factors Collaboration. Major lipids, apolipoproteins, and risk of vascular disease. JAMA 2009; 302 : 1993–2000.
13. Nordestgaard BG, Benn M, Schnohr P et al. Non--fasting triglycerides and risk of myocardial infarction, ischemic heart disease, and death in men and women. JAMA 2007; 298 : 299–308.
14. Randomised trial of cholesterol lowering in 4444 patients with coronary heart disease: the Scandinavian Simvastatin Surfoval Study (4S). Lancet 1994; 344 : 1383–1389.
15. Prevention of cardiovascular events and death with pravastatin in patients with coronary heart disease and a broad range of initial cholesterol levels. The Long-Term Intervention with Pravastatin in Ischaemic Disease (LIPID) Study Group. N Engl J Med 1998; 339 : 1349–1357.
16. Heart Protection Study Collaborative Group. MRC/BHF Heart Protection Study of cholesterol lowering with simvastatin in 20,536 high-risk individuals: a randomised placebo-controlled trial. Lancet 2002; 360 : 7–22.
17. Downs JR, Clearfield M, Weis S et al. Primary prevention of acute coronary events with lovastatin in men and women with average cholesterol levels: results of AFCAPS/TexCAPS. Air Force/Texas Coronary Atherosclerosis Prevention Study. JAMA 1998; 279 : 1615–1622.
18. Sacks FM, Pfeffer MA, Moye LA et al. The effect of pravastatin on coronary events after myocardial infarction in patients with average cholesterol levels. Cholesterol and Recurrent Events Trial investigators. N Engl J Med 1996; 335 : 1001–1009.
19. Shepherd J, Cobbe SM, Ford I et al. Prevention of coronary heart disease with pravastatin in men with hypercholesterolemia. West of Scotland Coronary Prevention Study Group. N Engl J Med 1995; 333 : 1301–1307.
20. Gordon T, Castelli WP, Hjortland MC et al. High--density lipoprotein as a protective factor against coronary heart disease. The Framingham Study. Am J Med 1977; 62 : 707–714.
21. Executive Summary of The Third Report of The National Cholesterol Education Program (NCEP) Expert Panel on Detection, Evaluation, And Treatment of High Blood Cholesterol In Adults (Adult Treatment Panel III). JAMA 2001; 285 : 2486–2497.
22. Jafri H, Alsheikh-Ali AA, Karas RH. Meta-analysis: statin therapy does not alter the association between low levels of high-density lipoprotein cholesterol and increased cardiovascular risk. Ann Intern Med 2010; 153 : 800–808.
23. Ridker PM, Genest J, Boekholdt SM et al. HDL cholesterol and residual risk of first cardiovascular events after treatment with potent statin therapy: an analysis from the JUPITER trial. Lancet 2010; 376 : 333–339.
24. Bruckert E, Labreuche J, Amarenco P. Meta-analysis of the effect of nicotinic acid alone or in combination on cardiovascular events and atherosclerosis. Atherosclerosis 2010; 210 : 353–361.
25. Khera AV, Cuchel M, de la Llera-Moya M et al. Cholesterol efflux capacity, high-density lipoprotein function, and atherosclerosis. N Engl J Med 2011; 364 : 127–135.
26. Sarwar N, Danesh J, Eiriksdottir G et al. Triglycerides and the risk of coronary heart disease: 10,158 incident cases aminy 262,525 participants in 29 Western prospective studies. Circulation 2007; 115 : 450–458.
27. Keech A, Simes RJ, Barter P et al. Effects of long--term fenofibrate therapy on cardiovascular events in 9,795 people with type 2 diabetes mellitus (the FIELD study): randomised controlled trial. Lancet 2005; 366 : 1849–1861.
28. Ginsberg HN, Elam MB, Lovato LC et al. ACCORD Study Group. Effects of combination lipid therapy in type 2 diabetes mellitus. N Engl J Med 2010; 362 : 1563–1574.
29. Liu J, Sempos CT, Donahue RP et al. Non--high-density lipoprotein and very-low-density lipoprotein cholesterol and their risk predictive values in coronary heart disease. Am J Cardiol 2006; 98 : 1363–1368.
30. Lee M, Saver JL, Towfighi A et al. Efficacy of fibrates for cardiovascular risk reduction in persons with atherogenic dyslipidemia: a meta-analysis. Atherosclerosis 2011; 217 : 492–498.
31. Kearney PM, Blackwell L, Collins R et al. Cholesterol Treatment Trialists’ (CTT) Collaborators. Efficacy of cholesterol-lowering therapy in 18,686 people with diabetes in 14 randomised trials of statins: a meta-analysis. Lancet 2008; 371 : 117–125.
32. Ridker PM, Danielson E, Fonseca FA et al. Reduction in C-reactive protein and LDL cholesterol and cardiovascular event rates after initiation of rosuvastatin: a prospective study of the JUPITER trial. Lancet 2009; 373 : 1175–1182.
33. Ridker PM. Testing the inflammatory hypothesis of atherothrombosis: scientific rationale for the cardiovascular inflammation reduction trial (CIRT). J Thromb Haemost 2009; 7 (Suppl 1): 332–339.
Labels
Paediatric cardiology Internal medicine Cardiac surgery Cardiology
Article was published inCardiology Review

2012 Issue 3-
All articles in this issue
- Antidiabetika a kardiovaskulární riziko – dříve a nyní
- Význam stanovení apolipoproteinů B a A-1 pro klinickou praxi
- Reziduální vaskulární riziko a možnosti jeho ovlivnění
- Zítřky lipidy modifikující terapie – jaké budou?
- Náhlá smrt v kardiologii
- Hypertriglyceridemie a kardiovaskulární riziko
- Troponin jako prognostický rizikový faktor u pacientů hospitalizovaných pro akutní dekompenzaci chronického systolického srdečního selhání
- Léčba levosimendanem: up-date 2012
- Ticagrelor u pacientů s akutním koronárním syndromem
-
Antitrombotica v prevenci cévní mozkové příhody
1. část – Význam protidestičkové léčby - Renální denervace a její postavení v léčbě rezistentní hypertenze
- Mitrální stenóza v terminální fázi – kazuistika
- Cardiology Review
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Význam stanovení apolipoproteinů B a A-1 pro klinickou praxi
- Ticagrelor u pacientů s akutním koronárním syndromem
- Hypertriglyceridemie a kardiovaskulární riziko
- Troponin jako prognostický rizikový faktor u pacientů hospitalizovaných pro akutní dekompenzaci chronického systolického srdečního selhání
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

