-
Medical journals
- Career
Malá aneuryzmata břišní aorty – blíží se čas změny našich postupů?
Authors: P. Vařejka; A. Linhart
Published in: Kardiol Rev Int Med 2010, 12(4): 171-174
Category: Angiological Symposium
Overview
Aneuryzma břišní aorty je závažným cévním onemocněním s typickým výskytem ve skupině mužů nad 60 let s anamnézou aktivního kouření. Pro svého nositele je nebezpečné pro možnost ruptury, která je v 90 % pro pacienta smrtící. V současné době panuje shoda v indikacích aneuryzmat břišní aorty k chirurgickému nebo endovaskulárnímu výkonu s maximálním průměrem 55 mm a více. U aneuryzmat menších rozměrů se spíše volí konzervativnější přístup s načasováním chirurgického výkonu až do doby dosažení velikosti 55 mm nebo je-li rychlost zvětšování vaku aneuryzmatu 1 cm za 12 měsíců. Uvedený postup vychází z důkazů randomizovaných studií, které jako léčebnou eventualitu používaly pouze otevřený chirurgický výkon. V současné době rozmachu endovaskulárních technik v léčbě těchto nemocných, které jsou zatíženy nižším procentem procedurálních komplikací, je možné, že pacienti i s menším průměrem aneuryzmatu mohou profitovat z časného výkonu.
Klíčová slova:
aneuryzma břišní aorty – stentgraft – otevřená operaceÚvod
Aneuryzma je původem řecké slovo a znamená „rozšíření“. V současné době se tento termín používá pro označení lokalizovaného rozšíření přesahující o více než 50 % předpokládaný průměr dané tepny v dané úrovni. Jako ectazii označujeme rozšíření, které nedosahuje 50 % předpokládaného průměru. Průměr tepny je ovlivněn věkem, pohlavím, celkovým vzrůstem a dalšími faktory. Pokud rozšíření tepny postihuje její celou délku, nejedná se tedy jen o její segment, hovoříme o arteriomegalii.
Pro zjednodušení je aneuryzmatem abdominální aorty (AAA) označováno lokalizované rozšíření břišní aorty na ≤ 3 cm. Normální průměr aorty postupně klesá z asi 28 mm v oblasti ascendentní aorty na asi 20 mm v oblasti infrarenální aorty. U žen je průměr aorty ještě asi o 2 mm menší.
Aneuryzma břišní aorty poprvé popsal v 16. století anatom Vesalius [1]. Trvalo ovšem ještě několik století, než moderní cévní chirurgie dokázala nalézt účinné metody řešení tohoto onemocnění. První pokusy s ligací aorty, balením vaku do celofánu, zaváděním vodičů k vyvolání trombózy ve vaku a podobně selhávaly. Až v roce 1951 se poprvé podařilo provést úspěšný a dlouhodobě účinný zákrok – resekci AAA a náhradu části břišní aorty graftem [2]. Od té doby se výkony na AAA staly významnou částí cévně-chirurgických procedur. Druhou léčebnou možností, poprvé provedenou v roce 1991 Parodim, je vyřazení vaku aneuryzmatu pomocí implantace stentgraftu, tedy metalického stentu potaženého nepropustnou nesmáčivou tkaninou, tato tzv. endovaskulární léčba (endovascular treatment – EVT) za posledních 20 let zaznamenala obrovský rozmach a je účinnou minimálně invazivní alternativou otevřenému chirurgickému výkonu. V současné době se celosvětově provádí přibližně 30 000 implantací stentgraftů pro AAA s dobrými výsledky (obr. 1–3).
Image 1. 3D CT rekonstrukce obrazu aneuryzmatu břišní aorty s max. průměrem 49 mm. 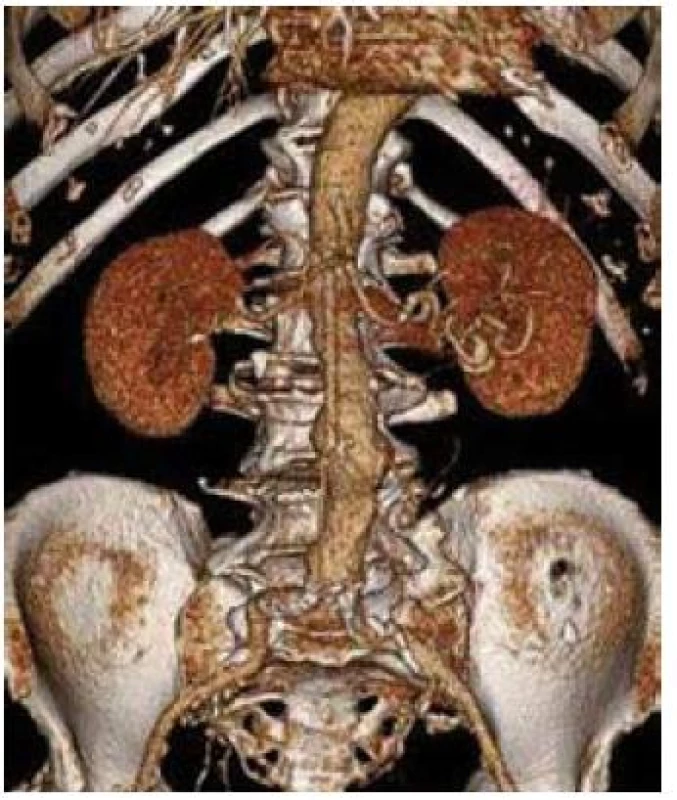
Image 2. CT transverzální řez v úrovni max. průměru vaku aneuryzmatu břišní aorty. 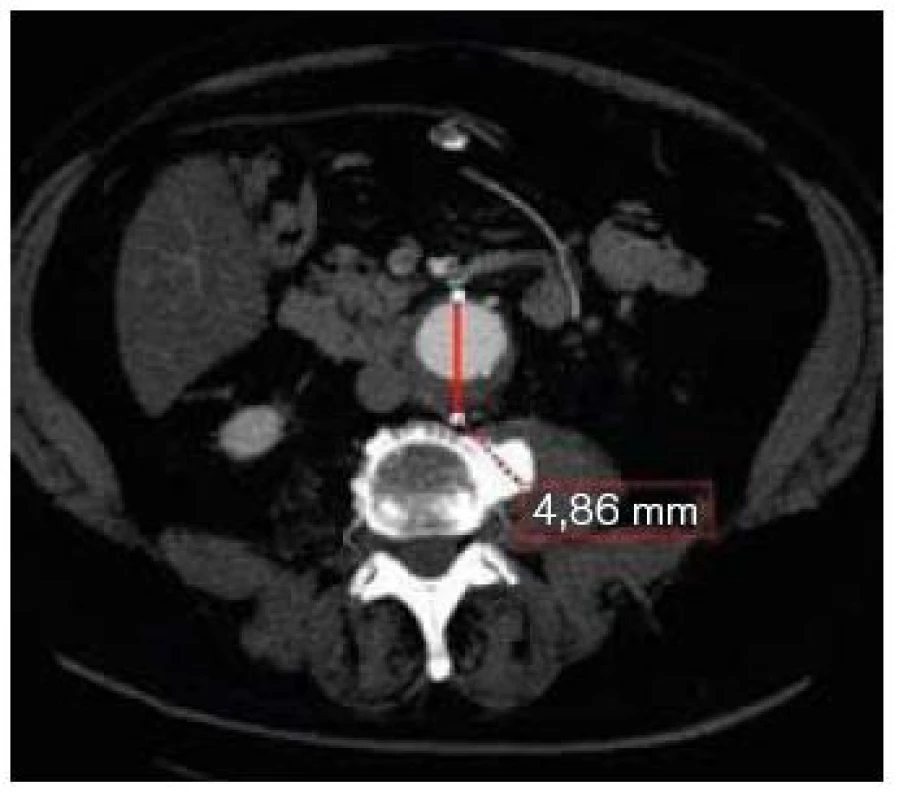
Image 3. 3D CT rekonstrukce obrazu aneuryzmatu břišní aorty po implantaci břišního stentgraftu. 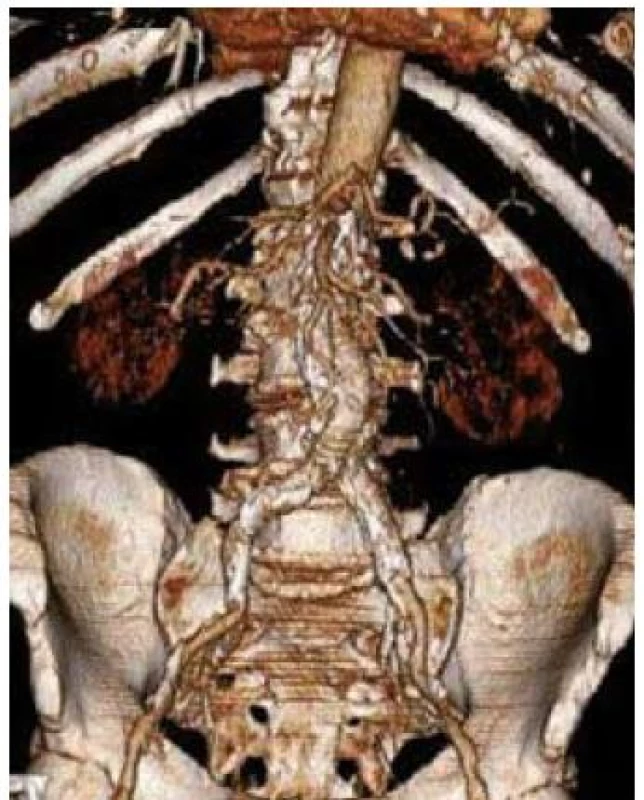
AAA je nejčastějším tepenným aneuryzmatem vůbec a vzhledem k vysokému potenciálu pro rupturu je i závažným zdravotnickým problémem. Ruptura AAA je 13. nejčastější příčinou úmrtí v západním světě. U mužů nad 55 let je potom 10. nejčastější příčinou úmrtí. V USA dochází každoročně k asi 9 000 úmrtí v souvislosti s AAA [3]. Tento údaj může být ve skutečnosti ještě vyšší, protože asi 30 až 50 % nemocných umírá v předhospitalizační fázi. Dalších 30 až 40 % nemocných s rupturou AAA umírá v nemocnicích ještě před případným chirurgickým výkonem. Pokud k těmto číslům ještě připočítáme vlastní operační mortalitu, která u operací prasklého AAA činí asi 40 až 50 %, docházíme k velmi alarmujícím číslům, která udávají, že ruptura AAA je provázena přibližně 90% mortalitou. Alarmující je rovněž fakt, že se tato vysoká úmrtnost od 80. let minulého století prakticky nemění. V kontrastu s touto skutečností je potom přibližně 3 až 5% mortalita u operací AAA, které jsou prováděny plánovaně. Navíc ve studiích porovnávajících EVT AAA s otevřenou operací byla krátkodobá mortalita i morbidita endovaskulárních výkonů přibližně třetinová [4–6]. Preventivní smysl výkonu u nemocného s AAA, který jej zbavuje problému potenciálně ohrožujícího na životě, je velmi významný a zásadně může ovlivnit pacientovu prognózu. Na druhou stranu je otevřená operace rozsáhlým zákrokem vyžadujícím celkovou anestezii, představujícím velký zásah do organizmu pacienta a který je i v renomovaných centrech zatížen nezanedbatelnou morbiditou i mortalitou. Je tedy nutné zhodnotit, zda-li je riziko případné intervence převáženo rizikem ruptury aneuryzmatu ponechaného bez patřičné léčby. Jako nejsilnější prognostický faktor z hlediska rizika ruptury AAA se jeví maximální průměr AAA a v současné době panuje shoda, že pacientům s aneuryzmatem aorty 55 mm a více by měla být nabídnuta operace. U nemocných s aneuryzmaty menšími než 55 mm se zatím doporučovalo sledování a k operaci přistoupit až při dosažení uvedeného maximálního průměru, samozřejmě pokud se u pacienta neobjeví varovné symptomy hrozící ruptury [7,8].
Epidemiologie
Stručně bychom o epidemiologii AAA mohli říci, že se jedná o onemocnění typicky se vyskytující u kuřáků, mužů vyššího věku. Výskyt AAA po 50. roce věku trvale narůstá a u mužů je 2–6krát častější než u žen. Prevalence AAA zjištěná v různých populačních studiích kolísá mezi 4,2–8,8 % u mužů a 0,6–1,4 % u žen. Ve skupině mužů mezi 55–59 lety byla zjištěna 1,99% prevalence AAA, ve skupině 65–69 let potom 4,75% a 5,95% ve věkové skupině 75–79 let. U žen je maximálního vrcholu výskytu AAA dosahováno přibližně o deset let později [9–16]. Zajímavým zjištěním v posledních letech je i rostoucí počet nových případů AAA, který může být vysvětlen narůstajícím počtem ultrazvukových nebo CT vyšetření břicha prováděných z jiných indikací. Faktem ovšem je, že se pravděpodobně zvyšuje i skutečný výskyt aneuryzmatického onemocnění břišní aorty, jak dokazují některé další práce hodnotící především zvyšující se počet úmrtí na rupturu AAA, která nejsou ovlivněna zvyšujícím se počtem břišních zobrazovacích vyšetření [16]. Tato zjištění tedy jen potvrzují, že problematika spojená s AAA se stává důležitým zdravotnickým problémem s významným sociálně ekonomickým dopadem na společnost. Výskyt AAA v populaci zvyšuje přítomnost některých rizikových faktorů, mezi nejdůležitější patří věk, mužské pohlaví, pozitivní rodinná anamnéza, kouření, vysoký krevní tlak, zvýšená hladina cholesterolu, přítomnost ischemické choroby dolních končetin a ischemické choroby srdeční. Ačkoliv jsou tyto faktory spojeny s vyšší incidencí AAA, nemusí se jednat o nezávislé příčinné faktory, ale spíše o markery výskytu AAA. Nejsilněji jsou s rizikem výskytu AAA spojeny věk, mužské pohlaví a kouření [16,17]. Kouření samo o sobě zvyšuje riziko výskytu AAA > 4 cm pětkrát a toto riziko se signifikantně zvyšuje s počtem let aktivního kouření [18]. Na závěr tedy lze říci, že výskyt AAA v populaci narůstá s věkem. Ve skupině mužů nad 60 let se jeho prevalence pohybuje přibližně okolo 5 % a roste lineárně s věkem. Svého maxima dosahuje ve věkové skupině 80letých mužů. Ženy jsou postiženy 2–6krát méně a nárůst výskytu AAA je přibližně o 10 let opožděn. Jako nejsilněji působící rizikový faktor kromě věku a pohlaví se jeví kouření.
Patogeneze
AAA jako onemocnění vyskytující se především ve vyšším věku je často vztahováno k ateroskleróze. Zdá se ovšem, že pouze aterosklerotické změny postihující stěnu aorty nemohou plně vysvětlit proces formování AAA. Tento proces je pravděpodobně mnohem komplexnější a spíše než jen aterosklerotickým bude výstižnější jej nazývat obecně degenerativním procesem postihujícím stěnu infrarenální břišní aorty.
Stěna aorty je tvořena nejenom buněčnými strukturami (např. buňky hladkých svalů), ale podstatnou část tvoří i matrixové proteiny (elastin a kolagen). Změny ve struktuře a poměrech uvedených proteinů pravděpodobně hrají velmi důležitou roli v patogenezi AAA. Víme, že obsah elastinu, který je především odpovědný za „pružnost“ aortální stěny, klesá od proximálních hrudních partií aorty k distálním infrarenálním úsekům. Největší pokles v obsahu elastinu je pozorován právě na přechodu aorty do infrarenálních partií, kde také dochází ke změně v poměrech mezi elastinem a kolagenem. Sám kolagen tvoří jakousi pevnou síť ve stěně aorty, která ochraňuje stěnu aorty před rupturou. Lze tedy velmi zjednodušeně shrnout, že změny v kvalitě či kvantitě elastinu ve stěně aorty spolupůsobí při formování vaku výdutě, změny v kvalitě či kvantitě kolagenu potom ovlivňují riziko ruptury vaku výdutě [19]. Na změnách ve struktuře aortální stěny u nemocných s AAA se pravděpodobně podílí zvýšená aktivita matrixových proteolytických enzymů, zejména metaloproteináz (MMP-9). V literatuře najdeme některé práce, jež prokazují až 3krát zvýšenou aktivitu MMP-9 ve stěně aorty u nemocných s AAA [20–23]. Histologické vyšetření stěny aorty u nemocných s AAA prokazují rovněž zánětlivou infiltraci zejména ve vrstvách medie a adventicie, u „klasického“ aterosklerotického postižení aortální stěny je tato zánětlivá infiltrace lokalizována v intimě [24]. Role zánětlivého procesu v patogenezi vývoje AAA zůstává ovšem nejednoznačná. Obdobně i nález patologických zánětlivých agens jako Chlamyda pneumonie ve stěně aorty u těchto nemocných nelze přesvědčivě interpretovat. Podle některých pozorování se zdá, že výskyt AAA má i jisté familiární rozvrstvení. U 15 až 25 % nemocných podstupujících chirurgický výkon pro AAA lze zjistit výskyt tohoto onemocnění v rodině [25–28]. Genetické aspekty se tedy pravděpodobně u části nemocných s AAA rovněž uplatňují.
Na vzniku AAA se tedy podílí četné vzájemně spolupůsobící procesy, které vedou ke komplexnímu degenerativnímu postižení stěny aorty a následně ke vzniku aneuryzmatického postižení břišní aorty. Toto degenerativní postižení působí při vzniku asi 90 % AAA, mezi další příčiny patří některá vrozená onemocnění pojiva, cystická nekróza medie, infekce, traumata nebo pseudoaneuryzmata v anastomózách cévních rekonstrukcí.
Klinický význam malých aneuryzmat abdominální aorty
Rozhodovací proces, který vede k určení dalšího léčebného postupu u nemocného s AAA, zohledňuje zejména velikost vlastního vaku AAA. Maximální rozměr AAA je nejsilnějším známým prediktorem rizika ruptury. U aneuryzmat menších než 55 mm se pohybuje kolem 1 %, u aneuryzmat nad 60 mm je roční riziko ruptury ovšem již 10 % [29,30]. Dle rozměrových kritérií tedy k otevřenému chirurgickému výkonu indikujeme nemocné s maximálním průměrem vaku 55 mm a více. U aneuryzmat označovaných jako malá (30–55 mm) byla potvrzena randomizovanými studiemi shodná účinnost i bezpečnost časného chirurgického výkonu i dlouhodobého sledování a provedení chirurgického výkonu až po dosažení průměru 55 mm [7,8]. Nutno ovšem dodat, že více než 50 % pacientů randomizovaných do skupiny sledování a odloženého výkonu až po dosažení rozměru 55 mm a více v průběhu sledování k vlastnímu výkonu stejně dospělo. Můžeme si tedy položit poněkud provokativní otázku: Pokud většina nemocných s AAA, které v okamžiku záchytu nedosahuje požadovaných 55 mm, stejně během následujících let dospěje k řešení tohoto stavu, není vhodnější takový výkon provést ihned a nečekat další léta, kdy celková kondice pacienta může být negativně ovlivněna jinými onemocněními? Není bezpečnější pacienta nevystavovat riziku ruptury AAA, neboť je známým faktem, že i malá aneuryzmata mohou prasknout se všemi důsledky tohoto závažného stavu? Není bezpečnější neponechávat pacienta v riziku embolizačních komplikací, protože i malá aneuryzmata jsou často v různé míře trombotizována? Pokud by jedinou terapeutickou alternativou byla otevřená chirurgie, pak musíme na položené otázky odpovědět negativně. Byla by ovšem naše odpověď stejně jednoznačně zamítavá i v případě použití endovaskulární léčby? Endovaskulární léčba, která prokazatelně přináší významně nižší rizika vlastního výkonu, by tak mohla být výhodnější léčebnou alternativou pro nemocné s malými AAA, u kterých by se k časné léčbě přistoupilo. Riziko závažných komplikací při vlastním výkonu je třetinové a celkový benefit z této léčby by tak mohl být vyšší ve srovnání s otevřenou chirurgií. Je pravda, že zkušenosti s EVT u malých AAA jsou omezené, zejména z pohledu dlouhodobého efektu této léčby. Existují ale některé práce, jež hodnotí efekt EVT v závislosti na velikosti léčeného AAA [31,32]. Bylo zjištěno, že krátkodobý i dlouhodobý efekt EVT je lepší u nemocných s menšími AAA, a můžeme tedy říci, že pro nemocné s menšími AAA má EVT větší přínos. V současné době tento problém řeší dvě randomizované studie (CAESAR, PIVOTAL), jejichž výsledky jsou netrpělivě očekávány.
Závěr
AAA je v současné době ve středu zájmu cévních chirurgů, angiologů a lékařů provádějících endovaskulární cévní výkony. Tento zájem, který lze sledovat prakticky na všech současných angiologických a angiochirurgických lékařských sympoziích, je jistě oprávněný. Pracujeme totiž s pacienty, u kterých správně načasovaný a kvalitně provedený výkon může naprosto zásadně změnit jejich prognózu a odvrátit hrozící fatální událost, jíž je ruptura AAA. Endovaskulární léčba v průběhu předchozích 20 let prokázala svoji účinnost a bezpečnost u nemocných s AAA 55 mm a více. Pro nemocné s AAA, kteří nedosahují této velikosti a jsou asymptomatičtí, nebyla prokázána žádná výhoda z časného výkonu, pokud byl proveden otevřenou chirurgickou cestou. Je možné, že endovaskulární výkony u této skupiny nemocných by mohly být lepší alternativou a mohly by být provedeny již časně po zjištění aneuryzmatu, byť nedosahuje požadovaného maximálního rozměru 55 mm, a mohly by tak odvrátit některé kritické stavy u nemocných, kdy i přes menší rozměr AAA dojde k jeho prasknutí.
Doručeno do redakce 2. 11. 2010
Přijato po recenzi 1. 12. 2010as. MUDr. Petr Vařejka
prof. MUDr. Aleš Linhart, DrSc.
II. interní klinika kardiologie a angiologie1. LF UK a VFN, Praha
petr.varejka@seznam.cz
Sources
1. Leonardo R. History of Surgery. New York: Froben Press 1943.
2. Dubost C, Allary M, Oeconomos N. Resection of an aneurysm of the abdominal aorta: Reestablishment of the continuity by a preserved human arterial graft, with result after five months. Arch Surg 1952; 64: 405–408.
3. Gillum RF. Epidemiology of aortic aneurysm in the United States. J Clin Epidemiol 1995; 48: 1289–1298.
4. Anderson PL, Arons RR, Moskovitz AJ et al. A statewide experience with endovascular abdominal aortic aneurysm repair: rapid diffusion with excellent early results. J Vasc Surg 2004; 39 : 10–19.
5. Greenhalgh RM, Brown LC, Kwong GP et al. EVAR trial participants. Comparison of endovascular aneurysm repair with open repair in patients with abdominal aortic aneurysm (EVAR trial 1), 30-day opreative mortality results: randomised controll trial. Lancet 2004; 364 : 843–848.
6. Prinssen M, Verhoeven ELG, Buth J et al. A randomised trial comparing conventional and endovascular repair of abdominal aortic aneurysms. N Engl J Med 2004; 351 : 1607–1618.
7. Lederle FA, Wilson SE, Johnson GR et al. Aneurysm Detection and Management Veterans Affairs Cooperative Study Group. Immediate repair compared with surveillance of small abdominal aortic aneurysm. N Engl J Med 2002; 346 : 1437–1444.
8. Mortality results for randomised controlled trial of early elective surgery or ultrasonographic surveillance for small abdominal aortic aneurysms. The UK Small Aneurysm Trial Participants. Lancet 1998; 352: 1694–1655.
9. Bengtsson H, Bergqvist D, Ekberg O et al. A population based screening of abdominal aortic aneurysms (AAA). Eur J Vascr Surg 1991; 5 : 53–57.
10. Smith FC, Grimshaw GM, Paterson IS et al. Ultrasonographic screening for abdominal aortic aneurysm in an urban community. Brit J Surg 1993; 80: 1406–1409.
11. Morris GE, Hubbard CS, Quick CR. An abdominal aortic aneurysm screening programme for all males over the age of 50 years. Eur J Vasc Surg 1994; 8: 156–160.
12. Simoni G, Pastorino C, Perrone R et al. Screening for abdominal aortic aneurysms and associated risk factors in a general population. Eur J Vasc Endovasc Surg 1995; 10 : 207–210.
13. Lindholt JS, Henneberg EW, Fasting H et al. Mass or high-risk screening for abdominal aortic aneurysm. Br J Surg 1997; 84 : 40–42.
14. Ashton HA, Buxton MJ, Day NE et al. Multicentre Aneurysm Screening Study Group. The Multicentre Aneurysm Screening Study (MASS) into the effect of abdominal aortic aneurysm screening on mortality in men: a randomised controlled trial. Lancet 2002; 360: 1531–1539.
15. Norman PE, Jamrozik K, Lawrence-Brown MM et al. Western Australian randomized controlled trial of screening for abdominal aortic aneurysm. Brit J Surg 2003; 90 : 492.
16. Lederle FA, Johnson GR, Wilson SE et al. The aneurysm detection and management study screening program: validation cohort and final results. Aneurysm Detection and Management Veterans Affairs Cooperative Study Investigators. Arch Inter Med 2000; 160: 1425–1430.
17. Halloran BG, Davis VA, McManus BM et al. Localization of aortic disease is associated with intrinsic differences in aortic structure. J Surg Res 1995; 59 : 17–22.
18. Grange JJ, Davis V, Baxter BT. Pathogenesis of abdominal aortic aneurysm: An update and look toward the future. Cardiovasc Surg 1997; 5 : 256–265.
19. Patel MI, Hardman DT, Fisher CM et al. Current views on the pathogenesis of abdominal aortic aneurysms. J Am Coll Surg 1995; 181 : 371–382.
20. Hunter GC, Smyth SH, Aguirre ML et al. Incidence and histologic characteristics of blebs in patients with abdominal aortic aneurysms. J Vasc Surg 1996; 24: 93–101.
21. McMillan WD, Tamarina NA, Cipollone M et al. Size matters: The relationship between MMP-9 expression and aortic diameter. Circulation 1997; 96: 2228–2232.
22. van der Vliet JA, Boll AP. Abdominal aortic aneurysm. Lancet 1997; 349 : 863–866.
23. Darling RC 3rd, Brewster DC, Darling RC et al. Are familial abdominal aortic aneurysms different? J Vasc Surg 1989; 10 : 39–43.
24. Johansen K, Koepsell T. Familial tendency for abdominal aortic aneurysms. JAMA 1986; 256: 1934–1936.
25. Verloes A, Sakalihasan N, Koulischer L et al. Aneurysms of the abdominal aorta: Familial and genetic aspects in three hundred thirteen pedigrees. J Vasc Surg 1995; 21 : 646–455.
26. Webster MW, Ferrell RE, St Jean PL et al. Ultrasound screening of first-degree relatives of patients with an abdominal aortic aneurysm. J Vasc Surg 1991; 13: 9–13.
27. Lederle FA, Simel DL. The rational clinical examination: Does this patient have abdominal aortic aneurysm? JAMA 1999; 281 : 77–82.
28. Hinchliffe RJ, Yusuf SW, Macierewicz JA et al. Endovascular repair of ruptured abdominal aortic aneurysm – a challenge to open repair? Results of a single centre experience in 20 patients. Eur J Vasc Endovasc Surg 2001; 22 : 528–534.
29. Lederle FA, Johnson GR, Wilson SE et al. Veterans Affairs Cooperative Study #417 Investigators. Rupture rate of large abdominal aortic aneurysms in patients refusing or unfit for elective repair. JAMA 2002; 287: 2968–2972.
30. Wilt TJ, Lederle FA, Macdonald R et al. Comparison of endovascular and open surgical repairs for abdominal aortic aneurysm. Evid Rep Technol Assess (Full Rep) 2006; 144 : 1–113.
31. Ouriel K, Siravastava SD, Sarac TP et al. Disparate outcome after endovascular treatment of small versus large abdominal aortic aneurysm. J Vasc Surg 2003; 37 : 1206–1212.
32. Zarins CK, Crabtree T, Bloch DA et al. Endovascular aneurysm repair at 5 years: does aneurysm diameter predict outcome? J Vasc Surg 2006; 44: 920–930.
Labels
Paediatric cardiology Internal medicine Cardiac surgery Cardiology
Article was published inCardiology Review

2010 Issue 4-
All articles in this issue
-
Situace v diagnostice a léčbě ischemické choroby dolních končetin v České republice
(poznatky z projektu MOET ICHDK – Monitoring Efektivní Terapie ICHDK) - Co nového přinášejí guidelines 2010 pro léčbu pacientů s fibrilací síní?
- Máme v současné době dostatek důkazů o kardioprotektivním efektu konzumace mírného množství vína na kardiovaskulární onemocnění?
- Vzácná onemocnění popliteální tepny
- Aortitis – zánět aortální stěny
- Malá aneuryzmata břišní aorty – blíží se čas změny našich postupů?
- Trombolytická terapie akutní okluze a. centralis retinae
- Neobvyklá příčina akutní končetinové ischemie – fraktura stentu
-
Situace v diagnostice a léčbě ischemické choroby dolních končetin v České republice
- Cardiology Review
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Aortitis – zánět aortální stěny
- Trombolytická terapie akutní okluze a. centralis retinae
- Vzácná onemocnění popliteální tepny
- Malá aneuryzmata břišní aorty – blíží se čas změny našich postupů?
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

