-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Mikrobióm pri srdcovom zlyhávaní a aortálnej stenóze
Gut microbiome in heart failure and aortic stenosis
The gut microbiome is linked to the development of individual diseases. Patients with congestive heart failure (HF) develop intestinal wall edema due to venous congestion, which impairs absorption function and allows bacterial overgrowth. Consequently, the pathogenous bacterial strains produce many harmful substances, including trimethylamine N-oxide (TMAO) and endotoxin (LPS – lipopolysaccharide), which lead to deterioration of HF. These discoveries led to hypothesis about the heart-bowel axis. High levels of TMAO present in patients with HF predispose to higher long-term mortality, even after correlation with traditional risk factors and cardiorenal indices. Most LPS is generated by the intestinal microbiome, and the osteogenic response in aortic stenosis to LPS stimulation of valve interstitial cells (VIC) is closely linked to inflammation and immunity. Thus, the concentration of intestinal microbiome research may provide new insights into the investigation of new therapeutic targets for HF and aortic stenosis.
Keywords:
Microbiome – heart failure – aortic stenosis
Autoři: Pavol Fülöp 1,2; Marianna Dvorožňáková 3; Marianna Vachalcová 2; Zuzana Fülöpová 5; Katarína Šoltys 4; Gabriel Valočik 2
Působiště autorů: Interná klinika UPJŠ LF a Nemocnice AGEL Košice‑Šaca, a. s. 1; I. kardiologická klinika UPJŠ LF a VÚSCH, a. s., Košice 2; II. kardiologická klinika UPJŠ LF a VÚSCH, a. s., Košice 3; Prírodovedecká fakulta, UK v Bratislave 4; I. interná klinika UPJŠ LF a UNLP, Košice 5
Vyšlo v časopise: Vnitř Lék 2022; 68(E-2): 4-10
Kategorie: Přehledové články
Souhrn
Črevný mikrobióm je prepojený s vývojom jednotlivých ochorení. U pacientov s kongestívnym srdcovým zlyhávaním (SZ) sa vyvíja edém črevnej steny pre venóznu kongesciu, ktorá narúša absorpčnú funkciu a povoľuje bakteriálne prerastanie. Následne patogénne baktérie produkujú mnoho škodlivých substancií vrátane trimetylamín‑N - oxidu (TMAO) a endotoxínu (LPS – lipopolysacharid), ktoré vedú k zhoršeniu SZ. Tieto objavy viedli k hypotéze o osi srdce‑črevá pri SZ. Vysoké hladiny TMAO prítomné u pacientov so SZ predisponujú k vyššej dlhodobej mortalite, dokonca aj po korelácii s tradičnými rizikovými faktormi a kardiorenálnymi indexami. Väčšina LPS je generovaná črevným mikrobiómom, pričom osteogénna odpoveď pri aortálnej stenóze na LPS stimuláciu intersticiálnych chlopňových buniek je úzko prepojená so zápalom a imunitou. Koncentrácia výskumu na črevný mikrobióm môže poskytnúť nové náhľady pri skúmaní nových terapeutických cieľov srdcového zlyhávania a aortálnej stenózy.
Klíčová slova:
mikrobiom – srdcové zlyhávanie – aortálna stenóza
Úvod
Srdcové zlyhávanie (SZ) je časté, smrteľné a drahé. Patrí celosvetovo medzi hlavné príčiny morbidity a mortality, pričom zodpovedá za ~30 % úmrtí ročne (1). Prevalencia rastie a predpokladá sa nárast až na 10 % populácie do roku 2030. Liečba SZ predstavuje 2–3 % celkových zdravotných nákladov vo vyspelých krajinách s predpoveďou viac ako dvojnásobku v priebehu ďalších 20 rokov z dôvodu starnutia populácie (2). Aortálna stenóza je najčastejšia chlopňová chyba vyžadujúca intervenciu v Európe a Severnej Amerike. Prevalencia AS stúpa s vekom, pričom postihuje 0,2 % ľudí vo veku 50–59 rokov, 3–5 % u ľudí starší ch ako 75 rokov, s najvyšš ou prevalenciou do 9,8 % v skupine 80–89 rokov (3). Napriek vysokej morbidite a mortalite spojenej s AS v súčasnosti abstinujú efektívne preventívne a neinvazívne terapeutické stratégie. Ľudský mikrobióm je súbor mikroorganizmov, ktoré spolunažívajú v alebo na tele hostiteľa. Pri rôznych chorobných stavoch sa zistili špecifické zmeny v mikrobióme. Je možné, že črevný mikrobióm je zahrnutý aj do progresie kardiovaskulárnych ochorení (4), a teda má potenciál stať sa novým terapeutickým cieľom.
Srdcové zlyhávanie
SZ je definované ako neschopnosť srdca zásobiť periférne orgány dostatočným množstvom krvi a kyslíka na zabezpečenie metabolických potrieb. Väčšinou je spôsobené základnou chorobou myokardu (najmä ischémiou), avšak kardiálne príčiny vrátane chlopňových chýb, abnormalít perikardu a arytmií môžu taktiež vyústiť do poškodenia srdcovej funkcie. Nedeliteľnú etiológiu tvoria aj kardiomyopatie, myokarditídy, infekcie a expozícia kardiotoxickými liekmi.
Napriek pozoruhodnému progresu v klinickom manažmente pacientov a používaní zariadení, či už resynchronizačných alebo mechanickej podpory, prognóza SZ ostáva nepriaznivá s ročnou úmrtosťou 6–7 % u pacientov s chronickým SZ a do 25 % u hospitalizovaných s akútnou dekompenzáciou SZ (5). Liečba SZ predstavuje 2–3 % celkových zdravotných nákladov vo vyspelých krajinách s predpoveďou viac ako dvojnásobku v priebehu ďalších 20 rokov z dôvodu starnutia populácie (2).
SZ je väčš inou diagnostikované anamnézou, fyzikálnym vyšetrením, laboratórnymi testami a kardiovaskulárnym zobrazovaním. Tradične sa srdcové zlyhávanie delí na viacero fenotypov na základe merania ejekčnej frakcie (EF) ľavej komory. Redukovaná EF (HFrEF) je definovaná ako ≤ 40 %, ľahko redukovaná EF (HFmrEF) 41–49 % a zachovaná (HFpEF) EF ≥ 50 % (6). Jednou z hlavných výziev v diagnostike je identifikácia spoľahlivých biomarkerov. Natriuretické peptidy sú najviac študované a používané biomarkey SZ. Sérový mozgový nátriuretický peptid (BNP) je v súčasnosti jediný biomarker SZ s odporúčaniami triedy IA v európskych a amerických odporúčaniach (6, 7).
Mikrobióm
Ľudský mikrobióm je súbor mikroorganizmov, ktoré spolunažívajú v alebo na tele hostiteľa (8). Existuje viac ako 2 000 druhov komenzálnych organizmov, najmä baktérií, ktoré spolunažívajú v ľudskom tele, poväčšine v tráviacom trakte. Zdravý dospelý jedinec má približne 100 biliónov baktérií v tráviacom trakte, predominantne v hrubom čreve. Črevný mikrobióm (ČM) je získaný z prostredia, nie geneticky. V maternici je tráviaci trakt plodu bežne sterilný. Plod získava rozdielny mikrobióm počas cisárskeho rezu ako pri vaginálnom pôrode (9). Ďalej sa typy mikrobiómu rôznia v závislosti od stravy a vplyvu prostredia (10).
V ľudskom mikrobióme dominuje päť kmeňov (Obr. 1.): Bacteroidetes, Firmicutes, Actinobacteria, Proteobacteria a Verrucomicrobia (8). Zvyčajne je mikrobióm jedinca stabilný. V zdravom tráviacom trakte anaeróbne skupiny Bacteroidetes a Firmicutes prispievajú k viac ako 90 % bakteriálnych druhov (11).
Obr. 1. Distribúcia červeného mikrobiómu. Upravené podl'a (12) 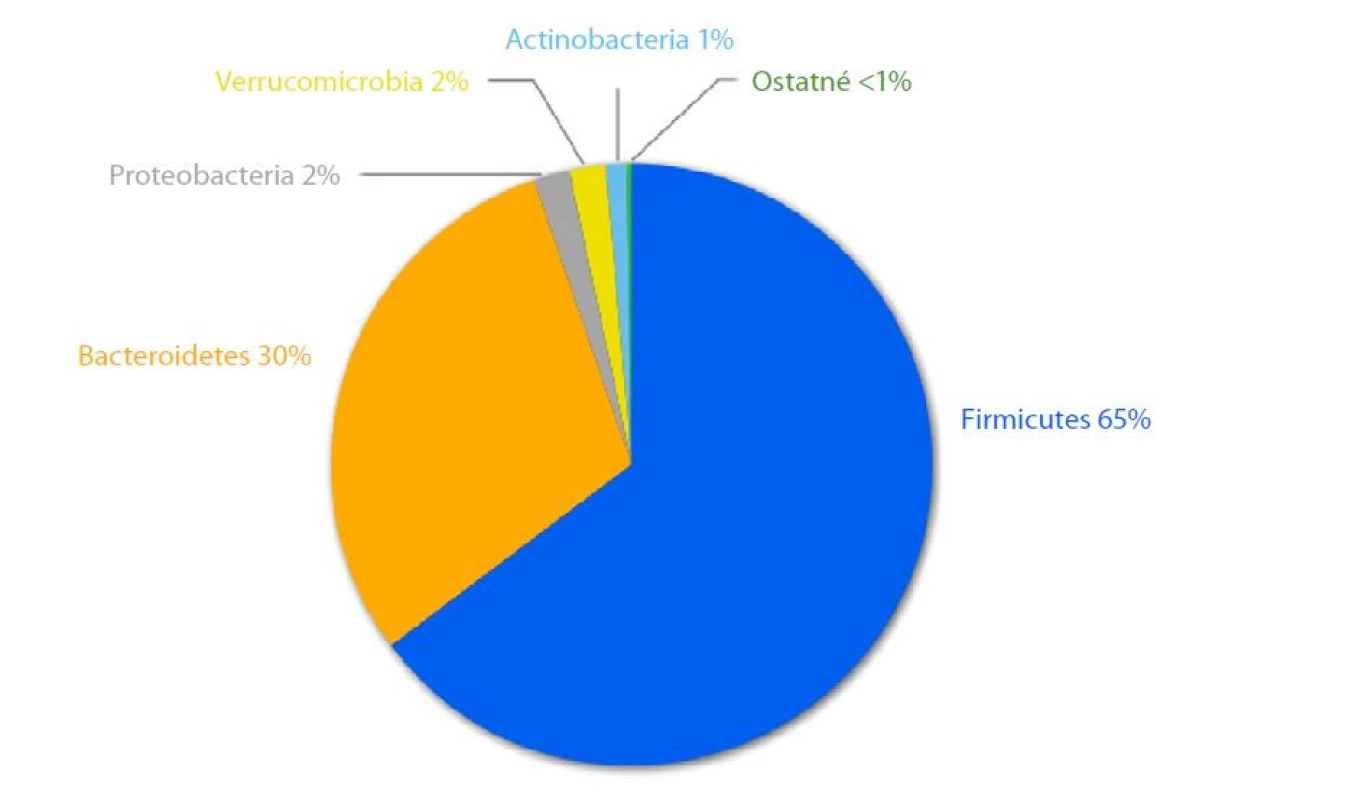
Špecifické vzorce črevného mikrobiómu sa nazývajú enterotypy. Nepriaznivá zmena v črevnom mikrobióme sa nazýva dysbióza. Jedným z najdôležitejších faktorov ovplyvňujúcich enterotypy je dlhodobá diéta jedinca. Napríklad, diéta bohatá na živočíšne proteíny a tuky spôsobí vysoké hladiny Bacteroides a nízke hladiny Prevotella (časť rodu Bacteroidetes) (13). Naopak, diéta bohatá na uhľovodíky a chudobná na živočíšne proteíny a tuky spôsobí nízke hladiny Bacteroides a vysoké hladiny Prevotella. Ďalším príkladom interakcie jedla a mikrobiómu sú Japonci, ktorých črevá obsahujú Bacteroides plebeius, ktorý produkuje enzým pomáhajúci v trávení morských rias (14). Ďalšie faktory ovplyvňujúce mikrobióm, okrem stravy, sú enviromentálne zmeny, hygiena, užívanie antibiotík a štádiá rôznych ochorení (8).
Črevný mikrobióm plní veľa funkcií. Jednou z nich je protektívna funkcia spočívajúca vo vytesňovaní patogénov, produkcii antimikrobiálnych látok, produkcii vitamínov. K najdôležitejším funkciám patrí metabolická, pretože pomáha tráveniu zložiek potravy, napríklad pri rozklade cukrov glykozid hydrolázou (glykány, ktoré nemôžu byť trávené ľudskými enzýmami). ČM participuje na sacharolytickej a proteolytickej katabolickej ceste (15). Obe vedú k produkcii mastných kyselín s krátkym reťazcom (SCFA – short chain fatty acids). SCFA v systémovej cirkulácii preukázali schopnosť modulovať kardiovaskulárne rizikové faktory vrátane redukcie krvného tlaku a regulácie glukózovej a lipidovej homeostázy (16). Proteolytická cesta ale produkuje aj toxické molekuly ako amoniak, rôzne amíny, tioly, fenoly a indoly, ktoré sú vylučované obličkami, avšak akumulujú sa pri renálnej insuficiencii (8, 15). Nové dôkazy poukazujú na ovplyvňovanie regulácie trávenia a absorpcie lipidov ČM (17). Podľa súčasných poznatkov sa na funkciu mikrobiómu pozerá ako na „endokrinný“ orgán, ktorý svojimi metabolitmi ovplyvňuje ľudskú fyziológiu. Podľa štúdií sa ČM identifikuje ako možný rizikový faktor kardiovaskulárnych ochorení.
Štúdium ČM je zložité kvôli miliónom baktérií a tisícov druhov, ako aj výskytu húb či vírusov, ktoré môžu interferovať so skúmaným genetickým materiálom. Ďalším problémom je výskyt rozličnej flóry v rôznych úsekoch čreva, ako aj časté zmeny génomu pre horizontálne transfery génov (8). Tradičnou metódou je kultivácia, ale je časovo náročná a nezáživná. Novšie metódy spočívajú v sekvenovaní bakteriálneho genómu. Menovite 16S ribozomálna RNA génová amplikónová analýza, ktorá sa snaží objasniť, čo (aké baktérie) sa tam nachádza, zatiaľ čo metagenómové sekvenovanie, ktoré je drahšie, poskytuje špecifickejšiu taxonomickú a funkčnú klasifikáciu (18) a odpovedá na doplnkovú otázku – čo dokážu urobiť (19).
Obr. 2. Asociácia mikrobiómu so srdcovým zlyhávaním, upravené podľa (48) 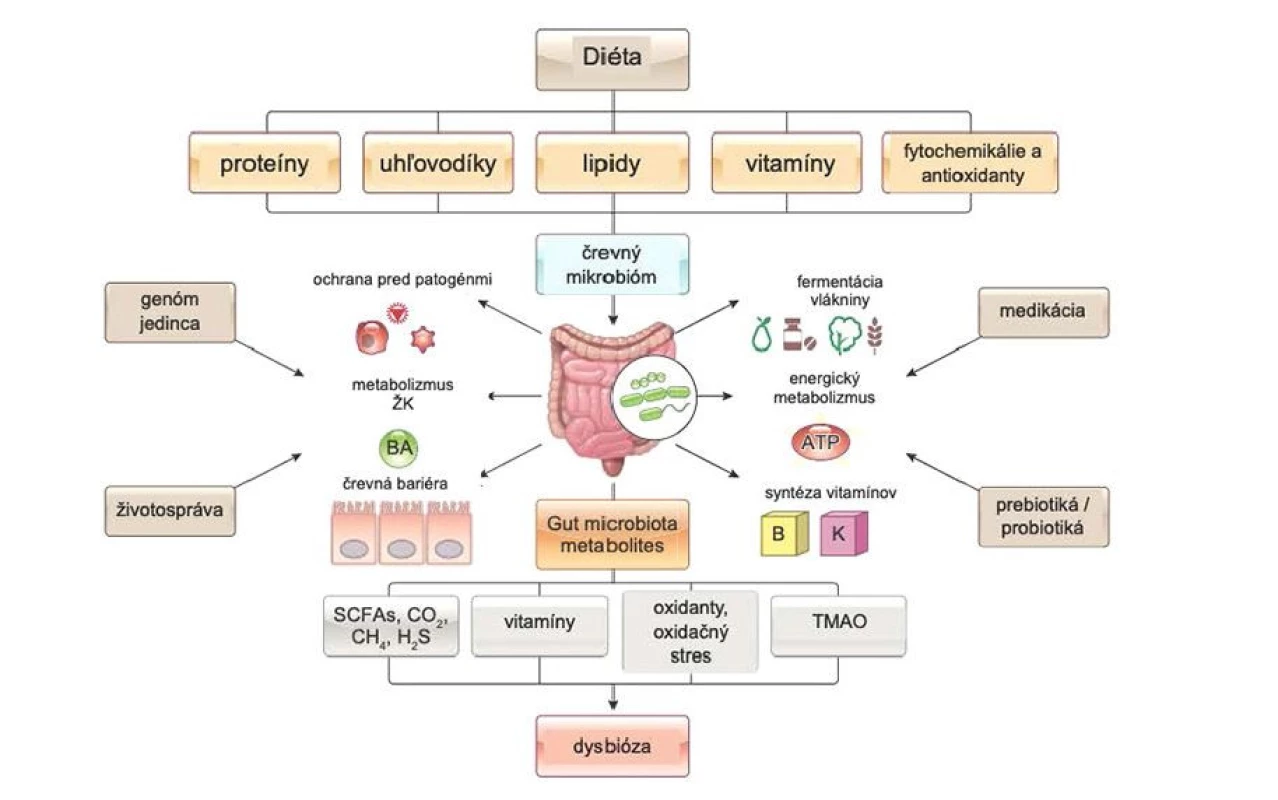
Dôležitým zistením je koncept spoločenstva v ČM, ktorý opisuje symbiózu a prepojenie medzi črevnými mikroorganizmami (20). Niektoré ústredné baktérie sú potenciálne kľúčové patogény, ktoré môžu potláčať symbiotické baktérie a promovať iné patogény. Tieto zistenia naznačujú, že narušenie pôvodnej mikroflóry nie je indukované jediným špecifickým mikróbom, ale viacerými skupinami organizmov.
Metabolity
Trimetylamín‑N - oxid
Trimetylamín (TMA) je tvorený rozkladom potravín bohatých na fosfatidylcholín, cholín alebo karnitín (získané z červeného mäsa, rýb, vajec). TMA sa absorbuje v tenkom čreve a hepatálnym enzýmom flavín monooxygenázou 3 sa mení na trimetylamín‑N - oxid (TMAO), ktorý sa vpustí do krvného obehu a eventuálne odstráni obličkami (21).
TMAO je biologicky aktívna molekula, pričom štúdie preukázali koreláciu medzi metabolizmom TMAO pomocou črevného mikrobiómu a rizikom KVS ochorení. Recentná metaanalýza odhalila 67 % zvýšenie rizika vývoja KVS ochorení pri vysokých hladinách TMAO. Navyše, každým ďalším nárastom hladiny TMAO o 10 μmol/L sa zvýšilo riziko úmrtia zo všetkých príčin o 7,6 % (22). TMAO sa preukázal ako prediktor akútneho koronárneho syndrómu, cievnej mozgovej príhody a smrti, pravdepodobne svojou proaterogénnou cestou (21, 23). Administrácia 3,3-dimethyl-1-butanolu, inhibítora TMA, dokázala zabrániť kardiálnej dysfunkcii spôsobenej západnou diétou bohatou na cukry a tuky (24).
Žlčové kyseliny
Primárne žlčové kyseliny (ŽK) sú syntetizované v pečeni z cholesterolu v rámci viacstupňového procesu a sú potrebné na absorpciu dietárnych lipidov z čreva. Vďaka ŽK sa môže cholesterol eliminovať exkréciou do stolice. Týmto spôsobom ŽK znižujú hladinu cirkulujúceho cholesterolu a riziko tvorby aterosklerotického plátu. Črevný mikrobióm dokáže znížiť tvorbu ŽK, čím sa zvýši plazmatická hladina LDL, ako aj riziko aterosklerózy (25).
Mastné kyseliny s krátkym reťazcom
Mastné kyseliny s krátkym reťazcom (SCFA) ako acetát, butyrát a propionát sú produkované v procese fermentácie nestráviteľnej diétnej vlákniny v črevách mikrobiómom. SCFA sa môžu buď vstrebať črevným epitelom alebo vylúčiť stolicou (26). Butyrát slúži ako primárny zdroj energie pre kolonocyty. SFCA majú aj ďalšie funkcie, a to protizápalovú či metabolickú pri metabolizme tukov a glukoneogenéze. Acetát a propionát majú v systémovej cirkulácii možnosť väzby na endotelové receptory, ktoré ovplyvňujú kardiometabolické zdravie (27). Butyrát a propionát sú odstraňované portálnou cirkuláciou, aby sa zabránilo ich vysokým koncentráciám v krvi. Zvýšené fekálne hladiny SFCA sú asociované so zníženou diverzitou ČM, zvýšenou permeabilitou čreva, systémovým zápalom, glykémiou, dyslipidémiou, obezitou a hypertenziou.
Obr. 3. Hypotéza osi srdce–čreva, upravené podľa (4). 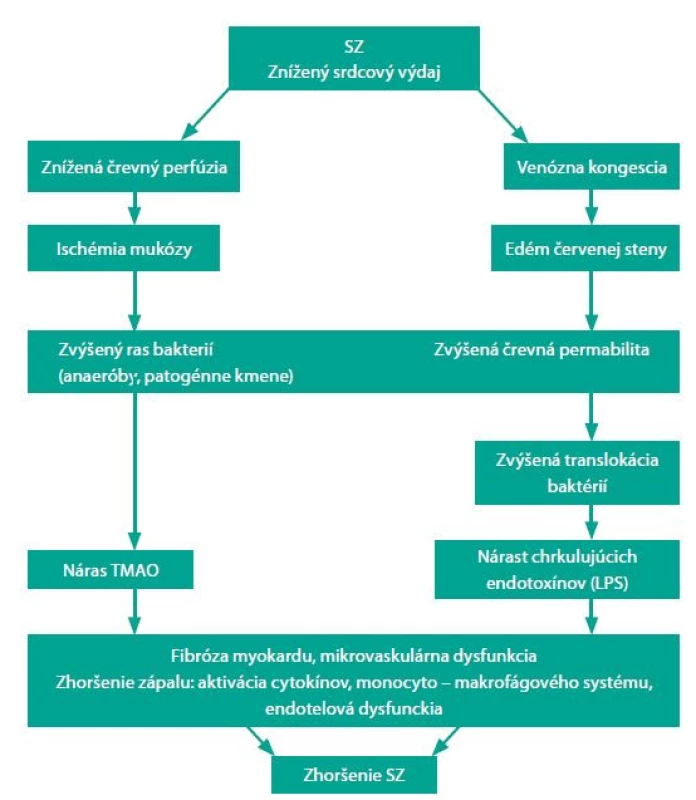
SZ – srdcové zlyhávanie, LPS – lipopolysacharidy, TMAO – trimetalmin N-oxid. Pacienti so SZ majú značné zmeny v mikrobióme v zmysle redukovanej biodiverzity a deplécie baktérií, ktoré môžu produkovať butyrát alebo maslovú kyselinu, ktorá je hlavným zdrojom energie pre kolonocyty (28). ČM je teda pravdepodobne zapojený aj do patogenézy SZ. Pri SZ dochádza pre znížený vývrhový objem k redukcii prietoku krvi v črevách a nízkej dodávke kyslíka. To predisponuje v črevách k rastu patogénnych typov anaeróbnych baktérií (29). U pacientov s kongestívnym SZ sa vyvíja edém črevnej steny pre venóznu kongesciu, ktorá narúša absorpčnú funkciu a povoľuje bakteriálne prerastanie v mukóznej vrstve hlienu, susediacej s apikálnym povrchom sliznice hrubého čreva. Zvýšená črevná permeabilita bola pozorovaná pri SZ a koreluje s tlakom v pravej predsieni a hladinou C‑reaktívneho proteínu. Následne patogénne baktérie produkujú mnoho škodlivých substancií vrátane TMAO a endotoxínu (LPS – lipopolysacharid), ktoré vedú k zhoršeniu SZ. Tieto objavy viedli k hypotéze o osi srdce‑črevá pri SZ (30). Vyššie koncentrácie LPS boli opísané u pacientov s dekompenzovaným SZ, čo koreluje so stupňom opuchu črevnej steny. LPS klesajú po kardiálnej rekompenzácii. Sandek et al. na základe týchto informácií navrhuje kauzálny vzťah medzi edémom brušnej steny, epitelovou dysfunkciou a translokáciou LPS (31).
Eleváciu TMAO pri SZ pravdepodobne spôsobuje zmena bakteriálneho zloženia, ako bolo spomenuté vyššie. Pacienti s chronickým SZ majú signifikantne väčšiu mieru patogénnych baktérii a kvasiniek (Candida) a zníženú hladinu protizápalových baktérií, ako napríklad Faecalibacterium prausnitzii (32). Takisto k patogénnej distribúcii prispieva renálna insuficiencia a diétne vzorce.
Vysoké hladiny TMAO prítomné u pacientov so SZ predisponujú k vyššej dlhodobej mortalite, dokonca aj po korelácii s tradičnými rizikovými faktormi a kardiorenálnymi indexami. Po 1-ročnom sledovaní 972 pacientov s akútnou kardiálnou dekompenzáciou výskumníci zistili, že vyššie hladiny TMAO zhoršujú prognózu. Kombináciou TMAO a NT‑proBNP bolo možné dosiahnuť aditívnu prognostickú informáciu (33). Spomínané korelácie boli silnejšie u pacientov so závažnejším SZ (NYHA III‑IV) (34).
Zatiaľ nie je úplne zrejmé, ako TMAO vplýva na patofyziológiu SZ. Navrhované teórie zahŕňajú stimuláciu cytokínov ako tumor necrosis factor alpha, ktorý zhoršuje fibrózu myokardu, mikrovaskulárnu dysfunkciu v myokarde a neurohormonálne odchýlky (35). Organ et al. (36) opísali signifikantnú deterioráciu funkcie myokardu u myší so srdcovým zlyhávaním po administrácii TMAO, charakterizovanú pľúcnym edémom, hypertrofiou myokardu a zníženou ejekčnou frakciou. Schuett et al. (37) opísali možné zvýšenie náchylnosti k SZ cestou TMAO potenciovaním fibrózy myokardu. Vzhľadom na vyššie uvedené skutočnosti môže TMAO slúžiť ako potenciálny terapeutický cieľ.
Mikrobióm a aortálna stenóza
Odpoveď na otázku, či AS vzniká náhodne, alebo je spustená cieleným patomechanizmom, ostáva nezodpovedaná. Je možné, že črevný mikrobióm môže byť zahrnutý do progresie AS. Predošlé štúdie ukázali, že osteogénna odpoveď na LPS stimuláciu VIC (valve interstitials cells) je úzko prepojená so zápalom a imunitou (38), a väčšina LPS je generovaná ČM. A teda koncentrácia výskumu na črevný mikrobióm môže poskytnúť nové náhľady na tieto zaujímavé deje.
Nedávno Liu et al. (39) publikovali závery štúdie zameranej na mikrobióm pri ischemickej chorobe srdca (ICHS) a kalcifikácii chlopní. Zistili, že ČM u pacientov s chlopňovými chybami a ICHS sa signifikantne líši v beta diverzite napriek podobným rizikovým faktorom. Baktérie Veillonella dispar, Bacteroides plebeius a Fusobacterium boli prerastenejšie v skupine chlopňových chýb, zatiaľ čo zástupcovia Collinsella aerofaciens, Megamonas, Enterococcus, Megasphaera, Dorea a Blautia boli v menšom počte. Pre asociáciu s dyslipidémiou navrhli 7 operačných taxonomických jednotiek (OTU) vrátane Parabacteroides distasonis, Megamonas, Fusobacterium, Bacteroides sp., Bacteroides plebeius, Lactobacillus a Prevotella copri ako potenciálne patogény pre kardiovaskulárne choroby. Navyše zistili, že Prevotella copri môže mať kľúčovú úlohu u pacientov s chlopňovými chybami, zatiaľ čo Collinsella aerofaciens je pravdepodobne hlavný patogén pri ischemickej chorobe srdca na základe početných korelácií týchto baktérií s ostatnými OTU. Blautia, SFCA‑produkujúca baktéria, ktorá je asociovaná s protizápalovou odpoveďou, bola redukovaná v skupine chlopňových chýb a zistilo sa, že aj v skupine pacientov so SZ. Blautia bola v negatívnej asociácii s NT‑pro‑BNP a pozitívne korelovala s LDL.
Kocyigit et al. (40) sledovali 60 pacientov so stredne závažnou až závažnou AS, pričom merali plazmatické hladiny diétnych a s mikrobiómom súvisiacich metabolitov, menovite cholínu, betaínu a TMAO. Zistili zvýšené plazmatické hladiny cholínu v porovnaní s kontrolnou skupinou (p < 0,001) a skupinou so sklerotickou aortálnou chlopňou (p = 0,006). Plazmatické hladiny betaínu a TMAO boli podobné (obe p > 0,05). V porovnaní s najnižším kvartálom hladín cholínu (< 11,15 IM), pacienti v najvyššom kvartále (≥ 14,98 IM) mali vyššie kalciové skóre aortálnej chlopne (p < 0,001) ako aj mitrálneho prstenca (p = 0,013). Plazmatické hladiny cholínu boli nezávisle prepojené s vrcholovou rýchlosťou nad aortálnou chlopňou V max (B±SE: 0,165±0,060, p = 0,009). Hladina cholínu bola zvýšená u pacientov s hustejšou lymfocytovou infiltráciou (p < 0,001), neovaskularizáciou (p = 0,011), kostnou metapláziou (p = 0,004), závažnejšou tkanivovou prestavbou (p = 0,002) a kalcifikáciou (p = 0,002). Skupina odhalila signifikantnú asociáciu medzi hladinou cholínu a závažnosťou AS potvrdenou zobrazovacími metódami a histopatologickým vyšetrením. Tieto zistenia môžu otvoriť nové obzory pri prevencii AS.
Úprava dysbiózy
Kombinované gény mikrobiómu násobne prevyšujú ľudský genóm a každý mikrób má potenciál zapnúť alebo vypnúť produkciu stoviek metabolitov. Existujú štúdie o manipulácii ČM, ktoré poskytujú nádej v liečbe istých ochorení. Manipulovať sa dá viacerými spôsobmi, a to zmenou stravy, cielením chemikálií produkovaných ČM, priamym ovplyvnením mikroflóry pridaním neabsorbovateľných antibiotík, ktoré zabíjajú špecifické mikróby, alebo podávaním probiotík (41)
Probiotiká sú živé prospešné baktérie (bifidobaktérie, laktobacily, streptokoky a nepatogénne kmene Escherichia coli), ktoré je možné konzumovať na vytvorenie vhodnej črevnej mikrobiálnej rovnováhy. Existujú štúdie s použitím Saccharomyces boulardii pri SZ, ktoré preukázali prínos v zmysle zlepšenia EF (42). Na druhej strane existujú aj možné negatíva, pretože pri absencii imunitnej hliadky sa aj benígna baktéria môže stať patogénom. Medzi potenciálne riziká spojené s podávaním probiotík u rizikových skupín populácie patrí translokácia pri narušenej integrite čreva: v presakujúcom, zapálenom alebo nedovývijanom čreve môžu probiotiká (Saccharomyces cerevisiae, Lactobacillus, Bifidobacterium) preniknúť cez črevnú sliznicu a dostať sa do krvného obehu, alebo životne dôležitých orgánov a spôsobiť systémové ,resp. lokalizované infekcie. U pacientov s oslabenou imunitou môžu faktory virulencie a škodlivé metabolity probiotík viesť k oportúnnym infekciám a poruchám metabolizmu. Horizontálny prenos génov rezistencie na antibiotiká z probiotík na patogénne črevné baktérie a naopak môže viesť k vývoju patogénov rezistentných voči antibiotikám. Prehnaná imunitná odpoveď prostredníctvom vyvolanej produkcie cytokínov môže viesť k autoimunitnému ochoreniu alebo zápalu (41).
Ďalšou metódou je podávanie neabsorbovateľných antibiotík, ktoré zabíjajú špecifickú mikroflóru a tak menia celkovú mikrobiálnu štruktúru. Nedávna štúdia GutHeart randomizovala 150 pacientov so stabilným SZ s redukovanou EF ĽK < 40 %. Pacienti boli rozdelení do 3 skupín a skúmal sa efekt rifaximínu a Saccharomyces boulardii (ATCC 74012) s kontrolnou skupinou bez pridanej liečby (43). Trojmesačná intervencia so S. boulardii alebo rifaximínom nemala klinicky významný vplyv na EF ĽK, diverzitu a funkciu mikrobiómu, cirkulujúce hladiny TMAO alebo systémový zápal. Liečba bola dobre tolerovaná. Štúdia naznačuje, že optimálne liečení pacienti so SZ so zníženou EF nemusia mať nevyhnutne vysoký stupeň dysbiózy. V dôsledku toho modulácia mikroflóry pomocou širokospektrálnych antibiotík, ako je rifaximín alebo nešpecifických probiotík, ako je S. boulardii, nemusí byť u takýchto pacientov možná. Pri navrhovaní budúcich stratégií na zacielenie osi čreva a srdca pri SZ je potrebné prispôsobiť liečbu podľa stupňa dysbiózy alebo priamo zacieliť na konkrétne druhy alebo metabolity.
Podľa súčasných poznatkov diéta bohatá na cholín vedie k nepriaznivej prestavbe a srdcovej dysfunkcii. Ak v strave obmedzíme červené mäso, znížime príjem cholínu a lecitínu, a tým znížime TMAO, čo má pozitívny vplyv na riziko srdcových ochorení. Preukázalo sa, že prechod na stredomorskú stravu znižuje markery SZ (44).
Neletálne mikrobiálne inhibítory predstavujú ďalšiu možnosť ovplyvnenia mikrobiómu. DMB 3,3-dimetyl-1-butanol (DMB) je inhibítor TMA ‑ lyázy a znižuje produkciu TMAO. Skúma sa vplyv viacerých inhibítorov TMA ‑ lyázy (45). Je zaujímavé, že DMB bol tiež pozorovaný v extra panenských olivových olejoch lisovaných za studena, dôležitej zložke stredomorskej stravy (46). Preto môže existovať určitá súvislosť medzi mikrobiálnou inhibíciou produkcie TMAO a výhodami stredomorskej stravy. Nie je však jasné, či zníženie TMAO v dôsledku inhibície TMA ‑ lyázy môže viesť k doposiaľ nerozpoznaným nežiaducim účinkom.
Veľmi zaujímavou metódou, ktorá je čoraz populárnejšia pri liečbe gastrointestinálnych ochorení, je transplantácia stolice. Zistilo sa, že fekálna transplantácia od štíhlych dobrovoľníkov vplývala na redukciu hmotnosti, ako aj zníženie hladín rizikových faktorov pre SZ (47).
Budúce smerovanie
Vzhľadom na zložitosť a veľkosť ČM a jeho metabolitov, ako aj na potenciálne prínosy a riziká ovplyvňovania ČM u vysokorizikových pacientov, je potrebný multidisciplinárny prístup. Do budúcna je potrebné rozsiahlejšie aplikovať úplné metagenomické sekvenovanie na lepšie definovanie funkčných zmien v ČM u pacientov s kardiovaskulárnymi ochoreniami. Takéto metódy sú drahé, ale poskytujú rozlíšenie na úrovni druhu, ako aj funkčný potenciál mikróbov v čreve na hostiteľa.
Existuje široké spektrum možností ovplyvňovania ČM a v súčasnosti prebieha výskum jednotlivých modalít pri kardiovaskulárnych ochoreniach. Zatiaľ nie je známe, ktorá metóda je najvhodnejšia na ovplyvnenie črevnej mikroflóry. Farmakologické zacielenie TMA‑lyázy a modifikácia stravy predstavujú prijateľné stratégie na zmiernenie prejavov a progresie SZ. Najbezpečnejšou a najsľubnejšou možnosťou však môže byť zmena stravy.
Na hlbšie pochopenie a následné terapeutické zacielenie osi črevá‑srdce bude potrebná úzka spolupráca medzi špecializovanými lekármi a výskumnými skupinami zameranými na mikrobióm s kapacitou pre analýzu produktov mikrobiálnej aktivity (metabolomické a/alebo proteomické analýzy), metagenomiku a viacúrovňovú bioinformatiku.
Záver
Podľa súčasných poznatkov sa na funkciu mikrobiómu pozerá ako na „endokrinný“ orgán, ktorý svojimi metabolitmi ovplyvňuje ľudskú fyziológiu. Črevný mikrobióm je prepojený s vývojom jednotlivých ochorení. Zatiaľ ostáva neisté, do akej miery ovplyvňuje vývoj a priebeh chorôb. Upresnenie úlohy mikrobiómu pri patogenéze je cieľom výskumu. Pochopenie a následná manipulácia črevnej mikroflóry môže byť v budúcnosti atraktívnou metódou na redukciu rizikových faktorov a minimalizáciu kardiovaskulárnych ochorení.
KORESPONDENČNÍ ADRESA AUTORA:
MUDr. Pavol Fülöp
Interná klinika UPJŠ LF a Nemocnice AGEL Košice-Šaca, a. s.
Lúčna 57, 040 15 Košice-Šaca
Cit. zkr: Vnitř Lék 2022;68(2):E4-E10
Článek přijat redakcí: 20. 1. 2022
Článek přijat po recenzích: 7. 3. 2022
Zdroje
1. Roth GA, Johnson C, Abajobir A et al. Global, regional, and national burden of cardiovascular diseases for 10 causes, 1990 to 2015. J Am Coll Cardiol. 2017;70 : 1-25.
2. Cook C, Cole G, Asaria P et al. The annual global economic burden of heart failure. Int J Cardiol 2014;171 : 368-376.
3. Eveborn GW, Schirmer H, Heggelund G et al. The evolving epidemiology of valvular aortic stenosis. the Tromso study. Heart (British Cardiac Society) 2013; 99(6): 396-400.
4. Harikrishnan S. Diet, the Gut Microbiome and Heart Failure. Card Fail Rev. 2019 May 24;5(2):119-122. doi: 10.15420/cfr.2018. 39. 2.
5. Crespo‑Leiro MG, Anker SD, Maggioni AP et al., Heart. Failure Association of the European Society of Cardiology. European Society of Cardiology Heart Failure Long‑Term Registry (ESC‑HF‑LT): 1-year follow‑up outcomes and differences across regions. Eur J Heart Fail 2016;18 : 613-625.
6. McDonagh TA, Metra M, Adamo M et al. ESC Scientific Document Group. 2021 ESC Guidelines for the diagnosis and treatment of acute and chronic heart failure. Eur Heart J. 2021 Sep 21;42(36):3599-3726. doi: 10.1093/eurheartj/ehab368.
7. Yancy CW, Jessup M, Bozkurt B et al. 2017 ACC/AHA/HFSA Focused Update of the 2013 ACCF/AHA Guideline for the Management of Heart Failure: A Report of the American College of Cardiology/American Heart Association Task Force on Clinical Practice Guidelines and the Heart Failure Society of America. Circulation. 2017 Aug 8;136(6):e137-e161. doi: 10.1161/CIR.0000000000000509.
8. Tang WH, Kitai T, Hazen SL. Gut microbiota in cardiovascular health and disease. Circ Res 2017;120 : 1183–96. https://doi. org/10.1161/CIRCRESAHA.117.309715.
9. Jakobsson HE, Abrahamsson TR, Jenmalm MC et al. Decreased gut microbiota diversity, delayed Bacteroidetes colonisation and reduced Th1 responses in infants delivered by Caesarean section. Gut 2014;63 : 559–66. https://doi. org/10.1136/gutjnl-2012-303249.
10. Tamburini S, Shen N, Wu H et al. The microbiome in early life: implications for health outcomes. Nat Med 2016;22 : 713–22. https://doi.org/10.1038/nm.4142.
11. Qin J, Li R, Raes J et al. A human gut microbial gene catalog established by metagenomic sequencing. Nature 2010;464 : 59 – 65. https://doi.org/10.1038/nature08821.
12. Yang X, Xie L, Li Y et al. More than 9,000,000 unique genes in human gut bacterial community: estimating gene numbers inside a human body. PLoS One 4: e6074, 2009. doi:10.1371/journal.pone.0006074.
13. Johnson EL, Heaver SL, Walters WA et al. Microbiome and metabolic disease: revisiting the bacterial phylum Bacteroidetes. J Mol Med Berl Ger 2017;95 : 1-8. https://doi. org/10.1007/s00109-016-1492-2.
14. Hehemann JH, Correc G, Barbeyron T et al. Transfer of carbohydrate‑active enzymes from marine bacteria to Japanese gut microbiota. Nature 2010;464 : 908-12. https://doi. org/10.1038/nature08937.
15. Sekirov I, Russell SL, Antunes LC et al. Gut microbiota in health and disease. Physiol Rev 2010;90 : 859–904. https://doi. org/10.1152/physrev.00045.2009.
16. Edwards CA, Havlik J, Cong W et al. Polyphenols and health: interactions between fibre, plant polyphenols and the gut microbiota. Nutr Bull 2017;42 : 356-60.
17. Martinez‑Guryn K, Hubert N, Frazier K et al. Small intestine microbiota regulate host digestive and absorptive adaptive responses to dietary lipids. Cell Host Microbe. 2018;23(4):458-469 e5.)
18. Jovel J, Patterson J, Wang W et al. Characterization of the gut microbiome using 16S or shotgun metagenomics. Front Microbiol 2016;7 : 459. https://doi.org/10.3389/ fmicb.2016.00459.
19. Wang WL, Xu SY, Ren ZG et al. Application of metagenomics in the human gut microbiome. World J Gastroenterol 2015;21 : 803–14. https://doi.org/10.3748/wjg.v21.i3.803.
20. Zhao L, Zhang F, Ding X et al. Gut bacteria selectively promoted by dietary fibers alleviate type 2 diabetes, Science 359 (2018) 1151-1156.
21. Zeisel SH, Warrier M. Trimethylamine N -oxide, the microbiome, and heart and kidney disease. Annu Rev Nutr 37 : 157-181, 2017. doi:10.1146/annurev‑nutr - 071816-064732.
22. Schiattarella GG, Sannino A, Esposito G et al. Diagnostics and therapeutic implications of gut microbiota alterations in cardiometabolic diseases. Trends Cardiovasc Med 29 : 141–147, 2019. doi:10.1016/j.tcm.2018. 08. 003.
23. Koeth RA, Wang Z, Levison BS et al. Intestinal microbiota metabolism of L ‑ carnitine, a nutrient in red meat, promotes atherosclerosis. Nat Med 19 : 576-585, 2013. doi:10.1038/ nm.3145.
24. Chen K, Zheng X, Feng M et al. Gut microbiota‑dependent metabolite trimethylamine N‑oxide contributes to cardiac dysfunction in western diet‑induced obese mice. Front Physiol 8 : 139, 2017. doi:10. 3389/fphys.2017.00139.
25. Sayin SI, Wahlström A, Felin J et al. Gut microbiota regulates bile acid metabolism by reducing the levels of tauro‑beta‑muricholic acid, a naturally occurring FXR antagonist. Cell Metab 17 : 225–235, 2013. doi:10.1016/j.cmet.2013. 01. 003.
26. Stumpff F. A look at the smelly side of physiology: transport of short chain fatty acids. Pflugers Arch 470 : 571–598, 2018. doi:10.1007/s00424-017-2105-9.
27. den Besten G, Lange K, Havinga R et al. Gut‑derived short ‑ chain fatty acids are vividly assimilated into host carbohydrates and lipids. Am J Physiol Gastrointest Liver Physiol 305: G900 –G910, 2013. doi:10.1152/ajpgi.00265.2013.
28. Trøseid M, Andersen GØ, Broch K et al. The gut microbiome in coronary artery disease and heart failure: Current knowledge and future directions. EBioMedicine. 2020 Feb; 52 : 102649. doi: 10.1016/j.ebiom.2020.102649.
29. Sandek A, Swidsinski A, Schroedl W et al. Intestinal blood flow in patients with chronic heart failure: a link with bacterial growth, gastrointestinal symptoms, and cachexia. J Am Coll Cardiol 2014;64 : 1092–102. https://doi.org/10.1016/j. jacc.2014. 06. 1179.
30. Kamo T, Akazawa H, Suzuki JI et al. Novel concept of a heart‑gut axis in the pathophysiology of heart failure. Korean Circ J 2017;47;663–9. https://doi.org/10.4070/kcj.2017.0028.
31. Sandek A, Bjarnason I, Volk HD et al. Studies on bacterial endotoxin and intestinal absorption function in patients with chronic heart failure. Int J Cardiol 2012;157 : 80-5. https:// doi.org/10.1016/j.ijcard.2010. 12. 016.
32. Zhou W, Cheng Y, Zhu P et al. Implication of Gut Microbiota in Cardiovascular Diseases. Oxid Med Cell Longev. 2020 Sep 26;2020 : 5394096. doi: 10.1155/2020/5394096.
33. Suzuki T, Heaney LM, Bhandari SS et al. Trimethylamine N‑oxide and prognosis in acute heart failure. Heart 2016;102 : 841–8. https://doi.org/10.1136/heartjnl-2015-308826.
34. Pasini E, Aquilani R, Testa C et al. Pathogenic gut flora in patients with chronic heart failure. JACC Heart Fail. 2016;4 : 220-227.
35. Nagatomo Y, Tang WH. Intersections between microbiomeand heart failure: revisiting the gut hypothesis. J Card Fail 2015;21 : 973-80. https://doi.org/10.1016/j.cardfail.2015. 09. 017.
36. Organ CL, Otsuka H, Bhushan S et al. Choline diet and its gut microbe‑derived metabolite, trimethylamine N‑oxide, exacerbate pressure overload ‑ induced heart failure. Circ Heart Fail. 2016;9:e002314.
37. Schuett K, Kleber ME, Scharnagl H et al. „Trimethylamine‑N - oxide and heart failure with reduced versus pre - served ejection fraction,“ Journal of the American College of Cardiology, vol. 70, no. 25, pp. 3202-3204, 2017.
38. Zeng Q, Song R, Fullerton DA et al. Interleukin-37 suppresses the osteogenic responses of human aortic valve interstitial cells in vitro and alleviates valve lesions in mice, Proc. Natl. Acad. Sci. U. S. A. 114 (2017)1631-1636.
39. Liu Z, Li J, Liu H et al. The intestinal microbiota associated with cardiac valve calcification differs from that of coronary artery disease. Atherosclerosis. 2019 May; 284 : 121-128. doi: 10.1016/j.atherosclerosis.2018. 11. 038.
40. Kocyigit D, Tokgozoglu L, Gurses KM et al. Association of dietary and gut microbiota‑related metabolites with calcific aortic stenosis. Acta Cardiol. 2021 Jul;76(5):544-552. doi: 10.1080/00015385.2020.1853968.
41. Kothari D, Patel S, Kim SK. Probiotic supplements might not be universally‑effective and safe: A review. Biomed Pharmacother. 2019 Mar;111 : 537-547. doi: 10.1016/j.biopha. 2018. 12. 104. Epub 2018 Dec 28. PMID: 30597307.
42. Costanza AC, Moscavitch SD, Faria Neto HC, Mesquita ET. Probiotic therapy with Saccharomyces boulardii for heart failure patients: a randomized, double‑blind, placebo‑controlled pilot trial. Int J Cardiol 2015;179 34850.
43. Awoyemi A, Mayerhofer C, Felix AS et al. Rifaximin or Saccharomyces boulardii in heart failure with reduced ejection fraction: Results from the randomized GutHeart trial. EBio - Medicine. 2021 Aug;70 : 103511. doi: 10.1016/j.ebiom.2021.103511. Epub 2021 Jul 28. PMID: 34329947; PMCID: PMC8339250.
44. Sanches Machado d’Almeida K, Ronchi Spillere S, Zuchinali P, et al. Mediterranean Diet and Other Dietary Patterns in Primary Prevention of Heart Failure and Changes in Cardiac Function Markers: A Systematic Review. Nutrients. 2018;10(1):58. Published 2018 Jan 10. doi:10.3390/nu10010058.
45. Iglesias‑Carres L, Hughes MD, Steele CN, et al. Use of dietary phytochemicals for inhibition of trimethylamine N‑oxide formation. J Nutr Biochem. 2021 May;91 : 108600. doi: 10.1016/j.jnutbio.2021.108600. Epub 2021 Feb 9. PMID: 33577949.
46. Wang Z et al. Non ‑ lethal Inhibition of Gut Microbial Trimethylamine Production for the Treatment of Atherosclerosis. Cell 163, 1585-1595, doi:10.1016/j.cell.2015. 11. 055 (2015). [PubMed: 26687352]
47. Marotz CA, Zarrinpar A. Treating obesity and metabolic syndrome with fecal microbiota transplantation. Yale J Biol Med 2016;89(3):383-8. PMID: 27698622.
48. Ahmad AF, Dwivedi G, O’Gara F et al. The gut microbiome and cardiovascular disease: current knowledge and clinical potential. Am J Physiol Heart Circ Physiol 317: H923-H938, 2019.
Štítky
Diabetologie Endokrinologie Interní lékařství
Článek vyšel v časopiseVnitřní lékařství
Nejčtenější tento týden
2022 Číslo E-2- Není statin jako statin aneb praktický přehled rozdílů jednotlivých molekul
- Magnosolv a jeho využití v neurologii
- Moje zkušenosti s Magnosolvem podávaným pacientům jako profylaxe migrény a u pacientů s diagnostikovanou spazmofilní tetanií i při normomagnezémii - MUDr. Dana Pecharová, neurolog
- Biomarker NT-proBNP má v praxi široké využití. Usnadněte si jeho vyšetření POCT analyzátorem Afias 1
-
Všechny články tohoto čísla
- Histiocytóza z Langerhansových buněk. Přehled příznaků, které přivádějí pacienty k lékařům všech medicínských odborností
- Terminologie adherence k léčbě – prvotní konsenzuální překlad pomocí Delphi metody
- Zriedkavá príčina spontánneho krvácania sleziny: kazuistika a prehľad literatúry
- prof. MUDr. Jarmila Siegelová, DrSc. – 80 let
- Mikrobióm pri srdcovom zlyhávaní a aortálnej stenóze
- Vnitřní lékařství
- Archiv čísel
- Aktuální číslo
- Pouze online
- Informace o časopisu
Nejčtenější v tomto čísle- Mikrobióm pri srdcovom zlyhávaní a aortálnej stenóze
- Histiocytóza z Langerhansových buněk. Přehled příznaků, které přivádějí pacienty k lékařům všech medicínských odborností
- Terminologie adherence k léčbě – prvotní konsenzuální překlad pomocí Delphi metody
- Zriedkavá príčina spontánneho krvácania sleziny: kazuistika a prehľad literatúry
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



