-
Medical journals
- Career
Ph negativní myeloproliferativní neoplázie na českých hematologických centrech – analýza dat MIND
Authors: N. Podstavková 1; B. Weinbergerová 1; M. Palová 2; A. Hluší 2; P. Bělohlávková 3; M. Brejcha 4; L. Stejskal 5; Z. Křístková 6; T. Nečasová 6; K. Hurdálková 6; A. Panovská 1; Y. Brychtová 1; L. Červinek 1; M. Horáčková 1; Z. Král 1; P. Žák 3; E. Faber 2; M. Doubek 1; J. Mayer 1
Authors‘ workplace: Interní hematologická a onkologická klinika LF MU a FN Brno 1; Hemato-onkologická klinika LF UP a FN Olomouc 2; 4. Interní hematologická klinika LF UK a FN Hradec Králové 3; Komplexní onkologické centrum Nový Jičín 4; Klinika hematoonkologie LF OU a FN Ostrava 5; Institut biostatistiky a analýz s. r. o., spin-off společnost MU Brno 6
Published in: Transfuze Hematol. dnes,27, 2021, No. 3, p. 242-253.
Category: Original Papers
doi: https://doi.org/10.48095/cctahd2021242Overview
Úvod: Databáze MIND (MyeloprolIferative Neoplasia Database) vznikla v květnu 2013 pod záštitou České leukemické skupiny pro život a sbírá data od pacientů s Ph negativními myeloproliferativními neopláziemi (Ph-MPN) sledovaných v participujících českých hematologických centrech. Cílem této práce je analýza zadaných dat pacientů a jejich srovnání s publikovanými mezinárodními výsledky. Materiál a metodika: Retrospektivní neintervenční multicentrická analýza byla provedena u celkem 641 validních pacientů s Ph-MPN zadaných do databáze MIND v období 2013–2020. Hodnocena byla data týkající se epidemiologie, diagnostiky, léčby a prognózy. Výsledky: Medián sledování pacientů v souboru byl 35 měsíců. Nejvíce byla zastoupena pravá polycytémie, PV (34 %), primární myelofibróza, PMF (31 %) a esenciální trombocytémie, ET (22 %). Z doprovodných příznaků se při stanovení diagnózy nejčastěji vyskytovaly únava (52 %), noční pocení (32 %), snížená aktivita (30 %) a svědění kůže (27 %). Splenomegalie byla přítomna u více než poloviny pacientů s PMF (54 %). Mutace JAK2 V617F byla zachycena u 90 % PV, 65 % PMF a 62 % ET; mutace CALR u 22 % ET a 16 % PMF. Cytogenetické abnormality byly pozorovány signifikantně frekventněji u PMF a PV oproti ET (17 a 15 vs. 3 % vyšetřených pacientů; p ≤ 0,005). Nejčastější komplikace v době diagnózy představovaly trombotické (22 %) a krvácivé příhody (10 %) bez signifikantního rozdílu četnosti mezi typy Ph-MPN (p > 0,017). U PV byla v 1. i 2. linii léčby nejčastěji podávána hydroxyurea (72 a 65 %), u ET v obou liniích anagrelid (52 a 82 %), u PMF v 1. linii hydroxyurea (70 %) a ve 2. linii ruxolitinib (30 %). Leukemická transformace byla zachycena u 3 % Ph-MPN, a to pouze u MF (10 %). Zemřelo celkem 17 % případů, nejvíce PMF (53 %). Medián celkového přežití nebyl dosažen u ET, na rozdíl od nejkratšího mediánu u sekundární MF (2,5 roku). U PMF měly nejnižší celkové přežití skupiny pacientů s vyšším věkem, vyšším IPSS a s mutací JAK2 V617F. Závěr: Potvrdili jsme četný výskyt symptomů zhoršujících kvalitu života pacientů s Ph-MPN. Cytogenetické abnormality byly sledovány výrazně častěji u pacientů s PMF a PV oproti ET. Trombotické a krvácivé události v době diagnózy provázely stejně frekventně PV, ET i PMF. Nejdéle přežívali pacienti s PV, zato u pacientů s MF byly pozorovány nejčastější leukemické transformace a nejnižší křivka přežívání. Vyšší věk, vyšší IPSS a přítomnost mutace JAK2 V617F se projevily jako faktory asociované s horším přežíváním pacientů s PMF.
ÚVOD
Ph negativní myeloproliferativní neoplázie (Ph-MPN) představují heterogenní skupinu vzácných onemocnění s incidencí 1–2/100 000 obyvatel [1]. Postihují hematopoetickou kmenovou buňku s následnou nekontrolovanou proliferací buněk myeloidní krevní řady, která se projevuje zvýšenou tvorbou funkčních erytrocytů, trombocytů a/nebo granulocytů [2]. Do této skupiny řadíme tři nejčastěji se vyskytující onemocnění – pravou polycytémii (PV), esenciální trombocytémii (ET) a primární myelofibrózu (PMF) [3]. Na patogenezi jejich vzniku se podílí porucha regulace dráhy JAK/STAT (Janus kinase/signal transducers and activators of transcription), která slouží k přenosu signálu z Janusových kináz na signální přenašeče a aktivátory transkripce [4,5]. Mutace aktivující tuto dráhu, tzv. „driver mutace“, zodpovídají za fenotyp onemocnění [6]. Dominantě se jedná o mutaci JAK2 V617F, která je přítomna u více než 95 % pacientů s pravou polycytémií a u 50–60 % pacientů s esenciální trombocytémií a primární myelofibrózou [7]. U zbývajících pacientů s ET a PMF nacházíme nejčastěji mutaci v genu pro kalretikulin (CALR) a mutaci v genu pro trombopoetinový receptor (myeloproliferative leukemia virus oncogene – MPL) [7]. Přítomnost těchto mutací se u většiny pacientů navzájem vylučuje, přesto žádná z nich není specifická pro jeden určitý typ Ph-MPN a existuje i malá část pacientů (10–15 %), u kterých není prokázána ani jedna z těchto tří mutací, JAK2 V617F, CALR a MPL, tzv. „tripple negativních“ [8]. U části pacientů můžeme kromě těchto somatických mutací najít spektrum dalších tzv. přídatných genetických změn, které nejsou specifické pouze pro Ph-MPN a jejich přítomnost má vliv především na celkovou prognózu onemocnění, např. ASXL1 (additional sex-combs-like 1), TET2 (TET oncogene family member 2) nebo SRSF2 (serine/arginine-rich splicing factor 2) [2,9].
Skupinu Ph-MPN pojí kromě společné patogeneze obdobný klinický obraz (konstituční symptomy a splenomegalie), zvýšený výskyt trombotických a krvácivých komplikací a riziko fibrotické a leukemické transformace [2,10]. Cílem správně vedené terapie je prevence vzniku těchto příhod snižujících celkovou dobu přežití. V zásadě je důležité přesné odlišení jednotlivých typů Ph-MPN na základě kombinace molekulárně-biologického a histologického vyšetření kostní dřeně s cílem stanovení rizika progrese do myelofibrózy a sekundární leukémie a následné volby odpovídající léčebné strategie [2,9].
MyeloprolIferative Neoplasia Database – „MIND“, představuje databázi určenou pro sběr dat od pacientů s Ph-MPN sledovaných na participujících českých hematologických centrech. Databáze vznikla v roce 2013 pod záštitou České leukemické skupiny pro život (the Czech Leukemia Study Group for Life – CELL) ve spolupráci s německou pracovní skupinou SAL (Study Alliance Leukemia).
Cílem naší práce byla analýza dat pacientů s Ph-MPN zadaných do databáze MIND a jejich srovnání s doposud publikovanými mezinárodními výsledky.
MATERIÁL A METODIKA
Provedli jsme retrospektivní multicentrickou neintervenční analýzu dat týkajících se epidemiologie, diagnostiky, léčby a přežívání případů Ph-MPN zadaných do databáze MIND v letech 2013–2020 [11]. Pacienti byli diagnostikováni podle kritérií Světové zdravotnické organizace (World Health Organisation – WHO) z roku 2016 v celkem 6 participujících českých hematoonkologických centrech (Interní hematologická a onkologická klinika LF MU a FN Brno, Hemato-onkologická klinika LF UP a FN Olomouc, IV. Interní hematologická klinika LF UK a FN Hradec Králové, Komplexní onkologické centrum Nový Jičín, Klinika hematoonkologie FN Ostrava a Hematologicko-onkologické oddělení FN Plzeň), přičemž pacienti diagnostikovaní před rokem 2016 byli následně taktéž přehodnoceni dle nejnovějších WHO kritérií z roku 2016 [3].
Databáze je členěna do 5 částí, které představují „Vstup“, „Follow-up“, „Terapie“, „Těhotenství“ a „Aktualizace stavu pacienta“. Vstupní formulář obsahuje data z doby diagnózy Ph-MPN vč. základních údajů předchorobí, fyzikálního vyšetření a výsledků laboratorních a zobrazovacích vyšetření získaných ze zdrojové dokumentace. Tyto formuláře jsou shodné rovněž pro část „Follow-up“, kde jsou průběžně zaznamenávána data s minimální frekvencí 12 měsíců k hodnocení vývoje stavu onemocnění. Část „Terapie“ zahrnuje detailní data týkající se konkomitantní, specifické a symptomatické léčby, alogenní transplantace krvetvorných buněk, komplikací terapie a hodnocení léčebné odpovědi podle společných kritérií European Leukemia Net (ELN) a International Working Group-Myeloproliferative Neoplasms Research and Treatment (IWG-MRT) [12,13]. Stupeň závažnosti nežádoucích účinků terapie byl hodnocen dle CTCAE verze 5.0. z roku 2017 (Common Terminology Criteria for Adverse Events) [14]. Část databáze „Těhotenství“ obsahuje základní informace o průběhu, komplikacích a terapii MPN v období těhotenství u gravidních pacientek. Poslední formulář „Aktualizace stavu“ zaznamenává aktuální stav sledování pacienta v databázi, poslední podanou léčbu a dosaženou léčebnou odpověď. V případě ukončení sledování pacienta je navíc uveden i důvod.
Součástí databáze je také sledování kvality života nemocných pomocí mezinárodních dotazníků hodnotících jednak subjektivní příznaky (MPN Symptoms Assessment Form Total Symptom Score – MPN-SAF TSS) a kvalitu života (European Quality of Life five-dimension three-level Questionnaire – EQ-5D-3L) [15,16]. V rámci vstupních a „follow-up“ formulářů jsou zaznamenávány také komplexní výsledky laboratorních vyšetření periferní krve a kostní dřeně. Stupeň fibrózy bioptického vzorku kostní dřeně byl hodnocen dle klasifikace EUMNET (European Myelofibrosis Network) [17]. Trombotické riziko u PV bylo posouzeno na základě věku pacienta a trombotické události v anamnéze, u ET podle tzv. „IPSET skóre“ (International Prognostic Score of Thrombosis in Essential Thrombocytemia) [18,19]. U PMF bylo určeno riziko progrese onemocnění v době diagnózy na základě IPSS (International Prognostic Scoring System) a pomocí DIPSS (Dynamic International Prognostic Scoring System) v rámci každoročního „follow-up“ [20,21].
Statistické zhodnocení dat bylo provedeno pomocí Fisherova exaktního testu, pro analýzy byla použita jako úroveň statistické významnosti a = 0,05, při mnohonásobném testování byla použita korekce dle Bonfferoniho s úrovní statistické významnosti a = 0,017. Incidence trombotických příhod a křivky přežití byly počítány jako 1 – kumulativní incidence od data diagnózy. Diagnóza sekundární MF byla hodnocena jako kompetitivní riziko, takže pacienti byli v křivkách hodnoceni jako PV/ET pouze do doby přechodu do sekundární MF. Pro pacienty s prefibrotickou PMF byl přechod do fibrotického stadia PMF považován za kompetitivní riziko, takže tito pacienti byli v křivkách sledováni pouze v rámci prefibrotické fáze. Úmrtí bylo považováno jako událost pouze v případě celkového přežití, v ostatních případech jako kompetitivní riziko. Do analýzy přežití byli vzati pouze pacienti s kompletními údaji pro danou konkrétní analýzu.
Databáze MIND byla schválena multicentrickou Etickou komisí (02-290420/EK). Všichni analyzovaní pacienti souhlasili se zařazením do MIND a podepsali informovaný souhlas.
VÝSLEDKY
Do databáze MIND bylo ve sledovaném období zadáno celkem 11 157 vstupních a „follow-up“ formulářů u celkem 641 pacientů.
Základní charakteristika pacientů při vstupu do databáze
Nejčastější diagnózu při vstupu do databáze představovala PV (34 %), následovaná fibrotickou fází PMF (23 %), ET (22 %) a prefibrotickou fází PMF (8 %). Ostatní diagnózy tvořily sekundární MF po ET nebo po PV (3 %) a histologicky neurčené a neklasifikovatelné Ph-MPN (10 %).
Základní charakteristiku analyzovaného souboru pacientů s PV, ET a PMF ukazuje tab. 1. Poměr zastoupení mužů a žen se zásadně nelišil ve skupině pacientů s PV a PMF (48 vs. 52 % u PV, p = 0,67; 54 vs. 46 % u PMF, p = 0,32), ženské pohlaví bylo častěji zastoupeno u pacientů s ET (65 vs. 35 %; p < 0,05). Medián věku v době diagnózy byl nejvyšší u pacientů s PMF (64 let).
Table 1. Základní charakteristika souboru pacientů s PV, ET a PMF v době diagnózy (n = 641). 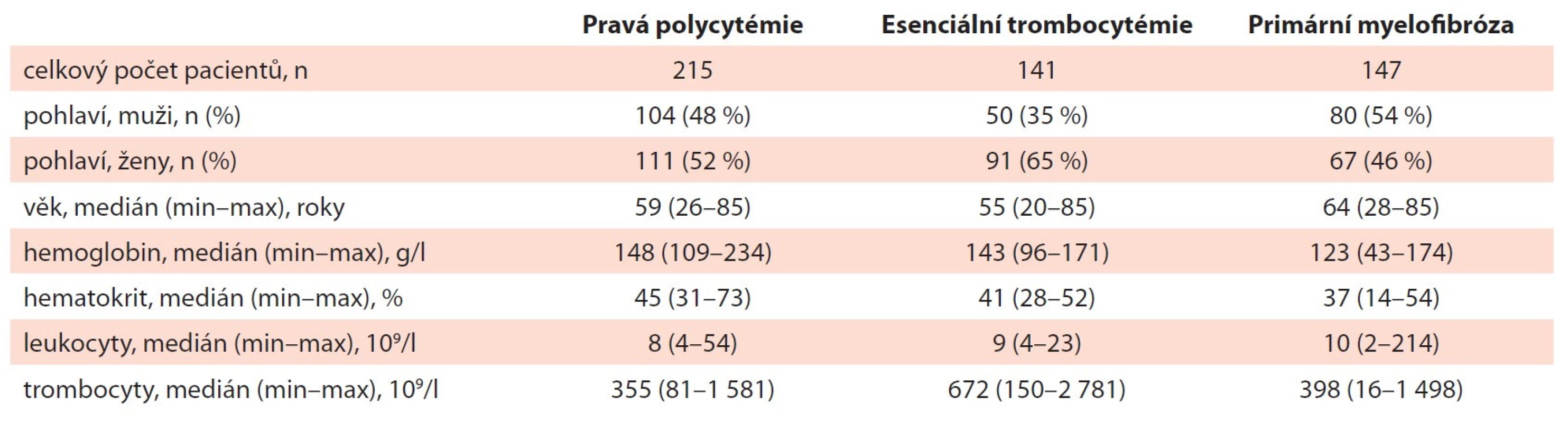
ET – esenciální trombocytémie, PMF – primární myelofi bróza, PV – pravá polycytémie Ze subjektivních příznaků se při stanovení diagnózy nejčastěji vyskytovaly únava (52 %), noční pocení (32 %), snížená aktivita (30 %), svědění kůže (27 %) a břišní dyskomfort (24 %). Oproti pacientům s ET se u pacientů s PMF signifikantně častěji vyskytovala únava (43 vs. 67 %; p < 0,05), noční pocení (21 vs. 38 %; p < 0,05) a snížená aktivita (23 vs. 43 %; p < 0,05), u ostatních průvodních symptomů nebyl zaznamenán signifikantní rozdíl v četnosti výskytu mezi jednotlivými diagnózami. Splenomegalie byla vstupně přítomna u 25 % pacientů (n = 161), přičemž v největším procentu byla zachycena u pacientů s PMF (54 %; p < 0,017). K nejčastějším komplikacím při stanovení diagnózy patřily trombotické (22 %, 144 případů) a krvácivé (10 %, 61 případů) příhody. Porovnání zastoupení symptomů a splenomegalie u jednotlivých diagnóz je znázorněno na obr. 1.
V následující části analýzy jsme hodnotili data tří nejčastějších Ph-MPN (PV, ET, PMF).
Image 1. Výskyt symptomů, splenomegalie a komplikujících událostí v čase diagnózy Ph-MPN zadaných do MIND (n = 641). 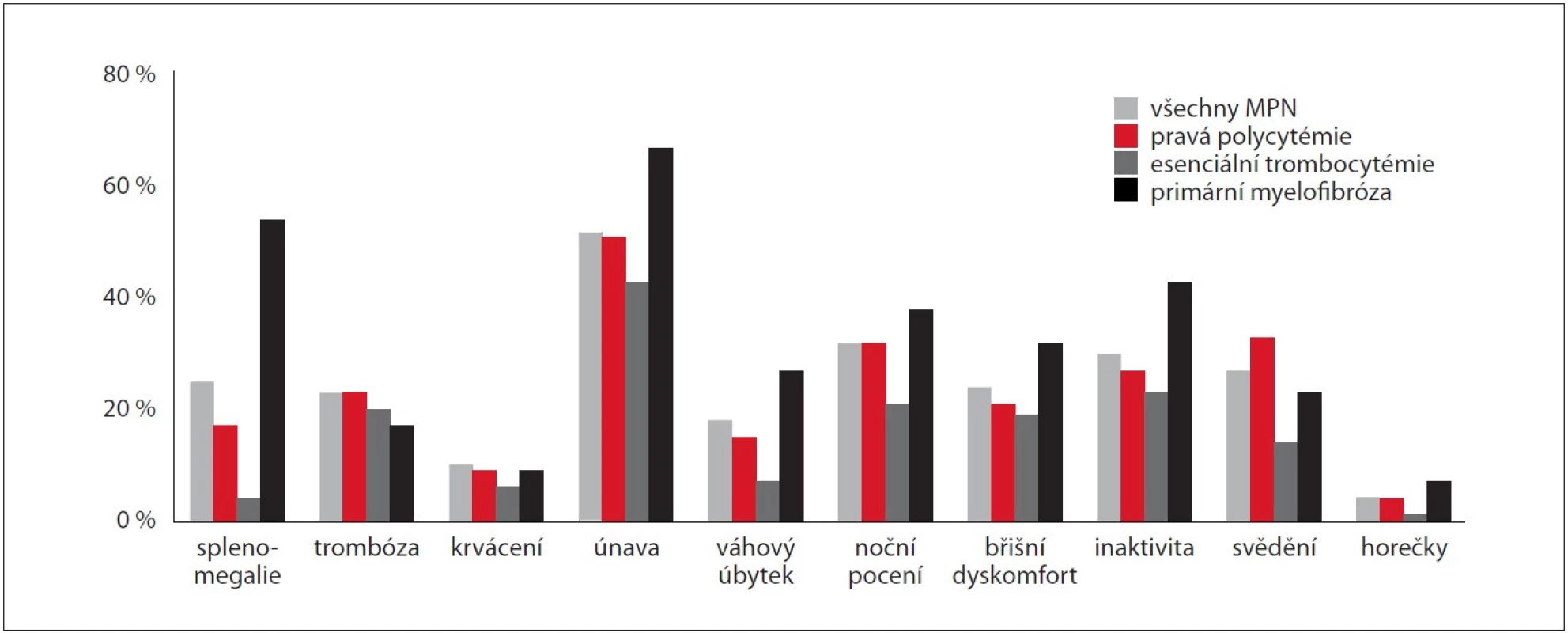
MIND – MyeloprolIferative Neoplasia Database, Ph-MPN – Ph negativní myeloproliferativní neoplázie Molekulárně-genetické a cytogenetické nálezy
Vyšetření mutace JAK2 V617F bylo provedeno u celkem 97 % pacientů s PV (n = 208), přičemž prokázaná byla u 90 % ze všech PV (n = 194). Ze čtrnácti JAK2 V617F negativních pacientů byla vyšetřena mutace JAK2 exon 12 u 79 % (n = 11) a identifikována byla u 2 z nich (1 % ze všech PV). U esenciální trombocytémie bylo vyšetřeno celkem 139 pacientů (99 %) na přítomnost mutace JAK2 V617F, nalezena byla u 62 % všech ET (n = 87). Druhá nejčastější mutace u ET byla CALR hodnocená u 41 % pacientů (n = 58), přičemž detekována byla u 22 % ze všech ET (n = 31). Mutace MPL byla vyšetřena u 11 % pacientů s ET, nalezena byla u 1 pacienta (1 % ze všech ET). Co se týče PMF, vyšetření mutace JAK2 V617F bylo provedeno u 95 % pacientů (n = 139), pozitivní nález byl u 65 % ze všech PMF (n = 95). Mutace CALR byla vyšetřena u 34 % pacientů s PMF (n = 50), identifikována byla u 16 % ze všech PMF (n = 24) a mutace MPL byla hodnocena u 10 % pacientů (n = 15), pozitivní byla u 2 % ze všech PMF (n = 3). Cytogenetické vyšetření kostní dřeně bylo provedeno u 141 pacientů s PV, 116 pacientů s ET a 86 pacientů s PMF, četnost záchytu abnormálních cytogenetických změn se významně nelišila u PMF oproti PV (17 vs. 15 %; p = 0,85). Naproti tomu jsme prokázali signifikantní rozdíl mezi PMF a ET (17 vs. 3 %; p < 0,05) a podobně mezi PV a ET (15 vs. 3 %; p < 0,05). Nejčastěji byly pozorovány trizomie chromozomu 8 (14 %, n = 5), monozomie chromozomu 7 (3 %, n = 1) a komplexní změny karyotypu (5 %, n = 2).
Hodnocení rizika progrese, trombotické a krvácivé komplikace
Více než polovina pacientů s PV (57 %, n = 122) byla v čase primární diagnózy ve vysokém trombotickém riziku. Co se týče ET, v době diagnózy bylo IPSET skóre vysoké u 56 % (n = 79), střední u 29 % (n = 40) a nízké u 15 % pacientů (n = 21). V době diagnózy PMF bylo riziko dle IPSS zhodnoceno jako nízké u 29 % (n = 28), střední-1 u 34 % (n = 33), střední-2 u 23 % (n = 22) a vysoké riziko u 14 % nemocných (n = 14).
Trombotické komplikace v době před stanovením diagnózy Ph-MPN byly zachyceny u 22 % pacientů s PV (n = 49), u 20 % pacientů s ET (n = 28) a u 17 % pacientů s PMF (n = 25), přičemž jejich četnost se mezi jednotlivými diagnózami signifikantně nelišila (p = 0,73 vs. 0,38 vs. 0,71). Konkrétně venózní trombóza se objevila u 29 % případů, arteriální trombóza u 16 % případů, ischemická cévní mozková příhoda u 15 % případů, plicní embolie u 10 % případů a tranzitorní ischemická ataka v 8 % případů, přičemž u jednoho pacienta se mohlo objevit i více trombotických příhod. Krvácivé komplikace vykazovalo v době diagnózy 9 % pacientů s PV (n = 20), 6 % pacientů s ET (n = 9) a 9 % pacientů s PMF (n = 13), přičemž jejich četnost se opět mezi jednotlivými diagnózami signifikantně nelišila (p = 0,59 vs. 1 vs. 0,59). Intenzita krvácení byla zaznamenána ve většině případů jako nezávažná (65 %, n = 33), řešená lokálním ošetřením nebo hemostyptiky. Naproti tomu velké krvácení, které si vyžádalo chirurgické ošetření a následnou hospitalizaci, bylo pozorováno u zhruba pětiny všech krvácivých událostí (20 %, n = 10). Stupeň intenzity krvácení nebyl znám u 16 % dokumentovaných případů krvácení (n = 8). U jednoho pacienta mohlo být zaznamenáno i více krvácivých příhod.
Specifická terapie
První linie cytoredukční terapie byla zahájena u celkem 188 pacientů s PV, přičemž jednoznačně nejčastěji užívaným lékem byla hydroxyurea (72 %, n = 135) a dalšími byly anagrelid (12 %, n = 22) a interferon alfa (10 %, n = 19). Nejlepší dosažená léčebná odpověď byla hodnocena u celkem 69 % pacientů s PV (n = 129), z nichž 74 % (n = 95) dosáhlo stabilního onemocnění, 21 % (n = 27) parciální remise bez histologické verifikace a kompletní remise vč. histologické verifikace byla dosažena pouze u 1 % pacientů (n = 1), kteří byli léčeni interferonem alfa. Druhá linie léčby byla zahájena u 38 % pacientů (n = 71), lék volby představovala opět hydroxyurea, a to buď v monoterapii (24 %, n = 17), nebo v kombinaci s interferonem alfa (24 %, n = 17), případně anagrelidem (17 %, n = 12). Dalším lékem 2. linie byl interferon alfa v monoterapii (11 %, n = 8) a v neposlední řadě u 2 pacientů ropeginterferon alfa-2b, registrovaný od roku 2020 v České republice. Nejlepší dosažená léčebná odpověď ve 2. linii byla hodnocena u 73 % pacientů s pravou polycytémií (n = 52) s efektem stabilního onemocnění u 85 % pacientů (n = 44), parciální remise bez histologické verifikace u 13 % pacientů (n = 7) a progrese onemocnění u 2 % pacientů (n = 1).
Cytoredukční terapie první linie byla zahájena u 110 pacientů s diagnózou ET, nejčastěji byly podávány anagrelid (52 %, n = 57) a hydroxurea (45 %, n = 49). Nejlepší dosažená léčebná odpověď byla hodnocena u 81 % pacientů (n = 89), z nichž u 74 % (n = 66) se jednalo o stabilní onemocnění, u 25 % pacientů (n = 22) o parciální remisi bez histologické verifikace a u 1 % pacientů (n = 1) došlo k progresi onemocnění. Druhá linie terapie byla podávaná celkem 38 % pacientů (n = 42), nejčastěji taktéž anagrelid, a to buď samostatně (36 %, n = 15) nebo v kombinaci s hydroxyureou (36 %, n = 15) nebo interferonem alfa (10 %, n =4). Nejlepší léčebná odpověď byla hodnocena u 83 % pacientů (n = 35), z nich u 86 % pacientů bylo dosaženo stabilní onemocnění (n = 30), u 11 % parciální remise bez histologické verifikace (n = 4) a u 3 % pacientů (n = 1) byla zaznamenána progrese onemocnění.
Celkem 110 pacientů s PMF bylo léčeno cytoredukcí, v naprosté většině v 1. linii hydroxyureou (70 %, n = 77), dále anagrelidem (16 %, n = 18) a ruxolitinibem (6 %, n = 7). Nejlepší léčebná odpověď na 1. linii byla vyhodnocena u celkem 60 % pacientů (n = 66), přičemž stabilního onemocnění bylo dosaženo u 61 % pacientů (n = 40), u 9 % (n = 6) klinického zlepšení, u 8 % (n = 5) parciální remise bez histologické verifikace a u 23 % pacientů (n = 15) nemoc zprogredovala. Druhá linie terapie byla zahájena u 46 % pacientů (n = 51), nejčastěji byl podáván ruxolitinib (30 %, n = 15), hydroxyurea v kombinaci s anagrelidem (18 %, n = 9) a hydroxyurea v monoterapii (14 %, n = 7). Nejlepší léčebná odpověď byla posouzena ve 2. linii u 78 % pacientů (n = 40) a vyhodnocena jako stabilní onemocnění u 45 % (n = 18), klinické zlepšení u 33 % (n = 13), parciální remise bez histologické verifikace u 10 % (n = 4) a progrese byla pozorována u 13 % nemocných (n = 5).
Změna terapie v průběhu sledování byla provedena u 255 (40 %) pacientů, přičemž nejčastějším důvodem byla u všech 3 typů Ph-MPN toxicita medikace (31 %, n = 79) nebo nedostatečná léčebná odpověď (30 %, n = 77). V průběhu léčby se hematologické nežádoucí účinky vyskytly u 13 % pacientů s PV (n = 28), u 10 % pacientů s ET (n = 14) a 27 % pacientů s PMF (n = 39). Konkrétně u celkem 65 % (n = 53) se jednalo o anémii maximálně stupně 3, u 52 % (n = 42) o trombocytopenii maximálně stupně 4 a u 12 % (n = 10) případů o neutropenii maximálního stupně 3. Nehematologické komplikace cytoredukce byly zaznamenány u 20 % pacientů s PV (n = 44), u 16 % pacientů s ET (n = 22) a u 18 % pacientů s PMF (n = 26). Při terapii hydroxyureou byly pozorovány nejčastěji zažívací potíže stupně 1 (3 %, n = 11) a kožní exantém maximálně stupně 2 (3 %, n = 11). Terapie anagrelidem byla provázena v 5 % krvácením (n = 7), v jednom případě až stupně 4, ve 4 % bolestmi hlavy (n = 6) a taktéž ve 4 % palpitacemi (n = 6) maximálně stupně 2. Léčba interferonem alfa byla v 10 % komplikována flu-like syndromem maximálně stupně 2 (n = 8), v 9 % zažívacími obtížemi maximálně stupně 2 (n = 7) a v 8 % kožním exantémem maximálně stupně 2 (n = 6). Užívání ruxolitinibu doprovázely u 20 % případů infekční komplikace nejvýše stupně 3 (n = 8) a v 5 % (n = 2) kožní nádory, u kterých ale nebyla prokázána přímá souvislost s užíváním ruxolitinibu.
Alogenní transplantace krvetvorných buněk byla provedena u 3 % pacientů (n = 16), přičemž dominantně se jednalo o pacienty s PMF (75 %, n = 12), zbytek tvořili pacienti se sekundární MF po PV a ET (25 %, n = 4).
Follow up
V srpnu 2020 byl medián sledování v databázi 35 měsíců a pravidelný „follow-up“ pokračoval u celkem 65 % zadaných pacientů (n = 418). Devadesát případů (17 %) nepokračovalo ve sledování z důvodu úmrtí a 6 % (n = 35) ukončilo účast v databázi na vlastní žádost. Největší procento zemřelých představovali pacienti s PMF (53 %, n = 48). Co se týče důvodu úmrtí pacientů byla u 31 % (n = 28) shledána souvislost s diagnózou Ph-MPN, přičemž jako primární důvod úmrtí byla nejčastěji infekce (29 %, n = 8) nebo progrese základního onemocnění (29 %, n = 8).
U všech tří typů Ph-MPN došlo v průběhu „follow-up“ k postupnému zlepšení kvality života pacientů, přičemž nejmarkantněji byl tento jev patrný u pacientů s PMF (obr. 2).
Image 2. Hodnocení kvality života dle dotazníku EQ-5D-3L v průběhu sledování v MIND při vstupu do databáze, na 12měsíčním a 24měsíčním „follow-up“ (n = 503). 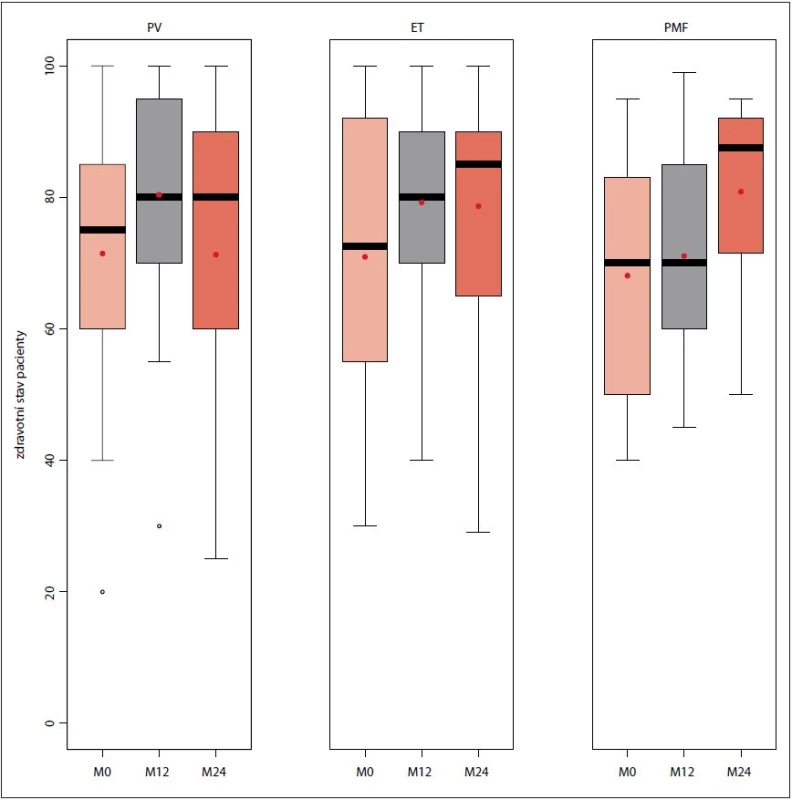
EQ-5D-3L – European Quality of Life five-dimension three-level Questionnaire, ET – esenciální trombocytémie, MIND – Myeloproliferative Neoplasia Database, PMF – primární myelofibróza, PV – pravá polycytémie V průběhu sledování pacientů v databázi došlo ke snížení výskytu krvácivých příhod, u pacientů s PV z 9 % (n = 19) na vstupu na žádnou příhodu ve 24. měsíci „follow-up“, u PMF z 9 % (n = 13) na 1 % (n = 1), u pacientů s ET z 6 % (n = 8) na 1 % (n = 1). Obdobně bylo pozorováno snížení četnosti trombotických příhod. U PV došlo ke snížení reálného výskytu z 26 % (n = 55) na 2 % (n = 2) ve 24. měsíci „follow-up“, u ET z 23 % (n = 32) na 1 % (n = 1) a u PMF z 19 % (n = 28) na žádnou trombotickou příhodu. Obr. 3 a 4 přehledně ukazují incidenci krvácivých a trombotických příhod v průběhu sledování pacientů v závislosti na typu diagnózy.
Image 3. Kumulativní incidence trombotických příhod u pacientů s Ph-MPN v průběhu sledování v MIND (n = 352). 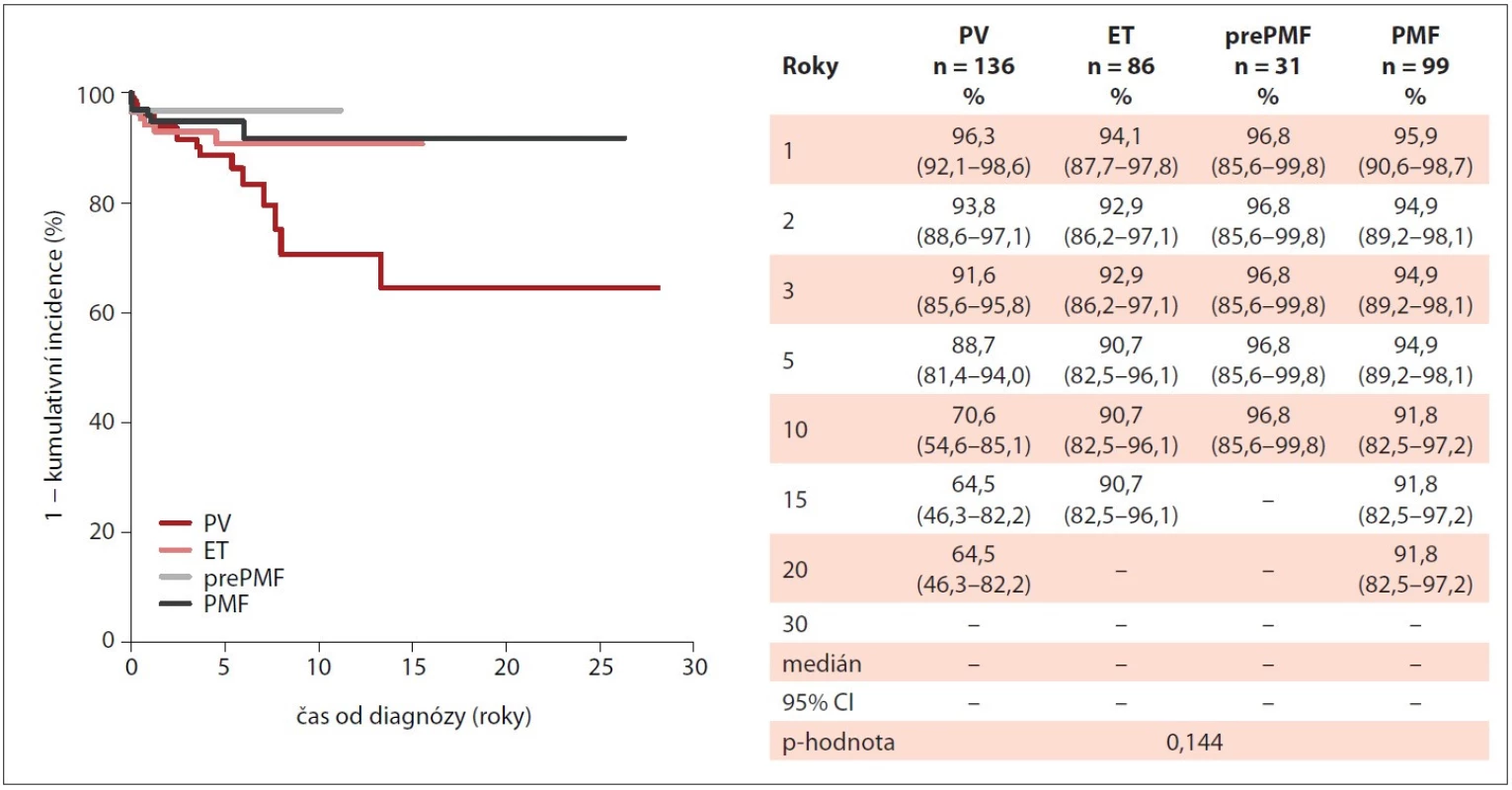
ET – esenciální trombocytémie, MIND – MyeloprolIferative Neoplasia Database, Ph-MPN – Ph negativní myeloproliferativní neoplázie, PMF – primární myelofibróza, prePMF – prefibrotická primární myelofibróza, PV – pravá polycytémie Image 4. Incidence krvácivých příhod u pacientů s Ph-MPN v průběhu sledování v MIND (n = 503). 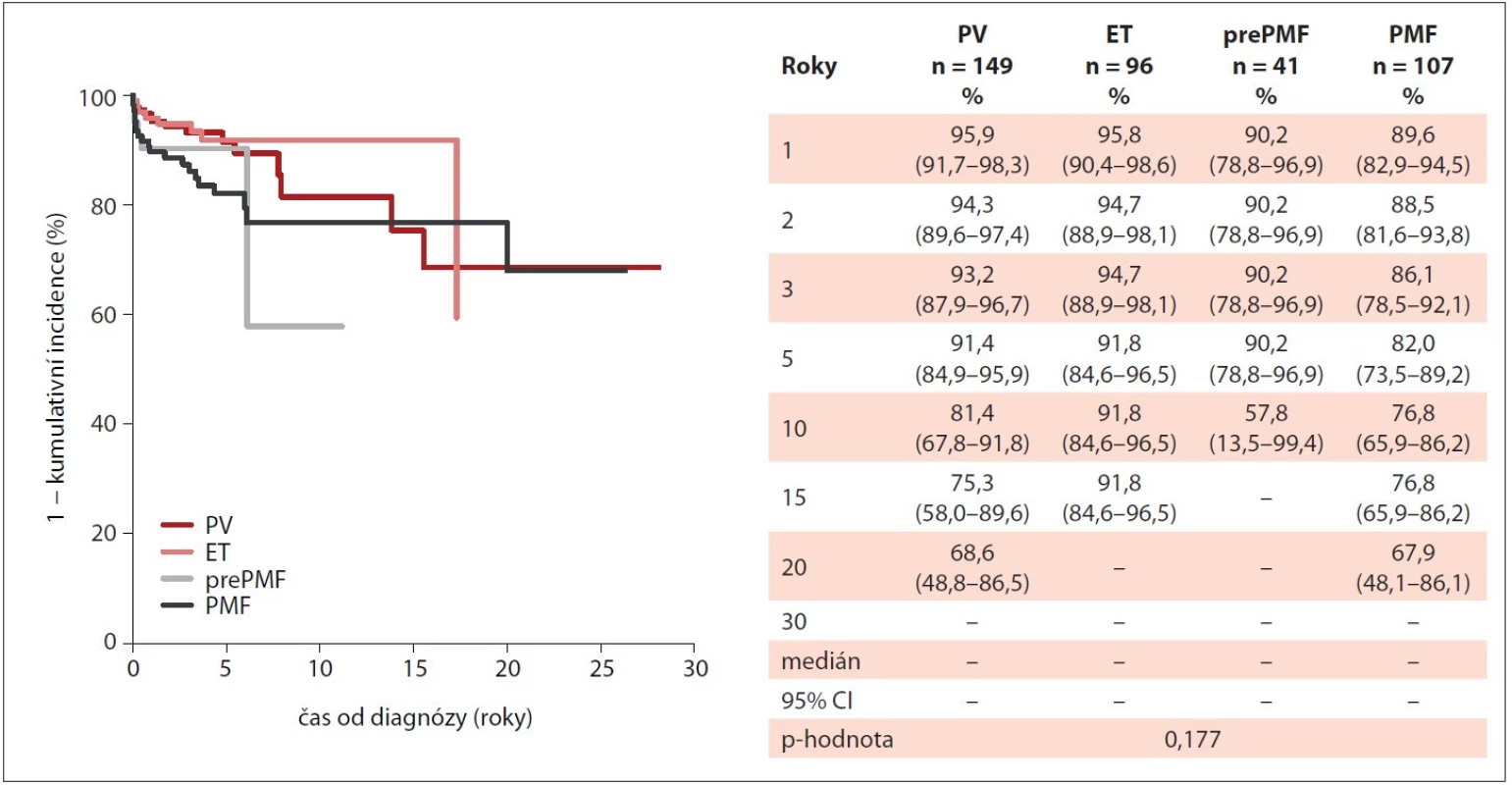
ET – esenciální trombocytémie, MIND – MyeloprolIferative Neoplasia Database, Ph-MPN – Ph negativní myeloproliferativní neoplázie, PMF – primární myelofibróza, PV – pravá polycytémie V průběhu sledování došlo u 2 % pacientů (n = 9) k přechodu do sekundární myelofibrózy, dominantně u pacientů s PV (n = 6). Přechod do sekundární akutní myeloidní leukémie byl zaznamenán u 2 % pacientů ze všech Ph-MPN (n = 15), přičemž se jednalo pouze o pacienty s MF – 10 % (PMF, n = 8; sekundární MF po PV, n = 5; sekundární MF po ET, n = 2).
Medián celkového přežití nebyl dosažen u pacientů s diagnózou ET a PV, naopak nejkratší medián v porovnání s ostatními diagnózami vykazovali pacienti se sekundární MF po ET nebo po PV (2,5 roku). Jako negativní prognostický faktor signifikantně zhoršující celkové přežití u PMF byl shledán věk nad 65 let (medián 4,6 vs. 20,7 let; p < 0,001) a IPSS v době diagnózy (IPSS střední-2 : 4,8 let vs. IPSS vysoké: 2,9 let; p < 0,001). Naproti tomu CALR mutace byla u pacientů s PMF spojená s delším mediánem celkového přežití než mutace JAK2 V617F (21,3 vs. 7,5 let). Křivky celkového přežití jsou znázorněny na obr. 5–7.
Image 5. Kumulativní incidence celkového přežití pacientů v MIND dle typu diagnózy Ph-MPN (n = 424). 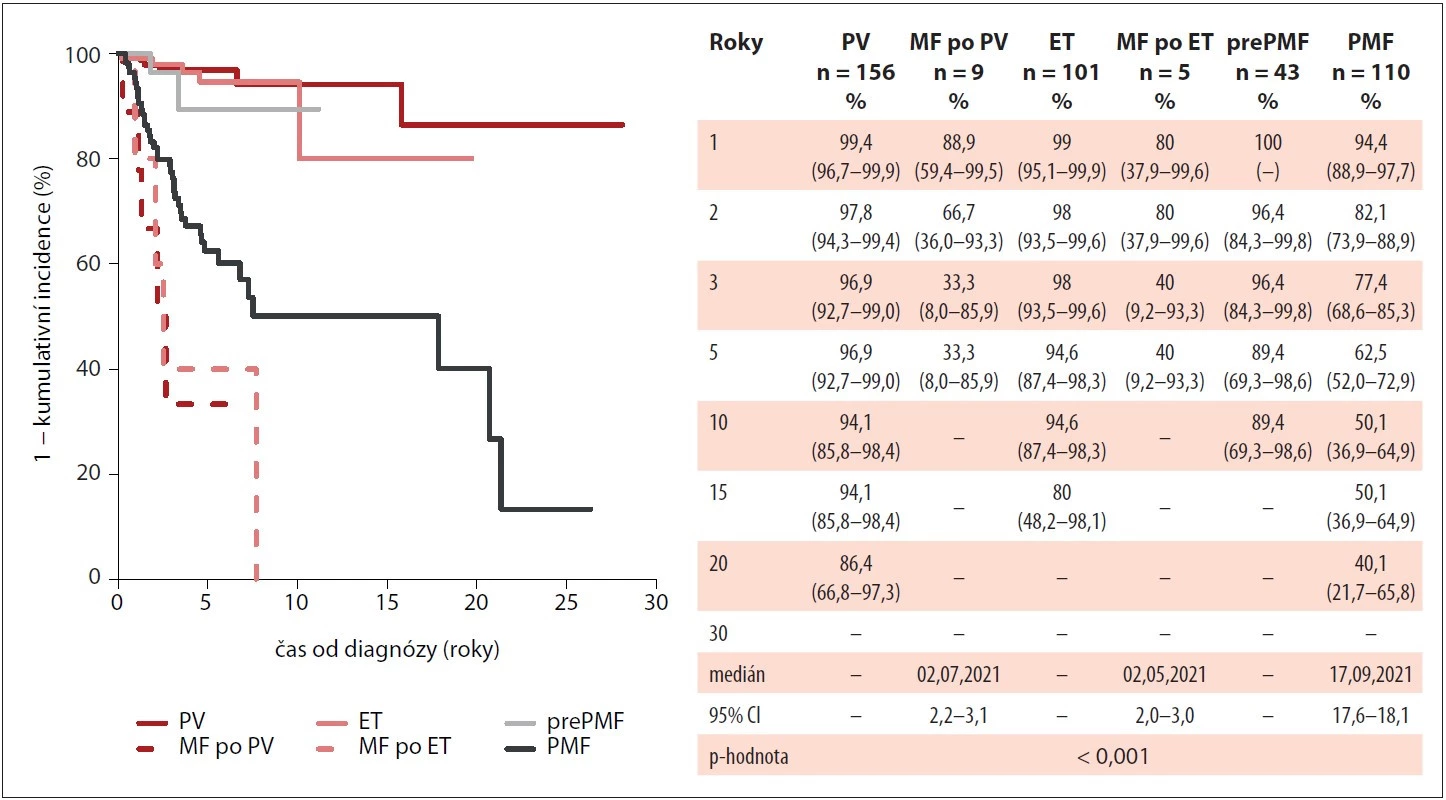
ET – esenciální trombocytémie, MF po ET – myelofibróza po esenciální trombocytémii, MF po PV – myelofibróza po pravé polycytémii, MIND – MyeloprolIferative Neoplasia Database, Ph-MPN – Ph negativní myeloproliferativní neoplázie, PMF – primární myelofibróza, prePMF – prefibrotická primární myelofibróza, PV – pravá polycytémie Image 6. Kumulativní incidence celkového přežití pacientů s PMF v MIND dle IPSS v době diagnózy (n = 71). 
IPSS – International Prognostic Scoring Systém, MIND – MyeloprolIferative Neoplasia Database, PMF – primární myelofibróza Image 7. Kumulativní incidence celkového přežití pacientů s PMF v MIND dle věku v době diagnózy (n = 110). 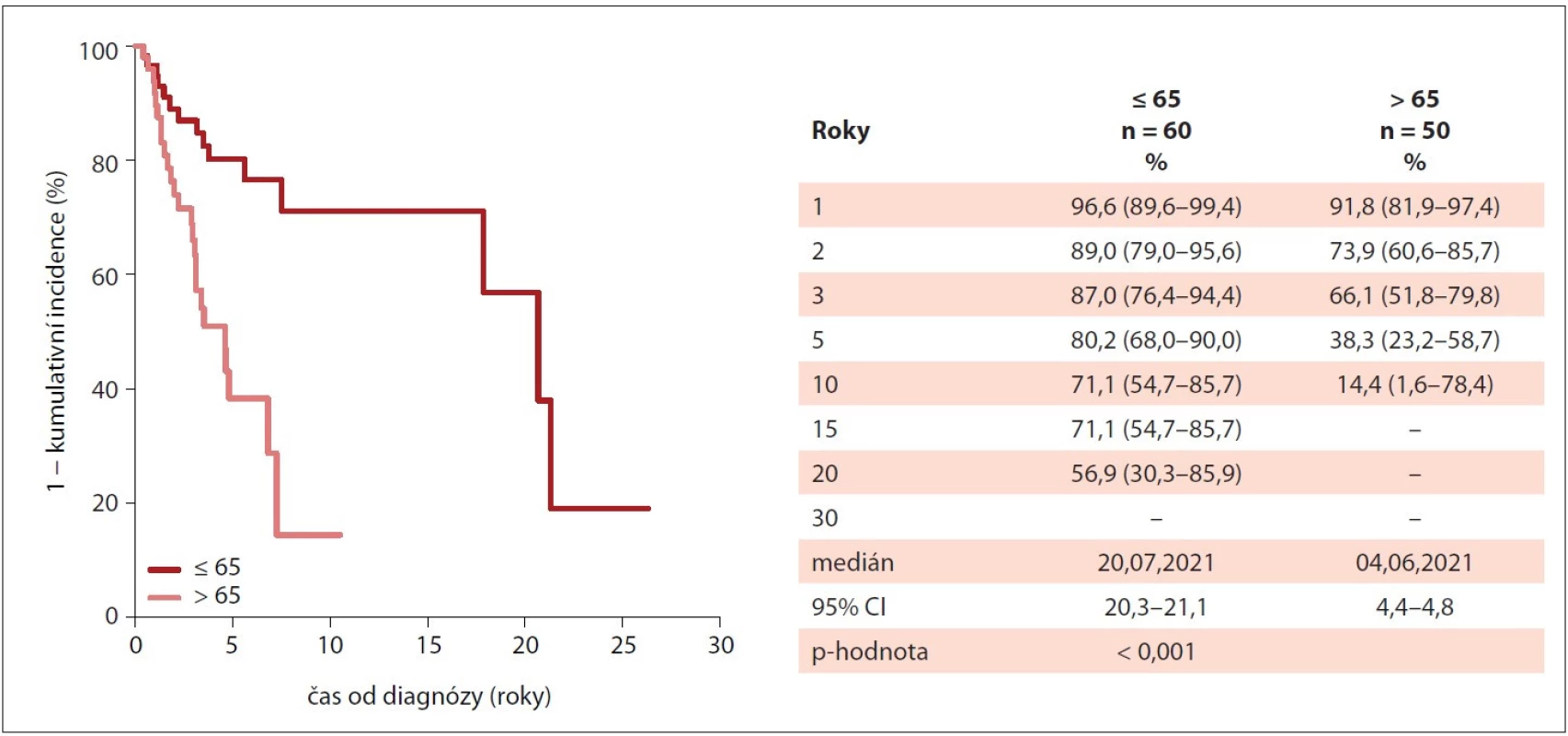
MIND – MyeloprolIferative Neoplasia Database, PMF – primární myelofibróza DISKUZE
Naše studie představuje dosud největší publikovanou multicentrickou analýzu komplexně hodnotící případy Ph-MPN v České republice. MIND reprezentuje síť hematoonkologických center shromažďujících a sdílejících informace o Ph-MPN s cílem zlepšení pochopení epidemiologie, zkvalitnění a sjednocení diagnostiky a terapie a zlepšení přežívání pacientů.
Provedenou analýzou jsme v souladu s publikovanými daty potvrdili výskyt Ph-MPN převážně ve starší věkové skupině a častější výskyt ET u žen v porovnání s muži [22–24]. Četnost zastoupení jednotlivých diagnóz se v našem souboru lišila od mezinárodních dat především vyšším procentem pacientů s PMF. Hypoteticky by tento fakt mohl být způsoben selekcí pacientů s PMF a jejich odesíláním okresními pracovišti do hematologických center ke zvážení terapie JAK 2 inhibitory nebo rozvaze stran provedení alogenní transplantace krvetvorných buněk [1].
Stanovení přesné diagnózy Ph-MPN, které je obzvlášť důležité při volbě nejlepší léčebné strategie, se v současné době opírá o kombinaci molekulárně-biologického a histologického vyšetření kostní dřeně [2,9]. Je však nutné uvést, že u části případů je histologické vyšetření kostní dřeně nekonkluzivní, což můžeme vidět i na zastoupení v našem souboru, kde 10 % všech případů představují histologicky neurčené nebo neklasifikovatelné MPN.
V souladu s publikovanými daty jsme prokázali, že se jedná o diagnózy provázené vysokou frekvencí symptomů snižujících kvalitu života a omezujících pacienty v každodenních činnostech s absolutní převahou u pacientů s PMF. Naše výsledky se plně shodují s výsledky mezinárodních analýz, které dále dokládají, že únava je nejčastěji zastoupeným příznakem u všech Ph-MPN, přičemž frekvence výskytu a stupeň závažnosti není závislý na rizikovém skóre PV, ET ani PMF [25].
Podobně četnost záchytu tzv. „driver mutací“, JAK2 V617F, CALR a MPL, se v našem souboru výrazně neodlišovala od dosud publikovaných dat. Výjimku tvořila mutace MPL, což by mohlo být vysvětleno méně frekventním rutinním vyšetřováním v minulosti u pacientů s ET a PMF [7,26]. Potvrdili jsme nízký výskyt cytogenetických abnormalit, které jsou jedním z hlavních prediktorů rizika leukemické transformace u pacientů s ET, naproti tomu signifikantně častěji u pacientů s PV a PMF. Jejich frekvence byla v našem souboru oproti publikovaným datům nižší (20 vs. 30–57 %, resp.). Tento fakt by mohla částečně přiblížit nižší četnost provedených cytogenetických vyšetření u pacientů s PMF v našem souboru (60 %) [10]. Význam komplexního molekulárně-genetického a cytogenetického testování dokazují i nově zavedené prognostické skórovací systémy pro pacienty s PMF, které řadí přídatné genetické mutace k hlavním determinantám celkového přežití – MIPSS70+ (Mutation and Karyotype-Enhanced International Prognostic Scoring System) a GIPSS (Genetically Inspired Prognostic Scoring System) [27,28].
Nejčastějšími komplikacemi u pacientů s Ph-MPN přispívajícími ke zvýšené morbiditě a mortalitě oproti běžné populaci jsou krvácivé a trombotické příhody. Četnost trombotických komplikací se v našem sledovaném souboru shodovala s výsledky analýzy MPN registru německé skupiny SAL z roku 2016 [29]. Uvedená studie obdobně prokázala jejich výskyt v době diagnózy u přibližně jedné třetiny pacientů bez signifikantního rozdílu mezi jednotlivými typy Ph-MPN. Identicky jako v naší analýze byla incidence těchto příhod nejvyšší v době diagnózy, a může tak představovat často první příznak, který nás upozorní na suspektní diagnózu Ph-MPN. Taktéž frekvence krvácivých příhod v naší analýze byla ve shodě s mezinárodními daty a ukázala, že incidence krvácivých příhod je oproti trombotickým v době diagnózy nižší (10 vs. 23 %). Německá skupina SAL navíc prokázala zvyšující se četnost krvácivých příhod v čase sledování, což je dáváno do souvislosti se samotným onemocněním a jeho komplikacemi (portální hypertenze, jícnové varixy a jiné) a taktéž užívanou antiagregační a antikoagulační terapií [29,30]. Naše data naproti tomu ukázala postupně se snižující frekvenci krvácivých příhod, což ale mohlo být způsobeno mimo jiné kratším mediánem sledování v naší studii [29]. Ve svém důsledku uvážlivé a individuální posouzení rizika krvácivých a trombotických komplikací u pacientů s Ph-MPN před nasazením antiagregační nebo antikoagulační terapie představuje základ správně a úspěšně vedené terapie těchto pacientů.
Mezi cytoredukčními léky používanými u našich pacientů dominovala v naprosté většině hydroxyurea, a to jak v první, tak i ve druhé léčebné linii. Výjimku tvořila skupina pacientů s PMF a ET, kde ve 2. linii převažoval JAK 2 inhibitor, ruxolitinib u PMF a anagrelid u ET. Naše výsledky odpovídaly aktuálním doporučením ELN z roku 2018 pro terapii Ph-MPN s výjimkou užívaní anagrelidu v první linii terapie ET, řazeným dle recentních doporučení až do druhé linie vzhledem k prokázanému lepšímu efektu hydroxyurey na redukci trombotických a krvácivých událostí a nedostatečnému poměru rizika a přínosu [31,32].
Dosažení celkové remise vč. histologické verifikace bylo v našem souboru prokázáno pouze u menšího množství pacientů, což je ale způsobeno především nízkou frekvencí provádění kontrolních odběrů kostní dřeně v průběhu terapie odpovídající reálné klinické praxi.
Medián celkového přežívaní pacientů s Ph-MPN se u námi sledovaného souboru zásadně neodlišoval od dostupných mezinárodních dat. Potvrdil nejlepší prognózu u pacientů s ET, a naopak nejhorší u pacientů s MF. Zároveň jsme v souladu s publikovanými daty prokázali horší přežívání pacientů s PMF ve vyšším věku, s vyšším stupněm IPSS anebo JAK2 V617F mutovaných [8,33]. Rizikovým faktorem u ET a PV je věk nad 60 let, leukocytóza a trombocytóza a u PV nepříznivé cytogenetické změny [34–36]. Výrazně odlišná prognóza u jednotlivých typů Ph-MPN dokázala nutnost komplexní diagnostiky za cílem určení správné diagnózy, a to kombinací klinického a laboratorního obrazu, histologického vyšetření kostní dřeně a molekulárně genetického vyšetření, což v konečném důsledku vede k určení nejlepší léčebné strategie a zlepšení prognózy.
MIND uvedenou analýzou představil robustní data databáze Ph-MPN vedené pod hlavičkou CELL s multicentrickým sběrem dat a aktivní participací většiny hematoonkologických center České republiky. Validace dat společným data manažerem CELL zaručuje jejich maximální kvalitu. Právě výsledky naší analýzy potvrdily reprezentativnost zadaných dat, která tak jsou porovnatelná s dosud publikovanými mezinárodními daty. Výstupy analýzy dat databáze MIND slouží nejen k publikačním účelům a aktualizaci doporučení lokálního významu, ale mají také mezinárodní dopad [37–39]. Aktuální, jednotná a zejména kvalitní data zadaná v MIND nabývají ve svém důsledku na důležitosti pro jednání s plátci zdravotní péče, farmakoekonomické analýzy, tvorbu hodnotících zpráv nejen pro účely SÚKL, výběr adekvátní a moderní léčby vč. selekce vhodných pacientů do klinických studií, sledování nových faktorů ovlivňujících výsledky léčby, spolupráci se zahraničními pracovišti. Součástí sběru dat je také uchovávání vzorků periferní krve a kostní dřeně, které umožňuje participaci na řadě mezinárodních výzkumných projektů s reálnými výstupy v diagnostice a léčbě pacientů s Ph-MPN. V roce 2019 byla data ve spolupráci s Institutem biostatistiky a analýz (IBA) přesunuta na zcela novou platformu CLADE-IS (Clinical Data Warehouse – Information System), která umožňuje nejen zadávat a prohlížet data v reálném čase, ale také provádět on-line validaci zadaných dat, čímž je dosaženo efektivnější kvality dat již v okamžiku jejich zadávání. „CLADE-IS“ oproti předchozímu „TRIAL“ systému nabízí dále širší nabídku výstupů z databáze v podobě sofistikovanějších reportů.
Naše studie byla limitována dominantním zastoupením centrových dat reprezentovaných hematoonkologickými pracovišti, což se mohlo podílet na vyšším zastoupení komplikovaných pacientů vstupujících do analýzy. V současné době se však k databázi postupně přidávají i pracoviště okresního formátu, a databáze tak bude představovat reprezentativnější vzorek populace pacientů s Ph-MPN v České republice.
ZÁVĚR
Databáze MIND představuje multicentrický projekt zaměřený na hodnocení epidemiologie, kvality diagnostiky a následné zdravotní péče u pacientů s Ph-MPN v reálné klinické praxi. Naše práce prezentovala analýzu souboru pacientů s Ph-MPN sledovaných na hematologických pracovištích v České republice. Prokázali jsme v souladu s aktuálními daty, že Ph-MPN jsou onemocnění starších pacientů doprovázená vysokou četností příznaků zhoršujících jejich kvalitu života, a to převážně u pacientů s MF. Trombotické a krvácivé události v době diagnózy provázely PV, ET i PMF bez signifikantního rozdílu v četnosti se snižujícím se výskytem v dalším průběhu. V souladu s publikovanými daty jsme potvrdili nejdelší přežívání pacientů s ET. Na rozdíl od toho byly u pacientů s MF potvrzeny nejvyšší incidence leukemické transformace a nejkratší křivka přežívání. Vyšší věk, vyšší IPSS a přítomnost mutace JAK2 V617F byly potvrzeny jako faktory výrazně ovlivňující přežívání pacientů s PMF.
PODÍL AUTORŮ NA RUKOPISU
NP, BW – napsání rukopisu
NP, BW, ZK, TN, KH, MH, MD, ZK, JM – příprava analýzy
NP, BW, MP, AH, PB, MB, LS, AP, YB, LČ, MH, ZK, MK, PJ, MD, PŽ, EF, JM – diagnostika a léčba nemocných
NP, BW, MP, AH, PB, MB, LS, ZK, TN, KH, AP, YB, LČ, MH, MK, PJ, MD, PŽ, ZK, EF, JM – revize rukopisu
PODĚKOVÁNÍ
Na závěr bychom chtěli poděkovat všem participujícím hematologickým pracovištím v ČR a okresním hematologickým pracovištím za vynikající spolupráci a obzvlášť všem jejich data manažerům za náročnou, avšak důsledně odvedenou práci. V neposlední řadě patří velké poděkování kolegům IBA za společnou práci při tvorbě a úpravách databáze a analýze dat.
Práce byla podpořena Českou leukemickou skupinou pro život (CELL) a grantem MZ ČR – RVO (FNBr 65269705).
PROHLÁŠENÍ AUTORŮ O KONFLIKTU ZÁJMŮ
Autoři práce prohlašují, že v souvislosti s tématem, vznikem a publikací tohoto článku nejsou ve střetu zájmů a vznik ani publikace článku nebyly podpořeny žádnou farmaceutickou firmou.
Do redakce doručeno dne: 2. 4. 2021.
Přijato po recenzi dne: 8. 6. 2021.
MUDr. Barbora Weinbergerová
Interní hematologická a onkologická klinika
LF MU a FN Brno
Jihlavská 20
625 00 Brno
e-mail: weinbergerova.barbora@fnbrno.cz
Sources
- Titmarsh GJ, Duncombe AS, McMullin MF, et al. How common are myeloproliferative neoplasms? A systematic review and meta-analysis. Am J Hematol. 2014 Jun; 89 (6): 581–587.
- Tefferi A, Pardanani A. Myeloproliferative neoplasms: a contemporary review. JAMA Oncol. 2015; 1 (1): 97–105.
- Arber DA, Orazi A, Hasserjian R, et al. The 2016 revision to the World Health Organization classification of myeloid neoplasms and acute leukemia. Blood. 2016; 127 (20): 2391–2405.
- James C, Ugo V, Le Couedic JP, et al. A unique clonal JAK2 mutation leading to constitutive signalling causes polycythaemia vera. Nature. 2005; 434 (7037): 1144–1148.
- Kralovics R, Passamonti F, Buser AS, et al. A gain-of-function mutation of JAK2 in myeloproliferative disorders. N Engl J Med. 2005; 352 (17): 1779–1790.
- Vannucchi AM, Lasho TL, Guglielmelli P, et al. Mutations and prognosis in primary myelofibrosis. Leukemia. 2013; 27 : 1861–1869.
- Tefferi, A. Myeloproliferative neoplasms: A decade of discoveries and treatment advances. Am J Hematol. 2016; 91 : 50–58.
- Tefferi A, Guglielmelli P, Larson DR, et al. Long-term survival and blast transformation in molecularly annotated essential thrombocythemia, polycythemia vera, and myelofibrosis. Blood. 2014; 124 (16): 2507–2513.
- Grinfeld J, Nangalia J, Baxter EJ, et al. Classification and personalized prognosis in myeloproliferative neoplasms. N Engl J Med. 2018; 379 (15): 1416–1430.
- Dunbar AJ, Rampal RK, Levine R. Leukemia secondary to myeloproliferative neoplasms. Blood. 2020; 136 (1): 61–70.
- https: //cell-sal-mind.data-warehouse.zone/login
- Barosi G, Mesa R, Finazzi G, et al. Revised response criteria for polycythemia vera and essential thrombocythemia: an ELN and IWG-MRT consensus project. Blood. 2013; 121 (23): 4778–4781.
- Tefferi A, Cervantes F, Mesa R, et al. Revised response criteria for myelofibrosis: International Working Group-Myeloproliferative Neoplasms Research and Treatment (IWG-MRT) and European LeukemiaNet (ELN) consensus report. Blood. 2013; 122 (8): 1395–1398.
- 14.https: //ctep.cancer.gov/protocoldevelopment/electronic_applications/docs/ctcae_v5_quick_reference_8.5x11.pdf
- Emanuel RM, Dueck AC, Geyer HL, et al. Myeloproliferative neoplasm (MPN) symptom assessment form total symptom score: prospective international assessment of an abbreviated symptom burden scoring system among patients with MPNs. J Clin Oncol. 2012; 30 (33): 4098–4103.
- EuroQoL Group. EuroQol-a new facility for the measurement of health-related quality of life. Health Policy. 1990; 16 : 199–208.
- Thiele J, Kvasnicka HM, Facchetti F, Franco V, van der Walt J, Orazi A. European consensus on grading bone marrow fibrosis and assessment of cellularity. Haematologica. 2005; 90 (8): 1128–1132.
- Barbui T, Barosi G, Birgegard G, et al. European LeukemiaNet. Philadelphia-negative classical myeloproliferative neoplasms: critical concepts and management recommendations from European LeukemiaNet. J Clin Oncol. 2011; 29 (6): 761–770.
- Barbui T, Finazzi G, Carobbio A, et al. Development and validation of an International Prognostic Score of thrombosis in World Health Organization-essential thrombocythemia (IPSET-thrombosis). Blood. 2012; 120 (26): 5128–5133.
- Cervantes F, Dupriez B, Pereira A, et al. New prognostic scoring system for primary myelofibrosis based on a study of the International Working Group for Myelofibrosis Research and Treatment. Blood. 2009; 113 (13): 2895–2901.
- Passamonti F, Cervantes F, Vannucchi AM, et al. A dynamic prognostic model to predict survival in primary myelofibrosis: a study by the IWG-MRT (International Working Group for Myeloproliferative Neoplasms Research and Treatment). Blood. 2010; 1159 : 1703–1708.
- Srour SA, Devesa SS, Morton LM, et al. Incidence and patient survival of myeloproliferative neoplasms and myelodysplastic/myeloproliferative neoplasms in the United States, 2001-12. Br J Haematol. 2016; 174 (3): 382–396.
- Shallis RM, Wang R, Davidoff A, Ma X, Podoltsev NA, Zeidan AM. Epidemiology of the classical myeloproliferative neoplasms: The four corners of an expansive and complex map. Blood Rev. 2020; 42 : 100706.
- Moulard O, Mehta J, Fryzek J, Olivares R, Iqbal U, Mesa RA. Epidemiology of myelofibrosis, essential thrombocythemia, and polycythemia vera in the European Union. Eur J Haematol. 2014; 92 (4): 289–297.
- Harrison CN, Koschmieder S, Foltz L, et al. The impact of myeloproliferative neoplasms (MPNs) on patient quality of life and productivity: results from the international MPN Landmark survey. Ann Hematol. 2017; 96 (10): 1653–1665.
- Tefferi A, Lasho TL, Finke CM, et al. CALR vs JAK2 vs MPL-mutated or triple-negative myelofibrosis: clinical, cytogenetic and molecular comparisons. Leukemia. 2014; 28 (7): 1472–1477.
- Tefferi A, Guglielmelli P, Lasho TL, et al. MIPSS70+ version 2.0: mutation and karyotype‐enhanced international prognostic scoring system for primary myelofibrosis. J Clin Oncol. 2018; 36 : 1769–1770.
- Tefferi A, Guglielmelli P, Nicolosi M, et al. GIPSS: genetically inspired prognostic scoring system for primary myelofibrosis. Leukemia. 2018; 32 : 1631–1642.
- Kaifie, A., Kirschner, M., Wolf, D. et al. Bleeding, thrombosis, and anticoagulation in myeloproliferative neoplasms (MPN): analysis from the German SAL-MPN-registry. J Hematol Oncol. 2016; 9 : 18.
- Rungjirajittranon T, Owattanapanich W, Ungprasert P, Siritanaratkul N, Ruchutrakool T. A systematic review and meta-analysis of the prevalence of thrombosis and bleeding at diagnosis of Philadelphia-negative myeloproliferative neoplasms. BMC Cancer. 2019; 19 (1): 184.
- Barbui T, Tefferi A, Vannucchi AM, et al. Philadelphia chromosome-negative classical myeloproliferative neoplasms: revised management recommendations from European LeukemiaNet. Leukemia. 2018; 32 (5): 1057–1069.
- Harrison CN, Campbell PJ, Buck G, et al. Hydroxyurea compared with anagrelide in high-risk essential thrombocythemia. N Engl J Med. 2005; 353 (1): 33–45.
- Hultcrantz M, Kristinsson SY, Andersson TM, et al. Patterns of survival among patients with myeloproliferative neoplasms diagnosed in Sweden from 1973 to 2008: a population-based study. J Clin Oncol. 2012; 30 (24): 2995–3001.
- Tefferi A, Rumi E, Finazzi G, et al. Survival and prognosis among 1545 patients with contemporary polycythemia vera: an international study. Leukemia. 2013; 27 (9): 1874–1881.
- Passamonti F, Thiele J, Girodon F, et al. A prognostic model to predict survival in 867 World Health Organization-defined essential thrombocythemia at diagnosis: a study by the International Working Group on Myelofibrosis Research and Treatment. Blood. 2012; 120 (6): 1197–1201.
- Bonicelli G, Abdulkarim K, Mounier M, et al. Leucocytosis and thrombosis at diagnosis are associated with poor survival in polycythaemia vera: a population-based study of 327 patients. Br J Haematol. 2013; 160 (2): 251–254.
- Weinbergerová B, Čičátková P, Palová M, et al. Zkušenosti s léčbou ruxolitinibem u pacientu s myelofibrózou a pravou polycytemií na českých hematologických pracovištích. Transfuze Hematol Dnes. 2017; 23 (1): 30–40.
- Weinbergerová B, Bělohlávková P, Ráčil Z, Mayer J. Ph (BCR-ABL1) -negativní myeloproliferativní neoplázie (D45, D47.1, D47.3). In: Léčebné postupy v hematologii. Doporučení ČHS ČLS JEP. 2016 : 153–178.
- Czech J, Cordua S, Weinbergerova B, et al. JAK2V617F but not CALR mutations confer increased molecular responses to interferon-alpha via JAK1/STAT1 activation. Leukemia. 2019; 33 (4): 995–1010.
Labels
Haematology Internal medicine Clinical oncology
Article was published inTransfusion and Haematology Today
2021 Issue 3-
All articles in this issue
- Nové poznatky v patofyziológii Ph-negatívnych myeloproliferatívnych neoplázií
- Změny v imunitním systému u neléčených nemocných s chronickou lymfocytární leukémií – část 2: nespecifická imunita
- POEMS syndrom – vzácné onemocnění asociované s monoklonální gamapatií a polyneuropatií: diagnostika a terapie
- Laboratorní diagnostika imunitně podmíněných trombocytopenií
- Ph negativní myeloproliferativní neoplázie na českých hematologických centrech – analýza dat MIND
- Kryokonzervované směsné trombocyty v náhradním roztoku
- Mnohočetná plazmocytóza lymfatických uzlin s přítomností monoklonální gamapatie – plazmocelulární neoplázie či indolentní B-lymfom?
- Primář MUDr. Jiří Horák, 11. 6. 1936 – 21. 6. 2021
- Transfusion and Haematology Today
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Laboratorní diagnostika imunitně podmíněných trombocytopenií
- Nové poznatky v patofyziológii Ph-negatívnych myeloproliferatívnych neoplázií
- POEMS syndrom – vzácné onemocnění asociované s monoklonální gamapatií a polyneuropatií: diagnostika a terapie
- Kryokonzervované směsné trombocyty v náhradním roztoku
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

