-
Medical journals
- Career
Sticklerův syndrom v České republice:
fenotypová variabilita a genetická heterogenita
Authors: Čopíková J. 1; Katra R. 2; Pourová Kremlíková R. 1
Authors‘ workplace: Ústav biologie a lékařské genetiky 2. LF UK a FN v Motole 1; Klinika ušní, nosní a krční 2. LF UK a FN v Motole 2
Published in: Otorinolaryngol Foniatr, 70, 2021, No. 1, pp. 39-46.
Category: Review Article
doi: https://doi.org/10.48095/ccorl202139Overview
Sticklerův syndrom (STL) je progresivní multisystémové onemocnění pojivové tkáně s incidencí 1 : 7 500 novorozenců, která však může být podhodnocena kvůli velké fenotypové variabilitě znesnadňující stanovení klinické diagnózy. Symptomy STL zahrnují rozštěp patra nebo Pierre-Robinovu sekvenci, nedoslýchavost, poruchy zraku, zejména časnou vysokou myopii a spontánní odchlípení (amoci) sítnice, poruchy pohybového aparátu a typický vzhled obličeje zahrnující plochý profil, vystupující oči a malou ustupující bradu (mikrognacii). Výskyt a závažnost jednotlivých příznaků se může značně lišit dokonce i v rámci jedné rodiny. K dnešnímu datu byly jako příčina STL popsány poruchy sedmi různých genů pro kolageny. Nejčastější formou (80–90 % STL) je typ 1 s autozomálně dominantní (AD) dědičností, způsobený defektem genu COL2A1. Typ 2 (10–20 % STL), spojený s genem COL11A1, je též AD. Všechny ostatní typy s různými formami dědičnosti (AD i autozomálně recesivní) jsou extrémně vzácné. Geneticky potvrzená diagnóza STL umožňuje prevenci rozvoje dalších komplikací, včasné zahájení symptomatické léčby a přesné stanovení rizika STL v rodině.
Klíčová slova:
Sticklerův syndrom – kolagen – myopie – amoce sítnice – Pierre-Robinova sekvence – porucha sluchu – COL2A1
Úvod
Sticklerův syndrom (STL) je vzácné geneticky podmíněné progresivní onemocnění s neúplnou penetrancí, variabilní expresivitou a závažností. Naprostá většina případů vykazuje autozomálně dominantní (AD) typ dědičnosti, která se vyznačuje výskytem nemoci v několika po sobě jdoucích generacích, bylo popsáno pouze několik jednotlivých rodin s autozomálně recesivním (AR) STL [1–4].Onemocnění AD formou STL však neznamená nutnost pozitivní rodinné anamnézy. Jednak vzhledem k častému výskytu mutací vzniklých de novo (v publikovaném českém souboru [5] se jednalo o 63 % rodin), kdy rodiče pacienta mutaci nenesou, a logicky tedy nemají ani příznaky, jednak vzhledem k velké fenotypové variabilitě, kdy až po potvrzení diagnózy STL u pacienta a nalezení mutace v STL genu u jednoho z jeho rodičů je zjištěno, že daný rodič trpí příznaky, kterým dříve nebyla věnována pozornost. Zcela bezpříznakové nosičství prokazatelně patogenní mutace nebylo dosud v literatuře popsáno. Onemocnění postihuje rovnoměrně obě pohlaví stejně jako všechny etnické skupiny. Ačkoli chronická bolest pohybového aparátu, odchlípení sítnice a ztráta sluchu mohou významně ovlivnit kvalitu života, přesto jeho délka není ovlivněna [6]. Dědičné progresivní onemocnění pojivové tkáně bylo poprvé popsáno Sticklerem et al. [7] v roce 1965 u rodiny s progresivní myopií, odchlípením sítnice s následnou slepotou a předčasnými degenerativními změnami kloubů pod názvem hereditární progresivní artro-oftalmopatie. Krátce na to byla jako součást syndromu doplněna porucha sluchu spolu s charakteristickou faciální hypoplazií a muskuloskeletálními anomáliemi [8]. Opitz et al. [9] popsali též častou koincidenci s Pierre-Robinovou sekvencí. Výše uvedené klinické příznaky a symptomy se mohou lišit mezi postiženými jedinci a vykazují vysokou inter - a intrafamiliální variabilitu [10]. Incidence onemocnění je uváděna v rozsahu 1/ 7 500–1/ 9 000 u novorozenců [11], velmi pravděpodobně je však možné, že čísla jsou ještě vyšší vzhledem k velké klinické heterogenitě onemocnění. Mírné formy onemocnění velmi často nejsou identifikovány a k diagnóze dochází až ve chvíli narození hůře postiženého potomka či sourozence. V České republice dosud nejsou dostupné spolehlivé údaje ohledně incidence a prevalence STL, dosud však zde bylo popsáno a diagnostikováno 16 rodin s AD STL typu 1 a 2, výskyt AR STL dosud nebyl popsán [5]. V diferenciální diagnostice figurují syndromy Marshallův, Marfanův (a další poruchy pojiva), Binderův, myopia-deafness, brittle cornea a Wagnerův.
Klinický obraz Sticklerova syndromu
Sticklerův syndrom je multisystémové onemocnění způsobené poruchou tvorby kolagenu, jedná se tedy o jednu z tzv. kolagenopatií. Dělí se na několik typů (tab. 1), které se liší klinickým obrazem i genetickou podstatou. V klinickém obrazu převládají oftalmologické a otorinolaryngologické příznaky (porucha sluchu, rozštěp patra, Pierre-Robinova sekvence), faciální dysmorfie a poruchy kloubního aparátu.
Table 1. Klasifikace a klinické příznaky jednotlivých typů Sticklerova syndromu.
Tab. 1. Classification and clinical features of different types of Stickler syndrome.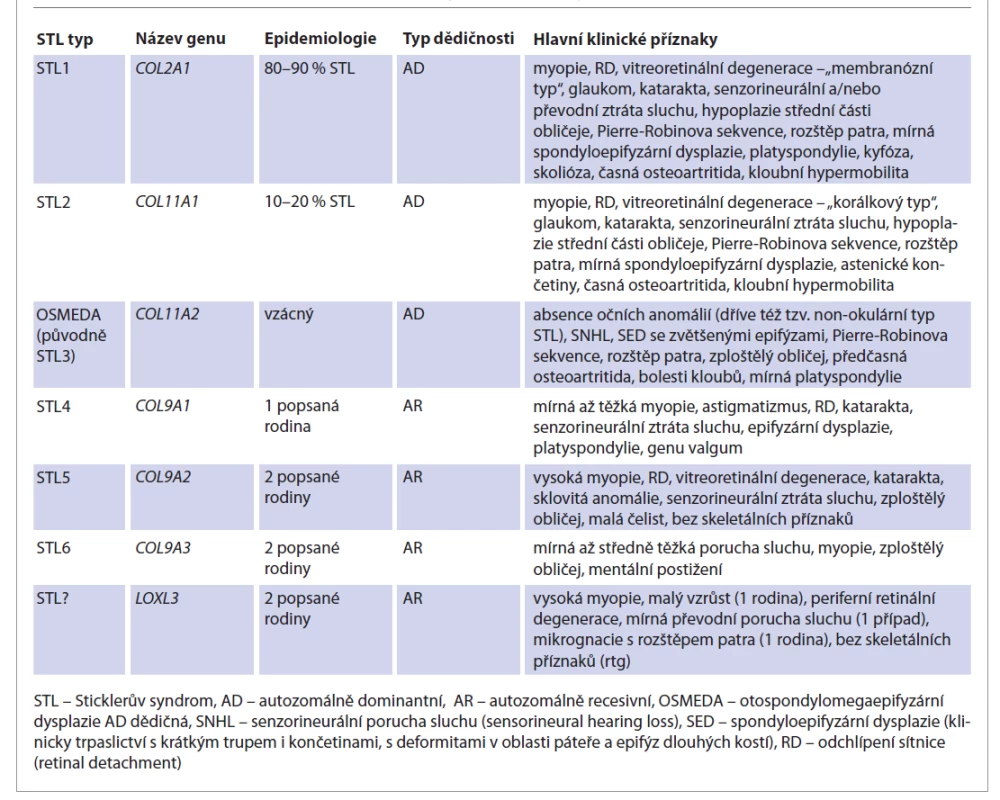
Pierre-Robinova sekvence
Triáda mikrognacie, glosoptózy (abnormálního posazení jazyka) a následné obstrukce dýchacích cest se nazývá Pierre-Robinova sekvence (PRS). V 90 % případů je provázena úplným či částečným rozštěpem patra, který je někdy uváděn též jako součást triády. PRS může vést k problémům s dýcháním a krmením v kojeneckém věku a v extrémních případech až k zadušení [12]. Incidence je uváděna mezi 1 : 8 500 [13] a 1 : 14 000 [14]. Asi třetina případů je provázena dalšími příznaky, tzv. PRS plus, kdy nejčastější příčinou je právě STL, způsobující celkově až 20 % případů PRS [15, 16]. Ze všech pacientů s diagnostikovaným STL v ČR má PRS cca 50 % případů [5].
Kraniofaciální abnormity
K typickým a výrazným obličejovým rysům u pacientů se STL patří zploštělý obličej, prominující oči, malý nos a mikro/ retrognacie. Tyto příznaky jsou nejčastější v dětství a s rostoucím věkem jsou méně výrazné [17]. Tyto dysmorfické rysy mohou navazovat na vrozenou PRS, nebo se postupně rozvinout v raném dětství. Součástí fenotypu u více než 40 % pacientů se STL je rozštěp patra, ať již izolovaný, nebo v rámci PRS. Přibližně další třetina pacientů má subtilní abnormality patra včetně gotického patra, submukózních rozštěpů nebo uvula bifida [18, 19]. Častá je též hypodoncie – snížený počet zubů v důsledku poruchy erupce a hypoplazie skloviny [20]. Je nutné podotknout, že všechny uvedené příznaky jsou velice variabilní, takže jako samostatné diagnostické kritérium mají spíše doplňující význam.
Oční komplikace
K prvním očním příznakům patří nejčastěji těžká myopie ve velmi nízkém věku, nejzávažnější komplikací je však amoce neboli odchlípení sítnice (tzv. rhegmatogenní), často následovaná sekundární kataraktou, glaukomem a chronickou uveitidou. Pokud nedojde k včasnému záchytu, mohou tyto komplikace vést u řady pacientů až ke slepotě. Těžká myopie v rozmezí –8 až –18 dioptrií nastupuje často již v prvních letech života, bez rychlé progrese, nicméně často asociována s astigmatizmem. Avšak téměř čtvrtina pacientů nevykazuje žádné významné refrakční vady, a proto nemůže být nepřítomnost myopie spolehlivým diagnostickým nástrojem pro vyloučení STL [21]. Z českých pacientů byla prokazatelná nepřítomnost myopie u pacientů se STL1 zjištěna pouze u dvou (10 %), u nichž byl STL prokázán v rámci vyšetření v rodině [5]. Naopak odchlípení sítnice v dětském věku je nejspecifičtějším a zároveň nejzávažnějším příznakem STL, kdy STL je zároveň považován za nejčastější příčinu tohoto stavu [17]. První příznaky se objevují nejčastěji v období dospívání nebo časné dospělosti (10–30 let) a až 60 % pacientů se STL trpí odchlípením sítnice alespoň jednoho oka. Existuje možnost profylaktické intervence [22, 23], její úspěšnost však u našich pacientů nebyla vysoká. Dojde-li již k amoci sítnice, je nezbytná časná léčba, jinak může dojít postupně až k úplné ztrátě zraku. U mnoha postižených byla popsána asociace s kongenitální i sekundární kataraktou [24] a zvýšená predispozice ke vzniku glaukomu, nejčastěji až jako následku odchlípení sítnice a proliferativní vitreoretinopatie [21].
Porucha sluchu
U STL je porucha sluchu jedním z hlavních klinických příznaků. Jedná se nejčastěji o senzorineurální ztrátu sluchu, dále kombinovanou a převodní ztrátu sluchu, která se vyskytuje u dětí v raném věku a u pacientů s asociovaným defektem patra [25, 26]. Až 60 % pacientů se STL trpí senzorineurální poruchou sluchu [27, 28]. U různých typů STL existují rozdíly v prevalenci ztráty sluchu a každý z genotypů vykazuje odlišný typ poruchy sluchu. Asi polovina pacientů s 1. typem STL (STL1) trpí mírnou až středně těžkou poruchou sluchu [25]. U STL2 a STL3 se jedná o frekventovanou asociaci se ztrátou sluchu již v mladém věku, která je mnohem závažnější [27]. Stupeň poruchy sluchu je variabilní a často progresivní. Míra postižení sluchu se u jednotlivých postižených osob liší, a to i v rámci jedné rodiny, kdy například matka a syn mají sluch zcela v normě a dcera je od 10 let uživatelkou kochleárního implantátu [5]. U pacientů se STL byla pozorována abnormální svalová mobilita musculus tensor tympani [28]. Defekt přítomného kolagenu typu II pravděpodobně ovlivňuje morfologii kolagenních fibril v tympanické membráně a vede k převodní poruše sluchu [21]. Patogeneze senzorineurálního poškození sluchu u pacientů se STL není přesně známa a doposud nebyly publikovány žádné radiologické a histopatologické studie temporální kosti u jednotlivců se STL [28], kolagen typu II je však přítomen v extracelulární matrix pojící vláskové buňky se stěnou hlemýždě. Vzhledem k velké fenotypové variabilitě a vysoké prevalenci ztráty sluchu u pacientů se STL se doporučuje pro potvrzení diagnózy pravidelné sledování a hodnocení sluchu [25].
Poruchy pohybového aparátu
Více než 80 % dětí a dospělých s diagnózou STL trpí muskuloskeletálními poruchami, což má značný dopad na kvalitu života u těchto pacientů [18]. V klinické praxi existují velké rozdíly projevů, z nichž žádný není pro STL zcela unikátní. Téměř 90 % pacientů má abnormality páteře (zploštělé obratle, skolióza, kyfóza různého stupně) a z toho 85 % dospělých si stěžuje na chronickou bolest zad [29] či kloubů končetin (epifyzární dysplazie). Součástí STL je i časné degenerativní postižení kloubů, které začíná většinou jako kloubní hypermobilita, a značná část pacientů dospěje k nutnosti výměny kyčelního nebo kolenního kloubu už před dosažením věku 30 let. Kombinace hypermobility kloubů u dětí s vysokou myopií či poruchou sluchu by měla být varovným signálem pro diagnózu STL. V průběhu vývoje hypermobilita mizí a nastupuje degenerativní artropatie s různou závažností a rozvojem až do třetí nebo čtvrté dekády [30].
Další příznaky
V rozsáhle studii Liberfarb et al. [31] byl nalezen prolaps mitrální chlopně (MVP) u téměř poloviny pacientů se STL, důsledkem čehož bylo doporučeno provádění screeningu chlopenních vad (echokardiografie). Tato uváděná zvýšená prevalence vrozených srdečních vad u pacientů se STL však byla recentně negována [32], což potvrzují jednoznačně i poslední studie [5, 33, 34].
Epilepsie jako další z klinických příznaků STL, byla poprvé publikována Savastem et al. v roce 2015, kteří jako první popsali epilepsii u 3 dětí s abnormálním EEG a s diagnózou STL1 [35]. Nicméně, žádné další studie s výskytem epilepsie nebyly publikovány, a proto lze předpokládat, že epilepsie nepatří mezi hlavní diagnostické klinické příznaky STL, a může se tedy jednat o přidruženou komplikaci anebo o jiný typ onemocnění řadící se mezi kolagenopatie, do kterých spadá obrovské spektrum syndromů včetně syndromu Legg-Calve Perthes, u kterého byla asociace s výskytem epilepsie popsána.
Klinická a genetická klasifikace Sticklerova syndromu
Sticklerův syndrom patří mezi kolagenopatie, choroby způsobené mutacemi v genech podílejících se na tvorbě či funkci určitého typu kolagenu. Kolagen je nejhojnějším proteinem extracelulární matrix a představuje 25–30 % všech bílkovin v lidském těle. Je hlavním strukturálním elementem všech pojivových tkání a byl také nalezen v intersticiální tkáni prakticky všech parenchymálních orgánů, kde přispívá ke stabilitě tkání a orgánů a udržuje jejich strukturální integritu [36]. Vysokou variabilitu, kterou pozorujeme u příznaků STL, vidíme i u jeho genetických příčin. Aktuálně je známo sedm genů zodpovědných za různé typy STL a dalších několik genů pro fenotypicky příbuzné kolagenopatie, je však velmi pravděpodobné, že budou v budoucnu identifikovány ještě další geny pro STL a příbuzné choroby. Kolagenopatie zahrnují široké fenotypické spektrum více než 30 různých onemocnění, jako je například osteogenesis imperfecta (extrémní sklon ke spontánním frakturám), Ehlersův-Danlosův syndrom (hyperflexibilní klouby a kůže, cévní aneuryzmata), epidermolysis bullosa (nemoc motýlích křídel s extrémně fragilní svrchní vrstvou kůže), Alportův syndrom (progresivní postižení ledvin a sluchu), nejrůznější kostní dysplazie či nesyndromová porucha sluchu (DFNB53, DFNA13, DFNA37). V mnoha případech mohou různé mutace v tomtéž kolagenovém genu způsobit různá onemocnění. Přehled těchto tzv. alelických chorob pro jednotlivé STL geny je uveden v tab. 2.
Table 2. Vybraná onemocnění způsobená poruchami genů spojených se Sticklerovým syndromem (tzv. alelické choroby).
Tab. 2. Selected disorders caused by defect of genes associated with Stickler syndrome (so-called allelic disorders).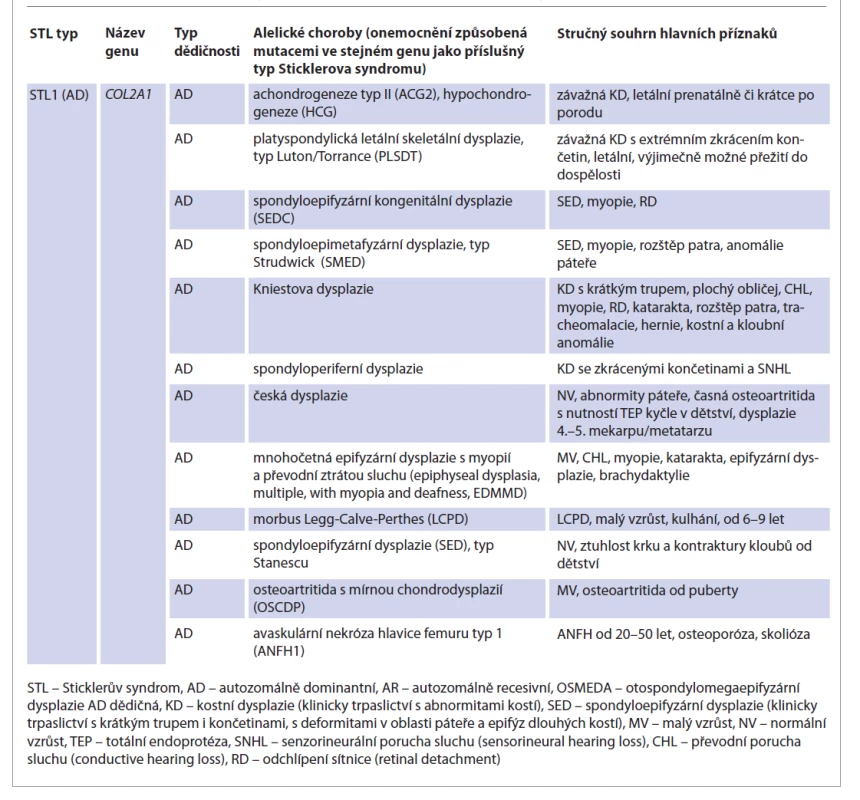
Nejčastější formou STL je AD dědičný STL1, který je způsoben defektem genu COL2A1, ve kterém byly patogenní mutace nalezeny až u 80–90 % případů s klinickou diagnózou STL [11]. Tento gen se nachází v lokusu 12q13.11, sestává z 54 exonů a kóduje protein kolagen typu II [37]. Výsledkem mutací v genu COL2A1 je, že buňky produkují jenom polovinu z normálního množství kolagenových řetězců. Manifestace STL1 je okulární i extraokulární. K typickým extraokulárním příznakům patří kloubní hypermobilita, rozštěp patra, zploštělý obličej, malá čelist a různý stupeň sluchového postižení [18, 38], z očních komplikací je nejčastější odchlípení sítnice a těžká myopie, dále se vyskytuje častěji rozvoj presenilní katarakty a glaukom [17]. Mutace v genu COL2A1 jsou také asociovány se značným rozsahem jiných fenotypových abnormalit, a to od letálního disproporcionálního dwarfizmu (trpaslictví) s krátkými končetinami až po relativně normální fenotyp s myopií a předčasnou artritidou. Rozlišujeme také určité typy mutací, které vedou k různým fenotypovým projevům celé škály vzácných onemocnění uvedených v tab. 2 [39]. U většiny dosud charakterizovaných mutací v genu COL2A1, které vedou k rozvoji příznaků STL1, je mechanizmem jejich působení předčasné ukončení translace, a tudíž snížení množství kolagenu typu II [40]. Ostatní alelické choroby se závažnějším průběhem (tab. 2), kde nejčastěji dominuje postižení kostí a kloubů, jsou naopak většinou důsledkem mutací způsobujících pouhou záměnu aminokyseliny. Pravděpodobným mechanizmem je zde tzv. dominantně negativní efekt, což znamená, že nejde o deficit v množství kolagenu II, ale o přímé narušení normální funkce tohoto proteinu produktem mutované alely [41, 42].
Sticklerův syndrom 2. typu (STL2), též AD dědičný, je následkem mutace v genu COL11A1 a předpokládá se, že zahrnuje až 20 % pacientů se STL. Oční nálezy u STL2 jsou většinou méně závažné ve srovnání se STL1, můžou být subklinické či dokonce zcela chybět [17]. Dalším hlavním rozdílem mezi těmito dvěma typy je přítomnost a tíže sluchového postižení. Pacienti se STL2 mají častěji středně těžkou až těžkou poruchu sluchu, obvykle vrozenou či časnou, zatímco pacienti se STL1 mohou mít normální sluch nebo mírnou až střední postlingvální poruchu sluchu [40]. Kraniofaciální dysmorfie se příliš neliší – u obou typů se vyskytuje zploštělý obličej a rozštěp patra. Podobnost STL1 a STL2 fenotypů je způsobena podobnou strukturou a funkcí genů způsobujících onemocnění, COL2A1 a COL11A1 [40].
Vzácné AD onemocnění, způsobené mutacemi v genu COL11A2, označované dříve jako STL typ 3, bylo recentně pro nepřítomnost očních příznaků reklasifikováno na AD dědičnou otospondylomegaepifyzární dysplazii (OSMEDA). Klinicky zde nacházíme zploštělý obličej, rozštěp patra, senzorineurální poruchu sluchu a předčasnou osteoartritidu. Postižení pacienti nevykazují žádnou oční abnormalitu vzhledem k tomu, že gen COL11A2 není exprimován v oku. Oproti STL1 a STL2 vykazují pacienti s OSMEDA vyšší prevalenci senzorineurální ztráty sluchu [43, 44]. Mutace v genu COL11A2 jsou také mimo jiné (podobně jako mutace COL11A1) asociované s nesyndromovou poruchou sluchu (tab. 2).
Tab. 2 – pokračování. Vybraná onemocnění způsobená poruchami genů spojených se Sticklerovým syndromem (tzv. alelické choroby).
Tab. 2 – continuing. Selected disorders caused by defect of genes associated with Stickler syndrome (so-called allelic disorders).
Velmi vzácný je též STL4, způsobený AR mutacemi v genu COL9A1, který byl dosud popsán u dvou rodin s proporcionálně malým vzrůstem, střední až vysokou myopií s vitreoretinopatií a abnormálním sklivcem, střední až těžkou senzorineurální poruchou sluchu a mírnou epifyzární dysplazií. Jedna rodina byla bez známek odchlípení sítnice, u druhé se amoce vyskytla [1, 2].
V jediné publikované rodině se STL5, na podkladě AR mutací v genu COL9A2, se vyskytovala těžká myopie, vitreoretinální degenerace, amoce sítnice a mírná senzorineurální porucha sluchu [3].
Mutace v genu COL9A3 jsou zodpovědné za STL6 typ a byly popsány u 2 rodin s klinickými příznaky STL – mírnou až středně těžkou senzorineurální ztrátou sluchu, nespecifickými metakarpálními a femorálními změnami epifýz. V první rodině byla přítomna mentální retardace, ale žádné vitreoretinální abnormality [4], ve druhé rodině dominovala vysoká myopie a vrozeně šavlovité tibie a femury [45].
Nedávno byl gen LOXL3 identifikován jako kandidátní pro novou vzácnou AR formu STL. Gen LOXL3 kóduje enzym lyzyl oxidázu, která se účastní procesu zesíťování kolagenu a elastinu v pojivové tkáni. Jeho mutace byly nalezeny u dvou konsangvinních rodin – jedné s těžkou myopií, mikrognacií s rozštěpem patra a mírnou převodní ztrátou sluchu [46] a druhé s těžkou myopií a malým vzrůstem [47].
Diagnostická kritéria
Pro STL nebyla formálně dodnes stanovena žádná závazná diagnostická kritéria.
Na STL by se podle Snead a Yates [17] mělo pomyslet:
1. u novorozenců s Pierre-Robinovou sekvencí,
2. u kojenců se spondyloepifyzární dysplazií asociovanou s myopií a/ nebo hluchotou,
3. u pacientů s pozitivní rodinnou anamnézou výskytu odchlípení sítnice,
4. u sporadických případů odchlípení sítnice spojených s kloubní hypermobilitou, rozštěpem patra a/ nebo hluchotou.
Avšak tato kritéria nepokrývala celou šíři příznaků STL.
Na základě rozsáhlé rešerše literatury a naší vlastní studie [5] jsme vypracovali doporučení, kdy je vhodné pacienta odeslat ke genetickému vyšetření pro STL:
1. všichni pacienti s Pierre-Robinovou sekvencí,
2. všichni kojenci s vysokou myopií (–6,0 D a výše),
3. všechny děti s netraumatickou rupturou sítnice,
4. pacienti kombinující alespoň dvaz následujících příznaků:
- rozštěp patra,
- porucha sluchu – všechny typy (po vyloučení souvislosti s rozštěpem patra),
- těžká myopie,
- kloubní hypermobilita,
- spondyloepifyzární dysplazie,
- předčasná degenerace kloubů (TEP před 30. rokem),
- plochý profil obličeje, ustupující brada, prominující oči,
- ruptura sítnice (i traumatická či v dospělém věku),
- pozitivní rodinná anamnéza.
Molekulárně genetická diagnostika
Všechny geny asociované se STL jsou charakteristické vysokým počtem kódujících exonů (v průměru 48 exonů) a Sangerova sekvenační analýza je poměrně zdlouhavá a finančně náročná, proto nebyla molekulárně genetická diagnostika STL dlouho k dispozici. V současné době díky tzv. sekvenování nové generace (NGS) je možné masivní paralelní sekvenování všech genů asociovaných se STL i jejich fenotypově příbuzných syndromů v jedné době. Tuto diagnostiku jsme zavedli na pracovišti ÚBLG, 2. LF UK a FN v Motole, kde zároveň probíhá výzkum Sticklerova syndromu i dalších syndromů spojených s kombinovaným senzorickým postižením.
Doporučená péče
I přes recentní rozvoj různých genových terapií není dosud kauzální léčba pro STL k dispozici, avšak symptomatická léčba může zmírňovat či potlačovat rozvíjející se příznaky, a tím sloužit jako prevence možných komplikací. Pacienty se STL je nutné neustále sledovat a na každé zhoršení problémů rychle reagovat. Sluch by měl být u postižených pacientů kontrolován každých 6 měsíců do věku 5 let a dále pak alespoň jednou ročně. Oční vyšetření by mělo probíhat každých 6 měsíců až do dospělosti. Pacienti by se měli vyhýbat míčovým hrám a kontaktním sportům kvůli riziku úderů do hlavy z důvodu rizika odchlípení sítnice. Včasná diagnostika a léčba očních poruch může zabránit rozvoji komplikací vedoucích k praktické slepotě. Potřebu konkrétní péče a sledování většinou řídí klinický genetik, který komunikuje se všemi odborníky a specifikuje rizika, kterých by se preventivní vyšetření mělo týkat. STL je multisystémové onemocnění, proto optimální management vyžaduje efektivní koordinaci interdisciplinární spolupráce týmu specialistů. Nezanedbatelnou součástí je též genetické poradenství v rodinách postižených osob. Znalost přesné molekulární příčiny do budoucna otvírá nejen možnosti pro genetickou diagnostiku v rodině, ale také pro cílenou genovou terapii.
Správná a včasná diagnostika vede k efektivnější léčbě, a tím ke zlepšení kvality života a sociálního začlenění postiženích jedinců. Zavedení molekulárně genetické diagnostiky do běžné praxe v ČR přineslo mnoha pacientům konečné potvrzení diagnózy, stanovení prognózy a otevřelo jim a jejich rodinám možnosti prenatální a preimplantační diagnostiky.
Grantová podpora
Práce vznikla za podpory GAUK 165815, IP FNM 00064203/ 6024 a 9782.
Prohlášení o střetu zájmu
Autor a spoluautoři práce prohlašují, že v souvislosti s tématem, vznikem a publikací tohoto článku nejsou ve střetu zájmů a vznik ani publikace článku nebyly podpořeny žádnou farmaceutickou firmou.
Přijato k recenzi: 13. 7. 2020
Přijato do tisku: 9. 9. 2020
Mgr. Jana Čopíková
Ústav biologie a lékařské genetiky 2. LF UK a FN v Motole
V Úvalu 84
150 06 Praha 5
Sources
1. Van Camp G, Snoeckx RL, Hilgert N et al. A new autosomal recessive form of Stickler syndrome is caused by a mutation in the COL9A1 gene. Am J Hum Genet 2006; 79(3): 449–457. Doi: 10.1086/ 506478.
2. Nikopoulos K, Schrauwen I, Simon M et al. Autosomal recessive Stickler syndrome in two families is caused by mutations in the COL9A1 gene. Invest Ophthalmol Vis Sci 2011; 52(7): 4774–4779. Doi: 10.1167/ iovs.10-7128.
3. Baker S, Booth C, Fillman C et al. A loss of function mutation in the COL9A2 gene causes autosomal recessive Stickler syndrome. Am J Med Genet A 2011; 155A(7): 1668–1672. Doi: 10.1002/ ajmg.a.34071.
4. Faletra F, D‘Adamo AP, Bruno I et al. Autosomal recessive Stickler syndrome due to a loss of function mutation in the COL9A3 gene. Am J Med Genet A 2014; 164A(1): 42–47. Doi: 10.1002/ ajmg.a.36165.
5. Čopíková J, Paděrová J, Románková V et al. Expanding the phenotype spectrum associated with pathogenic variants in the COL2A1 and COL11A1 genes. Ann Hum Genet 2020; 84(5): 380–392. Doi: 10.1111/ ahg.12386.
6. Francomano CA. Stickler syndrome. In: Management of Genetic Syndromes. 3rd ed. Ed. Cassidy SB, Allanson JE. Baltimore, Meryland: John Wiley & Sons; 2010 : 787–796.
7. Stickler GB, Belau PG, Farrell FJ et al. Hereditary progressive arthro-ophthalmopathy. Mayo Clin Proc 1965; 40 : 433–455.
8. Stickler GB, Pugh DG. Hereditary progressive ophthalmopathy. II. Additional observations, a hearing defect and a report of a similar case. Mayo Clin Proc 1967; 42 : 495–500.
9. Opitz JM, France T, Herrmann J et al. The Stickler syndrome. N Engl J Med 1972; 286(10): 546–547. Doi: 10.1056/ NEJM197203092861020.
10. Zlotogora J, Sagi M, Schuper A et al. Variability of Stickler syndrome. Am J Med Genet 1992; 42(3): 337–339. Doi: 10.1002/ ajmg.1320420316
11. Robin NH, Moran RT, Ala-Kokko L. Stickler syndrome. In: GeneReviews((R)). Ed. Adam MP, Ardinger HH, Pagon RA, Wallace SE, Bean LJH, Mirzaa G, Amemiya A. Seattle (WA); 1993.
12. Schreiner RL, McAlister WH, Marshall RE et al. Stickler syndrome in a pedigree of Pierre-Robin syndrome. Am J Dis Child 1973; 126(1): 86–90. Doi: 10.1001/ archpedi.1973.02110190074016.
13. Bush PG, Williams AJ. Incidence of the Robin Anomalad (Pierre-Robin syndrome). Br J Plast Surg 1983; 36(4): 434–437. Doi: 10.1016/ 0007-1226(83)90123-6.
14. Printzlau A, Andersen M. Pierre-Robin sequence in Denmark: a retrospective population-based epidemiological study. Cleft Palate Craniofac J 2004; 41(1): 47–52. Doi: 10.1597/ 02-055.
15. van den Elzen AP, Semmekrot BA, Bongers EM et al. Diagnosis and treatment of the Pierre-Robin sequence: results of a retrospective clinical study and review of the literature. Eur J Pediatr 2001; 160(1): 47–53. Doi: 10.1007/ s0043 10000646.
16. Holder-Espinasse M, Abadie V, Cormier-Daire V et al. Pierre-Robin sequence: a series of 117 consecutive cases. J Pediatr 2001; 139(4): 588–590. Doi: 10.1067/ mpd.2001.117784.
17. Snead MP, Yates JR. Clinical and molecular genetics of Stickler syndrome. J Med Genet 1999; 36(5): 353–359.
18. Stickler GB, Hughes W, Houchin P. Clinical features of hereditary progressive arthro-ophthalmopathy (Stickler syndrome): a survey. Genet Med 2001; 3(3): 192–196. Doi: 10.1097/ 00125817-200105000-00008.
19. Liberfarb RM, Levy HP, Rose PS et al. The Stickler syndrome: genotype/ phenotype correlation in 10 families with Stickler syndrome resulting from seven mutations in the type II collagen gene locus COL2A1. Genet Med 2003; 5(1): 21–27. Doi: 10.1097/ 00125817-200301000-00004.
20. Herrmann J, France TD, Spranger JW et al. The Stickler syndrome (hereditary arthroophthalmopathy). Birth Defects Orig Artic Ser 1975; 11(2): 76–103.
21. Snead MP, McNinch AM, Poulson AV et al. Stickler syndrome, ocular-only variants and a key diagnostic role for the ophthalmologist. Eye (Lond) 2011; 25(11): 1389–1400. Doi: 10.1038/ eye.2011.201.
22. Carroll C, Papaioannou D, Rees A et al. The clinical effectiveness and safety of prophylactic retinal interventions to reduce the risk of retinal detachment and subsequent vision loss in adults and children with Stickler syndrome: a systematic review. Health Technol Assess 2011; 15(16): iii–xiv, 1–62. Doi: 10.3310/ hta15160.
23. Temple IK. Stickler‘s syndrome. J Med Genet 1989; 26(2): 119–126. Doi: 10.1136/ jmg.26.2.119.
24. Seery CM, Pruett RC, Liberfarb RM et al. Distinctive cataract in the Stickler syndrome. Am J Ophthalmol 1990; 110(2): 143–148. Doi: 10.1016/ s0002-9394(14)76982-x.
25. Acke FR, Dhooge IJ, Malfait F et al. Hearing impairment in Stickler syndrome: a systematic review. Orphanet J Rare Dis 2012; 7 : 84. Doi: 10.1186/ 1750-1172-7-84.
26. Nowak CB. Genetics and hearing loss: a review of Stickler syndrome. J Commun Disord 1998; 31(5): 437–453; 453–434. Doi: 10.1016/ s0021-9924(98)00015-x.
27. Admiraal RJ, Szymko YM, Griffith AJ et al. Hearing impairment in Stickler syndrome. Adv Otorhinolaryngol 2002; 61 : 216–223. Doi: 10.1159/ 000066812.
28. Szymko-Bennett YM, Mastroianni MA, Shotland LI et al. Auditory dysfunction in Stickler syndrome. Arch Otolaryngol Head Neck Surg 2001; 127(9): 1061–1068. Doi: 10.1001/ archotol. 127.9.1061.
29. Rose PS, Ahn NU, Levy HP et al. Thoracolumbar spinal abnormalities in Stickler syndrome. Spine (Phila Pa 1976) 2001; 26(4): 403–409. Doi: 10.1097/ 00007632-200102150-00017.
30. Rai A, Wordsworth P, Coppock JS et al. Hereditary arthro-ophthalmopathy (Sticklersyndrome): a diagnosis to consider in familial premature osteoarthritis. Br J Rheumatol 1994; 33(12): 1175–1180. Doi: 10.1093/ rheu-matology/ 33.12.1175.
31. Liberfarb RM, Goldblatt A. Prevalence of mitral-valve prolapse in the Stickler syndrome. Am J Med Genet 1986; 24(3): 387–392. Doi: 10.1002/ ajmg.1320240302.
32. Ahmad N, Richards AJ, Murfett HC et al. Prevalence of mitral valve prolapse in Stickler syndrome. Am J Med Genet A 2003; 116A(3): 234–237. Doi: 10.1002/ ajmg.a.10619.
33. Poulson AV, Hooymans JM, Richards AJ et al. Clinical features of type 2 Stickler syndrome. J Med Genet 2004; 41(8): e107. Doi: 10.1136// jmg.2004.018382.
34. Higuchi Y, Hasegawa K, Yamashita M et al. A novel mutation in the COL2A1 gene in a patient with Stickler syndrome type 1: a case report and review of the literature. J Med Case Rep 2017; 11(1): 237. Doi: 10.1186/ s13256-017-1396-y.
35. Savasta S, Salpietro V, Sparta MV et al. Stickler syndrome associated with epilepsy: report of three cases. Eur J Pediatr 2015; 174(5): 697–701. Doi: 10.1007/ s00431-015-2514-8.
36. Gelse K, Poschl E, Aigner T. Collagens-structure, function, and biosynthesis. Adv Drug Deliv Rev 2003; 55(12): 1531–1546. Doi: 10.1016/ j.addr.2003.08.002.
37. Maumenee IH. Vitreoretinal degeneration as a sign of generalized connective tissue diseases. Am J Ophthalmol 1979; 88(3 Pt 1): 432–449. Doi: 10.1016/ 0002-9394(79)90645-7.
38. Baitner AC, Maurer SG, Gruen MB et al. The genetic basis of the osteochondrodysplasias. J Pediatr Orthop 2000; 20(5): 594–605. Doi: 10.1097/ 00004694-200009000-00010.
39. Godfrey M, Hollister DW. Type II achondrogenesis-hypochondrogenesis: identification of abnormal type II collagen. Am J Hum Genet 1988; 43(6): 904–913.
40. Annunen S, Korkko J, Czarny M et al. Splicing mutations of 54-bp exons in the COL11A1 gene cause Marshall syndrome, but other mutations cause overlapping Marshall/ Stickler phenotypes. Am J Hum Genet 1999; 65(4): 974–983. Doi: 10.1086/ 302585.
41. Jobling R, D‘Souza R, Baker N et al. The collagenopathies: review of clinical phenotypes and molecular correlations. Curr Rheumatol Rep 2014; 16(1): 394. Doi: 10.1007/ s11926-013-0394-3.
42. Nenna R, Turchetti A, Mastrogiorgio G et al. COL2A1 Gene mutations: mechanisms of spondyloepiphyseal dysplasia congenita. Appl Clin Genet 2019; 12 : 235–238. Doi: 10.2147/ TACG.S197205.
43. Vikkula M, Mariman EC, Lui VC et al. Autosomal dominant and recessive osteochondrodysplasias associated with the COL11A2 locus. Cell 1995; 80(3): 431–437. Doi: 10.1016/ 0092-8674(95)90493-x.
44. Vuoristo MM, Pappas JG, Jansen V et al. A stop codon mutation in COL11A2 induces exon skipping and leads to non-ocular Stickler syndrome. Am J Med Genet A 2004; 130A(2): 160–164. Doi: 10.1002/ ajmg.a.30111.
45. Hanson-Kahn A, Li B, Cohn DH et al. Autosomal recessive Stickler syndrome resulting from a COL9A3 mutation. Am J Med Genet A 2018; 176(12): 2887–2891. Doi: 10.1002/ ajmg.a.40647.
46. Alzahrani F, Al Hazzaa SA, Tayeb H et al. LOXL3, encoding lysyl oxidase-like 3, is mutated in a family with autosomal recessive Stickler syndrome. Hum Genet 2015; 134(4): 451–453. Doi: 10.1007/ s00439-015-1531-z.
47. Chan TK, Alkaabi MK, ElBarky AM et al. LOXL3 novel mutation causing a rare form of autosomal recessive Stickler syndrome. Clin Genet 2019; 95(2): 325–328. Doi: 10.1111/ cge.13465.
Labels
Audiology Paediatric ENT ENT (Otorhinolaryngology)
Article was published inOtorhinolaryngology and Phoniatrics

2021 Issue 1-
All articles in this issue
- EDITORIAL
- Využití PET/ CT v diagnostice vzdálených metastáz a duplicitních nádorů v onkologii hlavy a krku
- Frontální sinotomie Draf 3 jako součást revizních výkonů pro chronickou rinosinusitidu s polypy
- Klasifikace středoušních operací pro cholesteatom dle nového systému SAMEO-ATO v praxi
- Meningeom spánkové kosti
- Úloha narrow band imaging a autofl uorescence při diagnostice karcinomu orofaryngu
-
Sticklerův syndrom v České republice:
fenotypová variabilita a genetická heterogenita - Konsenzuální doporučení České kooperativní skupiny pro nádory hlavy a krku (2019): definice resekčních okrajů, reportování krčních disekcí a vyšetřování HPV/ p16
- Opustil nás prim. MUDr. Jiří Rutar
- Vzpomínka na emeritního primáře MUDr. Darko Klobučara
-
Kikuchiho-Fujimotova choroba
(histiocytárna nekrotizujúca lymfadenitída)
- Otorhinolaryngology and Phoniatrics
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue-
Sticklerův syndrom v České republice:
fenotypová variabilita a genetická heterogenita -
Kikuchiho-Fujimotova choroba
(histiocytárna nekrotizujúca lymfadenitída) - Meningeom spánkové kosti
- Klasifikace středoušních operací pro cholesteatom dle nového systému SAMEO-ATO v praxi
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

