-
Medical journals
- Career
Léčba hypotyreózy a hypertyreózy
Authors: Jan Jiskra
Authors‘ workplace: III. interní klinika 1. LF UK a VFN Praha, přednosta prof. MUDr. Štěpán Svačina, DrSc., MBA
Published in: Vnitř Lék 2015; 61(10): 868-872
Category: Reviews
Overview
Funkční tyreopatie přinášejí nemocným významná zdravotní rizika. Rozvinuté funkční tyreopatie léčíme vždy, zatímco indikace k léčbě subklinických tyreopatií jsou individuální a často kontroverzní. Panuje shoda, že tyto poruchy by měly být diagnostikovány a osoby by měly být sledovány. V substituci hypotyreózy je lékem volby levotyroxin, v léčbě hypertyreózy methimazol. Podávání propylthiouracilu by mělo být omezeno na 1. trimestr gravidity, protože byla popsána jeho závažná hepatotoxicita. U hypertyreózy na podkladě tyreoidálních uzlů a u imunogenní hypertyreózy, která nepřejde do trvalé remise, je na místě definitivní řešení – operace nebo léčba radiojodem. Radiojod lze při dodržení podmínek radiační ochrany podat i ambulantně. Výjimečně lze v individuálních případech podávat malé dávky methimazolu dlouhodobě.
Klíčová slova:
hypertyreóza – hypotyreóza – levotyroxin – methimazol – propylthiouracil – radiojod 131I – totální tyreoidektomie – tyreoidální stimulační hormonDefinice funkčních tyreopatií
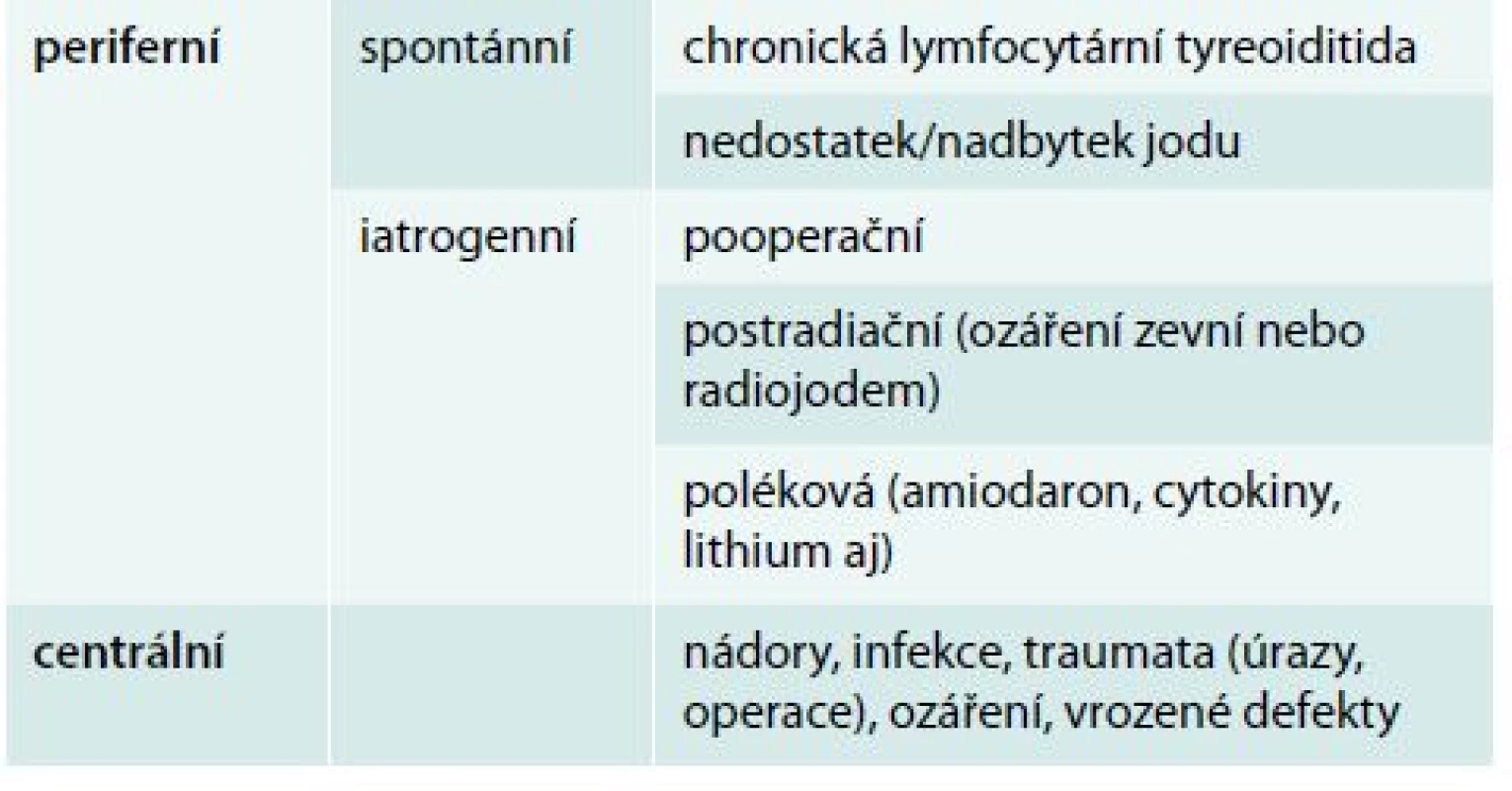
Hypotyreóza znamená nedostatek hormonů štítné žlázy. Centrální hypotyreóza je vzácná a diagnostikuje se na základě poklesu volných tyreoidálních hormonů – volného tyroxinu (fT4) a volného trijodtyroninu v séru (fT3) – v séru pod dolní hranici normálních hodnot příslušné laboratorní metody. TSH nemá pro diagnostiku centrální hypotyreózy význam. Naopak periferní hypotyreóza je onemocnění velmi časté (prevalence 5–15 %) a definuje se laboratorně jako vzestup tyreostimulačního hormonu (TSH) v séru nad horní hranici normálních hodnot příslušné laboratorní metody (obvykle 4,0–5,0 mIU/l). Je-li provázen poklesem fT4, eventuálně fT3 v séru, jde o rozvinutou (manifestní) hypotyreózu, jsou-li tyreoidální hormony v normě, jde o subklinickou hypotyreózu [10].
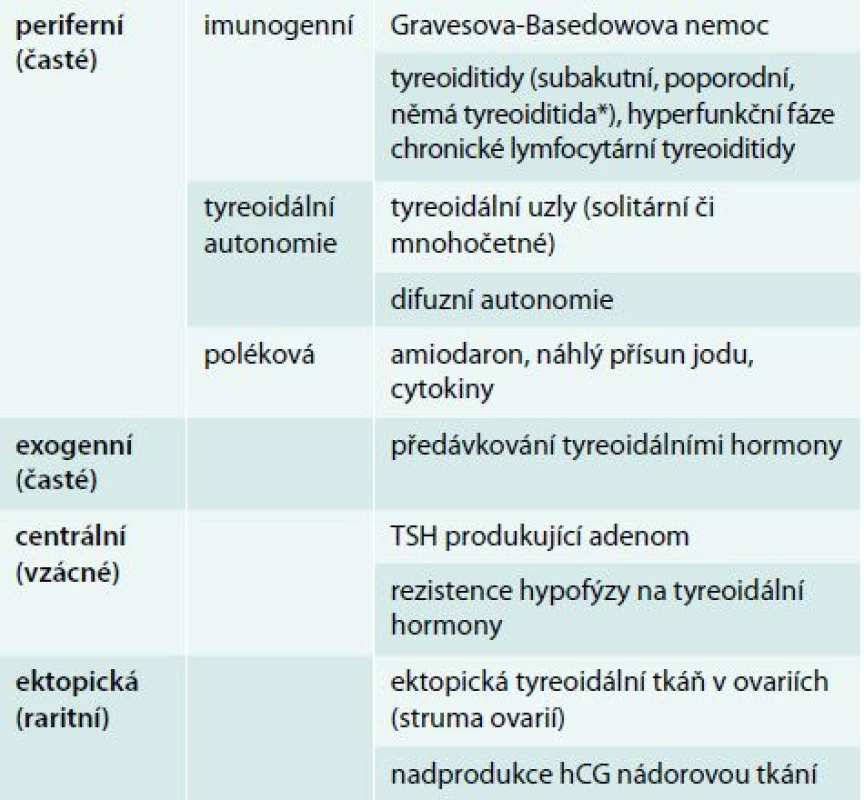
Hypertyreóza znamená nadbytek hormonů štítné žlázy. Centrální hypertyreóza je mimořádně vzácná a diagnostikuje se na podkladě zvýšení fT4 a fT3 v séru při normálním nebo vyšším TSH. Periferní hypertyreóza se diagnostikuje na základě poklesu TSH pod dolní hranici normálních hodnot příslušné laboratorní metody (obvykle 0,4–0,5 mIU/l). Je-li provázen vzestupem fT4 nebo fT3, jde o rozvinutou (manifestní) hypertyreózu, jsou-li tyreoidální hormony v normě, jde o subklinickou hypertyreózu [2]. Nejčastější příčiny hypotyreózy a hypertyreózy jsou uvedeny v tab. 1 a tab. 2, orientační normální hodnoty pro vyšetřované laboratorní parametry v tab. 3.
Table 3. Orientační referenční rozmezí tyreoidálních laboratorních parametrů v séru Referenční rozmezí všech parametrů a zejména pak fT4, fT3 a TPOAb je ovlivněno laboratorní metodou. 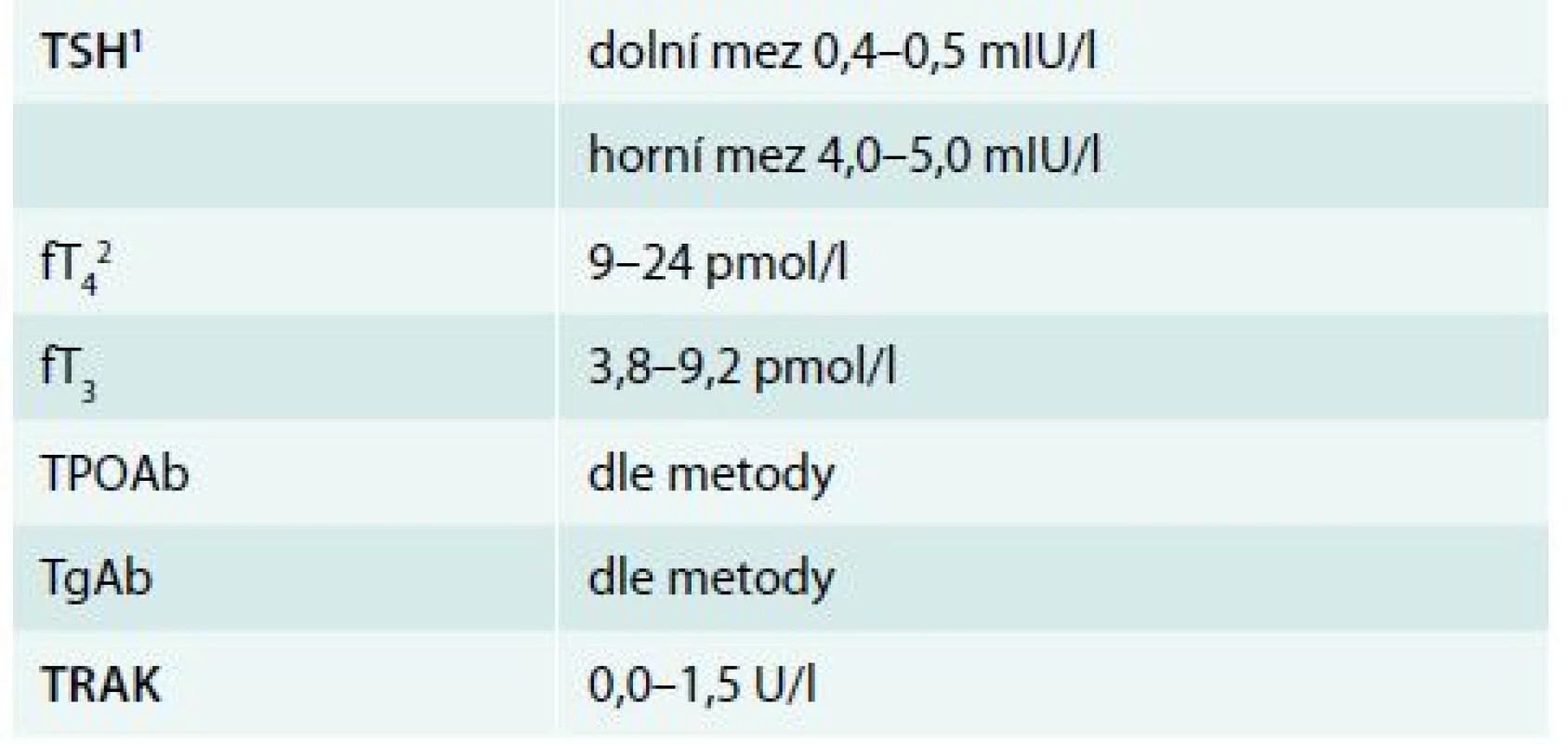
1 Horní hranice TSH stoupá s věkem: od 40 let asi o 0,3 mIU/l každých 10 let a normy pro TSH jsou také odlišné v graviditě. Pokud nejsou k dispozici vlastní normy pro graviditu v konkrétní laboratoři, nemá být koncentrace TSH > 2,5 mIU/l v 1. trimestru, 3,0 v 2. a 3,5 v 3. trimestru gravidity. Dolní hranice TSH se v prvním trimestru snižuje na 0,1–0,2 mIU/l. 2 V poslední době se ukazuje, že fT4 není v těhotenství příliš spolehlivý parametr z důvodu změn sérových bílkovin. Je vhodné, aby v budoucnu každá laboratoř vypracovala vlastní normy pro fT4 pro jednotlivé trimestry gravidity. Léčba hypotyreózy
Podstatou je substituce levotyroxinem (LT4). Léčba je snadná a využívá se více než 110 let. Syntéza LT4 umožnila fyziologickou léčbu a exaktní dávkování. Na hormon není alergie, výjimečně se objeví reakce na stabilizační látku v tabletě. Při laktázovém deficitu může být zhoršená resorpce účinné látky. Při zahájení substituce zvažujeme zdravotní stav pacienta: koronární cévy, dobu trvání hypotyreózy, psychiku, zázemí u starých osob, eventuálně i další faktory. Potřeba LT4 je individuální, uvádí se 1,6 µg/1 kg při naprostém chybění funkční tkáně, ale denní dávka kolísá od 75 do 200 µg, někdy i více. Začínáme dávkou nižší a po 3–6 týdnech zvyšujeme podle subjektivního stavu, u starých nebo polymorbidních osob začínáme dávkou 12,5–50 µg denně, u mladých jinak zdravých osob dávkou 75–100 µg denně. Plnou dávku bez titrace podáváme po totální tyreoidektomii, v graviditě a pokud došlo k přerušení léčby na dobu kratší než 2–3 měsíce [5,8]. Substituci potřebují i osoby s ICHS, ale dávku zvyšujeme velmi pozvolna, kombinujeme s betablokátory a koronárními vazodilatancii za časté kontroly stavu [13]. Cílové hodnoty TSH při substituci hypotyreózy obecně odpovídají pásmu normy až na některé výjimky, pro něž se doporučují dávky takové, abychom dosáhli většího poklesu TSH (např. 0,5–2,5 mIU/l v 1. trimestru gravidity [4,8], 0,5–2,0 mIU/l jsou-li současně přítomné uzly štítné žlázy nebo struma). Pacienty opakovaně upozorníme, že léky se musí užívat nalačno, 30–60 min před jídlem a odděleně od ostatní medikace. Alternativně lze léky užívat i na noc 3–4 hod po posledním jídle [5,7]. Resorpce léků je někdy snížená u gastritidy pozitivní na Helicobacter pylori, atrofické gastritidy, celiakie a vlivem některých léků (iontoměniče, preparáty železa, omeprazol apod). Kontrola TSH má být až po dosažení rovnováhy zpětné vazby, to jest za 5–6 týdnů od poslední změny dávky. Po stabilizaci stačí kontroly stavu a hladiny TSH 1krát za 6–12 měsíců. Kontrola TSH by se také měla provést za 2–3 měsíce po zahájení nové medikace, která může interferovat s resorpcí tyreoidálními hormony [5]. U většiny nemocných jde o léčbu celoživotní.
Na rozdíl od substituční léčby, při které má být TSH ve fyziologickém pásmu, je u některých chorob (karcinom štítné žlázy, výjimečně některé druhy strum či chronická autoimunitní tyreoiditida s uzly) indikována supresní léčba, při které je TSH snížený pod normu a fT4 je při tom na horní hranici normy. Při déletrvající supresní léčbě se mohou zvláště u starších osob se dostavit vedlejší účinky – kardiální a kostní, proto se indikace supresní terapie zpřísňují a supresní léčba se uvolňuje [3].
Podle doporučení European Thyroid Association [11] je LT4 pro léčbu hypotyreózy základním lékem. Nicméně u části osob (10–15 %) nevede substituční léčba T4 k plné úpravě všech známek hypotyreózy (hlavně psychické změny). U těchto osob lze vyzkoušet efekt kombinace LT4 s trijodtyroninem (T3). V ČR je v současné dostupný preparát Cynomel na mimořádný dovoz. Tuto léčbu by měli provádět pouze zkušení endokrinologové. Základní klinické indikace k podávání T3 zahrnují:
- nemožnost normalizace nebo nezbytné suprese podáváním LT4 (v kombinaci s LT4)
- přetrvávající psychické problémy (deprese) při léčbě hypotyreózy (vhodný terapeutický pokus, v kombinaci s LT4)
- myxedémové kóma (v kombinaci s LT4) – předpokládá se, že je snížená aktivita dejodáz, i když důkazy pro tento postup jsou slabé [7] a velké dávky T3 byly naopak spojeny se zvýšenou mortalitou [12]
- T3 supresní test při podezření na syndrom rezistence tyreoidálními hormony a v jeho diferenciální diagnostice (podává se samotný T3)
- T3 supresní test při scintigrafii štítné žlázy (v diferenciální diagnostice toxického adenomu)
- převedení z léčby T4 na T3 před léčbou radiojodem (tím je možné zkrátit následnou dobu ukončení substituce, protože poločas T3 je asi 2 dny, zatímco T4 7–8 dní, rutinně se dnes ale nepoužívá)
Při podávání T3 má být poměr T3 : T4 asi 1 : 10–14. Cynomel tbl. obsahuje 25 µg T3 a tabletu lze rozdělit na 1/2–1/4 (tableta obsahuje půlící a čtvrtící rýhu). V praxi podáváme T3 obvykle jednorázově s tabletou T4, tj. např. 75–150 µg T4 a 1/4–1/2 tablety T3 (Cynomel) denně, i když teoreticky se zdá vhodnější podání ve 2–3 denních dávkách z důvodu menšího kolísání hladin a nežádoucích kostních a kardiovaskulárních účinků [1]. U mladých a zdravých osob není kontraindikace, u osob s ICHS, osteoporózou, dysrytmiemi apod se snažíme této léčbě vyhnout. Kombinační léčba také není vhodná v těhotenství (rozdílný průnik T4 a T3 do tkání plodu, především do CNS).
Léčba hypertyreózy
Léčba hypertyreózy se částečně liší podle příčiny (tab. 2) a patří výlučně do rukou endokrinologa. Má 2 fáze – tzv. iniciální zklidnění a definitivní řešení.
Iniciální zklidnění
Zásady 1. fáze jsou v podstatě stejné pro všechny formy hypertyreózy – cílem je co nejrychlejší dosažení eutyreózy podáváním tyreostatik. Nástup jejich účinku je ale až za několik týdnů, proto je velmi důležité tlumit v úvodu oběhové příznaky hypertyreózy symptomaticky – zpravidla betablokátory. Dnes se vzhledem k menšímu množství nežádoucích účinků upřednostňují betablokátory kardioselektivní bez vnitřní aktivity, např. metoprolol. Pokud nejsou kontraindikace a pacient má oběhové projevy hypertyreózy, je léčba betablokátory indikována vždy – typicky např. v situaci, pokud diagnóza ještě není laboratorně potvrzena. Po potvrzení diagnózy laboratorně zahajujeme terapii tyreostatiky.
Lékem volby je methimazol (thiamazol) iniciálně 20–30 mg denně (výjimečně až 40 mg denně) [2]. Je obvyklé rozdělit lék do 2–3 denních dávek, vzhledem k dlouhému biologickému poločasu se však dá užívat i v jednou denně. Po 4–6 týdnech a v dalším průběhu se dávka postupně snižuje podle klinického obrazu a laboratorních nálezů tak, aby fT4 a fT3 byly v normálním rozmezí, zatímco TSH může zůstávat neměřitelné nebo nízké i řadu měsíců. Udržovací malá dávka methimazolu (asi 5 mg denně nebo ob den) se u hypertyreózy při Gravesově-Basedowově (GB) chorobě doporučuje podávat nejméně 6–18 měsíců a nejdéle 2 roky, u endokrinní orbitopatie až 4 roky. Pokud stav pacienta neumožní do této doby vysazení terapie nebo dochází po vysazení k relapsům, je nutné indikovat definitivní řešení. Dojde-li při terapii k přechodu do hypotyreózy (pokles fT4 pod dolní mez normálních hodnot), lze v některých případech kromě snižování dávky tyreostatika přidat přechodně malou dávku levotyroxinu (obvykle 25–50 µg denně). Propylthiouracil, dříve dosti oblíbený především v USA, ale i u nás, by se měl používat výhradně v 1. trimestru gravidity a při závažné nesnášenlivosti methimazolu, protože je příčinou častější jaterní toxicity, a to především u dětí (v USA je propylthiouracil 3. nejčastějším lékem způsobujícím závažnou hepatotoxicitu, která si vyžádá transplantaci jater) [9].
Časté méně závažné nežádoucí účinky methimazolu jsou kožní alergie, dyspepsie a mírná neutropenie (pokles do 1,5 × 109/l). V těchto případech se nedoporučuje přerušovat léčbu a postupuje se symptomaticky (protialergické léky, užívání léku s jídlem, monitorování krevního obrazu), vedlejší projevy často během několika dnů vymizí [2]. Pokud přetrvávají, lze změnit léčbu na propylthiouracil (počáteční dávka 200–300 mg denně s postupným snižováním po 4–6 týdnech), avšak s vědomím rizik možné hepatopatie či zkřížené reakce.
Vzácné, ale život ohrožující nežádoucí účinky jsou agranulocytóza, vaskulitida a hepatopatie. První dva se mohou vyskytnout u obou preparátů, závažná hepatopatie (hepatocelulární toxicita s vzestupem ALT a AST) bývá častěji po propylthiouracilu [9]. Methimazol způsobuje méně závažný vzestup cholestatických enzymů (ALP, GMT). Objeví-li se tyto závažné nežádoucí účinky, je nutno léčbu přerušit, záměna jednoho preparátu za druhý je kontroverzní a u závažných reakcí se nedoporučuje, protože se vyskytují zkřížené reakce. Léčba je symptomatická a pacienta je třeba po zvládnutí akutního stavu připravit lugolizací a kortikoidy k totální tyreoidektomii nebo indikovat léčbu radiojodem (v tom případě se nelugolizuje).
Před zahájením tyreostatické léčby by se měl vyšetřit krevní obraz, diferenciální rozpočet leukocytů, bilirubin a jaterní testy. Pravidelné rutinní monitorování krevního obrazu a jaterních testů se v dalším průběhu léčby tyreostatiky nedoporučuje, důležitější (a efektivnější) je dobře poučit pacienta, aby v případě horečnatého onemocnění, při zežloutnutí a jiných příznacích hepatopatie (tmavá moč, acholická stolice, bolesti břicha apod) lék vysadil a vyhledal lékařskou pomoc s vyšetřením krevního obrazu a jaterních testů. Průběžné kontroly jaterních testů jsou nutné při podávávání propylthiouracilu.
Nereaguje-li nemocný na obvyklou dávku tyreostatik, je třeba – spíše než zvyšovat dávku –vyzkoušet efekt kortikoidů, revidovat komplianci a správnost diagnózy, eventuálně zajistit užívání léků pod dohledem nebo zvolit intravenózní aplikaci. Podávání kombinace methimazolu a propylthiouracilu se dnes spíše nedoporučuje z důvodu již zmiňované hepatotoxicity.
V léčbě floridní hypertyreózy nelze opomenout režimová opatření (fyzické a psychické šetření, eventuálně inaptibilita) a někdy jsou vhodná anxiolytika. Jako podpůrnou léčbu u závažných hypermetabolických příznaků lze podávat vitaminy skupiny B, vitamin D a kalcium.
Definitivní řešení
Nemocní s GB chorobou mají asi ve 40–60 % naději na dlouhodobou remisi po ukončení tyreostatické léčby. GB choroba však může relabovat i po mnoha letech, jindy spontánně přejde do hypotyreózy. Proto po ukončení tyreostatické léčby má být pacient o těchto rizicích informován a sledován. Pokud nedojde k remisi GB choroby s možností vysazení tyreostatik do 2 let (u endokrinní orbitopatie do 4 let), nebo má onemocnění relabující průběh, je namístě definitivní řešení operační, nebo léčba radiojodem 131I. U hyperfunkčních uzlů musíme indikovat trvalé řešení vždy, protože naděje na spontánní remisi není a jen výjimečně můžeme ponechat trvalou léčbu malými dávkami tyreostatik, pokud z nějakého důvodu není jiné řešení možné. Podle současných poznatků nelze ani jednu z možností (operace vs radiojod) upřednostnit. Obě mají své výhody i nevýhody a rozhodnutí, kterou z nich použít, musí být vždy individuální. Faktem je, že v ČR je radiojod v léčbě benigních tyreoidálních onemocnění používán mnohem méně často než např. v USA. Jedním z důvodů je i nízká kapacita lůžkových oddělení nukleární medicíny, protože dříve bylo zvykem podávat léčbu za hospitalizace. Současná právní úprava ale umožňuje i u nás podat aktivitu do 550 MBq 131I ambulantně [6]. Podmínky, vhodné a nevhodné indikace a kontraindikace léčby hypertyreózy radiojodem uvádí tab. 4. Kontraindikací k léčbě radiojodem je kromě jiných i středně těžká, těžká a zrak ohrožující endokrinní orbitopatie. U lehké aktivní orbitopatie lze radiojod použít pod clonou kortikoidů. Operaci také častěji indikujeme u žen plánujících graviditu, u osob s perspektivou náročného zaměstnání či u sportovců, u osob s další závažnou autoimunitní chorobou (především s diabetes mellitus), u osob s objemnou retrosternální strumou a u pacientů vyžadujících ke kompenzaci vysoké dávky tyreostatika.
Table 4. Podmínky, vhodné a nevhodné indikace a kontraindikace léčby hypertyreózy radiojodem 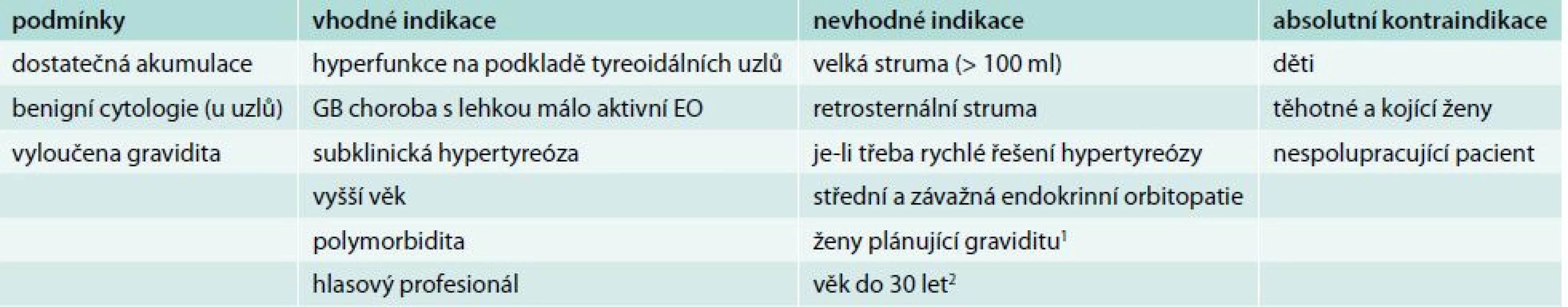
1 Není absolutní kontraindikací. Za podmínky, že žena neotěhotní následujících 6 (lépe 12) měsíců, tak lze radiojod použít. 2 Není absolutní kontraindikací. Je-li indikována operace, jde u GB choroby a toxické polynodózní strumy/přestavby o totální tyreoidektomii, u toxického adenomu obvykle o lobektomii nebo hemityreoidektomii (pokud není podezření na malignitu). Operační a pooperační komplikace jsou na specializovaných pracovištích vzácné.
K operaci nebo léčbě radiojodem odešleme pacienta eufunkčního s udržovací malou dávkou tyreostatika, kterou vysazujeme po operaci nebo 5–7 dní před podáním radiojodu. Někdy přetrvává dlouhodobá suprese TSH s již normalizovanými tyreoidálními hormony u klinicky zklidněného pacienta. V těchto případech jsou operační řešení i radiojod možné, před operací je ale vhodné zvážit předchozí lugolizaci, v závislosti na lokálním nálezu na ultrazvuku. Při operaci má být odstraněna celá štítná žláza, ponechané zbytky mohou udržovat aktivitu endokrinní orbitopatie nebo regenerovat s rizikem dalšího relapsu choroby. Ihned po operaci zahajujeme i bez znalosti histologie substituci fT4 v plné dávce a v případě nálezu malignity se naplánuje léčba radiojodem po vynechání substituční léčby. Po léčbě radiojodem se v závislosti na závažnosti choroby a předchozí dávce tyreostatika buď pokračuje v redukované dávce, nebo se léčba vysazuje a kontroluje se fT4 a TSH nejpozději za 4 týdny.
Hyperfunkční fáze poporodní a subakutní tyreoiditidy odezní spontánně a tyreostatika nepodáváme. U silentní tyreoiditidy a u hyperfunkční fáze autoimunitní (Hashimotovy) tyreoiditidy se v léčbě někdy vystačí s podáním betablokátorů, při těžším průběhu urychlí odeznění hyperfunkční fáze menší dávka methimazolu (do 10 mg denně) nebo výjimečně i malá dávka kortikoidu (20–30 mg prednisonu denně). U silentní tyreoiditidy nastane zklidnění do několika měsíců a je možné léčbu ukončit, relapsy nebývají, autoimunitní (Hashimotova) tyreoiditida většinou přejde do hypotyreózy.
Amiodaronová hypertyreóza se léčí podle typu: typ I. vzniká v již předem nemocné štítné žláze, léčí se tyreostatiky a mívá protrahovaný průběh s častou rezistencí na terapii, typ II. vzniká v dosud zdravé štítné žláze toxickým působením jodu, léčí se kortikoidy a často přejde do remise. Odlišení obou typů není někdy snadné, přínosné je ultrasonografické vyšetření, ale výsledek nemusí být jednoznačný a časté jsou i smíšené formy. Po odeznění fáze hyperfunkce může zejména II. typ přejít do hypofunkce.
Závěr
Tyreopatie jsou nemoci masového výskytu a neléčené přinášejí postiženým významná zdravotní rizika. Na druhou stranu i nesprávně indikovaná a vedená léčba – především předávkování tyreoidálními hormony u osob vyššího věku – může mít pro pacienty negativní důsledky. Základem racionální léčby je přesná diagnostika včetně určení etiologie funkční poruchy. V substituci hypotyreózy je lékem volby levotyroxin, v léčbě hypertyreózy methimazol. Podávání propylthiouracilu by mělo být omezeno na 1. trimestr gravidity, protože byla popsána jeho závažná hepatotoxicita. U hypertyreózy na podkladě tyreoidálních uzlů a u imunogenní hypertyreózy, která nepřejde do trvalé remise, je na místě definitivní řešení – operace nebo léčba radiojodem.
Doručeno do redakce 17. 8. 2015
Přijato po recenzi 25. 9. 2015
doc. MUDr. Jan Jiskra, Ph.D.
jan.jiskra@vfn.cz
III. interní klinika 1. LF UK a VFN, Praha
www.vfn.cz
Sources
1. Abdalla SM, Bianco AC. Defending plasma T3 is a biological priority. Endocrinol (Oxf) 2014; 81(5): 633–641.
2. Bahn RS, Burch HB, Cooper DS et al. American Thyroid Association; American Association of Clinical Endocrinologists. Hyperthyroidism and other causes of thyrotoxicosis: management guidelines of the American Thyroid Association and American Association of Clinical Endocrinologists. Endocr Pract 2011; 17(3): 456–520.
3. Cooper DS, Doherty GM, Haugen BR et al. American Thyroid Association (ATA) Guidelines Taskforce on Thyroid Nodules and Differentiated Thyroid Cancer, Revised American Thyroid Association management guidelines for patients with thyroid nodules and differentiated thyroid cancer. Thyroid 2009; 19(11): 1167–1214.
4. DeGroot L, Abalovich M, Alexander EK et al. Management of thyroid dysfunction during pregnancy and postpartum: An Endocrine Society practice guidelines. J Clin Endocrinol Metab 2012; 97(8): 2543–2565.
5. Garber JR, Cobin RH, Gharib H et al. American Association of Clinical Endocrinologists and American Thyroid Association Taskforce on Hypothyroidism in Adults. Clinical practice guidelines for hypothyroidism in adults: cosponsored by the American Association of Clinical Endocrinologists and the American Thyroid Association. Endocr Pract 2012; 18(6): 988–1028.
6. Jiskra J, Kubinyi J, Telička Z. Léčba hypertyreóza radiojódem 131I v ambulantním režimu – bezpečná, účinná a ekonomická varianta. Vnitř Lék 2012; 58(2): 94–98.
7. Jonklaas J, Bianco AC, Bauer AJ et al. Guidelines for the treatment of hypothyroidism. Thyroid 2014; 24(12):1670–1751.
8. Límanová Z et al. Doporučení pro diagnostiku a léčbu onemocnění štítné žlázy v těhotenství a pro ženy s poruchou fertility. Klin Biochem Metab 2013; 21(42): 41–64.
9. Malozowszki S, Chiesa A. Propylthiuracil-induced hepatotoxicity and death. Hopefully, never more. JCEM 2010; 95(7): 3161–3163.
10. Pearce SH, Brabant G, Duntas LH et al. 2013 ETA Guideline: Management of Subclinical Hypothyroidism. Eur Thyroid J 2013; 2(4): 215–228.
11. Wiersinga WM, Duntas L, Fadeyev V et al. 2012 ETA Guidelines: The use of LT4 + LT3 in the treatment of hypothyroidism. Eur Thyroid J 2012; 1(2): 55–71.
12. Yamamoto T, Fukuyama J, Fujiyoshi A. Factors associated with mortality of myxedema coma: report of eight cases and literature survey. Thyroid 1999; 9(12): 1167–1174.
13. Zamrazil V. Nemoci štítné žlázy v klinické praxi. Postgraduální medicina 2013; 15(7): 720–729.
Labels
Diabetology Endocrinology Internal medicine
Article was published inInternal Medicine

2015 Issue 10-
All articles in this issue
- Incidentalom nadledviny
- Adrenální insuficience
- Štítná žláza a gravidita – souhrn důležitých poznatků
- Léčba hypotyreózy a hypertyreózy
- Subklinické tyreopatie
- Chronická lymfocytární tyreoiditida a karcinom štítné žlázy
- Funkční hypotalamická amenorea
- Syndrom polycystických ovarií
- Novinky v diagnostice a léčbě MEN1
- Akromegalie: současný pohled
- Systémová léčba glukokortikoidy: praktický pohled
- Internal Medicine
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Funkční hypotalamická amenorea
- Systémová léčba glukokortikoidy: praktický pohled
- Incidentalom nadledviny
- Adrenální insuficience
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career