-
Medical journals
- Career
Chronická obstrukční plicní nemoc pohledem nových doporučení – souhrn aktuálního fenotypově zaměřeného standardu České pneumologické a ftizeologické společnosti pro internisty
Authors: V. Koblížek 1; J. Chlumský 2; V. Zindr 3; K. Neumannová 4,5; J. Zatloukal 4; V. Sedlák 1; J. Kociánová 6; J. Zatloukal 7; B. Novotná 1
Authors‘ workplace: Plicní klinika Lékařské fakulty UK a FN Hradec Králové, přednosta doc. MU Dr. František Salajka, CSc. 2 Pneumologická klinika 1. lékařské fakulty UK a Thomayerovy nemocnice Praha, přednosta prof. MU Dr. Jiří Homolka, DrSc. 3 Plicní ordinace Karlovy Vary4 1
Published in: Vnitř Lék 2013; 59(6): 505-514
Category: Guidelines
Overview
Úvod:
CHOPN představuje celosvětový zdravotně‑sociální problém. Morbidita a mortalita roste i v České republice. V současnosti existuje několik mezinárodních návodů a strategií.Metodika:
Česká pneumologická a ftizeologická společnost (ČPFS) na konci roku 2011 pověřila Sekci bronchiálních obstrukcí vypracováním návrhu národních doporučení týkajících se stabilní fáze CHOPN. Následně vznikl dokument diskutovaný během Národní konsenzuální konference (CHOPN fórum) v listopadu roku 2012 a prezentovaný na sérii lokálních seminářů a celostátních konferencí. Poté bylo doporučení podrobeno recenznímu řízení a nakonec vyvěšeno na webové stránky k dalšímu kolu připomínek.Diagnóza:
Základem moderního přístupu k CHOPN je pohled na pacienta přes plicní funkce, symptomy, výskyt exacerbací a přítomnost fenotypů. ČPFS konsenzuálně identifikovala 6 klinicky relevantních fenotypů: frekventní exacerbátor, CHOPN + AB overlap, CHOPN + bronchiektázie overlap, emfyzematický a bronchitický fenotyp a fenotyp plicní kachexie.Léčba:
Léčebná doporučení byla rozdělena do 4 základních kroků. Prvním krokem je eliminace všech inhalačních rizik. Standardní terapie, zahrnující zejména inhalační bronchodilatancia, pulmonální rehabilitaci a léčbu závažných komorbidit, je krokem číslo dva. Třetí krok představuje cílená fenotypická léčba zaměřená na specifické typy postižení. Jako poslední, čtvrtý krok byla určena terapie respirační nedostatečnosti a péče o terminální CHOPN.Závěr:
Optimální terapie CHOPN vyžaduje snahu o personalizovaný přístup k nemocným.Klíčová slova:
fenotypy CHOPN – personalizovaná medicína – národní doporučeníÚvod
Chronická obstrukční plicní nemoc (CHOPN) postihuje nejméně 5 % populace Evropské unie [1 – 3]. České odhady prevalence z konce minulého století (1996) hovoří o přibližně 7 % nemocných [4]. Přesnější data ze současnosti ukazují 16 000 v ČR hospitalizovaných osob a přibližně 2 500 zemřelých z důvodu CHOPN [5,6]. Z výše uvedeného je zřejmé, že i v České republice představuje CHOPN reálný a závažný problém. Aktuálně existuje několik zahraničních léčebných návodů a doporučení. Tyto dokumenty však zcela neodpovídají požadavkům a reálným možnostem českého zdravotního systému [7 – 11]. Díky aktivitě Sekce bronchiálních obstrukcí České pneumologické a ftizeologické společnosti (ČPFS) vznikl v roce 2012 koncept národního standardu péče o nemocné se stabilní fází CHOPN. V listopadu roku 2012 byl předložen odborné pneumologické veřejnosti na Konsenzuální konferenci a na desítkách regionálních seminářů. Na základě poznatků z těchto akcí byl koncept dotvořen a na počátku roku 2013 vyvěšen na webové stránky ČPFS k dalšímu kolu připomínek členů odborné společnosti. Nakonec byl celý národní dokument prezentován kolegům ze zahraničí a finálně upraven. Po zapracování všech připomínek byla v květnu roku 2013 vytvořena definitivní verze tohoto dokumentu, jehož hlavním rysem je důraz na cílenou individualizovanou péči adekvátní symptomům a fenotypu každého nemocného, přihlížející k závažným komorbiditám a k současně podávané medikaci [12].
Popis pojmu CHOPN
Chronická obstrukční plicní nemoc (CHOPN) je léčitelným, preventabilním a klinicky heterogenním syndromem s dominujícími plicními projevy a s různě vyjádřeným mimoplicním postižením. Plicní komponenta je spojena s ne zcela reverzibilní limitací průtoku vzduchu při výdechu. Limitace průtoku vzduchu je vyvolána zúžením průsvitu průdušek a průdušinek, vznikajícím postupně v důsledku chronického, primárně neinfekčního zánětu dýchacích cest a plicního parenchymu. Jedná se o vystupňovanou a prolongovanou zánětlivou reakci geneticky predisponovaného organizmu na dlouhodobou inhalační expozici škodlivým částicím a plynům. Mimoplicní postižení nacházíme zejména v kardiovaskulárním a muskuloskeletálním systému. CHOPN lze navíc považovat za prekancerózu [8].
Patofyziologie
Důsledkem CHOPN je celé spektrum morfologických změn dýchacích cest, plicního parenchymu a plicních cév. Nejdůležitější se zdá poškození alveolů a úbytek elastických vláken, zvyšující poddajnost plicní tkáně a snižující její elastický retrakční tlak. Elastické vlastnosti plic a hrudní stěny, odpor a případný kolaps periferních dýchacích cest určují nejen rychlost proudění vydechovaného vzduchu, ale i velikost důležitých plicních objemů. Pro nemocné s CHOPN je typická interindividuálně variabilní tendence k progresivnímu zhoršování především dynamických ventilačních parametrů a zvyšování plicní hyperinflace.
Rizikové faktory
Nejdůležitějším rizikovým faktorem (70 – 80 % onemocnění) zůstává kouření cigaret – kuřáci s CHOPN navíc mívají těžší symptomy, výraznější mortalitu a rychlejší pokles plicních funkcí v porovnání s CHOPN trpícími nekuřáky. Kromě aktivního kouření jsou rizikové: pasivní kouření, kouření marihuany, doutníků, dýmky, inhalace škodlivých exhalací a zplodin z dopravy či ze spalování fosilních paliv a biomasy, nízká porodní hmotnost, recidivující respirační infekce v dětském věku. Rozhodující je individuální interakce mezi genetickými + epigenetickými faktory a vlivy prostředí [13 – 15].
Klinický průběh a relevantní fenotypy
Nejčastějším klinickým projevem CHOPN je dušnost. Nejprve vzniká při velkém fyzickém zatížení, poté během běžných denních aktivit a nakonec v klidu [16,17]. Druhým projevem je únava a třetím kašel [18]. Kašel má u většiny nemocných produktivní charakter – hovoříme o tzv. bronchitickém fenotypu CHOPN [19]. Naopak nemocné s celoživotní nepřítomností chronické expektorace označujeme jako emfyzematiky – jedná se téměř výhradně o osoby s predominancí plicního emfyzému [20,21]. Někteří nemocní s CHOPN současně trpí bronchiektáziemi, hovoříme o fenotypu CHOPN s bronchiektaziemi [22,23]. Relativně stabilní průběh CHOPN bývá u menší části nemocných intermitentně přerušován atakami akutního zhoršování překračujícími obvyklou mezidenní symptomovou variabilitu, trvajícími 3 dny a vedoucími k nutnosti léčby antibiotiky a/ nebo systémovými kortikoidy – tzv. akutními exacerbacemi (AE). Pacienty s výskytem 2 epizod AE/ posledních 12 měsíců obvykle nazýváme frekventními exacerbátory [24 – 26]. Někteří nemocní s CHOPN mají v průběhu onemocnění značnou tendenci k poklesu tělesné hmotnosti (BMI < 21), zejména netukové tkáně (pokles fat free mass indexu – FFMI < 16 kg/ m2 u mužů,< 15 kg/ m2 u žen). U těchto subjektů (po vyloučení jiných příčin) hovoříme o přítomnosti fenotypu tzv. plicní kachexie [20,27]. Důležitým fenotypem je překryvný fenotyp CHOPN s bronchiálním astmatem charakterizovaný přítomností 2 hlavních či 1 hlavního a nejméně 2 vedlejších kritérií ukazujících na víceméně trvalou kombinaci rysů typických pro obě diagnózy [21,28,29]. Přehled všech 6 základních fenotypů CHOPN přináší obr. 1. Závažné formy CHOPN směřují, většinou po mnoha letech, k rozvoji chronické respirační nedostatečnosti spojené se vznikem plicní hypertenze vedoucí k přetížení a posléze selhání pravého srdce. S CHOPN se často vyskytují další choroby neboli komorbidity: plicní karcinom, embolizace do plicní cirkulace, pneumonie, ischemická choroba srdeční, kardiální selhávání, afektivní poruchy, osteoporóza, anémie a vředová choroba – obr. 2 [8,30 – 32]. Pro osoby s konečnou fází choroby užíváme pojem terminální CHOPN [33,34].
Image 1. Přehled základních klinických projevů šesti fenotypů chronické obstrukční plicní nemoci (podrobněji viz text a obr. 4). 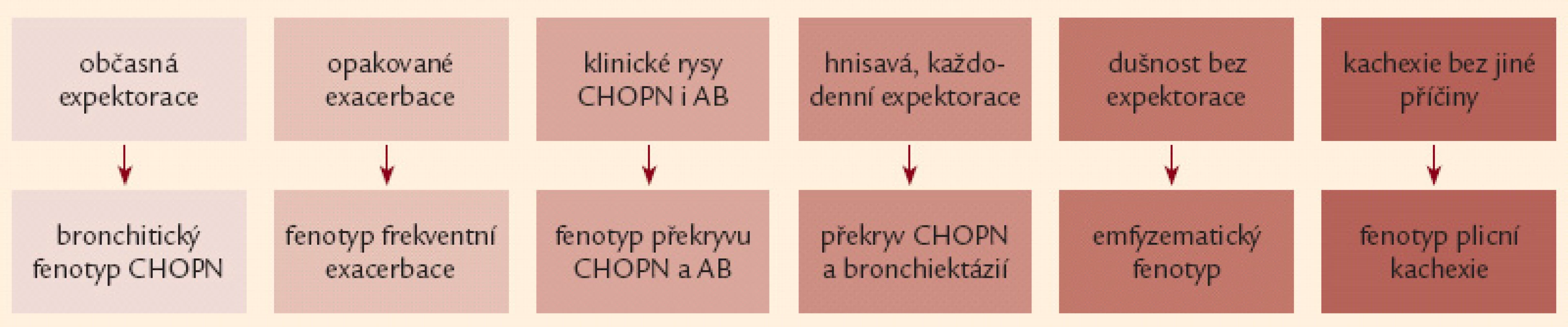
Image 2. Časté a klinicky významné komorbidity nemocných s chronickou obstrukční plicní nemocí. 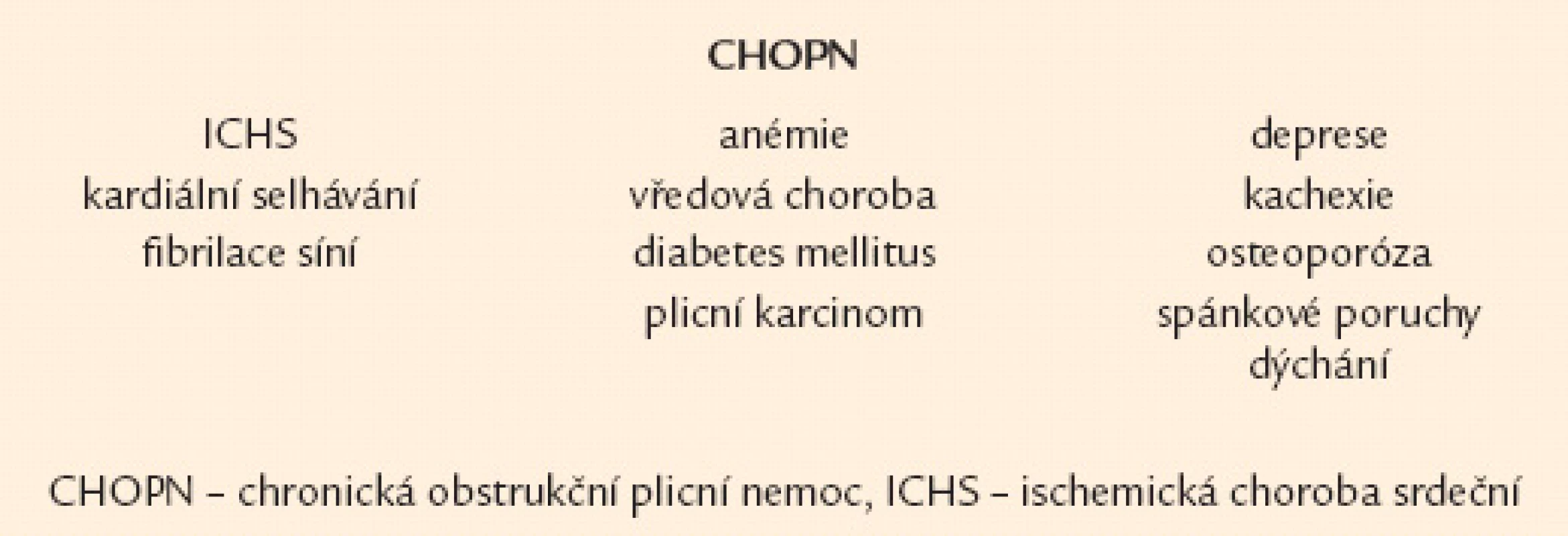
Diagnostika CHOPN
Základem moderního přístupu k CHOPN je pohled na pacienta pomocí sledování plicních funkcí, symptomů, výskytu akutních exacerbací a klinického fenotypu. Správnost diagnózy je třeba ověřit pomocí funkčního vyšetření plic, kdy je k průkazu přítomnosti bronchiální obstrukce nezbytné provést spirometrické vyšetření po podání inhalačních bronchodilatancií (salbutamol nebo ipratropium). Spirometrické vyšetření je doporučováno u všech symptomatických jedinců, zvláště u osob v dlouhodobém inhalačním riziku, případně subjektů s pozitivní rodinnou anamnézou [7]. Základním funkčním kritériem CHOPN je přítomnost limitace výdechového proudění vzduchu. Tato expirační limitace je definována doporučeními Evropské respirační společnosti jako FEV1/ VCmax pod dolní limit normálních hodnot (LLN) [14,35].
Klasifikace
Vzhledem ke komplexní povaze CHOPN je kromě zjištění hodnoty post‑BDT FEV1 doporučováno systematické sledování symptomů (pomocí škály CAT nebo dušnosti dle modifikovaného MRC skóre – tab. 1) a výskytu akutních exacerbací (AE) [36]. Pomocí těchto parametrů lze snadno každého nemocného zařadit do 1 ze 4 kategorií označených písmeny A, B, C a D – obr. 3. Kategorie A se vyskytuje zejména v počátečních fázích onemocnění a může být dobře sledována praktickými lékaři. Obzvláště velkou pozornost je třeba věnovat kategorii B – osoby s méně výrazným poklesem plicních funkční, avšak s výrazným mortalitním rizikem (hlavně díky kardiovaskulárním a maligním příčinám) – a zejména kategorii D. Subjekty z posledně jmenované kategorie CHOPN jsou extrémně ohroženy vysokou respirační a kardiovaskulární morbiditou a mortalitou, jejich sledování a terapie musí být po všech stránkách maximální. Pacienty v kategorii C můžeme zachytit zejména v běžné neselektované populaci, naopak mezi symptomatickými pacienty ve specializované péči pneumologa se s touto kategorií téměř nesetkáváme [37 – 39].
Table 1. Popis dušnosti dle mMRC (volně dle Fletchera 1952 a [11]). ![Popis dušnosti dle mMRC (volně dle Fletchera 1952 a [11]).](https://www.prolekare.cz/media/cache/resolve/media_object_image_small/media/image/cf90282f26fee81d53ea468cdb2a8d4d.png)
Image 3. Klasifikace CHOPN dle Doporučení ČPFS [8]. Kategorie CHOPN převzaty s korekcí* z aktuální verze GOLD (2013) [8] – při nesouladu kritérií na stejné ose (např. na ose y – při těžké obstrukci a nulových exacerbacích) vždy rozhoduje horší kritérium (tzn. v našem případě těžká bronchiální obstrukce). Specialista bude klasifi kace CHOPN používat v následujícím tvaru: tíže obstrukce dle post-BDT FEV<sub>1</sub> (1–4)/celková kategorie onemocnění (A–D). V praxi např. 2/D, resp. 4/D. post-BDT FEV<sub>1</sub> – hodnota usilovně vydechnutého objemu za 1. s po inhalaci bronchodilatačního léku (salbutamolu nebo ipratropia), CAT – test ohodnocení CHOPN, CHOPN – chronická obstrukční plicní nemoc, GOLD – Světová strategie diagnostiky, léčby a prevence CHOPN, mMRC – modifi kovaná škála dušnosti dle Medical Research Council ![Klasifikace CHOPN dle Doporučení ČPFS [8].
Kategorie CHOPN převzaty s korekcí* z aktuální verze GOLD (2013) [8] – při nesouladu kritérií na stejné ose (např. na ose y – při těžké obstrukci a nulových exacerbacích) vždy rozhoduje horší kritérium (tzn. v našem případě těžká bronchiální obstrukce). Specialista bude klasifi kace CHOPN používat v následujícím tvaru: tíže obstrukce dle post-BDT FEV<sub>1</sub> (1–4)/celková kategorie onemocnění (A–D). V praxi např. 2/D, resp. 4/D.
post-BDT FEV<sub>1</sub> – hodnota usilovně vydechnutého objemu za 1. s po inhalaci bronchodilatačního léku (salbutamolu nebo ipratropia), CAT – test ohodnocení CHOPN, CHOPN – chronická obstrukční plicní nemoc, GOLD – Světová strategie diagnostiky, léčby a prevence CHOPN, mMRC – modifi kovaná škála dušnosti dle Medical Research Council](https://www.prolekare.cz/media/cache/resolve/media_object_image_small/media/image/ba0c983b5807a433f300a6277b1a65bf.jpg)
Popis onemocnění
Iniciálně je doporučeno popsat každý konkrétní případ CHOPN jako stupeň bronchiální obstrukce (1. – 4. stupeň dle post‑BDT FEV1) a kategorii (A – D) onemocnění (obr. 3). Do jednotlivých kategorií by měli být nemocní zařazováni pouze ve stabilní fázi onemocnění. Syndrom CHOPN zahrnuje různé klinické formy neboli fenotypy [36]. Každý z fenotypů nabízí specifické léčebné možnosti. Kromě základní klasifikace CHOPN je proto vhodné, zejména pro osoby s kategoriemi B a D, pátrat po fenotypu konkrétního pacienta a po přítomnosti respirační insuficience, zjistit rizikové faktory a všechny relevantní komorbidity – obr. 2 a 4 [30]. Za terminálního lze považovat pacienta trpícího CHOPN ve chvíli, kdy do konce předpokládané délky jeho života zbývá 6 měsíců, a to za splnění dalších předpokladů: klidová dušnost špatně odpovídající na farmakoterapii vedoucí k dennímu režimu postel + křeslo, postupná klinická progrese onemocnění a přítomnost hypoxemie. Závěrečnou fázi terminálního CHOPN pak nazýváme end‑of‑life neboli poslední týdny, dny, hodiny života – obr. 5 [33,34].
Image 4. Kritéria pro detailní rozlišení mezi jednotlivými fenotypy chronické obstrukční plicní nemoci. 
Image 5. Schéma ukazující vztah respirační nedostatečnosti, terminální fáze chronické obstrukční nemoci a „end-stage“ CHOPN. Rychlost progrese je interindividuálně rozdílná. Někteří nemocní se nikdy nedostanou do terminální (resp. „end stage“ fáze CHOPN) – pacient A. Na druhou stranu existují pacienti s rychlým rozvojem terminálního onemocnění – pacient B. 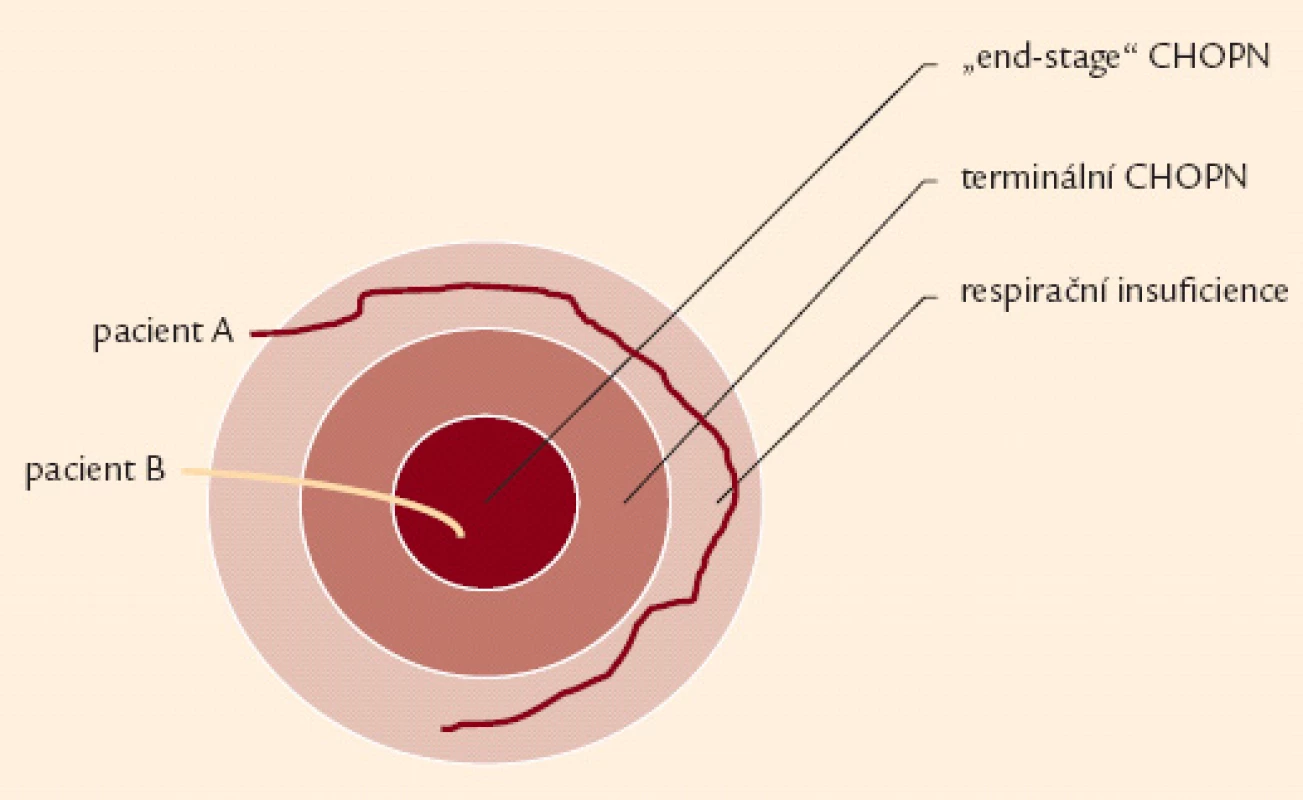
Strategie léčby CHOPN
Základem terapie a podmínkou jejího úspěchu je eliminace vyvolávajících inhalačních rizik. Komplexní léčebná intervence u nemocných s CHOPN využívá celé řady farmakologických a nefarmakologických postupů. Léčba nemocných s CHOPN se obecně řídí kategorií (A–D) a fenotypem (fenotypy) onemocnění s přihlédnutím k (ne)přítomnosti respirační nedostatečnosti. Léčebná doporučení lze rozdělit do 4 kroků (obr. 6).
Image 6. Čtyřstupňové schéma terapie CHOPN – základní verze. Poznámka: 1. krok a 2. krok je určen všem nemocným se symptomy, může je indikovat i praktický lékař. Naopak 3. a 4. krok jsou vázány na detailní znalosti laboratorních, funkčních a zobrazovacích vyšetření plic a měly by být v rukou specialistů (pneumologů). 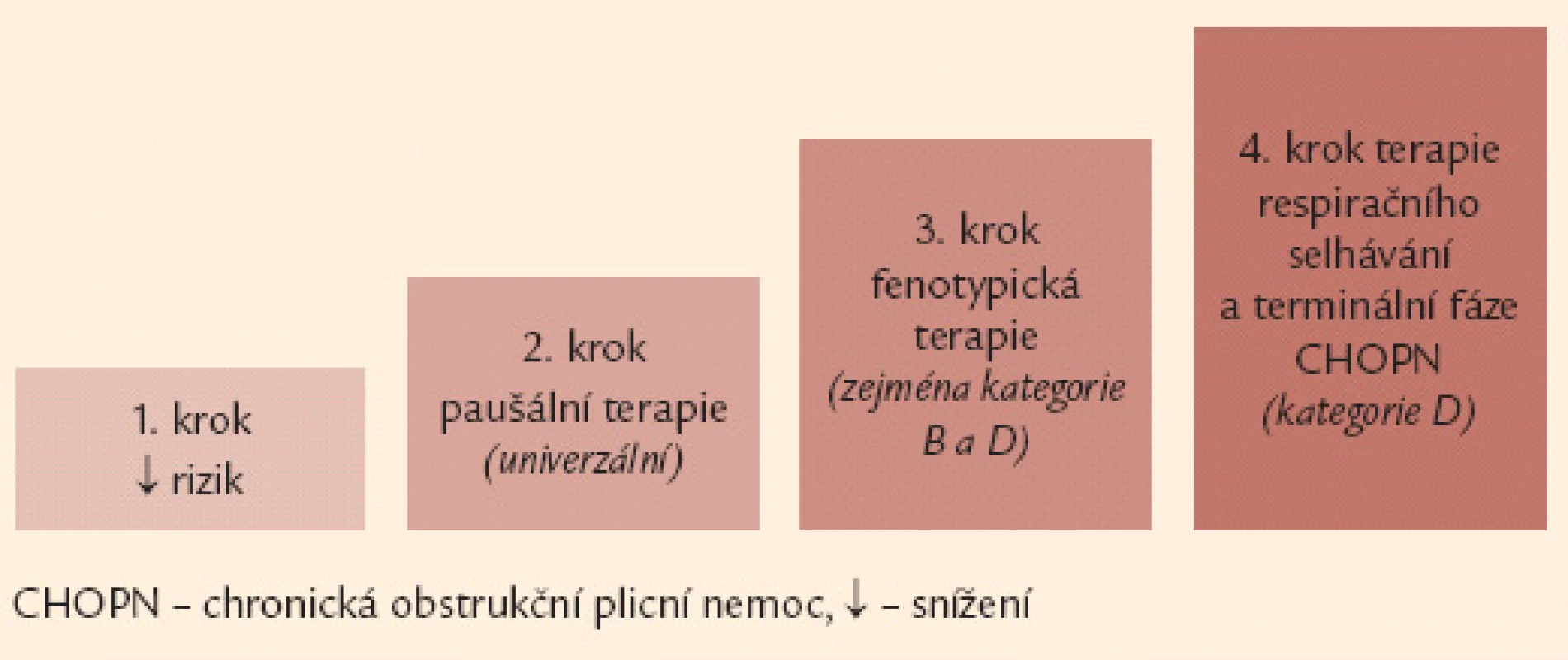
Eliminace rizik – krok 1
Ukončení rizikové expozice (např. kouření cigaret) přináší největší naději na příznivé ovlivnění přirozeně nepříznivého vývoje CHOPN [10,11,40,41]. Na druhou stranu bylo prokázáno, že pokračování v rizikové expozici významně urychluje vývoj nemoci, a to nezávisle na její vstupní tíži [41,42]. Víme, že protikuřácké intervence mají svůj význam i u nemocných s těžkými formami CHOPN – obr. 7 [40].
Image 7. Čtyřstupňové schéma terapie CHOPN – rozšířená verze. ATB – antibiotika, BVR – bronchoskopická volum-redukce, DDOT – dlouhodobá domácí oxygenoterapie, LuTx – plicní transplantace, LVRS – chirurgická volum-redukce, NIV – neinvazivní ventilační podpora, RHB – plicní rehabilitace 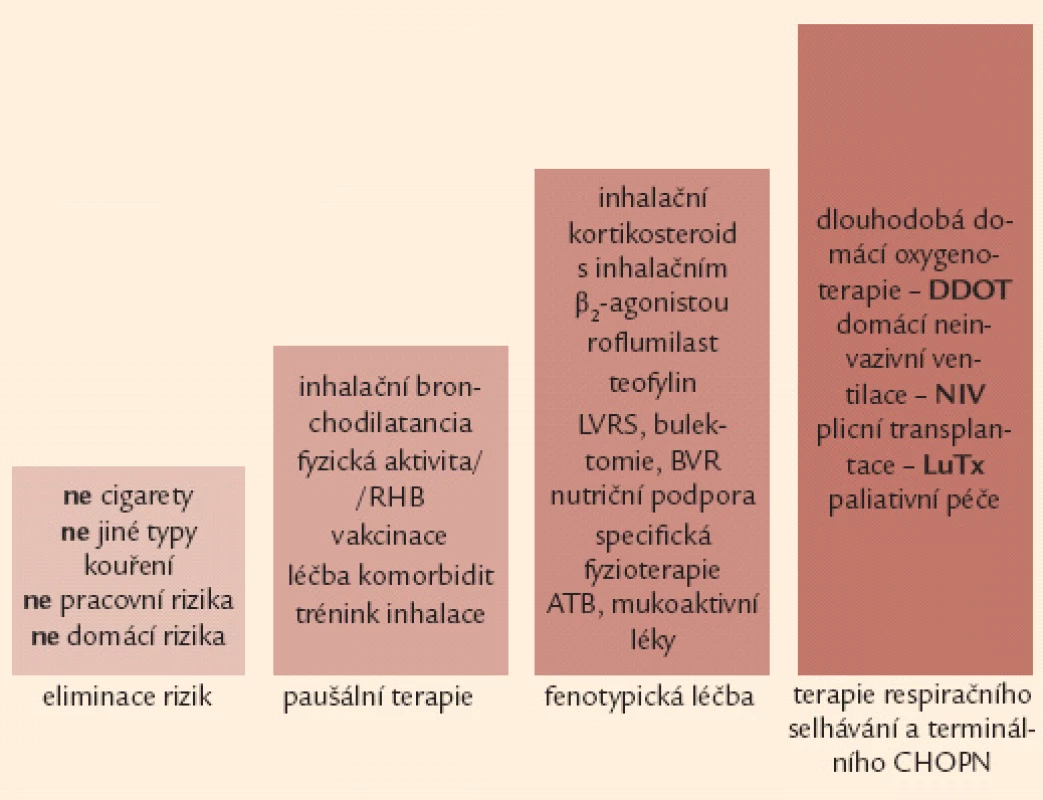
Paušální léčba – krok 2
Paušální léčba je léčba indikovaná pro všechny nemocné bez rozdílu fenotypu. Zahrnuje farmakologické (převážně inhalační medikace + očkování) i nefarmakologické (pohybová aktivita, pulmonální rehabilitace, edukace a trénink inhalačních technik) postupy (obr. 6 a 7). Nedílnou součástí paušální léčby jsou farmakologické intervence zaměřené na klinicky důležité komorbidity (obr. 2).
Paušální farmakologická léčba
Základem farmakologické paušální léčby stabilní CHOPN jsou inhalační bronchodilatancia vedoucí k symptomatické úlevě zaměřené proti pocitu dušnosti, omezené toleranci zátěže a zhoršené kvalitě života. Většina těchto léků redukuje výskyt akutních exacerbací. Příznivé ovlivnění deklinace funkce plic, zástava progrese onemocnění a prodloužení života zatím nebylo u těchto léků nezpochybnitelně prokázáno, i když je velmi pravděpodobné [10,43 – 45]. U všech CHOPN pacientů je nezbytná opakovaná a kontrola správnosti inhalační techniky, u více než 50 % z nich je totiž inhalace chybná a málo efektivní [46]. Kombinace obou typů (β2 - agonisté a inhalační anticholinergika) bronchodilatancií (ve formě dlouhodobě či krátkodobě působících preparátů) přináší výraznější benefit než prosté zvyšování dávek jednoho typu léku [47 – 49]. Krátkodobě působící inhalační medikace je určena jako úlevová léčba, případně hlavní medikace u oligosymptomatických (kategorie A) osob bez rizika exacerbací. K udržovací léčbě je nutné používání inhalačních dlouhodobě působících farmak, jako např. tiotropia, glykopyrronia, aklidinia, indakaterolu, salmeterolu či formoterolu [43,44,50 – 59]. Další komponentou paušální léčby je vakcinace. Jako nepostradatelné se jeví očkování všech nemocných s CHOPN proti chřipce – každý rok od září do prosince před pravidelným nástupem celoevropské epidemie. Existují i doporučení (méně ověřená) pro očkování pneumokokovou vakcínou (1krát za 5 – 10 let) a proti černému kašli (u osob v kontaktu s dětmi) [60,61].
Paušální nefarmakologická léčba
Základním kamenem paušální nefarmakologické terapie je pulmonální rehabilitace, jejíž součástí je edukace, léčebná rehabilitace, ergoterapie (zejména nácvik běžných aktivit denního života), nutriční a psychosociální pomoc [10,11,62]. Léčebná rehabilitace zahrnuje pravidelnou pohybovou aktivitu a techniky respirační fyzioterapie. Pro méně závažné případy představuje alternativu sofistikovaného rehabilitačního programu pravidelná fyzická aktivita (obecně 45 – 60 min aerobní zátěže/ obden). Techniky respirační fyzioterapie jsou zaměřené na reedukaci dechového stereotypu, zvýšení rozvíjení hrudníku, usnadnění expektorace, zahrnují cílené cvičení respiračních svalů a posilovací trénink horních i dolních končetin. Komplexní pulmonální rehabilitace bude řešena samostatným národním doporučeným postupem ČPFS.
Kromě terapie samotné CHOPN musíme u všech pacientů myslet na efektivní léčebnou intervenci relevantních komorbidit, která se v podstatě neliší (včetně využívání β‑blokátorů) od léčby těchto chorob u osob bez přítomnosti CHOPN (obr. 2) [8].
Fenotypicky cílená léčba – krok 3
U pacientů s již vyhraněným fenotypem CHOPN bychom měli kromě paušální medikace systematicky zvážit reálné možnosti fenotypicky zaměřené terapie. Jedná se většinou o nemocné v kategoriích B a D. Fenotypy se u jednoho pacienta mohou různě kombinovat (např. kachexie a plicní emfyzém, resp. chronická bronchitida a časté exacerbace), případně vyvíjet v čase. Na druhou stranu se, zejména v počátečních fázích CHOPN, setkáváme s nemocnými bez jasně vyhraněného fenotypu (zejména v kategorii A) – u těchto osob naše léčebné působení bude obsahovat jen eliminaci rizik a paušální léčbu.
Pro nemocné s frekvenčním výskytem akutních exacerbací (bezpodmínečně při post‑BDT FEV1 60 % n.h., pravděpodobně efektivní i u méně výrazné obstrukce) je vhodné do léčby zahrnout inhalační kombinační léčbu dlouhodobým β2 - agonistou s inhalačním kortikosteroidem (LABA + IKS) [9,26,44,45,63].
Druhým fenotypem s prokazatelným přínosem kombinační léčby (LABA + IKS) je překryv CHOPN s bronchiálním astmatem – kombinace LABA + IKS je zde léčbou 1. volby. Léčebné doporučení pro tento klinický fenotyp pak jako další léčbu následně doporučuje inhalační „trojkombinaci“ IKS + LABA + LAMA (LAMA – dlouhodobě působící inhalační anticholinergikum). Následně může být farmakoterapie tohoto fenotypu doplněna i o perorálně podávané antileukotrieny (např. montelukast) [9,64 – 66].
U pacientů se současnou přítomností bronchitického fenotypu spolu s fenotypem frekventních exacerbací se v případě poklesu FEV1 pod 50 % n.h. ukazuje jako jasně benefitní perorální léčba roflumilastem – selektivním inhibitorem fosfodiesterázy 4. Roflumilast redukuje výskyt středních a těžkých exacerbací a současně (výhradně pomocí svého protizánětlivého působení) zlepšuje funkční parametry – zejména FEV1 [67,68].
Mladší (obvykle ≤ 50 let) nemocní trpící emfyzémovým fenotypem s FEV1 mezi 30 a 60 % náležitých hodnot a prokazatelně bez aktivního nikotinizmu s těžkou formou (sérová koncentrace 0,5 g/ l) deficitu proteinázového inhibitoru α1 antitrypsinu podmíněnou homozygotní mutací Pi*ZZ, případně Pi*null (odhadem 1 % evropských nemocných s CHOPN), by měli být léčeni pravidelnou (intravenózně) substituční léčbou a1 antitrypsinem [69,70].
Terapie emfyzematických nemocných s přítomností velkých bul (zejména pokud souhrnný rozsah bulózního postižení dosahuje 1/ 3 objemu postiženého hemitoraxu a případně se chová expanzivně a vede ke zhoršování symptomů) je možná pomocí provedení resekce těchto bul – tzv. bulektomie [71,72].
Pacienti s heterogenním typem plicního emfyzému postihujícího apikální partie plic a s preferenčně nízkou tolerancí zátěže mohou být indikováni k provedení tzv. plicní volum ‑ redukující operace (LVRS), a to zejména v přítomnosti plicní hyperinflace RV 150 – 200 % n.h., těžkých symptomů dušnosti (mMRC 3 – 4) a nízké tolerance zátěže [72 – 74]. Pacientům s dominující heterogenní formou plicního emfyzému, kteří nejsou schopni a/ nebo ochotni podstoupit výše zmíněné chirurgické (LRVS) metody léčby existuje alternativa v podobě bronchoskopické volum-redukce – tzv. BVR [75,76].
U nemocných s fenotypem plicní kachexie je indikována nutriční podpora v kombinaci s rehabilitační péčí (zejména silový trénink). Typ a složení nutriční podpory je nutričním specialistou spočítáno na základě zhodnocení energetických potřeb pacienta, reziduálního perorálního příjmu a možnosti perorálního nebo enterálního podání výživy. Parenterální výživa je vyhrazena pro pacienty s intolerancí nazogastrické nebo nazojejunální sondy a nemožností přijímat sipping [77,78].
Terapie antibiotiky (ATB) může přinášet pozitivní efekt u 3 fenotypů: u nemocných s nadměrnou produkcí hlenu – bronchitický fenotyp, u osob s častými exacerbacemi a také u fenotypu CHOPN s bronchiektáziemi. Doporučovány jsou makrolidy – azitromycin či klaritromycin – a respirační chinolony – moxifloxacin [79 – 87].
Dlouhodobou aplikaci mukoaktivní medikace lze zvážit zejména pro symptomatické osoby s bronchitickým fenotypem a fenotypem překryvu CHOPN a bronchiektázií. Sumarizující doporučení týkající se fenotypicky cílené léčby CHOPN uvádí obr. 8 [88,89].
Image 8. Souhrnná léčebná doporučení pro jednotlivé vyhraněné fenotypy CHOPN. A1AT – α-1 antitrypsin, AB – bronchiální astma, ATB – antibio tika, BVR – bronchoskopická volumredukce, IKS – inhalační kortikosteroidy, LABA – inhalační β<sub>2</sub>- agonisté s dlouhodobým účinkem, LAMA – inhalační anticholinergika s dlouhodobým účinkem, LVRS – plicní volum redukující operace, NAC – N- acetylcystein, PDE4 – fosfodiesteráza 4, NaCl – natrium chloratum 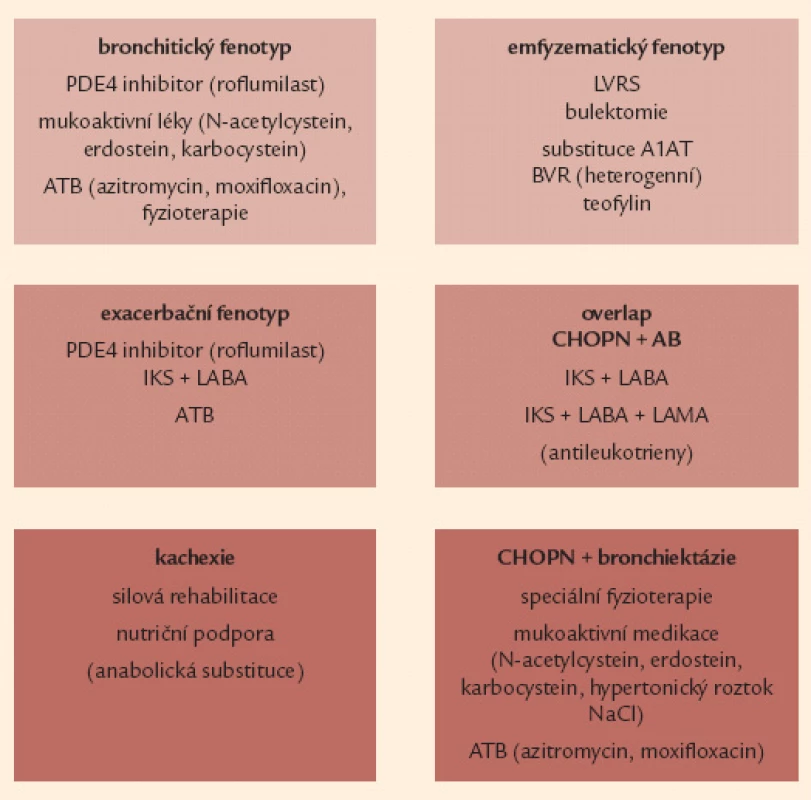
Léčba respirační nedostatečnosti a péče o terminální CHOPN – krok 4
V rámci moderní personalizované medicíny disponujeme řadou efektivních léčebných intervencí cílených na pacienty s chronickou hypoxemií, případně hypoxemií + hyperkapnií (kyslíková léčba, domácí neinvazivní ventilační podpora, plicní transplantace). Specifické terapeutické návody existují i pro případ další progrese onemocnění do terminální fáze CHOPN – metody paliativní péče (obr. 7).
Kyslíková terapie osob s CHOPN se řídí tíží onemocnění a má zhruba 3 hlavní indikace:
- A) Vůbec nejčastěji podáváme kyslík nemocným jako domácí dlouhodobou (≥ 16 hod/ den) kyslíkovou léčbu (neboli DDOT), a to u osob s chronickou respirační nedostatečností. Mezi hlavní indikační kritéria DDOT (kromě absence aktivního nikotinizmu, dobré spolupráce a maximální konzervativní léčby úměrné rozsahu a typu onemocnění) patří výsledky arteriálních krevních plynů: jasná indikace je při PaO2 pod 7,3 kPa při absenci progresivní hyperkapnie, další indikace pak případně při PaO2 7,3 – 8,0 kPa, a to v přítomnosti jasných klinických, EKG nebo sonografických známek plicní hypertenze, polyglobulie, výrazných nočních desaturací souvisejících s CHOPN či těžké přinámahové desaturace a opět při absenci, kyslíkovou substitucí vyvolané, progresivní hyperkapnie. Téma DDOT je v ČR zpracováno ve formě samostatného národního doporučení [90].
- B) Kyslíková léčba během pulmonální rehabilitace. Zde byl prokázán benefit na redukci dynamické plicní hyperinflace vedoucí ke zlepšení výkonu během rehabilitace, což se odráží ve větším přínosu aerobního tréninku na symptomy a kvalitu života [91].
- C) Kyslíková substituční léčba osob cestujících v letadle je poslední indikací léčebného použití kyslíku u osob se stabilní fází CHOPN. O kyslíkové léčbě uvažujeme u všech osob s klidovou SpO2< 92 % nebo s SpO2 < 84 % při 6minutovém testu chůzí [92].
Použití dlouhodobé domácí neinvazivní ventilační podpory (NIV) je metodou volby u pacientů se stabilní CHOPN s chronickým hyperkapnickým respiračním selháváním, tedy nejčastěji u pacientů kategorie 4/ D. Použití vysokých inspiračních tlaků, tzv. high‑intensity NIV (HI ‑ NIV), prokázalo klinický benefit. HI ‑ NIV je nastavena pacientům během několikadenního pobytu v nemocnici ve stabilní fázi CHOPN. Cílem léčby HI ‑ NIV je dosáhnout adekvátní alveolární ventilace použitím vysokých inspiračních tlaků (vrcholový inspirační tlak 25 – 30 cm H2O) a mandatorní dechovou frekvencí rovnající se spontánní dechové frekvenci pacienta (u nemocných s CHOPN okolo 20 – 25 dechů/ min). HI ‑ NIV prokazatelně u pacientů s CHOPN zlepšuje parciální tlak oxidu uhličitého v arteriální krvi, snižuje pokles plicních funkcí, zlepšuje schopnost cvičební kapacity a kvalitu života a snižuje četnost hospitalizací pro exacerbaci hyperkapického respiračního selhávání [93 – 95].
Transplantace plic je indikována pro pacienty s vysokým BODE skóre (tab. 2). Nemocné s BODE 5 začínáme sledovat a k transplantačnímu výkonu indikujeme pacienty s BODE 7 – 10, pokud současně splňují jeden a více z následujících bodů: FEV1 20 % n.h.a/ nebo TLCO 20 % n.h., homogenní typ emfyzému, anamnézu závažné akutní exacerbace s hyperkapnií (s PaCO2 ≥ 6,6 kPa) a plicní hypertenzi s plicním srdcem [71,72].
Table 2. Klasický BODE index [16]. ![Klasický BODE index [16].](https://www.prolekare.cz/media/cache/resolve/media_object_image_small/media/image/97666d391a432dd1848ee53187c8df47.png)
Léčba terminální fáze CHOPN
Preterminální/ terminální fáze CHOPN bývá spojena s opakovanými atakami akutního zhoršování chronické respirační nedostatečnosti, se selháváním pravého srdce, s plicní infekcí a s dekompenzací řady závažných interních komorbidit. Nemocné s terminálním CHOPN lze identifikovat podobně jako nemocné odeslané k transplantaci (BODE 7 – 10). Jedná se tedy o podobné pacienty – hlavní rozdíl spočívá v přítomnosti kontraindikací plicní transplantace ve skupině osob indikovaných „jen“ k paliativní terapii. Tyto situace často vedou k okamžiku, kdy je nutné stanovit individuální limity další péče. Stanovení limitů se provádí po konsenzuální domluvě všech zdravotníků pečujících o daného nemocného s následným souhlasem rodiny a případně (je‑li toho objektivně schopen) i se souhlasem pacienta. Limity péče jsou celosvětově označovány jako:
- A) DNR/ DNI – neboli neresuscitovat a/ nebo neintubovat,
- B) NIVmax – neinvazivní ventilace stanovena jako maximální strop ventilační podpory,
- C) nerozšiřování a zastavení současně podávané péče – jde o nerozšiřování medikace a dalších stávajících léčebných postupů (např. nepodání další transfuze, nepodávání další katecholaminové podpory, nezajištění eliminačních metod, absence další nutriční podpory, neprovádění chirurgických intervencí) a
- D) deeskalace neboli odnětí současně podávané péče – pokles FiO2 na 21 %, zastavení katecholaminové podpory, odstranění nutriční podpory, vypnutí ventilátoru.
Důležitou součástí péče o terminální stadia CHOPN je v dokumentaci jasně zdůvodněné podávání opiátů v orální, transdermální či parenterální formě. Hlavní indikace opiátů u nemocných s CHOPN představuje: sedace, útlum bolesti (např. z kompresivních fraktur páteře) a inhibice pocitu těžké dušnosti. V této fázi onemocnění je doporučováno rovněž podávání benzodiazepinů. Léčba nezvladatelné dušnosti může být podpořena inhalační léčbou furosemidem a dalšími nefarmakologickými postupy – např. ochlazováním obličeje.
Závěr
Optimální léčba nemocných s CHOPN vyžaduje individualizovaný a multidisciplinární přístup zaměřený na symptomy, potřeby a přání pacienta. Musí zohledňovat osobní, sociální a kulturní faktory (tzv. personalizovaná medicína). Měla by pokrývat všechny aspekty a systémové dopady tohoto multiorgánového syndromu. K jejímu naplnění je třeba do integrovaného systému péče zahrnout kromě pacienta nejen ošetřujícího pneumologa či zdravotnická zařízení, ale i rodinu nemocného, jeho praktického lékaře, fyzioterapeuta, psychologa a nutricionistu. Hlavními složkami terapie jsou eliminace rizikových faktorů, paušální terapie zaměřená na redukci symptomů a dopadů onemocnění spolu s intervencí klinicky relevantních komorbidit a cílená fenotypická léčba s případnou terapií respiračního selhávání. Nezbytným předpokladem je partnerský vztah pacienta a lékaře a nikdy nekončící edukace a trénink. Pokud onemocnění dospěje do terminální fáze, je na místě ještě více prohloubit partnerský vztah a včas rozhodnout o limitech další péče.
MU Dr. Vladimír Koblížek, Ph.D.
www.fnhk.cz
e‑mail: vladimir.koblizek@fnhk.cz
Doručeno do redakce: 7. 5. 2013
Sources
1. Atsou K, Chouaid C, Hejblum G. Variability of the chronic obstructive pulmonary disease key epidemilogical data in Europe: systematic review. BMC Med 2011; 9 : 7.
2. Pauwels RA, Rabe KF. Burden and clinical features of chronic obstructive pulmonary disease (COPD). Lancet 2004; 364 : 613 – 620.
3. Lamprecht B, Mahringer A, Soriano JB et al. Is spirometry properly used to diagnose COPD? Results from the BOLD study in Salzburg, Austria: a population‑based analytical study. Prim Care Respir J 2013; 22 : 195 – 200.
4. Malý M, Zvolský M, Rozborilová E et al. Respiratory Mortality in Czech and Slovak Republics in the year 2011. Stud Pneumol Phtiseol 2013; 79. In press.
5. Vondra V. Úmrtnost na CHOPN v letech 1996 – 2005 se zdvojnásobila. Stud Pneumol Phtiseol 2007; 73 : 75.
6. Institute of Medical Information Services. Tuberculosis and respiratory diseases 2011. 2012 Nov [cited 2013 Mar 2]. Available from: http:/ / www.uzis.cz/ katalog/ zdravotnicka ‑ statistika/ tuberkuloza ‑ respiracni ‑ nemoci.
7. Qaseem A, Wilt TJ, Weinberger SE et al. Diagnosis and management of stable chronic obstructive pulmonary disease: a clinical practice guideline update for the ACP, ACCP, ATS and ERS. Ann Intern Med 2011; 155 : 179 – 191.
8. Global Initiative for Chronic Obstructive Lung Disease. Global Strategy for the Diagnosis, Management, and Prevention of Chronic Obstructive Pulmonary Disease. Updated 2013. 2013 Feb [cited 2013 Mar 2]. Available from: http:/ / www.goldcopd.org/ uploads/ users/ /files/ GOLD_Report_2013_Feb20.pdf.
9. Miravitlles M, Soler ‑ Cataluña JJ, Calle M et al. Spanish COPD Guidelines (GesEPOC): pharmacological treatment of stable COPD. Spanish Society of Pulmonology and Thoracic Surgery. Arch Bronconeumol 2012; 48 : 247 – 257.
10. National Institute for Health and Care Excellence. Chronic obstructive pulmonary disease (updated) Clinical guidelines CG101. 2013 Mar [cited 2013 Apr 2]. Available from: http:/ / www.nice.org.uk/ CG101.
11. Celli BR. Update on the management of COPD. Chest 2008; 133 : 1451 – 1462.
12. Česká pneumologická a ftizeologická společnost. Doporučený postup pro diagnostiku a léčbu CHOPN. 2013 Feb [cited 2013 May 4]. Available from: http:/ / www.pneumologie.cz/ aktualne/ doc/ Standard%20verze%2021.1.pdf.
13. Hooper R, Burney P, Vollmer WM et al. Risk factors for COPD spirometrically defined from the lower limit of normal in the BOLD project. Eur Respir J 2012; 39 : 1343 – 1353.
14. Lamprecht B, McBurnie MA, Vollmer WM et al. COPD in never smokers: results from the population‑based burden of obstructive lung disease study. Chest 2011; 139 : 752 – 763.
15. Cho MH, Castaldi PJ, Wan ES et al. A genome ‑ wide association study of COPD identifies a susceptibility locus on chromosome 19q13. Hum Mol Genet 2012; 21 : 947 – 957.
16. Celli BR, Cote CG, Marin JM et al. The body‑mass index, airflow obstruction, dyspnea and exercise capacity index in chronic obstructive pulmonary disease. N Engl J Med 2004; 350 : 1005 – 1012.
17. O’Donnell DE, Flüge T, Gerken F et al. Effects of tiotropium on lung hyperinflation, dyspnoea and exercise tolerance in COPD. Eur Respir J 2004; 23 : 832 – 840.
18. Stridsman C, Lindberg A, Skär L. Fatigue in chronic obstructive pulmonary disease: a qualitative study of people’s experiences. Scand J Caring Sci 2013. In press.
19. Koblizek V, Tomsova M, Cermakova E et al. Impairment of nasal mucociliary clearance in former smokers with stable chronic obstructive pulmonary disease relates to the presence of a chronic bronchitis phenotype. Rhinology 2011; 49 : 397 – 406.
20. Bakke PS, Ronmark E, Eagan T et al. Recommendations for epidemiological studies on COPD. Eur Respir J 2011; 38 : 1261 – 1277.
21. Miravitlles M, Calle M, Soler ‑ Cataluña JJ. Clinical phenotypes of COPD. Identification, definition and implications for quidelines. Arch Bronconeumol 2012; 48 : 86 – 98.
22. Floto RA, Haworth CS. Bronchiectasis. European Respiratory Monograph. Sheffield: European Respiratory Society 2011.
23. Pasteur MC, Bilton D, Hill AT et al. British Thoracic Society guideline for non‑CF bronchiectasis. Thorax 2010; 65 (Suppl 1): i1 – i59.
24. Aaron SD, Donaldson GC, Whitmore GA et al. Time course and pattern of COPD exacerbation onset. Thorax 2012; 67 : 238 – 243.
25. George C, Zermansky W, Hurst JR. Frequent exacerbations in chronic obstructive pulmonary disease. BMJ 2011; 342: d1434.
26. Hurst JR. Exacerbation phenotyping in chronic obstructive pulmonary disease. Am J Respir Crit Care Med 2011; 184 : 625 – 626.
27. Sanchez FF, Faganello MM, Tanni SE et al. Anthropometric midarm measurements can detect systemic fat‑free mass depletion in patients with chronic obstructive pulmonary disease. Braz J Med Biol Res 2011; 44 : 453 – 459.
28. Schleich FN, Seidel L, Sele J et al. Exhaled nitric oxide tresholds associated with a sputum eosinophil count ≥ 3% in a cohort of unselected patients with asthma. Thorax 2010; 65 : 1039 – 1044.
29. Izquierdo ‑ Alonso JL, Rodriguez ‑ Gonzálezmoro JM, de Lucas ‑ Ramos P et al. Prevalence and characteristics of three clinical phenotypes of chronic obstructive pulmonary disease (COPD). Respir Med 2013; 107 : 724 – 731.
30. Vanfleteren LE, Spruit MA, Groenen M et al.Clusters of comorbidities based on validated objective measurements and systemic inflammation in patients with chronic obstructive pulmonary disease. Am J Respir Crit Care Med 2013; 187 : 728 – 735.
31. Clarenbach CF, Thurnheer R, Kohler M et al. Vascular dysfunction in chronic obstructive pulmonary disease: current evidence and perspectives. Expert Rev Respir Med 2012; 6 : 37 – 43.
32. Sode B, Dahl M, Nordestgaar BG. Myocardial infarction and other co ‑ morbidities in patients with chronic obstructive pulmonary disease: a Danish nationwide study of 7.4 million individuals. Eur Heart J 2011; 32 : 2365 – 2375.
33. Nava S, Sturani C, Hartl S et al. End‑of‑life decision – making in respiratory intermediate care units: a European survey. ERS TASK FORCE. Eur Respir J 2007; 30 : 156 – 164.
34. Lanken PN, Terry PB, DeLisser HM et al. An official American Thoracic Society clinical policy statement: palliative care for patients with respiratory diseases and critical illnesses. Am J Respir Crit Care Med 2008; 177 : 912 – 927.
35. Pellegrino R, Viegi G, Brusasco V et al. Interpretative strategies for lung function tests. Eur Respir J 2005; 26 : 948 – 968.
36. Gonem S, Raj V, Wardlaw J et al. Phenotyping airways disease: an A to E approach. Clin Exper Allergy 2012; 42 : 1664 – 1683.
37. Jones P, Adamek L, Nadeau G et al. Comparisons of health status scores with MRC grades in a primary care COPD population: implications for the new GOLD 2011 classification. Eur Respir J 2012. In press.
38. Han M, Dransfield M, Curran ‑ Everett D et al. Characteristics of GOLD 2011 grading system in the COPDGene cohort. In: European Respiratory Society Annual Congress Vienna 2012 1 – 5 Sep. Eur Respir J 2012; 40 (Suppl 56): 1646.
39. Lange P, Marott JL, Vestbo J et al. Prediction of the clinical course of chronic obstructive pulmonary disease, using the new GOLD classification: a study of the general population. Am J Respir Crit Care Med 2012; 186 : 975 – 981.
40. Anthoniesen NR, Skeans MA, Wise RA et al. The effects of a smoking cessation intervention on 14.5‑year mortality: a randomized clinical trial. Ann Intern Med 2005; 142 : 233 – 239.
41. Lee PN, Fry JS. Systematic review of the evidence relating FEV1 decline to giving up smoking. BMC Med 2010; 8 : 84.
42. Vestbo J, Edwards LD, Scanlon PD et al. Changes in forced expiratory volume in 1 second over time in COPD. N Engl J Med 2011; 365 : 1184 – 1192.
43. Decramer M, Celli BR, Kesten S et al. Effect of tiotropium on outcomes in patients with moderate chronic obstructive pulmonary disease (UPLIFT) a prespecified subgroup analysis of a randomised controlled trial. Lancet 2009; 374 : 1171 – 1178.
44. Celli BR, Thomas NE, Anderson JA et al. Effect of pharmacotherapy on the rate of decline of lung function in chronic obstructive pulmonary disease: results from the TORCH study. Am J Respir Crit Care Med 2008; 178 : 332 – 338.
45. Jenkins CR, Jones PW, Calverley PM et al. Efficacy of salmeterol/ fluticasone propionate by GOLD stage of chronic obstructive pulmonary disease: analysis from the randomised, placebo ‑ controlled TORCH study. Respir Res 2009; 10 : 59.
46. Laube BL, Janssens HM, Jongh FH et al. What the pulmonary specialist should know about the new inhalation therapies. Eur Respir J2011; 37 : 1308 – 1331.
47. Mahler DA, D’Urzo A, Bateman ED et al. Concurrent use of indacaterol plus tiotropium in patients with COPD provides superior bronchodilatation compared with tiotropium alone: a randomised, double‑blind comparison. Thorax 2012; 67 : 781 – 788.
48. Tashkin DP, Fabbri LM. Long‑acting beta‑agonist in the management of chronic obstructive pulmonary disease: current and future agents. Respir Res 2010; 11 : 149.
49. Wedzicha JA, Decramer M, Ficker JH et al. Analysis of chronic obstructive pulmonary disease exacerbations with the dual bronchodilator QVA149 compared with glycopyrronium and tiotropium (SPARK): a randomised, double‑blind, parallel ‑ group study. Lancet 2013. In press.
50. Vogelmeier C, Hederer B, Glaab T et al. Tiotropium versus salmeterol for the prevention of exacerbation of COPD. N Engl J Med 2011; 364 : 1093 – 1103.
51. Calverley PM, Anderson JA, Celli BR et al. Salmeterol and fluticasone propionate and survival in chronic obstructive pulmonary disease. N Engl J Med 2007; 356 : 775 – 789.
52. Donohue JF, Fogarty LM, Lotvall J et al. Once ‑ daily bronchodilators for chronic obstructive pulmonary disease: indacaterol versus tiotropium. Am J Respir Crit Care Med 2010; 182 : 155 – 162.
53. Kornmann O, Dahl R, Centanni S et al. Once ‑ daily indacaterol versus twice ‑ daily salmeterol for COPD: a placebo ‑ controlled comparison. Eur Respir J 2011; 37 : 273 – 279.
54. Welte T, Miravitlles M, Hernandez P et al. Efficacy and tolerability of budesonide/ formoterol addend to tiotropium in patients with chronic obstructive pulmonary disease. Am J Respir Crit Care Med 2009; 180 : 741 – 750.
55. Singh S, Loke YK, Enright PL et al. Mortality associated with tiotropium mist inhaler in patients with chronic obstructive pulmonary disease: systematic review and meta‑analysis of randomised controlled trials. BMJ 2011; 342: d3215.
56. Michele TM, Pinheiro S, Iyasu S. The safety of tiotropium the FDA’s conclusions. N Engl J Med 2010; 363 : 1097 – 1099.
57. Kesten S, Casaburi R, Kukafka D et al. Improvement in self ‑ reported exercise participation with combination of tiotropium and and rehabilitative exercise training in COPD patients. Int J Chron Obstr Pulmon Dis 2008; 3 : 127 – 136.
58. Calverley PM, Stockley RA, Seemungal TA et al. Reported pneumonia in patients with COPD: findings from the INSPIRE study. Chest 2011; 139 : 505 – 512.
59. Ferguson GT, Calverley PM, Anderson JA et al. Prevalence and progression of osteoporosis in patients with COPD: results from the TORCH study. Chest 2009; 136 : 1456 – 1465.
60. Centers for disease control and prevention. Prevention and control of seasonal influenza vaccines. Recommendations of the Advisory Committee on Immunization Practice (ACIP). MMWR Morb Mortal Wkly Rep 2009; 58 : 1 – 52.
61. Centers for disease control and prevention. Recommended adult immunization schedule. United States 2010. MMWR Morb Mortal Wkly Rep 2011; 60 : 1 – 4.
62. Hodgkin JE, Celli BR, Connors GL. Pulmonary rehabilitation. Guidelines to success. St. Louis, Missouri: Mosby Elsevier 2009.
63. Stone RA, Lowe D, Potter JM et al. Managing patients with COPD exacerbation: does age matter? Age Ageing 2012; 41 : 461 – 468.
64. Kerstjens H, Engel M, Dahl R et al. Tiotropium in asthma poorly controlled with standard combination therapy. N Engl J Med 2012; 367 : 1198 – 1207.
65. Thomsen M, Nordestgaard BG, Sethi AA et al. 2‑adrenergic receptor polymorphisms, asthma and COPD: two large population‑based studies. Eur Respir J 2012; 39 : 558 – 566.
66. Rossi A, Kristufek P, Levine BE et al. Comparison of the efficacy, tolerability, and safety of formoterol dry powder and oral, slow ‑ release theophylline in the treatment of COPD. Chest 2002; 121 : 1058 – 1069.
67. Grootendorst DC, Gauw SA, Verhoosel RM et al. Reduction in sputum neutrophil and eosinophil numbers by the PDE4 inhibitor roflumilast in patients with COPD. Thorax 2007; 62 : 1081 – 1087.
68. Rabe KF. Roflumilast for the treatment of chronic obstructive pulmonary disease. Expert Rev Resp Med 2010; 4 : 543 – 555.
69. Wood A, Stockley R. Alpha one antitrypsin deficiency: from gene to treatment. Respiration 2007; 74 : 481 – 492.
70. Wood A, Tan S, Stockley R. Chronic obstructive pulmonary disease: towards pharmacogenetics. Genome Med 2009; 1 : 112.
71. Benditt JO. Surgical options for patients with COPD: sorting out the choices. Respir Care 2006; 51 : 173 – 182.
72. Martinez FJ, Chang AC, Chan KM. Surgical Therapy for COPD. In: Rennard SI, Rodríguez ‑ Roisin S, Huchon G et al (eds). Clinical Management of Chronic Obstructive Pulmonary Disease. New York: Informa, Healthcare 2008 : 435 – 474.
73. Criner GJ, Cordova F, Sternberg AL et al. The National Emphysema Treatment Trial (NETT): Part I: Lessons learned about emphysema. Am J Respir Crit Care Med 2011; 184 : 763 – 770.
74. Criner GJ, Cordova F, Sternberg AL et al. The National Emphysema Treatment Trial (NETT) Part II: Lessons learned about lung volume reduction surgery. Am J Respir Crit Care Med 2011; 184 : 881 – 893.
75. Herth F, Noppen M, Valipour A et al. Efficacy predictors of lung volumereduction with Zephyr valves in a Europeancohort. Eur Respir J 2012; 39 : 1334 – 1342.
76. Herth F, Eberhardt R, Gompelmann D et al. Radiological and clinical outcomes of using ChartisTM to plan endobronchial valve treatment. Eur Respir J 2013; 41 : 302 – 308.
77. Anker S, John M, Pedersen P et al. ESPEN Guidelines on Enteral Nutrition: Cardiology and pulmonology. Clin Nutr 2006; 25 : 311 – 318.
78. Anker S, Laviano A, Filippatos G et al. ESPEN Guidelines on Parenteral Nutrition: on cardiology and pneumology. Clin Nutr 2009; 28 : 455 – 460.
79. Elborn S, Tunney MM. Macrolide and bronchiectasis. Clinical benefit with a resistance price. JAMA 2013; 309 : 1295 – 1296.
80. Pannu KD. Azithromycin 250 mg daily reduces exacerbation frequency and improves quality of life in selected COPD patients. Thorax 2012; 67 : 391.
81. Peters J, Anzueto A. Azithromycin once daily for 1 year reduced acute COPD exacerbations. Ann Intern Med 2012; 156: JC1 – JC10.
82. Pomares X, Montón C, Espasa M et al. Long‑term azithromycin therapy in patients with severe COPD and repeated exacerbations. Int J Chron Obstr Pulmon Dis 2011; 6 : 449 – 456.
83. Albert RK, Connett J, Bailey WC. Azithromycin for prevention of exacerbations of COPD. N Engl J Med 2011; 365 : 689 – 698.
84. Uzun S, Djamin RS, Kluytmans J et al. Influence of macrolide maintenance therapy and bacterial colonisation on exacerbation frequency and progression of COPD (COLUMBUS): study protocol for a randomised controlled trial. Trials 2012; 13 : 82.
85. Altenburg J, de Graaff CS, Stienstra Y et al. Effect of azitromycin maintenance treatment on infectious exacerbations among patients with non‑cystic fibrosis bronchiectasis. The BAT randomized controlled trial. JAMA 2013; 309 : 1251 – 1259.
86. Sethi S, Jones PW, Theron MS et al. Pulsed moxifloxacin for the prevention of exacerbations of chronic obstructive pulmonary disease: a randomized controlled trial. Respir Res 2010; 11 : 10.
87. Hobbs K, Brown D. Consider adding this drug to fight COPD that‘s severe. J Fam Pract 2012; 61 : 414 – 416.
88. Decramer M, Janssens W. Mucoactive therapy in COPD. Eur Respir Rev 2010; 19 : 134 – 140.
89. Moretti M, Bottrighi P, Dallari R et al. The effect of long‑term treatment with erdosteine on chronic obstructive pulmonary disease: the EQUALIFE Study. Drugs Exp Clin Res 2004; 30 : 143 – 152.
90. Czech Pneumological and Phthisiological Society. Guidelines for indication of home long term oxygen therapy 2013. 2013 Apr [cited 2013 Apr 17]. Available from: http:/ / www.pneumologie.cz/ odborne/ doc/ Standard%20DDOT ‑ %20final.pdf.
91. Somfay A, Porszasz J, Lee SM et al. Dose‑response effect of oxygen on hyperinflation and exercise endurance in nonhypoxaemic COPD patients. Eur Respir J 2001; 18 : 77 – 84.
92. Edvardsen A, AkerØ´ A, Christensen CC et al.Air travel and COPD: A new algorithm for pre‑flight evaluation. Thorax 2012; 67 : 964 – 969.
93. Dreher M, Storre JH, Schmoor C et al. High intensity versus low ‑ intensity non‑invasive ventilation in patients with stable hypercapnic COPD: a randomised crossover trial. Thorax 2010; 65 : 303 – 308.
94. Duiverman ML, Wempe JB, Bladder G et al. Nocturnal non‑invasive ventilation in addition to rehabilitation in hypercapnic patients with COPD. Thorax 2008; 63 : 1052 – 1057.
95. Duiverman ML, Wempe JB, Bladder G et al. Two‑year home‑based nocturnal non‑invasive ventilation added to rehabilitation in chronic obstructive pulmonary disease patients: a randomized controlled trial. Respir Res 2011; 12 : 112.
96. Au DH, Curtis JR. Providing Palliative and End‑of ‑ Life Care for Patients with COPD. In: Rennard SI, Rodríguez ‑ Roisin S, Huchon G et al (eds). Clinical Management of Chronic Obstructive Pulmonary Disease. New York: Informa, Healthcare 2008 : 515 – 529.
97. Kamal AH, Maguire JM, Wheeler JL et al. Dyspnea review for the palliative care professional: treatment goals and therapeutic options. J Palliat Med 2012; 15 : 106 – 114.
98. Uronis HE, Currow DC, Abernethy AP. Palliative management of refractory dyspnea in COPD. Int J Chron Obstr Pulmon Dis 2006; 1 : 289 – 304.
Labels
Diabetology Endocrinology Internal medicine
Article was published inInternal Medicine

2013 Issue 6-
All articles in this issue
- Adherence a perzistence se zaměřením na léčbu hypertenzních pacientů
- Diuretika v monoterapii a v kombinaci s diuretiky a nediuretiky v léčbě hypertenze
- Hypertenze u pacientů s polycystickými ledvinami – incidence, patogeneze, prognóza, terapie
- Primární hyperaldosteronizmus: častá forma sekundární hypertenze s vyšším kardiovaskulárním rizikem
- Chronická obstrukční plicní nemoc pohledem nových doporučení – souhrn aktuálního fenotypově zaměřeného standardu České pneumologické a ftizeologické společnosti pro internisty
- Účinnost léčby anagrelidem u nemocných s Ph‑ negativními myeloproliferativními chorobami: ovlivnění výskytu trombózy ve výstupech Registru pacientů s diagnózou esenciální trombocytemie a trombocytemie provázející jiné myeloproliferativní onemocnění léčených Thromboreductinem® ke konci roku 2012
- Počátky České kardiologické společnosti a české kardiologie
- Moderní trendy v inzulinoterapii
- Vplyv tuhosti aorty na centrálnu hemodynamiku a na kardiovaskulárny systém
- Lipidy a veľkosť lipoproteínových častíc u pacientov s novozisteným a doposiaľ neliečeným diabetes mellitus 2. typu
- Metabolický syndróm a prediabetické stavy
- Rezistentná hypertenzia v staršom veku
- Epigenetická cytostatika a jejich role v protinádorové léčbě
- Environmentálny estrogén bisfenol A a jeho účinky na organizmus človeka
- Jak ovlivňuje gravidita onemocnění hypofýzy
- Diferenciálna diagnóza a liečba hyponatriémie
- Internal Medicine
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Diferenciálna diagnóza a liečba hyponatriémie
- Jak ovlivňuje gravidita onemocnění hypofýzy
- Diuretika v monoterapii a v kombinaci s diuretiky a nediuretiky v léčbě hypertenze
- Environmentálny estrogén bisfenol A a jeho účinky na organizmus človeka
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

