-
Medical journals
- Career
Myelodysplastický syndrom. Pokroky v diagnostice a léčbě během 30 let trvání registru nemocných s myelodysplastickým syndromem v ÚHKT
Authors: J. Čermák
Authors‘ workplace: Ústav hematologie a krevní transfuze Praha, ředitel prof. MUDr. Marek Trněný, CSc.
Published in: Vnitř Lék 2012; 58(Suppl 2): 8-15
Category:
Overview
Analýza dat získaných od 367 nemocných s primárním myelodysplastickým syndromem (MDS) sledovaných v ÚHKT v letech 1980–2009 ukázala zásadní změny v přístupu k diagnostice a k léčbě tohoto onemocnění během posledních 30 let. V diagnostice MDS se zejména v poslední době uplatňují molekulárně genetické metody a význam nálezů získaných těmito metodami pro prognózu nemocných, a tím i pro způsob jejich léčby, je intenzivně zkoumán. Při zhodnocení vývoje léčby vidíme přechod od podpůrné léčby a paliativní terapie k moderním léčebným metodám užívajícím léky, jež mohou cíleně ovlivnit právě molekulárně genetickou podstatu onemocnění. Takovými léky jsou lenalidomid u nízce rizikových nemocných a hypometylační látky u pokročilé fáze onemocnění. Zavedení transplantace krvetvorných buněk (SCT) výrazně zlepšilo délku přežití zejména u mladších nemocných s pokročilými formami choroby s nadbytkem blastů. SCT představuje stále jediný kurativní přístup k této chorobě.
Klíčová slova:
myelodysplastický syndrom – diagnostika – léčba – prognóza – registrÚvod
Již dlouho je známo, že část akutních leukemií nezačíná u nemocných náhle z plného zdraví, ale po různě dlouhém období charakterizovaném sníženým počtem jednoho či více typů krvinek a z toho vyplývajícími komplikacemi, nejčastěji opakovanými infekty či krvácením. Popisy těchto případů lze najít již v odborných článcích publikovaných mezi dvěma světovými válkami, první nozologickou jednotku charakterizovanou výše uvedenými příznaky popsal v polovině 50. let minulého století Björkman jako získanou sideroblastickou anémii [1]. O 25 let později byly blíže definovány jako samostatné jednotky refrakterní anémie s nadbytkem blastů a chronická myelomonocytární leukemie, nazývané dříve paušálně preleukemie či doutnající leukemie. V roce 1982 pak byly výše uvedené jednotky zahrnuty do společné skupiny tzv. myelodysplastických syndromů (MDS), jenž byly definovány jako heterogenní skupina onemocnění kmenové krvetvorné buňky s odlišnou prognózou týkající se jak přežití, tak rizika progrese do akutní leukemie [2]. Na patogenezi onemocnění se podle současných názorů podílí v časné fázi mutace kmenové krvetvorné buňky, jež vede k abnormální imunitní odpovědi organizmu, k aktivaci cytotoxických T-lymfocytů a ke zvýšené produkci cytokinů, jež indukují apoptózu zejména zralejších forem krvetvorby [3]. Poškozený genom je náchylný k akumulaci dalších mutací, v tomto procesu hrají významnou roli jednak mutace onkogenů vedoucí k abnormální proliferaci klonu vznikajícího z poškozené kmenové krvetvorné buňky, jednak mutace tzv. tumor supresorických genů, což vede k poruše diferenciace prekurzorů do zralejších forem krvetvorby a celkové regulace krvetvorby [4]. Konečným výsledkem je postupný rozvoj akutní myeloidní leukemie (AML).
Diagnostika
V diagnostice MDS hraje stále základní roli pečlivé morfologické vyšetření kostní dřeně vzhledem k tomu, že jak předešlá, tak současná klasifikace MDS definuje přesně a poměrně striktně kritéria, jaké morfologické změny jsou hodnoceny jako projev dysplazie a jaké procento buněk v jednotlivých krevních řadách musí tyto změny vykazovat (tab. 1) [5]. Krom vyšetření punktátu kostní dřeně je při podezření na MDS nutno provést histologické vyšetření dřeně z trepanobioptického vzorku, z něhož je možno krom potvrzení dysplastických změn lépe posoudit i buněčnost dřeně, některé topické změny a event. přítomnost fibrózy. Zhruba u 40 % nemocných s MDS jsou při vyšetření klasickými cytogenetickými metodami přítomny přestavby chromozomů, nález abnormit karyotypu může pomoci při diagnostice MDS, řada studií však prokázala zásadní význam typu a počtu chromozomálních změn pro prognózu nemocných a cytogenetický nález je jedním ze základních parametrů při hodnocení prognózy nemocných s MDS pomocí tzv. Mezinárodního prognostického skórovacího systému (IPSS) (tab. 2) [6]. Tento cytogenetický prognostický systém, stejně jako jeho recentní revize [7] je postaven na vyšetření karyotypu pomocí standardních pruhovacích metod. Rozvoj molekulární cytogenetiky a metod, jakými jsou fluorescenční hybridizace in situ (FISH) a komparativní genomová hybridizace (aCGH), přinesl možnost komplexního vyšetření genomu a upřesnění lokalizace postižení daného chromozomu (obr. 1). Nicméně jejich přínos pro revizi stupně rizika u jednotlivých nemocných není zcela jednoznačný [8]. Vyšetření exprese povrchových buněčných antigenů pomocí průtokové cytometrie může upřesnit procento CD34+ blastů v kostní dřeni, v současné době se ukazuje, že změny exprese povrchových antigenů u nemocných s MDS mají krom přínosu pro diagnostiku i význam prognostický [9]. Řada molekulárně genetických metod dnes slouží ke zkoumání mutací a změn exprese nejrůznějších genů u MDS. Vzhledem k řadě faktorů, které se podílejí na vzniku a progresi MDS, se však dosud nepodařilo identifikovat gen či skupinu genů, jež by měly univerzální diagnostický význam. Studium možného prognostického významu molekulárně genetických změn je zmíněno níže. V současné době je intenzivně studován i význam proteinového profilu séra u nemocných s MDS pomocí proetomických metod [10].
Table 1. Charakteristické morfologické dysplastické změny. 
Table 2. Mezinárodní prognostický skórovací systém (IPSS). Jako kritéria pro cytopenii jsou považovány hodnoty: Hb < 100 g/l, počet neutrofilních segmentů < 1,8 × 10<sup>9</sup>/l, počet trombocytů < 100 × 10<sup>9</sup>/l. 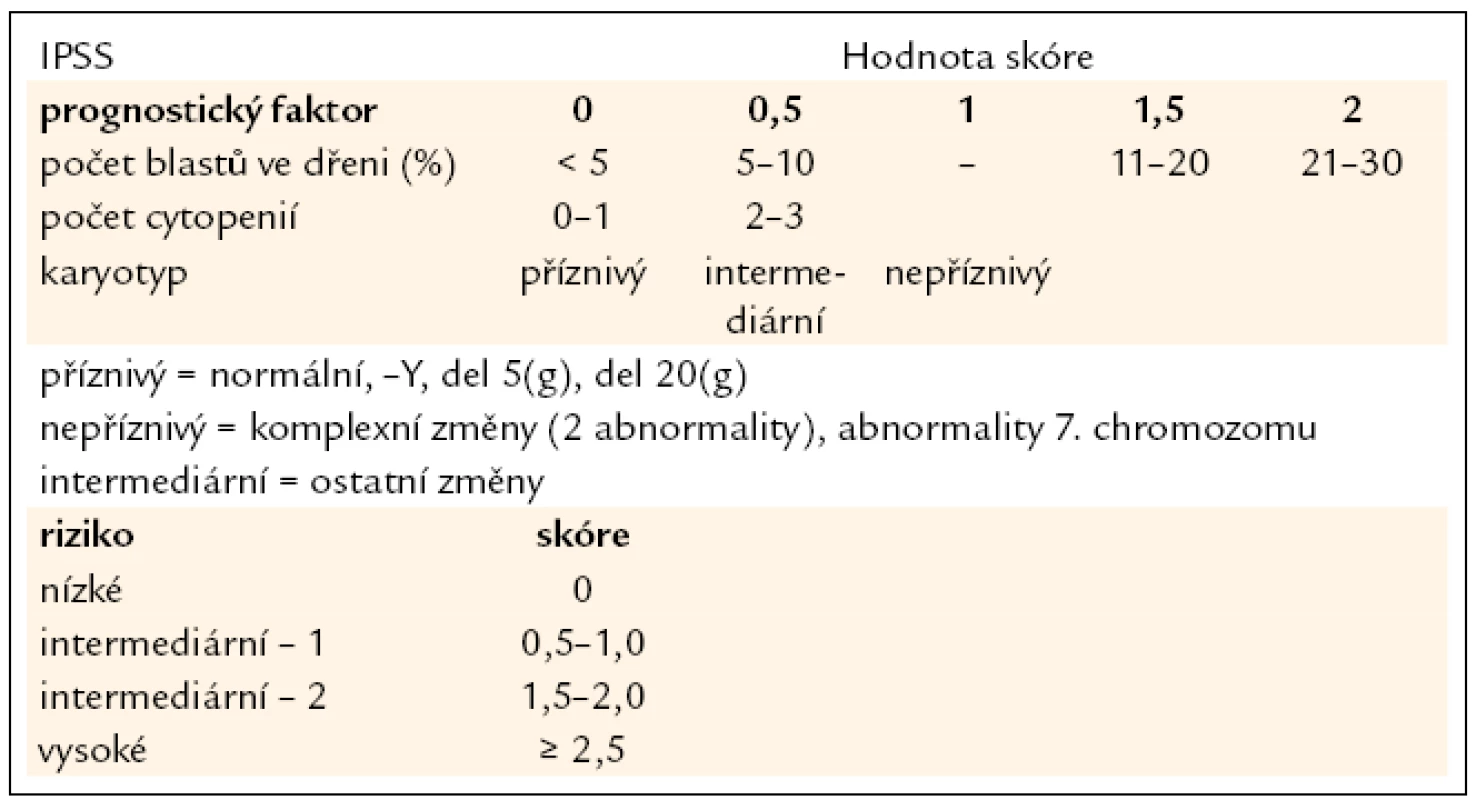
Image 1. Nález komplexních změn karyotypu pomocí metody m-FISH u nemocného s MDS typu RAEB. 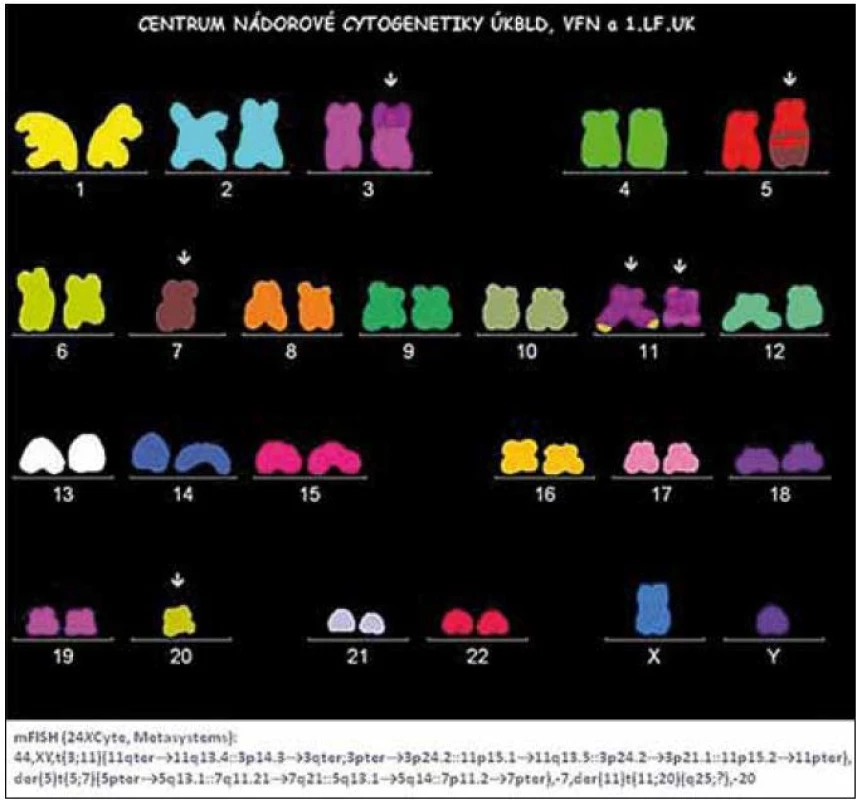
Prognóza
Již výše zmíněná první klasifikace MDS (tzv. FAB – francouzsko/americko/britská klasifikace) z roku 1982 (tab. 3) [2] rozděluje nemocné do podskupin s relativně lepší prognózou, nižší incidencí komplikací, delší dobou přežití a malým rizikem leukemizace choroby (RA, RARS), a podskupin se zmnožením blastů v kostní dřeni (RAEB, RAEB-T a CMML) s nepříznivou prognózou a vysokým rizikem progrese do AML. Na obr. 2a je znázorněna délka přežití 182 neléčených nemocných z celkového počtu 367 nemocných s primárním MDS z registru ÚHKT sledovaných v letech 1980–2009 a rozdělených do jednotlivých podskupin podle FAB klasifikace. Během 80. let minulého století bylo vytvořeno několik prognostických schémat hodnotících jako prognosticky významné různé faktory, zejména počet cytopenií v periferní krvi a změny karyotypu [11], a v roce 1997 byl publikován již výše zmíněný tzv. Mezinárodní prognostický skórovací systém (IPSS) [6], jenž na základě počtu blastů v kostní dřeni, počtu cytopenií v periferní krvi a počtu a typu abnormit karyotypu dělí nemocné s primárním MDS do 4 podskupin s různou délkou přežití a rizikem leukemické transformace. Obr. 2b ukazuje délku přežití našich nemocných rozdělených podle rizikových podskupin IPSS. V roce 2001 byla publikována tzv. WHO klasifikace MDS [12], která na základě rozdílné prognózy rozděluje nemocné v původní skupině refrakterních anémií do podskupiny s čistou refrakterní anémií (RA), refrakterní cytopenií s dysplazií ve více řadách (RCMD) a tzv. 5q-syndromem. Vzhledem k prakticky identickému průběhu a prognóze byli nemocní s diagnózou RAEB-T přeřazeni mezi akutní myeloidní leukemie a CMML byla na základě svého biologického chování zařazena do skupiny smíšených myelodysplastických/myeloproliferativních onemocnění (MDS/MPS). Obr. 2c ukazuje délku přežití našich nemocných rozdělených podle WHO klasifikace z roku 2001. Nová revize WHO klasifikace z roku 2008 [5] pak detailněji rozděluje nemocné s cytopenií v jedné řadě a nemocné s RAEB dělí do 2 podskupin dle počtu blastů v kostní dřeni (tab. 2). V roce 2007 byl publikován tzv. WHO-based prognostic scoring system (WPSS) využívající podskupiny dle WHO klasifikace (2001), prognostické skupiny karyotypu dle IPSS a přidávající jako významný prognostický parametr závislost na podávání transfuzí erytrocytů [13]. Nepříznivý vliv opakovaného podávání transfuzí erytrocytů na délku přežití může být důsledkem toxického působení nadbytečného železa dodaného transfuzemi, zejména na myokard, nicméně transfuzní dependence může odrážet i prognosticky nepříznivé rozsáhlé postižení krvetvorby. V naší práci bylo podávání transfuzí erytrocytů nezávislou proměnnou negativně ovlivňující délku přežití pouze u skupiny nemocných s izolovanou dysplazií v červené řadě a dependencí na více než 2 TU erytrocytů měsíčně. U nemocných s RCMD byl negativní dopad podávání transfuzí přítomen pouze u nemocných s nepříznivými změnami karyotypu (dle IPSS) a závislostí na ≥ 3 TU erytrocytů měsíčně [14].
Table 3. Srovnání FAB klasifikace MDS s WHO klasifikací z roku 2001 a její revizí z roku 2008. 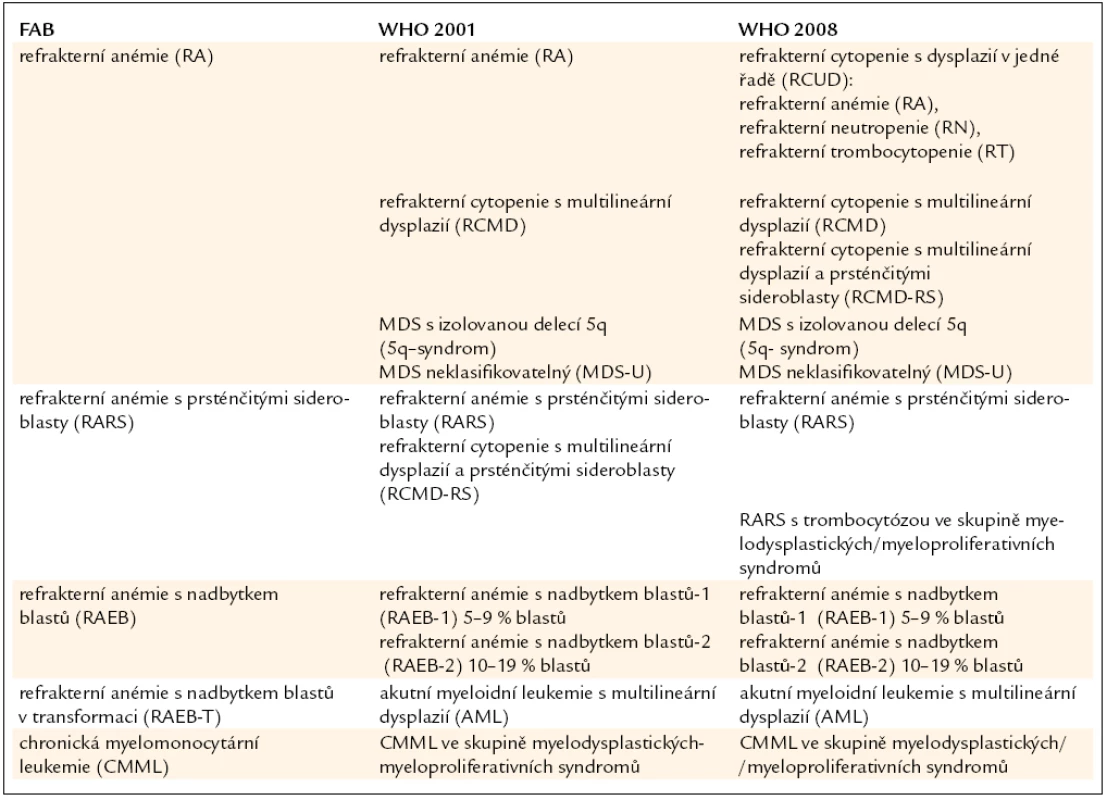
Image 2. Pravděpodobnost délky přežití jednotlivých skupin neléčených nemocných z registru ÚHKT podle FAB klasifikace (obr. 2a), IPSS (obr. 2b) a WHO klasifikace z roku 2001 (obr. 2c). 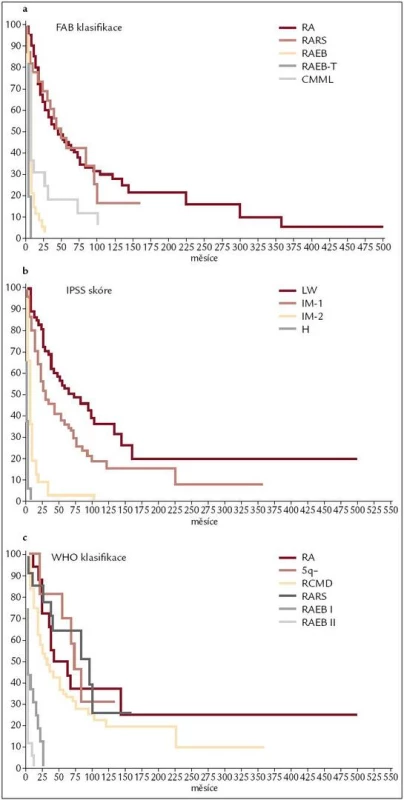
Na rozdíl od do určité míry omezeného přínosu molekulární cytogenetiky pro klasifikaci a prognózu nemocných s MDS ukazují recentní studie na možný prognostický význam detekce změn genomu pomocí molekulárně genetických metod. Detekce polymorfizmu jednotlivých nukleotidů pomocí tzv. SNP array karyotypování představuje citlivou metodu k odhalení diskrétních nebalancovaných translokací u nemocných s normálním nálezem při užití konvenční cytogenetické analýzy. Může jít o variaci počtu kopií alel (copy number variation – CNV), nebo o ztrátu heterozygozity daného úseku genomu (LOH) kvůli tzv. uniparentální disomii (UPD), při níž jde o ztrátu genetického materiálu jednoho chromozomu s následným vyplněním ztraceného úseku duplikací zbývajícího chromozomu, takže nedochází ke ztrátě genetického materiálu (a proto změny nemohou být detekovány klasickou cytogenetikou). Počet kryptických chromozomálních aberací může mít vztah k délce přežití nemocných [8], kromě toho může tato metodika odhalit některé diskrétní změny karyotypu s prognostickým významem [15]. Na obr. 3 je příklad detekce kryptické delece dlouhého raménka 5. chromozomu, která byla následně ověřena metodou FISH s užitím lokus specifické sondy. V kombinaci s detekcí změn exprese genů pomocí studia expresního profilu genomu v úseku identifikovaném pomocí SNP karyotypování pak můžeme určit kandidátní geny, jejichž změny exprese jsou důsledkem zjištěné diskrétní změny genomu [15,16]. V poslední době se podařilo pomocí velmi citlivých metodik, jakými jsou genotypování pomocí hmotnostní spektrometrie a tzv. sekvenace „příští generace“ (next generation sequencing) identifikovat somatické bodové mutace některých genů, jejichž postižení může mít prognostický význam [17]. Řada z těchto genů (ASXL1, EZH2, TET2) se podílí na procesu regulace exprese zejména diferenciačních genů cestou ovlivnění aktivity koncových nepřepisovaných regulačních úseků daného genu změnou stupně metylace genových promoterů a acetylace histonů. Některé geny mají zřejmě klíčovou roli v regulaci buněčné proliferace a regulace reparace poškození (TP53, RUNX1), nejnověji byl popsán možný prognostický význam mutací genů podílejících se na procesu sestřihu nukleových kyselin z proformy do přepisované formy (SFR3B1) [18].
Image 3. Nález delece v oblasti 5q31.3–q33.2 (nemocný č. 3) a delece v oblasti 12p13.1–p13.2 (nemocný č. 30) pomocí studia variací počtu kopií alel (CNV) v izolovaných populacích granulocytů, nález není přítomen v populace T-lymfocytů, takže se jedná o získanou chromozomální změnu. Nález je ověřen pomocí FISH s lokus specifickou sondou (3 obrázky karyotypů vpravo dole). 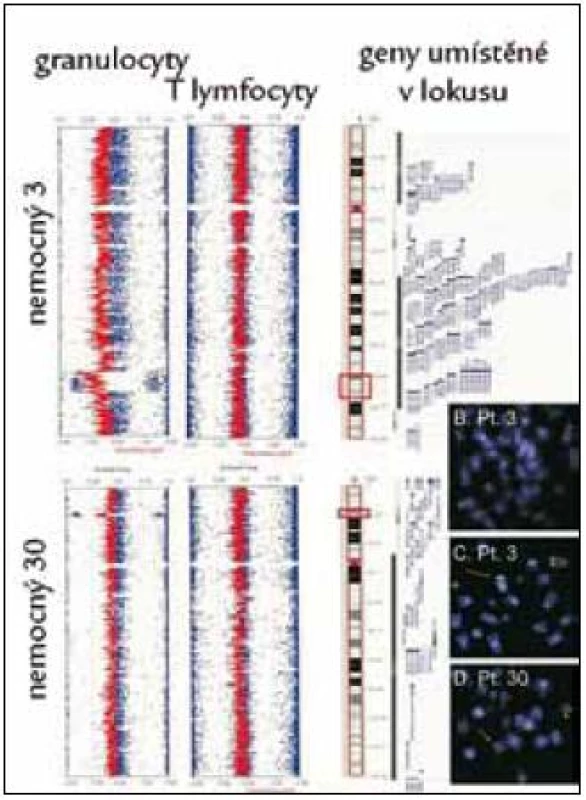
Léčba
Všechny výše uvedené klasifikace MDS i prognostické skórovací systémy ukázaly na významný rozdíl v délce přežití mezi jednotlivými podskupinami nemocných, zejména mezi nemocnými s normálním počtem mladých prekurzorů v kostní dřeni a nemocnými s narůstajícím procentem blastů (zejména > 10 % v kostní dřeni) – viz obr. 2a–c. Z této zkušenosti vychází i současný přístup k léčbě nemocných s MDS. U nemocných s nízkým či středním skóre dle IPSS (tab. 2), resp. u nemocných bez nadbytku blastů v kostní dřeni, převažují konzervativní přístupy k léčbě. V tab. 4 jsou uvedeny výsledky různých léčebných přístupů k 175 nemocným s časným MDS s nižším rizikem (≤ 5 % blastů v kostní dřeni) z registru ÚHKT. Vidíme, že část nemocných může profitovat pouze z podpůrné léčby, na níž 33 % nemocných přežívá 5 let, a pravděpodobnost přežití 10 let od diagnózy činí 19 %. U těchto nemocných se může rozvinout přetížení železem v důsledku opakovaného podávání transfuzí erytrocytů a je u nich namístě včasné zahájení efektivní chelatační léčby [14,19]. U části nemocných může mít účinek podávání erytropoézu stimulujících látek (ESA), většinou jde o nemocné s určitým deficitem endogenního erytropoetinu (EPO). Nejlepší efekt byl pozorován u nemocných s hladinou EPO v séru < 200 IU/l a závislých na ≤ 2 TU erytrocytů měsíčně [20]. Podávání imunosupresiv, zejména antithymocytárního globulinu (ATG), je indikováno především u nemocných s hypoplastickou formou MDS [21], 5 let přežívalo 60 % našich nemocných, kterým byl podáván ATG. Nicméně u 6 z 10 nemocných došlo během let k progresi choroby směrem k akutní leukemii, u 4 z nich byla v období progrese nalezena delece 7q či úplná ztráta 7. chromozomu. Tyto nálezy souhlasí s pozorováním jiných autorů [22], kteří přítomnost změn na 7. chromozomu v době podávání ATG hodnotí jako důležitý nepříznivý faktor vedoucí k potenciální progresi choroby, pravděpodobně kvůli defektu funkce některých tumor supresorických genů lokalizovaných na 7. chromozomu. V současné době je proto doporučováno u všech nemocných indikovaných k intenzivní imunosupresi vyloučit přítomnost změn na 7. chromozomu pomocí metod molekulární cytogenetiky či molekulární genetiky.
Table 4. Délka přežití nemocných z registru ÚHKT s ≤ 5 % blastů v době diagnózy, nemocní jsou rozděleni podle jednotlivých léčebných přístupů. 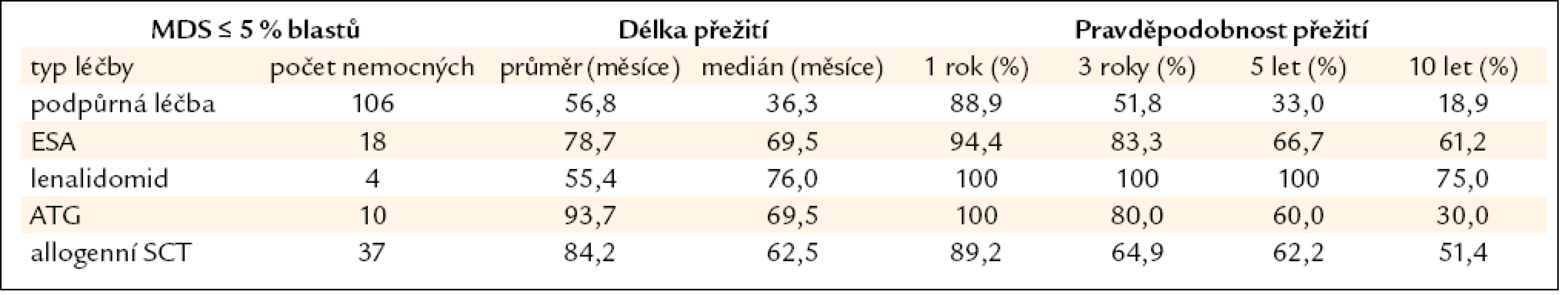
Efekt lenalidomidu na korekci anémie u nemocných s delecí 5q je vysvětlován ovlivněním funkce některých proliferačních genů a regulačního efektu tzv. mikroRNA (mRNA) [23]. U nemocných odpovídajících na léčbu je v našem registru pravděpodobnost přežití 10 let 75 %, počet takto léčených nemocných je ale zatím poměrně malý. Před léčbou je nutno všechny nemocné vyšetřit na možný výskyt mutace genu p53, její přítomnost je obecně nepříznivým prognostickým faktorem [17] a při léčbě lenalidomidem je spojena s vysokým rizikem progrese choroby [24]. Alogenní transplantace krvetvorných buněk je efektivní metodou u nemocných s časným MDS, 5 let po SCT přežívá 62 % našich nemocných a pravděpodobnost přežití 10 let je 51 %. Nicméně mortalita spojená s transplantací není u této skupiny nemocných zanedbatelná (22 % v našem souboru), což ukazuje na to, že u nemocných s MDS s nízkým rizikem je třeba indikaci SCT vždy pečlivě zvážit, tato léčba přichází v úvahu zejména u nemocných s těžkou cytopenií a z ní vyplývajícími život ohrožujícími komplikacemi, s komplexními změnami karyotypu či při současné přítomnosti vyššího stupně fibrózy v kostní dřeni (MF-2) [25].
Nemocní s MDS s 6–10 % blastů (RAEB I dle WHO klasifikace z roku 2008) v kostní dřeni tvoří skupinu s nejednotnou a většinou významně horší prognózou než nemocní s MDS a ≤ 5 % blastů v kostní dřeni (obr. 2). Nepříznivý průběh je dán poměrně častou progresí směrem k akutní leukemii (27 % v naší sestavě) a častými závažnými komplikacemi rezultujícími z těžké cytopenie (21 % našich nemocných). Příčina není zcela jasná, uvažuje se o vlivu dlouhodobě se rozvíjejícího procesu, jenž vede k hrubé poruše krvetvorné buňky i hemopoetického stromatu. V tab. 5 jsou shrnuty výsledky léčby našich nemocných s MDS typu RAEB I. Jedinou efektivní metodou se ukazuje být alogenní SCT, ale i zde ve srovnání s nízcerizikovými nemocnými přežívá 5 let pouze 32 % nemocných a peritransplantační mortalita činí 42 %. Nicméně přítomnost progredujícího počtu blastů v kostní dřeni je indikací k provedení alogenní SCT [26]. Chronická myelomonocytární leukemie je dnes řazena mezi MDS/MPS. V tab. 5 jsou uvedeny i výsledky léčby této jednotky u našich nemocných, někteří mohou poměrně dlouho přežívat pouze s podpůrnou léčbou či při podávání hydroxyurey v monoterapii, transplantace bývá spojena s častými relapsy, určitý efekt může mít podávání hypometylačních látek (azacytidinu), ale počty nemocných na této léčbě jsou zatím poměrně malé.
Table 5. Délka přežití nemocných z registru ÚHKT s RAEB I a CMML, nemocní jsou rozděleni podle jednotlivých léčebných přístupů. 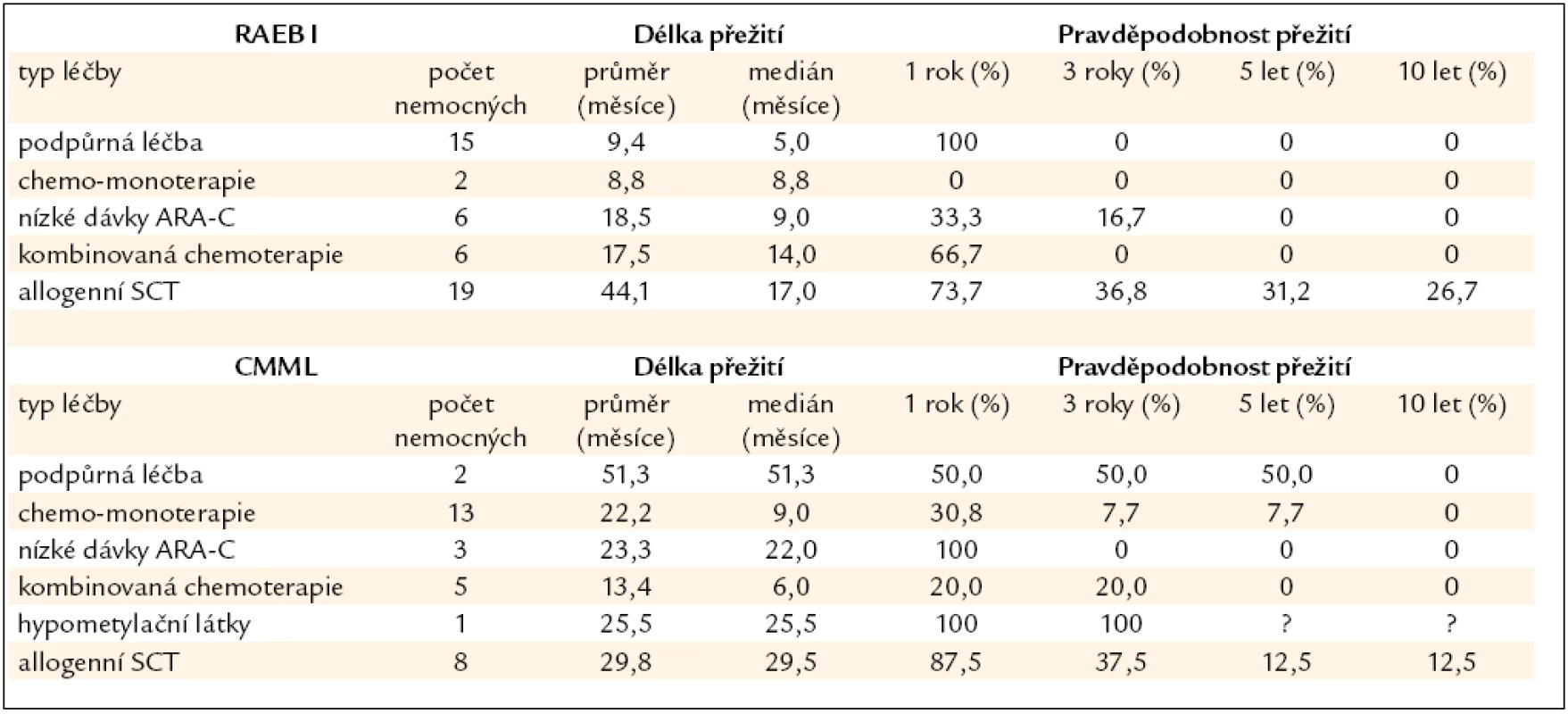
Nemocní s MDS s > 10 % blastů v kostní dřeni jsou považováni za vysoce rizikovou skupinu a je u nich indikována intenzivní léčba včetně alogenní SCT. Vzhledem k tomu, že bez léčby prakticky všichni nemocní zemřou na komplikace či na progresi do AML, nemá pouhá podpůrná léčba či perorální monoterapie smysl. To tab. 6 ukazuje i výsledky získané v souboru 112 nemocných léčených v ÚHKT s diagnózou RAEB II či RAEB-T. Z konzervativních typů léčby používaných zejména u starších nemocných má určitý efekt podávání nízkých dávek cytarabinu a v poslední době pak hypometylačních látek, jež svým účinkem mohou revertovat vyhasínání funkce některých důležitých genů hrajících roli zejména v buněčné diferenciaci a regulaci krvetvorby [27]. Autologní SCT nemá větší význam vzhledem k tomu, že se často jen velmi obtížně dosáhne molekulárně genetické remise choroby a zbytková nemoc je pak zdrojem relapsů choroby. Z naší skupiny 6 autologně transplantovaných nemocných s MDS přežívá dlouhodobě pouze 1 nemocná. U 27 nemocných byla provedena alogenní SCT, 5 let přežívá 56 % nemocných, což je srovnatelné s výsledky u nízce rizikových nemocných, pravděpodobnost přežití 10 let je 52 %, peritransplantační mortalita činí 30 %. Nebyl pozorován významnější rozdíl ve výsledcích při užití standardních a redukovaných přípravných režimů a při transplantaci od příbuzného či nepříbuzného dárce, stejně jako v zahraničních studiích [28,29]. U skupiny našich nemocných byl přítomen signifikantní vliv na délku přežití, pokud bylo před SCT dosaženo redukce počtu blastů chemoterapií pod 10 % [30], jinak samotná kombinovaná chemoterapie bez následné transplantace měla jen omezený efekt (3leté přežití pouze u 3 % nemocných).
Table 6. Délka přežití nemocných z registru ÚHKT s > 10 % blastů v době diagnózy, nemocní jsou rozděleni podle jednotlivých léčebných přístupů. 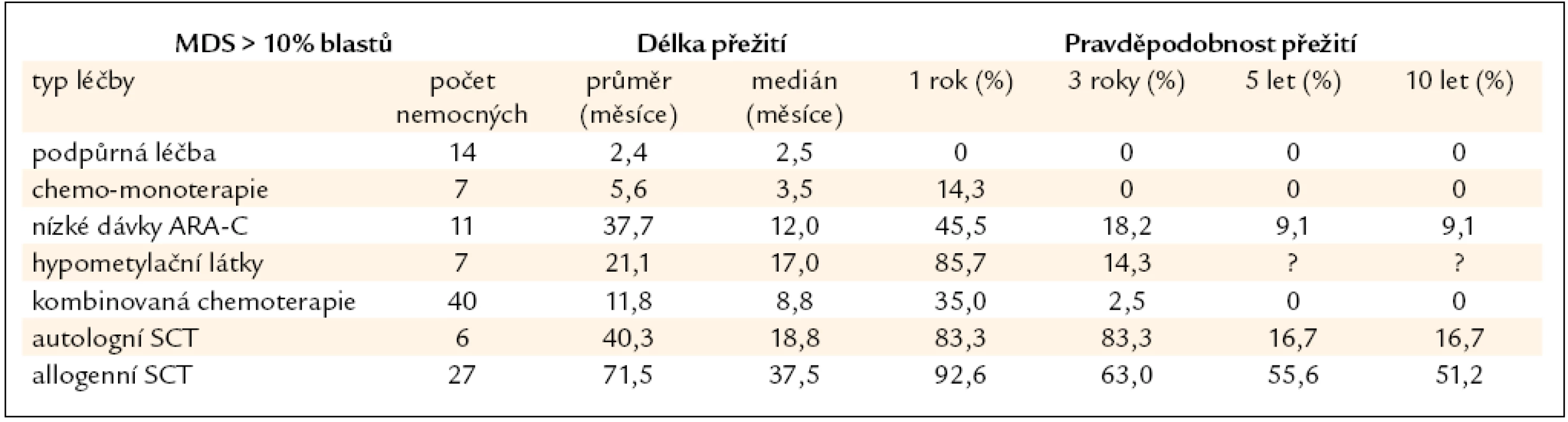
Závěr
Při zhodnocení vývoje léčby nemocných s MDS během posledních 30 let na datech z registru ÚHKT vidíme přechod od podpůrné léčby a paliativní terapie k moderním léčebným metodám užívajícím léky, jež mohou cíleně ovlivnit molekulárně genetickou podstatu onemocnění. Takovými léky jsou lenalidomid u nízce rizikových nemocných a hypometylační látky u pokročilé fáze onemocnění. Zavedení transplantace krvetvorných buněk výrazně ovlivnilo délku přežití zejména mladších nemocných s pokročilými formami choroby s nadbytkem blastů a představuje stále jediný kurativní přístup k této chorobě.
Poděkování
Autor děkuje za spolupráci Mgr. Monice Beličkové, RNDr. Michaele Dostálové-Merkerové, Mgr. Alžbětě Vašíkové, prof. Ing. Kyře Michalové, CSc., MUDr. Janě Březinové, CSc., MUDr. Daně Mikulenkové, MUDr. Petře Kačírkové a všem lékařům klinického a výzkumného úseku ÚHKT, kteří se podíleli na diagnostice MDS a na léčbě nemocných.
doc. MUDr. Jaroslav Čermák, CSc.
www.uhkt.cz
e-mail: cermak@uhkt.cz
Doručeno do redakce: 19. 6. 2012
Sources
1. Björkman SE. Chronic refractory anemia with sideroblastic bone marrow: a study of four cases. Blood 1956; 11 : 250–259.
2. Bennett J, Catovsky D, Daniel MT et al. Proposals for the classification of the myelodysplastic syndromes. Br J Haematol 1982; 51 : 189–199.
3. Raza A, Gezer S, Mundle S et al. Apoptosis in bone marrow biopsy samples involving stromal and hematopoietic cells in 50 patients with myelodysplastic syndromes. Blood 1995; 86 : 268–276.
4. Parker JE, Mufti GJ. Ineffective haemopoiesis and apoptosis in myelodysplastic syndromes. Br J Haematol 1998; 101 : 220–230.
5. Brunning RD, Orazi A, Germing U et al. Myelodysplastic syndromes/neoplasms, overview. In: Swerdlow SH, Campo E, Harris NL et al (eds). WHO Classification of Tumours of Haematopoietic nad Lymphoid Tissues. 4th ed. Lyon: IARC Press 2008 : 88–93.
6. Greenberg P, Cox C, LeBeau MM et al. International scoring system for evaluating prognosis in myelodysplastic syndromes. Blood 1997; 89 : 2079–2088.
7. Schanz J, Tüchler H, Solé F et al. A new comprehensive cytogenetic scoring system for primary myelodysplastic syndromes (MDS) and oligoblastic AML after MDS derived from an international database merge. J Clin Oncol 2012; 30 : 820–829.
8. Tiu RV, Gondek LP, O’Keefe CL et al. Prognostic impact of SNP array karyotyping in myelodysplastic syndromes and related myeloid malignancies. Blood 2011; 117 : 4552–4560.
9. van de Loosdrecht AA, Alhan C, Béné MC et al. Standardization of flow cytometry in myelodysplastic syndromes: report from the first European LeukemiaNet working conference on flow cytometry in myelodysplastic syndromes. Haematologica 2009; 94 : 1124–1134.
10. Májek P, Reicheltová Z, Suttnar J et al. Plasma proteome changes associated with refractory cytopenia with multilineage dysplasia. Proteome Sci 2011; 9 : 64.
11. Sanz GF, Sanz MA, Vallespí T et al. Two regression models and a scoring system for predicting survival and planning treatment in myelodysplastic syndromes: a multivariate analysis of prognostic factors in 370 patients. Blood 1989; 74 : 395–408.
12. Harris NL, Jaffe ES, Diebold J et al. World Health Organization classification of neoplastic diseases of the hematopoietic and lymphoid tissues: report of the Clinical Advisory Committee meeting – Airlie House, Virginia, November 1997. J Clin Oncol 1999; 17 : 3835–3849.
13. Malcovati L, Germing U, Kuendgen A et al. Time-dependent prognostic scoring system for predicting survival and leukemic evolution in myelodysplastic syndromes. J Clin Oncol 2007; 25 : 3503–3510.
14. Čermák J, Kacirkova P, Mikulenkova D et al. Impact of transfusion dependency on survival in patients with early myelodysplastic syndrome without excess of blasts. Leuk Res 2009; 33 : 1469–1474.
15. Dostálová Merkerová M, Bystrická D, Belicková M et al. From cryptic chromosomal lesions to pathologically relevant genes: integration of SNP-array with gene expression profiling in myelodysplastic syndrome with normal karyotype. Genes Chromosomes Cancer 2012; 51 : 419–428.
16. Vasikova A, Belickova M, Budinska E et al. A distinct expression of various gene subsets in CD34+ cells from patients with early and advanced myelodysplastic syndrome. Leuk Res 2010; 34 : 1566–1572.
17. Bejar R, Stevenson K, Abdel-Wahab O et al. Clinical effect of point mutations in myelodysplastic syndromes. N Eng J Med 2011; 364 : 2496–2506.
18. Malcovati L, Papaemmanuil E, Bowen DT et al. Clinical significance of SFR3Bl mutations in myelodysplastic syndromes and myelodysplastic/myeloproliferative neoplasms. Blood 2011; 118 : 6239–6246.
19. Bennett JM. Consensus statement on iron overload in myelodysplastic syndromes. Am J Hematol 2008; 83 : 858–861.
20. Hellström-Lindberg E. Efficacy of erythropoietin in the myelodysplastic syndromes: a meta-analysis of 205 patients from 17 studies. Br J Haematol 1995; 89 : 67–71.
21. Passweg JR, Giagounidis AA, Simcock M et al. Immunosuppressive therapy for patients with myelodysplastic syndrome: a prospective randomized multicenter phase III trial comparing antithymocyte globulin plus cyclosporine with best supportive care – SAKK 33/99. J Clin Oncol 2010; 29 : 303–309.
22. Sloand EM, Wu CO, Greenberg P et al. Factors affecting response and survival in patients with myelodysplasia treated with immunosuppressive therapy. J Clin Oncol 2008; 26 : 2505–2511.
23. Bejar R, Levine R, Eberet BJ. Unraveling the molecular pathophysiology of myelodysplastic syndromes. J Clin Oncol 2011; 29 : 504–515.
24. Kuendgen A, Lauseker M, List AM et al. Lenalidomid treatment is not related to AMl progression risk but is associated with survival benefit in RBC-dependent transfusion patients with IPSS Low - or Int1-Risk MDS with del5q. Blood 2011; 118. Abstract 119.
25. Cermák J, Vítek A, Michalová K. Combined stratification of refractory anemia according to both WHO and IPSS criteria has a prognostic impact and improves identification of patients who may benefit from stem cell transplantation. Leuk Res 2004; 28 : 551–557.
26. Cutler CS, Lee SJ, Greenberg P et al. A decision analysis of allogeneic bone marrow transplantation for the myelodysplastic syndromes: delayed transplantation for low-risk myelodysplasia is associated with improved outcome. Blood 2004; 104 : 579–585.
27. Fenaux P, Mufti GJ, Hellstrom-Lindberg E et al. Efficacy of azacitidine compared with that of conventional care regimens in the treatment of higher-risk MDS: a randomized, open-label, phase III study. Lancet Oncology 2009; 10 : 223–232.
28. Martino R, Iacobelli S, Brand R et al. Retrospective comparison of reduced-intensity conditioning and conventional high-dose conditioning for allogeneic hematopoietic stem cell transplantation using HLA-identical sibling donors in myelodysplastic syndromes. Blood 2006; 108 : 836–846.
29. Schmid C, Schleuning M, Ledderose G et al. Sequential regimen of chemotherapy, reduced-intensity conditioning for allogeneic stem-cell transplantation, and prophylactic donor lymphocyte transfusion in high-risk acute myeloid leukemia and myelodysplastic syndrome. J Clin Oncol 2005; 23 : 5675–5687.
30. Cermak J, Vitek A, Markova M et al. Combination chemotherapy leading in advanced MDS patients in a rapid clearence of bone marrow blasts prior stem cell transplantation (SCT) is superior to up-front SCT even with intensified conditiong for long-term survival. Blood 2010; 116. Abstract 4020.
Labels
Diabetology Endocrinology Internal medicine
Article was published inInternal Medicine

2012 Issue Suppl 2-
All articles in this issue
- Myelodysplastický syndrom. Pokroky v diagnostice a léčbě během 30 let trvání registru nemocných s myelodysplastickým syndromem v ÚHKT
- Akutní myeloidní leukemie – historický vývoj a současnost léčby ve světě a v ÚHKT
- Akutní lymfoblastová leukemie: historie a současnost
- Chronická myeloidní leukemie – zásadní změna prognózy nemocných po zavedení léčby inhibitory tyrozinových kináz
- Molekulární genetika v diagnostice a léčbě chronické myeloidní leukemie
- Transplantace krvetvorných buněk a její role v léčbě chorob krvetvorby během posledních 25 let
- Prevence a léčba infekčních komplikací v hematoonkologii
- Naléhavé stavy v hematologii
- Péče o pacienty s hemofilií a jejich rodiny v ÚHKT
- Sledování vrozených a získaných, strukturních a funkčních změn fibrinogenu
- Využití „label-free“ proteinových čipů pro proteomiku onkohematologických onemocnění
- Hemaferéza – vysoce účinná technika v terapii nemocných
- Imunohematologie – historie, současný stav poznání a role ÚHKT
- Metabolizmus železa a jeho regulace
- Internal Medicine
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Imunohematologie – historie, současný stav poznání a role ÚHKT
- Naléhavé stavy v hematologii
- Metabolizmus železa a jeho regulace
- Hemaferéza – vysoce účinná technika v terapii nemocných
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

