-
Medical journals
- Career
Kotníko-pažní index u nemocných s diabetes mellitus 2. typu
Authors: B. Nussbaumerová 1; H. Rosolová 1; J. Ferda 2; P. Šifalda 1; I. Šípová 1; F. Šefrna 1
Authors‘ workplace: Centrum preventivní kardiologie II. interní kliniky Lékařské fakulty UK a FN Plzeň, přednosta prof. MUDr. Jan Filipovský, CSc. 1; Klinika zobrazovacích metod Lékařské fakulty UK a FN Plzeň, přednosta doc. MUDr. Boris Kreuzberg, CSc. 2
Published in: Vnitř Lék 2011; 57(3): 299-305
Category: 60th birthday of prof. Mudr. Jiřího Vítovce, CSc, FESC
Overview
Cíl:
Snížený poměr systolického krevního tlaku měřeného na kotníku a na paži, kotníko-pažní index (KPI) < 0,9, se užívá v diagnostice stenotického postižení tepen dolních končetin. Zároveň však souvisí s výskytem preklinické aterosklerózy i s kardiovaskulární (KV) mortalitou a morbiditou. Zkoumali jsme asociaci mezi sníženým KPI a KV rizikem nemocných s diabetes mellitus 2. typu (DM2).Metodika:
Vyšetřili jsme 253 osob s DM2 (135 mužů a 118 žen) průměrného věku 66 ± 9 let. Kotníkový tlak byl měřen dopplerovskou ultrasonografickou sondou po 5 minutách klidu vleže s přesností na 2 mm Hg, systolický krevní tlak na příslušné paži rtuťovým tonometrem se stejnou přesností a ve stejné poloze. Vysoké KV riziko bylo definováno přítomností KV nemocí, zvýšenými hodnotami kalciového skóre koronárního řečiště dle Agatstona (101 a více), zjištěného počítačovou tomografií, nebo podle globálního KV rizika 5 % a více dle tabulek rizika SCORE.Použité statistické metody:
Wilcoxonův nepárový test, χ2 test, mnohočetná logistická regrese.Výsledky:
Snížený KPI < 0,9 alespoň na jedné straně byl zjištěn u 23 nemocných (9 %), oboustranně u 24 nemocných (9 %); významně častěji byl nalezen u starších mužů (71 ± 8 let) s KV nemocí, s diabetickou nohou nebo s vyšším kalciovým skóre (600 ± 707) (p < 0,01), vyšším celkovým cholesterolem (5,4 ± 1,3 mmol/ l) a celkovým homocysteinem (17,2 ± 7,1 µmol/l) (p < 0,05), ve srovnání s nemocnými s KPI ≥ 0,9 (věk 66 ± 9 let, kalciové skóre 234 ± 458, celkový cholesterol 5,0 ± 0,9, celkový homocystein 14,3 ± 7,8). S KPI < 0,9 korelovala řada KV i metabolických rizikových faktorů; v pozitivní nezávislé asociaci zůstal věk (p < 0,001), kouření (p < 0,01), LDL-cholesterol, kalciové skóre a celkový plazmatický homocystein (p < 0,05). Snížený KPI < 0,9 významně predikoval ischemickou cévní mozkovou příhodu v následujících 3 letech u diabetiků s již přítomnými makrovaskulárními komplikacemi. Hodnota KPI < 0,9 nekorelovala významně s hladinou ultrasenzitivního CRP.Závěr:
Snížený KPI < 0,9 znamená stenotické postižení tepen dolních končetin (aterosklerózou nebo mediokalcinózou). Je ve významné asociaci s vysokým KV rizikem nemocných s DM2. Měření KPI je jednoduchá, neinvazivní, časově nenáročná a levná metoda k detekci subklinické aterosklerózy, která doplňuje standardní metody v predikci KV příhod.Klíčová slova:
kotníko-pažní index – diabetes mellitus – ateroskleróza – kardiovaskulární rizikoÚvod
Ischemická choroba dolních končetin (ICHDK) vzniká na podkladě okluze tepen dolních končetin aterosklerózou. Často se vyskytuje spolu s kardiovaskulárními (KV) a cerebrovaskulárními chorobami a představuje hlavní příčinu pro amputaci dolních končetin, zejména u nemocných s diabetes mellitus (DM). Prevalence ICHDK u DM není přesně známa; ve Framinghamské studii mělo 20 % osob se symptomatickou ICHDK současně DM, nicméně tento údaj je hrubě podhodnocen, protože většina nemocných je asymptomatická [1]. Diagnostika ICHDK pomocí dopplerovského měření krevního tlaku na kotníku a výpočtu kotníko-pažního indexu (KPI) je jednoduchou neinvazivní metodou s 95% senzitivitou a skoro 100% specificitou [2]. Kouření a DM jsou nejvýznamnějšími rizikovými faktory ICHDK. Přítomnost ICHDK, byť asymptomatické, markantně zvyšuje riziko dalších makrovaskulárních příhod. Dalšími rizikovými faktory ICHDK jsou arteriální hypertenze, dyslipidemie, věk, trvání DM, ale také hladina plazmatického homocysteinu, C-reaktivního proteinu stanoveného ultrasenzitivní metodou (hs-CRP) a přítomnost diabetické neuropatie [3]. I proto může být ICHDK u DM s poruchou senzitivity dolních končetin při neuropatii častěji nediagnostikovaná. Diagnóza sníženého KPI, resp. asymptomatické ICHDK u osob s DM, je tedy důležitá pro detekci subklinické aterosklerózy u vysokorizikových nemocných v prevenci makrovaskulárních příhod a také v prevenci amputace dolních končetin u nemocných s DM.
Materiál a metodika
Zkoumaný soubor tvořilo 253 nemocných s diabetes mellitus 2. typu (DM2) diagnostikovaným dle platných doporučení [4]. Všichni tito nemocní jsou pravidelně sledováni v jedné ze 2 odborných diabetologických ambulancí nebo v Centru preventivní kardiologie II. interní kliniky LF a FN v Plzni. Všichni zařazení pacienti vstupovali do sledování po předchozím poučení a dobrovolně, podepsali informovaný souhlas se zařazením do studie a s dlouhodobým sledováním. Nemocní byli vybíráni a zařazováni tak, jak byli zváni do výše jmenovaných ambulancí k pravidelným kontrolám v letech 2005–2006. Všechna níže uvedená vyšetření, kromě počítačové tomografie (CT), byla provedena v týž den; CT bylo provedeno do 6 týdnů od vstupní návštěvy studie. Vyloučeni byli nemocní mladší 35 let, nemocní po akutní KV nebo jiné vaskulární příhodě či intervenci před méně než 3 měsíci před zařazením, nemocní s těžkou hepatopatií (3krát zvýšené AST a ALT) nebo s pankreatitidou, nemocní s pokročilým renálním selháváním (kreatinin > 200 μmol/ l), se známou poruchou kalciofosfátového metabolizmu, nemocní s těžkým srdečním selháním (NYHA III a IV), s maligními nádory, s duševními chorobami a nespolupracující nemocní. Nemocní netrpěli v době vyšetření žádnou interkurentní chorobou. Anamnestické údaje byly získány jednak z dostupné zdravotnické dokumentace, dále pak z dotazníku, který jsme sestavili pro studii, a nemocní jej vyplňovali za pomoci zdravotní sestry. Dotazník byl zaměřen zejména na anamnézu KV chorob a kuřácké návyky. Snažili jsme se zjistit délku trvání DM, dyslipidemie a arteriální hypertenze i specifickou farmakoterapii těchto chorob. Tázali jsme se na jednotlivé makrovaskulární komplikace (klinické formy ischemické choroby srdeční, ICHDK, ischemická cévní mozková příhoda, významná symptomatická stenóza karotických nebo vertebrálních tepen prokázaná zobrazovacími metodami) a mikrovaskulární komplikace DM (neuropatie, nefropatie, postižení oka), na diabetickou nohu a diagnostické či léčebné zákroky s nimi spojené. Pokud výše uvedené údaje nebylo možné získat od nemocného či z dostupné zdravotnické dokumentace, byl jako rok prvozáchytu těchto chorob nebo počátku léčby zvolen rok zařazení do studie.
Příležitostný TK jsme měřili po 5 min klidu vsedě standardním způsobem, to znamená standardizovaným rtuťovým tonometrem s přesností na 2 mm Hg, 2krát po sobě s odstupem 2 min; hodnotu systolického TK (sTK) jsme odečítali v 1. fázi Korotkovových fenoménů a diastolického TK (DTK) v 5. fázi. Použili jsme vypočtený průměr obou TK. Tepová frekvence byla měřena po 5 min klidného sezení po dobu 1/2 min. Měřili jsme tělesnou výšku v cm a hmotnost s přesností na desetiny kg v lehkém oblečení. Byl vypočten body mass index (BMI) v kg. m-2. Ve stoji a ve výdechu, v poloviční vzdálenosti mezi dolním okrajem hrudníku a spina iliaca anterior superior, jsme měřili obvod pasu a v úrovni velkých trochanterů obvod boků. Bylo registrováno klidové 12svodové EKG. Kotníkový tlak jsme měřili dopplerovskou ultrasonografickou sondou (Dopplex Multi TM 8 MHz, Huntleigh, Cardiff, Velká Británie) po 5 min klidu vleže s přesností na 2 mm Hg na obou dolních končetinách. Systolický TK pro výpočet KPI jsme měřili na obou pažích rtuťovým tonometrem se stejnou přesností a ve stejné poloze. Pro výpočet KPI byla použita hodnota sTK z horní končetiny s vyšším sTK. KPI byl vypočten pro obě dolní končetiny a pro další analýzy byla použita končetina s nižší hodnotou, podobně jako ve studii MONICA (Monitoring of Trends and Determinants of Cardiovascular Diseases) [5]. Hodnota KPI < 0,9 je patologicky snížená, naopak KPI > 1,3 je považován za nediagnostický [6]. Dle výsledku KPI byli tedy nemocní rozděleni do 3 skupin.
Nemocným byla odebrána krev a moč v ranních hodinách po 12hodinovém lačnění. Hematologická a biochemická vyšetření byla provedena týž den v laboratoři Ústavu klinické biochemie a hematologie FN v Plzni na Borech. Krev určená k radioimunoanalytickým (RIA) metodám byla centrifugována a plazma byla zamražena a skladována při –70 °C. Vzorky byly poté rozmraženy a analyzovány hromadně v Centrální laboratoři pro imunoanalýzu FN v Plzni. Vzorky byly analyzovány komerčně dostupnými kity. Hodnota LDL-cholesterolu byla vypočítána podle Friedewaldovy rovnice. Pouze u 3 nemocných překročily hodnoty triglyceridů 4,0 mmol/ l, a tak u nich nemohl být LDL-cholesterol vypočten.
U diabetiků bez anamnézy makrovaskulárního onemocnění bylo provedeno, ve spolupráci s Klinikou zobrazovacích metod FN v Plzni, CT srdce s určením kalciového skóre (coronary artery calcium – CAC). Principem vyšetření je nativní vyšetření srdce provedené pomocí prospektivní synchronizace s EKG křivkou s kolimací 1,5 mm, které poskytuje zobrazení koronárních kalcifikací v celém objemu srdce. Pro hodnocení CAC se zhotovují axiální obrazy v diastolické fázi srdečního cyklu. Vyšetření se provádělo na multidetektorovém tomografu Somatom Sensation 64 (Siemens, Forchheim, Německo). Prognostická a diagnostická hodnota vyšetření je určena po elektronickém zpracování za pomoci klasifikace Rumbergera et al z roku 1998 na základě Agatstonova skóre, které určuje KV riziko (0 – velmi nízké riziko, 1–10 – nízké riziko, 11–100 – zvýšené riziko, 101–400 – vysoké riziko, 401 a více – velmi vysoké riziko) [7].
Vysoké KV riziko bylo definováno přítomností KV nemocí (ischemická choroba srdeční, ischemická cévní mozková příhoda, symptomatická stenóza karotid a vertebrálních tepen dle dokumentace), zvýšenými hodnotami CAC (v hodnotách nad 100) nebo podle výskytu standardních KV rizikových faktorů a globálního KV rizika 5 % a více z tabulek rizika SCORE pro Českou republiku [8]. Na konci roku 2009 jsme po asi 3letém sledování analyzovali nově vzniklé diabetické makro - a mikrovaskulární komplikace a sledovali souvislost těchto komplikací se vstupní hodnotou KPI. K analýze kvantitativních veličin byl použit Wilcoxonův nepárový test. U kvalitativních veličin byly vypočteny četnosti a jejich závislosti na sledovaných parametrech byly uvedeny v kontingenčních tabulkách za pomoci χ2 testu.
Výsledky
Vyšetřili jsme 253 osob s DM2 s proporcionálním zastoupením pohlaví (135 mužů a 118 žen) průměrného věku 66 ± 9 let. Většina mužů i žen byla ve věku nad 50 let; pouze 5 mužů a 2 ženy byli ve věku pod 50 let. Celkem 135 nemocných (64 mužů a 71 žen) bylo při vstupu do studie bez jakýchkoli vaskulárních komplikací, 18 nemocných (12 mužů a 6 žen) trpělo pouze makrovaskulárními komplikacemi DM, 61 nemocných (28 mužů a 33 žen) pouze mikrovaskulárními komplikacemi DM a 39 nemocných (31 mužů a 8 žen) oběma typy komplikací současně. Nemocní neměli anamnézu ICHDK ani klaudikace. Přehled průměrných hodnot sledovaných parametrů u mužů a žen (jejich rozdíly jsou hodnoceny nepárovým Wilcoxonovým testem) a u celého sledovaného souboru je uveden v tab. 1. Celkem 95 % nemocných s DM2 mělo zároveň v anamnéze diagnostikovanou arteriální hypertenzi. Mezi pohlavími jsme nenalezli rozdíl ve věku, trvání DM, arteriální hypertenze ani dyslipidemie. Mezi muži bylo statisticky významně více bývalých kuřáků než mezi ženami, ty byly naopak významně častěji nekuřačkami. Obvod pasu byl významně vyšší u mužů než u žen, ale mezi pohlavími jsme nenalezli rozdíl v BMI ani hodnotách příležitostního TK. Hladina celkového i LDL--cholesterolu byla významně vyšší u žen než u mužů, ale muži a ženy se nelišili v hladině HDL-cholesterolu ani v počtu aterogenních částic, to jest v hodnotě apolipoproteinu B, ani v koncentraci triglyceridů či lipoproteinu(a). Ženy měly významně vyšší průměrnou hladinu fibrinogenu a vyšší hodnoty hs-CRP než muži. Muži měli významně vyšší hladinu kyseliny močové. Nenalezli jsme rozdíly v hladinách urey, kreatininu, glykemie, glykovaného hemoglobinu HbA1c, homocysteinu ani v odpadu bílkoviny do moči či HOMA (homeostatis model assessment) indexu. Ve sledovaném souboru užívalo 95 % nemocných antihypertenziva, z toho 90 % sartany nebo inhibitory angiotenzin konvertujícího enzymu, a pouze 60 % diabetiků užívalo statiny a 4 % fibráty. V souboru byla velká rezerva v kontrole klasických rizikových faktorů, jak jsme publikovali dříve [9].
Table 1. Rizikové faktory u nemocných s diabetem 2. typu u mužů a u žen (rozdíl stanoven Wilcoxonovým nepárovým testem) a v celém souboru. 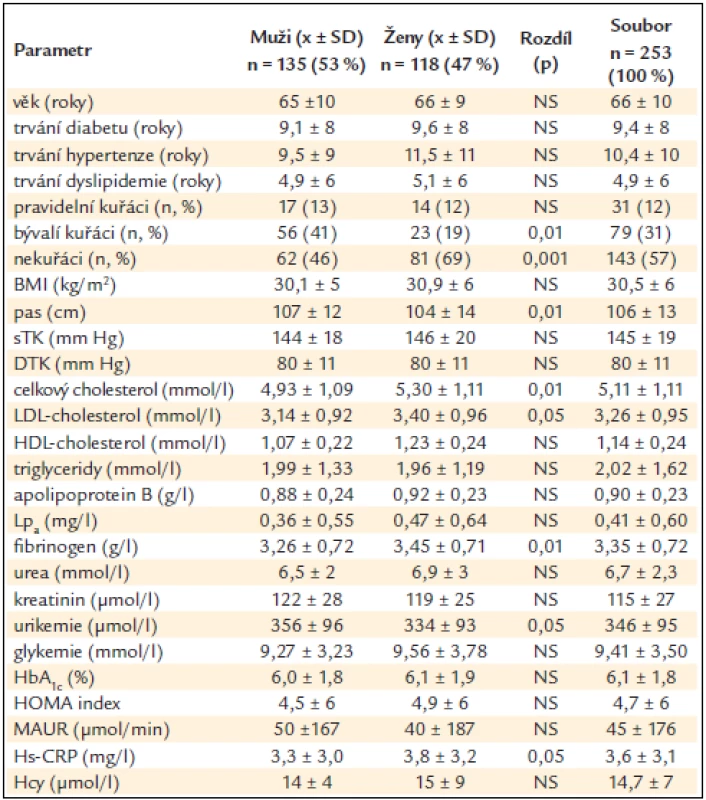
BMI – body mass index, sTK – systolický krevní tlak, DTK – diastolický krevní tlak, Lpa – lipoprotein malé „a“, HbA1c – glykovaný hemoglobin, HOMA index – homeostatis model assessment = lačná glykemie × lačný IRI/22,5 (index inzulinové rezistence), MAUR – mikroalbuminurie, HsCRP – C-reaktivní protein stanovený ultrasenzitivní metodou, Hcy – celkový homocystein v séru, NS – non-signifikantní tj. statisticky nevýznamný, x ± SD – průměr ± standard deviation (standardní odchylka) Nemocní byli rozděleni do jednotlivých skupin dle hodnoty KPI, vzhledem k malému počtu nemocných bez dalšího dělení podle pohlaví, jak ukazuje graf 1; snížený KPI byl diagnostikován u 18 % souboru. Vzhledem k tomu, že nemocní s nediagnostickým KPI tvořili nesourodou skupinu, ale ve sledovaných veličinách se statisticky významně nelišili od nemocných s normálním KPI, nejsou v dalších analýzách uváděni. Hodnota KPI neměla souvislost s užívanou farmakoterapií. Nemocní se sníženým KPI měli statisticky významně častěji anamnézu sledovaných makrovaskulárních komplikací – srdečního infarktu, ischemické choroby srdeční a diabetické nohy (p < 0,001). U nemocných s makrovaskulárními komplikacemi a sníženým KPI vznikla nová ischemická cévní mozková příhoda a symptomatická stenóza karotid v průběhu 3 let sledování častěji než u nemocných s makrovaskulárními komplikacemi a normálním KPI a nemocných bez makrovaskulárních komplikací se sníženým KPI. Mezi nemocnými se sníženým KPI byl větší počet kuřáků a bývalých kuřáků než mezi nemocnými s normálním KPI, ale trend nedosáhl statistické významnosti. Tab. 2 ukazuje souvislosti KPI a některých sledovaných anamnestických a antropometrických údajů. Mezi skupinou nemocných se sníženým a normálním KPI byl nalezen statisticky významný rozdíl v zastoupení pohlaví – muži měli častěji nižší KPI než ženy (p < 0,05). Nemocní se sníženým KPI byli statisticky významně starší než nemocní s normálním KPI (p < 0,01). Nebyly nalezeny rozdíly v BMI, obvodu pasu, sTK, DTK, pulzním tlaku ani tepové frekvenci.
Graph 1. Hodnoty KPI v souboru (%, n muži/ženy). 
Table 2. Vztah hodnoty KPI a některých anamnestických a antropometrických ukazatelů (rozdíl stanoven Wilcoxonovým nepárovým testem). 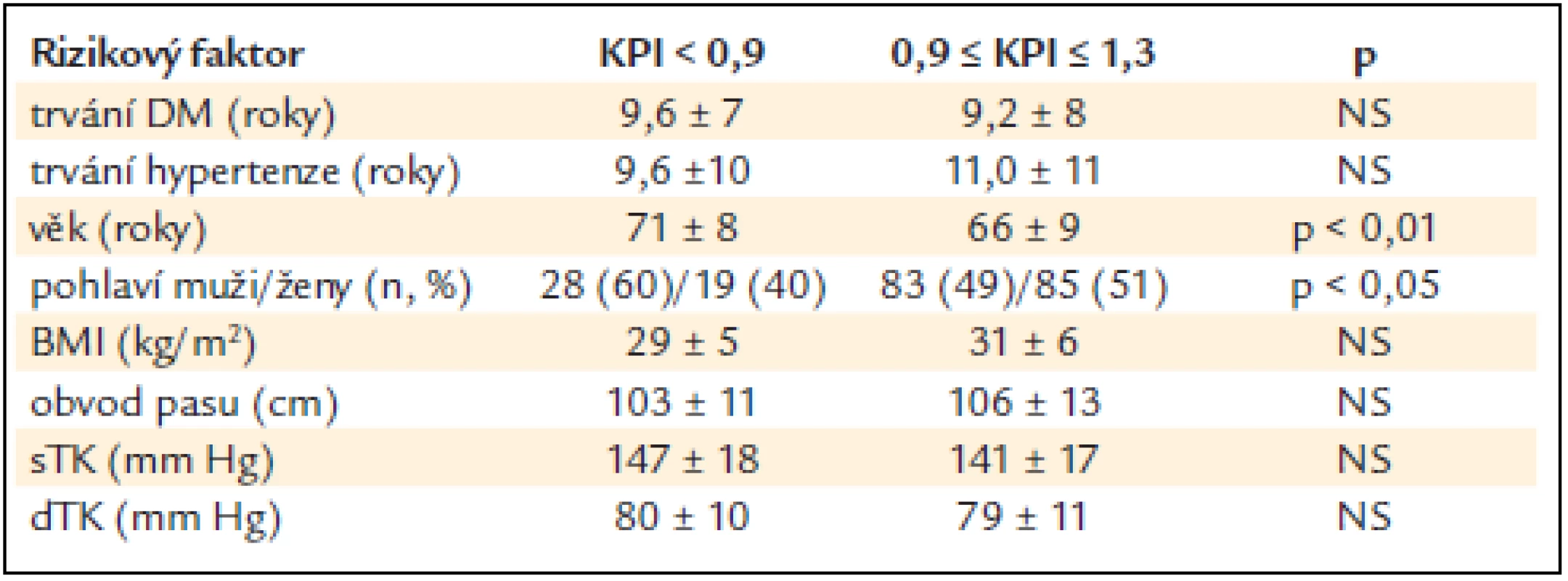
KPI – kotníko-pažní index, DM – diabetes mellitus, BMI – body mass index, sTK – systolický krevní tlak, dTK – diastolický krevní tlak, NS – non-signifikantní, tj. statisticky nevýznamný, x ± SD – průměr ± standard deviation (standardní odchylka) Tab. 3 ukazuje vztah KPI k některým laboratorním ukazatelům a k CAC. Nemocní se sníženým KPI měli statisticky významně vyšší hladinu celkového cholesterolu (p < 0,05) a byl naznačen trend i k vyšší hladině LDL-cholesterolu a apoliporoteinu B. Nelišili se v hodnotách triglyceridů a HDL-cholesterolu, glykemie nalačno ani hs-CRP. Nemocní se sníženým KPI měli statisticky významně vyšší hodnoty CAC (p < 0,01). Snížený KPI alespoň na jedné končetině statisticky významně pozitivně koreloval s věkem, sTK, hladinou celkového i LDL-cholesterolu, apolipoproteinu B, glykemií nalačno, celkovým homocysteinem a CAC (p < 0,05) (tab. 4). Při použití mnohočetné logistické regrese, kdy byly nezávislou proměnnou jednotlivé rizikové faktory, zůstaly v nezávislé asociaci se sníženým KPI věk (p < 0,001), kouření (p < 0,01), LDL-cholesterol, CAC a celkový homocystein (p < 0,05) (tab. 5).
Table 3. Vztah hodnoty KPI a některých laboratorních ukazatelů a CAC (rozdíl stanoven Wilcoxonovým nepárovým testem). 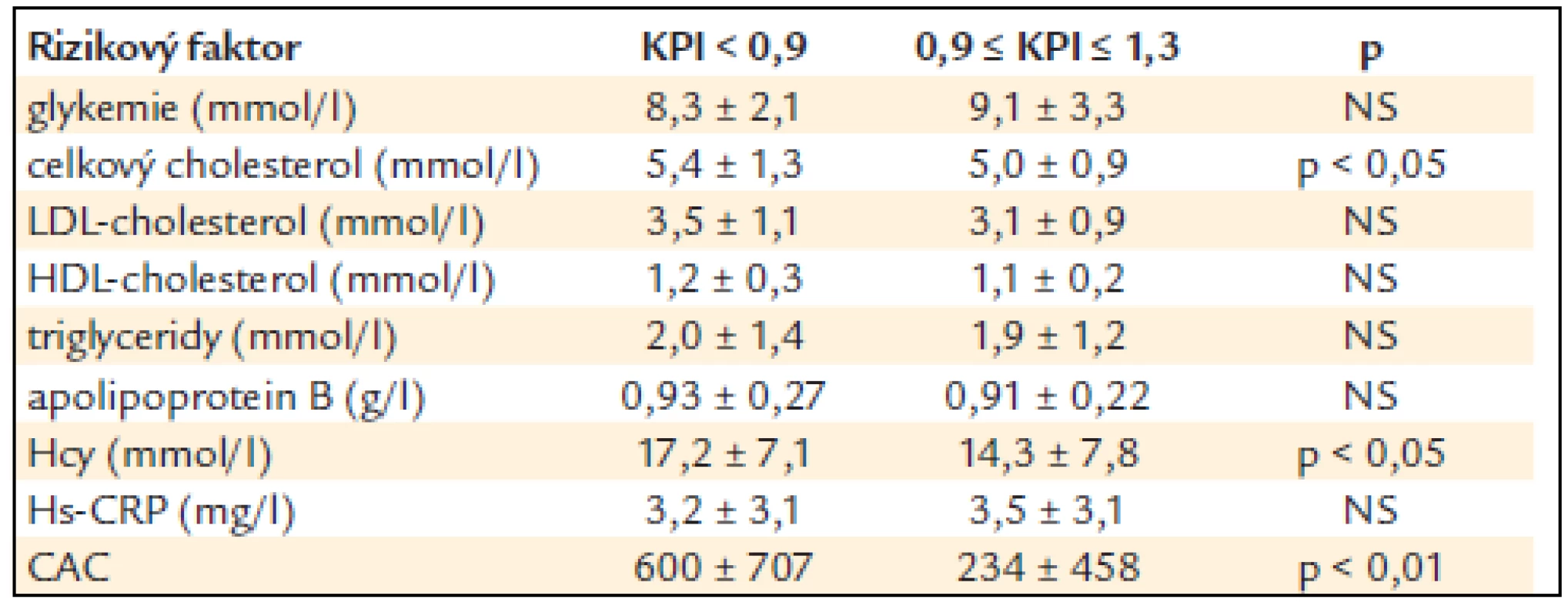
KPI – kotníko-pažní index, Hs-CRP – C-reaktivní protein stanovený ultrasenzitivní metodou, Hcy – celkový homocystein v séru, CAC – kalciové skóre srdce, NS – non-signifikantní, tj. statisticky nevýznamný, x ± SD – průměr ± standard deviation (standardní odchylka) Table 4. Pořadová korelace KPI < 0,9 alespoň na jedné dolní končetině s ostatními rizikovými faktory. 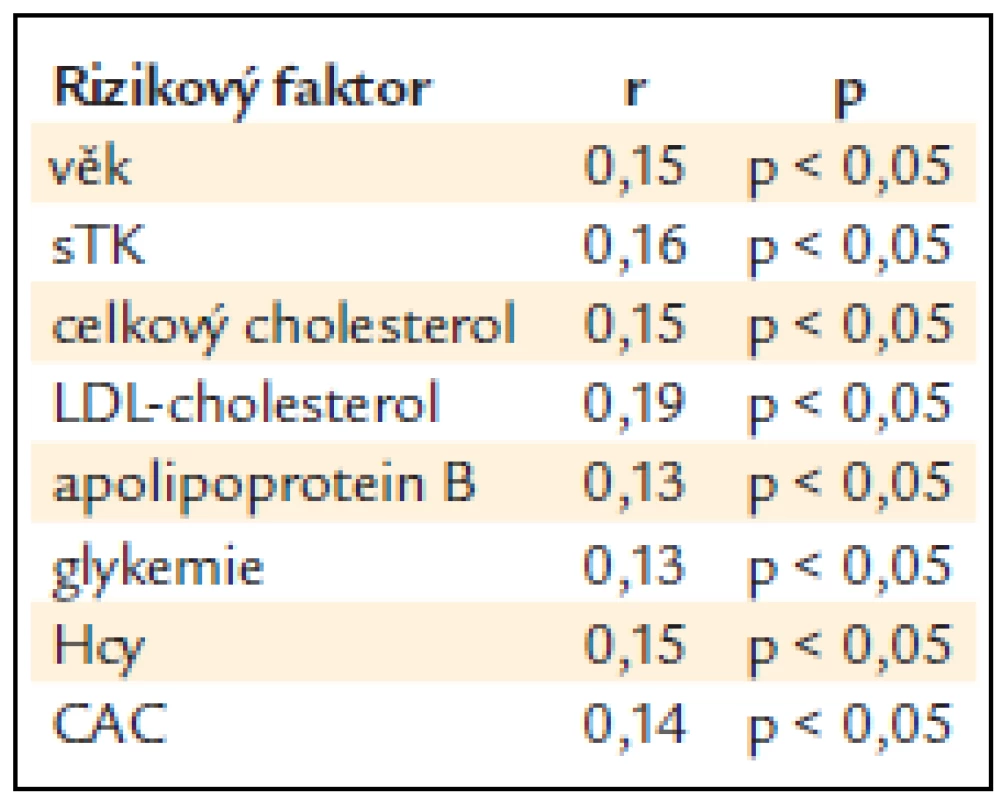
r – korelační koeficient, KPI – kotníko-pažní index, sTK – systolický krevní tlak, Hcy – celkový homocystein v séru, CAC – kalciové skóre srdce Table 5. Nezávislá asociace nižšího KPI s KV rizikovými faktory u diabetiků 2. typu (mnohočetná logistická regrese – step wise model). 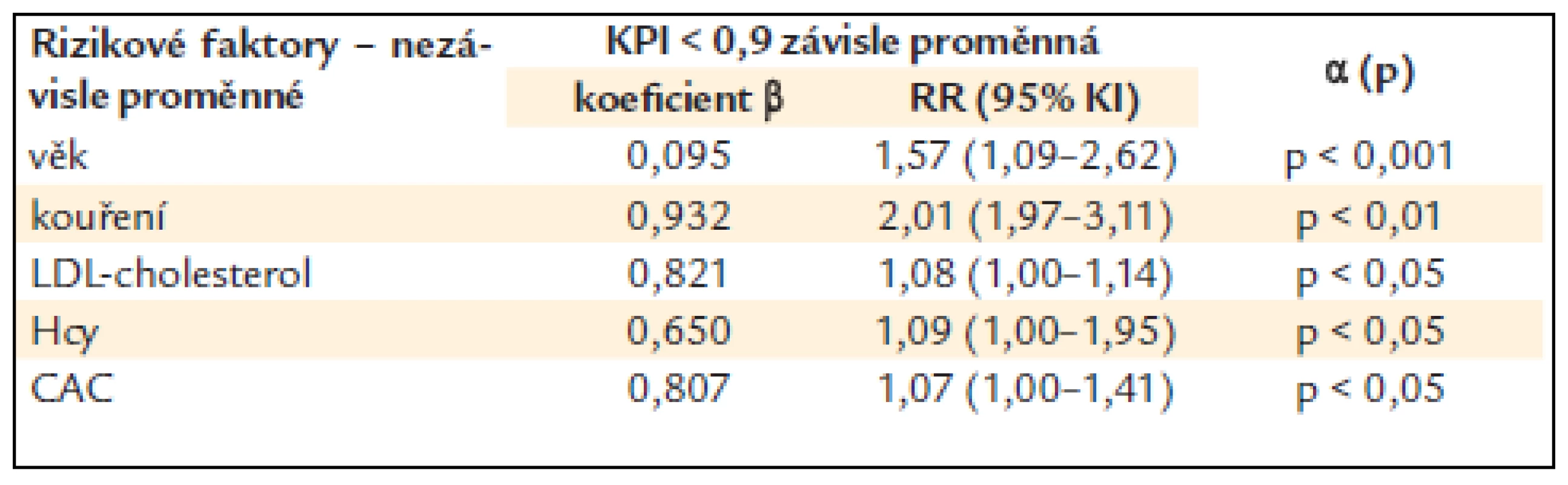
KPI – kotníko-pažní index, RR (95% KI) – relativní riziko, 95% konfidenční interval, Hcy – celkový homocystein v séru, CAC – kalciové skóre srdce Diskuze
V našem souboru nemocných s DM2 s celkově neuspokojivou kompenzací KV rizikových faktorů [9] činila prevalence asymptomatické ICHDK 18 %. Snížený KPI se vyskytoval hlavně u starších mužů s KV nemocí, s diabetickou nohou nebo s vyšším CAC. S nízkým KPI korelovala řada KV i metabolických rizikových faktorů; v pozitivní nezávislé asociaci zůstal věk, kouření, LDL-cholesterol, vyšší CAC a celkový plazmatický homocystein. Snížený KPI významně predikoval u osob s manifestní aterosklerózou, ischemickou cévní mozkovou příhodu a významnou stenózu extrakraniálních tepen v následujících 3 letech.
Prevalence ICHDK se v různých studiích liší a závisí na celkovém KV riziku zkoumané populace. V podobném souboru nemocných starších 55 let hospitalizovaných na různých interních odděleních a na neurologii byla prevalence asymptomatické ICHDK 41 % [10]. Naše prevalence nízkého KPI odpovídá prevalenci v podstudii americké Cardiovascular Health Study, kde byla prevalence sníženého KPI u podobně rizikové populace ve věku nad 65 let 19,8 % [11].
Relativně velká část nemocných v naší studii (7 %) měla nediagnostický KPI > 1,3. V obecné populaci ve věku 25–74 let je ve studii post MONICA udávána prevalence KPI > 1,3 jen u 4 % [12]. Nemocní s DM však častěji trpí mediokalcinózou, a proto je u nich prevalence nediagnostického KPI vyšší. Některé studie uvádějí, že hodnoty KPI > 1,3 mohou být spojeny s vyšším KV rizikem a také s větší pravděpodobností rozvoje renálního selhání [13,14]. Do naší studie nebyli zařazeni nemocní s pokročilým renálním selháváním a ani rozdíl v renálních parametrech mezi skupinou se sníženým a normálním KPI ve srovnání se skupinou s nediagnostickým KPI nebyl významný. Nemocní ve skupině s nediagnostickým KPI byli svým rizikovým profilem podobní nemocným s normálním KPI, ale k upřesnění rizika i stavu cirkulace by u nich bylo vhodné doplnit měření palcových tlaků.
Snížený KPI statisticky významně pozitivně koreloval s hodnotou sTK. Hodnota sTK byla u nemocných se sníženým KPI vyšší než u nemocných s normálním KPI (s trendem ke statistické významnosti). Skupiny se vzájemně nelišily v hodnotě DTK (v průměru 80 mm Hg), to znamená, že ve skupině nemocných se sníženým KPI se jednalo převážně o osoby s izolovanou systolickou hypertenzí a vyšším pulzním tlakem. Významnou pozitivní asociaci hodnot sTK a pulzního tlaku u hypertoniků s DM2 nalezli i jiní autoři [15,16]. Nenalezli jsme souvislost hodnot KPI a hs-CRP. Nepřítomnost rozdílu v hodnotách hs-CRP dle hodnoty KPI by se dala hypoteticky vysvětlit výběrem tak rizikové populace, že snížený KPI v ní již neměl na hs-CRP další signifikantní vliv.
Nemocní se sníženým KPI a již přítomnými makrovaskulárními komplikacemi měli v následném 3letém sledování statisticky významně vyšší pravděpodobnost vzniku cerebrovaskulární příhody nebo symptomatické stenózy extrakraniálních tepen. Vyšší incidence nových vaskulárních příhod u nemocných s již přítomnými makrovaskulárními komplikacemi a sníženým KPI byla prokázána i v jiných studiích u nemocných bez DM2 [17], ale u nemocných s DM2 nebyla přesvědčivě prokázána [18]. Naše zjištění nicméně podporuje fakt, že nemocní s DM2 a makrovaskulárními komplikacemi, a navíc se sníženým KPI, tvoří, oproti nemocným s DM2, makrovaskulárními komplikacemi a normálním KPI, nejrizikovější skupinu, které by měla být věnována maximální farmakologická i nefarmakologická intervence.
Naše výsledky také potvrzují, že stanovení KPI má smysl i ve stratifikaci KV rizika u vysoce rizikových nemocných, jakými jsou naši nemocní s DM2 a makrovaskulárními komplikacemi. Nemocní se sníženým KPI měli statisticky významně vyšší hladinu celkového cholesterolu (p < 0,05) a byl naznačen trend i k vyšší hladině LDL-cholesterolu a apolipoproteinu B, přestože nebyl přítomen rozdíl v léčbě statiny. Právě tato nejrizikovější skupina diabetiků by měla být léčena co nejpřísněji a léčeny by měly být především standardní rizikové faktory, to jest cholesterol, respektive LDL-cholesterol a kouření.
V celém souboru našich diabetiků bylo pouze 60 % z nich léčeno statiny, bez rozdílu v anamnéze makrovaskulárních komplikací. Otázkou zůstává i adherence nemocných k medikamentózní léčbě, která většinou v dlouhodobém horizontu klesá. Kouření je u všech nemocných v sekundární prevenci KV chorob věnována malá pozornost a přitom je známo, že kuřáci jsou schopni kouření sami zanechat pouze ve 3 % z těch, kteří chtějí přestat kouřit. Kouření je nemoc a odvykání by se měla věnovat větší pozornost [19].
Negativní nezávislá asociace KPI a hladin celkového homocysteinu a CAC ukazuje, že oba markery jsou významné z hlediska prognózy nemocných s DM2 [20,21]. Z intervenčních studií je známo, že léčba vyšších hladin homocysteinu (kombinací folátů a vitaminů skupiny B) nemá významný vliv na snížení KV rizika [22]. Vyšetření CAC má být indikováno u asymptomatických osob s intermediárním KV rizikem nebo u osob s nízkým KV rizikem a pozitivní rodinnou anamnézou časné manifestace aterosklerózy [23]. Nezodpovězenou zůstává stále otázka, zda by měli být asymptomatičtí nemocní s vysokým CAC vyšetřeni koronární angiografií nebo jinými zobrazovacími metodami za účelem ujasnění vysokého rizika koronárních příhod. Negativní a nízké CAC (1–10) mají každopádně vysokou negativní prediktivní hodnotu pro přítomnost významné koronární stenózy [24]. Asymptomatické osoby s CAC > 400 mohou v rozhodování o dalším postupu profitovat z provedení zátěžových metod nukleární kardiologie, stejně jako asymptomatické osoby s CAC 100–400, které mají vysoké KV riziko [25]. Podle stanoviska American Heart Association z roku 2006 by mělo být vyšetření CAC u asymptomatických osob užito pouze ke stratifikaci KV rizika a nikoli k okamžité indikaci CT angiografie (CTAG) nebo koronární angiografie [26]. Konsenzus odborných společností „Appropriate Use Criteria for Cardiac Computed Tomography“ z roku 2010 neuvádí žádné informace o indikaci CTAG na základě hodnot CAC u asymptomatických osob. V konsenzu není CTAG doporučeno ve stratifikaci KV rizika u osob s nízkým a středním KV rizikem a přínos CTAG u osob ve vysokém KV riziku je nejasný; vyšetření s sebou navíc nese vyšší radiační zátěž a nutnost aplikace kontrastní látky [23].
Závěry
Stanovení KPI je levná, rychlá, jednoduchá a účelná metoda ke zjištění postižení tepen dolních končetin, ale také k diagnostice preklinické aterosklerózy a k upřesnění KV rizika v primární prevenci aterosklerotických vaskulárních nemocí. Naše studie prokázala, že také nemocní s DM2 mají rozdílné KV riziko a že snížený KPI < 0,9, který se vyskytoval u 18 % nemocných, navyšuje toto riziko. Snížený KPI byl významně častější u starších mužů s DM2, kteří již měli v anamnéze makrovaskulární komplikace. Největším přínosem této studie bylo zjištění, že i tito vysoce rizikoví nemocní s DM2 a KV nemocí se lišili v prognóze podle KPI: ti s nízkým KPI měli vyšší výskyt nové ischemické cévní mozkové příhody a symptomatické stenózy karotid v následujících 3 letech. Důležitými výstupy studie bylo zaprvé potvrzení, že věk, kouření a hladina LDL-cholesterolu, tedy standardní rizikové faktory pro aterosklerózu a její komplikace, významně ovlivňovaly snížený KPI. Dalším výstupem studie je fakt, že i hladina celkového plazmatického homocysteinu a vysoké kalciové skóre srdečních tepen byly nezávislými prediktory pro nízký KPI, a tedy i pro vysoké riziko vzniku dalších aterosklerotických příhod.
Snížený KPI < 0,9 významně stratifikuje KV riziko u nemocných s DM2. Diabetici se sníženým KPI by měli být ještě intenzivněji léčeni z hlediska všech přítomných rizikových faktorů, a to především se zaměřením na snížení LDL-cholesterolu a odvykání kouření.
MUDr. Barbora Nussbaumerová, Ph.D.
www.fnplzen.cz
e-mail: nussbaumerova@fnplzen.czDoručeno do redakce: 13. 1.2011
Sources
1. Murabito JM, D’Agostino RB, Silbershatz H et al. Intermittent claudication: a risk profile from the Framingham Heart Study. Circulation 1997; 96 : 44–49.
2. Bernstein EF, Fronek A. Current status of non-invasive tests in the diagnosis of peripheral arterial disease. Surg Clin North Am 1982; 62 : 473–487.
3. Criqui MH. Peripheral arterial disease: epidemiological aspects. Vasc Med 2001; 6 (Suppl 3): 3–7.
4. http://www.diab.cz/modules/Standardy/dm2_2009.pdf
5. Wohlfahrt P, Palouš D, Inglischová M et al. Ankle-brachial index is associeated with increased aortic pulse wave velocity. The post-MONICA study. Eur Heart J 2011; přijato k tisku.
6. Bulvas M. Doporučení pro diagnostiku a léčbu ischemické choroby dolních končetin. Cor Vasa 2009; 51 : 145–163.
7. Agatston AS, Janowitz WR, Hildner FJ et al. Quantification of coronary artery calcium using ultrafast computed tomography. J Am Coll Cardiol 1990; 15 : 827.
8. Vaverková H, Soška V, Rosolová H et al. Doporučení pro diagnostiku a léčbu dyslipidemií v dospělosti, vypracované výborem České společnosti pro aterosklerózu. Vnitř Lék 2007; 53 : 181–187.
9. Petrlová B, Rosolová H, Šimon J et al. Kontrola kardiovaskulárních rizikových faktorů u diabetiků 2. typu. Vnitř Lék 2009; 55 : 512–818.
10. Mourad JJ, Cacoub P, Collet JP et al. ELLIPSE scientific committee and study investigators. Screening of unrecognized peripheral arterial disease (PAD) using ankle-brachial index in high cardiovascular risk patients free from symptomatic PAD. J Vasc Surg 2009; 50 : 572–580.
11. Newman AB, Siscovick SD, Manolio TA et al. Cardiovascular Heart Study (CHS) Collaborative Research Group. Ankle-arm index as a marker of atherosclerosis in the Cardiovascular Health Study. Circulation 1993; 88; 837–845.
12. Lamina C, Meisinger C, Heid IM et al. KORA Study Group. Association of ankle-brachial index and plaques in the carotid and femoral arteries with cardiovascular events and total mortality in a population-based study with 13 years of follow-up. Eur Heart J 2006; 27 : 2580–2587.
13. Criqui MH, McClelland RL, McDermott MM et al. The ankle-brachial index and incident cardiovascular events in the MESA (Multi-Ethnic Study of Atherosclerosis). J Am Coll Cardiol 2010; 56 : 1506–1512.
14. Liu H, Shi H, Yu J et al. Is Chronic Kidney Disease Associated with a High Ankle Brachial Index in Adults at High Cardiovascular Risk? J Atheroscler Thromb 2010; Nov 25. [Epub ahead of print].
15. Korhonen PE, Syvänen KT, Vesalainen RK et al. Ankle-brachial index is lower in hypertensive than in normotensive individuals in a cardiovascular risk population. J Hypertens 2009; 27 : 2036–2043.
16. Tseng CH, Chong CK, Lin BJ et al. Atherosclerotic risk factors for peripheral vascular disease in non-insulin-dependent diabetic patients. J Formos Med Assoc 1994; 93 : 663–667.
17. Agnelli G, Cimminiello C, Meneghetti G et al. Polyvascular Atherothrombosis Observational Survey (PATHOS) Investigators. Low ankle-brachial index predicts an adverse 1-year outcome after acute coronary and cerebrovascular events. J Thromb Haemost 2006; 4 : 2599–2606.
18. Mostaza JM, Manzano L, Suarez C et al. Different prognostic value of silent peripheral artery disease in type 2 diabetic and non-diabetic subjects with stable cardiovascular disease. Atherosclerosis 2010, 214 : 191–195.
19. Králíková E, Býma S, Cífková R et al. Doporučení pro léčbu závislosti na tabáku. Čas Lék Čes 2005; 144 : 327–333.
20. Graham IM, Daly LE, Refsum HM et al. Plasma homocysteine as a risk factor for vascular disease. The European Concerted Action Project. JAMA 1997; 277 : 1775–1781.
21. Elkeles RS, Godsland IF, Feher MD et al. PREDICT Study Group. Coronary calcium measurement improves prediction of cardiovascular events in asymptomatic patients with type 2 diabetes: the PREDICT study. Eur Heart J 2008; 29 : 2244–2251.
22. Clarke R, Halsey J, Lewington S et al. B-Vitamin Treatment Trialists’ Collaboration. Effects of lowering homocysteine levels with B vitamins on cardiovascular disease, cancer, and cause-specific mortality: Meta-analysis of 8 randomized trials involving 37 485 individuals. Arch Intern Med 2010; 170 : 1622–1631.
23. Taylor AJ, Cerqueira M, Hodgson JM et al. ACCF/SCCT/ACR/AHA/ASE/ASNC//NASCI/SCAI/SCMR 2010 Appropriate Use Criteria for Cardiac Computed Tomography: A Report of the American College of Cardiology Foundation Appropriate Use Criteria Task Force, the Society of Cardiovascular Computed Tomography, the American College of Radiology, the American Heart Association, the American Society of Echocardiography, the American Society of Nuclear Cardiology, the North American Society for Cardiovascular Imaging, the Society for Cardiovascular Angiography and Interventions, and the Society for Cardiovascular Magnetic Resonance. Circulation 2010; 122: e525–e555.
24. Budoff MJ, McClelland RL, Nasir K et al. Cardiovascular events with absent or minimal coronary calcification: the Multi-Ethnic Study of Atherosclerosis (MESA). Am Heart J 2009; 158 : 554–561.
25. Hendel RC, Berman DS, Di Carli MF et al. American College of Cardiology Foundation Appropriate Use Criteria Task Force; American Society of Nuclear Cardiology; American College of Radiology; American Heart Association; American Society of Echocardiography; Society of Cardiovascular Computed Tomography; Society for Cardiovascular Magnetic Resonance; Society of Nuclear Medicine. ACCF/ASNC//ACR/AHA/ASE/SCCT/SCMR/SNM 2009 appropriate use criteria for cardiac radionuclide imaging: a report of the American College of Cardiology Foundation Appropriate Use Criteria Task Force, the American Society of Nuclear Cardiology, the American College of Radiology, the American Heart Association, the American Society of Echocardiography, the Society of Cardiovascular Computed Tomography, the Society for Cardiovascular Magnetic Resonance, and the Society of Nuclear Medicine. Circulation 2009; 119: e561–e587.
26. Budoff MJ, Achenbach S, Blumenthal RS et al. American Heart Association Committee on Cardiovascular Imaging and Intervention; American Heart Association Council on Cardiovascular Radiology and Intervention; American Heart Association Committee on Cardiac Imaging, Council on Clinical Cardiology. Assessment of Coronary Artery Disease by Cardiac Computed Tomography: A Scientific Statement From the American Heart Association Committee on Cardiovascular Imaging and Intervention, Council on Cardiovascular Radiology and Intervention, and Committee on Cardiac Imaging, Council on Clinical Cardiology. Circulation 2006; 114; 1761–1791.
Labels
Diabetology Endocrinology Internal medicine
Article was published inInternal Medicine

2011 Issue 3-
All articles in this issue
- Interna a kardiologie, internisté a kardiologové
- Systolický wall stress ľavej komory srdca pri antihypertenzívnej liečbe
- Dyslipidemie a obezita 2011. Jak spolu souvisejí a v čem se liší
- Autoimunitní pankreatitida a IgG pozitivní sklerotizující cholangitida
- Výskyt aterogénnej dyslipidémie vo vzorke asymptomatických probandov vyšetrením pomocou metódy Lipoprint
- Zevní vlivy podmiňující vznik nádorů nebo ochraňující před jejich vznikem
- Vyskytují se v medicíně „módní“ choroby?
- Rostoucí problém – lidský papilomavirus a nádory hlavy/krku
- Mikroalbuminurie. Od diabetu ke kardiovaskulárnímu riziku
- Kotníko-pažní index u nemocných s diabetes mellitus 2. typu
- Trombohemoragický syndrom u nemocných s myeloproliferativním onemocněním s trombocytemií
- Reziduální riziko kardiovaskulárních komplikací a jeho snížení kombinací hypolipidemik
- Síť komplexních onkologických center České republiky
- Variabilita krevního tlaku a arteriální hypertenze
- Internal Medicine
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Mikroalbuminurie. Od diabetu ke kardiovaskulárnímu riziku
- Zevní vlivy podmiňující vznik nádorů nebo ochraňující před jejich vznikem
- Interna a kardiologie, internisté a kardiologové
- Systolický wall stress ľavej komory srdca pri antihypertenzívnej liečbe
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

