-
Medical journals
- Career
Plicní hypertenze – neobvyklá komplikace hemolýzy a syndromu bakteriálního přerůstání
Authors: V. Kojecký; M. Lukaštíková
Authors‘ workplace: Interní klinika IPVZ Praha, Krajská nemocnice T. Bati, a. s., Zlín, přednosta doc. MU Dr. Čestmír Čihalík, CSc.
Published in: Vnitř Lék 2010; 56(6): 513-516
Category: Case Reports
Overview
Autoři popisují případ nemocného s celiakií, u něhož došlo k rozvoji sekundárního bakteriálního přerůstání v tenkém střevě. Konzumpční deficit vitaminu B12 a kyseliny listové byl spojen s rozvojem makrocytární anémie a neimunitní hemolýzou. Během několika týdnů se rozvinula klinicky významná plicní hypertenze, jejíž příčina nebyla zprvu jasná. Po léčbě bakteriálního přerůstání, substituci vitaminu B12 a později i kyseliny listové vymizela hemolýza i plicní hypertenze. Retrospektivně autoři dovozují, že mohlo jít o syndrom plicní hypertenze spojené s hemolýzou.
Klíčová slova:
plicní hypertenze – hemolýza – celiakieÚvod
Plicní hypertenze, zvláště ve vyšším věku, není vzácná. Setkává se s ní především kardiolog, na jehož bedra obvykle další upřesnění příčiny padne. Diferenciální diagnóza se zaměřuje na vyloučení tromboembolické choroby, chlopenních a zkratových vad, hypoxemizujícího plicního onemocnění. Nemocí, u nichž se může plicní hypertenze objevit, je mnohem více, např. cirhóza jaterní s portální hypertenzí, myeloproliferativní onemocnění, kolagenózy. V posledním desetiletí přibývají informace o plicní hypertenzi provázející hemolytické stavy.
Popis případu
67letý pacient s chronickou pankreatitidou (po opakovaných atakách akutní pankreatitidy před léty), s celiakií, byl odeslán k hospitalizaci pro váhový úbytek, dušnost, slabost, častější řídké stolice, vzniklé během posledních 3 měsíců. Při objektivním vyšetření byl patrný subikterus kůže, bledost sliznic, astenie, meteorizmus břicha. Laboratorní screening potvrdil makrocytární anémii (Hb 83 g/ l, objem erytrocytu 114 fl) s leukopenií (3,3 × 109/ l) při normálním počtu trombocytů a nekonjugovanou hyperbilirubinemii (49 μmol/ l). Dále byla zjištěna hypokalcemie (2,12 mmol/ l) a hraniční albuminemie (30,5 g/ l). Sérový ferritin byl normální (89 μg/ l). Nízká hladina haptoglobinu (0,03 g/ l) ukazovala na probíhající hemolýzu, což vysvětlovalo nekonjugovanou hyperbilirubinemii. Imunní původ hemolýzy se nepotvrdil. Megaloblastová přestavba hemopoézy v kostní dřeni spolu s nízkou hladinou vitaminu B12 (16 pmol/ l) nás zprvu vedla k podezření na perniciózní anémii se sekundární hemolýzou. K našemu překvapení však nebyly achlorhydrie ani atrofická gastritida v žaludku potvrzeny.
Laboratorní nálezy (hypokalcemie, hypalbuminemie) byly podezřelé z malabsorpce. Další vyšetření jsme proto zaměřili tímto směrem. Sliznice duodena už makroskopicky neměla normální vzhled a změny odpovídající floridní celiakii (stadium Marsh 3) potvrdily bioptické vzorky. Pacient i jeho manželka popírali dietní chyby, které by vedly k expozici lepkem. Pravdivost jejich tvrzení následně potvrdily negativní protilátky proti transglutamináze a gliadinu. Při známé diagnóze mnohaleté celiakie jsme se snažili o vyloučení jejích pozdních komplikací, především střevního lymfomu, karcinomu tenkého střeva, které mohou malabsorpční syndrom imitovat. Enteroklýza na tenkém střevě neodhalila jinou patologii než hypotonii kliček, jaká provází floridní celiakii (obr. 1). CT břicha též nepřineslo rozuzlení. Lymfatické uzliny mezenteria byly mírně zmnožené, ale neměly charakter patologické lymfadenopatie, β2 - mikroglobulin byl nízký. Stolice na parazity (Ascaris, Lamblie) byla negativní. Vyloučili jsme hypogamaglobulinemii. V úvahu pak přicházela diagnóza refrakterní sprue. Do jejího klinického obrazu však nepatří deficit vitaminu B12 s neimunitní hemolýzou, proto jsme tuto variantu zatím nedošetřovali. U nemocného bylo přítomno více patologií, které do sebe jasně nezapadaly – deficit vitaminu B12, neimunitní hemolytická anémie, malabsorpce nejasné příčiny. Po shrnutí nálezů bylo jasné, že nedostatek vitaminu B12 bude konzumpčního původu. Hypotetickou příčinou je chronická pankreatitida (porucha štěpení R faktoru při zevně sekretorické insuficienci pankreatu). Nejčastěji jde o zvýšenou spotřebu vitaminu zmnoženou střevní flórou. Pacient měl dva faktory disponující k bakteriálnímu přerůstání, chronickou pankreatitidu a celiakii. Bakteriální přerůstání v tenkém střevě může imitovat i histologický obraz celiakie. Naše pracovní diagnóza tedy zněla – syndrom bakteriálního přerůstání. Další možnosti k jejímu potvrzení (dechový test) jsme neměli, proto jsme zahájili terapeutický test antibiotikem, rifaximinem, za substituce vitaminu B12. Do týdne se objevila retikulocytóza v krevním obraze se vzestupem hemoglobinu a pacient byl propuštěn. Při ambulantní kontrole za 6 týdnů se nemocný cítil spíše hůře. Po léčbě rifaximinem se sice zmenšil pocit distenze břicha, klesl počet stolic, nově se objevila námahová, později i noční ortopnoická dušnost a otoky dolních končetin. Při objektivním vyšetření byl na první pohled stále patrný subikterus, přibyly měkké otoky nohou po kolena. Trvala hemolytická anémie (Hb 92 g/ l, nekonjugovaný bilirubin 41 μmol/ l, haptoglobin 0,02 g/ l), zvětšila se makrocytóza (MCV 125 fl). To všechno vzdor normální hladině vitaminu B12. Na RTG hrudníku byl patrný oboustranný malý fluidotorax. Stupeň anémie dušnost nevysvětloval. Fluidotorax, otoky končetin, městnání v jaterních žilách, patrné při sonografii, budily dojem dušnosti kardiálního původu. Klidová tachykardie nebyla přítomna (84 tepů/ min), stejně jako městnání na RTG plic. TK 120/ 85 mm Hg. Echokardiograficky byla velikost i funkce levé komory normální (EF LK 0,65), bez chlopenní či zkratové vady. Překvapením byl nález dilatované pravé komory (RVDd 31 mm, RVDs 18 mm) a dilatace pravé síně se středně těžkou trikuspidální regurgitací (systolický gradient 70 mm Hg). Plicní hypertenze vysvětlovala pravostranné městnání. Její původ byl opět otazníkem. V dokumentaci nebyla zmínka o žádném srdečním či plicním onemocnění, hypertenzi, které by mohly být disponujícím faktorem. Chyběly známky hyperkinetické cirkulace. Vyloučili jsme embolii plicní, srdeční vady, plicní onemocnění. Další náročnější a invazivní vyšetření pacient odmítl. Příčina trvající neimunitní hemolýzy a makrocytózy nebyla jasná. Nepotvrdil se primárně dřeňový původ (myelodysplastický syndrom). Téměř nulová, vzdor hemolýze, byla hladina kyseliny listové v séru. Zvýšená hladina homocysteinu (22,1 μmol/ l) ukazovala, že půjde o metabolicky významnou odchylku, a ne o náhodný nález. Kyselina listová nebyla nemocnému původně podávána. Po 2 týdnech léčby (30 mg/ den) regredovala anémie a rychle zmizely otoky i dušnost, vzdor minimální diuretické léčbě. Při kontrole za 3 měsíce už neměl nemocný žádné potíže, normalizoval se krevní obraz, vymizela hemolýza a překvapivě také plicní hypertenze při kontrolní echokardiografii (RVDd 25 mm, RVDs 17 mm, lehká trikuspidální regurgitace, systolický gradient 25 mm Hg). Plicní hypertenze byla přechodná a její ústup koreloval s vymizením hemolýzy a anémie. Tato časová souvislost nás vedla k domněnce o přímé souvislosti plicní hypertenze s hemolýzou, k diagnóze tzv. plicní hypertenze spojené s hemolýzou. Celou chorobnou kaskádu nemocného patrně započalo bakteriální přerůstání v tenkém střevě. Následný deficit vitaminu B12 a kyseliny listové vedl k megaloblastové anémii s neimunitní hemolýzou a rozvoji plicní hypertenze.
Image 1. Enteroklýza s dilatací kliček tenkého střeva. 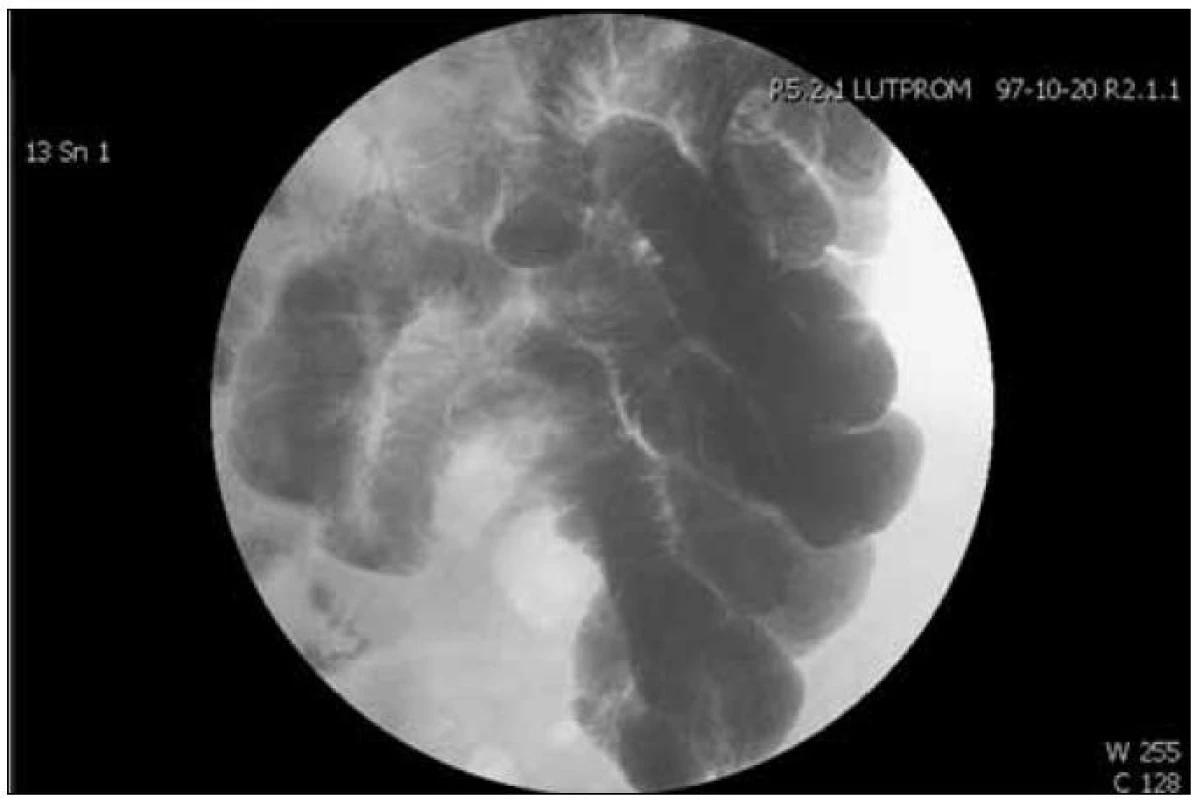
Diskuze
Časová koincidence bakteriálního přerůstání a hemolýzy navozuje u našeho nemocného představu o přímé, kauzální, souvislosti. Významná hemolýza však chronické bakteriální přerůstání běžně neprovází. Popisována je u střevních infekcí kmeny produkujícími hemolytický nebo hemolýzu indukující toxin (např. Bacillus cereus, Shigella, verotoxin produkující Escherichia coli). V těchto případech jde o akutní, často život ohrožující příhody (hemolyticko‑uremický syndrom), což nebyl případ našeho nemocného. Pravděpodobnější je, při negativní lékové anamnéze, spojitost s nedostatkem vitaminu B12 a kyseliny listové. Hemolýza trvala i po antibiotické léčbě a vymizela až po podání kyseliny listové. Při bakteriálním přerůstání je střevní flórou spotřebováván především vitamin B12. Deficit kyseliny listové je vzácný, ale možný. Hladina kyseliny listové v těle významně závisí na produkci a spotřebě folátů střevní flórou, resorpci ze střeva [1]. Známa je malabsorpce folátů při strukturálním postižení střevní sliznice, např. u celiakie [2], a vliv mohou mít kvalitativní a kvantitativní změny bakteriální flóry [3]. Všechny tyto okolnosti se mohly podílet na deficitu kyseliny listové u našeho nemocného.
Plicní hypertenze je syndrom charakterizovaný zvýšením středního tlaku v plicnici nad 25 mm Hg v klidu nebo nad 30 mm Hg při zátěži. Klasické dělení rozlišuje plicní hypertenzi prekapilární, postkapilární a hyperkinetickou. Klasifikace modernější [4] ji dělí podrobněji na 5 základních kategorií, na arteriální plicní hypertenzi, plicní žilní hypertenzi, plicní hypertenzi při hypoxemii, plicní hypertenzi při chronické trombotické a/ nebo embolické nemoci a plicní hypertenzi z jiných příčin. Poslední skupina zahrnuje pestrou skupinu chorob (tab. 1). Plicní hypertenze provází cirhózu jater, setkáme se s ní při léčbě anorektiky, kolagenózách (typicky sklerodermie), hemoglobinopatiích (thalasémie, sférocytóza, srpkovitá anémie) [5,6]. Plicní hypertenze se u této skupiny chorob vyskytuje již od dětství. Např. srpkovitou anémii plicní hypertenze provází ve 20 – 50 % případů a je prognosticky nepříznivým ukazatelem. Pokud se objeví, stoupá mortalita v průběhu 2 let na 50 % [5], přestože tlaky v plicnici nedosahují hodnot typických pro primární plicní hypertenzi. Rozvoj plicní hypertenze zde koreluje se stupněm hemolýzy [7]. Plicní hypertenze provází i jiná onemocnění spojená s intravaskulární hemolýzou, např. paroxyzmální noční hemoglobinurii, mikroangiopatické hemolytické anémie [7].
Table 1. Plicní hypertenze při jiných onemocněních [4]. ![Plicní hypertenze při jiných onemocněních [4].](https://www.prolekare.cz/media/cache/resolve/media_object_image_small/media/image/58b70cc8957261ddda77da4cd734e09d.jpeg)
Za patogenetickou se dříve považovala vazookluze deformovanými erytrocyty a uvolněným hemoglobinem s následným ischemicko‑reperfuzním poškozením tkáně.
Od poloviny 90. let minulého století se v literatuře objevuje nový termín plicní hypertenze spojené s hemolýzou (hemolysis‑associated pulmonary hypertension), spolu s novým výkladem příčiny změn, tzv. endoteliální dysfunkcí spojenou s hemolýzou [8]. Jde o přímý důsledek negativního působení intravaskulární hemolýzy na endotel. Za normálních okolností se uvolněný hemoglobin váže na haptoglobin a tento komplex je dále metabolizován. Vazebná kapacita haptoglobinu se pohybuje kolem 0,7 – 1,5 g hemoglobinu/ l. Po jejím překročení nebo po spotřebování haptoglobinu při dlouhotrvající hemolýze zůstává volný hemoglobin v cirkulaci. U osob s paroxyzmální noční hemoglobinúrií se pohybují při hemolýze hladiny volného hemoglobinu kolem 0,5 – 2 g/ l a při hemolytických krizích mohou dosáhnout až 10 g/ l [9]. Volný hemoglobin je reaktivní molekula, která rychle oxiduje endoteliální oxid dusnatý (NO) na methemoglobin. Výsledkem je lokální deficit NO v endotelu, který je kompenzován resyntézou NO, endoteliální NO syntázou z L - argininu. Při nadměrném zvýšení syntézy NO zásoby L - argininu klesají, dochází jejich spotřebování a poklesu tvorby NO. Při hemolýze se z erytrocytu dále uvolňuje argináza. Tento enzym konvertuje zásobní L - arginin na ornitin. Přispívá tak k rychlejšímu vyčerpání jeho zásob [10]. Zvýšená hladina ornitinu stimuluje produkci polyaminů, podílejících se na následné cévní remodelaci.
Důsledkem je porucha vazoregulace s převahou vazokonstrikce, zvýšení cévní permeability, nárůst produkce kyslíkových radikálů a oxidační stres, který dále poškozuje endotel. Zvýšená produkce endotelinu 1 prohlubuje vazokonstrikci. Déletrvající porucha a lokální zánět stimulují proliferaci hladké svaloviny s rozvojem hyperplazie médie arteriol a fixací hypertenze [7]. Při hemolýze dochází jak přímým účinkem hemoglobinu, tak následkem deficitu NO a zvýšené aktivity arginázy k aktivaci trombocytů, zvýšení tvorby trombinu a prokoagulačnímu stavu [9]. K cévní dysfunkci patrně přispívá i lokální deficit adenozinu vyvolaný uvolněním adenozin‑deaminázy z erytrocytu [11]. Podíl na rozvoji plicní hypertenze mají krom vazokonstrikce i tromboembolické uzávěry mikrocirkulace, proliferace hladké svaloviny cév a fibroprodukce.
Léčivo, které by tento patofyziologický řetězec přerušilo, k dispozici není. Zásadní je omezení hemolýzy. Pokud to není možné (např. u hemoglobinopatií), jsou testovány postupy, jak ovlivnit jednotlivé metabolické cesty – suplementace NO, L - argininu, podávání inhibitorů fosfodiesterázy - 5, omezení oxidačního stresu (hemoxygenáza 1, oxid uhelnatý) a antagonisté endotelinu 1 [12,13].
MUDr. Vladimír Kojecký, Ph.D.
www.bnzlin.cz
e-mail: kojecky@bnzlin.czDoručeno do redakce: 14. 12. 2009
Přijato po recenzi: 3. 3. 2010
Sources
1. Halfdanarson TR, Litzow MR, Murray JA. Hematologic manifestations of celiac disease. Blood 2007; 109 : 412 – 421.
2. Hoffbrand AV, Tabaqchali S, Booth CC et al. Small intestinal bacterial flora and folate status in gastrointestinal disease. Gut 1971; 12 : 27 – 33.
3. Klipstein FA, Samloff IM. Folate synthesis by intestinal bacteria. Am J Clin Nutr 1966; 19 : 237 – 246.
4. Jansa P, Aschermann M, Riedel M et al. Doporučení pro diagnostiku a léčbu plicní arteriální hypertenze v ČR. Cor Vasa 2004; 46: K35 – K44.
5. Castro O, Hoque M, Brown BD. Pulmonary hypertension in sickle cell disease: cardiac catheterization results and survival. Blood 2003; 101 : 1257 – 1261.
6. Řiháček I, Souček M, Kára T et al. Primární plicní hypertenze – aktuální pohled na diagnostiku a léčbu. Vnitř Lék 2003; 49 : 482 – 489.
7. Rother RB, Bell L, Hillmen P et al. The clinical sequelae of intravascular hemolysis and extracellular plasma hemoglobin: a novel mechanism of human disease. JAMA 2005; 293 : 1653 – 1662.
8. Gladwin MT, Sachdev V, Jison ML et al. Pulmonary hypertension as a risk factor for death in patients with sickle cell disease. N Engl J Med 2004; 350 : 886 – 895.
9. Morris CR. Mechanisms of vasculopathy in sickle cell disease and thalassemia. Hematology Am Soc Hematol Educ Program 2008; 1 : 177 – 185.
10. Morris CR, Gladwin MT, Kato GJ. Nitric oxide and arginine dysregulation: a novel pathway to pulmonary hypertension in hemolytic disorders. Curr Mol Med 2008; 8 : 620 – 632.
11. Tofovic SP, Jackson EK, Rafikova O. Adenosine deaminase - adenosine pathway in hemolysis‑associated pulmonary hypertension. Med Hypotheses 2009; 72 : 713 – 719.
12. Slebos DJ, Ryter SW, Choi AM. Heme oxygenase - 1 and carbon monoxide in pulmonary medicine. Respir Res 2003; 4 : 7.
13. Kato GJ, Gladwin MT. Evolution of novel small‑molecule therapeutics targeting sickle cell vasculopathy. JAMA 2008; 300 : 2638 – 2646.
Labels
Diabetology Endocrinology Internal medicine
Article was published inInternal Medicine

2010 Issue 6-
All articles in this issue
- Plicní hypertenze – neobvyklá komplikace syndromu bakteriálního přerůstání – editorial
- Existuje diurnální variabilita big endotelinu a NT‑proBNP u nemocných s těžkým chronickým srdečním selháním?
- Normalizovaný smoothness index a parametrický populační RDH index telmisartanu u pacientů s čerstvě zjištěnou hypertenzí a metabolickým syndromem
- Esenciální trombocytemie a jiné myeloproliferace s trombocytemií léčené Thromboreductinem. Výstupy z databáze Registru k 1. čtvrtletí roku 2010
- Plicní hypertenze – neobvyklá komplikace hemolýzy a syndromu bakteriálního přerůstání
-
Hyperlipoproteinemie a dyslipoproteinemie I.
Klasifikace, diagnostika, kardiovaskulární, kardiometabolické a reziduální riziko - Registr BRNO 2: farmakoterapie po infarktu myokardu
- Odlišné průběhy recidivující anebo multisystémové formy histiocytózy z Langerhansových buněk u dospělých osob – popis 22 případů z jednoho pracoviště
- Sepse a septický šok u onkologických a imunokompromitovaných pacientů – diagnostika, terapie
- Psychologický náhled na problémy onkologických pacientů a ošetřujícího týmu
- Preventivní podání antibiotik a probiotik u těžké akutní pankreatitidy
- Přínos jednotlivých zobrazovacích metod pro diagnostiku a sledování aktivity mnohočetného myelomu
- Příspěvek k hodnocení sérových hladin vybraných biologických působků u monoklonální gamapatie nejistého významu a v jednotlivých klinických stadiích mnohočetného myelomu
- Kontinuálne monitorovanie tkanivovej glukózy
- Význam senzitivity baroreflexu pre stratifikáciu kardiovaskulárneho rizika u hypertonikov
- Prevencia a liečba končatinovocievnej ischemickej choroby
- Zmeny v lipoproteínovom spektre pri končatinovo- cievnej ischemickej chorobe
- Vysoké školy musí mít nejen kvalitní výuku, ale také účinnou kontrolu kvality znalostí a schopností studentů (produktů) vysoké školy
- Internal Medicine
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Sepse a septický šok u onkologických a imunokompromitovaných pacientů – diagnostika, terapie
-
Hyperlipoproteinemie a dyslipoproteinemie I.
Klasifikace, diagnostika, kardiovaskulární, kardiometabolické a reziduální riziko - Esenciální trombocytemie a jiné myeloproliferace s trombocytemií léčené Thromboreductinem. Výstupy z databáze Registru k 1. čtvrtletí roku 2010
- Odlišné průběhy recidivující anebo multisystémové formy histiocytózy z Langerhansových buněk u dospělých osob – popis 22 případů z jednoho pracoviště
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

