-
Medical journals
- Career
SIADH jako jediný paraneoplastický příznak malobuněčného karcinomu plic: kazuistika
Authors: P. Lokaj; L. Křivan
Authors‘ workplace: Interní kardiologická klinika Lékařské fakulty MU a FN Brno, pracoviště Bohunice, přednosta prof. MUDr. Jindřich Špinar, CSc., FESC
Published in: Vnitř Lék 2008; 54(3): 273-275
Category: Case Reports
Overview
U 62leté pacientky přijaté pro progresi slabosti především dolních končetin byla zjištěna těžká euvolemická hyponatremie, hypochloremie a hypoosmolarita séra při stanovené diagnóze SIADH. V etiopatogenezi tohoto jediného příznaku byl u pacientky diagnostikován malobuněčný karcinom plic s expanzí do mediastina a četnou metastatickou diseminací do skeletu.
Klíčová slova:
syndrom nepřiměřené sekrece antidiuretického hormonu - malobuněčný karcinom plicÚvod
Syndrom nepřiměřené sekrece antidiuretického hormonu (SIADH) (nazývaný také Schwartzův-Bartterův syndrom) je relativně vzácným příznakem celé řady benigních a maligních onemocnění. Za normálních okolností dochází ke zvýšení sekrece ADH především při zvýšení osmolality plazmy a kromě toho při poklesu intravaskulárního objemu. Tato informace je zprostředkována cévními baroreceptory. Pokles intravaskulárního objemu vzniká např. u cirhózy, nefrotického syndromu, srdečního selhání nebo ztrát plazmy. Za těchto okolností sekrece ADH převáží nad osmotickými signály a vede k vzniku hyponatremie. O SIADH hovoříme v případě dysregulace buněk za normálních okolností produkujících vazopresin, autonomní sekrece nádorovými buňkami nebo vzestup renální citlivosti na ADH. Zdrojem zvýšené produkce ADH zdaleka nemusí být pouze buňky hypotalamických jader. K syndromu SIADH vedou prakticky 4 situace:
- ektopická sekrece v tumorech,
- onemocnění CNS,
- onemocnění plic,
- je způsobena lékově.
Z maligních onemocnění jmenujme především malobuněčný karcinom plic, nádory pankreatu, nádory CNS, ale i maligní lymfomy či leukemie atd. Mezi onemocněními CNS se může jednat o demyelinizaci a degenerativní onemocnění, zánětlivá onemocnění (encefalitidy, meningitidy, SLE, mozkový absces), ale také mohou být způsobena jinou patologií CNS od subarachnoidálního krvácení a subdurálních hematomů a trombózy kavernózního sinu počínaje, přes akutní psychózy, delirium tremens, akutní intermitentní porfyrii, neonatální hypoxii až k operacím a traumatům CNS. Onemocnění plic vedoucí k SIADH jsou nejen záněty, ale kupř. také poruchy plicní ventilace (akutní respirační selhání, pneumotorax, astma, cystická fibróza, CHOPN, plicní ventilace atd.). Také paleta léků je značně široká od běžně používaných nesteroidních antiflogistik až po cytostatika (např. vinkristin, cyklofosfamid) atd. Jsou to léky, které jednak stimulují sekreci ADH, ale také léky potencující účinek ADH v ledvinách (2). V klinickém obraze dominují především slabost , únava, nauzea, zvracení, letargie, dezorientace, křeče až kóma. Lehčí formy mohou být asymptomatické. Pokud hladina Na klesne pod 105 mmol/l, dostavují se život ohrožující příznaky (3). Na základě vzniklého osmotického gradientu mezi plazmou a mozkovými buňkami může dojít k rozvoji cytotoxického mozkového edému v důsledku nestejně rychlé úpravě složení buněk nervové tkáně a plazmy. Naopak rychlá korekce především chronické hyponatremie může vést k osmotickému demyelinizačnímu syndromu, obvykle s maximem změn v oblasti mozečkového mostu (centrální pontinní myelinolýza), která se manifestuje symptomy několik dnů po rychlé úpravě od agitovanosti až po poruchu vědomí a spastickou kvadruparézu. Demyelinizačnímu syndromu u chronických hyponatremií (vznik déle než 48 hod) zabráníme opatrnou korekcí hladiny sodíku v séru maximálně o 0,5 mmol/l/hod, resp. ne více jak 10 mmol/l/den (4). V ČR nelze stanovit plazmatickou hladinu ADH, proto se diagnostika stanoví dle Schücka splněním 3 kritérií: SNa < 130 mmol/l, Sosm < 280 mmol/kg vody, Uosm > 100 mmol/kg vody (5). Dle autorů Schwartze a Barttera jsou kritéria poněkud odlišná: hyponatremie s nízkou s nízkou osmolalitou plazmy; osmolarita moče je vyšší než osmolarita plazmy; exkrece natria ledvinami je vyšší než 20 mmol/l; není hypotenze, hypovolemie a edémové stavy; je normální renální a adrenální funkce. Musíme konstatovat, že v naší kazuistice byla splněna kritéria obou skupin autorů.
Uvádíme kazuistiku pacientky s tímto paraneoplastickým syndromem jako jediným příznakem při diagnóze malobuněčný karcinom plic.
Kazuistika
62letá pacientka byla přijata na Interní kardiologickou kliniku FN Brno pro progresi slabosti především dolních končetin se zhoršením v posledních dnech. V osobní anamnéze měla astma bronchiale na terapii Pulmex spray 1-0-1, Ventolin spray dle potřeby, Theoplus 1-0-1; esenciální hypertenzi na monoterapii Zorem 5mg 1-0-0 a chronickou žilní insuficienci s terapií Glyvenol 400 mg 1-0-1. Hospitalizována byla od 29. 4. 2007, objektivně bez pozoruhodností, bez otoků, hmotnost: 68 kg, výška: 167 cm, TK: 140/90, TF: 80/min, na EKG sinusový rytmus 76/min, bez patologického nálezu. V laboratoři dominovala těžká hyponatremie 104 mmol/l, hypochloremie 75 mmol/l a hypoosmolarita séra 230 mosmol/kg vody. Ostatní biochemické ukazatele, koagulace a krevní obraz bez pozoruhodností a známek zánětu. Anamnesticky a fyzikálním vyšetřením byly vyloučeny ztráty (průjmy, zvracení, výpotky) a vliv medikace. Za hospitalizace provedeny opakované sběry moče za 24 hod s odpady iontů. Diuréza činila 1 500 - 1 800 ml, kreatininová clearance 2,2 - 2,4 ml/s, odpady sodíku již při substituci činily 331 mmol/24 hod (norma 70 - 270 mmol/24 hod), odpady chloru činily 365 mmol/24 hod (norma 110 - 250 mmol/24 hod), dále za zmínku stojí snížené hodnoty EF vody 0,7 % (norma 1 - 2 %) při osmolaritě moči 1 022 mosmol/kg vody. Ostatní hodnoty exkrečních frakcí, odpadů iontů, dusíkatých látek byly fyziologické s normální tabulární resorpcí. Na základě těchto výsledků a nízkých plazmatických koncentrací dusíkatých látek (urea 4 mmol/l; kreatinin 49 µmol/l; kyselina močová 152 µmol/l), jsme vyloučili vliv dehydratace či renální etiologii (6). Laboratorně byla vyloučena endokrinní porucha štítné žlázy, hormonů kůry nadledvin včetně renin-angiotenzin-aldosteronového systému. Na základě těchto parametrů byla stanovena diagnóza SIADH.
Od počátku hospitalizace jsme u pacientky prováděli substituci koncentrovanými roztoky NaCl (250 ml FR + 20 ml 10 % NaCl à 6 hod); restrikci přijmu tekutin na 1 l/den a titrace dávek furosemidu od 10 mg do cílové dávky 40 mg/den per os. V týdenních intervalech jsme navyšovali dávku furosemidu o 10 mg per os při současných laboratorních kontrolách účinku titrace. Asi po 5 týdnech jsme dosáhli normonatremie a normochloremie s normální osmolalitou séra.
V pátrání po etiologii SIADH byly zvažovány nejčastější etiopatogenetické faktory a použity dostupné zobrazovací metody. RTG hrudníku při přijetí vyloučil zjevné plicní infiltráty a patologii mediastina. Popsáno bylo pouze mírné nahuštění cévní kresby parakardiálně bazálně vpravo. UZ a CT břicha včetně nadledvin popisoval normální nález na parenchymatózních orgánech. CT a MR mozku se zaměřením na sella turcica k vyloučení diencephalopatie bylo bez zjevné patologie. Gynekologické vyšetření s nálezem odpovídajícím věku pacientky. Onkomarkery a protilátky systémových autoimunitních onemocnění neposkytly informaci o možné etiologii. Vzhledem k oligosymptomům a negativitě dosud použitých vyšetřovacích metod byla pacientka podrobena vyšetření PET s nálezem generalizovaného tumoru v pravém dolním plicním laloku, mediastinu a osovém skeletu (obr. 1). Na základě tohoto nálezu bylo provedeno HRCT plic s nálezem objemného patologického infiltrátu celého mediastina s invazí do dolního lobárního bronchu pravé plíce. Kontrolní RTG snímek po 6 týdnech potvrzuje výše uvedený nález s expanzí do mediastina, deviací průdušnice vpravo, patologické zastření velikosti 5,5 cm pod pravým hilem a malý fluidotorax vpravo (obr. 2). Vzhledem k invazi nádoru do pravého lobárního bronchu provedena diagnostická bronchoskopie s biopsií k diferenciální diagnostice více pravděpodobného bronchogenního karcinomu či maligního lymfomu. Na základě histologického vyšetření jsme stanovili po 7 týdnech konečnou diagnózu malobuněčný karcinom plic, se kterou byla pacientka přeložena na Kliniku nemocí plicních a tuberkulózy FN Brno k zahájení chemoterapie.
Image 1. Celotělový PET s nálezem generalizovaného tumoru plic a mediastina s metastázami do skeletu. 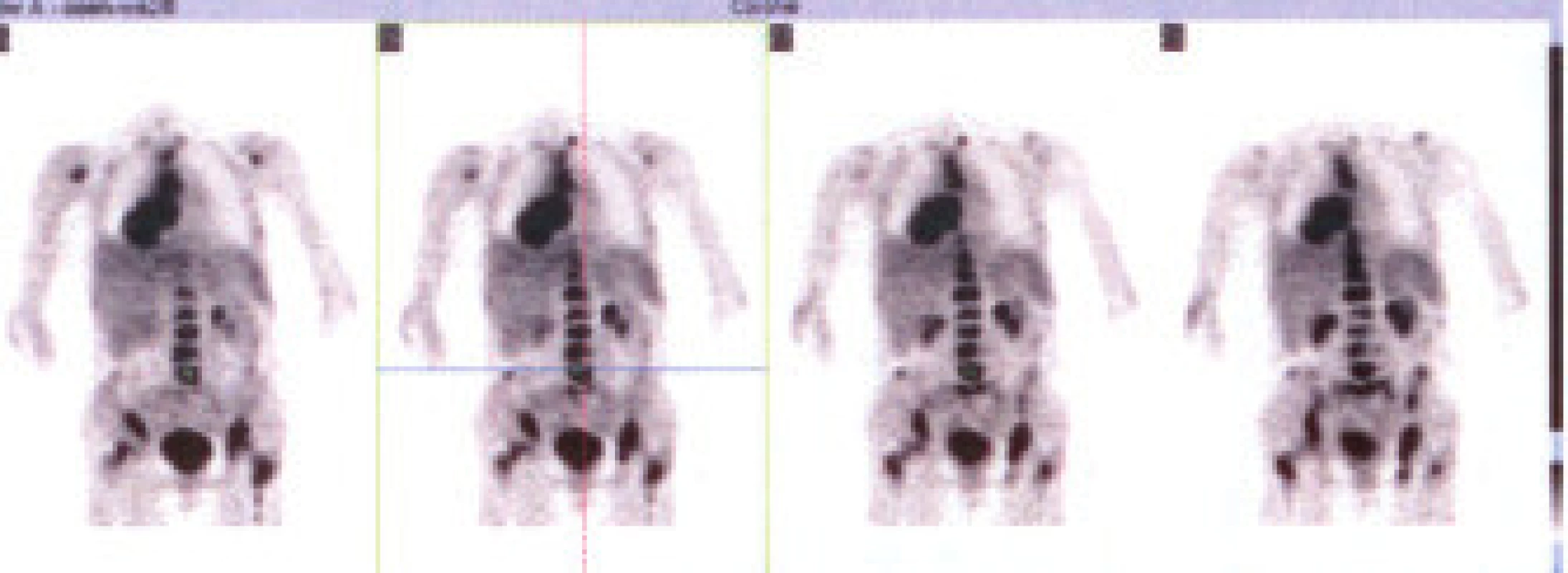
Image 2. RTG srdce a plic s nálezem 5,5 cm velikého tumoru pod pravým plicním hilem, deviací průdušnice vpravo a fluidotoraxem vpravo. 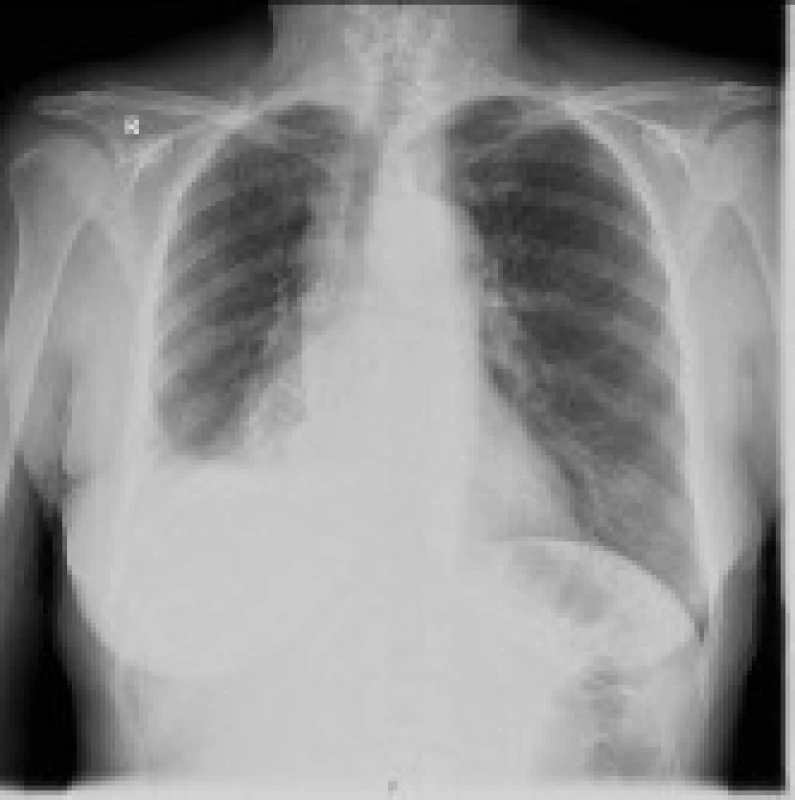
Téměř po celou dobu hospitalizace byla pacientka stran celkových či ložiskových příznaků nádorového onemocnění asymptomatická. Poslední týden hospitalizace se u pacientky rozvinuly bolesti bederní páteře bez RTG korelátu osteolytických ložisek či kompresivní fraktury, ale laboratorními známkami zvýšené osteoresopce, zvládnuté aplikací analgetik a kalcitoninu. Po zavedení chemoterapie došlo k vymizení SIADH jako paraneoplastického příznaku.
Diskuze
Malobuněčný karcinom plic je nejčastější nádorovou etiologií SIADH. Dle literatury z poslední doby byl SIADH zjištěn ve 2/140 (1,4 %) případů nepokročilé choroby a ve 22/292 (7,5 %) pokročilé choroby (7). Dle jiné literatury byl paraneoplastický SIADH zjištěn u 14 z 243 pacientů (5,7 %) nepokročilého bronchogenního karcinomu (8). Ovšem ve většině případů jsou dominující celkové či ložiskové symptomy plicního nádoru. V našem článku upozorňujeme na kazuistiku pacientky s jediným symptomem - euvolemickou hyponatremií při základní diagnóze malobuněčný karcinom plic, na který je nutno pomýšlet při stanovení relativně vzácné diagnózy SIADH.
V diferenciální diagnóze SIADH je třeba pomýšlet na další onemocnění s euvolemickou hyponatremií jako psychogenní polydipsie, hypotyreóza, deficit glukokortikoidů, některá farmaka. Naopak tam, kde pacient trpí edémovými stavy s hyponatremií, musíme vyloučit akutní či chronické renální selhání, srdeční selhání, jaterní cirhózu či nefrotický syndrom. Hyponatremie s dehydratací bývá spojována se ztrátami extrarenálními (zvracení, průjem, píštěle) nebo renálními (diuretika, nefropatie spojené se snížením tubulární resorpce Na, deficit mineralokortikoidů a glukokortikoidů, pseudohypoaldosteronizmus či nenatriová osmotická diuréza). Velmi obdobným syndromem SIADH je syndrom mozkového plýtvání solí (CSWS - cerebral salt waisting syndrome). V patogenezi tohoto syndromu by se primárně mělo uplatňovat zvýšené renální vylučování Na a Cl na podkladě zvýšené mozkové produkce peptidu s natriuretickým účinkem u některých onemocnění CNS (např. mozkových tumorů). Principiální rozdíl obou syndromů je, že u CSWS je typická dehydratace (9).
Literatura doporučuje v léčbě SIADH po předchozím odstranění reverzibilních příčin demeclocyklin a lithium carbonicum k vyvolání reverzibilního diabetes insipidus renalis (10). Jinou možností léčby je podání selektivních antagonistů V2 receptorů pro vazopresin (11). Demeclocyclin není v ČR registrován a lithium se používá všude tam, kde nelze dosáhnout úpravy pouhou restrikcí tekutin a použitím kličkových diuretik za postupné titrace dávek s kontrolou diurézy a výskytu nežádoucích účinků lithia. Léčba se tedy opírá o 4 opatření: léčba základního onemocnění, restrikce příjmu tekutin na maximálně 1 l/den, substituce koncentrovanými roztoky NaCl a titrace dávky furosemidu za současného laboratorního kontrolování (12).
MUDr. Petr Lokaj
www.fnbrno.cz
e-mail: ploka@fnbrno.cz
Doručeno do redakce: 3. 10. 2007
Přijato po recenzi: 17. 12. 2007
Sources
1. Adam Z, Vorlíček J, Kostíková J. Obecná onkologie a podpůrná léčba. Praha: Grada Publishing 2003; 587 - 591.
2. Dítě P et al. Vnitřní lékařství. Brno: Masarykova univerzita 2005: vol. 3.
3. Adrogué HJ, Madias NE. Hyponatremia. N Engl J Med 2000; 342 : 1581-1589.
4. Bednařík J et al. Učebnice speciální neurologie. Brno 1999; 133-134.
5. Schuck O Poruchy metabolismu vody a elektrolytů v klinické praxi. Praha: Grada Publishing 2000; 59-62.
6. Griva M, Kubánek J Syndrom nepřiměřené sekrece antidiuretického hormonu u nediferencovaného malobuněčného karcinomu plic. Vnitř Lék 2002; 48 : 993-995.
7. Seute T, Leffers P, ten Velde GP et al. Neurologic disorders in 432 consecutive patients with small cell lung carcinoma. Cancer 2004; 100; 801-806.
8. Mussig K, Horger M, Haring HU et al. Syndrome of inappropriate antidiuretic hormone secretion (SIADH) in pacients with limited stage small cell lung cancer. Lung Cancer 2007; 57; 120-122.
9. Rafailov A, Sinert R Syndrome of Inappropriate Antidiuretic Hormone Secretion. E-Medicine 2007, Endocrine and Metabolic
10. Rai A, Whaley-Connell A, McFarlane S et al. Hyponatremia, arginine vasopressin dysregulation, and vasopressin receptor antagonism. Am J Nephrol 2006; 26 : 579-589.
11. Verbalis JG AVP receptor antagonists as aquaretics: review and assessment of clinical data. Cleve Clin J Med 2006; 73: Suppl. 3: S24-S33.
12. Sorensen JB, Andersen MK, Hansen HH Syndrome of inappropriate secretion of antidiuretic hormone (SIADH) in malignant disease. J Int Med 1995; 238 : 97-110.
Labels
Diabetology Endocrinology Internal medicine
Article was published inInternal Medicine

2008 Issue 3-
All articles in this issue
- Raloxifen v klinické praxi. Výsledky neintervenční klinické studie CORAL (COmpliance with RALoxifene)
- Vliv rehabilitace na vrcholovou spotřebu kyslíku u nemocných po infarktu myokardu léčených beta-blokátory
- Makrovaskulární a mikrovaskulární komplikace u diabetiků 2. typu
- Léčba IgA nefropatie
- Možnosti ochrany reprodukčních funkcí u žen podstupujících léčbu cytotoxickými léky
- Glykovaný hemoglobin. Je ohroženo jeho výsostné postavení v diabetologii?
- Von Willebrandova choroba
- Úvod do laboratorní diagnostiky pleurálního výpotku
- SIADH jako jediný paraneoplastický příznak malobuněčného karcinomu plic: kazuistika
- Purtscher−like retinopatia – zriedkavá komplikácia akútnej pankreatitídy: kazuistika
- Idiopatická retroperitoneální fibróza - Ormondova choroba: kazuistiky
- Reminiscence k stoletému výročí objevu Whippleovy nemoci: souborný referát
- Internal Medicine
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Idiopatická retroperitoneální fibróza - Ormondova choroba: kazuistiky
- Von Willebrandova choroba
- SIADH jako jediný paraneoplastický příznak malobuněčného karcinomu plic: kazuistika
- Léčba IgA nefropatie
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

