-
Medical journals
- Career
Migrace samoexpandibilního metalického stentu do drénované pseudocysty po endoskopické pseudocystogastrostomii a jeho endoskopická extrakce
Authors: Martin Štěpán 1; O. Urban 2,3,4; P. Fojtík 1; Přemysl Falt 1,3,4
Authors‘ workplace: Centrum péče o zažívací trakt, Vítkovická nemocnice, a. s., Ostrava 1; II. interní klinika – gastroenterologická a hepatologická LF UP a FN Olomouc 2; LF OU v Ostravě 3; LF UK v Hradci Králové 4
Published in: Gastroent Hepatol 2018; 72(3): 221-224
Category:
doi: https://doi.org/10.14735/amgh2018221Overview
Pankreatická pseudocysta a ohraničená pankreatická nekróza patří mezi lokální komplikace akutní a chronické pankreatitidy. Jejich léčba, pokud je indikovaná, spočívá v provedení perkutánní, chirurgické nebo endoskopické drenáže. V posledních letech je stále více upřednostňována endosonograficky navigovaná transmurální drenáž těchto tekutinových kolekcí. Mezi relativně vzácnou komplikaci řadíme migraci zavedeného stentu po provedené endoskopické drenáži. V naší kazuistice prezentujeme 52letého pacienta s chronickou pankreatitidou a symptomatickou pseudocystou, u kterého bylo indikováno provedení endoskopické pseudocystogastrostomie pomocí celopotaženého samoexpandibilního metalického stentu, která byla komplikována rozvojem pneumoperitonea. Po chirurgické revizi byla pomocí zobrazovacích metod zjištěna přítomnost původně zavedeného stentu v reziduální pseudocystě, který byl následně endoskopicky, skrze nově zavedený metalický stent, úspěšně extrahován.
Klíčová slova:
pseudocysta – endosonograficky navigovaná transmurální drenáž – celopotažený samoexpandibilní metalický stent – migrace stentuÚvod
Mezi lokální komplikace akutní pankreatitidy řadíme, dle revidované Atlantské klasifikace z roku 2012, akutní peripankreatickou kolekci tekutiny, akutní nekrotickou kolekci, pankreatickou pseudocystu a ohraničenou pankreatickou nekrózu (WOPN – walled of pancreatic necrosis) [1,2]. Endosonograficky navigovaná drenáž je dnes již široce užívaná modalita v léčbě pankreatických tekutinových kolekcí. Komplikace této metody můžeme rozdělit na komplikace související s procedurou (krvácení, infekce, pankreatitida, perforace) a komplikace spojené se zavedením stentu (migrace, okluze a následná infekce) [3]. V endoskopickém managementu se uplatňuje široká škála akcesorní. K endoskopické drenáži pseudocyst se využívají především plastové double pigtail stenty. K drenáži WOPN se dříve rovněž nejčastěji využívaly plastové double pigtail stenty, které v těchto případech, díky svému tvaru, minimalizovaly riziko migrace stentu, ale kvůli úzkému lumen drenáže se vyskytovala okluze stentu až v 18 % případů, což vedlo k častým výměnám nebo zavedením dalších stentů [4,5]. Později vyvinuté samoexpandibilní metalické stenty měly sice širší lumen, a poskytovaly tak účinnější drenáž, avšak kvůli svému tubulárnímu tvaru byly spojeny s vyšším rizikem migrace [6]. Nově vyvinuté samoexpandibilní metalické stenty, speciálně navržené pro drenáž především WOPN (Niti-S NAGI™ a SPAXUS™ stenty od Tae Woong Medical, Jižní Korea; AXIOS™ stent od Boston Scientific, USA), mají upravené konce, které mají zabránit migraci stentu. Jejich výhodou je rychlé rozvinutí, spontánní vyprázdnění eventuálních nekrotických hmot a možnost endoskopické nekrektomie skrze široké lumen stentu. Jejich nevýhodou je vysoká cena, riziko migrace, k čemuž došlo i u našeho pacienta, krvácení při arozi cév uvnitř WOPN, perforace a superinfekce [7,8]. V našem případě pak byla provedena, jako zcela ojedinělá dle dostupných publikací [9,10], endoskopická extrakce migrovaného Niti-S NAGI™ stentu skrze následně zavedený stent AXIOS™, který migroval do dutiny pseudocysty po endosonograficky navigované drenáži.
Popis případu
Pacient, 52 let, s anamnézou opakovaných exacerbací chronické alkoholické pankreatitidy, po splenektomii po traumatu, byl přijat na spádové gastroenterologické pracoviště pro nauzeu a bolesti břicha. Po jeho přijetí bylo provedeno CT břicha, které mimo známek chronické pankreatitidy (kalcifikace, atrofie pankreatu) prokázalo na rozhraní hlavy a těla pankreatu pseudocystu o průměru 10 cm naléhající a komprimující zadní stěnu antra žaludku. Laboratorně pak vstupně dominovaly vyšší jaterní enzymy (alaninaminotransferáza 2,87 µkat/l; aspartátaminotransferáza 4,63 µkat/l; alkalická fosfatáza 2,95 µkat/l; γ-glutamyltransferáza 9,49 μkat/l), lehce vyšší pankreatické enzymy (alfa-amyláza – AMS 3,40 µkat/l; lipáza 3,03 µkat/l) a nízké zánětlivé parametry (leukocytóza 8,68 × 10⁹/l; C reaktivní protein – CRP 11 mg/l). Vzhledem k přítomnosti symptomatické pseudocysty byla indikována endoskopická pseudocystogastrostomie. Výkon byl proveden v celkové anestezii, na zadní stěně těla žaludku bylo patrno vyklenutí tlakem pseudocysty, endosonograficky nebyla zjištěna přítomnost velkých cév mezi stěnou žaludku a pseudocystou. Následně byl mediogastricky proveden pokus o punkci pseudocysty cystotomem COOK, který však byl neúspěšný pro nestabilní pozici cystotomu a zdařil se až druhý pokus na rozhraní těla a antra žaludku. Nejdříve byla aspirována serózní nažloutlá tekutina s vysokou hladinou pankreatických enzymů a CA 19-9 (AMS 124 µkat/l; lipáza 639 µkat/l; CA 19-9 26 120 kU/l), cytologie byla bez nálezu maligních buněk. Vzhledem k tomu, že stěna pseudocysty a žaludku na sebe nenaléhaly, byla zvolena a provedena drenáž samoexpandibilním metalickým stentem Niti-S NAGI™ 20 × 16 mm. V den výkonu, ve večerních hodinách, došlo k rozvoji prudkých bolestí břicha. Následoval prostý snímek břicha, který prokázal pneumoperitoneum. Nález byl konzultován s chirurgem a bylo rozhodnuto o chirurgické revizi. Operace byla nejprve vedena laparoskopicky, pro četné srůsty s nemožností laparoskopické adheziolýzy bylo rozhodnuto o otevřené operaci. Na zadní stěně žaludku byla zjištěna drobná perforace a provedena její sutura. Vzhledem k mnohočetným adhezím a rozsáhlému peripankreatickému plastronu a nemožnosti dosažení samotné pseudocysty nebyl vlastní stent extrahován. Pacient byl poté zajištěn dvojkombinací antibiotik (amoxicilin a kyselina, metronidazol). Pooperační průběh byl nekomplikovaný a pacient byl 20. pooperační den dimitován. S odstupem 2 a 4 týdnů bylo provedeno kontrolní CT břicha s nálezem cystoidu pankreatu v průměru 47 mm s patrným migrovaným stentem (obr. 1). Na základě tohoto nálezu, předpokládané obtížnosti další operace, které navíc pacient nebyl nakloněn, bylo rozhodnuto o pokusu o endoskopickou extrakci migrovaného metalického stentu. Výkon byl proveden lineárním echoendoskopem, který lokalizoval cystoid s patrným stentem za zadní stěnou žaludku. Za pomoci endosonografické a skiaskopické kontroly byl do dutiny zaveden stent HOT AXIOS™ 10 × 15 mm (obr. 2). Poté byla provedena balonová dilatace kanálu stentu balonem Boston CRE 12–15 mm a do dutiny pseudocysty bylo proniknuto gastroskopem a migrovaný stent byl extrahován kleštěmi typu „krysího zubu“ (obr. 3 a 4). Do dutiny byl přes metalický stent na závěr zaveden ještě pojistný plastový double pigtail stent 10 Fr 5 cm (obr. 5). S odstupem dalších 2 měsíců byla patrna regrese pseudocysty na kontrolním CT břicha a stent HOT AXIOS™ jsme následně gastroskopicky extrahovali.
Image 1. CT břicha demonstrující cystoid s migrovaným stentem Niti-S NAGI™.
Fig. 1. Computer tomography of the abdomen showing a migrating Niti-S NAGI™ stent in a cystoid.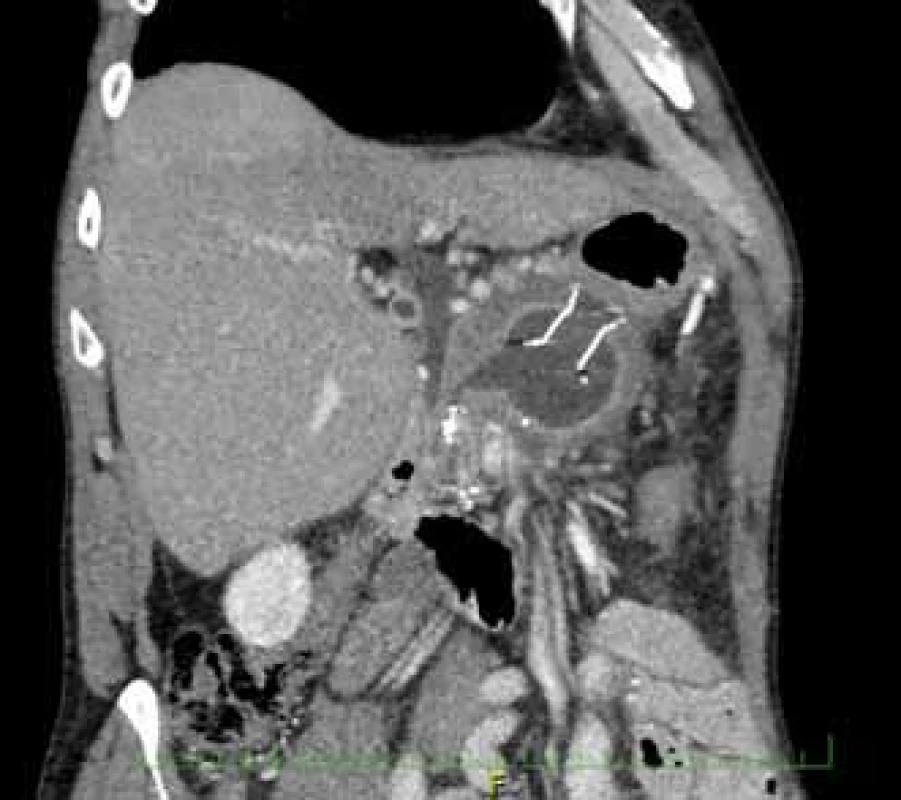
Image 2. Dutina pseudocysty se zavedeným stentem HOT AXIOS™ a viditelnými vlákny Niti-S NAGI™ stentu.
Fig. 2. Pseudocyst cavity with a HOT AXIOS™ stent and visible fibres of a Niti-S NAGI™ stent.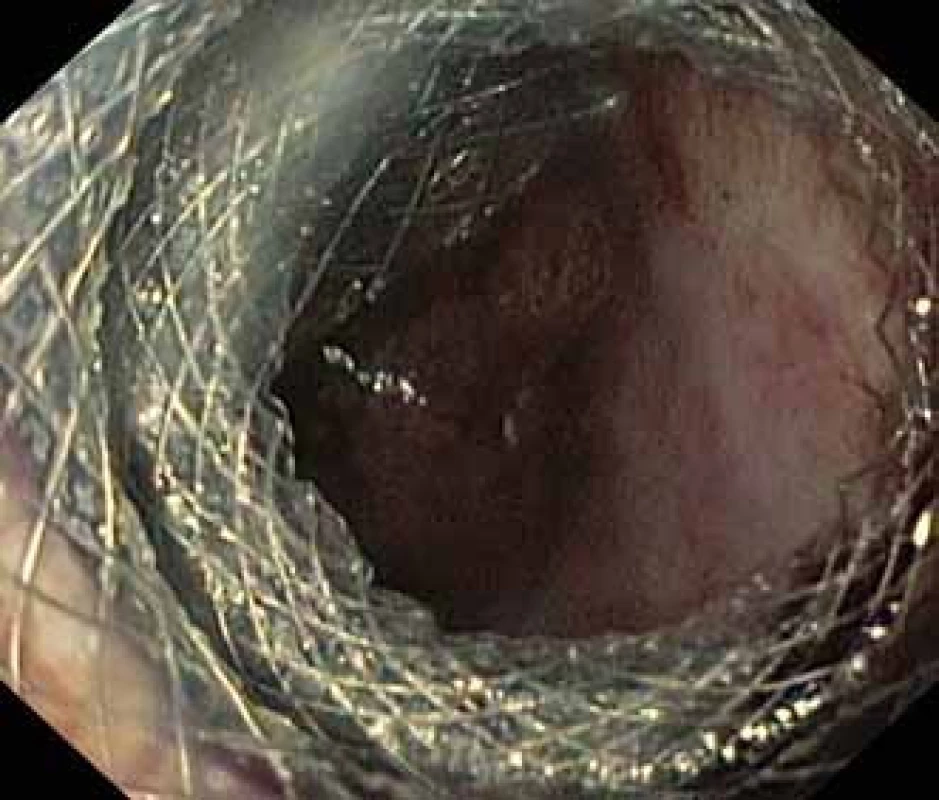
Image 3. Extrakce Niti-S NAGI™ stentu pomocí kleští krysí zub.
Fig. 3. Extraction of the Niti-S NAGI™ stent using a rat-tooth forceps.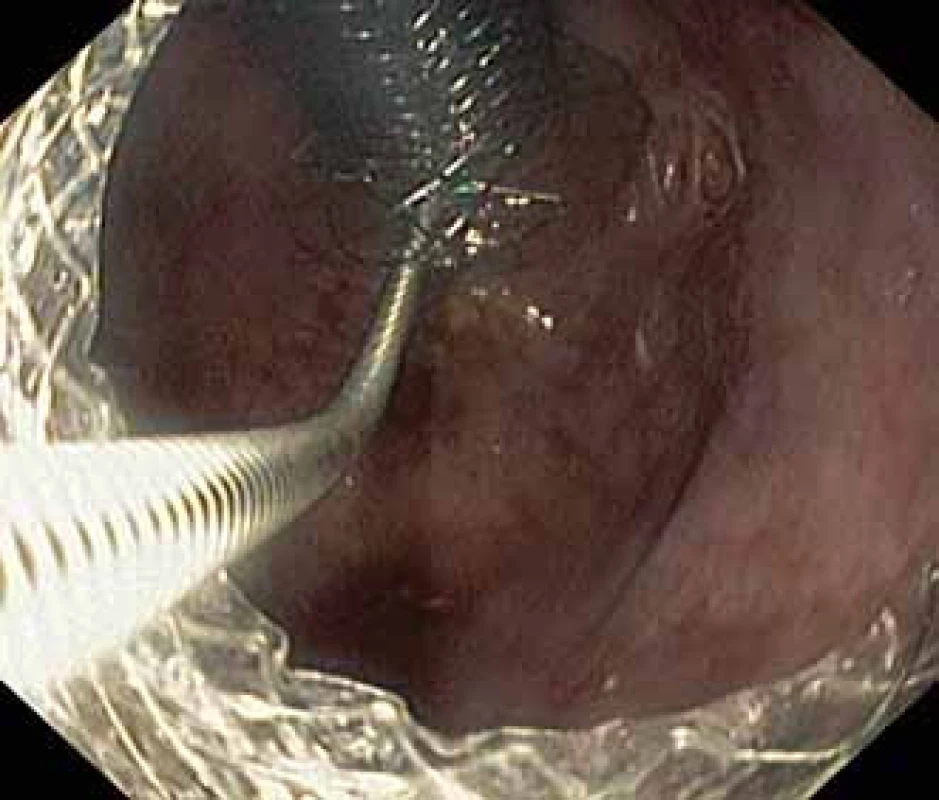
Image 4. Extrahovaný Niti-S NAGI™ stent.
Fig. 4. Niti-S NAGI™ stent exctracted.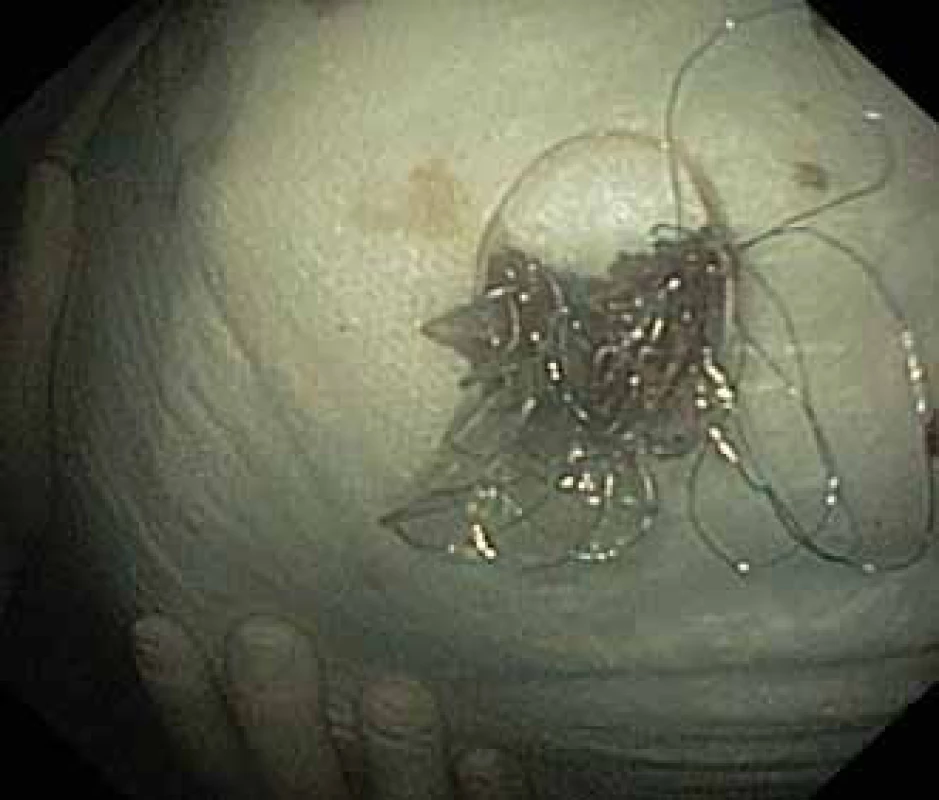
Image 5. HOT AXIOS™ stent a zavedený pojistný plastový double pigtail stent.
Fig. 5. A HOT AXIOS™ stent and a security plastic double pigtail stent.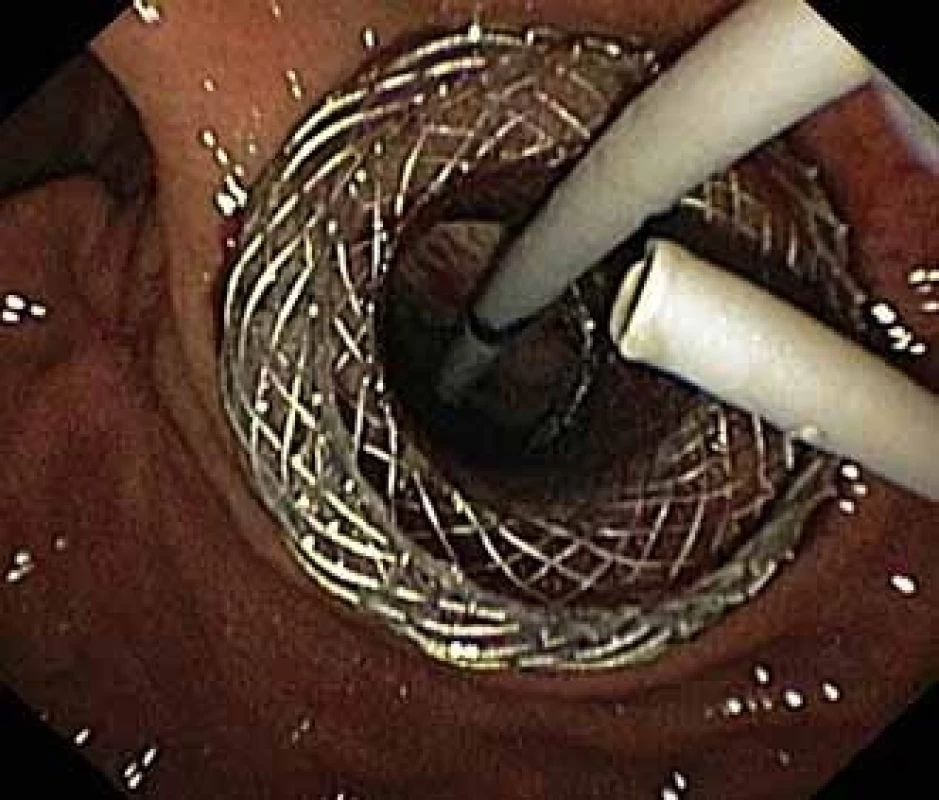
Diskuze
Mezi komplikace endosonograficky navigované drenáže pseudocysty patří opožděná infekce (0–8 %), krvácení (0–9 %), retroperitoneální perforace (0–5 %) a dislokace stentu (4–6,5 %) [11]. Migrace stentu do drénované pankreatické tekutinové kolekce v průběhu provedené endoskopické drenáže nebo po ní je relativně vzácná komplikace. Nové samoexpandibilní metalické stenty, které byly vyvinuty k drenáži pseudocyst a WOPN, mají speciálně upravené konce tak, aby bylo riziko migrace stentu sníženo na minimum. I přes toto opatření se tato komplikace, při použití nových metalických stentů, raritně vyskytuje, jak prezentujeme i v našem případě. Tato komplikace je pak v závislosti na lokalizaci migrovaného stentu řešitelná chirurgicky, endoskopicky a byl popsán i případ kombinované gastroskopické transgastrické laparoskopické rendez-vous techniky [9,10].
V našem popisovaném případě došlo k časné migraci zavedeného stentu, pravděpodobně kvůli nepříznivé pozici cystoidu a zadní stěny žaludku. Při následné chirurgické revizi indikované pro rozvoj pneumoperitonea byla uzavřena perforace zadní stěny žaludku, ale nepříznivé anatomické poměry neumožnily revizi dutiny cystoidu a extrakci migrovaného stentu. Proto byl později zvolen endoskopický přístup se zpřístupněním dutiny cystoidu přechodným zavedením dalšího metalického stentu a extrakcí původního migrovaného stentu. K minimalizaci rizika migrace a traumatizace stěny cystoidu byl zaveden i pojistný plastový double pigtail stent [12].
Závěr
V našem sdělení prezentujeme endoskopickou extrakci migrovaného metalického stentu po pseudocystogastrostomii symptomatické pseudocysty, u pacienta s chronickou pankreatitidou, zavedením dalšího metalického stentu. Tento miniinvazivní postup může být ve specifických situacích výhodnější oproti operačnímu řešení, které je pravděpodobně zatíženo vyšším rizikem pooperačních komplikací.
Autoři deklarují, že v souvislosti s předmětem studie nemají žádné komerční zájmy.
Redakční rada potvrzuje, že rukopis práce splnil ICMJE kritéria pro publikace zasílané do biomedicínských časopisů.
Doručeno: 15. 3. 2018
Přijato: 24. 4. 2018
MUDr. Michal Štěpán
Centrum péče o zažívací trakt
Vítkovická nemocnice, a. s.
Zalužanského 1192/ 15, 703 84 Ostrava
Sources
1. Andrašina T, Bohatá Š. Zobrazovací metody u akutní pankreatitidy. In: Trna J, Kala Z. Klinická pankreatologie. 1. vyd. Praha: Mladá fronta 2016 : 43–54.
2. Banks PA, Bollen TL, Dervenis C et al. Classification of acute pankreatitis-2012: revision of the Atlanta classification and definitions by international consensus. Gut 2013; 62 (1): 102–111. doi: 10.1136/gutjnl-2012-302 779.
3. Chung IH, Kim HW, Lee DK. Endoscopic removal of a migrated cystogastrostomy double pigtail stent through a pancreatico-duodenal fistula tract. J Interv Gastroenterol 2011; 1 (3): 142–144. doi: 10.4161/jig.1.3.18515.
4. Singhal S, Rotman SR, Gaidhane M et al. Pancreatic fluid collection drainage by endoscopic ultrasound: an update. Clin Endosc 2013; 46 (5): 506–514. doi: 10.5946/ce.2013.46.5.5 06.
5. Lopes CV, Pesenti C, Bories E et al. Endoscopic-ultrasound-guided endoscopic transmural drainage of pancreatic pseudocysts and abscesses. Scand J Gastroenterol 2007; 42 (4): 524–529. doi: 10.1080/00365520601065 093.
6. Patil R, Ona MA, Papafragkakis C et al. Endoscopic ultrasound-guided placement of AXIOS stent for drainage of pancreatic fluid collections. Ann Gastroenterol 2016; 29 (2): 168–173. doi: 10.20524/aog.2016.0008.
7. Kliment M, Urban O, Fojtík P et al. Endoscopic drainage of pancreatic fluid collections – 6 years’ experience at a tertiary referral gastroenterological center in a period 2006–2012. Gastroent Hepatol 2017; 71 (3): 199–207. doi: 10.14735/amgh2017199.
8. Walter D, Vleggaar FP, Siersema PD. Self-expandable metal stents for endoscopic ultrasound-guided drainage of peripancreatic fluid collections. Gastrointest Interv 2013; 2 (1): 24–29. doi: 10.1016/j.gii.2013.01. 002.
9. Patrzyk M, Dierzek P, Glitsch A et al. Retrieval of a self-expanding metal stent after migration and incorporation in the omental bursa, using a gastroscopic-transgastric laparoscopic rendezvous technique. J Minim Access Surg 2015; 11 (3): 207–209. doi: 10.4103/0972-9941.147 365.
10. Lakhtakia S, Basha J, Nabi Z et al. Salvaging a malpositioned fully covered self-expanding metal stent for pancreatic fluid collection drainage. Endoscopy 2016; 48 (Suppl 1): E180–E181. doi: 10.1055/s-0042-106966.
11. Wang GX, Liu X, Wang S et al. Stent diplacement in endoscopic pancreatic pseudocyst drainage and endoscopic management. World J Gastroenterol 2015; 21 (7): 2249–2253. doi: 10.3748/wjg.v21.i7.2249.
12. Tarantino I, Di Pisa M, Barresi L et al. Covered self expandable metallic stent with flared plastic one inside for pancreatic pseudocyst avoiding stent dislodgement. World J Gastrointest Endosc 2012; 4 (4): 148–150. doi: 10.4253/wjge.v4.i4.148.
Labels
Paediatric gastroenterology Gastroenterology and hepatology Surgery
Article was published inGastroenterology and Hepatology
2018 Issue 3-
All articles in this issue
- Editorial šéfredaktora časopisu
- Digestivní endoskopie
- Cholangiopankreatoskopie – doporučený postup České gastroenterologické společnosti ČLS JEP
- Endoskopická transmurální resekce v léčbě lokálních reziduálních neoplazií tlustého střeva – analýza souboru 19 pacientů
- Případ maligního melanomu metastazujícího do pankreatu
- Úspěšná léčba krvácení z aortoezofageální píštěle metalickým samoexpandibilním stentem
- Migrace samoexpandibilního metalického stentu do drénované pseudocysty po endoskopické pseudocystogastrostomii a jeho endoskopická extrakce
- Adenóm Brunnerových žliaz – zriedkavá príčina krvácania z gastrointestinálneho traktu
- Příspěvek k problematice hepatorenálního poškození a selhání
- Naše zkušenosti s léčbou masivního krvácení u Crohnovy nemoci pomocí anti-TNF terapie
- Intoxikácia Amanita phalloides – stále aktuálny problém?
- Tumorózní atrioezofageální píštěl jako neobvyklý zdroj sepse
- Nový člen redakční rady časopisu
- 40th Czech and Slovak Endoscopic Days 19th Endoscopic Day IKEM
- Výběr z mezinárodních časopisů
- Vistaprep – standard přípravy střeva před koloskopickým vyšetřením
- Srovnání endoskopické slizniční resekce a endoskopické submukózní disekce při léčbě plochých neoplastických lézí konečníku
- Gastroenterology and Hepatology
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Vistaprep – standard přípravy střeva před koloskopickým vyšetřením
- Tumorózní atrioezofageální píštěl jako neobvyklý zdroj sepse
- Intoxikácia Amanita phalloides – stále aktuálny problém?
- Naše zkušenosti s léčbou masivního krvácení u Crohnovy nemoci pomocí anti-TNF terapie
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

