-
Medical journals
- Career
Prediktivní diagnostika adenokarcinomu žaludku – stav v roce 2018
Authors: Ondřej Daum 1,2; Magdaléna Dubová 1,2; Alena Skálová 1,2; Tomáš Rozkoš 3; Jan Laco 3
Authors‘ workplace: Šiklův ústav patologie LF UK v Plzni a FN Plzeň 1; Bioptická laboratoř, s. r. o., Plzeň 2; Fingerlandův ústav patologie LF UK v Hradci Králové a FN Hradec Králové 3
Published in: Čes.-slov. Patol., 54, 2018, No. 1, p. 23-26
Category: Reviews Article
Overview
V současné klinické praxi cílenou terapii žaludečního adenokarcinomu představuje použití anti-HER2 monoklonální protilátky trastuzumabu u nádorů s imunohistochemickým skóre 3+ a zároveň s prokázanou amplifikací genu HER2 in situ hybridizací. Na základě současných poznatků o molekulární biologii adenokarcinomu žaludku, roli nádorového mikroprostředí a jeho cévním zásobení se jako slibné možnosti dalšího vývoje cílené terapie jeví zejména ovlivnění PD-1/PD-L1 a inhibice VEGFR2. Studie efektivity nových postupů cílené terapie, stejně jako zavádění metodik prediktivní diagnostiky, jsou však komplikovány nedostatečnou subtypizací nádorů ve studovaných souborech.
Klíčová slova:
žaludek – adenokarcinom – prediktivní diagnostika – cílená terapie – HER2 – PD-1 – PD-L1 – VEGFR
Počátky cílené terapie adenokarcinomu žaludku založené na morfologické prediktivní diagnostice byly položeny v roce 2010 studií ToGA, která určila kritéria indikace k léčbě monoklonální protilátkou proti HER2 (1). Od té doby došlo jak k pokrokům v poznání molekulární biologie žaludečního karcinomu, tak k vývoji nových monoklonálních protilátek a nízkomolekulárních inhibitorů receptorových tyrozinkináz potenciálně využitelných v cílené terapii žaludečního adenokarcinomu. Pozornost byla věnována možnostem ovlivnění dalších molekul tvořících intracelulární signální kaskády, angiogeneze nebo v současné době velmi oblíbených kontrolních bodů imunitní odpovědi (angl. „immune checkpoints“), která se může v regulaci růstu a šíření některých typů žaludečního adenokarcinomu významně uplatňovat. Přes všechny tyto dílčí úspěchy je však i dnes jedinou schválenou cílenou terapií adenokarcinomu žaludku založenou na prediktivní diagnostice metodami moderní patologie inhibice HER2 monoklonální protilátkou trastuzumabem. V České republice však doznal určitých změn algoritmus indikace této léčby.
HER2
Hlavní a z hlediska širšího praktického využití zatím jedinou cílenou terapií adenokarcinomu žaludku (a kardie) zůstává použití anti-HER2 monoklonálních protilátek (trastuzumab). Základy této terapie a principy její prediktivní diagnostiky byly na stránkách Česko-slovenské patologie popsány již před 6 lety (2). Principy imunohistochemické diagnostiky exprese HER2 zůstaly od té doby nezměněny, z praktických důvodů si dovolujeme zde znovu otisknout původní tabulku (tab. 1) schematicky ilustrující postup imunohistochemického vyšetření, v detailech odkazujeme na původní text. V České republice však doznala změn indikace k následnému vyšetření amplifikace HER2 metodami in situ hybridizace (ISH), a tím pádem i k případné cílené terapii. Zatímco dříve byly k cílené terapii indikovány karcinomy s imunohistochemickým skóre 3+ (bez nutnosti dalšího vyšetření ISH) a karcinomy se skóre 2+, v nichž byla následně metodami ISH prokázána amplifikace HER2, dnes je terapie trastuzumabem hrazena pouze pacientům s nádory s imunohistochemickým skóre 3+ a současně s prokázanou amplifikací HER2 (obr. 1), což jsou kritéria striktnější než požadovaná Českou onkologickou společností (3). To zároveň také znamená, že k vyšetření ISH jsou nyní indikovány pouze žaludeční adenokarcinomy s imunohistochemickým skóre 3+.
Image 1. Algoritmus indikace terapie trastuzumabem na základě morfologické prediktivní diagnostiky. 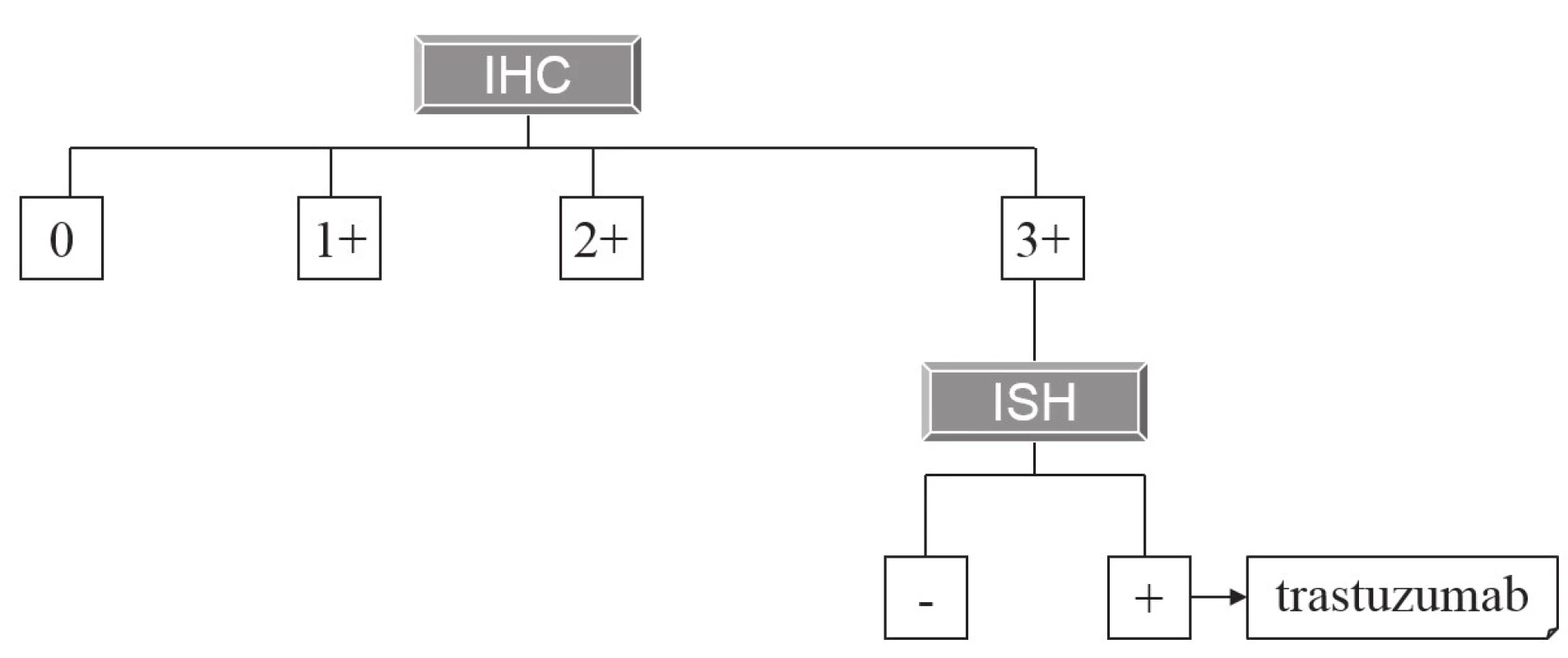
Pouze nádory, které mají imunohistochemické skóre overexprese HER2 3+, jsou indikovány k vyšetření amplifikace HER2 metodou in situ hybridizace. V případě pozitivního výsledku jsou určeny k terapii trastuzumabem. Table 1. Kritéria pro imunohistochemické skórování exprese HER2 v adenokarcinomu žaludku. 
Dalšími novinkami v této oblasti je vývoj nových léků ovlivňujících funkci HER2. Dosavadní studie bohužel neprokázaly účinnost nízkomolekulárního inhibitoru receptorových tyrosinkináz EGFR/HER2 lapatinibu (4-6), slibněji se v dosavadních studiích jeví užití pertuzumabu, monoklonální protilátky zabraňující dimerizaci HER2 s jinými receptory rodiny HER (7). Zatím však není známo, zda tento přípravek bude schválen k použití v cílené terapii karcinomu žaludku, ani jaký by případně byl algoritmus příslušné prediktivní diagnostiky.
Další signální kaskády asociované s receptory pro růstové faktory
V posledních letech byly studovány také možnosti využití cílené inhibice EGFR, mTOR nebo MET/HGF. Bohužel klinické studie fáze III neprokázaly účinnost terapie cílené na tyto molekuly, a to často i přes slibné výsledky studií fáze I/II. Otázkou však je, nakolik byly výsledky studií ovlivněny metodikou, která mnohdy nezohledňuje biologickou pestrost žaludečního adenokarcinomu. Například studie terapeutické účinnosti anti-EGFR monoklonálních protilátek cetuximabu (8) a panitumumabu (9) opomíjejí stratifikaci nádorů na základě mutační analýzy genů KRAS a NRAS, která je dobře známá již z problematiky prediktivní diagnostiky kolorektálního karcinomu, stejně jako distribuci těchto mutací v jednotlivých molekulárních podtypech žaludečního karcinomu (10). Kvůli inkompletním poznatkům současné molekulární biologie o regulaci a vzájemném propojení jednotlivých signálních kaskád nemohla být ani studie účinnosti inhibitoru mTOR everolimu založena na racionálním výběru testované skupiny na podkladě vhodných prediktivních markerů (11). K inhibici signální kaskády MET/HGF byly vyvinuty jednak monoklonální protilátky proti růstovému faktoru hepatocytů (HGF, scattered factor, SF) onartizumab a rilotumumab, jednak nízkomolekulární inhibitory receptorové tyrozinkinázy receptoru pro růstový faktor hepatocytů (MET) crizotinib, foretinib, tivantinib (12-16). Výsledky klinických studií jsou však zatím rozporuplné, pravděpodobně zejména kvůli nedostatečnému zohlednění heterogenity imunohistochemické pozitivity MET, nejasnému vztahu mezi intenzitou exprese na membráně nádorových buněk a procentem pozitivních buněk, a nezařazení mutační analýzy KRAS a PIK3CA mezi kritéria pro indikaci k této cílené léčbě (17).
Molekulární klasifikace žaludečního adenokarcinomu a inhibice PD-1/PD-L1
V současné době se již jeví koncepce nádoru jako jedné nemoci s nebo bez aktivace určité signální kaskády jako neudržitelná. Naopak, současným trendem je subtypizace jednotlivých nádorů (a tedy i žaludečního adenokarcinomu) do skupin charakterizovaných určitými molekulárními znaky, v optimálním případě asociovanými i s charakteristikami morfologickými a klinickými. V roce 2014 byla představena klasifikace TCGA (The Cancer Genome Atlas), která rozděluje žaludeční adenokarcinom na 4 podskupiny: s nestabilitou mikrosatelitů (MSI), asociovanou s infekcí EBV, s chromozomální nestabilitou (CIN) a se stabilním genomem (GS) (18). O rok později navázala na TCGA klasifikace ACRG (Asian Cancer Research Group) (19), jejíž podskupiny do značné míry korespondují s podskupinami podle TCGA a dále je rozvíjejí (tab. 2) (20,21).
Table 2. Současné molekulární klasifikace adenokarcinomu žaludku. 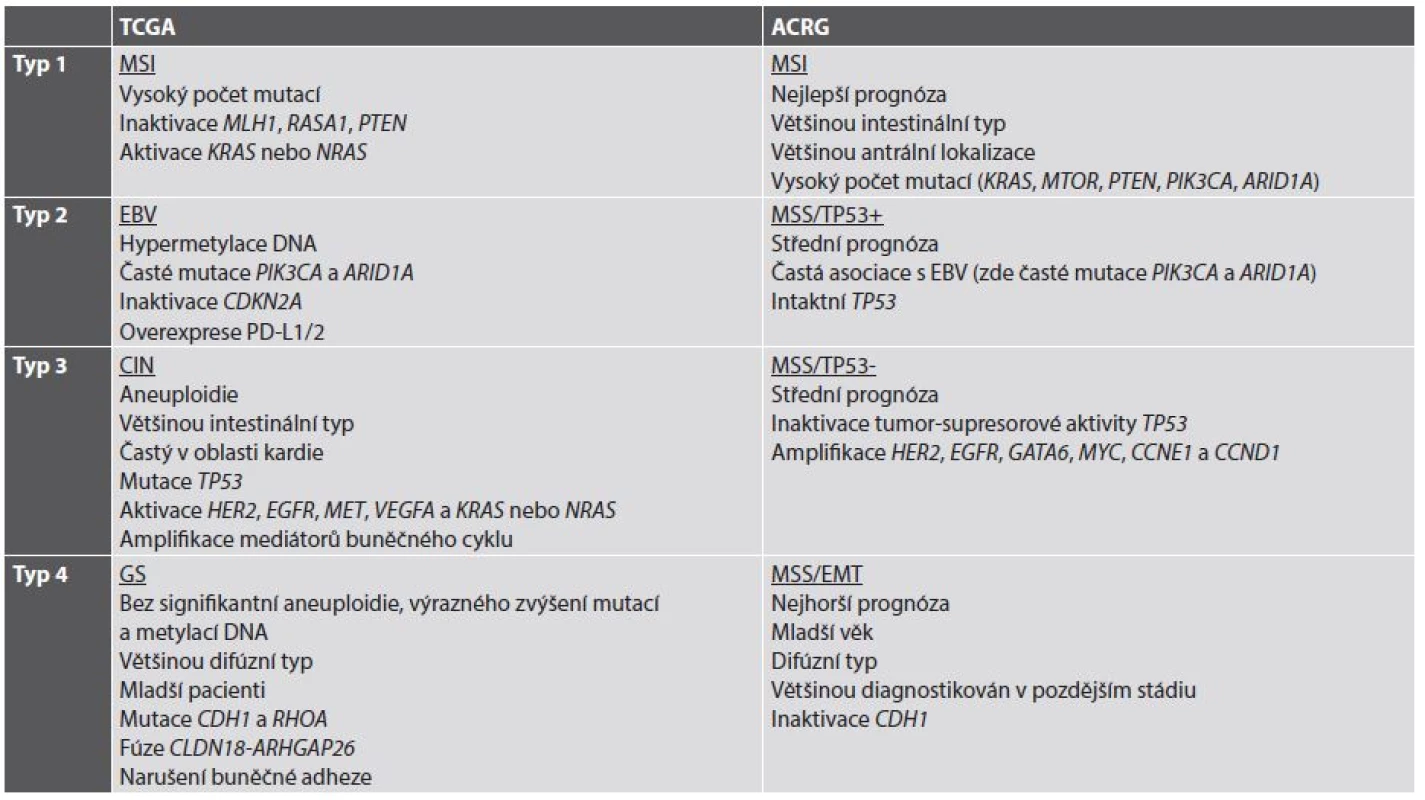
Volně podle (20,21). TCGA: The Cancer Genome Atlas. ACRG: Asian Cancer Research Group (další zkratky viz jejich seznam) Z hlediska cílené terapie a prediktivní diagnostiky je v současné době nejzajímavější informací vyplývající z molekulární klasifikace adenokarcinomu žaludku možnost použití terapie zaměřené na kontrolní body (checkpointy) imunitní reakce, konkrétně na signalizaci PD-1/PD-L1, a to v nádorech se signifikantní expresí neoantigenů na povrchu nádorových buněk v důsledku četných somatických mutací, tedy hlavně v žaludečních adenokarcinomech asociovaných s infekcí EBV a v nádorech s MSI. Protože cílená terapie zaměřená na inhibici PD-1/PD-L1 je v současné době doménou plicní onkologie a patologie, ponechávám bližší výklad jejího mechanismu na příslušné kapitole o prediktivní diagnostice v plicní patologii. V žaludečním adenokarcinomu je z morfologického hlediska exprese PD-L1 asociována s výraznou lymfocytární infiltrací nádoru a s jeho difúzním nebo smíšeným histologickým typem podle Lauréna (22); z klinických parametrů je asociována s velikostí nádoru, hloubkou invaze, lymfatickými metastázami a špatnou prognózou (22-24). Dosavadní klinické studie s monoklonálními protilátkami proti PD-1 pembrolizumabem a nivolumabem prokázaly objektivní odpověď u některých pacientů s (neselektovanými) žaludečními karcinomy zařazenými do těchto studií (25,26). I přes tyto dílčí úspěchy však dosud není jasné, zda cílená terapie adenokarcinomu žaludku inhibitory signalizace PD-1/PD-L1 bude schválena, stejně jako nejsou dosud známá případná kritéria selekce pacientů pro tuto terapii.
Inhibice angiogeneze
Vzhledem k nesporné roli vaskularizace nádoru v jeho šíření je pochopitelné, že i u žaludečního adenokarcinomu se zájem obrací také k možnostem inhibice angiogeneze. Na rozdíl od kolorektálního karcinomu se neprokázalo prodloužení celkového přežití u pacientů se žaludečním adenokarcinomem léčeným monoklonální protilátkou proti VEGF bevacizumabem (27,28); jako terapeuticky účinná se však prokázala monoklonální protilátka proti VEGFR2 ramucirumab (29,30) a nejnověji nízkomolekulární inhibitor receptorové tyrozinkinázy téže molekuly apatinib (31). I přes účinnost těchto látek v klinických studiích a možnosti jejich schválení pro léčbu žaludečního adenokarcinomu nejsou v současné době patrné tendence k selekci pacientů pro tuto terapii na základě morfologické diagnostiky.
ZÁVĚR
I přes značné pokroky v porozumění molekulární patogenezi žaludečního adenokarcinomu je jeho cílená terapie stále založena na trastuzumabu, monoklonální protilátce proti HER2, ačkoli se v České republice změnila indikační kritéria založená na imunohistochemickém vyšetření a in situ hybridizaci. Další potenciální novinkou v anti-HER2 terapii by mohlo být zavedení pertuzumabu, který inhibuje tvorbu heterodimerů HER2 s jinými receptory rodiny HER, do kombinované léčby s trastuzumabem. U nádorů asociovaných s infekcí EBV a u adenokarcinomů s nestabilitou mikrosatelitů se také jako perspektivní jeví možnost využití blokády imunitního checkpointu PD-1/PD-L1 monoklonálními protilátkami proti PD-L1. Prodloužení celkového přežití také lze očekávat od inhibice VEGFR2. V současné době však histopatologická prediktivní diagnostika hraje stále roli pouze v indikaci léčby trastuzumabem.
PODĚKOVÁNÍ
Tento výstup vznikl v rámci projektu Specifického vysokoškolského výzkumu 2017–260 391, programu PROGRES Q40/11 a projektu BBMRI-CZ LM2015089.
The work was supported by the grant SVV 2017–260 391, by program PROGRES Q40/11 and by project BBMRI-CZ LM2015089.
PROHLÁŠENÍ
Autor práce prohlašuje, že v souvislosti s tématem, vznikem a publikací tohoto článku není ve střetu zájmů a vznik ani publikace článku nebyly podpořeny žádnou farmaceutickou firmou. Toto prohlášení se týká i všech spoluautorů.
SEZNAM ZKRATEK
ARHGAP26: Rho GTPase Activating Protein 26
ARID1A: AT-rich Interactive Domain-Containing Protein 1A
CCND1: Cyclin D1
CCNE1: Cyclin E1
CDH1: Cadherin 1
CDKN2A: Inhibitor cyklin-dependentní kinázy 2A (Cyclin-dependent Kinase Inhibitor 2A)
CIN: Chromozomální nestabilita (Chromosome Instability)
CLDN18: Claudin 18
EGFR: Receptor pro epidermální růstový faktor (Epidermal Growth Factor Receptor)
GATA6: GATA-Binding Factor 6
GS: Stabilita genomu (Genome stability)
HER: Lidský receptor pro epidermální růstový faktor (Human Epidermal Growth Factor Receptor)
HGF: Růstový faktor hepatocytů (Hepatocyte Growth Factor)
HGFR: Receptor pro růstový faktor hepatocytů (Hepatocyte Growth Factor Receptor, MET)
ISH: In situ hybridizace
KRAS: homolog virového onkogenu Kirsten Rat Sarcoma
MLH1: MutL homolog 1
MSI: Nestabilita mikrosatelitů (Microsatellite Instability)
MSS/EMT: Nádor se stabilitou mikrosatelitů a epiteliálně-mezenchymální tranzicí
MSS/TP53-: Nádor se stabilitou mikrosatelitů a inaktivací tumor-supresorové funkce genu TP53
MSS/TP53+: Nádor se stabilitou mikrosatelitů a intaktní tumor-supresorovou funkcí genu TP53
mTOR: Mechanistický (dříve savčí) cíl rapamycinu (mechanistic (formerly mammalian) Target of Rapamycin)
MYC: Lidský homolog virového onkogenu ptačí myelocytomatózy (Avian Myelocytomatosis Viral Oncogene Homolog)
NRAS: gen Neuroblastoma RAS
PD-1: Receptor programované smrti-1 (Programmed Death Receptor-1)
PD-L1: Ligand receptoru programované smrti-1 (Programmed Death Ligand-1)
PIK3CA: Katalytická podjednotka alfa Fosfatidylinositol 3-kinázy (Phosphatidylinositol-4,5-Bisphosphate 3-Kinase Catalytic Subunit Alpha)
PTEN: Phosphatase and Tensin Homolog
RASA1: Aktivátorový protein 1 GTPázy proteinu RAS (RAS p21 Protein Activator 1, Ras GTPase Activating Protein)
RHOA: Ras Homolog Gene Family, Member A
SF: Scattered Factor
TP53: Tumor Protein 53
VEGF: Vaskulární endoteliální růstový faktor (Vascular Endothelial Growth Factor)
VEGFR2: Receptor pro vaskulární endoteliální růstový faktor 2 (Vascular Endothelial Growth Factor Receptor 2)Adresa pro korespondenci:
Doc. MUDr. Ondřej Daum, Ph.D.
Šiklův ústav patologie LF UK a FN Plzeň
Edvarda Beneše 13, 305 99 Plzeň
tel.: +420377402523
email: DAUM@fnplzen.cz
Sources
1. Bang YJ, Van Cutsem E, Feyereislova A, et al. Trastuzumab in combination with chemotherapy versus chemotherapy alone for treatment of HER2-positive advanced gastric or gastro-oesophageal junction cancer (ToGA): a phase 3, open-label, randomised controlled trial. Lancet 2010; 376(9742): 687-697.
2. Daum O, Skálová A, Rozkoš T, Laco J. Prediktivní diagnostika HER2 v adenokarcinomu žaludku. Cesk Patol 2011; 47(4): 160-163.
3. Vyzula R. Modrá kniha České onkologické společnosti (23. aktualizace). Brno: Masarykův onkologický ústav; 2017 : 228.
4. Satoh T, Xu RH, Chung HC, et al. Lapatinib plus paclitaxel versus paclitaxel alone in the second-line treatment of HER2-amplified advanced gastric cancer in Asian populations: TyTAN-a randomized, phase III study. J Clin Oncol 2014; 32(19): 2039-2049.
5. Lorenzen S, Riera Knorrenschild J, Haag GM, et al. Lapatinib versus lapatinib plus capecitabine as second-line treatment in human epidermal growth factor receptor 2-amplified metastatic gastro-oesophageal cancer: a randomised phase II trial of the Arbeitsgemeinschaft Internistische Onkologie. Eur J Cancer 2015; 51(5): 569-576.
6. Hecht JR, Bang YJ, Qin SK, et al. Lapatinib in combination with capecitabine plus oxaliplatin in human epidermal growth factor receptor 2-positive advanced or metastatic gastric, esophageal, or gastroesophageal adenocarcinoma: TRIO-013/LOGiC - a randomized phase III trial. J Clin Oncol 2016; 34(5): 443-451.
7. Kang YK, Rha SY, Tassone P, et al. A phase IIa dose-finding and safety study of first-line pertuzumab in combination with trastuzumab, capecitabine and cisplatin in patients with HER2-positive advanced gastric cancer. Br J Cancer 2014; 111(4): 660-666.
8. Lordick F, Kang YK, Chung HC, et al. Capecitabine and cisplatin with or without cetuximab for patients with previously untreated advanced gastric cancer (EXPAND): a randomised, open-label phase 3 trial. Lancet Oncol 2013; 14(6): 490-499.
9. Waddell T, Chau I, Cunningham D, et al. Epirubicin, oxaliplatin, and capecitabine with or without panitumumab for patients with previously untreated advanced oesophagogastric cancer (REAL3): a randomised, open-label phase 3 trial. Lancet Oncol 2013; 14(6): 481-489.
10. Queiros P, Pinheiro H, Carvalho J, et al. KRAS mutations in microsatellite instable gastric tumours: impact of targeted treatment and intratumoural heterogeneity. Virchows Arch 2015; 467(4): 383-392.
11. Ohtsu A, Ajani JA, Bai YX, et al. Everolimus for previously treated advanced gastric cancer: results of the randomized, double-blind, phase III GRANITE-1 study. J Clin Oncol 2013; 31(31): 3935-3943.
12. Lennerz JK, Kwak EL, Ackerman A, et al. MET amplification identifies a small and aggressive subgroup of esophagogastric adenocarcinoma with evidence of responsiveness to crizotinib. J Clin Oncol 2011; 29(36): 4803-4810.
13. Shah MA, Wainberg ZA, Catenacci DV, et al. Phase II study evaluating 2 dosing schedules of oral foretinib (GSK1363089), cMET/VEGFR2 inhibitor, in patients with metastatic gastric cancer. PLoS One 2013; 8(3): e54014.
14. Hack SP, Bruey JM, Koeppen H. HGF/MET-directed therapeutics in gastroesophageal cancer: a review of clinical and biomarker development. Oncotarget 2014; 5(10): 2866-2880.
15. Jardim DL, de Melo Gagliato D, Falchook GS, et al. MET aberrations and c-MET inhibitors in patients with gastric and esophageal cancers in a phase I unit. Oncotarget 2014; 5(7): 1837-1845.
16. Kang YK, Muro K, Ryu MH, et al. A phase II trial of a selective c-Met inhibitor tivantinib (ARQ 197) monotherapy as a second - or third-line therapy in the patients with metastatic gastric cancer. Invest New Drugs 2014; 32(2): 355-361.
17. Metzger ML, Behrens HM, Boger C, Haag J, Kruger S, Rocken C. MET in gastric cancer - discarding a 10% cutoff rule. Histopathology 2016; 68(2): 241-253.
18. Cancer Genome Atlas Research Network. Comprehensive molecular characterization of gastric adenocarcinoma. Nature 2014; 513(7517): 202-209.
19. Cristescu R, Lee J, Nebozhyn M, et al. Molecular analysis of gastric cancer identifies subtypes associated with distinct clinical outcomes. Nat Med 2015; 21(5): 449-456.
20. Hayakawa Y, Sethi N, Sepulveda AR, Bass AJ, Wang TC. Oesophageal adenocarcinoma and gastric cancer: should we mind the gap? Nat Rev Cancer 2016; 16(5): 305-318.
21. Chan BA, Jang RW, Wong RK, Swallow CJ, Darling GE, Elimova E. Improving outcomes in resectable gastric cancer: A review of current and future strategies. Oncology (Williston Park) 2016; 30(7): 635-645.
22. Li Z, Lai Y, Sun L, et al. PD-L1 expression is associated with massive lymphocyte infiltration and histology in gastric cancer. Hum Pathol 2016; 55(9): 182-189.
23. Wu C, Zhu Y, Jiang J, Zhao J, Zhang XG, Xu N. Immunohistochemical localization of programmed death-1 ligand-1 (PD-L1) in gastric carcinoma and its clinical significance. Acta Histochem 2006; 108(1): 19-24.
24. Thompson ED, Zahurak M, Murphy A, et al. Patterns of PD-L1 expression and CD8 T cell infiltration in gastric adenocarcinomas and associated immune stroma. Gut 2017; 66(5): 794-801.
25. Muro K, Chung HC, Shankaran V, et al. Pembrolizumab for patients with PD-L1-positive advanced gastric cancer (KEYNOTE-012): a multicentre, open-label, phase 1b trial. Lancet Oncol 2016; 17(6): 717-726.
26. Goode EF, Smyth EC. Immunotherapy for gastroesophageal cancer. J Clin Med 2016; 5(10).
27. Van Cutsem E, de Haas S, Kang YK, et al. Bevacizumab in combination with chemotherapy as first-line therapy in advanced gastric cancer: a biomarker evaluation from the AVAGAST randomized phase III trial. J Clin Oncol 2012; 30(17): 2119-2127.
28. Shen L, Li J, Xu J, et al. Bevacizumab plus capecitabine and cisplatin in Chinese patients with inoperable locally advanced or metastatic gastric or gastroesophageal junction cancer: randomized, double-blind, phase III study (AVATAR study). Gastric Cancer 2015; 18(1): 168-176.
29. Fuchs CS, Tomasek J, Yong CJ, et al. Ramucirumab monotherapy for previously treated advanced gastric or gastro-oesophageal junction adenocarcinoma (REGARD): an international, randomised, multicentre, placebo-controlled, phase 3 trial. Lancet 2014; 383(9911): 31-39.
30. Wilke H, Muro K, Van Cutsem E, et al. Ramucirumab plus paclitaxel versus placebo plus paclitaxel in patients with previously treated advanced gastric or gastro-oesophageal junction adenocarcinoma (RAINBOW): a double-blind, randomised phase 3 trial. Lancet Oncol 2014; 15(11): 1224-1235.
31. Li J, Qin S, Xu J, et al. Randomized, double-blind, placebo-controlled phase III trial of apatinib in patients with chemotherapy-refractory advanced or metastatic adenocarcinoma of the stomach or gastroesophageal junction. J Clin Oncol 2016; 34(13): 1448-1454.
Labels
Anatomical pathology Forensic medical examiner Toxicology
Article was published inCzecho-Slovak Pathology

2018 Issue 1-
All articles in this issue
- Prediktivní diagnostika u karcinomu prsu – co je nového pro rok 2018?
- Predikce odpovědi metastatického kolorektálního karcinomu na cílenou anti-EGFR léčbu
- Prediktivní diagnostika adenokarcinomu žaludku – stav v roce 2018
- Hodnocení zánětlivé infiltrace (tumor infiltrujících lymfocytů – TIL) u maligního melanomu
- Dediferencovaný karcinom ovaria – kazuistika
- Nefunkční karcinom parathyroidey v terénu parathyreomatózy. Kazuistika
- Czecho-Slovak Pathology
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Hodnocení zánětlivé infiltrace (tumor infiltrujících lymfocytů – TIL) u maligního melanomu
- Dediferencovaný karcinom ovaria – kazuistika
- Prediktivní diagnostika u karcinomu prsu – co je nového pro rok 2018?
- Predikce odpovědi metastatického kolorektálního karcinomu na cílenou anti-EGFR léčbu
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

