-
Medical journals
- Career
Význam vyšetření mozkomíšního moku u neuropsychiatrického systémového lupus erythematodes
Authors: V. Balajková; M. Olejárová
Authors‘ workplace: Revmatologická klinika 1. LF UK, Praha ; Revmatologický ústav, Praha
Published in: Čes. Revmatol., 26, 2018, No. 1, p. 23-33.
Category: Review Article
Overview
Neuropsychiatrické postižení u systémového lupus erythematodes (NPSLE) představuje závažnou komplikaci této choroby, která významně zhoršuje kvalitu života nemocného. Jde o jeden z nejkomplexnějších projevů systémového lupusu, který může postihnout centrální, periferní i autonomní nervový systém. Přesná patofyziologie tohoto onemocnění není dosud známa a specifický biomarker sloužící k jejímu odhalení také ne. Vyšetření mozkomíšního moku je v posledních letech věnována větší pozornost, zejména při diagnostickém algoritmu NPSLE. Mimo standardní cytologické, biochemické a imunologické vyšetření nabízí též možnost detekce autoprotilátek, zánětlivých mediátorů a poruchy hematoencefalické bariéry.
Cílem této práce je shrnout nejčastější likvorové nálezy u pacientů s neuropsychiatrickým postižením u systémového lupus erythematodes. Nejčastějším typem celulární odpovědi v likvoru NPSLE je mírná pleocytóza s převahou lymfocytů, u transverzální myelitidy pak neutrofilní granulocytóza. V biochemickém vyšetření bývá v likvoru až v polovině případů zvýšena celková bílkovina, stejně tak jako elevace Q albuminového kvocientu, který ukazuje na poškození hematoencefalické bariéry. Častým nálezem také bývá zvýšení IgG indexu a detekce intratékální oligoklonální syntézy IgG. Z prozánětlivých cytosinů jsou v likvoru ve většině případů NPSLE přítomny IL-6 a IL-8. Z autoprotilátek vykazují asociaci s NPSLE anti-RP, anti-N, anti-U1RNP a anti-Sm protilátky.
Klíčová slova:
neuropsychiatrický systémový lupus erythematodes, mozkomíšní mokÚvod
Systémový lupus erythematodes (SLE) je chronické autoimunitní onemocnění, charakterizované širokou škálou manifestací s multiorgánovým postižením (1). Mezi nejčastější manifestace patří neuropsychiatrický lupus (NPSLE), představující souhrnné označení pro afekci jak centrálního a periferního nervového systému, tak i psychiatrických abnormalit. NPSLE výrazně zhoršuje kvalitu života i prognózu nemocného (2) a vyskytuje se u 12 až 95 % pacientů se SLE (3–6).
Až do roku 1999 nebyla nomenklatura hodnocení neuropsychiatrického postižení jednotná. Tehdy Americká revmatologická společnost (ACR) ve spolupráci s neurology stanovila set devatenácti syndromů postihujících centrální či periferní nervový systém (tabulka 1) (7).
Table 1. Neuropsychiatrické syndromy u NPSLE. 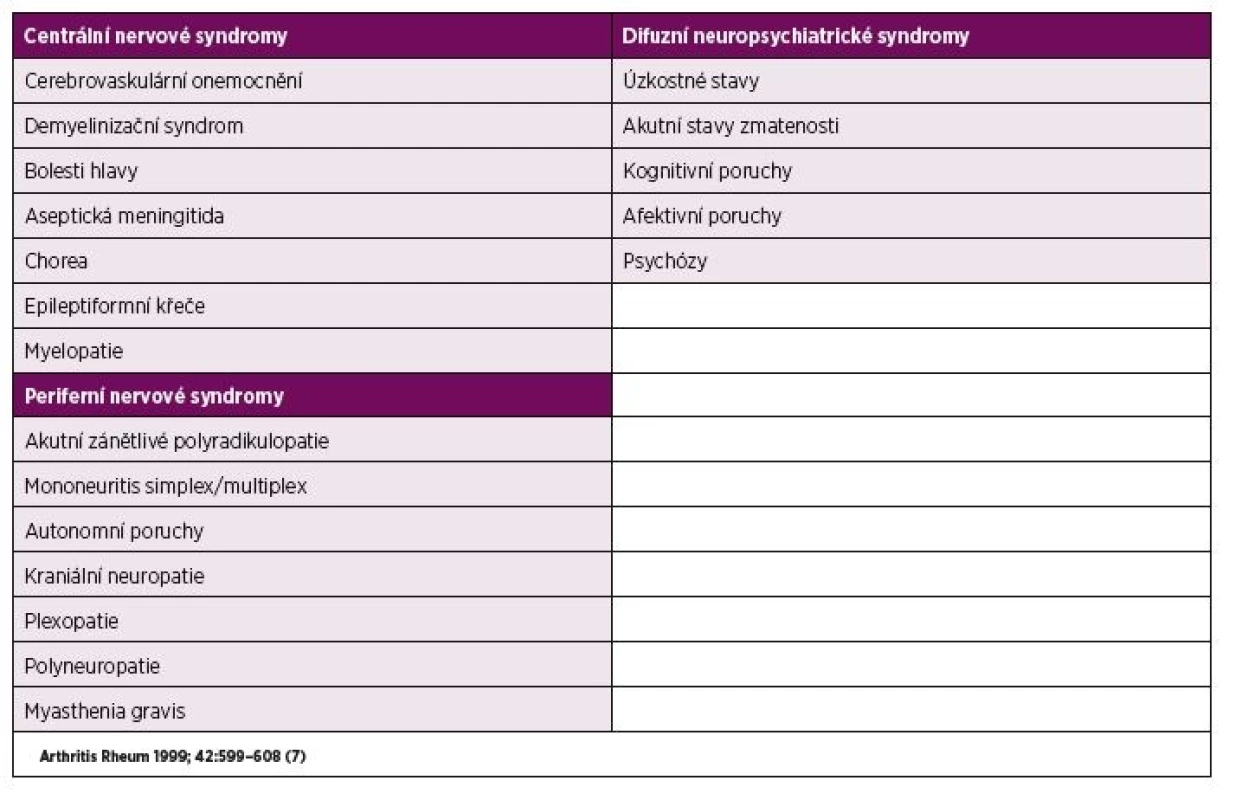
Problémem ale zůstává relativně nízká specificita této klasifikace. Protože však dosud nebyl objeven jednoznačný biomarker neuropsychiatrického postižení, představuje diagnóza NPSLE v klinické praxi stále jistou výzvu. Kromě nomenklatury doporučila ACR také diagnostické nástroje pro každý z 19 syndromů NPSLE k odhalení jednotlivých typů postižení, mezi které patří vyšetření krevních vzorků (základní biochemické vyšetření, krevní obraz, komplement, autoprotilátky, C-reaktivní protein a sedimentace erytrocytů), zobrazovací metody (MR mozku, CT, tomografická scintigrafie – SPECT a další) a v neposlední řadě také analýza mozkomíšního moku. Vyšetření likvoru se u NPSLE dříve využívalo zejména k vyloučení jiných příčin neuropsychiatrické symptomatologie, jako jsou např. neuroinfekce, tumory aj., v posledních letech se však toto vyšetření stává nedílnou součástí vlastního diagnostického algoritmu.
Vyšetření mozkomíšního moku
Analýza mozkomíšního moku se v posledních letech jeví jako cenné vyšetření pro stanovení diagnózy NPSLE. Italská pracovní skupina (Mosca et al.) udává, že abnormality v likvoru lze detekovat až u 30–40 % pacientů s aktivním NPSLE (8). Již vzhled (barva a zákal) cerebrospinálního moku, odebraného lumbální či ve výjimečných případech subokcipitální punkcí, poskytuje prvotní informaci v diferenciální diagnóze. Například u purulentních meningitid či encefalitid (hnisavých zánětů CNS) bývá likvor zkalený a nažloutlý až zelený (9). K odlišení infekcí CNS se krom jiného využívá mikrobiologického vyšetření mozkomíšního moku. Vyšetření specifických protilátek proti patogenním agens, kultivační vyšetření či PCR detekce nám mohou na pomoci vyloučit infekční zánět CNS.
Mezi základní vyšetření likvoru u NPSLE pacientů poté patří: cytologické vyšetření, biochemické vyšetření a detekce autoprotilátek.
Cytologické vyšetření
Cytologické vyšetření zahrnuje kvalitativní i kvantitativní zhodnocení mozkomíšního moku. Celkový počet elementů má pouze nízkou výpovědní hodnotu. Význam má v tomto případě pouze pleocytóza, která je obecně považována za patologický jev. Avšak ani normální počet elementů nemusí znamenat normální nález. Z tohoto důvodu se zhotovují trvalé cytologické preparáty v základním barvení May-Grünwald a Giemsa-Romanowski (MGG), které umožňují při zánětlivých procesech identifikovat jak jednotlivé leukocytární řady, tak i stupeň aktivace lymfocytární populace včetně plazmocytárních forem (10). U případů NPSLE s transverzální myelitidou byla např. popsána granulocytární pleocytóza, kde byl výrazně zvýšen počet leukocytů s 99 %neutrofilních granulocytů (11, 12). Pleocytóza s převahou leukocytů a 85 % neutrofilních granulocytů byla taktéž popsána u ischemického cerebrovaskulárního postižení asociovaného se systémovým lupus erythematodes (13). Ve většině případů neuropsychiatrického lupusu však počet leukocytů nepřesahuje 50/mm3 (14–17). To potvrzují i dva případy lupusové cerebritidy, zde byla však při kvalitativním hodnocení popsána pleocytóza lymfocytární (lymfocyty až ve 100 %) (17). Čínská studie zabývající se cytologickým obrazem likvoru NPSLE pacientů prokázala u 25 z 75 (33 %) z nich zánětlivou reakci (zvýšený počet neutrofilních granulocytů a lymfocytů) s prezentací abnormálních fagocytů (18). Vyšetření likvoru u NPSLE pacientů provedla i pracovní skupina neurologů a revmatologů z Prahy, kdy jako obvyklý typ celulární odpovědi byla popsána monocytární oligocytóza doprovázená aktivací monocyto-makrofágové buněčné řady (19).
Biochemické vyšetření
K základním parametrům biochemického vyšetření u NPSLE patří zejména bílkoviny, imunoglobuliny a cytokiny. Mezi další patří glukóza, jejíž hladina bývá u NPSLE pacientů v normě či snížená, laktát či proteiny akutní fáze a zánětlivé markery (CRP, transferin – Trf, prealbumin – PAB či komplement).
Především bílkoviny se používají k posouzení integrity hematoencefalické bariéry (HEB).
U pacientů s NPSLE bývá celková bílkovina v likvoru zvýšena zhruba v polovině případů (8, 13, 17, 20). Koncentrace celkové bílkoviny v likvoru však umožňuje pouze orientační zhodnocení stavu HEB. Pro přesnější posouzení permeability se užívá výpočet albuminového kvocientu (Q Alb = 1 000x albumin likvor/albumin krev), jehož normální hodnota se pohybuje pod 0,0076 (21). Při interpretaci albuminového kvocientu je však nutné pamatovat na jeho měnící s hodnoty v závislosti na věku (tabulka 2). Elevace likvorového Q Alb jakožto důkaz porušení HEB je popisována u více než 50 % pacientů s difuzní či centrální formou neurolupusu (akutní stavy zmatenosti, kognitivní poruchy, psychózy…) (8, 21–24).
Table 2. Závislost hodnoty Qalb na věku. 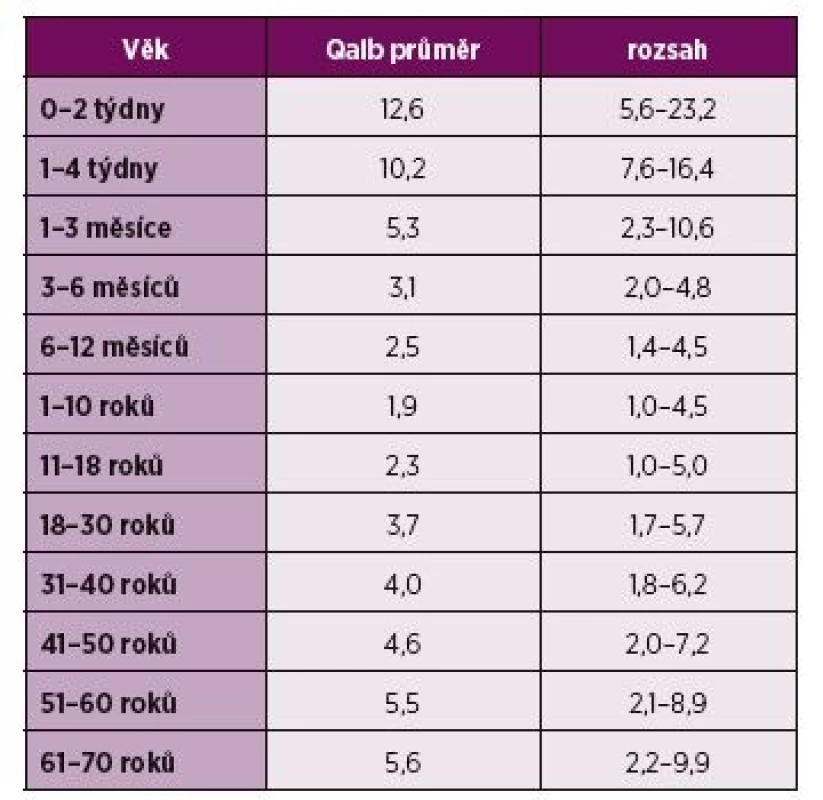
Qalb – albuminový kvocient, bezrozměrná hodnota
Sobek et al. (28)Kromě elevace bílkovin ukazuje analýza mozkomíšního moku na poruchu HEB také zvýšenými hodnotami imunoglobulinů (Ig). U zánětlivých a demyelinizačních procesů jsou zdrojem imunoglobulinů v likvoru plazmocyty vyzrávající z lymfocytů tvořících perivaskulární infiltráty. Absolutní koncentrace imunoglobulinů nemá větší výpovědní hodnotu, důležitým se stává až průkaz jejich intratékální produkce. Její stanovení se provádí na základě poměru IgG indexu (likvor IgG: sérum IgG ratio) (8). Bylo provedeno několik studií na zvířecích modelech, které u BXSB a MrLlpr/lpr myší (modelové inbrední kmeny spontánně vyvíjející symptomy podobné lidskému průběhu nemoci SLE) ukazují korelaci zvýšeného IgG indexu s aktivitou choroby a neurodegenerativními změnami v periventrikulárních oblastech mozku (25–27). Výpočet IgG indexu je však validní až při výraznějších kvantitativních rozdílech IgG v likvoru. Při mírných koncentračních změnách Ig (např. při výrazně porušené HEB s vysokým Q Alb) tak nemusí být intratékální syntéza odhalena. Proto se za spolehlivý průkaz při posuzování kvalitativní intratékální syntézy imunoglobulinů považuje vyšetření izoelektrickou fokusací, kterou lze stanovit oligoklonální produkci nejen ve třídě IgG, ale i IgM, IgA a volných řetězců (28). Při vyšetřování se používá izoelektrická fokusace na agarovém gelu s následným stříbřením, imunofixací či blottingem (28–30). Intratékalní syntézou imunoglobulinů u pacientů s NPSLE se zabývají již první studie z 80. let (31–33). Podobné výsledky referují i v novějších studiích Mc Lean et al., popisují u NPSLE pacientů zvýšený IgG index a oligoklonální pásy v likvoru (34). Stejně tak u pacientů s NPSLE West et al. uvádí abnormální CSF IgG index a oligoklonální pásy, které jsou asociovány s deficitem komplexní paměti, verbálními funkcemi, vážnější neurologickou symptomatologií a agresivnější kortikosteroidní terapií v důsledku závažnosti onemocnění (35). Korelaci aktivity nemoci NPSLE a vysokých dávek kortikoidů s IgG v likvoru popisuje i srbská pracovní skupina (24).
Jako biomarker pro akutní poškození HEB byl navržen S100B protein, který byl studován i u mnoha chronických neurologických onemocnění. Jde o gliální specifický protein exprimovaný na zralých astrocytech, který pomáhá formovat hematoencefalickou bariéru (36). Asociace NPSLE a S100B proteinu je však stále kontroverzní, některé studie popisují jeho zvýšené hodnoty v likvoru u centrálního neurolupusu, jiné je zase popírají (37–39).
Dalším možným markerem neurolupusu v mozkomíšním moku jsou prozánětlivé cytokiny a chemokiny, které působící jako aktivátory či inhibitory zánětlivé reakce. Změny jejich koncentrací lze v likvoru pozorovat u řady patologických stavů zejména u zánětlivých onemocnění CNS, degenerativních a demyelinizačních chorob, traumat či ischemií (28, 40, 41). Výhodou stanovení cytokinů jsou jejich srovnatelné koncentrace v likvoru i séru (tabulka 3) a jejich časná syntéza, která může předcházet patologickému cytologickému nálezu (40).
Table 3. Koncentrace cytokinů v séru a likvoru. 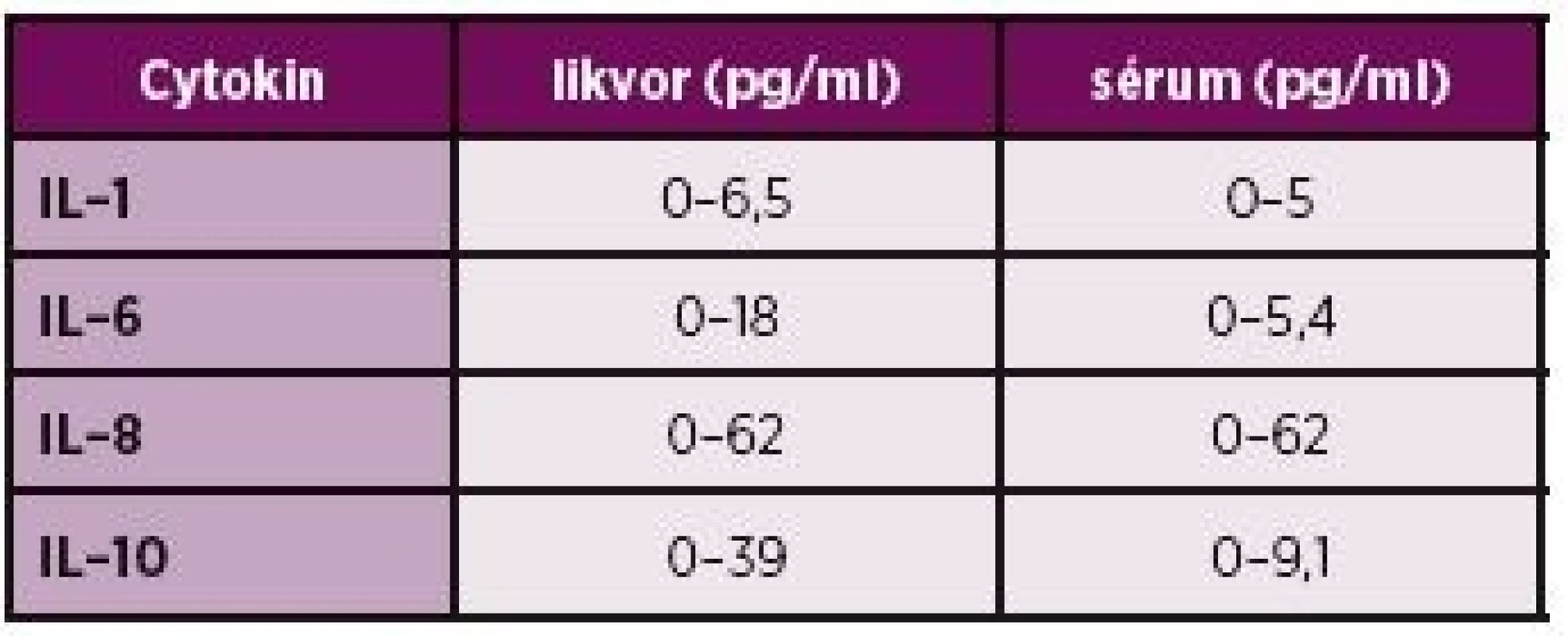
Koudelková et al. (42) U NPSLE figuruje řada prozánětlivých cytokinů, jejichž hladiny jsou v mozkomíšním moku zvýšeny a podporují produkci intratékálních protilátek, B a T buněčnou aktivaci a maturaci, a modulují uvolňování neurotransmiterů (8,43,44). Mnoho studií prokázalo, že interleukiny IL-12, IL-2, IL-4 a INFγ jsou u NPSLE přítomny v normálních koncentracích (45–49). Avšak hladiny IL-6, IL-8 a někdy i IL-17 v likvoru jsou zvýšeny u fokálního, ale i difuzního NPSLE. IL-6 a IL-8 jsou považovány za slibné diagnostické markery neuropsychiatrického postižení u systémového lupusu a současně za pomocníky při monitoraci aktivity onemocnění a odpovědi na léčbu (45, 49–54). Kromě těchto cytokinů popisuje Fragoso-Loyo a Yoshio ve svých studiích i elevaci IP-10 (interferon gama-indukovaný protein 10), MCP-1 (monocytární chemotaktický faktor 1) a G-CSF (růstový faktor granulopoezy) (55, 56). Autoři dospěli k velmi zajímavému zjištění, že intratékální koncentrace zejména IL6 i dalších cytokinů nejsou nezávislé na koncentracích v séru. Jejich hladiny v likvoru jsou dokonce několikanásobně signifikantně vyšší než sérové hladiny, což naznačuje, že produkce probíhá in situ a že vznik neuropsychiatrického postižení nevyžaduje nutně přítomnost faktorů, které by prošly HEB z krve (56–58). Kromě toho již Okamoto popsal zvýšené hladiny IL-6 v likvoru u NPSLE pacientů bez prokazatelného poškození hematoencefalické bariéry (59). Některé práce také ukázaly, že intratékální přítomnost IL-6 a IL-8 vede k syntéze matrixových metaloproteináz 9 (MMP-9), což má za následek poškození mozkového parenchymu s uvolňováním produktů při následné astrocytární a neuronální degeneraci (60, 61). Dalším problémem je, že zvýšené hodnoty MMP-9 zvyšují permeabilitu HEB a tím umožňují cirkulujícím protilátkám vstup do intratékálního prostoru (62, 63).
Jedním z dalších zánětlivých mediátorů v likvoru u NPSLE je také INFα (44, 56, 64). Přestože Fragoso-Loyo rovněž pozoroval zvýšené koncentrace INFα, kvůli nezměněným hodnotám po klinickém zlepšení pacientů a poklesu aktivity onemocnění se nepředpokládá, že by INFα byl užitečným biomarkerem NPSLE (65). U pacientů s NPSLE byly oproti SLE pacientům v likvoru prokázány také zvýšené hodnoty BAFF (B-cell activating factor) a APRIL (A proliferation inducing ligand), zhodnocení jejich potenciálu jakožto terapeutického cíle však vyžaduje provedení dalších studií (8, 66).
Důležitým aspektem diferenciální diagnostiky NSPLE je zejména vyloučení jiných autoimunitních onemocnění postihujících CNS, které by mohly mít podobné projevy. Právě na cytokinový profil u neurolupusu, roztroušené sklerózy (RS) a neuromyelitis optica (NMO) se zaměřila japonská pracovní skupina. Hladiny IL-6 a IL-8 byly však u všech skupin pacientů srovnatelné. Ukázalo se, že oproti RS a NMO skupinám bylo u NPSLE pacientů 14 ze 27 testovaných cytokinů zvýšeno, avšak pouze šest z nich (IL-17, IL-2, INFγ, IL-5, FGF a IL-15) ukázalo minimální prediktivní hodnotu při odlišení NPSLE od roztroušené sklerózy a Devicovy nemoci (neuromyelitis optica) (67).
Autoprotilátky
Samostatnou kapitolou ve vyšetřování mozkomíšního moku u pacientů s NPSLE je detekce autoprotilátek. V souvislosti se SLE bylo vyšetřováno více než 116 autoprotilátek, asociaci s neuropsychiatrickým postižením jich vykazuje kolem 20, ať už specifických pro CNS či systémových asociovaných s NPSLE (68, 69). Některé se vyšetřují rutinně, jiné pouze experimentálně. Přestože přesná etiopatogeneze NPSLE není dosud zcela jasná, zřejmé je, že u některých forem jistě hrají autoprotilátky významnou roli. Tudíž by identifikace specifických protilátek jako biomarkeru NPSLE mohla být významným přínosem v diagnostice i léčbě tohoto onemocnění.
Až do dnešních dní byly provedeny pouze dvě větší metaanalýzy, které se zabývají autoprotilátkami souvisejícími s NPSLE. Obě tyto studie však operují spíše s autoprotilátkami přítomnými v séru. Starší z nich (Sciascia et. al) porovnávající 42 studií podává důkaz o asociaci protilátek proti ribozomálnímu P proteinu (anti-RP) s NPSLE psychózou a asociaci cerebrovaskulárních chorob zejména s lupusovým antikoagulans (LA) (70). Druhá metaanalýza zahrnuje 41 studií a také popisuje asociaci antiribozomálních P protilátek (anti-RP) s psychózou, i zde se však jedná rovněž o protilátky sérové (71).
Protilátky proti ribozomálnímu P proteinu jsou obecně považovány za vysoce specifické pro SLE a byla popsána jejich korelace s aktivitou choroby a postižením ledvin, jater či CNS (72). Několik prací prokázalo schopnost anti-RP protilátek vázat neuronální antigeny, penetrovat neuronální buňky a inhibovat v nich syntézu proteinů (73, 74). Jak bylo ukázáno na zvířecím modelu, při poruše HEB jsou anti-RP protilátky schopné interakce s antigenem na hippokampálních neuronech, indukují tak jejich apoptózu a s tím také spojené poruchy paměti (75, 76). V retrospektivní průřezové studii (Govoni et al.) se ukázala být asociace anti-RP autoprotilátek v séru a likvoru značně kontroverzní, kdy v polovině studií byla asociace anti-RP autoprotilátek s NPSLE prokázána a v druhé polovině však nikoli (8). V prospektivní studii pak byla prokázána významná asociace psychózy s NPSLE, stejně jako ve studiích Briani a Hirohaty (tabulka 4) (8, 77, 78).
Table 4. Asociace anti-RP protilátek s NPSLE. 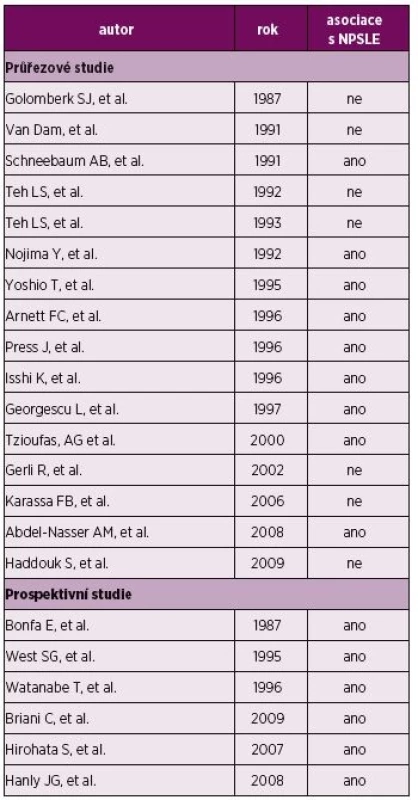
Govoni et al. (8), Briani et al. (77), Hirohata et al. (78) Z druhé uvedené metaanalýzy dále vyplývá signifikantně zvýšená prevalence anti-neuronálních protilátek (anti-N) v likvoru a asociace kombinovaných CSF protilátek s křečemi u pacientů s NPSLE (71). Bluestein et al. také popsali vysokou koncentraci anti-N IgG protilátek v CSF, avšak pouze u pacientů s aktivním NPSLE (79), stejně tak jako ve starší studii Isshi a Hirohata (80).
Velký význam jak v patogenezi, tak i diagnostice NPSLE mají protilátky proti glutamátovému receptoru (anti-NMDA či anti-NR2). Jde o podskupinu anti-dsDNA protilátek, které zkříženě reagují s receptorem pro N-methyl D-aspartát (NMDA) receptory, konkrétně s NMDA podjednotkou 2 (NR2) (18, 36). NMDA receptory jsou glutamátové receptory, které jsou v mozku zodpovědné za synaptickou plasticitu, paměť a schopnost učení a jsou ve vysoké hustotě pozorovány v amygdale a hippokampu (81–84). Vazba anti-NR2 protilátek na aktivované NR2 receptory je následována excitotoxickou neuronální smrtí, doprovázenou kognitivní a emocionální poruchou a hippokampální atrofií (detekovatelnou na magnetické rezonanci) s následnou poruchou paměti (84–87). Anti-NR2 protilátky byly popsány v likvoru u difuzních forem NPSLE, ve většině případů však jejich hladiny v séru nebyly signifikantně zvýšené (36, 87–92). Pacienti se závažnou formou difuzního NPSLE (např. akutní stavy zmatenosti) mají vysoké hodnoty anti-NR2 protilátek v mozkomíšním moku, které jsou doprovázeny poškozením HEB. Na zvířecích modelech bylo prokázáno, že nízké koncentrace NMDA protilátek alterují synaptickou transmisi, zatímco vysoké koncentrace indukují neuronální smrt. Tím by se dalo vysvětlit, proč je u některých jedinců kognitivní dysfunkce transientní a u někoho permanentní (93).
Dalšími autoprotilátkami specifickými pro SLE, jsou anti-Sm (anti-Smith) protilátky. Přítomnost anti-Sm protilátek jak v séru, tak i v mozkomíšním moku byla (spíše ve starších studiích) asocio-vána s postižením CNS, konkrétně s akutními stavy zmatenosti. Přesná úloha anti-Sm při rozvoji NPSLE však zůstává nejasná (94–96).
Jako možný biomarker pro aseptické meningitidy se zdají být přínosné anti-U1 RNP protilátky. Poprvé je v séru u NPSLE pacientů popsali Okada et al. (97). Dalšími autory byly anti-U1-RNP autoprotilátky detekovány v mozkomíšním moku, a to nejen u pacientů s aseptickou meningitidou, ale i u dalších forem NPSLE. Jejich nálezy vysoké specificity (92,2 %), ale i dobré senzitivity (64,3 %) naznačují, že by anti-U1-RNP mohly být užitečným indikátorem centrálního neurolupusu, svědčícím spíše pro intratékální produkci (98–100).
Hematoencefalická bariéra a autoprotilátky v mozkomíšním moku
Hematoencefalická bariéra (HEB) představuje účinnou mechanickou překážku mezi krví a mozkomíšním mokem a účinně brání průniku velkých molekul. Aby byly autoprotilátky schopny difundovat z krve přes HEB do CNS, musí nezbytně dojít k jejímu poškození.
Víme, že anti-RP protilátky a anti-NR2 protilátky mohou indukovat syntézu prozánětlivých cytokinů jako IL-6 a IL-8 monocyty a endoteliálními buňkami. Tyto cytokiny pak mohou poškodit HEB a umožnit tak autoprotilátkám průnik do likvoru (72, 90). Kromě toho se recentní studie zabývají poruchou HEB u zvířecích modelů při aktivaci osy molekuly TWEAK (Tumor necrosis factor-like WEAK inducer of apoptosis) a jejího receptoru Fn14 (101). Existuje také studie, která napovídá, že by významnou roli v poruše HEB u NPSLE mohl hrát také komplementový systém (zejména C5a a C5aR) přes zánětlivou reakci a zvýšenou produkci indukované NO-syntetázy, která pak ovlivňuje nervovou tkáň a různými mechanismy (např. přímou nitrosylací NMDA receptoru) způsobuje neuronální smrt (8, 102).
Na druhou stranu existují i studie podporující teorii, že produkce autoprotilátek, cytokinů a chemokinů se může dít pouze intratékálně (nasvědčují tomu výrazně zvýšené intratékální koncentraceo oproti sérovým) a porucha HEB tak nastává až jejich působením (56, 100).
Přítomnost protilátek v mozkomíšním moku se dá vysvětlit několika mechanismy: 1. může se jednat o jejich intratékální produkci; 2. porucha HEB jim dovolí průchod do mozkomíšního moku; 3. může jít o kombinaci obojího a 4. díky snížení rychlosti toku mozkomíšního moku dochází k jejich zvýšené koncentraci.
Vyšetření likvoru v doporučení pro NPSLE
V roce 1999 ustanovila Americká revmatologická společnost set 19 syndromů postihujících centrální či periferní nervový systém, sdružených se SLE. Navíc pro každý z nich vydala také diagnostická doporučení. Vyšetření likvoru podle ACR slouží zejména k vyloučení jiných onemocnění způsobujících neurologickou symptomatologii a je vhodné u následujících syndromů:
Guillain-Barré syndromu, aseptické meningitidy, cerebrovaskulárních postižení, demyelinizačního syndromu, bolestí hlavy a myelopatie (7).
Doporučení pro terapii neuropsychiatrického lupusu vydala i Evropská liga proti revmatismu (EULAR), která analýzu likvoru specificky doporučuje v případech akutních stavů zmatenosti, aseptické meningitidy, myelopatie a polyradikulopatie (103).
Závěr
Přestože je neuropsychiatrický lupus v posledních dekádách rozsáhle studován, byla stanovena klasifikace, publikováno mnoho studií a došlo k rozvoji laboratorních a zobrazovacích metod, zůstává diagnóza NPSLE pro lékaře v praxi stále velkou výzvou, stejně tak jako terapeutický postup. Přisouzení neuropsychiatrické symptomatologie k lupusu je velmi obtížné. Je proto stále nutné při vyšetřování vyloučit i jiné příčiny onemocnění.
Právě vyšetření mozkomíšního moku se v posledních letech stalo nezastupitelnou součástí vyšetřovacího algoritmu. Kromě vyloučení např. infekční etiologie, v likvoru hledáme zejména specifické protilátky pro jednotlivé syndromy. Spolehlivý biomarker pro neuropsychiatrické postižení však stále chybí. Jak se ukazuje, důležitou roli v celém problému NPSLE hrají zánětlivé cytokiny, autoprotilátky a hematoencefalická bariéra. Ta může být alterována jak látkami kolujícími v krevním oběhu, tak i látkami produkovanými intratékálně. Recentní studie se soustředí právě na výzkum intratékální produkce autoprotilátek a cytokinů, u kterých je potřeba zkoumat párové vzorky (sérum, likvor), avšak takových studií je stále velmi málo.
adresa pro korespondenci:
MUDr. Veronika Balajková
Revmatologický ústav Praha
Revmatologická klinika 1. LF UK Praha
Na Slupi 4
128 50 Praha 2
e-mail: balajkova@revma.cz
Sources
1. Bertsias GK, Boumpas DT. Pathogenesis, diagnosis and management of neuropsychiatric SLE manifestations. Nat Rev Rheumatol 2010; 6(6): 358–67.
2. Yazdany J. Health-related quality of life measurement in adult systemic lupus erythematosus: Lupus Quality of Life (LupusQoL), Systemic Lupus Erythematosus-Specific Quality of Life Questionnaire (SLEQOL), and Systemic Lupus Erythematosus Quality of Life Questionnaire (L-QoL). Arthritis Care Res (Hoboken) 2011; 63 (Suppl 11): S413–9.
3. Bortoluzzi A, Scirè CA, Bombardieri S, Caniatti L, Conti F, De Vita S, et al. Development and validation of a new algorithm for attribution of neuropsychiatric events in systemic lupus erythematosus. Rheumatology (Oxford) 2015; 54(5): 891–8.
4. Brey RL, Holliday SL, Saklad AR, Navarrete MG, Hermosillo-Romo D, Stallworth CL, et al. Neuropsychiatric syndromes in lupus: prevalence using standardized definitions. Neurology 2002; 58(8): 1214–20.
5. Joseph FG, Scolding NJ. Neurolupus. Pract Neurol 2010; 10(1): 4–15.
6. Sibbitt WL, Jr., Brandt JR, Johnson CR, Maldonado ME, Patel SR, Ford CC, et al. The incidence and prevalence of neuropsychiatric syndromes in pediatric onset systemic lupus erythematosus. J Rheumatol 2002; 29(7): 1536–42.
7. The American College of Rheumatology nomenclature and case definitions for neuropsychiatric lupus syndromes. Arthritis Rheum 1999; 42(4): 599–608.
8. Govoni M, Bortoluzzi A, Padovan M et al. The diagnosis and clinical management of the neuropsychiatric manifestation of lupus. Journal Autoimmuny 2016; 74 : 41–72.
9. Rožnovský L. Neuroinfekce v intenzivní péči. Neurol prax 2013; 14(5): 258–2.
10. Adam P, Táborský L, Průcha M, Sobek O, Kratochvíla J, Zeman D. Cerebrospinal fluid cytology. A Monograph. Prague, Medica News Publishers, 2000.
11. Feinglass EJ, Arnett FC, Dorsch CA, et al. Neuropsychiatric manifestation of systemic lupus erythematosus: diagnosis, clinical spectrum and relationship to others features of the disease. Medicine 1976; 55(4); 323–339.
12. Boumpas DT, Patronas NJ, Dalakas MC, et al. Acute transverse myelitis in systemic lupus erythematosus: magnetic resonance imaging and review of the literature. J Rheumatol 1990; 17(1): 89–92.
13. Abialmouna J, Shoemaker DW, Pullicino PM and Baer AN. Marked cerebrospinal fluid pleocytosis in systemic lupus erythematosus related cerebral ischemia. J Rheumatol 1992; 19(4): 626–9.
14. Gibson T, Myers AR. Nervous system involvement in systemic lupus erythematosus. Ann Rheum Dis 1975; 35(5): 398–406.
15. Pierce R, Logothetis J. Spinal fluid pleocytosis in systemic lupus erythematosus. J Lancet 1962; 82 : 458–60.
16. Canosa JJ, Cohen AS. Aseptic meningitis in systemic lupus erythematosus: report of three cases. Arthritis Rheum 1975; 18 : 369 – 73.
17. Goswani D, Shuddosatta Ch, Ahmad BI, Shabtanu D. Two cases reports indicating the dilemma in diagnosis lupus cerebritis. J Family Med Prim Care 2013; 2(1): 111–114.
18. Zhao YH, Shao YG, Ren HT et al. Cerebrospinal fluid cytology studies of neuropsychiatric systemic lupus erythematosus. Chin J Contemp Neurol Neurosurg 2013; 13(2): 132–5.
19. Adam P, Peterová V, Dostál C, Seidl Z, Obenberger J, Olejárová M, et al. Likvorologické nálezy u systémového lupus erythematodes s postižením CNS. Klin Biochem Metab 1998; 6 (27): 35–9.
20. Neuwelt CM, Young RG. Managing neuropsychiatric lupus: Top 10 clinical pearls. J Muscoskelet Med 2009; 26 : 127–35.
21. Abbott NJ, Mendonca LL, Dolman DE. The blood-brain barrier in systemic lupus erythematosus. Lupus 2003; 12 : 908–15.
22. Sakuma Y, Nagai T, Yoshio T, Hirohata S. Differential activation mechanism of serum C5a in lupus iritis and neuropsychiatric systemic lupus erythematosus. Mod Rheumatol 2017; 27(2): 292–297.
23. Hirohata S, Sakuma Y, Yanagida T, Yoshioy T. Association of cerebrospinal fluid anti-Sm antibodies with acute confusional state in systemic lupus erythematosus. Arthritis Res Ther 2014; 16(5): 450.
24. Stojanovich L, Smiljanich-Milijkovich D, Omdal R and Sakic B. Neuropsychiatric lupus and association with cerebrospinal fluid immunoglobulins: A pilot study. Isr Med ASIC J 2009; 11(6): 359–62.
25. Alexander JJ, Quigg RJ. Systemic lupus erythematosus and the brain: what mice are telling us. Neurochem Int 2007; 50 : 5–11.
26. Sidor MM, Sakic B, Malinowski PM, Ballock DA, Oleschuk CJ, Macri J. Elevated immunoglobulin levels in the cerebrospinal fluid from lupus-prone mice. J Neuroimmunol 2005; 165 : 104–13.
27. Zameer A, Hoffman SA. Immunoglobulin binding to brain in autoimmune mice. J Neuroimmunol 2001; 120 : 10–8.
28. Sobek O, Adam P, Keilbich P et al. Vyšetření likvoru – současné možnosti. Neurol praxi 2009; 10(5): 280–4.
29. Deisenhamer F, Bartoš A, Egg R, Gilhus NE, Giovannoni G, Rauer S, et al. Guidelines on routine cerebrospinal fluid analysis. Report from EFNS task force. Eur J Neurol 2006; 13 : 913–22.
30. Freedman MS, Thompson EJ, Deisenhamer F, Giovannoni G, Grimsley G, Keir G et al. Recommended standard of cerebrospinal fluid analysis in the diagnosis of multiple sclerosis. A consensus statement. Archive Neurol 2005; 62 : 865–70.
31. Miller JR. Burke AM, Bever CT. Occurrence of oligoclonal bands in multiple sclerosis and other CNS disease. Ann Neurol 1983; 13 : 53–8.
32. Link H Kostulas V. Utility of isoelectric focusing of cerebrospinal fluid and serum on agarose evaluated for neurological patients. Clin Chem 1983; 29 : 810–5.
33. Wielfield JB, Shaw M, Silverman LM et al. Intrathecal Ig synthesis and blood-brain barrier impairment in patients with systemic lupus erythematosus and central nervous system dysfunction. Am J Med 1983; 74 : 837–44.
34. McLean BN, Miller D, Thompson EJ. Oligoclonal banding of IgG in CSF, blood-brain barrier function, and MRI findings in patients with sarcoidosis, systemic lupus erythematosus, and Bechcet´s disease involving the nervous system. J Neurol Neurosurg Psychiatry 1995; 58 : 548–54.
35. West SG, Emlen W, Wener MH, Kotin BL. Neuropsychiatric lupus erythematosus: a 10-year prospective study on the value of diagnostic test. Am J Med 1995; 99(2): 153–63.
36. Gulati G, Iffland PH, Janigro D, Zhag B,Luggen ME. Anti-NR2 antibodies, blood-brain barrier and cognitive dysfunction. Clin Rheumatol 2016; 35(12): 2989–97.
37. Fragoso-Loyo H, Cabiedes J, Atisha-Fregoso Y, Llorente L, Sanchéz-Guerrero J. Utility of serum S100B protein for identification of central nervous system involvement in systemic lupus erythematosus. J Rheumatol 2010; 37 (11): 2280 –5.
38. Brunner HI, Klein-Gitelman MS, Zelko F, Beebe DW et al. Blood-based candidate biomarkers of the presence of neuropsychiatric systemic lupus erythematosus in children. Lupus Sci Med 2014; 1(1): e000038.
39. Yang X, Lin J Lu X, Zhao X. Expression of S100B protein levels in serum and cerebrospinal fluid with different forms of neuropsychiatric systemic lupus erythematosus. Clin Rheumatol 2008; 27(3): 353–7.
40. Is M, Coskun A, Sanus GZ, Tanriverdi T, Kafadar AM, Hanimoglu H, et al. High - sensitivity C-reactive protein levels in cerebrospinal fluid and serum in severe injury: Relationship to tumor necrosis factor and interleukin-6. J Clin Neurosci 2007; 14(12): 1163 –71.
41. Singhal A, Baker A, Hare G, Reinders FX, Schlichter LC, Moulton R. Association between cerebrospinal fluid interleukin-6 concentration and outcome after severe human traumatic brain injury. J Neurotrauma 2002; 8 : 929–37.
42. Koudelková M, Sobek O, Kelbich P, Adam P, Melezinková V, Veselá B, Hajduková L, Adam D. Vyšetření cytokinů v likvoru. Labor Aktuell 2010; 01 : 14–7.
43. Lipsky PE. Systemic lupus erythematosus: an autoimmune disease of B cell hyperactivity. Nat Immunol 2001; 2(9): 1615–6.
44. Jonsen A, Bengstsson AA, Nived O, Ryberg B, Truedsson L, Ronnblom L et al. The heterogenity of neuropsychiatric systemic lupus erythematosus is reflected in lack of association with cerebrospinal fluid profile. Lupus 2003; 12(11): 846–50.
45. Trysberg E, Carlsten H, Tarkowski A. Intrathecal cytokines in systemic lupus erythematosus with central nervous system involvement. Lupus 2000; 9(7): 498–503.
46. Santer DM,Yosio T, Minota S, Moller T, Elkon KB. Potent induction of INF-alpha and chemokines by autoantibodies in the cerebrospinal fluid of patients with neuropsychiatric lupus. J Immunol 2009; 182(2): 1192–1201.
47. Lu XY, Zhu CQ, Qian J, Chen XX, Ye A, Gu YY. Intrathecal cytokine and chemokine profiling in neuropsychiatric lupus or lupus complicated with central nervous system infection. Lupus 2010; 19(6): 689–695.
48. Dellalibera-Jovilino R et al. Cytokines in plasma and cerebrospinal fluid of patients with neuropsychiatric lupus. J Rheumatol 2003; 30(3): 485–492.
49. Kothur K, Wienholt L, Brilot F, Dale RC. CSF cytokines/chemokines as biomarkers in neuroinflammatory CNS disorders: A systematic review. Cytokine 2016; 77 : 227–37.
50. Hirohata S, Miyamoto T. Elevated levels of interleukin-6 in systemic lupus erythematosus with central nervous system involvement. Arthritis Rheum 1990; 33 : 644–9.
51. Fragoso-Loyo H, Richaud-Patin Y, Orozco-Narváez a et al. Interleukin-6 and chemokines in the neuropsychiatric manifestation of systemic lupus erythematosus. Arthritis Rheum 2007; 56 : 1242–50.
52. Hirohata S, Kanai Y, Mitsuo A et al. Accuracy of cerebrospinal fluid IL-6 testing for diagnosis of lupus psychosis. A multicenter retrospective study. Clin Rheumatol 2009; 28 : 1319–23.
53. Ishikawa A, Kurumi A, Hirohta S. Elevation of interleuin 8 in cerebrospinal fluid in neuropschiatric systemic lupus erythematosus. Kitasto Med J 2011; 41 : 160–4.
54. Alcocer-Varela J, Aleman-Hoey D, Alarcon-Segovia D. Interleukin-1and interleukin-6 activities are increased in the cerebrospinal fluid of patients with CNS lupus erythematosus and correlated with local T-cell activation markers. Lupus 1992; 1 : 111–7.
55. Fragoso-Loyo H, Atisha-Fregoso Y, Llorente L, Sanchez-Guerrero J. Inflammatory profile in cerebrospinal fluid of patients with headache as manifestation of neuropsychiatric systemic lupus erythematosus. Rheumatology 2013; 52 : 2218–22.
56. Yoshio T, Okamoto H, Kurasawa K, Dei Y, Hirohata S, Minnota S. IL-6, IL-8, IP-10, MCP-1 and G-CSF are significantly increased in cerebrospinal fluid but not in sera patients with central neuropsychiatric lupus erythematosus. Lupus 2016; 25 : 997–1003.
57. Lit LC, Wong CK, Tam LS, Li EK et al. Raised plasma concentration and ex vivo production of inflammatory chemokines in patients with systemic lupus erythematosus. Ann Rheum 2006; 65 : 209–15.
58. Mok CC and Lau CS. Pathogenesis of systemic lupus erythematosus. J Clin Pathol 2003; 56 : 481–90.
59. Okamoto H, Kobayashi A, Yamanaka H. Cytokines and chemokines in neuropsychiatric syndromes of systemic lupus erythematosus. J Biomed Biotechnol 2010; 268436.
60. Trysberg E, Blennow K, Zachrisson O, Tarkowski A. Intrathecal levels of matrix metalloproteinases in systemic lupus erythematosus with central nervous system involvement. Arthritis Res Ther 2004; 6 : 551–6.
61. Ainiala H, Hietaharju P, Dastidar P, Loukkola J, Lehtimaki T, Peltola J, et al. Increased serum matrix metalloproteinase 9 levels in systemic lupus erythematosus patients with neuropsychiatric manifestation and brain magnetic resonance imaging abnormalities. Arthritis Rheum 2004; 50 : 858–65.
62. Hanly JG. Diagnosis and management of neuropsychiatric SLE. Nat Rev Rheumatol 2014; 10 : 338–47.
63. Hanly JG. New insights into central nervous system lupus: a clinical perspective. Curr Rheumatol Rep 2007; 9 : 116–24.
64. Shiozawa S, Kuroki Y, Kim M, Hirohata S, Ogino T. Interferon-alpha in lupus psychosis. Arthritis Rheum 1992; 4 : 417–22.
65. Fragoso-Loyo H, Atisha-Fregoso Y, Nunez-Alvarez CA et al. Utility of interferon alpha as a biomarker in central neuropsychiatric involvement in systemic lupus erythematosus. J Rheumatol 2012; 3 : 504–9.
66. George-Chandy A, Trysberg E, Eriksson K. Raised intrathecal levels of APRIL and BAFF in patients with systemic lupus erythematosus: relationship to neuropsychiatric symptoms. Arthritis Res Ther 2008; 10(4): R97.
67. Ichinos K, Arima K, Ushigusa T, Nishino A, Nakashima Y, Suzuki T, et al. Distinguishing the cerebrospinal fluid cytokine profile in neuropsychiatric systemic lupus erythematosus from other autoimmune neurological diseases. Clinical Immunology 2015; 157 : 114–20.
68. ShererY, Gorstein A, Fritzler MJ, Shoenfeld Y. Autoantibody explosion in systemic lupus erythematosus: more than 100 different antibodies found in SLE patients. Semin Arthritis Rheum 2004; 34 : 501–37.
69. Zandman-Goddard G, Chapman J, Shoenfield Y. Autoantibodies involved in neuropsychiatric SLE and antiphospholipid syndrome. Semin Arthritis Rheum 2007; 36 : 297–315.
70. Sciascia S, Bertolaccini LM, Roccatello D, Khamashta MA, Sanna G. Autoantibodies involved in neuropsychiatric manifestations associated with systemic lupus erythematosus: a systematic review. J Neurol 2014; 261 : 1706–14.
71. Ho RC, Thiaghu C, Ong H, Lu Y, Ho CS, Tam WW, et al. A meta-analysis of serum and cerebrospinal fluid autoantibodies in neuropsychiatric systemic lupus erythematosus. Autoimmunity Rev2016; 15 : 124–38.
72. Toubi E, Shoenfeld Y. Clinical and biological aspects of anti-P-ribosomal protein autoantibodies. Autoimmun Rev 2007; 6 : 119–25.
73. Koren E, Reichlin MW, Wolfson-Reichlin M, Fugste RD, Trieu E, Targoff IN et al. Autoantibodies to the ribosomal P protein react with a plasma membrane-related target on human cells. J Clin Invest 1992; 89 : 1236–41.
74. Stacey DW, Skelly S, Watson T, Elkon K et al. The inhibition of protein synthesis by IgG containing anti-ribosome P autoantibodies. Arch Biochem Biophys 1998; 267(1): 398–403.
75. Bravo-Zehnder M, Toledo EM, Segovia-Mirnda F, Serrano FG, Benito MJ, Metz C et al. Antiribosomal P protein autoantibodies from patients with neuropsychiatric lupus impact memory in mice. Arthritis Rheumatol Hob N J; 2015; 67 : 204–14.
76. Matus S, Burgos PV, Bravo-Zehnder M, Kraft R, Porras OH et al. Antiribosomal P autoantibodies from psychiatric lupus target a novel neuronal surface protein causing calcium influx and apoptosis. J Exp Med 2007; 204 : 3221–34.
77. Briani C, Lucchetta M, Ghirardello A, Toffanin E, Zampieri S, Ruggero S, Scarlato M et al. Neurolupus is associated with anti-ribosomal P protein antibodies: An inception cohort study. J Autoimmunity 2009; 32 : 79–84.
78. Hirohata S, Arinuma Y, Takayama M, Yoshio T. Association of cerebrospinal fluid anti-ribosomal P protein antibodies with diffuse psychiatric/neuropsychological syndromes in systemic lupus erythematosus. Arthritis Res Ther 2007; 9: R44.
79. Bluestein HG, Williams GW, Steinberg AAD. Cerebrospinal fluid antibodies to neuronal cells: association with neuropsychiatric manifestation of systemic lupus erythematosus. Am J Med 1981; 70 : 240–6.
80. Isshi K, Hirohata S. Differential roles of the anti-ribosomal P antibody and neuronal antibody in the pathogenesis of central nervous system involvement in systemic lupus erythematosus. Arthritis Rheum 1998; 41 : 1819–27.
81. Lauvsnes MB, Omdal R. Systemic lupus erythematosus, the brain and anti-NR2 antibodies. J Neurol 2012; 259(4): 622–9.
82. Ozawa S, Kamiya H, Tsuzuki K. Glutamate receptors in the mammalian central nervous system.Prog Neurobiol 1998; 54(5): 581–618.
83. Barkus C, McHugh SB, Sprengel R, Seeburg PH, Rawlins JN, Bannerman DM. Hippocampal NMDA receptors and anxiety: at the interface between cognition and emotion. Eur J Pharmacol 2010; 626 : 49–56.
84. Kowal C, DeGiorgio LA, Lee JY, Edgar MA et al. Human lupus antibodies against NMDA receptors mediate cognitive impairment. Proc Natl Acad Sci USA 2006; 103 : 19854–9.
85. Kowal C, DeGiorgio LA, Nakaoka T, Hetherington H, Huerta PT, Diamond B et al. Cognition and immunity: antibody impairs memory. Immunity 2004; 21 : 179–88.
86. Appenzeller S, Carnevalle AD, Li Lm, Costalllat LT, Cendes F. Hippocampal atrophy in systemic lupus erythematosus. Ann Rheum 2006; 65 : 1585–9.
87. Lauvsnes MB, Beyer MK, Kvyloy JT, Greve OJ et al. Association of hippocampal atrophy with cerebrospinal fluid antibodies against the NR2 subtype of N-methyl-d-aspartate receptor in patients with systemic lupus erythematosus and patients with primary Sjogren's syndrome. Arthritis Rheum 2014; 66 : 3387–94.
88. Arinuma Y, Yanagida T, Hirohata S. Association of cerebrospinal fluid anti-NR2 glutamate receptor antibodies with diffuse neuropsychiatric lupus erythematosus. Arthritis Rheum 2008; 58(4): 1130–5.
89. Yoshio T, Onda H, Nara H, Minota S. Association of IgG anti NR-2 glutamate receptor antibodies in cerebrospinal fluid with neuropsychiatric systemic lupus erythematosus. Arthritis Rheum 2006; 54(2): 675–678.
90. Yoshio T, Okamoto H, Hirohata S, Minota. IgG anti-NR2 glutamate receptor autoantibodies from patients with systemic lupus erythematosus active endothelial cells. Arthritis Rheum 2013; 65 : 457–63.
91. Diamond B, Volpe BT. A model for lupus brain disease. Immunol Rev 2012; 248 : 56–67.
92. Hirohata S, Arinuma Y, Yanagida, Yoshio T. Blood-brain barrier damages and intrathecal synthesis of anti-N-methyl-d-aspartate receptor NR2 antibodies in diffuse psychiatric/neuropsychological syndromes in systemic lupus erythematosus. Arthritis Res Ther 2014; 16: R77.
93. Faust TW, Chang EH, Koval C, Berlin R, Gazaryan IG, Bertini E et al. Neurotoxic lupus autoantibodies alter brain function through two distinct mechanisms. Proc Natl Acad Sci USA 2010; 107 : 18569–74.
94. Winfield JB, Brunner CM, Koffler D. Serologic studies in patients with systemic lupus erythematosus and central nervous system dysfunction. Arthritis Rheum 1978; 21 : 289–94.
95. Yasuma M, Takasai Y, Matsumoto K, Kodama A, Hashimoto H, Hirose S. Clinical significance of IgG anti-Sm antibodies in patients with systemic lupus erythematosus. J Rheumatol 1990; 17 : 469–75.
96. Hirohata S, Kosaka M. Association of anti-Sm antibodies with organic brain syndrome secondary to systemic lupus erythematosus. Lancet 1994; 343 : 796.
97. Okada J, Hamana T, Kondo H. Anti-U1RN antibody and aseptic meningitis in connective tissue disease. Scand J Rheumatol 2003; 32 : 247 – 52.
98. Fujita Y, Fujii T, Nakashima R, Tanaka M, Mimori T. Aseptic meningitis in mixed connective tissue disease: cytokine and anti U1RNP antibodies in cerebrospinal fluids from two different cases. Mod Rheumatol 2008; 18 : 184 – 8.
99. Herbst F, Artlich A, Neuhauser G, Gortner L, Diehl M, Riss J. MCTD in the differential diagnosis of cereberall ataxia. Klin Padiatr 2001; 213 : 332–3.
100. Sato T, Fujii T, Yokoyama, Fujita Y, Imura Y, Yukawa N, et al. Anti-U1RNP antibodies in cerebrospinal fluid are associated with central neuropsychiatric manifestations in systemic lupus erythematosus and mixed connective tissue disease. Arthritis Rheum 2010; 62 : 3730–40.
101. Wen J, Doerner J, Weidenheim K, Xia Y, Stock A, Michaelson JS, et al. TNF-like weak inducer of apoptosis promotes blood brain barrier disruption and increases neuronal cell death in MRL/lpr mice. J Autoimmu 2015; 60 : 40–50.
102. Jacob A, Hack B, Chiang, Garci JGN, Quigg RJ, Alexander JJ. C5a alters blood-brain barrier integrity in experimental lupus. FASEB J 2010; 24 : 1682–8.
103. EULAR recommendations for the management of systemic lupus erythematosus with neuropsychiatric manifestations: report of a task force of the EULAR standing committee for clinical affairs. Ann Rheum Dis 2010; 69(12): 2074–82.
Labels
Dermatology & STDs Paediatric rheumatology Rheumatology
Article was published inCzech Rheumatology

2018 Issue 1
Most read in this issue- Význam vyšetření mozkomíšního moku u neuropsychiatrického systémového lupus erythematodes
- Nefarmakologická terapie u systémové sklerodermie
- Péče o pacienty s autoinflamatorními onemocněními: Česko-slovenská adaptace překladu evropských doporučení SHARE
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

