-
Medical journals
- Career
Imunoglobulinové volné lehké řetězce v séru jako biomarker aktivity u systémového lupus erythematodes
Authors: Hrnčíř Zb; M. Drahošová 1; T. Soukup; J. Tomš
Authors‘ workplace: II. interní klinika a 1Ústav klinické imunologie a alergologie, Lékařská fakulta UK a Fakultní nemocnice, Hradec Králové
Published in: Čes. Revmatol., 21, 2013, No. 1, p. 4-10.
Category: Original Papers
Overview
Východisko:
Molekuly imunoglobulinu (Ig) sestávají ze dvou identických dvojic těžkých a lehkých řetězců. Fyziologicky se tvoří více lehkých než těžkých Ig řetězců a část z nich je možno prokazovat jako volné lehké řetězce (FLC, Free Light Chains) v biologických tekutinách, především v séru. Systémový lupus erythematodes (SLE) je provázen polyklonální aktivací B buněk; lze předpokládat, že proporcionální vzestup sérové koncentrace FLC kappa a FLC lambda při normálním rozmezí indexu FLC kappa:FLC lambda reflektují aktivitu SLE.Cíl:
Zjistit změny v sérové koncentraci FLC kappa a FLC lambda jako případného biomarkeru aktivity u SLE v prospektivní, komparativní, průřezové studii.Metody:
Zkoumanou sestavou je 83 dospělých SLE (ACR/1982, novelizace 1997) nemocných a kontrolní skupinou 33 zdravých osob odpovídajícího složení podle věku a pohlaví; konkomitatní infekt, monoklonální gamapatie a renální nedostatečnost byly u nemocných vyloučeny. Aktivita SLE byla hodnocena systémem SLEDAI-2K (Systemic Lupus Erythematosus Disease Activity Index-2000): skóre ≥6 bylo hodnoceno jako klinicky významné. FLC kappa a FLC lambda v séru byly stanoveny kvantitativní nefelometrií a porovnávány s hodnotami skóre SLEDAI-2K a sérologickými biomarkery IgG, C3, C4, „total“ ANA, anti-dsDNA a s antinukleosomovými protilátkami. Pro statistickou analýzu byl použit program Medcalc-Statistical software.Výsledky:
Sérová koncentrace FLC kappa, FLC lambda a celkově FLC kappa + FLC lambda u 22 SLE se SLEDAI-2K ≥6, a také u 61 SLE se SLEDAI-2K <6 byla signifikantně vyšší, než u zdravých kontrol (p = 0,003 – <0,001) vyjma FLC lambda u SLE se SLEDAI-2K <6 a zdravých kontrol (p > 0,05). U SLE se SLEDAI-2K ≥6 byla sérová koncentrace FLC kappa, FLC lambda a FLC kappa-FLC lambda vždy signifikantně vyšší, než u SLE se SLEDAI-2K <6 (p < 0,001). V celé sestavě 83 SLE byla zjištěna signifikantní korelace (p < 0,001) pro vztah mezi skóre SLEDAI-2K a FLC kappa (r = 0,56), FLC lambda (r = 0,58) i FLC kappa + FLC lambda (r = 0,62). Analýza sérových koncentrací FLC a hodnot šetřených autoprotilátek ukázala výraznou korelaci FLC kappa, FLC lambda a FLC kappa + FLC lambda k antinukleosomovým protilátkám (r = 0,59, r = 0,53 a r = 0,59).Závěr:
Koncentrace FLC (kappa, lambda a celkově) v séru výrazně koreluje s aktivitou SLE a je významně vyšší u nemocných s klinicky významným skóre SLEDAI-2K ≥6; tyto nálezy nasvědčují tomu, že stanovení FLC v séru je možno použít jako biomarker aktivity SLE.Klíčová slova:
Imunoglobulinové volné lehké řetězce, systémový lupus erythematodes, skórovací systém SLEDAI-2K, sérové biomarkery aktivityÚvod
Systémový lupus erythematodes (SLE) je multisystémové autoimunitní onemocnění, které nemá jednoznačný biomarker aktivity (1). Aktivita SLE a její změny při exacerbaci („flare“) se hodnotí skórovacími systémy (2), které umožňují celkové kvantitativní vyjádření nebo jde o škály k detekci aktivity v jednotlivých orgánech/tkáních, např. ledvin při renální biopsii. Porovnávání nejvíce používaných skórovacích systémů pro vyjádření celkové aktivity (dále „aktivity“) SLE u dospělých nemocných ukázalo, že každý z nich má určitou komparativní výhodu, ale žádný není dokonalým řešením (3). Zčásti se na tom podílí skutečnost, že sérové hodnoty imunologických deskriptorů aktivity SLE, jako jsou protilátky proti dvouspirálové DNA (anti-dsDNA) a složky komplementu ne vždy reflektují klinické projevy nemoci (4, 5). V této situaci je aktuální hledat klinicky využitelné laboratorní biomarkery aktivity SLE i v oblasti mimo autoprotilátky a složky komplementu. Některá pozorování z poslední doby (6) svědčí o tom, že přínosem může být stanovení volných lehkých řetězců (FLC, Free Light Chains) sérových imunoglobulinů (Ig) specifickou a vysoce senzitivní metodou kvantitativní nefelometrie (7). Tato metoda je založena na izolaci specifických polyklonálních avidních protilátek proti junkčním epitopům mezi konstantními doménami těžkých a lehkých řetězců Ig, zcela skrytým v kompletních Ig molekulách. Polyklonální aktivace B buněk lymfoidní tkáně u aktivní formy SLE (8) umožňuje předpokládat vzestup koncentrace FLC kappa a FLC lambda v séru. Cílem této prospektivní, komparativní, průřezové studie je vyhodnotit změny sérové koncentrace FLC kappa a FLC lambda jako imunochemického biomarkeru celkové aktivity SLE u dospělých nemocných, splňujících inkluzní kritéria.
Sestavy a metody
Výchozí sestavou je kohorta 87 SLE (ACR 1982, revize 1997) v péči II. interní kliniky LFUK a FN Hradec Králové. Předpokladem pro zařazení byl věk nad 18 let, nepřítomnost aktivního infektu, monoklonální gamopatie (MG) a významné renální nedostatečnosti. Tyto požadavky nesplňovali 4 pacienti: 2x šlo o aktivní infekt (pneumonie, maxilární sinusitida), 1x o MGUS (Monoclonal Gammopathy of Undefined Significance) IgG-kappa v sérové koncentraci 2,1 g/l a 1x o terminální renální nedostatečnosti v hemodialyzačním programu. Zkoumanou sestavou je 83 SLE, z toho 8 mužů (9,63 %) ve věku 21–77 (průměrně 46) roků. Kontrolní skupinou zdravých osob je 33 dárců krve, z toho 3 muži (9,09 %) ve věku 29–58 (průměrně 42) roků: mezi oběma skupinami nebyl statisticky významný věkový rozdíl (p > 0,05). Aktivita SLE byla hodnocena průřezově podle celkového skóre (dále „skóre“) SLEDAI-2K (Systemic Lupus Erythematosus Disease Activity Index-2000) (9). SLEDAI-2K skóre ≥ 6 se považuje za ukazatel klinicky významné aktivity a ovlivňuje rozhodování o terapii u více jako 50 % nemocných (3). Zkoumaná sestava SLE nemocných byla proto rozdělena podle této diskriminační hodnoty na dvě skupiny: 22 SLE s klinicky významnou aktivitou mělo SLEDAI-2K skóre 6–16, a 61 SLE bez průkazu klinicky významné aktivity mělo SLEDAI-2K skóre 0–5. SLEDAI-2K skóre ≥ 6 vždy zahrnovalo deskriptory i mimo složky komplementu a anti-dsDNA protilátky, SLEDAI-2K skóre < 6 bylo dáno především těmito sérologickými deskriptory.
Kvantitativní stanovení FLC kappa a FLC lambda v séru byla provedena soupravami Freelite (The Binding Site Group, Birmingham, UK) metodou kvantitativní nefelometrie (analyzátor IMMAGE 800, USA). Horní mez pro normální hodnoty v séru udává výrobce orientačně jako koncentraci FLC kappa 19,40 mg/l, FLC lambda 26,30 mg/l a pro index FLC kappa:FLC lambda v rozmezí 0,26–1,65; u 4 SLE zkoumané sestavy byla zjištěna hodnota tohoto indexu nad 1,65, a proto u nich bylo provedeno vyšetření imunofixací k depistáži monoklonálního Ig, ale vždy s negativním nálezem. U všech SLE byly paralelně s šetřením FLC stanoveny také sérové hodnoty IgG, C3, C4 (Beckman Coulter, analyzátor IMMAGE 800, USA), maximální titr „total“ ANA/IF testu (DIA SORIN USA, mikroskop AXIOSKOP 2 PLUS, Zeiss), „total“ ANA/ELISA (IMTEC HUMAN, Německo), maximální titr anti-dsDNA/IFCL (ImmunoFluorescence Crithidia Luciliae) testu (INOVA/USA), anti-ds-DNA/ELISA (HYCOR, USA) a protilátky proti nukleozomům ELISA testem (EUROIMMUN, Německo). Statistická vyhodnocení byla provedena podle programu Medcalc-Statistical software s vyjádřením výsledků formou mediánu a 95 % CI pro medián, vyhodnocením podle naměřené normality metodou t-testu nebo Wilcoxonovým testem a výpočtem korelačního koeficientu.
Výsledky
Základní data o FLC kappa, FLC lambda a FLC kappa + FLC lambda v séru u SLE a kontrolní skupiny (KS) zdravých osob jsou v tabulce 1. U SLE byl prokázán korelační analýzou signifikantní vztah mezi skóre SLEDAI-2K a sérovou koncentrací FLC kappa (r = 0,56, p < 0,001), skóre SLEDAI-2K a sérovou koncentrací FLC lambda (r = 0,58, p < 0,001) a nejvýrazněji (graf 1) mezi skóre SLEDAI-2K a celkovou koncentrací FLC v séru (r = 0,62, p < 0,001). Sérové koncentrace FLC kappa (graf 2) byly ve skupině SLE se skóre SLEDAI-2K ≥6 signifikantně vyšší (p < 0,001) než ve skupině SLE se skóre SLEDAI-2K <6 a v KS; ve skupině SLE se skóre SLEDAI-2K < 6 signifikantně vyšší (p<0,001) než v KS. Sérové koncentrace FLC lambda (graf 3) byly ve skupině SLE se skóre SLEDAI-2K ≥ 6 signifikantně vyšší (p < 0,001) než ve skupině SLE se skóre SLEDAI-2K < 6 a v KS; mezi hodnotami FLC lambda u skupiny SLE se skóre SLEDAI-2K < 6 a v KS nebyly signifikantní rozdíly (p > 0,05). Při souhrnném hodnocení sérových koncentrací FLC kappa + FLC lambda (graf 4) byly u skupiny SLE se skóre SLEDAI-2K ≥ 6 zjištěny signifikantně vyšší hodnoty než ve skupině SLE se skóre SLEDAI-2K < 6 a v KS (p < 0,001): ve skupině SLE se skóre SLEDAI-2K <6 byly rovněž zjištěny signifikantně vyšší hodnoty než v KS (p = 0,003).
Table 1. FLC kappa a lambda (mg/l) v séru u SLE a zdravých kontrol. 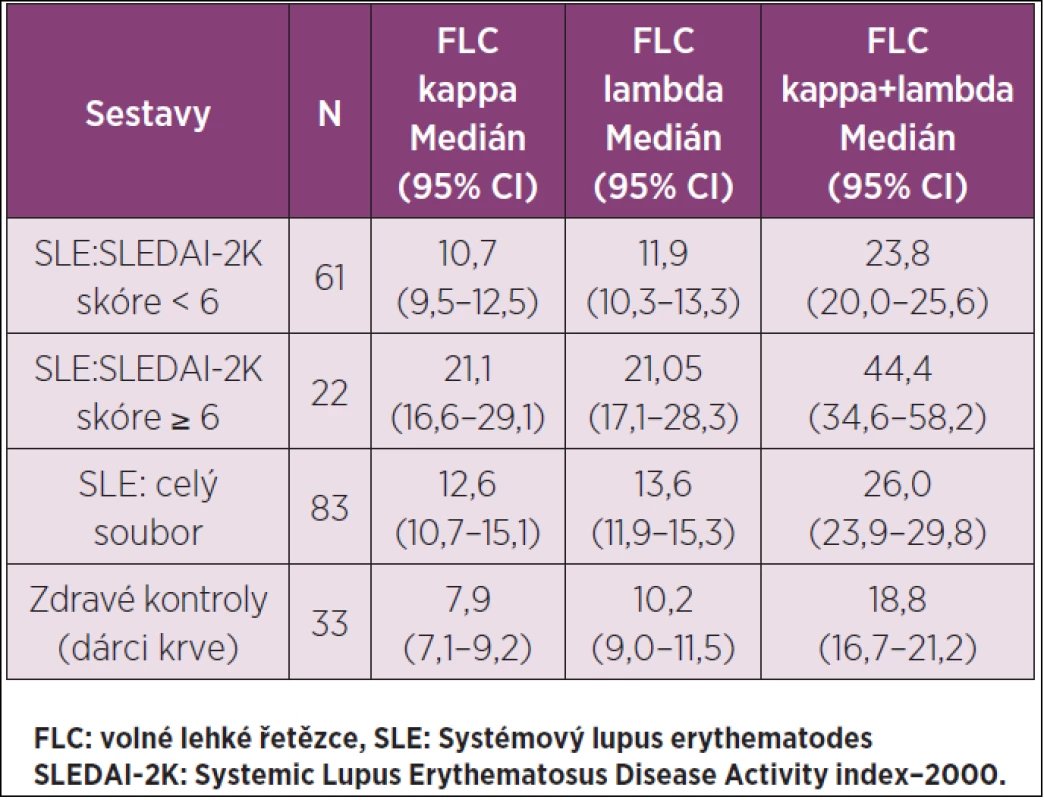
Graph 1. Korelační analýza pro vztah celkové koncentrace volných lehkých řetězců (FLC, Free Light Chains) v séru a skóre SLEDAI-2K (Systemic Lupus Erythematosus Disease Activity Index-2000) u 83 SLE. 
Graph 2. Koncentrace volných lehkých řetězců kappa (FLC, Free Light Chains) v séru u SLE skupin s rozdílným významem skóre SLEDAI-2K (Systemic Lupus Erythematosus Disease Activity Index-2000) pro hodnocení celkové aktivity a kontrolní skupiny dárců krve s adjustací podle věku a pohlaví. 
Graph 3. Koncentrace volných lehkých řetězců lambda (FLC, Free Light Chains) v séru u SLE podskupin s rozdílným významem skóre SLEDAI-2K (Systemic Lupus Erythematosus Disease Activity Index-2000) pro hodnocení celkové aktivity a kontrolní skupiny dárců krve s adjustací podle věku a pohlaví. 
Graph 4. Celková koncentrace volných lehkých řetězců (FLC, Free Light Chains) v séru u SLE podskupin s rozdílným významem skóre SLEDAI-2K (Systemic Lupus Erythematosus Disease Activity Index-2000) pro hodnocení celkové aktivity a kontrolní skupiny dárců krve s adjustací podle věku a pohlaví. 
Základní data pro vybrané parametry imunologického profilu SLE v séru ve skupinách se skóre SLEDAI-2K < 6 a skóre SLEDAI-2K ≥ 6 a jejich statistické vyhodnocení jsou v tabulce 2: nejvýznamnější diference byly zjištěny pro maximální titr anti-dsDNA protilátek IFCL testem (p < 0,001) a pro antinukleosomové protilátky (p < 0,001). U celého souboru SLE byla provedena korelační analýza pro vztahy mezi FLC kappa, FLC lambda a FLC kappa + FLC lambda k paralelně stanoveným vybraným parametrům imunologického profilu SLE v séru: příslušná data a jejich statistické vyhodnocení shrnuje tabulka 3.
Table 2. Vybrané parametry imunologického profilu SLE v séru ve vztahu ke skóre SLEDAI- 2K. 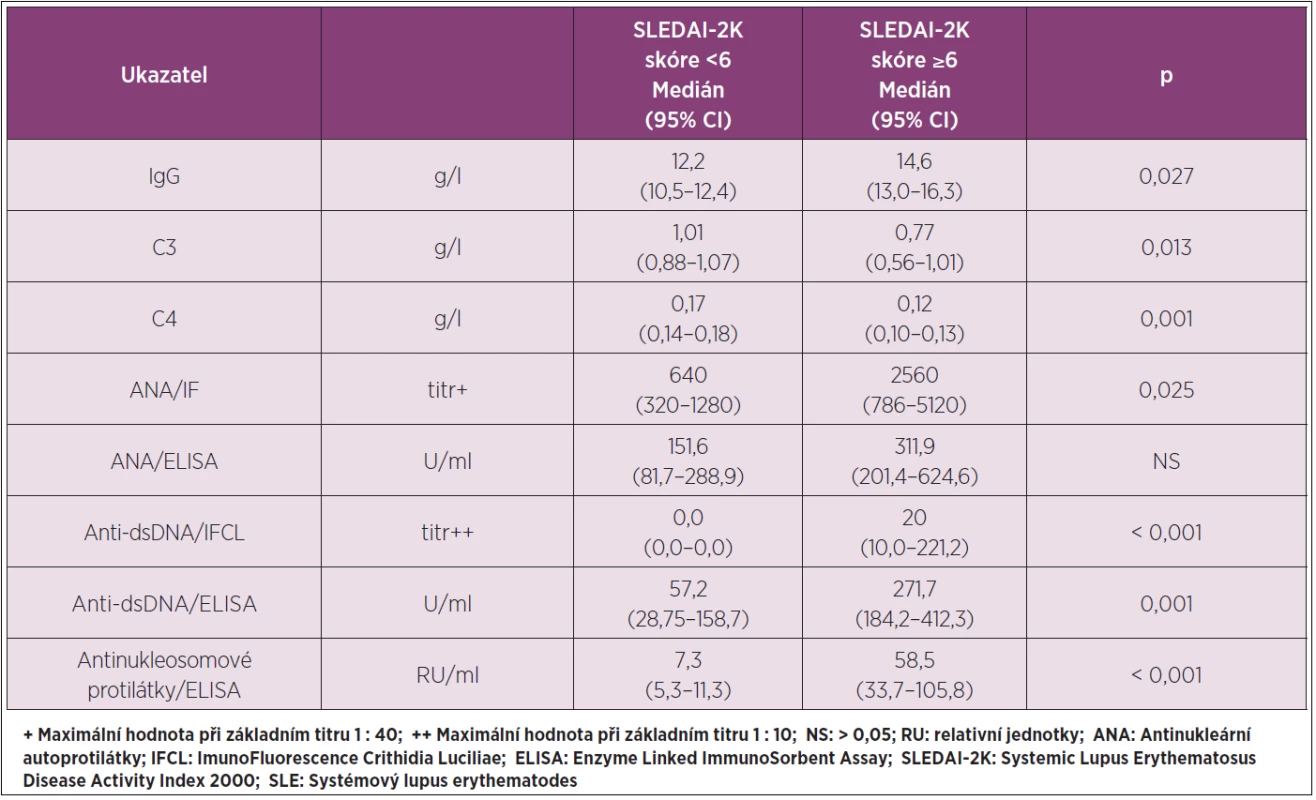
Table 3. Korelační analýza pro vztah mezi FLC kappa a/nebo FLC lambda a vybranými parametry imunologického profilu SLE v séru u celého souboru SLE (N 83). 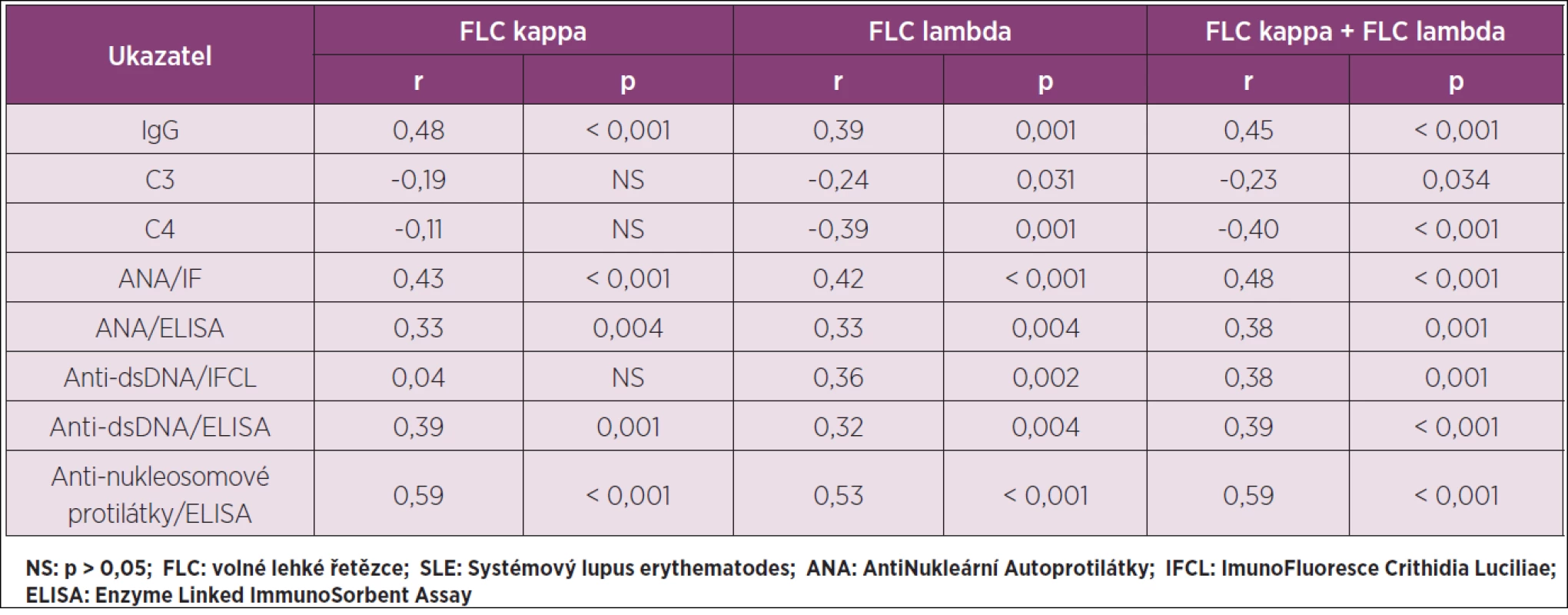
Diskuse
Plazmatické buňky produkují i fyziologicky lehké řetězce kappa nebo lambda v nadbytku; část z nich proto není vestavěna do tetrametrů kompletních Ig molekul a v biologických tekutinách (sérum, moč, mozkomíšní mok, synoviální tekutina) jsou přítomny jako FLC. Kvantitativní změny sérové koncentrace FLC kappa, FLC lambda a výpočet indexu FLC kappa:FLC lambda umožňují rozlišit dva typy těchto změn. Asymetrický vzestup sérových hodnot FLC kappa nebo FLC lambda s abnormálním indexem FLC kappa:FLC lambda svědčí pro monoklonální proliferaci u širokého spektra plazmocelulárních dyskrazií vč. MGUS (Monoclonal Gammopathy of Undefined Significance) u systémových autoimunitních nemocí. Zvýšení sérové hodnoty FLC kappa i FLC lambda s indexem FLC kappa:FLC lambda v normálním rozmezí svědčí pro polyklonální aktivaci lymfoidní tkáně u zánětu, vč. imunopatologického zánětu u systémových autoimunitních nemocí. Vyšetřením 27 pacientů s MG a 12 SLE byly oba typy těchto kvantitativních změn FLC v séru rozlišeny už v originální studii Bradwella a spoluprac. (7) o stanovení FLC metodou kvantitativní nefelometrie. Nutno dodat, že předpokladem věrohodnosti tohoto hodnocení FLC v séru je absence funkčně významné nefropatie.
Ve vztahu k systémovým autoimunitním nemocem jsou aktuálně k dispozici údaje o FLC v séru u revmatoidní artritidy (RA), primárního Sjögrenova syndromu (pSS) a u SLE. Na možnost využívat stanovení FLC v séru, v moči a v mozkomíšním moku k hodnocení aktivity u SLE upozorňovaly badatelské sondy už v éře před tím, než byla vypracována metoda stanovení FLC kvantitativní nefelometrií. Společným znakem těchto studií bylo to, že buď neumožňovaly spolehlivě odlišit FLC a lehké řetězce vázané v kompletních Ig molekulách, nebo šlo o technicky náročné separační postupy, nevhodné pro potřeby klinické praxe (10–13). Acidické Ig lehké řetězce byly ve vztahu k autoimunitě zkoumány také u myších modelů SLE (14). Východiskem pro posouzení významu kvantitativních změn polyklonálních FLC v séru jako klinicky využitelného biomarkeru aktivity SLE je komparace se skórovacími systémy pro hodnocení aktivity u této nemoci. Analýzou dat u kohorty 75 SLE tak byla prokázána signifikantní korelace (r = 0,66, p < 0,001) mezi celkovou koncentrací FLC v séru a skóre SELENA-SLEDAI (Safety of Estrogens in Lupus Erythematosus: National Assessment) a také signifikantní rozdíl (p < 0,001) v celkové koncentraci FLC v séru u SLE s klinickou i laboratorní aktivitou oproti SLE bez klinické a laboratorní aktivity (6). U 83 SLE nynější studie byla použita pro sérologickou analýzu FLC a vybraných parametrů imunologického profilu komparace se skóre SLEDAI-2K, protože všechny jeho deskriptory jsou valorizovány (9), má odůvodněným způsobem definováno skóre klinicky významné aktivity (3) a je běžně používán v klinické praxi. Základní data deskriptivní statistiky o FLC u SLE a v kontrolní skupině dárců krve s odpovídajícím složením podle věku a pohlaví jsou v tabulce 1. Zkoumaná sestava SLE zahrnuje i 4 nemocné s abnormální hodnotou indexu FLC kappa:FLC lambda; monoklonální Ig u nich nebyl imunofixací prokázán. Korelační analýzou dat získaných v celé sestavě 83 SLE byl prokázán signifikantní vztah mezi celkovými hodnotami FLC kappa + FLC lambda a skóre SLEDAI-2K (graf 1), i při odděleném hodnocení FLC kappa nebo FLC lambda a SLEDAI-2K (r = 0,56, resp. r = 0,58, p < 0,001). Tato zjištění lze považovat za nepřímý ukazatel polyklonální aktivace B buněk lymfoidní tkáně a biopatologický základ pro studium kvantitativních změn FLC v séru jako biomarkeru aktivity u SLE.
Předpokladem pro klinické využití změn sérových hodnot FLC jako biomarkeru SLE aktivity u jednotlivých nemocných jsou výsledky komparativních analýz ke skóre SLEDAI-2K (grafy 2, 3 a 4). U SLE s klinicky významným skóre SLEDAI-2K ≥ 6 byly koncentrace FLC kappa, FLC lambda i FLC kappa + FLC lambda vždy signifikantně vyšší nejenom oproti kontrolní skupině (p < 0,001), ale také oproti skupině SLE se skóre SLEDAI-2K < 6 (p < 0,001). Na celkovém skóre SLEDAI-2K ≥ 6 se u SLE této skupiny podílely i hodnoty váženého skóre klinických deskriptorů. Uvedená data svědčí pro to, že po vyloučení zkreslujících okolností lze považovat stanovení sérových koncentrací FLC za opodstatněný příspěvek k úsilí o rozšíření spektra sérových biomarkerů aktivity SLE. Interpretaci sérových hodnot FLC u jednotlivých SLE nemocných znesnadňují/znemožňují významné změny v patofyziologii tvorby a/nebo katabolismu FLC. Na straně tvorby to je nejčastěji polyklonální aktivace B buněk lymfoidní tkáně při komorbidním infektu. Pokud není klinicky vyjádřený, tak na něj může upozornit výrazný vzestup CRP v séru nad 50 mg/l nebo výrazný rozdíl mezi značně zrychlenou sedimentací a minimálními změnami CRP v séru. U aktivního SLE se totiž sérová koncentrace CRP buď nemění vůbec, nebo jenom nevýrazně, jako např. u serozitidy nebo artritidy (15). Vysoká hodnota celkového FLC v séru při asymetrickém vzestupu koncentrace FLC kappa nebo FLC lambda a výpočet abnormálního indexu FLC kappa: FLC lambda vyžaduje vyloučit monoklonální Ig imunofixací; v hodnocené sestavě tomu tak bylo u 4/83 SLE. Průkaz monoklonálního Ig sice znemožňuje interpretovat v konkrétní situaci FLC jako biomarker SLE aktivity, ale je současně indikací k upřesnění nálezu ve spektru plazmocelulárních dyskrazií. V této souvislosti je třeba dodat, že monoklonální Ig může být vzácně prokazatelný v séru i při indexu FLC kappa:FLC lambda v normálním rozmezí. Funkčně významná nefropatie zasahuje do eliminace a katabolismu FLC při polyklonální aktivaci i při monoklonální proliferaci lymfoidní tkáně. U nemocných se setrvalou retencí N katabolitů proto nelze stanovení FLC v séru použít jako biomarker aktivity u SLE; Aggarwall a spoluprac. udávají jako limitní hodnotu sérového kreatininu > 2 mg/dl (6).
Významným aspektem pro celkové posouzení přínosu sérových změn FLC jako biomarkeru aktivity SLE je vymezení k sérologickým parametrům, které jsou součástí systému SLEDAI-2K. Vztahy vybraných sérových parametrů imunologického profilu SLE ke skóre SLEDAI-2K u zkoumané sestavy 83 SLE jsou vyhodnoceny v tabulce 2 a jejich vztahy k hodnotám FLC v tabulce 3. Signifikantní korelace (p < 0,001) byly zjištěny zejména při celkovém hodnocení FLC kappa+FLC lambda a deskriptory C4 (r = -0,40) a anti-dsDNA: při hodnocení podle maximálního titru IFCL testu (r = 0,38) i při hodnocení ELISA testem (r = 0,39); za pozoruhodné zjištění lze v této souvislosti považovat to, že nejvýraznější korelace byla prokázána pro antinukleosomové protilátky (r = 0,59). Výsledky těchto analýz jsou přínosné pro úvahu o začlenění změn sérových hodnot FLC do spektra biomarkerů aktivity SLE. Svědčí pro to i dosavadní zkušenost se sledováním sérové koncentrace FLC při monitorování terpautické odpovědi na rituximab u SLE (16) a nepřímo také u RA (17); u RA responderů na rituximab byl prokázán signifikantní pokles sérové koncentrace FLC kappa i FLC lambda, u non-responderů nikoliv. Rituximab je součástí doporučení ACR (18) pro terapii lupusové nefritidy rezistentní na glukokortikoidy v kombinaci s cyklofosfamidem nebo MMF (Mofetilis Mycophenolas). Podrobnější přehled informací o významu imunoglobulinových volných lehkých řetězců u revmatických chorob je v recentním review (19).
Podporováno projektem Univerzity Karlovy PRVOUK P37 – 08.
Adresa pro korespondenci:
Prof. MUDr. Zbyněk Hrnčíř, DrSc.
II. interní klinika LFUK a FN
Sokolská 581
500 05 Hradec Králové
e-mail: hrncir@fnhk.cz
Sources
1. Illei GG, Tackey E, Lapteva L, Lipsky PE. Biomarkers in systemic lupus erythematosus. Arthritis Rheum 2004;50 : 2048–2061.
2. Ruperto N, Hanrahan LM, Alarcón GS, Belmont HM, Brey RL, Brunetta Pe, et al. International consensus for a definition of disease flare in lupus. Lupus 2011;20 : 453–462.
3. Romero-Diaz J, Isenberg D, Ramsey-Goldman R. Measures of adult systemic lupus erythematosus. Arthritis Care Res 2011;63 (S11):S37–S46.
4. Steiman AJ, Gladman DD, Ibanez D, Urowitz MB, et al. Outcomes in patients with systemic lupus erythematosus with and without a prolonged serologically active clinically quiescent period. Arthritis Care Res 2012;64 : 511–518.
5. Ho A, Magder LS, Barr SG, Petri M. Decrease in anti-double-stranded DNA levels are associated with concurrent flares in patients with systemic lupus erythematosus. Arthritis Rheum 2001;44 : 2342–2349.
6. Aggarwal R, Sequeira W, Kokebie R, Mikolaitis RA, Fogg L, Finnegan A, et al. Serum free light chains as biomarkers for systemic lupus erythematosus disease aktivity. Arthritis Care Res 2011;63 : 891–898.
7. Bradwell AR, Carr Smith HD, Mead GP, Tang LX, Showell PJ, Drayson MT, et al. Hihgly sensitive, automated immunoassay for immunoglobulin free light chains in serum and urine. Clin Chem 2001;47 : 673–680.
8. Rahna, A, Isenberg DA. Systemic lupus erythematosus. N Engl J Med 2008;358 : 929–939.
9. Gladman DD, Ibanez D, Urowitz MB. Systemic lupus erythematosus disease activity index 2000. J Rheumatol 2002;29 : 288–291.
10. Cooper A, Bluestone R. Free immunoglobulin light chains in connective tissue diseases. Ann Rheum Dis 1968;27 : 537–543.
11. Epstein WV, Tan M. Increase of L-chains proteins in the sera of patients with systemic lupus erythematosus and the synovial fluid of patients with peripheral arthritis. Arthritis Rheum 1966;9 : 713–716.
12. Hirohata S, Miyamoto T. Increased intrathecal immunoglobulin synthesis of both kappa and lambda types in patients with systemic lupus erythematosus and central nervous system involvment. J Rheumatol 1986;13 : 715–721.
13. Sølling K, Sølling J, Rømer FK. Free light chains of immunoglobulins in serum from patients with rheumatoid arthritis, sarcoidosis, chronic infections and pulmonary cancer. Acta Med Scand 1981;209 : 473 : 477.
14. Cohen PL, Eisenberg RA, Dermer GB. Unusual acidic light chains in murine SLE serum. Clin Exp Immunol 1984;55 : 509–515.
15. Gordon C. Assessing disease activity and outcome in systemic lupus erythematosus. In Hochberg MC, et al. „Rheumatology“, Mosby 3. Ed., 2003 : 1389–1393.
16. Chiche L, Cournac JM, Mancini J, Bardin N, Thomas G, Jean R, et al. Normalization of serum-free light chanis in patients with systemic lupus erythematosus upon rituximab treatment and correlation with biological disease activity. Clin Rheumatol 2011;30 : 695–689.
17. Komerlink TG, Tekstra J, Thurlings RM, Boumans MHJ, Vos K, Tak PP, et al. Decreace in immunoglobulin free light chains in patients with rheumatoid arthritis upon rituximab (anti-CD20) treatment correlates with decrease in disease activity. Ann Rheum Dis 2010;69 : 2137–2144.
18. Hahn BH, McMahon MA, Wilkinson A, Wallace WD, Daikh DI, Fitzgerald JD, et al. American College of Rheumatology guidelines for screening, treatment, and management of lupus nephritis. Arthritis Care Res 2012;64 : 797–808.
19. Hrnčíř Zb. Imunoglobulinové volné lehké řetězce u revmatických chorob. Rheumatologia 2012;26 : 57–62.
Labels
Dermatology & STDs Paediatric rheumatology Rheumatology
Article was published inCzech Rheumatology

2013 Issue 1
Most read in this issue- Imunoglobulinové volné lehké řetězce v séru jako biomarker aktivity u systémového lupus erythematodes
-
Význam nových cytokinů v patogenezi revmatických onemocnění
Autoreferát disertační práce
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

