-
Medical journals
- Career
Primární řasinky buněk pojivové tkáně
Authors: J. Dvořák 1; Z. Dvořák 2; V. Sitorová 3; Nikolov Dh 3; J. Mokrý 4; I. Richter 5,6; S. Filip 1; A. Ryška 3; J. Petera 1
Authors‘ workplace: Klinika onkologie a radioterapie LFUK a FN Hradec Králové, 2ARTHROMED, s. r. o., Pardubice, 3Fingerlandův ústav patologie LFUK a FN Hradec Králové, 4Ústav histologie a embryologie LFUK Hradec Králové, 5Oddělení klinické onkologie, Krajská nemocnice Libere 1
Published in: Čes. Revmatol., 20, 2012, No. 4, p. 170-174.
Category: Overview Reports
Overview
Primární řasinka je senzorická, solitární, nepohyblivá, mikrotubulární struktura, která v klidové části buněčného cyklu vyrůstá na povrch většiny lidských buněk, včetně kmenových buněk mezenchymu, osteoblastů, osteocytů, chondroblastů, chondrocytů, fibroblastů a fibrocytů. Primární řasinky se vyskytují i na povrchu chondrocytů osteoartrotické chrupavky a buněk benigních i maligních nádorů pojivové tkáně včetně enchondromu, osteochondromu, osteosarkomu, chondrosarkomu a Ewingova sarkomu kosti. Bazálním tělískem primární řasinky je mateřský centriol. Tématem tohoto přehledového sdělení jsou současné poznatky o primárních řasinkách buněk pojivové tkáně.
Klíčová slova:
primární řasinky, epifyzodiafyzární ploténka, kostní nádory, osteoartrózaÚvod
Primární řasinka u savců včetně člověka byla poprvé popsána v roce 1898 švýcarským anatomem KW. Zimmermannem, který ji pozoroval u mnoha typů lidských buněk, nikoliv však kostních (1). Primární řasinka buněk skeletu byla poprvé popsána v roce 1972 (2). Mnoho let byla primární řasinka považována za nevýznamný rudiment. Větší pozornost se primární řasince v biologii skeletu začala věnovat až po vyslovení hypotézy o její mechanosenzorické funkci ve skeletu v roce 2003 (3). Název této struktury je odvozen od řasinkové buňky epitelu dýchacích cest, kde bylo během buněčného vývoje pozorováno, že se nejprve z mateřského centriolu vytváří jedna nepohyblivá (primární) řasinka a následně v průběhu diferenciace, acentriolárně, několik set pohyblivých (sekundárních) řasinek (4).
Primární řasinka je senzorická, solitární, nepohyblivá, mikrotubulární struktura, která v klidové části buněčného cyklu vyrůstá na povrch většiny lidských buněk. Přítomnost primární řasinky na povrchu buňky je přechodná: vyskytuje se v klidové fázi G1 (G0) a na počátku S fáze buněčného cyklu, před vstupem nebo v průběhu G2 fáze buněčného cyklu je resorbována. Po ukončení mitózy centrosom (oba centrioly s pericentriolárním materiálem) migruje k povrchu buňky, kde se mateřský centriol diferencuje v bazální tělísko, které slouží jako nukleační centrum mikrotubulů axonematu primární řasinky (5). Po většinu doby interfáze je centrosom lokalizován při povrchu buňky pod buněčnou membránou, kde jeho mateřský centriol, dočasně diferencovaný na bazální tělísko, slouží jako nukleační centrum mikrotubulů senzorické primární řasinky. Před zahájením mitózy se mikrotubuly primární řasinky depolymerizují. Tím se uvolní bazální tělísko/mateřský centriol a centrosom se může přemístit k jádru buňky, aby mohla být zahájena mitóza (6). V literatuře se používá výraz „bazální tělísko/centriol“, který se někdy přirovnává k výrazu „jitřenka/večernice“. Jedná se o stejnou strukturu, která cyklicky migruje: v době, kdy organizuje mitotické vřeténko v centru buňky, se nazývá centriol a v době, kdy je ukotvena v buněčné membráně, a kdy z ní vyrůstají mikrotubuly primární řasinky, se nazývá bazální tělísko (7). Typicky je délka primárních řasinek i podíl buněk s primárními řasinkami v populaci větší ve statických buněčných populacích než v proliferujících buněčných populacích (8, 9).
Primární řasinka se vyskytuje na povrchu buňky vždy v jediném exempláři a je tvořena 9 páry vnějších mikrotubulů (uspořádání 9+0), bez páru vnitřních mikrotubulů, který je obvyklý u pohyblivých řasinek (uspořádání 9+2) (10).
Kompartment řasinky postrádá ribosomy (11), neprobíhá zde syntéza proteinů. Všechny proteiny, které jsou syntetizovány v cytosolu, musí být proto do řasinky transportovány molekulárními motory: kinesinem anterográdně a dyneinem retrográdně (10). Buňky vyvinuly specializovaný transportní mechanismus, nazývaný intraflagelární transport (IFT), který byl poprvé popsán u bičíku (flagely) jednobuněčné zelené řasy Chlamydomonas reinhardtii. Jedná se o dvousměrný pohyb skupin makromolekulárních proteinových komplexů podél mikrotubulů axonematu, pod membránou řasinky či bičíku (12, 13). Intraflagelární transport je vysoce konzervativní proces, který je kriticky nezbytný pro tvorbu, údržbu a funkci řasinek primárních, pohyblivých i bičíků (14). To má praktický význam: nejčastější poruchou řasinek primárních, pohyblivých, i bičíků (nejčastější příčinou ciliopatií) je porucha intraflagelárního transportu.
V primárních řasinkách různých typů buněk jsou přítomny různé typy receptorů včetně mechanosenzorů, receptorů pro růstové faktory (EGFR, PDGFR), hormony (somatostatin), biologicky aktivní látky (serotonin) a morfogeny (Hedgehog, Wnt). V primární řasince jsou aktivní signální dráhy Hedgehog a Wnt. U těch typů lidských buněk, které mají primární řasinku – tedy u naprosté většiny buněk, je signální dráha Hedgehog aktivní výlučně právě jen v primární řasince (15). Signalizace Hedgehog může probíhat i v buňkách bez primární řasinky, ale primární řasinka tuto signalizaci výrazně zesiluje.
V současné době jsou primární řasinky prokázány na povrchu většiny typů buněk pojivové tkáně včetně kmenových buněk mezenchymu (16), osteoblastů, osteocytů, chondroblastů, chondrocytů, fibroblastů a fibrocytů (17). Primární řasinky se vyskytují i na povrchu chondrocytů osteoartrotické chrupavky a buněk benigních i maligních nádorů pojivové tkáně včetně enchondromu, osteochondromu, osteosarkomu, chondrosarkomu a Ewingova sarkomu kosti.
Tématem tohoto přehledového sdělení jsou současné poznatky o primárních řasinkách buněk pojivové tkáně.
Mechanosenzorická funkce primárních řasinek
Předpokládá se, že primární řasinky v kostní tkáni a šlachách mají mechanosenzorickou funkci, a podílí se na orientaci buněk a extracelulární hmoty (18, 19). Mechanosenzorická funkce primárních řasinek je nejlépe objasněna u buněk epitelu, zejména epitelu ledvinných kanálků (17). Proud tekutiny v ledvinném kanálku ohýbá primární řasinku a tím iniciuje intracelulární signální kaskádu. Primární řasinky prostřednictvím mechanosenzorických polycystinových kalciových kanálů lokalizovaných v membráně primární řasinky ledvinných kanálků monitorují velikost smykového napětí (shear stress). Jedná se o třecí sílu, kterou viskozita proudící tekutiny působí tangenciálně na povrch buněk epitelové výstelky ledvinných kanálků. Porucha primárních řasinek ledvinných kanálků vede ke zvýšení proliferace a tvorbě cyst ledvin. Molekulárně biologické mechanismy mechanosenzorické funkce primárních řasinek v pojivové tkáni však zatím nejsou plně objasněny (20). Hlavním dosavadním důkazem mechanosenzorické funkce primárních řasinek v kostní tkáni jsou studie na kulturách osteoblastů a osteocytů (21). K hlubšímu studiu funkcí primárních řasinek ve skeletu bylo vytvořeno také několik myších modelů (20).
Ciliopatie spojené s poruchami skeletu
Postupně se rozrůstá počet nemocí a vývojových vad, u kterých je rozpoznáno, že se na jejich vzniku podílí poruchy primárních řasinek. Tyto nemoci a vývojové vady se souhrnně označují jako ciliopatie. Protože se primární řasinky vyskytují u mnoha různých typů buněk, jejich poruchy zpravidla postihují více orgánových soustav současně (tab. 1).
Table 1. Přehled onemocnění a syndromů, spojených s poruchami skeletu, na kterých se podílí poruchy primárních řasinek. 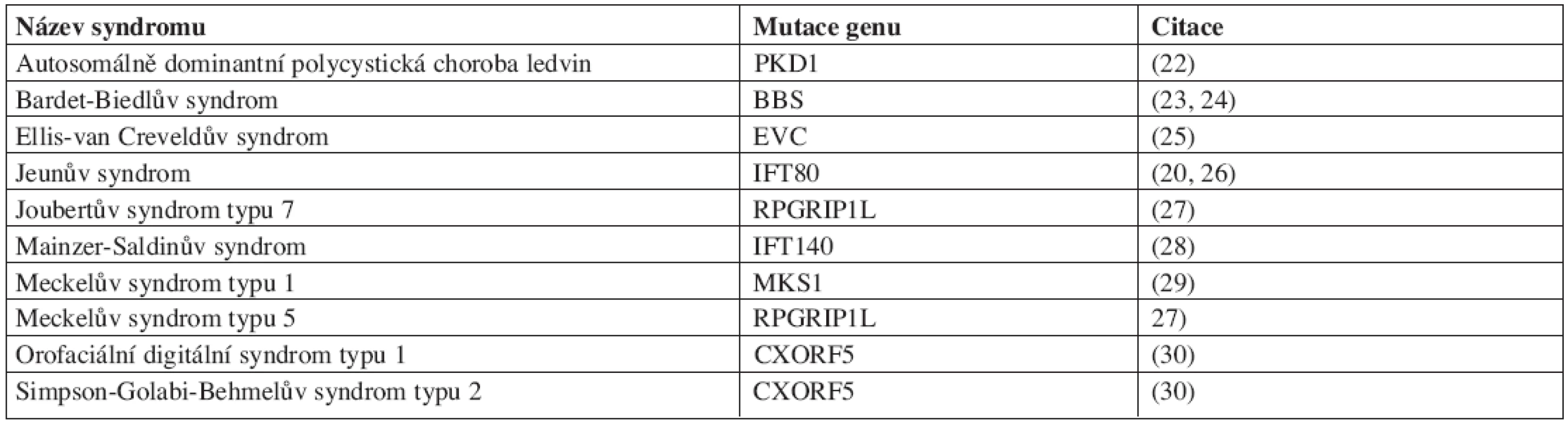
Primární řasinky ve šlachách extenzorů
Primární řasinky jsou ve šlachách extenzorů orientovány rovnoběžně s vlákny kolagenu podél dlouhé osy šlachy (17, 31, 32). V extenzoru šlachy potkana byly pozorovány primární řasinky u 64% tenocytů. Délka primárních řasinek tenocytů extenzoru šlachy potkana se pohybovala v širokém rozmezí 1,3-11,3 μm. Axonema primárních řasinek extenzoru šlachy je rovná, na rozdíl od ohnutého axonematu, které je v některých případech pozorováno u buněk chondrocytů nebo epitelu (22).
Primární řasinky epifyzodiafyzární ploténky a osteochondromu
Epifyzodiafyzární ploténka je vrstva růstové hyalinní chrupavky, která se nachází v metafýze všech dlouhých kostí u dětí a dospívajících. Epifyzodiafyzární(růstová) chrupavka umožňuje růst kostí do délky. U dospělých, u kterých došlo k ukončení růstu, je nahrazena epifyzodiafyzárnílinií. Epifyzodiafyzární ploténka je tvořena chondrocyty a větším množstvím mezibuněčné hmoty. Chondrocyty měří v průměru 10–30 μm. Jejich základní funkcí je produkce jednotlivých komponent mezibuněčné hmoty. V epifyzodiafyzární chrupavce jsou chondrocyty uspořádány do skupin až 8 buněk (isogenetických řad). Isogenetické řady vznikají mitotickým dělením jednoho chondrocytu. Na obvodu epifyzodiafyzární chrupavky mají chondrocyty eliptický tvar s dlouhou osou orientovanou rovnoběžně s povrchem, hlouběji jsou okrouhlé (33).
Epifyzodiafyzární ploténka má specifickou morfologii s uspořádáním do zón: klidová zóna na epifyzeálním konci ploténky, následuje postupně zóna proliferační, hypertrofická chrupavčitá, kalcifikovaná chrupavčitá, linie eroze, zóna osteoidní a ossiformní. Při dělení chondrocytů se dceřiné buňky hromadí na epifyzeálním konci ploténky, zatímco starší buňky jsou tlačeny směrem k diafýze, kde při postupné degeneraci starších chondrocytů, dochází k postupné osifikaci osteoblasty a tvorbě nové kosti. Epifyzodiafyzární ploténka je klinicky významná, protože je častým místem infekce, primárních nádorů, metastáz, zlomenin a hormonálních poruch.
V elektronmikroskopické studii byla hodnocena četnost výskytu buněk s primárními řasinkami ve 3 zónách epifyzodiafyzární ploténky a osteochondromu: klidové, proliferační a hypertrofické (34). Osteochondrom (osteokartilaginózní exostóza) je nejčastější benigní kostní nádor. Primární řasinky se vyskytovaly ve všech 3 hodnocených zónách (stupních diferenciace) epifyzodiafyzární ploténky i osteochondromu. Ve všech 3 zónách osteochondromu pozorovali vyšší procento buněk s primárními řasinkami než v epifyzodiafyzární ploténce (klidová vrstva: 94,9 versus 89,4 %; proliferační vrstva: 93,2 versus 71,9 %; hypertrofická vrstva: 94 versus 71,6 %). U osteochondromu nebyl pozorován statisticky významný rozdíl v četnosti výskytu primárních řasinek mezi jednotlivými zónami. U epifyzodiafyzární ploténky byla nejvyšší četnost primárních řasinek v klidové zóně (89,4 %) v porovnání s proliferační (71,9 %) a hypertrofickou zónou (71,6 %).
Byla pozorována vysoká variabilita v délce primárních řasinek v rámci jednotlivých zón i mezi jednotlivými zónami epifyzodiafyzární ploténky. Průměrná délka primárních řasinek byla nejkratší v proliferační zóně (1,62 μm), následovala hypertrofická (2,23 μm) a klidová zóna (2,39 μm). Obdobné výsledky byly pozorovány i u osteochondromu, kde průměrná délka primárních řasinek byla kratší v proliferační zóně (2,13 μm) než v hypertrofické zóně (2,38 μm).
Jelikož není významný rozdíl v délce primárních řasinek osteochondromu a epifyzodiafyzární ploténky, předpokládá se, že ciliogeneze u osteochondromu není porušena, ale že v patogenezi osteochondromu hraje roli spíše porucha signalizace mezi buňkami nebo porucha signalizace mezi buňkami a mezibuněčnou hmotou.
Primární řasinky chondrocytů ve zdravé epifyzodiafyzární ploténce i osteochondromu směřují směrem do extracelulární matrix. V případě zdravé epifyzodiafyzární ploténky jsou primární řasinky orientovány rovnoběžně s podélnou osou kosti směrem k epifýze nebo diafýze. Primární řasinky chondrocytů osteochondromu jsou však orientovány náhodně všemi směry (34).
V několika studiích bylo prokázáno, že porucha intraflagelárního transportu, který je nezbytný pro tvorbu a funkci primárních řasinek vede ke ztrátě primárních řasinek, což má za následek defekty epifyzodiafyzární ploténky s poruchami tvaru buněk a ztrátu orientace buněk do sloupců (20, 34, 35, 36). Předpokládá se, že tyto defekty epifyzodiafyzární ploténky při ztrátě primárních řasinek jsou způsobeny poruchou signální dráhy Hedgehog – absencí receptorů Patched a Smoothened, které se u chondrocytů nachází v primární řasince (37).
Primární řasinky sarkomů kostí
V elektronmikroskopické studii bylo vyšetřeno 9481 buněk ze 74 benigních a maligních nádorů kostí a měkkých tkání a 11 vzorků normálních, histologicky příbuzných tkání (38). Primární řasinky maligních, benigních nádorů kostí, i normální, histologicky příbuzné tkáně měly stejnou strukturu. Kromě převládajícího uspořádání mikrotubulů 9+0, bylo v jednotlivých případech pozorováno i uspořádání 8+0, 7+0, 6+0 a 5+0. Nejvyšší frekvence výskytu buněk s primárními řasinkami byla pozorována u chondrosarkomu 8,1% z 1007 vyšetřených chondroblastů, následoval Ewingův sarkom kosti 3 % ze 452 vyšetřených nádorových buněk, osteosarkom 2,5 % ze 114 vyšetřených osteoblastů, 499 chondroblastů a 99 fibroblastů, normální chondrocyty epifyzodiafyzární ploténky 2,4 % z 605 vyšetřených chondrocytů a enchondrom 2 % z 1445 vyšetřených chondroblastů. Statistické hodnocení Wilcoxonovým testem prokázalo vyšší hodnotu výskytu primárních řasinek u maligních nádorů než u benigních nádorů a buněk normálních, histologicky příbuzných tkání. Statisticky významně vyšší byla frekvence výskytu primárních řasinek chondrosarkomu v porovnání s osteosarkomem p < 0,01, chondrosarkomu v porovnání s Ewingovým sarkomem kosti p < 0,01, chondrosarkomu v porovnání s enchondromem p < 0,01 a chondrosarkomu v porovnání s normálními chondrocyty epifyzodiafyzární ploténky p < 0,01 (38).
Primární řasinky chondrocytů při osteoartróze
Osteoartróza je nejčastějším onemocněním kloubů, které postihuje přibližně 12 % populace. Primární řasinky jsou přítomny na povrchu chondrocytů osteoartrotické chrupavky (39, 40). Většina primárních řasinek chondrocytů v osteoartrotické chrupavce je orientována směrem do středu isogenetické skupiny. V normální chrupavce je frekvence výskytu a délka primárních řasinek nejnižší v povrchové zóně a zvyšuje se úměrně se vzdáleností od kloubního povrchu. Při osteoartróze se zvyšuje frekvence výskytu a délka primárních řasinek chondrocytů na erodovaném kloubním povrchu, která zvyšuje celkový počet primárních řasinek při osteoartróze. Ve studii, provedené na turu domácím, bylo pozorováno, že se frekvence výskytu primárních řasinek na chondrocytech zvyšovala úměrně stadiu osteoartrózy. Délka primárních řasinek se zvyšovala úměrně stadiu osteoartrózy pouze v povrchové zóně (41).
Ve studii in vitro, ve které byly kloubní chondrocyty kultivovány v trojrozměrném agarózovém gelu, bylo pozorováno, že po suprafyziologické tlakové zátěži se dramaticky snížil počet a délka jejich primárních řasinek (42).
Primární řasinka je mikrotubulární struktura. V této souvislosti je proto zajímavé, že se v chondrocytech osteoartrotické chrupavky v porovnání s chondrocyty zdravé chrupavky nachází nižší množství složek cytoskeletu: o 20,1% méně tubulinu, o 37,1 % méně vimentinu, o 4,7 % méně aktinu (40).
Závěr
Primární řasinky se v klidové fázi buněčného cyklu vyskytují na povrchu většiny typů buněk zdravé pojivové tkáně i při patologických stavech pojivové tkáně, včetně osteoartrózy, benigních a maligních nádorů. Primární řasinky jsou mikrotubulární senzorické struktury, ve kterých je přítomna celá řada receptorů a signálních drah. V současné době se v pojivové tkáni intenzivně studuje především mechanosenzorická funkce primárních řasinek osteocytů a chondrocytů, a vztah primárních řasinek k buněčnému cyklu a proliferaci. Postupně se rozrůstá počet nemocí a vývojových vad, u kterých je rozpoznáno, že se na jejich vzniku podílí poruchy primárních řasinek (ciliopatie).
Poděkování Práce byla podpořena výzkumným úkolem UK-LF HK: PRVOUK P37/06.
Poděkování panu Jiřímu Kopeckému z Reprografického centra FN Hradec Králové za zhotovení schématu. Práce byla podpořena výzkumným úkolem UK-LF HK: PRVOUK P37/06.
Doc. MUDr. Josef Dvořák, PhD.
Klinika onkologie a radioterapie LFUK a FN
Fakultní nemocnice
Sokolská 581
500 05 Hradec Králové
dvorakj@fnhk.cz
Sources
1. Zimmermann KW. Beitrage zur kenntniss einiger drusen und epithelien. Arch Mikrosk Anat 1898; 52 : 552-706.
2. Tonna EA, Lampen NM. Electron microscopy of aging skeletal cells. I. Centrioles and solitary cilia. J Gerontol 1972; 27 (3): 316-324.
3. Whitfield JF. Primary cilium—is it an osteocyte’s strain-sensing flowmeter? J Cell Biochem 2003; 89 (2): 233-237.
4. Sorokin SP. Reconstructions of centriole formation and ciliogenesis in mammalian lungs. J Cell Sci 1968; 3 (2): 207-230.
5. Plotnikova OV, Golemis EA, Pugacheva EN. Cell cycle-dependent ciliogenesis and cancer. Cancer Res 2008; 68 (7): 2058-2061.
6. Dvořák J, Sitorová V, Hadži Nikolov D, Mokrý J, Richter I, Filip S, et al. Primary cilium - antenna-like structure on the surface of most mammalian cell types. J Phys: Conf Ser 2011; 329 : 012022.
7. Marshall WF, Nonaka S. Cilia: tuning in to the cell’s antenna. Curr Biol 2006; 16 (15): R604-614.
8. Pugacheva EN, Jablonski SA, Hartman TR, Henske EP, Golemis EA. HEF1-dependent Aurora A activation induces disassembly of the primary cilium. Cell 2007; 129 (7): 1351 - -136.
9. Dvořák J, Sitorová V, Hadži Nikolov D, Mokrý J, Richter I, Filip S, et al. Primární řasinky buněk kardiovaskulárního aparátu. Vnitřní lékařství. in press.
10. Michaud EJ, Yoder BK. The primary cilium in cell signaling and cancer. Cancer Res 2006; 66 (13): 6463-6467.
11. Stephan A, Vaughan S, Shaw MK, Gull K, McKean PG. An essential quality control mechanism at the eukaryotic basal body prior to intraflagellar transport. Traffic 2007; 8 (10): 1323-2330.
12. Kozminski KG, Johnson KA, Forscher P, Rosenbaum JL. A motility in the eukaryotic flagellum unrelated to flagellar beating. Proc Natl Acad Sci USA 1993; 90 (12): 5519 - -5523.
13. Scholey JM. Intraflagellar transport motors in cilia: moving along the cell’s antenna. J Cell Biol 2008; 180 (1): 23-29.
14. Rosenbaum JL, Witman GB. Intraflagellar transport. Nat Rev Mol Cell Biol 2002; 3 (11): 813-825.
15. Dvořák J, Sitorová V, Hadži Nikolov D, Mokrý J, Richter I, Filip S, et al. Primární řasinky a jejich biologické funkce. Onkologie 2011; 5 (4): 234-238.
16. Tummala P, Arnsdorf EJ, Jacobs CR. The Role of Primary cilia in mesenchymal stem cell differentiation: A Pivotal Switch in Guiding Lineage Commitment. Cell Mol Bioeng 2010; 3 (3): 207-212.
17. Donnelly E, Ascenzi MG, Farnum C. Primary cilia are highly oriented with respect to collagen direction and long axis of extensor tendon. J Orthop Res 2010; 28 (1): 77-82.
18. Anderson CT, Castillo AB, Brugmann SA, Helms JA, Jacobs CR, Stearns T. Primary cilia: cellular sensors for the skeleton. Anat Rec (Hoboken) 2008; 291 (9): 1074-1078.
19. Temiyasathit S, Jacobs CR. Osteocyte primary cilium and its role in bone mechanotransduction. Ann NY Acad Sci 2010; 1192 : 422-428.
20. Haycraft CJ, Serra R. Cilia involvement in patterning and maintenance of the skeleton. Curr Top Dev Biol 2008; 85 : 303-332.
21. Malone AM, Anderson CT, Tummala P, Kwon RY, Johnston TR, Stearns T. Primary cilia mediate mechanosensing in bone cells by a calcium-independent mechanism. Proc Natl Acad Sci USA 2007; 104 (33): 13325-13330.
22. Turco AE, Padovani EM, Chiaffoni GP, Peissel B, Rossetti S, Marcolongo A, et al. Molecular genetic diagnosis of autosomal dominant polycystic kidney disease in a newborn with bilateral cystic kidneys detected prenatally and multiple skeletal malformations. J Med Genet 1993; 30 (5): 419-422.
23. Ansley SJ, Badano JL, Blacque OE, Hill J, Hoskins BE, Leitch CC, et al. Basal body dysfunction is a likely cause of pleiotropic Bardet-Biedl syndrome. Nature 2003; 425 (6958): 628-633.
24. Tobin JL, Di Franco M, Eichers E, May-Simera H, Garcia M, Yan J, et al. Inhibition of neural crest migration underlies craniofacial dysmorphology and Hirschsprung’s disease in Bardet-Biedl syndrome. Proc Natl Acad Sci USA 2008; 105 (18): 6714-6719.
25. Ruiz-Perez VL, Blair HJ, Rodriguez-Andres ME, Blanco MJ, Wilson A, Liu YN, et al. Evc is a positive mediator of Ihh-regulated bone growth that localises at the base of chondrocyte cilia. Development 2007; 134 (16): 2903-2912.
26. Beales PL, Bland E, Tobin JL, Bacchelli C, Tuysuz B, Hill J, et al. IFT80, which encodes a conserved intraflagellar transport protein, is mutated in Jeune asphyxiating thoracic dystrophy. Nat Genet 2007; 39 (6): 727-729.
27. Delous M, Baala L, Salomon R, Laclef C, Vierkotten J, Tory K, et al. The ciliary gene RPGRIP1L is mutated in cerebello-oculo-renal syndrome (Joubert syndrome type B) and Meckel syndrome. Nat Genet 2007; 39 (7): 875-881.
28. Perrault I, Saunier S, Hanein S, Filhol E, Bizet AA, Collins F, et al. Mainzer-Saldino syndrome is a ciliopathy caused by IFT140 mutations. Am J Hum Genet 2012; 90 (5): 864-870.
29. Kyttälä M, Tallila J, Salonen R, Kopra O, Kohlschmidt N, Paavola-Sakki P, et al. MKS1, encoding a component of the flagellar apparatus basal body proteome, is mutated in Meckel syndrome. Nat Genet 2006; 38 (2): 155-157.
30. Ferrante MI, Zullo A, Barra A, Bimonte S, Messaddeq N, Studer M, et al. Oral-facial-digital type I protein is required for primary cilia formation and left-right axis specification. Nat Genet 2006; 38 (1): 112-117.
31. Donnelly E, Williams R, Farnum C. The primary cilium of connective tissue cells: imaging by multiphoton microscopy. Anat Rec (Hoboken) 2008; 291 (9): 1062-1073.
32. Poole CA, Jensen CG, Snyder JA, Gray CG, Hermanutz VL, Wheatley DN. Confocal analysis of primary cilia structure and colocalization with the Golgi apparatus in chondrocytes and aortic smooth muscle cells. Cell Biol Int 1997; 21 (8): 483-494.
33. Lüllmann-Rauch R: Histologie. Grada Publishing a.s. 2012; překlad 3. vydání, 556 s.
34. de Andrea CE, Wiweger M, Prins F, Bovée JV, Romeo S, Hogendoorn PC. Primary cilia organization reflects polarity in the growth plate and implies loss of polarity and mosaicism in osteochondroma. Lab Invest 2010; 90 (7): 1091-1101.
35. Song B, Haycraft CJ, Seo HS, Yoder BK, Serra R. Development of the post-natal growth plate requires intraflagellar transport proteins. Dev Biol 2007; 305 (1): 202-216.
36. McGlashan SR, Haycraft CJ, Jensen CG, Yoder BK, Poole CA. Articular cartilage and growth plate defects are associated with chondrocyte cytoskeletal abnormalities in Tg737orpk mice lacking the primary cilia protein polaris. Matrix Biol 2007; 26 (4): 234-246.
37. Whitfield JF. The solitary (primary) cilium - a mechanosensory toggle switch in bone and cartilage cells. Cell Signal 2008; 20 (6): 1019-1024.
38. Ganev GG. Pathological significance of cilia and centrioles in bone and soft tissue tumors. J Orthop Sci 1997; 2 (3): 137--145.
39. Kouri JB, Argüello C, Luna J, Mena R. Use of microscopical techniques in the study of human chondrocytes from osteoarthritic cartilage: an overview. Microsc Res Tech 1998; 40 (1): 22-36.
40. Capín-Gutiérrez N, Talamás-Rohana P, González-Robles A, Lavalle-Montalvo C, Kourí JB. Cytoskeleton disruption in chondrocytes from a rat osteoarthrosic (OA) -induced model: its potential role in OA pathogenesis. Histol Histopathol 2004; 19 (4): 1125-1132.
41. McGlashan SR, Cluett EC, Jensen CG, Poole CA. Primary cilia in osteoarthritic chondrocytes: from chondrons to clusters. Dev Dyn 2008; 237 (8): 2013-2020.
42. McGlashan SR, Knight MM, Chowdhury TT, Joshi P, Jensen CG, Kennedy S. Mechanical loading modulates chondrocyte primary cilia incidence and length. Cell Biol Int 2010; 34 (5): 441-446.
Labels
Dermatology & STDs Paediatric rheumatology Rheumatology
Article was published inCzech Rheumatology

2012 Issue 4
Most read in this issue- Stillova nemoc dospělých - kazuistika
- Osteoimunologie
- Geny hlavního histokompatibilního komplexu nejsou pouze transplantačními antigeny
- Abatacept a jeho použití v České republice v léčbě RA – údaje z registru ATTRA
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

