-
Medical journals
- Career
Průběh systémového lupus erytematodes v graviditě
: D. Tegzová; K. Andělová 1
: Revmatologický ústav a Revmatologická klinika 1. LF UK v Praze, 1Ústav péče o matku a dítě v Praze
: Čes. Revmatol., 19, 2011, No. 1, p. 17-21.
: Reviews
Průběh gravidity i laktace u pacientek se SLE je rizikový. Riziko vyplývá ze samotné choroby, její aktivity, orgánového postižení, dále léčby matky před koncepcí, v průběhu těhotenství a i laktace. Nejčastěji dojde ke vzplanutí nemoci ve formě kožně kloubních změn a leukopenie, častý bývá i renální relaps. Existuje i riziko vzniku lupus neonatorum s ireverzibilním AV blokem až III. stupně u novorozence u matek s pozitivitou anti Ro a anti La protilátek. Vyšší je riziko opakovaných abortů v důsledku antifosfolipidového sydnromu. Imunosupresivní léčba SLE má s ohledem na graviditu závažná rizika. Nízké dávky glukokortikoidů a antimalarika jsou bezpečná. Léčba azatioprinem a cyklosporinem A není v graviditě vhodná, ale může být v indikovaných případech použita, zcela kontraindikováno je podávání cyklofosfamidu. Při léčbě těmito léky je nutno zajistit účinnou antikoncepci a léky včas před plánovanou koncepcí vysadit. Při terapii cyklofosfamidem je rovněž nutno před koncepcí preventivně zajistit ochranu vajíčka, aby nevznikla ireverzibilní amenorea. Zásadní význam pro sledování rizikových gravidních pacientek se SLE má dobře koordinovaná léčba, která by měla být zahájena již před graviditou výběrem správné antikoncepce a plánováním koncepce na dobu, kdy je onemocnění pod kontrolou nebo zcela v remisi.
Klíčová slova:
systémový lupus erytematodes, gravidita, farmakoterapieÚvod
Průběh gravidity i laktace u pacientek s revmatickou systémovou nemocí může být rizikový. Riziko vyplývá ze samotné choroby, z terapie matky před koncepcí, v průběhu těhotenství a laktace. Rizikem může být i terapie otce v období krátce před koncepcí. Výběr léčby revmatických chorob v graviditě a v laktaci je dán předně charakterem choroby, jejím obvyklým průběhem v graviditě, aktivitou, eventuální přítomností orgánového postižení a interkurentního onemocnění ženy, věkem nemocné apod. Proto je přístup k terapii u jednotlivých revmatických chorob odlišný (1).
Na rozdíl od revmatoidní artritidy je průběh onemocnění u systémového lupus erytematodes (SLE) v graviditě dosti rizikový (2, 3), což je dáno řadou okolností: vysokým rizikem vzplanutí nemoci, zejména pod obrazem kožně kloubních změn a leukopenie, ale často i renálního relapsu, dále rizikem vzniku lupus neonatorum s téměř ireverzibilním atrio-ventrikulárním (AV) blokem až III. stupně u novorozence matek s pozitivitou anti Ro a anti La protilátek a dále rizikem opakovaných abortů v důsledku antifosfolipidového syndromu (APS). Rovněž samotná nutnost soustavné imunosupresivní léčby SLE i v době gravidity má svá závažná rizika (4).
Možné komplikace gravidity u SLE
U gravidních pacientek se SLE je popisován relaps nemoci ve 21-60 %, a to nejčastěji ve formě exantému, artritidy a leukopenie s průvodním nárůstem autoprotilátkové aktivity, tedy poklesem komplementu a vzrůstem titru anti ds DNA autoprotilátek (5). Renální flare je udáván až ve 23 %, neuropsychiatrický flare u 5 %, trombocytopenie v 11 % a celkový relaps nemoci ve 24 % případů gravidních žen se SLE (4). Pacientky s lupusovou nefritidou mají v graviditě větší riziko hypertenze (37–56 %) (6) a preeklampsie, která je udávána až ve 30 % takovýchto případů. (7). Riziko gravidity pro plod a novorozence je vyšší zejména u pacientek s lupusovou nefritidou a při pozitivitě antifosfolipidových protilátek (aPL). Pozitivita lupusového antikoagulans (LA) se v poslední době jeví jako hlavní riziko možné trombózy nebo postižení uteroplacentární jednotky. Riziko gravidity a rozvoje komplikací vzrůstá v případě, že byly komplikace i v předcházející graviditě (5, 6).
Charakter onemocnění SLE přináší pro těhotenství celou řadu dalších možných komplikací, které jsou závislé na aktivitě choroby v průběhu gravidity a na přítomnosti orgánového postižení. Mezi nejčastější komplikace patří vyšší riziko abortů, předčasných porodů, hypertenze, preeklampsie a tromboembolických příhod. Dále je vyšší riziko růstové retardace plodů matek se SLE a intrauterinního úmrtí. Je třeba zmínit i vyšší výskyt gestačního diabetu, zejména u žen léčených vyššími dávkami kortikosteroidů.
Lupus neonatorum a kongenitální AV blokáda
Vzácnější, ale závažnou komplikací gravidity u SLE je lupus neonatorum, a to jak v lehčí formě přechodného exantému (až 75 % ze všech případů lupus neonatorum), tak i ve formě systémových projevů (5–15 % ze všech případů) s leukopenií, trombocytopenií a hepatomegalií (5, 6). Nejzávažnější formou lupus neonatorum je kongenitální AV blokáda, vzácně i třetího stupně, která bývá sdružena i s hydropsem plodu. AV blokáda bývá až ve 25 % případů kombinována s přechodným exantémem (7). Příčinou lupus neonatorum je přítomnost transplacentárně přenesených anti Ro autoprotilátek o molekulové hmotnosti 52,60 kDa a anti La protilátek 48 kDa. Objevuje se u 2 až 5 % matek, které mají pozitivitu těchto protilátek. Patogeneticky se na vzniku AV bloku podílí vazba anti-Ro protilátek na kardiomyocyty s indukcí apoptozy a vazba anti-La na apoptotické kardiomyocyty. Ty jsou následně fagocytovány makrofágy, dojde k indukci produkce prozánětlivých a fibrotizujících cytokinů a tento proces vede k fibrotizaci a jizvení převodního aparátu u geneticky citlivých plodů (8).
Jelikož zmíněné autoprotilátky se vyskytují nejen u SLE, ale i jiných autoimunitních systémových onemocnění pojiva, není lupus neonatorum vázán pouze na onemocnění SLE. Riziko postižení AV blokádou u matek s touto komplikací je v další graviditě zvýšeno. Perinatální mortalita je vysoká, až ve 20 % případů. 65 % novorozenců s kongenitální AV blokádou musí mít trvalý kardiostimulátor. Je závažné, že až ve 30 % jsou matky s projevy lupus neonatorum u dítěte do té doby klinicky asymptomatické, nemají tedy diagnostikované žádné systémové onemocnění, a tudíž není ani důvod je ve smyslu uvedených autoprotilátek v graviditě vyšetřovat. Komplikace jsou tak často zachyceny až po porodu, kdy již není možné eventuální AV blokádu terapeuticky ovlivnit. Dle údajů Amerického registru pro lupus neonatorum při analýze skupiny nemocných bylo zjištěno, že 23 % matek je asymptomatických, ale v 50 % došlo během dalších let k vývoji systémové nemoci. 24 % matek mělo nediferencované onemocnění pojiva (UCTD), 15 % SLE, 22 % Sjögrenův syndrom, 16 % SLE a sekundární Sjögrenův syndrom (8, 9).
Diagnostika kongenitální AV blokády spočívá v systematickém provádění fetální dopplerovské echokardiografie se sledováním eventuálního prodloužení PR intervalu, přičemž od 16. týdně gravidity je vyšetření nutno v pravidelných intervalech opakovat, zprvu dokonce po jednom týdnu, od 26. týdně pak po dvou týdnech. Terapeuticky je dosti problematické tuto vysoce závažnou komplikaci ovlivnit, efekt léčby je totiž sporný a lze jej předpokládat pouze u opravdu včasného nasazení terapie (8). Užívány jsou glukokortikoidy s průnikem placentou, tedy s nízkou molekulární vahou (dexametazon, betametazon). Současná léčba prednisonem nebo metylprednisolonem, kterou užívá matka v rámci léčby svého vlastního systémového onemocnění, nemá pro lupus neonatorum žádný preventivní ani léčebný význam (9, 10). Diskutováno je i preventivní použití intravenózních imunoglobulinů.
Sledování rizikových parametrů
Při sledování gravidních pacientek se SLE jsou k disposici parametry, které mohou pomoci včas určit možné vzplanutí SLE. Mezi diagnosticky významné parametry, které mohou předpovídat blížící se relaps nemoci, patří kožní raš, artritida, leukopenie, snížení komplementu a nárůst hodnoty anti ds DNA. Naopak zarůžovění obličeje a dlaní, artralgie, lehká anémie a únava jsou relativně málo významnými komplikacemi (tab. 1). Přítomnost trombocytopenie může provázet eventuální antifosfolipidový syndrom, bývá sdružena s rupturou placenty a vyskytuje se častěji u preeklampsie (3, 4).
1. Významné markery předpovídající možný relaps SLE. 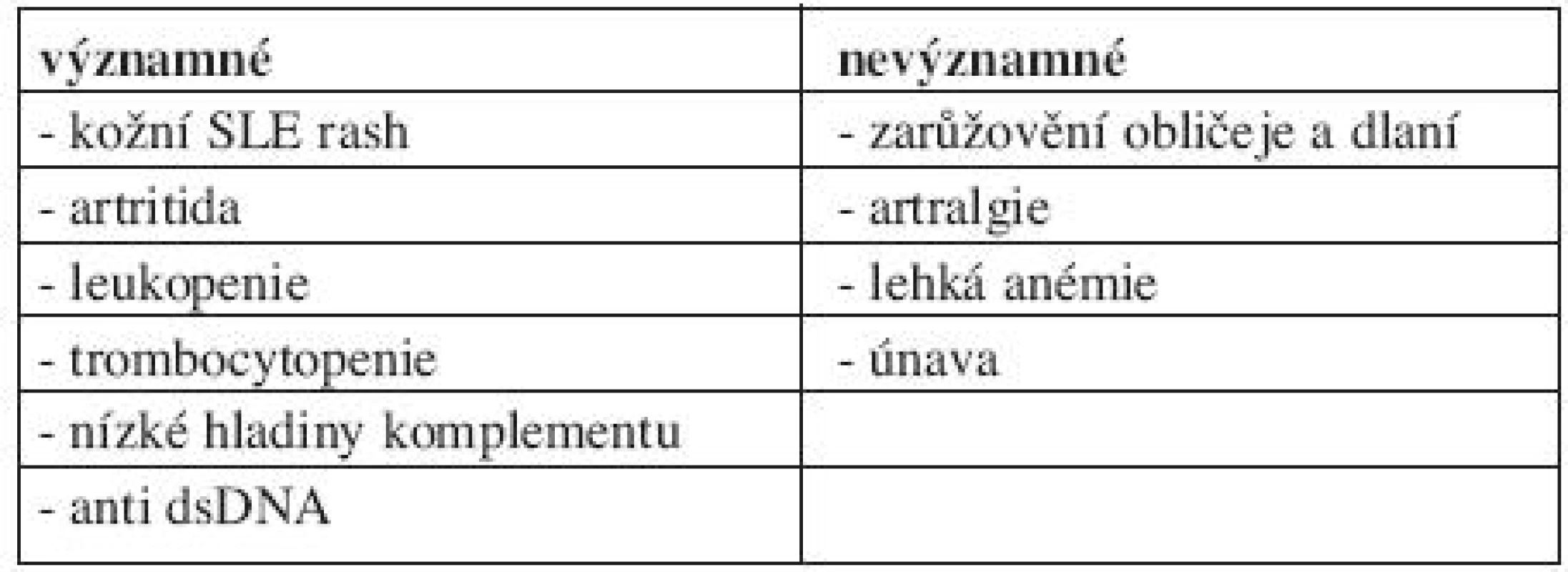
Přítomnost proteinurie je v graviditě typická jak pro preeklampsii, tak i pro lupusovou nefritidu. Diferencovat tyto varianty je často obtížné, jelikož celá řada projevů je společných, například zmíněná proteinurie, hyperurikemie, hypertenze a edémy. Dobrým diagnostickým vodítkem je vyšetření přítomnosti autoprotilátek, typických pro SLE, resp. lupusovou nefritidu (7) (tab. 2).
2. Diferenciální diagnostika preeklampsie a lupusové nefritidy. 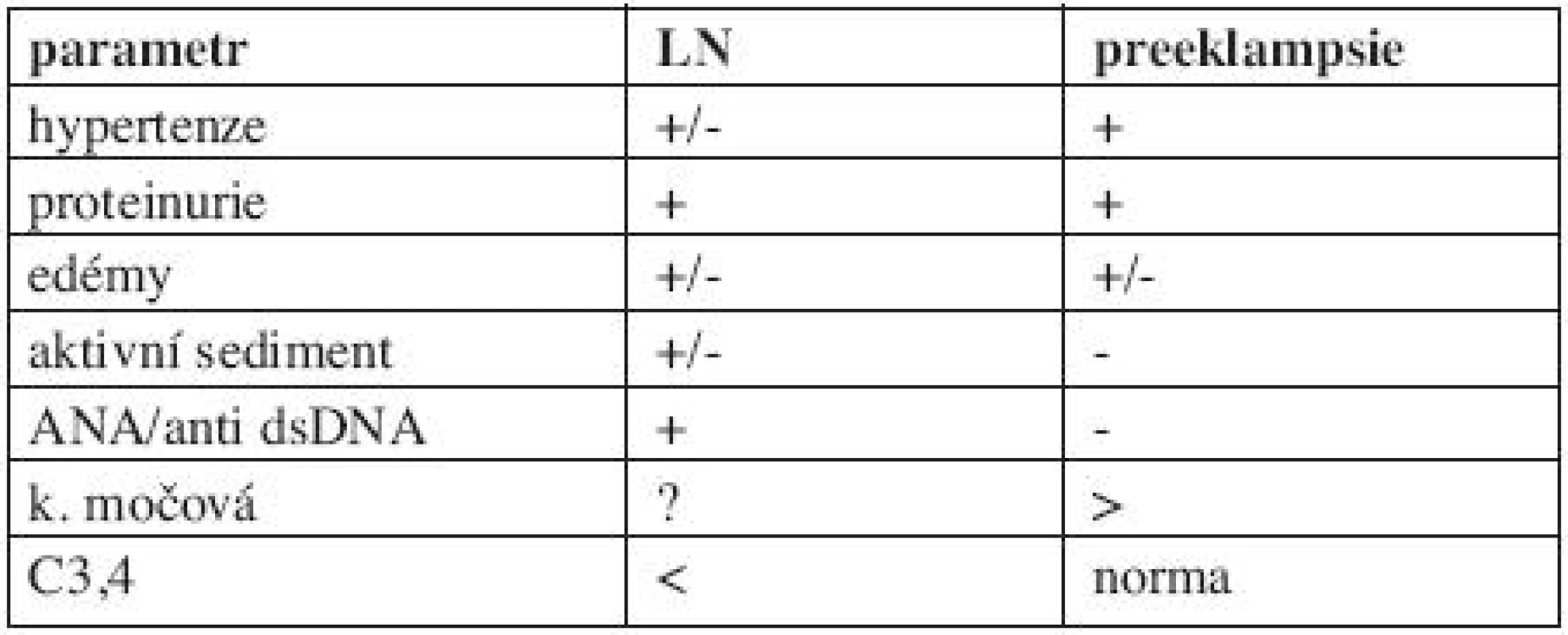
Imunosupresivní terapie gravidních žen
Další důležitou oblastí je terapie matky v průběhu gravidity. V léčbě SLE jsou běžně užívány léky, které jsou řazeny dle FDA (Food and Drug Administration, USA) do skupin s vyšším rizikem pro graviditu (11). Přesto literární údaje neuvádějí vyšší výskyt kongenitálních malformací, než je běžné ve zdravé populaci. Hlavním a relativně bezpečným lékem v graviditě jsou nepochybně glukokortikoidy, a to zejména v nižších dávkách. Jejich dávku je díky jejich rychlému nástupu účinků možno operativně dle stavu nemocné upravovat. Ani eventuální přechodné zvýšení jejich dávky v případě nutnosti nepředstavuje vysoké riziko pro plod (11, 12, 13). Mezi relativně bezpečné léky patří nesteroidní antirevmatika s krátkým poločasem podávaná maximálně do 32. týdne těhotenství (15, 16) a antimalarika, i když názory na jejich aplikaci v graviditě nejsou jednoznačné (17, 18). Je však zvažován i možný protektivní vliv hydroxychlorochinu u anti Ro a anti La pozitivních matek na vývoj eventuálního kongenitálního AV bloku (8). Vzhledem k řadě dalších velmi pozitivních vlivů antiamalarik a jejich relativní bezpečnosti někteří autoři ponechání či přímo nasazení těchto léků v graviditě spíše doporučují. Přísně kontraindikována jsou cytostatika, tedy cyklofosfamid a metotrexát (19, 20). Naopak azatioprin a cyklosporin A lze za určitých vážných situací v graviditě použít. Jedná se o závažné orgánové formy vzplanutí SLE, které ohrožují život matky, nejčastěji o lupusovou nefritidu. Někteří autoři i doporučují u těch pacientek, které otěhotní při léčbě azatioprinem, tuto terapii ponechat (13, 14).
Nemocné s orgánovou manifestací SLE bývají často léčeny právě kombinovanou imunosupresivní léčbou s cytotoxickými léky, jež jsou pro graviditu zásadně kontraindikovány. Vysazení takovéto léčby není ovšem vždy možné a bezpečné, a tudíž je nutno u každé nemocné se SLE dle možností graviditu řádně naplánovat na vhodnou dobu, kdy je nemoc v remisi nebo je alespoň stabilizovaná při takové terapii, jež je pro graviditu bezpečná (13). Vysoce riziková je z hlediska gravidity zejména terapie cyklofosfamidem, u které je nutno mimo jiné před koncepcí preventivně zajistit ochranu vajíčka, aby nevznikla ireverzibilní infertilita (20). V tomto směru byla zvažována možnost využití hormonální antikoncepce, ale její přínos stran prevence vzniku infertility nebyl jednoznačně prokázán. Efektivní formou zajišťující možnost budoucí gravidity je zmrazení embrya.
Hormonální terapie moderními preparáty je u žen se SLE nyní považována za bezpečnou, ovšem pouze v případě, že nejsou přítomny obecné rizikové faktory vzniku tromboembolie. Toto platí pro nemocné s anamnézou závažné trombózy a zejména pak pro pacientky s antifosfolipidovým syndromem (APS). Většina odborníků se přiklání k názoru, že pakliže žena se závažným systémovým autoimunitním onemocnění pojiva již další graviditu nechce, je nejvhodnější provést sterilizaci.
Léčba antifosfolipidového syndromu v graviditě
Antiagregační a antikoagulační terapie je v graviditě aplikována zejména u žen s APS jako prevence další tromboembolické příhody. Přístup k terapii jednotlivých pacientek se liší podle charakteru manifestace APS (21). V případě významné pozitivity antifosfolipidových protilátek bez proběhlé trombotické příhody je doporučována terapie malou dávkou aspirinu, která by měla být započata ihned po koncepci, resp. po zjištění gravidity, a měla by být ukončena 2–5 týdnů před plánovaným termínem porodu.
Ženám s pozitivitou aPL a anamnézou tromboembolie nebo ztráty plodu je doporučována terapie kombinací nízkomolekulárního heparinu (LMWH) a nízkých dávek aspirinu, přičemž přístup k léčbě pacientek s anamnézou TEN nebo ztráty plodu není zcela identický. LMWH nebo heparin u pacientek s anamnézou TEN by měl být podáván v terapeutických dávkách (22). Před porodem je tato terapie přerušena a za 6–8 hodin po porodu by měla být u takovýchto pacientek antikoagulační léčba opětně obnovena. Ženám s pozitivitou aPL bez klinických projevů tromboembolie bývá doporučována terapie nízkou dávkou aspirinu, někdy ale nebývá indikována žádná profylaktická terapie (23). Zvláštní případ tvoří ženy s pozitivitou aPL, které absolvovaly umělé oplodnění. V tomto případě panuje značná nejednotnost názorů a někdy jsou aplikovány nízké dávky aspirinu (24).
Závěr
Přes nepochybně vyšší rizika gravidity u žen se SLE jsou v posledních letech výsledky těhotenství u SLE velmi slibné a naprostá většina gravidit je ukončena porodem zdravého novorozence, což ale platí pouze v případech, že je nemocná před koncepcí v plné nebo aspoň částečné remisi a bez přítomnosti zásadních rizikových faktorů. Bezpečná gravidita u žen se SLE je tudíž možná, ovšem za předpokladu splnění některých důležitých podmínek. Gravidita by měla být vždy plánovaná s prekoncepčním zhodnocením rizika pro matku i dítě (13). Nemocná by měla absolvovat genetické vyšetření, v době aplikace rizikových léků je nutno dodržovat důslednou antikoncepci a rizikové léky musí být před koncepcí včas vysazeny.
Předchozí komplikovaná těhotenství, anamnéza spontánních nebo zamlklých potratů, postižení ledvin, hypertenze před graviditou, přítomnost antifosfolipidových protilátek a léčba vysokými dávkami imunosupresiv představují pro těhotenství hlavní rizikové faktory. Gravidita by neměla být doporučena v případě přítomnosti závažné plicní hypertenze, známek srdečního selhávání, závažného restrikčního postižení plic, dále v přítomnosti známek renálního selhávání a v neposlední řadě v případě vysoké aktivity SLE v době koncepce. Je nutno preventivně sledovat eventuální nežádoucí účinky léků na gravidní ženu i na plod a ženu je nutno systematicky sledovat za spolupráce příslušných specialistů, tedy revmatologa a gynekologa, resp. porodníka, s cílem zajistit pacientkám úspěšný průběh těhotenství a porod zdravého dítěte. Porod by měl probíhat v řádném termínu a měl by být zvýšeně sledován. Dále by měla být zajištěna specializovaná péče neonatologa pro případ poporodních komplikací.
V péči o ženy se systémovými chorobami existuje mnoholetá spolupráce Revmatologického ústavu v Praze a Ústavu péče o matku a dítě v Praze. Jen v průběhu posledních tří let bylo sledováno 54 gravidních pacientek se SLE s různě dlouhým trváním a aktivitou onemocnění. Byla zajištěna systematická a koordinovaná péče revmatologická, porodnická a neonatologická, gravidity byly většinou dopředu naplánované, bez rizikové terapie před otěhotněním, v době koncepce a v celém průběhu těhotenství. Výsledky v naší sledované skupině jsou velmi dobré a naprostá většina pacientek porodila zdravé dítě. Podrobné výsledky této naší práce budeme prezentovat v samostatné publikaci.
Podporováno Výzkumnými záměry MZ ČR NO: 000 000 23728.
MUDr. Dana Tegzová
Revmatologický ústav
Na Slupi 4
128 50 Praha 2
Sources
1. Gordon C. Long-term complications of systemic lupus erythematosus. Rheumatology 2002; 41 : 1095-1100
2. Urowitz MB, Gladman DD. How to improve morbidity and mortality in systemic lupus erythematosus. Rheumatology 2000; 39 : 238-244.
3. Manger K, Manger B, Repp R, et al. Definition of risk factors for death, and stage renal disease, and thromboembolic events in a monocentric cohort of 338 patients with systemic lupus erythematosus. Ann Rheum Dis 2002; 61 : 1065-1070.
4. Ostensen M, von Esebeck M, Viliger PM: Therapy with immunosupressive drugs and biological agents and use of contraception in patients with rheumatis disease. J Rheumatol 2007; Jun 34(6): 1266-9.
5. Lockshin MD, Reinitz E, Druzin ML, et al. lupus pregnancy. Case control prospective study demonstrating absence of lupus exacerbation during or after pregnancy. AmJ Med; 1984 Nov, 77(5): 893-8.
6. Oviasu E, Hicks J, Cameron JS. The outcome of pregnancy in women with lupus nephritis. Lupus 1991; Nov 1(1):19-25.
7. Julkunen H, Raaja R, Wallgren E, et al. Isolated congenital heart block: fetal and infant outcome and familial incidence of heart block. Obstet Gynecol 1993; Jul, 82(1): 11-16.
8. Izmirly PM, Kim MY, Lianos C, et al. Evaluation of the risk of anti SSA/Ro-SSB/La antibody-associated cardiac manifestations of neonatal lupus in fetuses of mothers with systemic lupus erythematosus exposed to hydroxychloroquine. Ann Rheum Dis 2010; Oct 69(10): 1827-30. Epub 2010 May 6.
9. Breur JM, Visser GH, Kruize AA, et al. Treatment of heart block with maternal steroid therapy: case report and review of the literature. Ultrasound Obstet Gynecol 2004; Sep, 24(4): 467-72.
10. Blanford AT, Murphy BP. In vitro metabolism of prednisolone, dexamethasone, betamethasone and cortisol by the human placenta. Am J Obstet Gynecol 1977; 27 : 264-268.
11. Ostensen M, Lockshin M, Doria A. Update on safety during pregnancy of biological agents and some immunosupressive anti-rheumatic drugs. Rheumatology (Oxford), 2008; jun 47 Suppl 3 : 28-31.
12. Janssen NM, Genta MS. The effects of immunosuppressive and anti-inflammatory medications on fertility, pregnancy and lactation. Arch Intern Med vol. 160 : 610-619.
13. Dostál C, Vencovský J. Těhotenství a SLE. Systémový lupus erytematodes. Medprint; 1997 : 147-153.
14. Briggs GG,Freeman RK, Yaffe SJ. Drugs in pregnancy and lactation. 5thed. Baltimore. MD: Williams and Wilkins, 1998.
15. Ostensen M. Safety on nonsteroidal antinflammatory drugs during pregnancy and lactation. Immunopharmacology 1996; 4 : 31-41.
16. Ostensen M, Ostensen H. Safety of nonsteroidal antiinflammatory drugs in pregnant patients with rheumatc diseases. J Rheumatol 1996; 3 : 1045-1049.
17. Parke A, West B. Hydroxychloroquine in pregnant patients with systemic lupus erythematosus. J Rheumatol 1996; 23 : 1715-1718.
18. Buchanan NMM, Toubi E, Khamasta MA, et al. Hydroxychloroquine and lupus pregnancy review of a series of 36 cases. Ann Rheum Dis 1996; 55 : 486-488.
19. Donnenfeld AE, Pastiszak A, Noah JS, et al. Methotrexate exposure prior and during pregnancy. Teratology 1994; 49 : 79-81.
20. Slater CA, Liang MH, McCune JW, et al. Preserving ovarian function in patients receiving cyclophosphamide. Lupus 1999; 8 : 3-10.
21. Caritis S, Sibai B, Hauth J, et al. Low aspirin to prevent preeclampsia in women at high risk. N Engl J Med 1998; 338 : 701-705.
22. Ginsberg JS, Kowalchuk G, Hirsh J, et al. Heparin therapy during pregnancy: risk to the fetus ad mother. Arch Intern Med 1989; 149 : 2233-2236.
23. Melissari E, Parker CJ, Wilson NV, et al. Use low molecular weight heparin in pregnancy. Thromb Haemost 1992, 68 : 652-656.
24. Hunt BJ, Doughty H, Majumdar G, et al. Thromboprophylaxis with low molecular weight heparin in high-risk pregnancy. Thrombo Haemost 1997; 77 : 39-43.
Labels
Dermatology & STDs Paediatric rheumatology Rheumatology
Article was published inCzech Rheumatology

2011 Issue 1
Most read in this issue- Sine syndromes in clinical picture of dermatomyositis
- Occurence of autoimmune diseases following the biological treatment
- The course of pregnancy in SLE
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

