-
Medical journals
- Career
HLA-Cw*0602 jako predispoziční alela rozvoje psoriatické artritidy
Authors: M. Fojtíková 1; J. Štolfa 1; L. Šedová 1; J. Gatterová 1; J. Lippert 3; M. Černá 2
Authors‘ workplace: Revmatologický ústav, Praha, 2Institut biochemie, buněčné a molekulární biologie, 3. LF UK Praha, 3Dermatovenerologická klinika FNKV a 3. LF UK, Praha 1
Published in: Čes. Revmatol., 17, 2009, No. 2, p. 68-73.
Category: Original Papers
Overview
Úvod:
Psoriatická artritida (PsA) je onemocnění ze skupiny spondylartritid. Je definována jako artritida, zpravidla séronegativní, provázející psoriázu. Etiopatogeneze onemocnění není zcela jasná, podílejí se na ní kromě zevních faktorů i genetické vlivy. Nejvýznamnější genetická predispozice pro rozvoj PsA byla lokalizována v rámci krátkého raménka 6. chromozomu v oblasti hlavního histokompatibilního systému (PSORS 1).Cíl studie:
Identifikovat alely HLA-Cw, genu HLA I. třídy, spojené s rizikem vývoje PsA, s typem psoriázy a s vývojem rentgenových erozí.Metodologie:
Bylo vyšetřeno celkem 102 nemocných s PsA, rozdělených dle a) výskytu erozí při rtg vyšetření (erozivní/neerozivní) a b) dle věku při manifestaci psoriázy (psoriáza I. typu s manifestací do 40 let věku/ psoriáza II. typu s manifestací kožního syndromu po 40 letech věku). Pro genotypizaci byla požita metoda PCR-SSP. Statistická analýza byla provedena pomocí χ2 a Fischerova exaktního testu, pro mnohočetné porovnání byla použita Bonferroniho korekce.Výsledky:
1. Zjistili jsme statisticky významně zvýšenou frekvenci alel HLA-Cw*06 ve skupině pacientů s PsA (35,3 %) ve porovnání se zdravou českou populací (16,2 %), Pc < 0,05 (OR 2,43, CI 95%: 1,32-4,76). Nejčastější HLA-Cw*06 alelou zjištěnou u obou skupin byla HLA-Cw*0602, která je u pacientů s psoriázou spojena s rozvojem PsA (frekvence 22,5 %) na rozdíl od zdravých osob (frekvence 10,1%), Pc < 0,05 (OR 2,74, CI 95%: 1,20-6,25). 2. HLA-Cw*0602 alela je statisticky významně spojená s rozvojem PsA u nemocných s psoriázou I. typu (frekvence alely je 28,0%) v porovnání se zdravými jedinci; Pc < 0,05; OR 3,12; CI 95 % 1,38–7,14. U skupiny PsA spojených s psoriázou II. typu byla frekvence této alely obdobná jako u zdravých. Nenašli jsme žádný významný rozdíl v distribuci alel HLA-Cw v závislosti na nálezu erozí při rtg vyšetření.Závěr:
HLA-Cw*0602 zvyšuje pravděpodobnost vývoje psoriatické artritidy, zejména u pacientů s manifestací kožního syndromu před 40. rokem věku. Tato alela není asociována s vývojem rentgenových erozí. Nenašli jsme jiné statisticky významné rozdíly v distribuci ostatních alel HLA-Cw u pacientů s psoriatickou artritidou.Klíčová slova:
HLA-Cw, psoriatická artritida, genetická predispoziceÚvod
Psoriatická artritida (PsA) je heterogenní chronické onemocnění, které je charakterizováno artritidou, zpravidla séronegativní, provázející psoriázu (1). Artritida postihuje 7–42 % pacientů s psoriázou (psoriasis vulgaris) (2, 3, 4). Vztah mezi rozvojem kožního a kloubního postižení není jednoznačný. PsA se zpravidla objevuje během kožní manifestace psoriázy (průměrně po 10 letech jejího trvání), může však dojít k rozvoji artritidy před nebo souběžně se vznikem kožních projevů nemoci (5). Souvislost mezi tíží kloubního a kožního postižení není úplně zřejmá, mnohdy těžký průběh PsA doprovází minimální kožní změny anebo klinické zhoršení kloubního nálezu nekoresponduje s relapsem kožním a obráceně (5, 6). PsA je závažné kloubní onemocnění, až u 20 % nemocných dochází k těžkým deformitám a erozivní typ artritidy může vést k vyšší mortalitě nemocných ve srovnání se zdravou populací (3, 7).
Příčiny vzniku psoriatické artritidy nejsou dosud zcela objasněny. K rozvoji onemocnění přispívají vedle genetické vnímavosti i faktory zevního prostředí, jako jsou infekce, úrazy a stres. Pro vliv genetické predispozice v etiopatogenezi kožní psoriázy svědčí vysoká konkordance onemocnění u monozygotních dvojčat (až 65–70 %) na rozdíl od dvojčat dizygotních (15–20 %), navíc, u dětí obou nemocných rodičů je riziko rozvoje psoriázy 50x, kdežto u jednoho rodiče jen 10–20x vyšší než v běžné populaci. U psoriatické artritidy nejsou prozatím data sledující výskyt choroby u dvojčat, precizní práce Molla a Wrighta však popisuje až 55x vyšší riziko vzniku artritidy u prvostupňových příbuzných v porovnání se zdravou populací a podporuje tak vysoký podíl genetických faktorů v rozvoji PsA (8). PsA je jistě polygenní onemocnění, neprokazuje znaky klasické mendelovské dědičnosti a stále častěji se vynořují data zabývající se genomovým imprintingem preferující otcovský chromozom v patogenezi PsA.
V genetice psoriázy bylo prozatím identifikováno devět rizikových lokalizací (PSORS1 -9), avšak pouze jedna z nich, PSORS 1 je spojena s rozvojem PsA (tab. 1) (9, 10, 11). Samostatnou oblastí asociovanou s PsA je PSORAS1, která obsahuje gen NOD2/CARD15, kódující intracelulární receptor fagocytujících buněk zasahující do imunitní odpovědi na bakteriální infekci. Zajímavé je, že recentní rodinná genetická studie z Islandu prokázala vliv paternálního imprintingu této oblasti v rozvoji PsA (11). PSORS 1 se nachází na krátkém raménku 6. chromozomu, v oblasti vysoce polymorfních genů hlavního histokompatibilního systému (MHC, též human leukocyte antigen – HLA) a MHC – asociovaných genů (MICA), ale i např. genu TNF alfa. HLA Cw*0602 byla identifikována jako alela přímo zasahující do rozvoje psoriázy (12, 13). Kupříkladu disponuje jedince k poruše rozpoznaní keratinu jako vlastního antigenu a vede tak k patologické aktivaci T lymfocytů. Navíc produkt HLA Cw*0602 alely slouží jako ligand pro receptory NK buněk (např. KIR) a patrně ovlivňuje jejich funkci, což může vést k širší poruše imunoregulace (14). HLA Cw*0602 alela je spojena s nižším věkem manifestace psoriázy (psoriáza I. typu – tj., manifestace onemocnění do 40 let věku) ve srovnání s psoriázou II. typu (rozvoj kožních symptomů u lidí starších 40 let). Psoriatická artritida je rovněž asociována s HLA Cw*06, avšak méně výrazně než samotná psoriáza (15). Některé studie v různých populacích dokonce neprokazují souvislost této alely s PsA vůbec (2, 16) Doposud nebyla zjištěna souvislost mezi výskytem této rizikové alely a typem PsA (oligoartikulární, polyartikulární či spondylartritidy) (17).
Table 1. Predispoziční genetické oblasti pro rozvoj psoriázy (PSORS 1-9) a psoriatické artritidy (PSORS 1 a PSORAS). 
V naší práci jsme sledovali výskyt alel HLA I. třídy – HLA Cw v české populaci zdravých lidí a nemocných s psoriatickou artritidou. Analyzovali jsme dispozici k rozvoji erozivní formy PsA a rozdíl v genetické predispozici mezi nemocnými s PsA a s psoriázou I. a II. typu.
Pacienti a metody
Pacienti
Bylo vyšetřeno celkem 102 nemocných s psoriatickou artritidou, diagnóza byla stanovena pomocí kritérií dle Molla a Wrighta (1). Skupina nemocných byla složena z 52 (51 %) žen a 50 (49 %) mužů, průměrný věk 53,4 ± 2,6 let. Všichni pacienti byli léčeni v Revmatologickém ústavu v Praze. Do studie byli zapojeni jen nemocní s postižením periferních kloubů, všichni nemocní byli RF negativní. Všem bylo provedeno rtg k vyšetření rukou a nohou, eroze byly nalezeny u 61,5 % nemocných. Ve studii bylo 69 (67,6 %) pacientů s psoriázou I. typu a 29 (28,5 %) pacientů s psoriázou II. typu, 4 (3,9 %) nemocní neměli v době vyšetření psoriázu, klinický a rentgenový obraz však odpovídal psoriatické artritidě.
V kontrolní skupině bylo vyšetřeno 99 zdravých jedinců (studenti medicíny, dárci krve). Skupina čítala 33 (33,4 %) žen a 66 (66,6 %) mužů, průměrný věk 39,3 ± 3,1 let.
Všichni vyšetření – jak nemocní, tak zdraví jedinci byli české národnosti. Protokol studie byl schválen Etickou komisí 3. lékařské fakulty Univerzity Karlovy v Praze.
Metody
Izolace DNA: DNA byla izolována z periferních leukocytů plné krve pomocí komerčního kitu (QiaAmp DNA Maxi Kit spin columns, QIAGEN GmbH, Hilde, Německo). DNA byla rozředěna na cílovou koncentraci 30 ng/μl.
HLA-C genotypizace: Byla provedena za použití polymerázové řetězové reakce (PCR) se sekvenčně specifickými primery (PCR-SSP). Pro genotypizaci HLA-C oblasti byl použit kit Olerup SSPTM HLA-C typing a HLA-Cw*06 subtyping kit (Genovision, Oslo, Norsko). Příprava PCR reakční směsi a parametry pro PCR reakci byly nastaveny dle doporučení.
PCR produkty byly vizualizovány pomocí UV světla na 2% agarózovém gelu s ethidium bromidem. Identifikace jednotlivých alel byla na základě pozitivní specifické amplifikace.
Statistická analýza
Byla provedena pomocí Epi Info software (Version 3.3 October 2004, Atlanta, Georgia). Statistické rozdíly v distribuci alel byly analyzovány pomocí χ2 a Fischerova exaktního testu. Jako statisticky signifikantní byla definována P hodnota nižší než 0,05 po použití Bonferroniho korekce pro mnohočetné porovnání. Síla zjištěné asociace byla určena výpočtem odds ratio (OR) dle Wolfovy metody s Holdanovou korekcí.
Výsledky
Vyšetřili jsme 102 pacientů s PsA a 99 zdravých kontrolních jedinců.
1. Detekce alel HLA-Cw u nemocných s PsA a kontrolní skupiny (viz tab. 2)
Table 2. Frekvence alel HLA - Cw u nemocných s psoriatickou artritidou (PsA) a zdravými jedinci v České republice 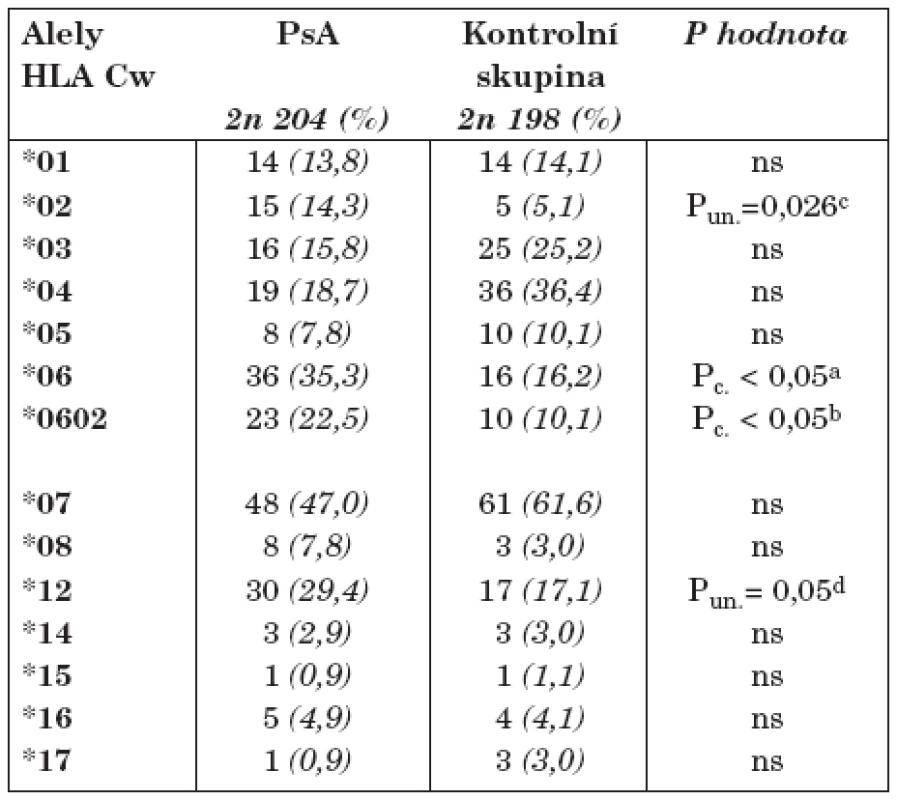
a) Pc.<0,05; OR 2,43; CI 95% 1,32-4,76 b) Pc <0,05; OR 2,74; CI 95% 1,20-6,25 c) Pc. = 0,364 a d) Pc. = 0,700; ns Pun.- nekorigovaná P hodnota, Pc.- korigovaná P hodnota pomocí Bonferroniho korekce, ns - statisticky nevýznamné Zjistili jsme statisticky významnou asociaci mezi HLA-Cw*06 alelami a PsA, které se u této skupiny vyskytly u 18 jedinců (frekvence alel 35,3 %), na rozdíl od 8 nositelů HLA-Cw*06 u skupiny kontrolní (frekvence16,2%), Pc < 0,05 (OR 2,43, CI 95 %: 1,32–4,76). Nejčastější alelou zjištěnou v obou skupinách byla HLA-Cw*0602, mezi nemocnými s PsA bylo detekováno celkem 11 nositelů této alely (frekvence 22,5%), u zdravých pouze 4 (s frekvencí 10,1 %), což je rovněž statisticky významný nález Pc < 0,05 (OR 2,74, CI 95 %: 1,20–6,25).
Frekvence HLA-Cw*02 alely byla 14,3% u nemocných s PsA oproti 5,1% u zdravých jedinců, tento nález je ale při Bonferroniho korekci statisticky nevýznamný. Statisticky nevýznamný je po Bonferroniho korekci i nález vyšší frekvence alely HLA-Cw*12 u PsA (29,4%) oproti zdravým jedincům (17,1 %).
Nezjistili jsme žádný rozdíl v distribuci genotypů HLA-Cw mezi oběma skupinami, přičemž vždy jeden HLA-Cw*0602 homozygot byl nalezen u obou skupin.
2. Výskyt alel HLA-Cw lokusu u jednotlivých klinických typů PsA (viz tab. 3)
Table 3. Frekvence jednotlivých alel HLA - Cw mezi nemocnými s PsA vzhledem k jejich klinické charakteristice. 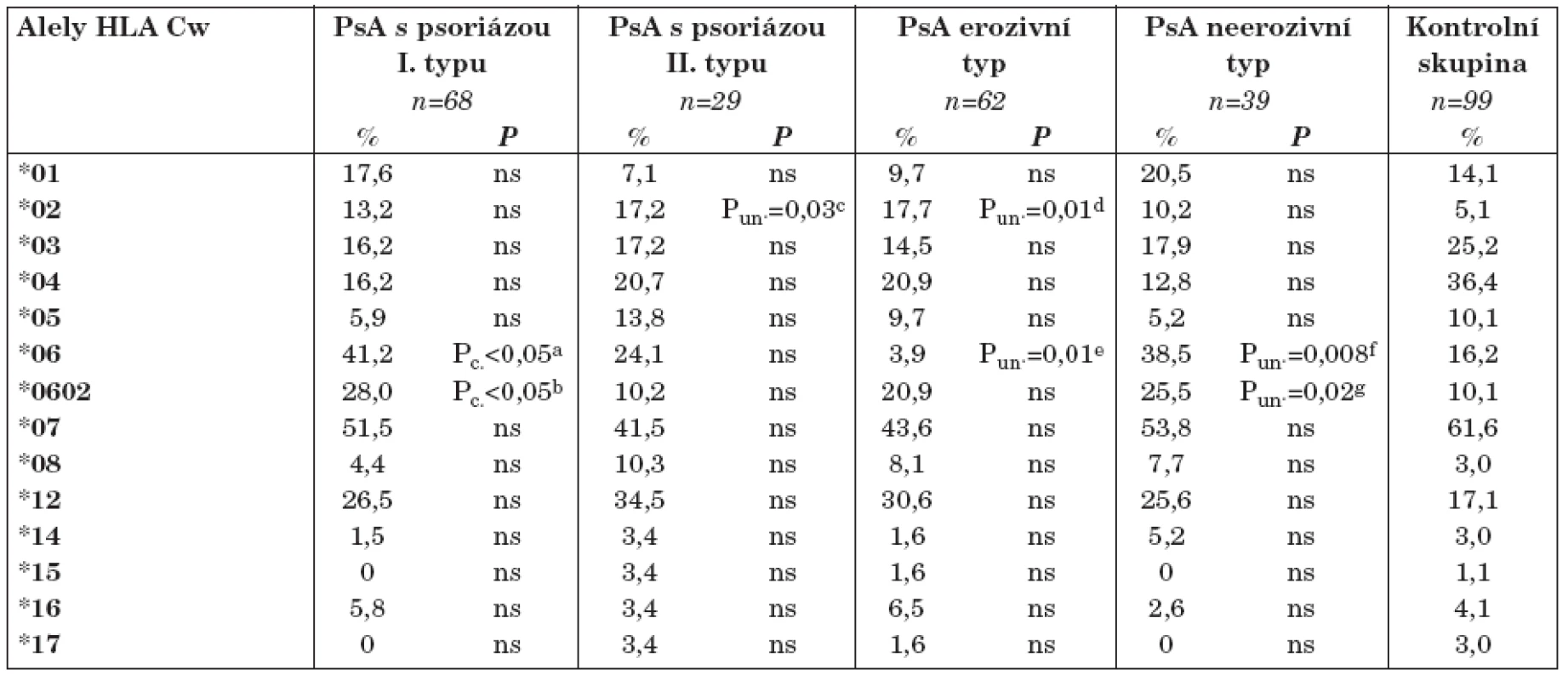
a) OR 3,03; CI 95% 1,53-5,88 b) OR 3,12; CI 95% 1,38-7,14 c) Pc.=0,420 d) Pc.=0,140 e) Pc.=0,140 f) Pc.=0,112 g) Pc.=0,280 ns=statisticky nevýznamné Pc.= P hodnota pomocí Bonferroniho korekce; Pun.= P hodnota bez korekce pro mnohočetné porovnání P hodnota byla stanovena porovnáním mezi jednotlivými skupinami PsA versus kontrolní skupině Nejprve jsme zjišťovali rozdíl mezi zastoupením alel HLA-Cw lokusu u nemocných s časným a pozdním rozvojem kožního syndromu, tj. psoriázou I. a II. typu.
U nemocných PsA s psoriázou I. typu jsme zjistili významný rozdíl ve frekvencích HLA-Cw*06 alel oproti zdravým osobám, a to 41,2% versus 16,2%, Pc < 0,05; OR 3,03; CI 95 % 1,53-5,88. Nejčastěji jsme detekovali HLA-Cw*0602 alelu, která se vyskytla u 19 těchto nemocných (frekvence alely je 28,0 %), což je nález statisticky významný při porovnání se zdravými osobami; Pc < 0,05; OR 3,12; CI 95 % 1,38–7,14.
Naopak, frekvence alely HLA-Cw*0602 byla obdobná u nemocných PsA spojených s psoriázou II. typu jako u zdravých osob, 10,2 % versus 10,1%. V této skupině jsme zjistili vyšší frekvenci alely HLA-Cw*02, a to 17,2 %, na rozdíl od zdravých, kde se tato alela vyskytla jen u 5,1 % jedinců. Tento nález je však po korekci pro mnohočetné porovnání statisticky nevýznamný.
Dále jsme sledovali vliv HLA-Cw alel na vývoj erozí dle rtg vyšetření. U obou typů artritidy (erozivní, resp. neerozivní) jsme detekovali zvýšenou frekvenci HLA-Cw*06 alel oproti zdravým jedincům (33,9 % u PsA erozivní a 38,5 % u PsA ne - erozivní versus 16,2 % u zdravých osob). Avšak po korekcích pro mnohočetné porovnání si ani jeden z těchto nálezů nezachoval statistickou významnost. Zajímavá je vyšší frekvence HLA-Cw*02 alely u nemocných s PsA erozivní (17,7 %) oproti kontrolní skupině (5,1 %) či PsA neerozivní (10,2 %). Tyto nálezy jsou ale po korekci pro mnohočetné porovnání statisticky nevýznamné.
Diskuse
Naše studie zabývající se genetickou predispozicí rozvoje psoriatické artritidy je první studií na úrovní genetických polymorfismů v oblasti lokality PSORS 1, konkrétně hlavního histokompatibilního systému I. třídy, HLA-Cw oblasti, u české populace. HLA komplex I. třídy je exprimován na všech jaderných buňkách organismu a podílí se na imunitní odpovědi prezentací antigenního peptidu T-lymfocytům. Vysoce polymorfní geny kódující tyto povrchové molekuly mohou tudíž ovlivnit imunitní reakci a vést k rozvoji autoimunitních chorob.
Zjistili jsme, že výskyt alel HLA-Cw je rozdílný mezi nemocnými s psoriatickou artritidou a zdravou českou populací. Frekvence alel HLA–Cw u české populace jsou obdobné jako u jiných evropských národů (18). V naší studii jsme zaznamenali zvýšenou frekvenci HLA-Cw*06 alel (35,3 %) a rizikové alely HLA-Cw*0602 (22,5 %) u pacientů s PsA při porovnání se zdravými osobami. Oba tyto rozdíly jsou statisticky významné (Pc< 0,05). HLA-Cw*0602 alela se vyskytuje v průměru u 50 % nemocných s kožní formou psoriázy ve studiích v různých populacích (13, 19, 20). Naopak, u PsA bývá frekvence HLA-Cw*06 alel a potažmo HLA-Cw*0602 zpravidla nižší – pohybuje se v rozmezí 17 %, v kanadské studii (21), 40 % z recentní práce z UK (15), až po 58 % ze sousedního Polska, kde však chybí údaj o rozlišení jednotlivých HLA-Cw*06 alel (18). Z druhé strany, Grubić et al. v chorvatské populaci asociaci mezi HLA-Cw*06 a PsA neprokázal (16). Naše práce podporuje roli HLA-Cw*0602 alely v patogenezi PsA a udává frekvenci alely u středoevropské české populace.
Naše sledování přináší další důležitý poznatek, a to, že alela HLA-Cw*0602 je významně spojena s PsA s psoriázou I. typu (frekvence 28 %) Pc< 0,05, přičemž její frekvence u PsA s psoriázou II. typu je obdobná jako u zdravých osob (viz tab. 3). HLA-Cw*0602 je popsána jako predispoziční marker pro časnou manifestaci psoriázy a je spojena i s jejím těžším průběhem (18, 19, 20). Otázkou zůstává, zda je asociace HLA-Cw*0602 u psoriázy I. typu a PsA je sekundární, či zda se HLA-Cw*0602 podílí na rozvoji artritidy u této skupiny nemocných (patogenetickým momentem by mohla být snížená aktivace NK buněk). Zastoupení HLA-Cw*06 alel u obou typů periferní artritidy – erozivní i neerozivní je obdobné. HLA-Cw*0602 tak ovlivňuje spíše vznik artritidy než její další průběh. Naše pozorování podporuje a doplňuje zjištění v již publikované práci, kde nebyl shledán rozdíl v distribuci HLA-Cw*06 alel mezi jednotlivými klinickými typy PsA, a to periferní artritidou a spondylartritidou (22, 23).
Určení genetické predispozice pro rozvoj PsA tak stále zůstává otevřeno. Naše práce však vede k důležitým závěrům pro další genetické studie této choroby: nezbytnost rozdělení PsA na 2 skupiny v závislosti na věku manifestace kožního syndromu. Věk manifestace psoriázy ovlivňují genetické faktory spolu se zevními vlivy. Na věku závislá genetická predispozice byla popsána i u jiných autoimunitních chorob, například u auto-imunitního diabetu manifestovaného v dětství a v dospělosti (24, 25, 26). Dalším důležitým závěrem pro širší genetické studie je nezbytnost doplnit skupinu nemocných s psoriázou bez artritidy. To nám umožní rozlišit rizikové geny zasahující do patogeneze buď artritidy, nebo kožní psoriázy a zjistit rizikové genetické faktory pro rozvoj artritidy u psoriázy.
Závěr
Závěrem lze shrnout, že naše práce měla za cíl provést imunogenetickou studii u zdravých osob a u nemocných s psoriatickou artritidou. Z našeho pozorování můžeme říct, že oblast HLA I. třídy, konkrétně alela HLA-Cw*0602, je spojena s rozvojem psoriatické artritidy, a to zejména spojené s psoriázou I. typu, avšak neovlivňuje její rentgenologický typ. Cílem našich snah je najít vnímavé jedince pro rozvoj artritidy u psoriázy a v budoucnu je adekvátně léčit, k tomu může přispět analýza dalších polymorfních genů této lokality (TNF alfa, corneodesmosin, MICA) spolu s ozřejměním vzájemných genových vazeb a rizikových haplotypů pro vznik PsA.
Poděkování: Tato práce vznikla za podpory Výzkumných
záměrů MZ ČR č. 000 000 23728
MUDr. M. Fojtíková
Revmatologický ústav
Na Slupi 4
128 50 Praha 2
e-mail: fojtikova@revma.cz
Sources
1. Moll JM, Wright V. Psoriatic arthritis. Seminars in arthritis and rheumatism 1973; 3 : 55.
2. Alenius GM, Jidell E, Nordmark L, Dahlqvist SR. Disease manifestation and HLA antigens in psoriatic arthritis in Northern Sweden. Clinical Rheumatology 2002; 21 : 357.
3. Gladman DD, Antoni C, Mease P, Clegg DO, Nash P. Psoriatic arthritis: epidemiology, clinical features, course, and outcome. Annals of the rheumatic diseases 2005; 64 (Suppl. II), 14.
4. Shbeeb M, Gramoto KM, Gibbon LE, OęFallon WM, Gabriel SE. The epidemiology of psoriatic rthritis in Omlsted Country, Minnesota, USA, 1982-1991. J Rheumatology 2000; 27 : 1247.
5. Elkayam O, Ophir J, Yaron M, Casi D. Psoriatic arthritis: interrelationships between skin and joint manifestations related to onset, course and distribution. Clinical rheumatology 2000; 19 : 301.
6. Sibilia J. Psoriasis: skin and joints, same fight? Journal of the European Academy of Dermatology and Venerology 2006; 20 (Suppl. 2): 56.
7. Gladman DD, Farewell VT, Wong K, Husted J. Mortality studies in psoriatic arthritis: Results from a single center. II. Prognostic indicators for death. Arthritis Rheumatism 1998; 41 : 1103.
8. Moll JM. and Wright V. Familial occurrence of psoriatic arthritis. Annals of Rheumatic Diseases 1973; 32 : 181.
9. Valdimarsson H. The genetic basis of psoriasis. Clinics in Dermatology 2007; 25 : 563.
10. Nair RP, Stuart P, Henseler T. Localization of psoriasis-susceptibility locus PSORS1 to a 60-kb interval telomeric to HLA-C. American Journal of Human Genetics 2000; 66, 1833.
11. Karason A, Gudjonsson JE, Upmanyu R, Antonsdottir AA, Hauksson VB, Runasdottir EH, Jonsson HH, Gudbjartsson DF, Frigge ML, KongA, Stefansson, K, Valdimarsson, H, Gulcher JR. A susceptibility gene for psoriatic arthritis maps to chromosome 16p: evidence for imprinting. American Journal of Human Genetics 2003; 72 : 125.
12. Nair RP, Stuart PE, Nistor I, Hiremagalore R, Chia NV, Jenisch S, Weichenthal M, Abecasis GR, Lim HW, Christophers E, Voorhees JJ, Elder JT. Sequence and haplotype analysis supports HLA-C as the psoriasis susceptibility 1 gene. American Journal of Human Genetics 2006; 78 : 827.
13. Trembath RC, Clough RL, Rosbotham JL, Jones AB, Camp RDR, Frodsham A, Browne J, Barber R, Terwilliger J, Lathrop GM, Barker JNWN. Identification of a major susceptibility locus on chromosome 6p and evidence for further disease loci revealed by a two stage genome-wide search in psoriasis. Human Molecular Genetics 1997; 6 : 813.
14. Martin MP, Nelson G, Lee JH, Pellett F, Gao X, Wade J, Wilson MJ, Trowsdal J, Gladman D, Carrington M. Cutting Edge: Susceptibility to Psoriatic Arthritis: Influence of Activating Killer Ig-Like Receptor Genes in the Absence of Specific HLA-C Alleles. The Journal of Imunology 2002; 169 : 2818.
15. Ho YPCP, Barton A, Worthington J, Plant D, Griffiths CHEM, Young HS, Bradburn P, Thomson W, Silman AJ, Bruce IN. Investigating the role of the HLA-Cw*06 and HLA-DRB1 genes in susceptibility to psoriatic arthritis: comparison with psoriasis and undifferentiated inflammatory arthritis. Annals of the Rheumatic Diseases 2008; 67 : 677.
16. Grubic Z, Peric P, Eeéuk-Jelicic E, Zunec R, Stingl K, Curkovic B, Kerhin-Brkljacic V. () The MICA-A4 triplet repeats polymorphism in the transmembrane region confers additional risk for development of psoriatic arthritis in the Croatian population. European Journal of Immunogenetics 2004; 31 : 93.
17. Gonzalez S, Martinez-Borra J, Torre-Alonso JC, Gonzales-Roces S, Sanchez del Rio J, Perez R, Brautbar Ch, Lopez-Larrea C. The MICA-A9 triplet repeat polymorphism in the transmembrane region confers additional susceptibility to develop psoriatic arthritis, and is independent of the association of Cw*0602 in psoriasis. Arthritis and Rheumatism 1999; 42 : 1010.
18. Sczcerkowska Dobosz A, Rebala K, Szczerkowska Z, Nedoszytko B. HLA-C locus alleles distribution in patients from nothern Poland with psoriatic arthritis: preliminary report. International Journal of Immunogenetics 2005; 32 : 389.
19. Gudjonsson JE, Karason A, Runarsdottir EH, Antonsdottir AA, Hauksson VB, Jónsson HH, Gulcher J, Stefansson K, Valdimarsson H. Distinct clinical differences between HLA-Cw*0602 positive and negative psoriasis patients--an analysis of 1019 HLA-C - and HLA-B-typed patients. Journal of Investigative Dermatology 2006; 126 : 740.
20. Mallon E, Bunce M, Wojnarowska F, Welsh K. HLA-Cw*0602 is a susceptibility factor in type I psoriasis, and evidence Ala-73 is increased in male type I psoriasis. Journal of Investigative Dermatology 1997; 109 : 183.
21. Gladman DD, Cheung C, Ng CM, Wade JA. HLA-C locus alleles in patients with psoriatic arthritis (PsA). Human Imunology 1999; 60 : 259.
22. Queiro R, Torre JC, Gonzales S, Lopez-Larrea C, Tinture T, Lopez-Lagunas I. HLA antigens may influence the age of onset of psoriasis and psoriatic arthritis. The Journal of Rheumatology 2003; 30 : 505.
23. Queiro R, Gonzales S, Lopez-Larrea C, Alperi M, Sarasqueta C, Riestra JL, Ballina J. HLA-C locus alleles may modulate the clinical expression of psoriatic arthritis. Arthritis Research and Therapy 2006; 8: R185.
24. Gambelunghe G, Ghaderi M, Cosentino A, Falorni A na Ad, Brunetti P, Falorni Ad, Sanjeevi CB. Association of MHC class I chain-related A (MIC-A) gene polymorphism with type I diabetes. Diabetologia 2000; 4 : 507.
25. Gambelunghe G, Ghaderi M, Tortoioli C, Falorni A, Santeusanio F, Brunetti P, Sanjeevi CB, Falorni A. Two distinct MICA gene markers discriminate major autoimmune diabetes types. The Journal of Clinical Endocrinology & Metabolism 2001; 8 : 3754.
26. Novota P, Kolostova K, Pinterova D, Novak J, Weber P, Treslova L, Kovar J, Andel M, Cerna M. Association of MHC class I chain related gene-A microsatellite polymorphism with the susceptibility to T1DM and LADA in Czech adult patients. International Journal of Immunogenetics 2005; 32, 273.
27. Cerna M, Kolostova K, Novota P, Romzova M, Cejkova P. Pinterova D. Pruhova S, Treslova L, Andel M. Autoimmune diabetes mellitus with adult onset and type 1 diabetes mellitus in children have different genetic predispositions. Annals of the NewYork Academy of Science 2007; 1110, 140.
Labels
Dermatology & STDs Paediatric rheumatology Rheumatology
Article was published inCzech Rheumatology

2009 Issue 2-
All articles in this issue
- HLA-Cw*0602 jako predispoziční alela rozvoje psoriatické artritidy
- Utilizace zdravotní péče a náklady pacientů s revmatoidní artritidou léčených TNF-α inhibitory v České republice
- Omezený význam prokalcitoninu v odlišení septického stavu od vzplanutí autoimunitního onemocnění
- Vliv biologické úpravy povrchu vybraných implantačních materiálů na proliferaci a syntetickou aktivitu kostních buněk. Studie in vitro
- Sekundární imunodeficitní stav s infekčními komplikacemi po imunosupresivní terapii u nemocné se systémový lupus erytematodes
- Czech Rheumatology
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- HLA-Cw*0602 jako predispoziční alela rozvoje psoriatické artritidy
- Omezený význam prokalcitoninu v odlišení septického stavu od vzplanutí autoimunitního onemocnění
- Sekundární imunodeficitní stav s infekčními komplikacemi po imunosupresivní terapii u nemocné se systémový lupus erytematodes
- Utilizace zdravotní péče a náklady pacientů s revmatoidní artritidou léčených TNF-α inhibitory v České republice
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

