-
Medical journals
- Career
Omezený význam prokalcitoninu v odlišení septického stavu od vzplanutí autoimunitního onemocnění
: H. Dejmková 1; O. Šléglová 1; R. Bečvář 1; K. Pavelka 1; J. Uhrová 2
: Revmatologický ústav, Praha, 2Ústav klinické biochemie a laboratorní diagnostiky VFN, Praha 1
: Čes. Revmatol., 17, 2009, No. 2, p. 79-82.
: Original Papers
Prognóza pacientů se systémovým lupusem erythematodem je zlepšena díky imunosupresivní léčbě. Tato léčba spolu s imunologickými abnormalitami v rámci základního onemocnění však vede ke zvýšenému riziku závažných infekcí. Odlišení vzplanutí choroby od infekční komplikace je obtížné. Prokalcitonin je biomarkerem, který byl dosud využíván zejména u kriticky nemocných pacientů v diferenciální diagnóze syndromu systémové zánětlivé odpovědi a sepse. Senzitivita a specifita nálezu zvýšených sérových hodnot prokalcitoninu v případě infekce dle různých studií kolísá. Článek podává základní přehled poznatků o prokalcitoninu a zaměřuje se na jeho možné využití v revmatologii. Vzhledem k tomu, že hodnota prokalcitoninu se rychle zvyšuje v důsledku systémové bakteriální či mykotické infekce a autoimunitním procesem či léčbou glukokortikoidy není významněji ovlivněna, lze uvažovat, že by prokalcitonin mohl být vhodným podpůrným ukazatelem v diferenciální diagnóze těchto dvou situací.V článku však prezentujeme kazuistiku, která tento předpoklad nepotvrzuje.
Klíčová slova:
prokalcitonin, sepse, exacerbace autoimunitního onemocněníÚvod
Jeden ze zásadních diagnostických problémů v revmatologii představuje správné rozpoznání závažné bakteriální či mykotické komplikace autoimunitního onemocnění. Vlivem imunosupresivní léčby a imunologických abnormalit provázejících základní onemocnění jsou pacienti výrazné oslabeni vůči infekci. Infekční komplikace systémového lupusu erythematodu (SLE) se staly v posledních letech vedoucí příčinou smrti těchto nemocných a podílí se zhruba 30–50 % na morbiditě a mortalitě nemocných (1–2). Odlišit, zda zhoršení klinického stavu souvisí se vzplanutím základní choroby nebo s komplikující infekcí je obtížné. Záměna těchto dvou stavů může však mít pro nemocného fatální důsledky (3, 4). Běžné klinické a laboratorní nálezy mnohdy neumožní tyto dva stavy diferencovat. Horečka může provázet jak aktivitu autoimunitního onemocnění, tak komplikující infekci a naopak někteří nemocní mohou být při infekční komplikaci afebrilní v důsledku utlumení imunitního systému léčbou. Leukocytóza může být přítomna nejen v důsledku infekce, ale v důsledku léčby vyššími dávkami glukokortikoidů. Vyšší hodnoty C-reaktivního proteinu (CRP), které běžně doprovází bakteriální infekci, mohou odrážet destruktivní orgánové změny při autoimunitním onemocnění. V posledních letech se pozornost zaměřila na potenciál prokalcitoninu (PCT) v diferenciální diagnóze těchto dvou stavů (5). Zjistilo se totiž, že hodnota PCT není výrazněji ovlivněna ani autoimunitním procesem, ani imunosupresivní léčbou (6, 7). Naproti tomu přítomnost systémové bakteriální či mykotické infekce vede k výraznému zvýšení PCT v séru (8, 9). Zdá se tedy, že by PCT mohl být slibným parametrem v této situaci. Jeho nevýhodou je omezená senzitivita, neboť jeho hodnoty významně stoupají jen pod vlivem systémové bakteriální infekce , zatímco při lokalizované infekci se jeho hodnoty prakticky nemění (6). Výsledky dosud publikovaných prací nejsou jednotné. Většina autorů však považuje stanovení hodnoty PCT v séru za přínosné. Signifikantní zvýšení PCT v séru je dle většiny autorů indikací k zahájení antimikrobiální léčby (10).
V současné době probíhá v Revmatologickém ústavu studie zabývající se významem stanovení PCT v séru v diferenciální diagnóze mezi aktivitou autoimunitního onemocnění a komplikující bakteriální infekcí. Studie je zatím ve stadiu hodnocení.
Prezentujeme případ, kde na rozdíl od literárních údajů stanovení sérových hodnot PCT nepřispělo ke stanovení diagnózy nástupu septického stavu.
Popis případu
44letá pacientka se SLE byla přijata v březnu roku 2008 na lůžkové oddělení Revmatologického ústavu pro 14denní febrilní stav k diagnostickému procesu.
V anamnéze nemocné byla hluboká žilní trombóza v 18 letech, ve 20 letech plicní embolie a v dalších letech následovaly tři předčasné porody mrtvých dětí. Ve 30 letech (v r. 1994) byl diagnostikován na jiném pracovišti primární antifosfolipidový syndrom (APS) na základě prodělaných chorob, zvýšených hodnot antikardiolipidových protilátek (ACLA) a pozitivního lupusového antikoagulantia (LA). V 35 letech (v r. 1999) byla diagnóza přehodnocena na SLE se sekundárním APS. Nemocná měla v této době motýlový exantém, lymfopenii, pozitivní antinukleární protilátky (ANA), pozitivní anti dsDNA protilátky, pozitivní ACLA a LA. Ve 38 letech (v r. 2002) došlo k vývoji gangrén prstů horních končetin, které se zhojily po intenzifikaci terapie (obr. 1). V r. 2006 došlo k další komplikaci ve smyslu tvorby hlubokých kožních defektů na bércích, které se nikdy nepodařilo zhojit a které trvaly v době příjmu na lůžkové oddělení (obr. 2).
1. Ischemické změny prstů HK podmíněné SLE s antifosfolipidovým syndromem. 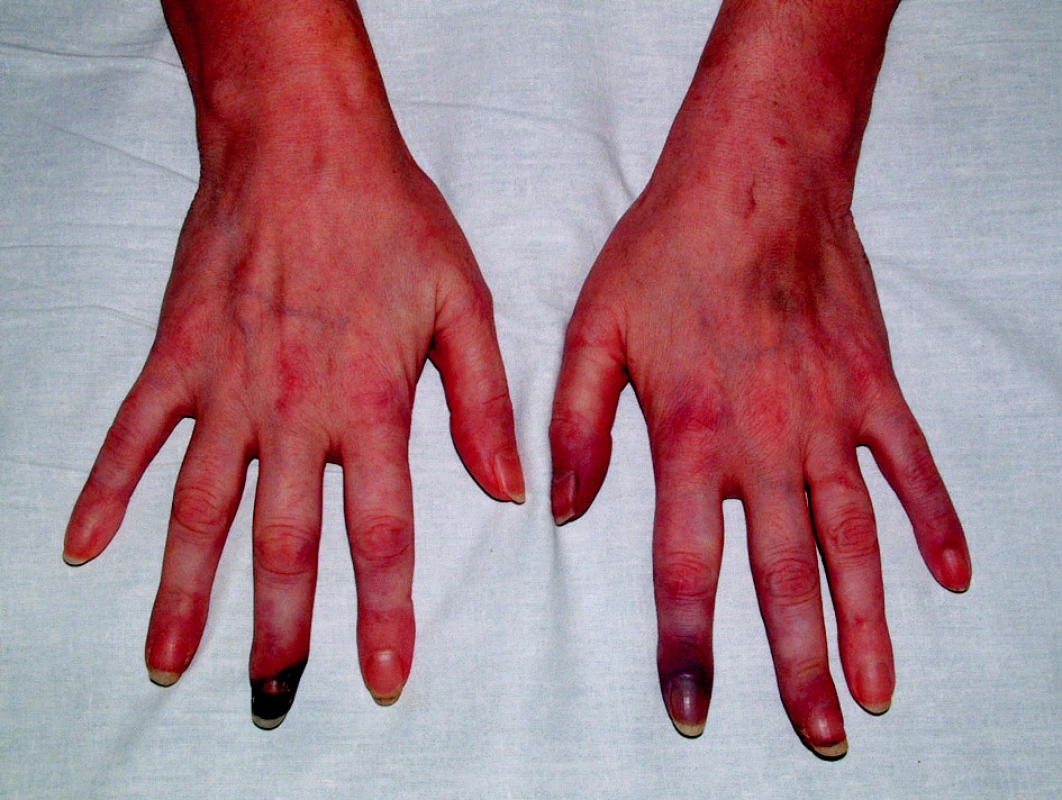
2. Infikované ulcerace bérců dolních končetin. 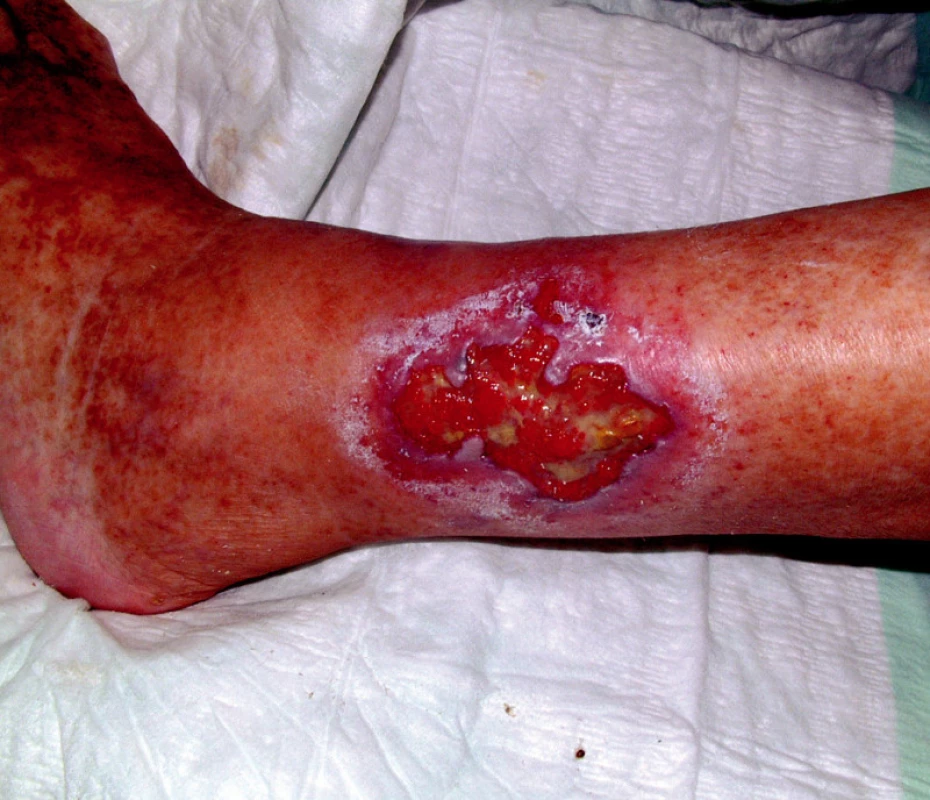
V březnu roku 2008 je nemocná přijata na oddělení pro 14denní horečnatý stav se skákavým typem horeček spojených se zimnicí a třesavkou.
V objektivním nálezu kromě astenie, lehce anemického habitu, rozsáhlých bércových vředů a schvácenosti při horečce nejsou přítomny další změny.
V laboratorních výsledcích je sedimentace 80/h. V krevním obraze je Hgb 107,0 g/l, HCT 0,34, leukocyty 21,7 l0^9/l, neutrofilní leukocyty 0,84, lymfocyty 0,07. V biochemických ukazatelích je CRP je 56,7 mg/l, močovina 13,6 mmol/l, kreatinin 171 μmol/l. V moči je proteinurie 1,49 g/24 h. Glomerulární filtrace je snížena na 0,51 ml/s, resorpce na 0,97. V imunologickém profilu jsou ANA 640 ++, homogenní fluorescence, anti dsDNA protilátky IF 320 titr a ELISOU 69IU/ml. Antinukleozomální protilátky jsou rovněž zvýšeny (281 U/ml). Cirkulující imunokomplexy PEG jsou zvýšeny na 163, C4 složka komplementu je snížena na 0,16 g/l.
V bércových vředech je masivně přítomna Pseudomonas aeruginosa a Morganella morganii. Výsledky ostatních laboratorních vyšetření včetně PCT jsou bez signifikantních odchylek od normálních hodnot. Na základě zhodnocení klinického stavu a zhodnocení výsledků laboratorních vyšetření cílíme terapii jednak na komplikující infekci, jednak na aktivitu základního onemocnění. Nemocná je léčena infuzními antibiotiky (ciprinol, augmentin, zinacef, tazocin), defekty jsou ošetřovány chirurgicky. Současně zvyšujeme dávku glukokortikoidů na 40 mg medrolu denně a po ústupu teplot aplikujeme intravenózně redukovanou 500 mg dávku cyklofosfamidu. Stav nemocné se však navzdory léčbě zhoršuje a rozvíjí se septický stav. Laboratorně dochází k vzestupu sedimentace na 120/h, CRP dosahuje hodnoty 126,27 mg/l, leukocyty narůstají na 52,9 10^9/l. Současně se zhoršují hodnoty kreatininu (257 μmol/l) a urey (24,1mmol/l). Sérová hodnota PCT, která byla úvodně v mezích normy, stoupá na 1,3 ng/ml.
Nemocná je vzhledem k rozvinutému septickému stavu přeložena na oddělení intenzivní péče Všeobecné fakultní nemocnice.
Diskuse
První práce zabývající se významem PCT v séru byly publikovány již v devadesátých letech a jsou z pediatrické oblasti (11). K dnešnímu datu bylo publikováno více než 500 studií. Většina studií se zaměřuje na hodnocení významu PCT v odlišení syndromu systémové zánětlivé odpovědi od septického stavu u kriticky nemocných pacientů jednotek intenzivní péče (12, 13, 14). Další studie jsou z různých oborů a týkají se významu stanovení sérových hladin PCT v diferenciální diagnóze zhoršení základního onemocnění od komplikující bakteriální nebo mykotické infekce (15–19). Velký zájem o PCT je dán jeho charakteristickými vlastnostmi, které jej předurčují být užitečným parametrem v diagnóze septické komplikace. Je zjištěno, že za normálních okolností je PCT uvolňován z místa svého vzniku, z C buněk štítné žlázy, do oběhu pouze v nepatrném množství (8). Na-proti tomu při invazivní bakteriální nebo mykotické infekci je PCT syntetizován mimo štítnou žlázu a jeho hodnoty v séru významně stoupají (5). Jiné patologické stavy v organismu jeho hodnotu výrazněji neovlivňují. Hodnota není ovlivněna ani terapií glukokortikoidy, ani další imunosupresivní léčbou. Aktivita autoimunitního onemocnění rovněž sérové hodnoty PCT nemění (20). Z tohoto aspektu se zdá, že by PCT měl být velmi užitečným parametrem u pacientů s autoimunitními chorobami. Slabou stránkou PCT je skutečnost, že jeho hodnota začne většinou stoupat až při závažných systémových infekcí s maximálními hodnotami v případě septického stavu, zatímco v případě lokalizovaných infekcí zůstává většinou hodnota neovlivněna (5–9). Navíc hodnota PCT méně citlivě odráží přítomnost grampozitivních infekcí a chronických infekcí (21, 22).
Studie z revmatologické oblasti většinou svědčí pro přínos vyšetření sérových hodnot PCT v diferenciální diagnóze mezi vzplanutím základního onemocnění a komplikující infekcí. Eberhard a spol. vyšetřil 397 sérových vzorků od 18 nemocných s aktivním SLE a od 35 nemocných s aktivní ANCA pozitivní vaskulitidou. PCT byl signifikantně zvýšen ve všech 16 sérových vzorcích 16 nemocných s prokázanou systémovou infekcí (23). Brunkhorst a spol. vyšetřil opakovaně séra 18 pacientů se SLE a 35 nemocných s ANCA pozitivní vaskulitidou. Zvýšená hladina PCT byla přítomna jen ve 3 ze 324 sérových vzorků pacientů s autoimunitním onemocněním bez prokázané infekce, zatímco ve všech sérech nemocných se systémovou bakteriální infekcí byla hodnota PCT signifikantně zvýšena.Autoři dospěli ve své studii k závěru, že stanovení sérové hladiny PCT je v této situaci přínosné (24). Scire a spol se zaměřili na rozbor souboru nemocných s autoimunitním onemocněním s horečnatým průběhem. Vyšetřili 44 pacientů se systémovým autoimunitním onemocněním s horečkou nad 38 stupňů Celsia. Ve 20 případech byla prokázána komplikující infekce, ve 24 případech prokázána nebyla. Senzitivita nálezu zvýšených sérových hodnot PCT byla 73,6 %, specificita 89,4 %. Na omezení specificity se podílela skutečnost, že pacienti se Stillovou nemocí v dospělosti vykazovali zvýšené hladiny PCT i v případě , že komplikující infekce nebyla prokázána (25). Další studii na toto téma publikoval Tamaki a spol. Autoři vyšetřili séra nemocných s autoimunitními revmatickými chorobami, kteří byli hospitalizováni pro zhoršení stavu. Sérové hladiny PCT byly hodnoceny v 99 vzorcích. Ve 29 případech byla zjištěna komplikující bakteriální infekce, v 70 případech se jednalo o zhoršení základního onemocnění. Specificita vyšetření byla značná (97,1 %), senzitivita podstatně nižší (53,3 %). Autoři usuzují, že vyšetření PCT má pozitivní význam zejména díky své vysoké specificitě (26).
V případě zde prezentované pacientky naproti tomu vyšetření PCT nepřispělo k včasné diagnóze nastupující sepse. Ke zvýšeným sérovým hodnotám PCT došlo až v době plně rozvinutého septického stavu, kdy byly zvýšeny i ostatní běžné parametry svědčící pro tento stav (extrémní leukocytóza, stoupající hodnota CRP).
Závěr
Stanovení sérových hodnot PCT u nemocných s autoimunitním onemocněním s podezřením na komplikující infekci má dle dostupných literárních údajů význam, výpovědní cena vyšetření není však stoprocentní , jak dokumentuje prezentovaná kasuistika. Výsledek je vždy třeba interpretovat v kontextu s klinickým stavem a ostatními laboratorními nálezy.
Přes četné dosud provedené studie není úloha PCT dosud jasně etablována, jak dokumentuje dosud probíhající dánská randomizovaná multicentrická studie počítající s vyšetřením 1000 pacientů (27).
Podpořeno grantem od IGAMZ ČR NR/929 1-3
MUDr. H. Dejmková
Revmatologický ústav
Na Slupi 4
128 50 Praha 2
e-mail: dejm@revma.cz
Sources
1. Cervera R, Khamashta MA, Font J, et al. Morbidity and mortality in systemic lupus erythematodes during a 5-year period. A multicenter prospective study of 1000 patiens. European Working Party on Systemic Lupus erythematodes. Medicine 1999; 78 : 167–175.
2. Paton NI. Infections in systemic lupus erythematodes patients. Ann Acad Med Signapore 1997; 26 : 694–700.
3. Joshua F, Riordan J, Sturgess A. Salmonella typhimurium mediastinal abscess in a patient with systemic lupus erythematosus. Lupus 2003; 12 : 710–3.
4. Wu KC, Yao TC, Yeh KW, Huang JL. Osteomyelitis in patients with systemic lupus erythematosus. J Rheumatol 2004; 31 : 1340–3.
5. Meisner M. Biomarkers of sepsis: clinically useful? Curr Opin Crit Care 2005; 11 : 473–80.
6. Mokart D, Merlin M, Sannini A, et al. Procalcitonin, interleukin 6 and systemic inflammatory response syndrome (SIRS): early markers of postoperative sepsis after major surgery. Br J Anaesth 2005; 94 : 767–73.
7. Malgorzata A, Verboon-Maciolek, Thijsen SFT, et al.Inflammatory mediators for diagnosis and treatment of sepsis in early infancy. Pediatr Res 2006; 59 : 457–61.
8. Zima T, et al. Laboratorní diagnostika. 1. vyd., Galén, Praha 2002; 839–44.
9. Kazda A in ZimaT, et al. Laboratorní diagnostika. 1. vyd., Galén, Praha 2002; 829–44.
10. Delevaux I, André M, Colombier M, et al. Can procalcitonin measurement help in differentiating between bacterial infection and other kinds of inflammatory processes? Ann Rheum Dis 2003; 62 (4): 337–40.
11. Assicot M, Gendrel D,Carsin H, et al. High serum procalcitonin concentrations in patiens with sepsis and infection. Lancet 1993; 341 : 515–518.
12. Meisner M, Adina H, Schmidt J. Correlation of procalcitonin and C-reactive protein to inflammation, complications, and outcome during the intensive care unit course of multiple-trauma patiens. Critical Care 2006; 10: R1
13. Dorizzi RM, Polati E, Sette P, et al. Procalcitonin in the diagnosis of inflammation in intensive care units. Clin Biochem 2006; 39(12): 1138–43.
14. Selberg O, Hecker H, Martin M, et al. Discrimination of sepsis and systemic inflammatory response syndrome by determination of circulating plasma concentrations of procalcitonin, protein komplement 3a, and interleukin-6. Crit Care Med 2000; 28 : 2793–8.
15. Gendrel D, Bohuon C. Procalcitonin as a marker of bacterial infection. Pediatr Infect Dis J 2000; 19 : 679–687.
16. Husová L, Husa P, Šenkyřík M, et al. Prokalcitonin jako indikátor infekce u pacientů s jaterní cirhózou. Vnitř Lék 2004; 50 : 153–6.
17. Sitter T, Schmidt M, Schneider S, et al. Differential diagnosis of bacterial infection and inflammatory response in kidney diseases using procalcitonin. J Nephrol 2002; 15 : 297–301.
18. Uzun G, Solmazgul E, Curuksulu H, et al. Procalcitonin as a diagnostic aid in diabetic foot infections. Tohoku J Exp Med 2007; 213(4): 305–12.
19. Martinot M, Sordet C, Soubrier M, et al. Diagnostic value of serum and synovial procalcitonin in acute arthritis: a prospective study of 42 patiens. Clin Exp Rheumatol 2005; 23 : 303–10.
20. Quintana G, Medina YF, Rojas C, et al. The use of procalcitonin determinations in evaluation of systemic lupus erythematosus. J Clin Rheumatol 2008; 14(3): 138–42.
21. Charles PE, Ladoire S, AHO S, et al. Serum procalcitonin elevation in critically ill patiens at the onset of bacteremia caused by either Gram negative or Gram positive bacteria. BMC Infect Dis 2008; 26 : 8: 38.
22. Perrotti C, et al. Diagnostic value of procalcitonin measurement in febrile patients with systemic autoimmune diseases. Clin Exp Rheumatol 2006; 24(2): 123–8.
23. Eberhard OK, Haubitz M, Brunkhorst FM, et al. Usefulness of procalcitonin for differentiation between activity of systemic autoimmune disease (systemic lupus erythematosus/systemic antineutrophil cytoplasmic antibody-associated vasculitis) and invasive bacterial infection. Arthritis Rheum 1997; 40(7): 1250–6.
24. Brunkhorst R, Eberhardt OK, Haubitz M, et al. Procalcitonin for discrimination between activity of systemic autoimmune disease and systemic bacterial infection. Intensive Care Med 2000; 26 Suppl 2: S199–201.
25. Scire CA, Cavagna L, Perotti C, et al. Diagnostic value of procalcitonin measurement in febrile patients with systemic autoimmune diseases. Clin Exp Rheumatol 2006; 24(2): 123–8.
26. Tamaki K, Kogata Y, Sugiyama D, et al. Diagnostic accuracy of serum procalcitonin concentrations for detecting systemic bacterial infection in patients with systemic autoimmune diseases. J Rheumatol 2008; 35 : 114–9.
27. Jensen JU, Lundgren B, Hein L, et al. The Procalcitonin and Survival Study (PASS) - a randomised multi-center investigator-initiated trial to investigate whether daily measurements biomarker Procalcitonin and pro-active diagnostic and therapeutic response to abnormal Procalcitonin levels, can improve survival in intensive care unit patients. Calculated sample size(target population): 1 000 patients. BMC Infect Dis 2008 : 91. online 2008 July 13. doi:10.1186/1471-2334-8-91.
Labels
Dermatology & STDs Paediatric rheumatology Rheumatology
Article was published inCzech Rheumatology

2009 Issue 2-
All articles in this issue
- HLA-Cw*0602 is a predisposing allele to develop psoriatic arthritis
- Utilization of health care and the costs for patients with rheumatoid arthritis treated with TNF-α inhibitors in the Czech Republic
- Limited significance of procalcitonin in differentiation between sepsis and flare of a rheumatic disease
- The impact of biological modification of the surface of selected implant materials on the proliferation and synthetic activity of bone cells. In vitro study
- Secondary immunodeficiency with infectious complications following immunosuppressive therapy in a female patient with systemic lupus erythematosus
- Czech Rheumatology
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- HLA-Cw*0602 is a predisposing allele to develop psoriatic arthritis
- Limited significance of procalcitonin in differentiation between sepsis and flare of a rheumatic disease
- Secondary immunodeficiency with infectious complications following immunosuppressive therapy in a female patient with systemic lupus erythematosus
- Utilization of health care and the costs for patients with rheumatoid arthritis treated with TNF-α inhibitors in the Czech Republic
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

