-
Medical journals
- Career
Ashermanův syndrom: popis dvou případů
: M. Miklošová 1; M. Mára 2
: Gynekologicko-porodnické oddělení, Nemocnice Pardubického kraje, pracoviště Chrudimská nemocnice, primář MUDr. T. Pavlíček 1; Gynekologicko-porodnická klinika 1. LF UK a VFN, Praha, přednosta prof. MUDr. A. Martan, DrSc. 2
: Ceska Gynekol 2018; 83(6): 440-444
: Case Report
Cíl studie:
Poukázat na důležitost správné indikace a šetrného provedení intrauterinních výkonů. Upozornit na klíčovou roli včasné diagnostiky a léčby nitroděložních adhezí.
Pracoviště:
Gynekologicko-porodnické oddělení, Nemocnice Pardubického kraje, pracoviště Chrudimská nemocnice. Gynekologicko-porodnická klinika 1. LF UK a VFN, Praha.
Typ práce:
Kazuistika.
Metodika:
Popis dvou rozdílných případů pacientek s Ashermanovým syndromem.
Závěr:
Ashermanův syndrom je závažná diagnóza s velmi obtížnou léčbou ve vztahu k fertilitě. Zásadní roli tak hraje předcházení této patologii a její včasné diagnostikování a řešení.
klíčová slova
Ashermanův syndrom, intrauterinní synechie, revize děložní dutiny, hysteroskopie
ÚVOD
Ashermanův syndrom (AS) je iatrogenní poškození děložní sliznice se vznikem adhezí a s tím související poruchy menstruace a plodnosti [3]. Intrauterinní adheze zabraňují normálnímu růstu a obnově endometria. Symptomy, kterými trpí postižené ženy, jsou hypomenorea či amenorea, popřípadě dysmenorea (při hlavním poškození v oblasti istmu či cervixu), sterilita a častější výskyt spontánních abortů [3, 11]. Nejčastěji vzniká poškození endometria po nešetrné a agresivní kyretáži, která poškozuje jeho bazální vrstvu. Dominují případy postpartální instrumentální revize dutiny děložní (RCUI) pro těhotenská rezidua, případně RCUI po potratu (pro inkompletní spontánní abort či missed abortion, zřídka po umělém přerušení těhotenství), a to zejména při provedení výkonu v delším, dvoutýdenním až čtyřtýdenním odstupu od porodu či potratu. Deficit estrogenů, typický u kojících matek, také zvyšuje riziko vzniku této patologie [4, 7]. Po RCUI zde nenásleduje obvyklá regenerace endometria, která za normálních okolností zabraňuje vzniku nitroděložních adhezí. V dalším průběhu bývá syndrom často nepoznán pro absenci menstruace, která však během kojení není nijak překvapující. Tím často dochází k oddálení časné diagnostiky, která je pro další prognózu zásadní [2, 7]. Incidence AS celosvětově vzrůstá [8].
VLASTNÍ POZOROVÁNÍ
Kazuistika 1
Pacientkou byla nyní dvaačtyřicetiletá žena s anamnézou spontánního porodu plodu mužského pohlaví v listopadu 2014. Porod v 37. týdnu těhotenství proběhl bez komplikací, včetně III. doby porodní, avšak narozený chlapec v šestinedělí zemřel na komplikace vrozené cystické fibrózy (CF). Genetické vyšetření prokázalo, že oba partneři jsou nosiči genu CF. Další těhotenství bylo proto doporučeno cestou mimotělního oplodnění (IVF) s preimplantační genetickou diagnostikou. V roce 2016 pacientka otěhotněla v druhém cyklu IVF, kdy bylo transferováno jedno geneticky vyšetřené embryo. V 10. týdnu gravidity však byl zjištěn missed abortion a po dohodě s pacientkou zvolen expektační postup. Za 14 dní, kdy nedošlo ke spontánní expulzi plodového vejce, byla provedena RCUI. Dva týdny po RCUI byla diagnostikována rezidua a provedena další revize děložní dutiny a měsíc poté i operační hysteroskopie (HSK). Za dva měsíce po posledním výkonu byla pacientka stále amenoroická a přetrvávala lehce zvýšená hladina těhotenského hormonu hCG (32 IU/l).
S podezřením na AS byla pacientka odeslána na specializované klinické pracoviště, kde byla v červnu 2016 provedena HSK a zjištěny masivní fibrózní synechie ve fundu a v levé hraně děložní dutiny a reziduální těhotenská tkáň v oblasti levého děložního rohu. Pomocí bipolárního resektoskopu a za peroperační asistence ultrazvuku (abdominální sonda při močovém měchýři naplněném 300 ml fyziologického roztoku) byly adheze rozrušeny a rezidua resekována a evakuována z děložní dutiny. Dále byl aplikován antiadhezivní gel – AAG (Hyalobarrier gel, Anika Therapeutic, Bedford). Posléze nasazeny vysoké dávky hormonální terapie (HRT). Na tři týdny estrogenní složka (estradiol hemihydricum 2 mg p.o. třikrát denně – Estrofem, Novo Nordisk A/S, Bagsvaerd, Dánsko) s přidáním gestagenu (dydrogesteron 10 mg dvakrát denně – Duphaston, Solvay Biologicals B.V. Olst, Nizozemsko) v posledním týdnu užívání a poté následoval týden bez HRT. V srpnu 2016 byla provedena „second-look“ HSK a znovu shledány fibrózní adheze v oblasti děložních hran v distálních dvou třetinách dutiny děložního těla (obraz „trubicovitě užší“ děložní dutiny). Pomocí jemných studených nůžek byla dutina postupně remodelována do přibližně 95 % předpokládaného původního tvaru a objemu a intrauterinně opět instilován AAG. V podávání již nastavených dávek a způsobu užívání HRT se pokračovalo po dobu dalších dvou cyklů. Hned poté byla doporučena snaha o koncepci.
Pacientka spontánně otěhotněla po dvou měsících snahy. V prosinci 2016 byl pro genetickou zátěž CF ve 13. týdnu gravidity proveden odběr choriových klků (CVS) a u plodu diagnostikována trizomie 21. chromozomu. Vzhledem k anamnéze nitroděložních adhezí byl potrat veden medikamentózně za pomoci prostaglandinů a bez provedení RCUI. Kontrolní ultrazvuk (UZ) měsíc po abortu prokázal přítomnost reziduí v děložní dutině. Pomocí bipolární resektoskopie prováděné za asistence UZ v únoru 2017 byla vybavena tkáň vzhledu reziduí, avšak v oblasti levého děložního rohu přetrvával kulovitý útvar prorůstající hluboko do myometria. Proto byla v březnu 2017 indikována laparoskopie, při níž byla patologická tkáň z myometria kompletně resekována a provedena vícevrstevná sutura děložní stěny (viz obr. 1). Histologie potvrdila nekrotické části abnormálně penetrující placentární tkáně. Další kontrolní HSK v dubnu a červenci 2017 neprokázaly nález reziduí ani nitroděložních adhezí. Nyní pacientka plánuje další koncepci.
1. Laparoskopická resekce abnormálně penetrující placenty 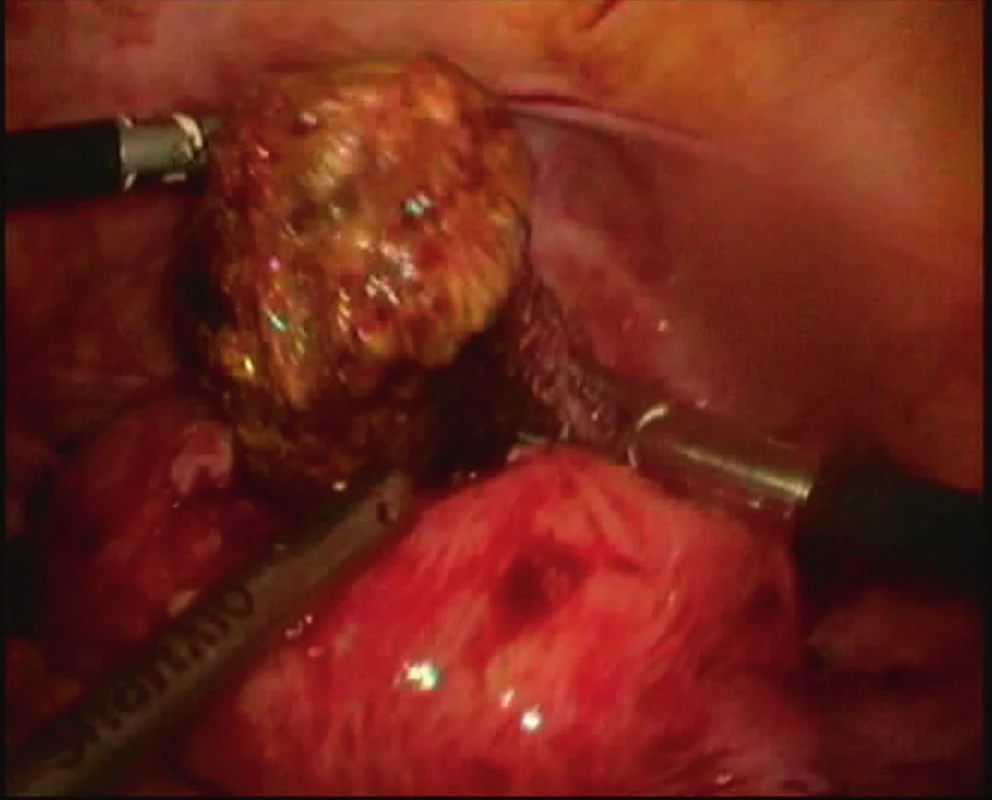
Kazuistika 2
Druhý případ se týká třiatřicetileté ženy s anamnézou spontánního termínového nekomplikovaného porodu v červenci 2014. Za 14 dní po porodu se objevilo středně silné krvácení tmavou krví a pro ultrazvukem potvrzená postpartální rezidua byla provedena RCUI za kontroly UZ. Po výkonu přetrvávalo mírné špinění. Na konci šestinedělí byl při kontrole UZ opět prokázán hyperechogenní obsah v děložní dutině o síle 15 mm. V září 2014 tak byla provedena HSK s nálezem na zadní stěně pevně adherujících těhotenských reziduí, jež byla obtížně odstraněna pomocí grasperu a kyrety. Po tomto výkonu již pacientka dále nekrvácela ani nešpinila. Kojení ukončila v srpnu 2015.
V září 2015 byla při vaginálním UZ stanovena sliznice o celkové síle 4–5 mm a dostavilo se dvoudenní špinění imitující menstruaci. V tu dobu nebyla doporučena žádná intervence. Pacientka se následujících šest měsíců snažila otěhotnět, ale neúspěšně. Proto kontaktovala jiné pracoviště, kde v únoru 2016 byla pro suspekci na AS provedena HSK. Při výkonu se pro masivní adheze v oblasti děložního hrdla vůbec nepodařilo vizualizovat děložní dutinu. Od dalšího pokusu o průnik hysteroskopu do dutiny děložního těla bylo upuštěno a bylo zavedeno nitroděložní tělísko (IUD). Po konzultaci o dalším postupu ve specializované endoskopické ambulanci na klinickém pracovišti se zjistilo, že IUD je chybně uložené v přední děložní stěně, nicméně bylo bez komplikací vyjmuto.
V dubnu 2016, tedy necelé dva roky po porodu, následovala na tomto klinickém pracovišti HSK s nálezem zjizvené vnitřní branky hrdla, děložní dutina byla zřetelně užší a nesouměrná pro přítomnost masivních pevných fibrózních synechií, vycházejících z přední děložní stěny a rozdělujících dutinu na dvě části. Další adheze byly shledány při pravé hraně děložní. Dutinu se pomocí studených nůžek podařilo remodelovat do přibližně 70 % předpokládaného původního objemu a intrauterinně byl aplikován AAG (Hyalobarrier gel, Anika Therapeutic, Bedford). Následovala HRT léčba s estrogenní složkou na tři týdny (estradiol hemihydricum 2 mg p.o. třikrát denně – Estrofem, Novo Nordisk A/S, Bagsvaerd, Dánsko) a v posledním týdnu přidání gestagenu (dydrogesteron 10 mg dvakrát denně – Duphaston, Solvay Biologicals B.V. Olst, Nizozemsko). Další HSK v květnu 2015 ukázala asymetrickou dutinu s asi 60% objemovou kapacitou z předpokládané normy pro nález de-novo vzniklých fibrózních synechií v pravé hraně a pravém rohu děložní dutiny. Dutina byla znovu remodelována do obrazu téměř normálního objemu i symetrie a opět byl aplikován AAG (viz obr. 2). HRT pacientka užívala celkem tři měsíce a poté byla doporučena spontánní koncepce, kterou pacientka zatím preferovala před IVF.
2. Detail synechiolýzy studeným hysteroskopickým nástrojem (nůžky) 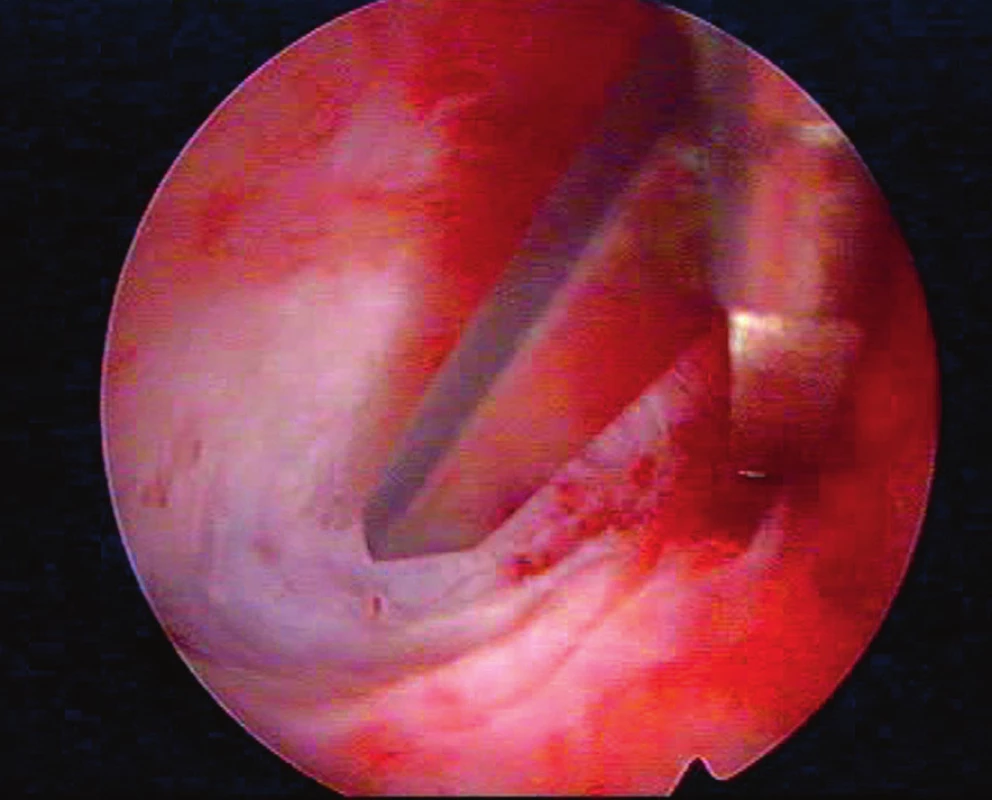
Šest měsíců po poslední HSK bylo pro sekundární sterilitu a stále slabou menstruaci přistoupeno k další HSK (listopad 2016), kde se děložní dutina zdála opět výrazně menší (odhadovaný objem jen 30 % oproti normě) pro masivní bělavé fibrózní synechie ve fundu a obou děložních hranách (obraz „kratší a trubicovitě užší“ děložní dutiny – viz obr. 3). Dutina byla, již snadněji než při předešlých výkonech, remodelována do 100 % obvyklého objemu a opět podán AAG a nasazena HRT ve stejném dávkování a režimu. HSK v prosinci 2016 prokázala normálně objemnou a symetrickou dutinu bez synechií. Pro výraznou tendenci pacientky k tvorbě recidivujících nitroděložních adhezí časně po HSK a vysazení HRT byla další snaha o graviditu doporučena cestou IVF.
3. Typicky bělavé fibrózní adheze u Ashermanova syndromu po postpartální revizi 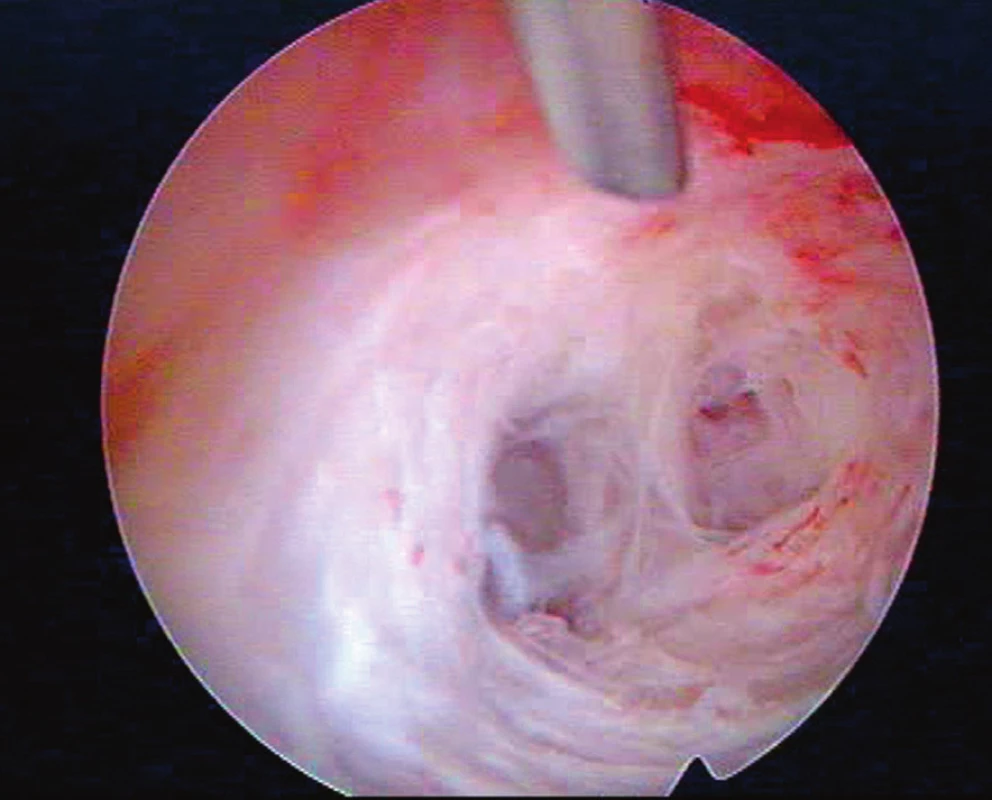
Vzhledem k hyperstimulačnímu syndromu komplikujícímu první IVF cyklus byl proveden první kryoembryotransfer (KET) až v červenci 2017, avšak pacientka neotěhotněla. Před dalším KET byla v září 2017 provedena další HSK, při níž byly rozrušeny již jen zbytkové jemné synechie při pravé děložní hraně. Opět byly aplikovány AAG a HRT. Následující KET opět nebyl zakončen graviditou. Nyní pacientka podstupuje druhý cyklus IVF. Endometrium se v periovulačním období podle UZ jeví jako proliferační a dosahující celkové síly 7 mm.
DISKUSE
Výše popsané případy naznačují fakt, že masivní nitroděložní srůsty vznikají zejména po postpartálních revizích a včasná diagnostika, spolu s navazující adekvátní hysteroskopickou adheziolýzou, může být zásadní pro obnovení fertility. První pacientce, které byl AS diagnostikován záhy po dvou RCUI pro missed abortion, se podařilo spontánně otěhotnět pouhé dva měsíce po dvou operačních HSK. Druhé ženě, kde byla adekvátní léčba zahájena až 16 měsíců od RCUI, indikované dvakrát pro postpartální rezidua, se otěhotnět nezdařilo ani po dvou letech snahy, včetně opakované léčby metodami asistované reprodukce. Tyto kazuistické údaje samozřejmě nemají váhu dat, vycházejících z výsledků klinických studií větších souborů pacientek. Nicméně jsou v souladu s publikovanými literárními zdroji i mnohaletými zkušenostmi centra gynekologické endoskopie Gynekologicko-porodnické kliniky 1. LF UK a VFN v Praze [8].
Zásadní je nesporně samotné předcházení vzniku tohoto závažného stavu spočívající v uvážlivé indikaci nitroděložních operačních zákroků, zvláště na postgravidní děloze a zejména při diagnóze postpartálních reziduí. U symptomatických, silně krvácejících žen je jasná indikace k RCUI. Zákrok by však měl být proveden šetrně, optimálně pod kontrolou UZ a pro obavy z perzistujících reziduí by se neměl zbytečně prodlužovat. Již v jeho průběhu vznikají v ultrazvukovém obraze hyperechogenní odrazy a vzduchové bubliny, které znemožňují jasně určit, zda je děložní dutina prázdná [5, 6, 8]. Při suspekci na postpartální rezidua na UZ by se již koncem šestinedělí měla před RCUI upřednostnit HSK, a zejména asymptomatické či jen slabě krvácející šestinedělky by neměly RCUI podstupovat vůbec. Pokud již u šestinedělky k RCUI dojde, je vhodné zvážit v odstupu dvou až tří měsíců od porodu provedení HSK na pracovišti erudovaném v provádění pokročilých transcervikálních operačních výkonů. A to i u žen asymptomatických, z důvodu možného latentního klinického průběhu AS (amenorea kojících žen). U nekojících eumenoroických žen s normálně vysokou sliznicí na UZ je indikace HSK po postpartální RCUI sporná a spíše zbytečná. Obecně však platí, že čím dříve je léčba AS započata, tím je reprodukční prognóza příznivější [8].
Při ultrazvukovém nálezu suspektních reziduí do 15 mm po porodu či abortu je u asymptomatických či jen málo symptomatických žen vhodné s výkonem počkat po šestinedělí a poučené pacientce provést HSK až v odstupu a případná rezidua odstranit cíleně pod vizuální kontrolou. Existují zkušenosti i data o tom, že nevelké množství reziduí je v mnohých případech děloha schopna eliminovat i spontánně a bez intervence [6].
Podezření na diagnózu AS lze získat již na základě anamnézy. Typická je především absence menstruačního krvácení či menstruace výrazně slabší ve srovnání s obdobím před prodělaným nitroděložním výkonem. Dále mohou být zastoupeny dysmenorea, sterilita či opakované potraty. Na UZ nacházíme obraz nápadně nízkého či nepravidelně silného endometria a v některých případech nelze dutinu a sliznici vůbec vizualizovat. Jindy se adheze zobrazují jako nápadně hyperechogenní okrsky. Pomocnou diagnostickou metodou může být sonohysterografie či hysterosalpingografie, tedy metody neinvazivní či miniinvazivní, jednoduché, dostupné a levné [1]. HSK je diagnostickým standardem a zároveň metodou léčebnou, kdy lze pomocí nůžek, bipolární koagulace či laseru disekovat přítomné adheze. Na konci výkonu je podle některých autorů doporučena aplikace gelového antiadhezivního gelu s kyselinou hyaluronovou [9] nebo zavedení Foleyova katétru po dobu několika dní [7]. Dříve byla používána tříměsíční aplikace nitroděložního tělíska. Nyní je od této metody upouštěno pro hrozbu chronické formy zánětu, který může přispívat k novotvorbě adhezí v děložní dutině [7].
Po prvním remodelačním nitroděložním výkonu je obvykle doporučována dvou - až tříměsíční hormonální léčba (HRT), založená zejména na proliferativním efektu estrogenu za účelem co nejlepší regenerace reziduálního endometria do obnovované děložní dutiny. Obvykle následuje další (second-look) HSK pro případné rozrušení reziduálních či nově vzniklých srůstů [5]. Pokud není dosaženo úspěchu, celý cyklus se i vícekrát opakuje pro obvykle přítomnou tendenci k tvorbě nových adhezí. Je vhodné provádět tyto náročné intrauterinní zákroky na specializovaném pracovišti, optimálně již od prvního výkonu, kdy lze v jedné anestezii spojit diagnostickou a operační část HSK.
Podle některých nových experimentálních prací je možné u pacientek, které nereagují na tuto standardní léčbu, provést autologní transplantaci kmenových buněk. Monoklonální kmenové buňky izolované z kostní dřeně se implantují na několika místech subendometriálně. Během dvou měsíců dochází k regeneraci a nárůstu endometria o 2,5 mm a několika ženám se takto podařilo otěhotnět. Tyto nové studie přinášejí slibnou perspektivu do dalších let [9, 10].
Prognóza AS je vážná a vzhledem k dosažení životaschopného těhotenství nejistá. Případný úspěch léčby záleží na mnoha více či méně známých faktorech, nejvíce na iniciálním stupni postižení a odstupu první HSK od RCUI. Pozitivními pro prognózu jsou i úspěch primární chirurgické léčby, spočívající v dosažení optimálně prostorné děložní dutiny, a obnova spontánní dostatečně silné menstruace. Podstatná je i individuální dispozice různých pacientek k tvorbě adhezí [8] i jejich vztah k metodám asistované reprodukce. Pochopitelně o úspěšnosti fertilních výsledků nerozhoduje jen samotná anatomie a funkce dělohy, ale i věk pacientek a další faktory a parametry sterility či subfertility. Některé práce z více optimistické části publikací, popisujících reprodukční výsledky žen léčených pro AS, udávají frekvenci gravidit (pregnancy rate) u středního a těžkého stupně AS mezi 55 a 100 % a frekvenci porodů životaschopného dítěte (live-birth rate) 30 až 70 % [7]. Jinou významnou problematikou AS je výrazně vyšší četnost peripartálních komplikací, zejména abnormálně invadující placenta [7], tak jak je i popsáno v rámci naší první kazuistiky.
ZÁVĚR
AS je závažné onemocnění, které zásadně ovlivňuje fertilitu postižených žen. Jeho léčba je pro většinu pacientek traumatizující zkušeností pro obvyklou nutnost opakování výkonů v celkové anestezii a velmi nejistou reprodukční prognózu s potenciálem závažných psychologických a psychosociálních dopadů.
Iniciální rozsah adhezí a úspěšná primární remodelace děložní dutiny hraje významnou roli v úspěšnosti léčby. Pomýšlet na riziko vzniku a důsledky této patologie bychom však měli již při indikaci a provádění každého nitroděložního výkonu po porodu či potratu.
MUDr. Martina Miklošová
Nemocnice Pardubického kraje a.s.
Chrudimská nemocnice
Václavská 570
537 27 Chrudim
e-mail: mar.miklosova@gmail.com
Sources
1. Ahmadi, F., Siahbazi, S., Akhbari, F., et al. Hysterosalpingography finding in intra uterine adhesion (Asherman‘s syndrome): a pictorial essay. Int J Fertil Steril, 2013, 7, p. 155–160.
2. Conforti, A., Alviggi, C., Mollo, A., et al. The management of Asherman syndrome: a review of literature. Reprod Biol Endocrinol, 2013, 11, p. 118.
3. Engelbrechtsen, L., Langhoff-Roos, J., Kjer, JJ., Istre, O. Placenta accreta: adherent placenta due to Asherman syndrome. Clin Case Rep, 2015, 3, p. 175–178.
4. Hrazdirová, L., Kužel, D., Žižka, Z. Ashermanův syndrom. I – historie, prevalence, histopatologie, klasifikace, etiologie, symptomatologie a vyšetřovací metody. Čes Gynek, 2010, 75, s. 492–498.
5. Hrazdirová, L., Kužel, D., Žižka, Z. Ashermanův syndrom. II – terapie, asistenční metody, prevence readhezí, komplikace a výsledky léčby. Čes Gynek, 2010, 75, s. 499–506.
6. Hrazdirová, L., Kužel, D., Žižka, Z. Je hysteroskopie správná volba pro řešení reziduí těhotenských tkání? Čes Gynek, 2012, 77, s. 35–38.
7. Kolařík, D., Halaška, M., Feyereisl, J. Repetitorium gynekologie, 2. aktualizované vyd. Praha: Maxdorf, 2011, 1086 s.
8. Kužel, D., Tóth, D., Mára, M., et al. Základy panoramatické hysteroskopie, 1. vyd. Praha: Grada Publishing, 2016, 192 s.
9. Křižan, V., Pánková, S., Hudeček, R. Význam hyaluronátu v gynekologii a porodnictví. Prakt Gyn 2012, 16(1), s. 7–12.
10. Santamaria, X., Cabanillas, S., Cervelló, I., et al. Autologous cell therapy with CD133+ bone marrow-derived stem cells for refractory Asherman‘s syndrome and endometrial atrophy: a pilot cohort study. Hum Reprod, 2016, 31, p. 1087–1096.
11. Singh, N., Mohanty, S., Seth, T., et al. Autologous stem cell transplantation in refractory Asherman‘s syndrome: a novel cell based therapy. J Hum Reprod Sci, 2014, 7, p. 93–98.
12. Smikle, C., Bhimji, SS. Asherman syndrome. In: StatPearls [Internet]. Treasure Island (FL): StatPearls Publishing, 2018.
Labels
Paediatric gynaecology Gynaecology and obstetrics Reproduction medicine
Article was published inCzech Gynaecology

2018 Issue 6-
All articles in this issue
- The effect of myomectomy on the morphology uterine and tubal factor of infertility
- Radiofrequency endometrial ablation – new possibility of heavy menstrual bleeding conservative treatment
- Perinatal mortality and morbidity in Slovak Republic in the years 2007–2015
- Asherman‘s syndrome: the description of two case reports
- Fetal and neonatal alloimmune thrombocytopenia
- New potential biomarkers for preeclampsia prediction
- Surrogate motherhood: the contradicitons in terminology
- Etiology, risk factors, and methods of postpartum depression prevention
- Ectopic pregnancies: a retrospective cohort analysis in a tertiary reference center in the Northeast Region of Brazil
- Gynecological tumor triplicity
- Strumal carcinoid of the ovary – report of two cases and review of literature
- Czech Gynaecology
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Etiology, risk factors, and methods of postpartum depression prevention
- Radiofrequency endometrial ablation – new possibility of heavy menstrual bleeding conservative treatment
- Asherman‘s syndrome: the description of two case reports
- Perinatal mortality and morbidity in Slovak Republic in the years 2007–2015
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

