-
Medical journals
- Career
Gravidita u pacientek s vrozenou krvácivou chorobou
Authors: T. Binder 1; P. Salaj 2; V. Komrska 3
Authors‘ workplace: Gynekologicko-porodnická klinika FZS UJEP a MN, Ústí nad Labem, přednosta doc. MUDr. T. Binder, CSc. 1; ÚHKT, Praha, přednosta prof. MUDr. P. Cetkovský, Ph. D., MBA 2; Dětská hemato-onkologická klinika 2. LF UK a FN Motol, Praha, přednosta prof. MUDr. J. Starý, DrSc. 3
Published in: Ceska Gynekol 2016; 81(6): 420-425
Overview
Cíl:
Poukázat na rizika spojená s těhotenstvím a porodem u dvou nejčastěji se vyskytujících vrozených krvácivých chorob – von Willebrandovy nemoci a hemofilie. Zkompletovat pravidla mezioborové prenatální a peripartální péče, která tato rizika minimalizují. Článek je doplněn o kazuistiku nesprávného postupu s fatálními důsledky pro novorozence.Typ studie:
Přehledový článek a kazuistika.Pracoviště:
Gynekologicko-porodnická klinika FZS UJEP a MN v Ústí nad Labem, ÚHKT Praha a Dětská hemato-onkologická klinika FN Motol Praha.Výsledky:
Těhotenství u obou výše uvedených stavů je rizikové a vyžaduje úzkou mezioborovou spolupráci mezi hematologem, porodníkem a neonatologem.Klíčová slova:
těhotenství, von Willebrandova nemoc, hemofilieVROZENÉ KRVÁCIVÉ STAVY
V tabulce 1 jsou uvedeny vrozené krvácivé stavy, s kterými se porodník může u těhotné potenciálně setkat. Svou incidencí v populaci jsou pro porodníka nejvý#znamnější von Willebrandova nemoc a oba typy hemofilie.
Table 1. Přehled vrozených krvácivých chorob 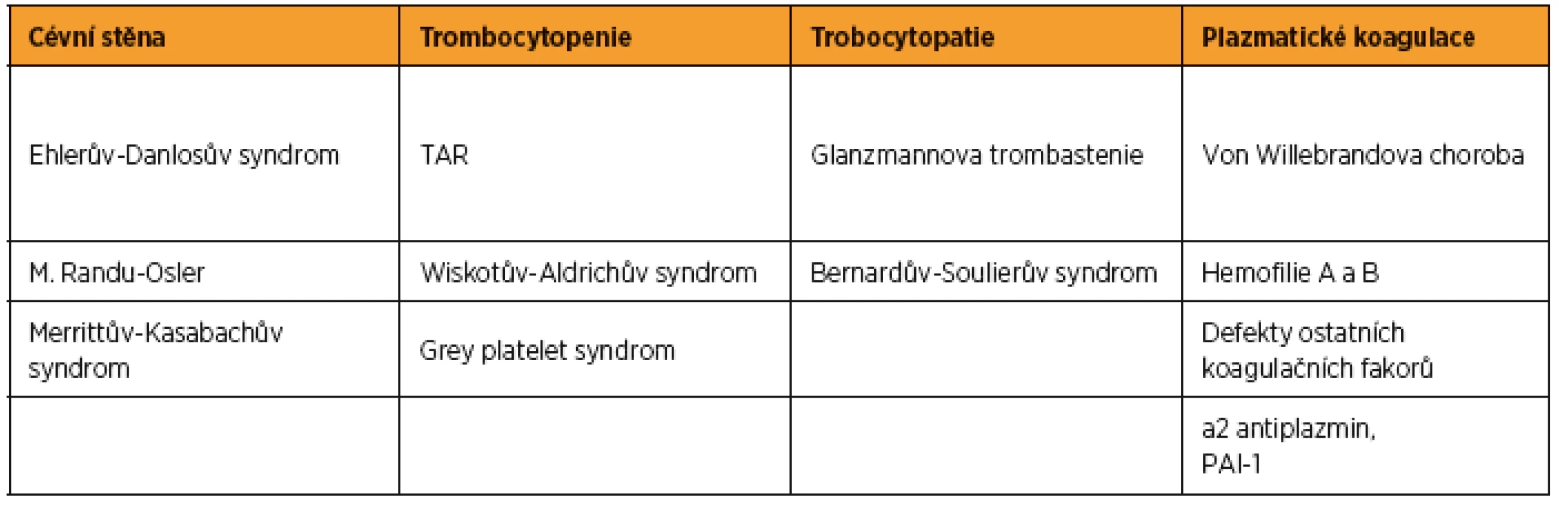
MORBUS VON WILLEBRAND
Morbus von Willebrand (vWD) je nejčastější dědičnou krvácivou nemocí s prevalencí kolem sta případů na milion obyvatel. Podle některých prací by se dal při podrobném vyšetření obyvatelstva detekovat výskyt až u jednoho procenta obyvatel.
Klasifikace
Morbus von Willebrand se dělí podle laboratorních kritérií do tří typů, z nichž u typu 2 je rozlišeno ještě několik podtypů (tab. 2).
Table 2. Klasifikace morbus vonWillebrand 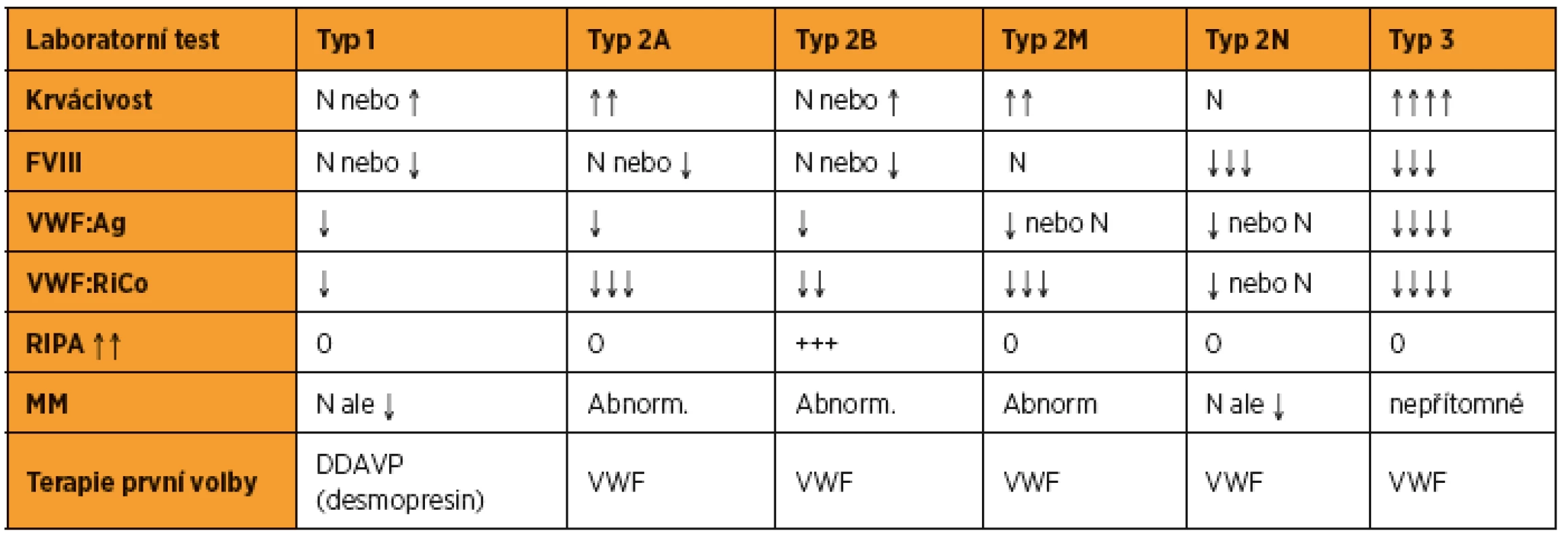
FVIII – hladina koagulačního faktoru FVIII, vWF:Ag – hladina antigenu vWF, vWF:RiCo – hladina ristocetinového kofaktoru VWF (funkční stanovení hladiny vWF), MM – multimery vFW, RIPA – ristocetin induced platelet agregation, agregace trombocytů indukovaná ristocetinem Koagulační změny u vWD v graviditě
Fyziologicky dochází u zdravých těhotných žen v průběhu jejich gravidity k vzestupu hladin faktoru VIII a vWF. U nemocných s vWD je hemostatická odpověď v průběhu těhotenství variabilní, závislá na typu či podtypu vWD.
U typu 1, kde se jedná o parciální kvantitativní poruchu, dochází v průběhu těhotenství k progresivnímu vzestupu fakoru VIII a vWF, často s normalizací hladin v průběhu 3. trimestru.
U typu 2, který zahrnuje kvalitativní poruchy vWF, hladiny FVIII a vWF během gravidity sice stoupají, ale jenom s minimálním vzestupem aktivity vWF (vWF:RiCo) a s perzistujícím nálezem abnormálních multimerů vWF.
U typu 3 vWD – totální kvantitativní poruchy, dochází jen k minimálnímu nebo žádnému vzestupu FVIII a vWF [1].
V České republice se setkáváme se pacientkami všech podtypů vWD.
Dědičnost von Willebrandovy nemoci
U typu 1 a 2 vWD se jedná o autozomálně dominantní typ dědičnosti. Pravděpodobnost přenosu vWD na děti žen s typem 1 je 50 %, ale jen 33 % dětí je klinicky postižených. Je to způsobeno variabilní penetrací a expresí abnormálních genů.
U typu 3 vWD se jedná o autozomálně recesivní typ dědičnosti, přičemž postižení jedinci jsou homozygoti nebo kombinovaní heterozygoti. Když v rodině již došlo k narození dítěte s vWD typu 3, tak riziko postižení dalšího dítěte je 25 % [1].
Morbus von Willebrand a riziko těhotenských komplikací
Riziko spontánního potratu je v běžné populaci asi 15 %. U pacientek s morbus von Willebrand toto riziko podle Leea [7] stoupá k 21–22 %. Kadir [5] uvádí, že až jedna třetina pacientek s vWD v průběhu těhotenství krvácí z rodidel. V USA byly v roce 2007 uveřejněny výsledky velké studie 4000 porodů pacientek s vWD. Nebylo zjištěno zvýšené riziko intrauterinního odumření plodu, předčasného porodu, intrauterinní růstové restrikce či abrupce placenty. Potvrdilo se však desetkrát vyšší riziko krvácení v průběhu těhotenství a peripartálně [6].
O riziko postpartálního krvácení (PPH) u pacientek s vWD se zajímalo více autorů. Primární PPH (krevní ztráta do dvou hodin po porodu > 500 ml u spontánního vaginálního porodu a > 1000 ml po císařském řezu) lze očekávat u 6 % běžné populace rodiček. U pacientek s vWD lze očekávat primární PPH u 16–29 % [4, 5]. Sekundární PPH (krevní ztráta > 500 ml/24 hodin do konce šestinedělí) lze očekávat u 1,3 % nedělek v běžné populaci. U pacientek s vWD se objevuje u 20–29 % [3, 4, 5].
Léčba v těhotenství a peripartálně
Léčbu řídí ošetřující hematolog.
Pacientky s typem 1 vWD, které dosáhly v III. trimestru normalizace hladin FVIII a vWF nevyžadují žádnou substituční léčbu v průběhu těhotenství ani peripartálně. U pacientek, kde vzestup hladin nebyl dostatečný, je lékem volby DDAVP (Desmopresin). Při jeho nedostupnosti nebo neúčinnosti (klinickou odpověď na DDAVP nutno otestovat předem u každé pacientky) přistupujeme k substituční terapii chybějících faktorů.
U pacientek s typem 2 a 3 vWD je substituční zajištění peripartálně nezbytné. Pokud se objeví krvácivé projevy již v průběhu těhotenství, pak je substituční léčba indikovaná i zde. U nás jsou dostupné plazmatické preparáty, které obsahují jak FVIII, tak i vWF [1].
HEMOFILIE A A HEMOFILIE B
Hemofilie A se vyznačuje absencí nebo nedostatkem faktoru VIII, hemofilie B se vyznačuje absencí nebo nedostatkem faktoru IX.
Dědičnost
Oba typy se přenášejí vadnou alelou na chromozomu X. Jedná se tedy o onemocnění gonozomálně recesivní. Hemofilie obvykle postihuje pouze muže (není příliš pravděpodobné, že by se sešly dvě postižené alely), žena s jednou vadnou alelou je pouze přenašečka. Muži nemohou být přenašeči, jsou buďto nemocní, nebo zdraví.
Ženy mají dva pohlavní chromozomy X, muži jeden X a jeden Y. To znamená, že všechny dcery hemofiliků jsou přenašečky, protože zdědily od otce postižený chromozom X a všichni synové hemofiliků jsou zdraví, protože od otce dědí chromozom Y, na který se chybný gen neváže. U dětí ženy přenašečky mohou nastat vždycky s padesátiprocentní pravděpodobností tyto případy: Může se narodit syn, který dědí od otce zdravý chromozom Y a od matky poškozený chromozom X, je tedy hemofilik. Se stejnou pravděpodobností ovšem může syn od téže matky získat zdravý chromozom X a pak je zdravý. Tím hemofilie v této dědičné linii končí. Narodí-li se dcera, získá od zdravého otce zdravý chromozom X a od matky s padesátiprocentní pravděpodobností poškozený chromozom X, je tedy také přenašečkou. Existuje ovšem padesátiprocentní naděje, že zdědí i od matky zdravý chromozom a pak řada přenašeček a nemocných končí (schéma 1).
Schéma 1 Dědičnost u hemofilie 
Zhruba ve 30 % případů se ale hemofilie objeví ve zdravé rodině, aniž by její výskyt byl zjištěn u předků – tj. mutace se objevuje v rodině „de novo“! V ČR je registrováno kolem 1000 hemofiliků. Incidence hemofilie A je přibližně 1/5000 porodů, incidence hemofilie B je mnohem méně frekventní, asi 1/30 000 porodů [1, 2, 7].
Ženy přenašečky
Porodník, jak vyplývá z výše uvedeného, se setkává s těhotnými ženami-přenašečkami. U drtivé většiny z nich dosahuje hladina FVIII/FIX 50 %. Tato hodnota je dostatečná k zajištění hemostázy, za běžných situací přenašečky hemofilie nekrvácí. V případě, že hladiny FVIII, resp. FIX klesají pod 20 % (což je poměrně vzácné), většinou nedochází ke spontánnímu krvácení, žena je však ohrožená zvýšeným krvácením peripartálně. Během těhotenství krvácí po chirurgických zákrocích, extrakcích zubů, úrazech. V těhotenství jsou tyto ženy ohroženy i spontánním abortem. Mimo graviditu zvýšeně krvácejí při menstruaci.
Management těhotenství přenašečky hemofilie
Hladiny inkriminovaných koagulačních faktorů je vhodné vyšetřit v časné fázi těhotenství a zopakovat po 34. gestačním týdnu. Je třeba mít na paměti, že hladina FVIII v průběhu těhotenství stoupá, tak jako u zdravých těhotných. Krvácení v době porodu nebývá u přenašeček hemofilie A výrazně zvýšené. U přenašeček hemofilie B hladina FIX zůstává po celou dobu gravidity na stejné úrovni.
Substituční terapie je indikována před porodem u těch žen, u kterých hladina FVIII/FIX nedosáhne 50 %. Podávají se přednostně rekombinantní přípravky s obsahem FVIII nebo FIX. Cílová hladina chybějícího faktoru je nad 80 % normy. Délka substituce je individuální, ale doporučuje se tři dny po spontánním nekomplikovaném porodu a pět dnů po císařském řezu. Substituční léčba je indikovaná, je-li třeba, před každým invazivním výkonem.
Všem přenašečkám hemofilie, hlavně v případě, že odmítají dítě s hemofilií, doporučujeme provedení některé z metod prenatální diagnostiky [1, 2, 7]. Snahou je stanovit diagnózu již v průběhu I. trimestru. U hemofilie je nejjednodušší metodou neinvazivní analýza free DNA plodu z krve matky, které s přesností 96 % určí pohlaví plodu.
Z invazivních metod dnes dominuje odběr choriových klků. Amniocentéza by se dnes již neměla používat, protože se provádí až v 15.–18. gestačním týdnu. V IVF centrech se provádí preimplantační diagnostika na blastule na úrovni asi deseti buněk. V České republice se na molekulárně genetické vyšetřování hemofilií specializuje ÚHKT Praha (dr. Hrachovinová). Vyšetření je dostupné pro všechna zdravotnická zařízení. Riziko postižení mužského plodu hemofilií může být na přání matky indikací k přerušení těhotenství. I v dnešní době se setkáváme se ženami, které přes poučení veškeré metody prenatální diagnostiky odmítají.
PRAVIDLA PREKONCEPČNÍ A PRENATÁLNÍ PÉČE U ŽEN S KRVÁCIVOU PORUCHOU
- a) Těhotenství žen s krvácivou poruchou by mělo být plánované.
- b) Těhotenství těchto žen vyžaduje úzkou spolupráci hematologa, gynekologa a peripartálně i neonatologa.
- c) Těhotenství by měla předcházet podrobná krvácivá anamnéza a zvážení profylaktické terapie (krvácení, těžký deficit, zvýšené riziko potratů).
- d) Doporučení některé z metod prenatální diagnostiky (hemofilie A a B).
- e) Monitorování hladin deficitních faktorů na počátku těhotenství a po 34.gestačním týdnu.
- f) Častější UZ kontroly zaměřené na nitrolebeční struktury plodu [1, 2, 7],
VEDENÍ PORODU
- a) Porod by měl být veden v centru s návazností na hemofilické centrum.
- b) Je nezbytné zajistit, aby rodička měla v dostatečném předstihu zajištěno hematologické vyjádření k opatřením k porodu, případně rozpis substituční terapie a léky měla při sobě nebo deponované přímo na porodním sále.
- c) Porod je možné vést vaginální cestou (riziko krvácení u hemofilií je přibližně 3–4 %). Porod by měl být veden šetrně, tj. neměl by být protrahovaný nebo provázený nadměrnými a častými děložními kontrakcemi. Použití vakuum extraktoru je kontraindikované (riziko nitrolebečního krvácení je až 65 %), kleště lze použít jen z vitální indikace plodu. Císařský řez samozřejmě zůstává metodou volby, ale je iluzorní, že představuje pro plod šetrnější metodu (riziko krvácení je 15 %).
- d) Použití některé z metod regionální analgezie (epidurální, spinální) je obecně nevhodné.
- e) Ihned po porodu je nutné provést odběr krve z pupečníku ke stanovení hladiny deficitního faktoru. Není doporučeno provádět tento odběr před porodem intrauterinně.
- f) Být si vědom potenciálně zvýšeného rizika časného i pozdního PPH u matky.
- g) V substituční terapii pokračovat tam, kde je to indikované – po vaginálním porodu tři až pět dnů, po císařském řezu pět až sedm dnů.
- h) Individuálně zvážit antitrombotickou profylaxi. Je celá řada porodnických stavů vyžadujících profylaxi TEN. LMWH není u žen s krvácivou poruchou kontraindikováno. Krvácivý deficit koagulačních faktorů není ochranou před TEN [1, 2, 7].
PÉČE O NOVOROZENCE
U těžkých forem hemofilie (aktivita deficitního faktoru kolem 1 %) lze příznaky u novorozence pozorovat ihned po porodu. Projevuje se krvácením z pupečníku, krvácením do měkkých tkání hlavičky, krvácením do kloubů. Intrakraniální krvácení je spíše raritní (3–4 %). Tito novorozenci vyžadují aplikaci substituční léčby ihned po porodu [1, 2, 7].
VLASTNÍ POZOROVÁNÍ
Pro ilustraci uvádíme kazuistiku, kdy nebyla dodržena pravidla péče o vrozené krvácivé stavy v průběhu těhotenství a porodu a případ skončil pro rodinu tragicky.
Jednalo se o třetí těhotenství ženy s prokázaným přenašečstvím těžké formy hemofilie A (inverze intronu 22). V anamnéze jednou missed abortion, jednou spontánní porod zdravé dcery. Žena byla sledována na hematologické ambulanci v místě bydliště, doporučenou prenatální diagnostiku neabsolvovala.
Porod na žádost matky proběhl v okresní nemocnici v ukončeném 38. gestačním týdnu. Byl spontánní záhlavím. Porozen byl chlapec s porodní hmotností 3350 g a 49 cm. Bezprostřední adaptace po porodu proběhla zcela v normě (Apgar skóre 9–10–10). Novorozenec byl umístěn na pokoj spolu s matkou v systému rooming in, plně kojen, bez neonatálního ikteru. Třetí den po porodu matka hlásí línější pití, doporučen byl dokrm umělou formulí. V nočních hodinách matka pozoruje, že chlapec je nápadně bledý, apatický. Provedly se krevní odběry, po kterých se ve 4 : 45 hodin objevují u chlapce křeče – záškuby pravostranných končetin, opistotonus, anizokorie – mydriáza vpravo, mióza vlevo. Dítě bylo intubováno, podán Luminal, Dormicum a přeloženo bylo na NJIP. UZ CNS prokázal rozsáhlou hyperechogenitu vpravo s přetlakem středových struktur vlevo.
V dopoledních hodinách (10.30 h) byl chlapec přeložen na novorozenecký NJIP FN Motol. Zde pokračuje umělá plicní ventilace, chlapec je oběhově stabilní. Kontrolní UZ potvrzuje ICH do komor vpravo s přetlakem doleva a je kontaktována hematologie.
Hematologické odběry potvrzují deficit FVIII < 1 %, ve 12 : 40 (asi 30 hodin od prvních příznaků !!) podána první substituce FVIII (Advate 250 IU). Hladina FVIII po substituci stoupá na 170 %.V 16 : 00 provedeno CT neurokrania.
Nález je indikací k neurochirurgickému výkonu z vitální indikace. V 18 : 00 h – kraniotomie temporoparietálně vpravo, evakuace hematomu na sále dětské neurochirurgie FN Motol. V 21 : 00 h překlad ze sálu na dětské ARK FN Motol – pokračuje umělá plicní ventilace, komplexní resuscitační péče, pokračuje substituce FVIII (Advate), podávána antiedematózní terapie.
Přes veškerou terapii dochází opět k progresi nitrolebeční hypertenze. Neurochirurg indikuje dekompresní kraniektomii l. dx.
Dvacátý pooperační den je chlapec přeložen na Kliniku dětské hematologie a onkologie FN Motol – spontánně ventiluje, postupně je možné snižovat oxygenoterapii. Dvacátý druhý pooperační den bylo provedeno kontrolní CT CNS se stacionárním nálezem (obr. 2). Čtyři týdny po druhém neurochirurgickém výkonu byl extrahován krátkodobý centrální žilní katétr a ukončena substituce FVIII.
Image 1. CT neurokrania 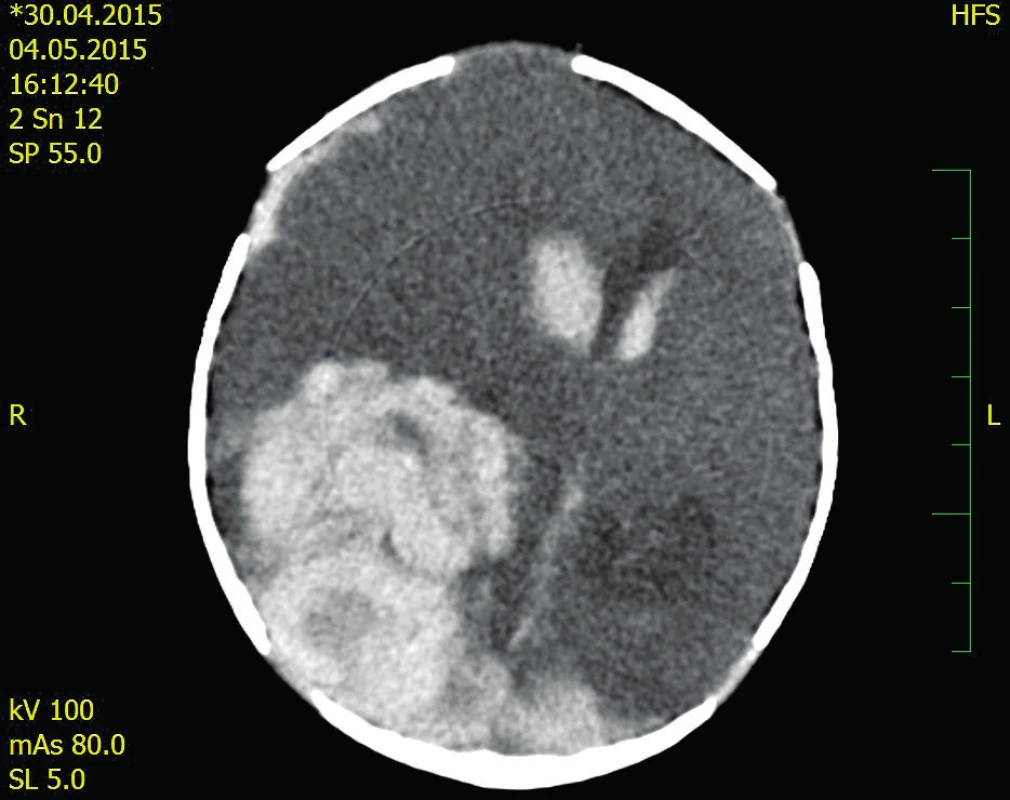
Popis snímku: objemný intraparenchymový hematom parietookcipitálně l.dx s provalením do komor, posun středových struktur 17 mm vlevo, tentoriální konus vpravo. Image 2. Kontrolní CT 22. pooperační den 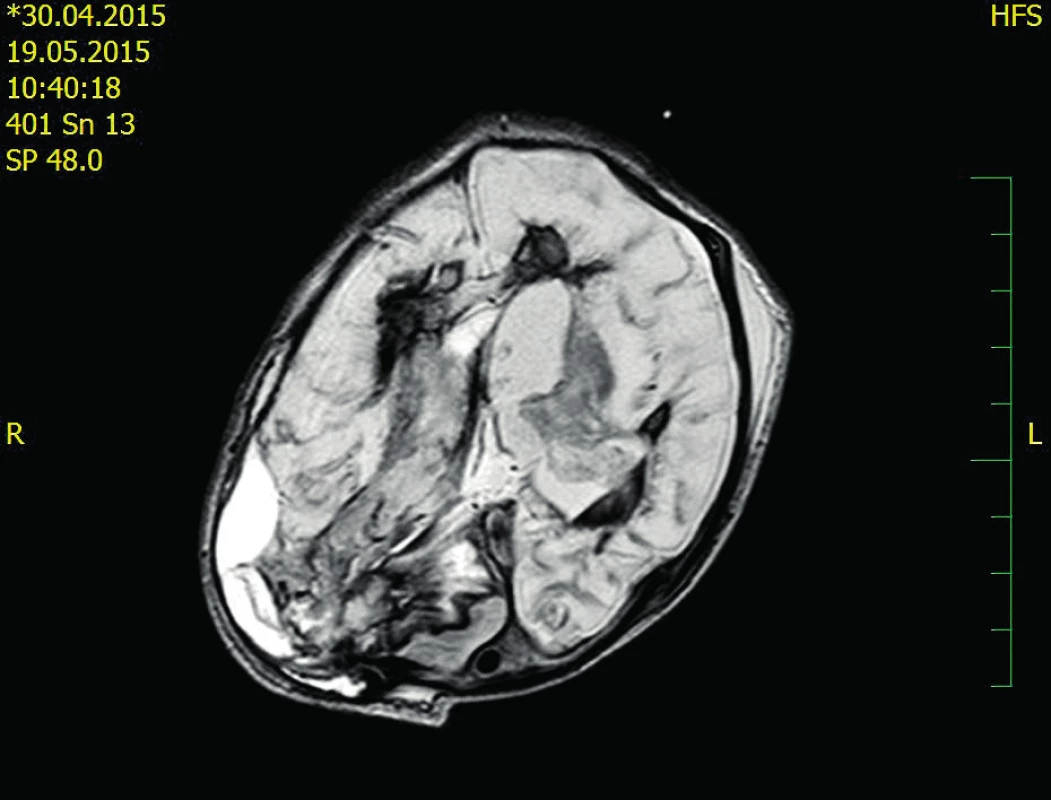
Popis snímku: rozsáhlé malatické v.s. postischemické změny bilat., bez čerstvého krvácení, bez rozvoje hydrocefalu. Neurologický nález v šesti měsících života: sekundární záchvatové onemocnění, terapie – fenobarbital, PMR na úrovni I. trimenonu. EEG: hrubě abnormální plochá areaktivní aktivita, bez epileptiformních projevů.
Mikroencefalie, na oslovení nereaguje, na zvukový podnět se leká, krátce zafixuje na pohyb v zorném poli nebo na kontrastní bíločerný obrázek, na svit baterky nereaguje. Zornice izokorické, fotoreakce sym. +/+, hypomimie. Nabídnutý dudlík dumlá, spontánní motorika nízká, kvadruhypertonie, refl. C5C7 a L2S2 vysoké polykinetické, PJI – Babinski a Siccard bilat., váznou úchopy bilaterálně. Při manipulaci dráždivý, tendence k opistotonu.
Závěr: mikroencefalie, centrální spastická kvadruparéza s levostrannou převahou, těžká PMR na úrovni patologického novorozence!
ZÁVĚR
Těhotenství žen s vrozenou krvácivou chorobou je rizikové a vyžaduje od počátku úzkou multidisciplinární spolupráci hematologa a porodníka. Ženy by měly být s možnými riziky, které jejich choroba pro ně samotné či jejich potomky představuje, obeznámeny, a to nejlépe ještě před plánovou koncepcí. Přenašečkám hemofilie nabídneme vždy některou z metod prenatální diagnostiky. Porod by měl být veden na pracovišti s návazností na hemofilické centrum. Jen tak je možné stanovit hladinu deficitního faktoru u novorozence ihned po porodu a případnou substituci zahájit neodkladně. Prodlení, jak ukazuje kazuistika, může vést k fatálnímu poškození novorozence.
Doc. MUDr. Tomáš Binder, CSc.
Sociální péče 3316/12a
400 11 Ústí nad Labem
e-mail: BinderT@seznam.cz
Sources
1. Dunkley, SM., Russell, SJ., Rowell, JA., et al. A consensus statement on the management of pregnancy and delivery in women who are carriers of or have bleeding disorders. Med J Aust, 2009, 19, 191(8), p. 460–463.
2. Huq, FY., Kadir, RA. Management of pregnancy, labour and delivery in women with inherited bleeding disorders. Haemophilia, 201, 17, Suppl. 1, p. 20–30.
3. Chee, YL., Townend, J., Crowther, M., et al. Assessment of von Willebrand disease as a risk factor for primary postpartum haemorrhage. Haemophilia, 2012, 18, p. 593–597.
4. James, AH., Jamison, MG. Bleeding events and other complications during pregnancy and childbirth in women with von Willebrand disease. J Thromb Haemost, 2007, 5(6), p. 1165–1169.
5. Kadir, RA., Lee, CA., Sabin, CA., et al. Pregnancy in women with von Willebrand‘s disease or factor XI deficiency. Br J Obstet Gynaecol, 1998, 105(3), p. 314–321.
6. Kujovich, JL. von Willebrand disease and pregnancy. J Thromb Haemost, 2005, 3(2), p. 246–53. Review.
7. Lee, C., Kessler, C., Makris, M., Gough, S. Hemophylia, 2011, 17(1), p. 1365–2516.
Labels
Paediatric gynaecology Gynaecology and obstetrics Reproduction medicine
Article was published inCzech Gynaecology

2016 Issue 6-
All articles in this issue
- Současné možnosti preimplantačního genetického screeningu a preimplantační genetické diagnostiky
- Mutace v genech ovlivňujících plodnost mužů – současná rutinní laboratorní genetická diagnostika a hledání dalších úseků DNA a genů, ovlivňujících spermatogenezi
- Význam trifolátů u gynekologických onemocnění
- Možnosti užití selektivních modulátorů progesteronových receptorů v léčbě děložních myomů
- Sarkoidóza ženského pohlavního ústrojí
- Samovyšetření prsu. Ano, či ne?
- Celiakia ako možná príčina niektorých gynekologicko-pôrodníckych ochorení
- Incidence císařského řezu a úspěšnost vaginálně vedeného porodu u těhotných po myomektomii
- Ektopická gravidita v jizvě po císařském řezu
- Gravidita u pacientek s vrozenou krvácivou chorobou
- Cervix skóre dle Bishopa a jeho modifikace
- Nekrotizující fasciitida laterální svalové skupiny stehna jako pozdní komplikace inzerce tahuprosté transobturátorové pásky
- Czech Gynaecology
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Cervix skóre dle Bishopa a jeho modifikace
- Ektopická gravidita v jizvě po císařském řezu
- Samovyšetření prsu. Ano, či ne?
- Celiakia ako možná príčina niektorých gynekologicko-pôrodníckych ochorení
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

