-
Medical journals
- Career
Efekt hormonálnej liečby hyperandrogénneho syndrómu
Authors: J. Višňovský 1; K. Biringer 1; I. Švecová 1; Z. Biringerová 2
Authors‘ workplace: Gynekologicko-pôrodnícka klinika JLF UK, Martin, Slovensko, prednosta prof. MUDr. J. Danko, CSc. 1; Klinika anesteziológie a intenzívnej medicíny JLF UK, Martin, Slovensko, prednosta doc. MUDr. B. Sániová, CSc. 2
Published in: Ceska Gynekol 2010; 75(5): 481-485
Overview
Cieľ štúdie:
Zhodnotiť efektivitu hormonálnej liečby hyperandrogénneho syndrómu (HAS).Typ štúdie:
Prospektívna randomizovaná štúdia.Názov a sídlo pracoviska:
Gynekologicko-pôrodnícka klinika, Jesseniova lekárska fakulta, Univerzita Komenského, Martin, Slovenská republika.Metodika:
U 90 pacientok so známkami HAS sme hodnotili efekt ročnej hormonálnej liečby na menštruačný cyklus (MC), klinické známky HAS a ultrazvukový (UZ) nález. Pacientky sme náhodne rozdelili do troch skupín po 30 žien: A – 35 μg etinylestradiolu (EE) s 2,0 mg cyproterón acetátu/deň; B – 30 μg EE s 2,0 mg dienogestu/deň; C – 30 μg EE s 3,0 mg drospirenonu/deň.Výsledky:
Vo všetkých skupinách došlo už počas prvých 6 mesiacov k pozitívnemu ovplyvneniu pravidelnosti MC (p<0,001). Známky hirzutizmu, virilizácie a UZ prejav HAS boli signifikantne zlepšené v skupine A.Záver:
V našej štúdii sa najefektívnejšou metódou hormonálnej liečby HAS ukázala kombinácia 35 μg EE s 2,0 mg cyproterón acetátu/deň.Kľúčové slová:
hyperandrogénny syndróm, HAS, PCOS, menštruačné krvácanie, ultrazvuk.ÚVOD
Jedným z najčastejších endokrinných ochorení žien vo fertilnom veku je hyperandrogénny syndróm (HAS, syndróm polycystických ovárií - PCOS, Steinov-Leventhalov syndróm). Vyskytuje sa u 3-7 % ženskej populácie a až u 75 % žien s nepravidelným menštruačným cyklom [4]. Charakterizovaný je eleváciou koncentrácie luteinizačného hormónu (LH), pomeru luteinizačného hormónu k folikulostimulačnému hormónu (LH/FSH) a koncentrácie androgénov. Prejavuje sa chronickou anovuláciou, hyperandrogenizmom, hirzutizmom, inzulínovou rezistenciou. Definícia a aktuálne diagnostické kritériá boli prijaté v roku 2003.
Morfologický obraz zahŕňa bilaterálne zväčšený objem ovárií (12-22 cm3) s výskytom minimálne desiatich drobných folikulov o priemere 2-8 mm najmä v kortexe ovárií [5]. Etiopatogenéza ochorenia nie je doposiaľ úplne jasná. Existuje niekoľko teórií vzniku HAS: tzv. top-down (zmeny neuroendokrinnej regulácie, najmä pulzného výdaja gonadotropin releasing hormónu - GnRH); tzv. bottom-up (primárna porucha v ováriách); tzv. androgénová (porucha regulácie steroidogenézy medzi ováriom a nadobličkou) a tzv. inzulínová (porucha metabolizmu inzulínu - fosforylácie inzulínových receptorov). Dodnes nie je dokázaný genetický podklad PCOS, vie sa iba, že sa prenáša autozómovo dominantne [7, 8, 10].
SÚBOR A METODIKA
Štúdia po schválení Etickou komisiou prebiehala na Gynekologicko-pôrodníckej klinike Jesseniovej lekárskej fakulty Univerzity Komenského v Martine od marca 2003 do apríla 2005. Pacientky boli zaradené po podpísaní informovaného súhlasu. Vstupné kritériá: vek 18–30 rokov, sterilita pacientky, nuligravidita, prítomnosť aspoň dvoch patognomických kritérií PCOS (oligo/anovulácia, resp. oligo/amenorrhoe - pozitívny hormonálny profil alebo trvanie menštruačného cyklu 35–90 dní, resp. neprítomnosť menštruácie >90 dní; klinické a/alebo biochemické známky hyperandrogenizmu - hirzutizmus a virilizácia na 3 predilekčných miestach (pery, brada, podbruško a vonkajšie rodidlá), resp. hladina testosterónu >0,65 nmol/l; polycystické ováriá v sonografickom obraze (aspoň na jednom ováriu početné folikuly veľkosti 6-9 mm, v počte >12, bez prítomnosti dominantného folikulu, alebo zväčšený objem ovárií nad 10 %). Vylučovacie kritériá: konkomitantné endokrinologické ochorenie; všeobecné kontraindikácie hormonálnej terapie; neúplné hormonálne vyšetrenie a dysfunkčné krvácanie.
Do štúdie sme na základe zvolených kritérií zaradili 90 žien, stupeň závažnosti HAS bol hodnotený subjektívne - žiadny, mierny, stredný a závažný. Hormonálny profil bol realizovaný RIA metódou a zahrňoval vyšetrenie koncentrácií estradiolu, progesterónu, testosterónu, prolaktínu, LH, FSH, trijódtyronínu (T3), tyroxínu (T4) a tyreotropínu (TSH) na 8., 9., alebo 10. deň cyklu; v polovici cyklu a následne o 10 až 12 dní po druhom odbere, najskôr však 10 dní pred očakávaným termínom menštruácie. Referenčné hodnoty uvádzame v tabuľke 1. Sonografické (UZ) vyšetrenie sme vykonali trikrát počas cyklu, vždy v deň hormonálnych odberov, ALOKA 5000 s 5 MHz transvaginálnou sondou.
Table 1. Referenčné hodnoty vyšetrovaných hormónov 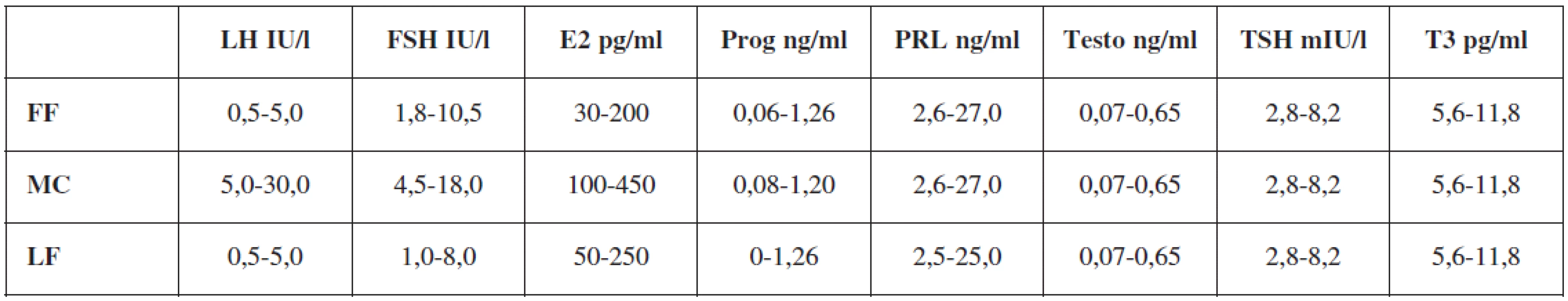
Legenda: FF - folikulárna fáza, MC - stred cyklu, LF - luteálna fáza, LH – luteinizačný hormón, FSH - folikulostimulačný hormón, E2 - estradiol, Prog - progesterón, Testo -testosterón, TSH - tyreotropný hormón, T3 - trijódtyronín Pacientky sme rozdelili náhodným výberom do troch skupín po 30 žien. Jednotlivé skupiny sa líšili podľa aplikovanej hormonálnej liečby - perorálna dávka v skupine A bola 35 μg a v skupinách B a C bola 30 μg etinylestradiolu (EE). Gestagénna zložka bola odlišná - v skupine A: cyproterón acetát (CPA) 2,0 mg/deň, v skupine B: dienogest (DNG) 2,0 mg/deň a v skupine C: drospirenon (DRSP) 3,0 mg/deň. U všetkých pacientok trvala liečba v nezmenenom režime jeden rok. V polovici terapie, bezprostredne po ukončení liečby a následne po pol roku po ukončení liečby boli znovu realizované klinické a UZ vyšetrenia ako na začiatku terapie.
Hodnotili sme pravidelnosť a charakter menštruačného cyklu (MC), efekt liečby na klinické známky hyperandrogenizmu, charakter UZ nálezov u pacientok v priebehu a po skončení liečby. Výsledky boli štatisticky spracované a vyhodnotené štatistickým programom Medcalc, verzia 2002. Použili sme testy ANOVA, Študentov t-test a χ2 test. Za hladinu významnosti bola stanovená hodnota p<0,05.
VÝSLEDKY
Do štúdie sme po podpísaní písomného informovaného súhlasu zaradili celkovo 90 žien spĺňajúcich vstupné podmienky. Priemerný vek pacientok bol 25,3 +/ - 4,2 roka. Oligomenorrhoe bolo prítomné u 82 pacientok, hirzutizmus u 54, UZ obraz PCOS u 81 a pozitívny hormonálny profil u 65 pacientok. Jednotlivé skupiny sa navzájom štatisticky signifikantne nelíšili z hľadiska veku, nepravidelnosti menštruačného cyklu, klinických známok hirzutizmu, hodnôt hormonálnych parametrov a UZ markerov PCOS (tab. 2).
Table 2. Charakteristika jednotlivých sledovaných skupín 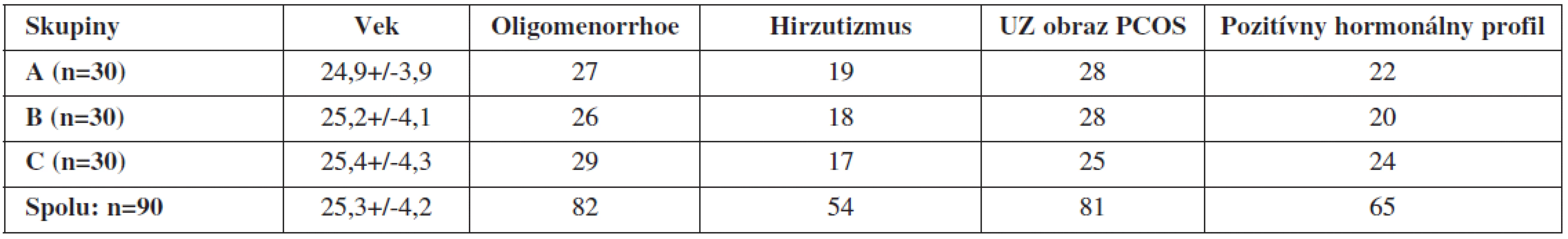
Už počas prvého polroku liečby došlo vo všetkých skupinách k výraznému pozitívnemu ovplyvneniu pravidelnosti menštruačného cyklu (χ2 : p<0,001). Po jej vysadení došlo k miernemu, ale nesignifikantnému vzostupu nepravidelnosti cyklu (tab. 3), avšak bez rozdielov medzi skupinami. Úprava cyklu teda nezávisela od druhu použitej hormonálnej terapie.
Table 3. Vplyv hormonálnej terapie na nepravidelnosť menštruačného cyklu 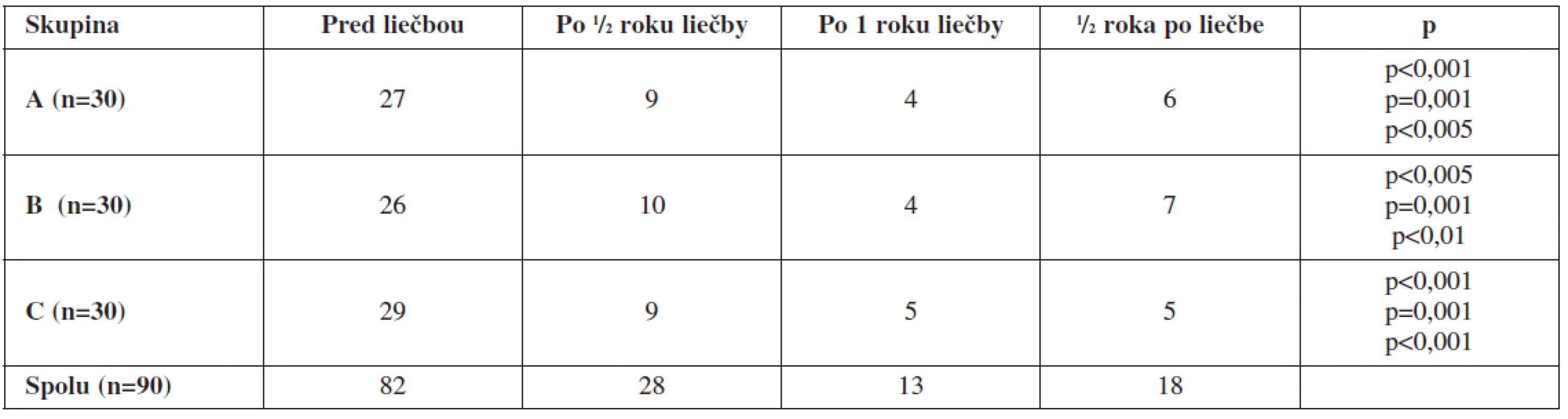
Známky hirzutizmu a virilizácie boli signifikantne zredukované pri a po liečbe v skupine A, kým v skupinách B a C bol efekt liečby len minimálny (tab. 4).
Table 4. Vplyv hormonálnej terapie na prítomnosť známok hirzutizmu/virilizácie 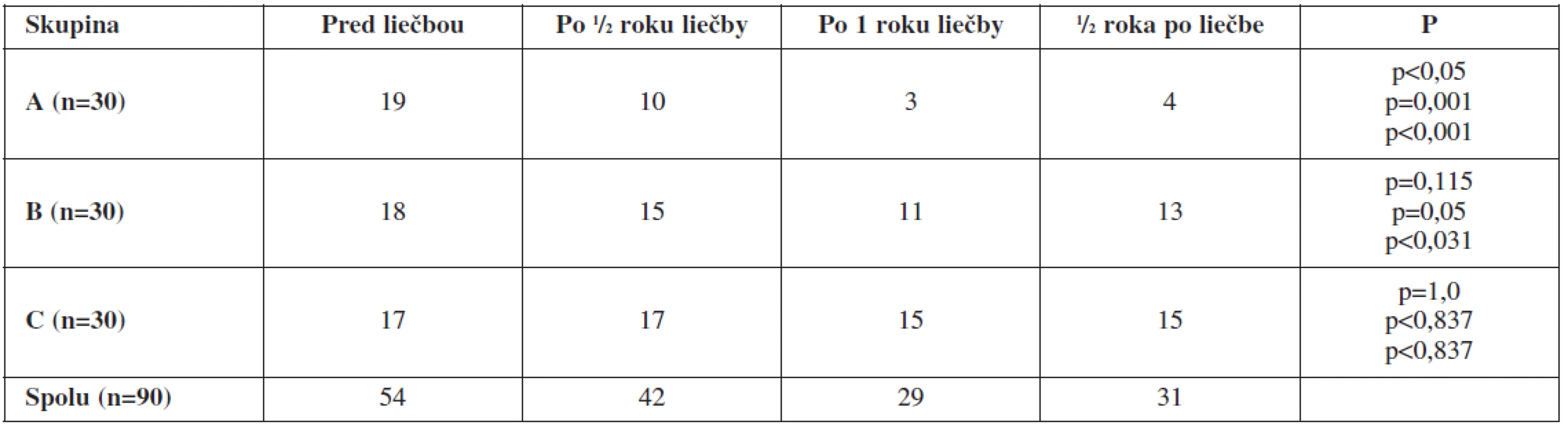
Jednoznačný pozitívny efekt hormonálnej liečby na UZ známky PCOS sme zaznamenali v skupine A, ktorý navyše pretrvával aj pol roka po liečbe. V skupine B liečba iba minimálne ovplyvnila UZ prejavy PCOS a v skupine C bola takmer bez efektu (tab. 5). Sumarizáciu efektivity rôznych druhov hormonálnej liečby pri jej jednoročnom kontinuálnom podávaní uvádzame v tab.6.
Table 5. Vplyv hormonálnej terapie na zmeny UZ známok PCOS 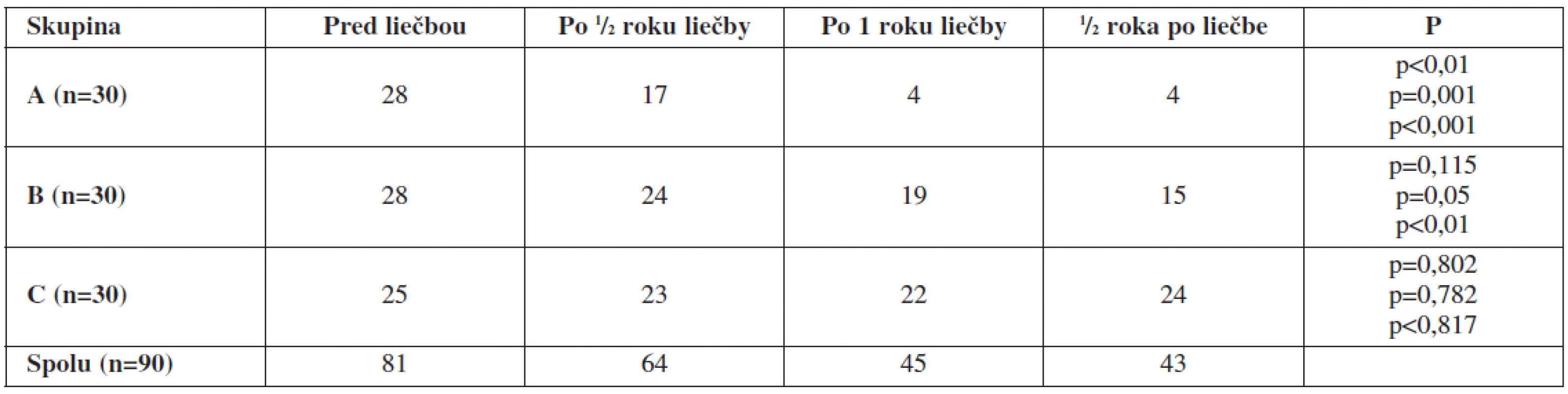
Table 6. Efektivita hormonálnej liečby po jednom roku kontinuálneho podávania 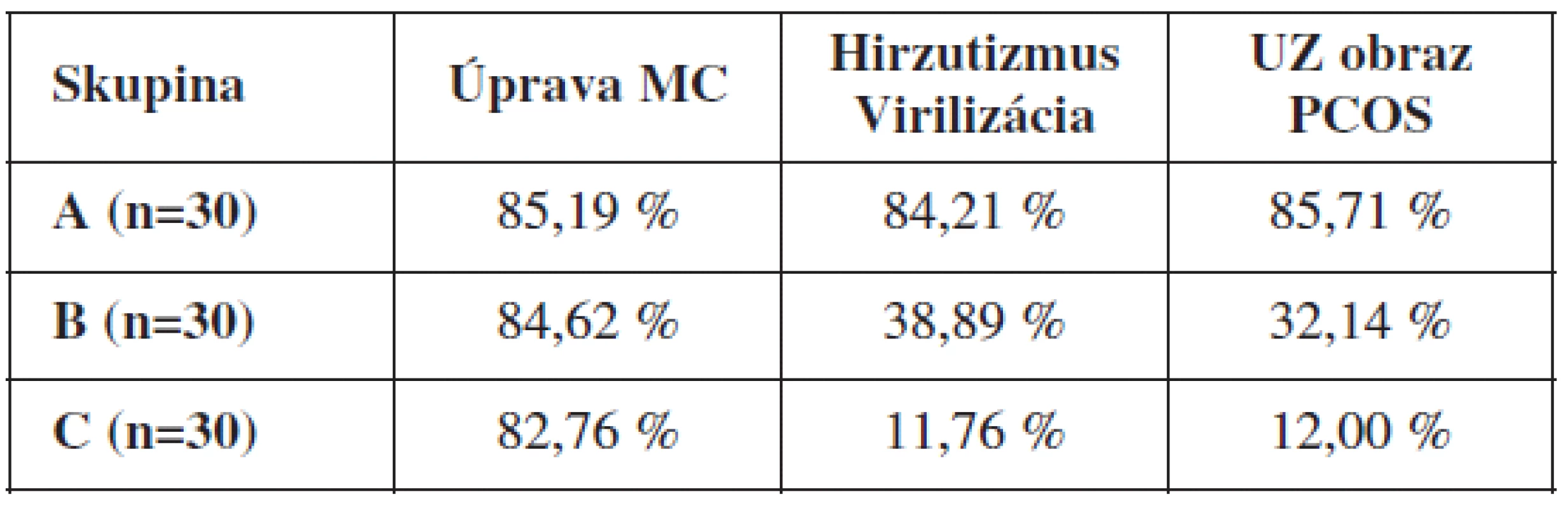
DISKUZIA
PCOS celosvetovo postihuje cca 105 miliónov žien. Klinicky ide o heterogénnu poruchu charakterizovanú excesom androgénov, čo neuľahčuje ani jej diagnostiku, klasifikáciu a liečbu. Primárnymi aspektmi liečby PCOS sú poruchy menštruačného cyklu (oligo/amenorrhoe), prejavy hyperandrogenizmu (hirzutizmus, virilizácia) a metabolické poruchy (inzulínová rezistencia). Hirzutizmus býva prítomný až u 75 % žien s PCOS [1]. Jeho liečbu zabezpečujú najmä kontraceptíva s antiandrogénnym účinkom. Hyperandrogenizmus možno ovplyvniť tiež orálnymi kontraceptívami (COC), avšak výhodnejšou sa javí ich kombinácia s metformínom [11].
Hlavným, dobre známym mechanizmom účinku COC je inhibícia folikulogenézy. Ďalšími miestami účinku sú: zníženie množstva cirkulujúceho albumínu, pokles dehydroepiandrosterón sulfátu (DHEAS), zníženie sekrécie androgénov, inhibícia kožnej 5α-reduktázy s poklesom dihydrotestosterónu. Estrogénny komponent COC zvyšuje pečeňovú produkciu sex hormone-binding globulínu (SHBG), čo znižuje koncentráciu voľného testosterónu a jeho biologickú dostupnosť.
Kritériá použitia COC v liečbe PCOS nie sú v súčasnosti presne dané. Voľba vhodného preparátu závisí od viacerých faktorov. Na jednej strane to sú vstupné klinické dáta (manifestácia PCOS) a tolerancia COC pacientkou, na druhej strane to je výber vhodného estrogénového (v súčasnosti dominantne EE) a najmä progestínového komponentu COC, ako aj ich dávok.
Cyproterón acetát (CPA) má progestogénny, signifikantný antiandrogénny a slabý antiglukokortikoidný efekt. Inhibuje produkciu LH a následne ovariálnu sekréciu androgénov. Kombinácia antiandrogénne pôsobiaceho CPA s EE má dokázanú efektivitu pri prejavoch PCOS – hyperandrogenizme a abnormalitách menštruačného cyklu. Na vedľajšie účinky tejto terapie existujú kontroverzné názory, avšak pri dodržaní pravidiel lege artis je možné im predchádzať. Navyše venózny tromboembolizmus u nej nebýva častejší než u orálnych kontraceptív tretej generácie [6]. Aj naše výsledky potvrdzujú uvedené skutočnosti. Z literárnych údajov sa zdá, že ešte výhodnejšou kombináciou pri PCOS je pridanie metformínu k dlhodobej hormonálnej liečbe pomocou CPA a EE. To vedie k zníženiu koncentrácií zápalových markerov a adhezívnych molekúl (soluble intercellular adhesion molecule-1 - sICAM-1, soluble vascular cell adhesion molecule-1 - sVCAM-1), čo znižuje celkové riziko aterosklerózy a chronického zápalu [3].
Dienogest (DNG) je progestín s antiandrogénnym efektom napriek čiastočnej androgénnej aktivite, má silnú progestogénnu, slabú estrogénnu a antiestrogénnu aktivitu a slabý antigonadotropný efekt, nemá antimineralokortikoidnú aktivitu. Ide o tzv. hybridný progestín kombinujúci výhody progesterónu a 19-nortestosterónových derivátov. Namiesto 17α-etinylovej skupiny obsahuje skupinu 17α - kyanometylovú. DNG je vysoko selektívny pre progesterónový receptor (PR), avšak jeho afinita je <10 % v porovnaní s progesterónom. Relatívna väzobná aktivita je pre PR 5 %, pre estrogénový receptor 0 %, pre androgénový receptor 10 %, pre glukokortikoidový receptor 1 % a pre mineralokortikoidový receptor 0 % (pre samotný progesterón to je 60 % - 0 % - 0 % - 10 % - 100 % a pre CPA 90 % - 0 % - (6-21) % - 6 % - 8 %). Antiandrogénna aktivita DNG dosahuje cca 1/3 aktivity CPA [17]. DNG inhibuje aktivitu kožnej 5α‑reduktázy, čím sa stáva vhodným preparátom na potlačenie symptómov hyperandrogenizmu [16]. U 2/3 z 16087 pacientok zlepšil stav kože a vlasov. Tento jeho efekt je podobný CPA [18]. V 90 % zlepšuje stredne ťažký a ťažký a v 25 % mierny hirzutizmus [13]. DNG preukazuje dobrú kontrolu cyklu: amenorrhoe u 3 %, spotting u 5 % pacientok, avšak pri dlhšom užívaní tieto parametre ešte klesajú. Zároveň znižuje výskyt dysmenorrhoe z 29 % na 5 % [13]. DNG je rovnako efektívny v liečbe mierneho a stredne ťažkého akné ako CPA (91,9 % vs. 90,2 %) [15]. V našej štúdii prejavil DNG výborné výsledky v zmysle kontroly menštruačného cyklu (84,62 %), avšak v potlačení prejavov hirzutizmu a UZ obrazu PCOS nebol tak efektívny ako CPA (38,89 % vs. 84,21 % a 32,14 % vs. 85,71 %).
Drospirenon (DRSP) má spomedzi progestínov výnimočné postavenie kombinujúc mineralokortikoidný a antiandrogénny efekt. Štrukturálne a funkčne je analogický spironolaktónu – antagonistovi aldosterónu, čím znižuje nepriaznivé účinky estrogénov. Nemá androgénny, estrogénny, glukokortikoidový, ani antiglukokortikoidový účinok. DRSP znižuje koncentrácie testosterónu, vedie k elevácii SHBG. Tým eliminuje prejavy hyperandrogenizmu pri PCOS [12]. Podľa niektorých štúdií má lepší efekt v liečbe hyperandrogenizmu než 17α-hydroxyprogesterónové deriváty [9]. Pravidelné užívanie antikonceptív s obsahom drospirenónu zabezpečuje dobrú kontrolu menštruačného cyklu a znižuje výskyt akné, ale až u 70 % pacientok nemá vplyv na prítomnosť hirzutizmu [14]. V inej štúdii autori uvádzajú viac ako 50% úspešnosť v znižovaní stupňa závažnosti hirzutizmu pomocou drospirenónu, čo ale nevedie k jeho úplnej eliminácii [9]. Úspešnosť liečby po 6 mesiacoch na úrovni 67 % a po 12 mesiacoch v 78 % prípadov uvádzajú Batukan a Muderris [2]. Ide najmä o predilekčné miesta: hrudník a brucho, následne horná pera a brada. Najnižšia účinnosť je na chrbte a ramenách [2]. Sledovanie pacientok v našej štúdii síce potvrdilo vynikajúci vplyv DRSP na pravidelnosť cyklu (82,76 %), avšak jeho efektivita pri eliminácii prejavov hyperandrogenizmu a UZ obrazu PCOS po jednoročnom užívaní bola len na úrovni cca 12 %.
ZÁVER
Jedným z najčastejších endokrinných ochorení žien vo fertilnom veku je hyperandrogénny syndróm. Prejavuje sa chronickou anovuláciou, hyperandrogenizmom, hirzutizmom, inzulínovou rezistenciou. Jeho liečbu zabezpečujú najmä kontraceptíva s antiandrogénnym účinkom. V našej štúdii sa ako najefektívnejšia metóda liečby PCOS pomocou COC ukázala kombinácia 35μg EE s 2,0 mg CPA/deň. Menej efektívnou, najmä voči klinickým prejavom PCOS i voči zlepšeniu UZ obrazu PCOS sa javí kombinácia 30 μg EE s 2,0 mg DNG/deň. COC v podobe 30 μg EE s 3,0mg DRSP/deň bola najmenej účinná, význam mala len v kontrole menštruačného cyklu.
Táto publikácia vznikla s podporou ERDF – Európskeho fondu regionálneho rozvoja v rámci činnosti Centra excelentnosti pre perinatologický výskum.
Doc. MUDr. Jozef Višňovský, CSc.
Gynekologicko-pôrodnícka klinika
JLF UK a MFN
Kollárova 2
036 01 Martin
Slovenská republika
e-mail: visnovsky@jfmed.uniba.sk
Sources
1. Azziz, R., Woods, K.S., Reyna, R., et al. The prevalence and features of the polycystic ovary syndrome in an unselected population. J Clin Endocrinol Metab, 2004, 89, p. 2745–2749.
2. Batukan, C., Muderris, I.I. Efficacy of a new oral contraceptive containing drospirenone and ethinyl estradiol in the long-term treatment of hirsutism. Fertil Steril, 2006, 85, 2, p. 436-440.
3. Bilgir, O., Kebapcilar, L., Taner, C., et al. The effect of ethinylestradiol (EE)/cyproterone acetate (CA) and EE/CA plus metformin treatment on adhesion molecules in cases with polycystic ovary syndrome (PCOS). Inter Med, 2009, 48, p. 1193-1199.
4. Cibula, D., Hill, M., Vohradníková, O., et al. The role of androgens in determining acne severity in adult women. Br J Dermatol, 2000, 53, p. 78-91.
5. Cibula, D., Živný, J., Stárka, L. Syndrom polycystických ovarií. Aktuální endokrinologie. Praha: Maxdorf, 1999,126 s.
6. Franks, S., Layton, A., Glasier, A. Cyproterone acetate/ethinyl estradiol for acne and hirsutism: time to revise prescribing policy. Human Reproduction, 2008, 23, 2, p. 231–232.
7. Franks, S. Adult polycystic ovary syndrome begins in childhood. Best Pract Clin Endocrin Metab, 2002, 32, 1, p. 71-75.
8. Gandar, R., Spizzo, M., Collin, D. Diagnostic at treatment du syndrome des ovaries polycystigues. J Gynekol Obstet Biol Reprod (Paris), 1999, 28, 6, p. 510-518.
9. Guido, M., Romualdi, D., Giuliani, M., et al. Drospirenone for the treatment of hirsute women with polycystic ovary syndrome: a clinical, endocrinological, metabolic pilot study. J Clin Endocrinol Metab, 2004, 89, 6, p. 2817-2823.
10. Kidson, W. Polycystic ovary syndrome: a new direction in treatment. Human Reprod Update, 1996, 8, p. 231-241.
11. Lobo, RA. Choice of treatment for women with polycystic ovary syndrome. Fertil Steril, 2006, 86, Suppl. 1, p. S22–S23.
12. Mathur, R., Levin, O., Azziz, R. Use of ethinylestradiol/drospirenone combination in patients with the polycystic ovary syndrome. Ther Clin Risk Manag, 2008, 4, 2, p. 487-492.
13. Moore, C., Walter, F., Mellinger, U., et al. Multicentre study on contraceptive safety, cycle control and tolerance of MP 2000 Micropille: an interim report. In: Teichmann, AT., ed. Dienogest: Präklinik und Klinik eines Gestagens. 2nd ed. Berlin: Walter de Gruyter, 1995, S. 203-212.
14. Palep-Singh, M., Mook, K., Barth, J., Balen, A. An observational study of Yasmin in the management of women with polycystic ovary syndrome. J Fam Plann Reprod Health Care, 2004, 30, 3, p. 163-165.
15. Palombo-Kinne, E., Schellschmidt, I., Schumacher, U., Gräser, T. Efficacy of a combined oral contraceptive containing 0.030 mg ethinylestradiol/2 mg dienogest for the treatment of papulopustular acne in comparison with placebo and 0.035 mg ethinylestradiol/2 mg cyproterone acetate. Contraception, 2009, 79, 4, p. 282-289.
16. Rabe, T., Kowald, A., Ortmann, J., Rehberger-Schneider, S. Inhibition of skin 5 alpha-reductase by oral contraceptive progestins in vitro. Gynecol Endocrinol, 2000, 14, 4, p. 223-230.
17. Raudrant, D., Rabe, T. Progestogens with antiandrogenic properties. Drugs, 2003, 63, 5, p. 463-492.
18. Zimmermann, T., Dietrich, H., Wisser, KH., et al. Efficacy and tolerability of the dienogest-containing oral contraceptive Valette (R); results of a postmarketing surveillance study. Drugs Today, 1999, 35, Suppl C, p. 79-87.
Labels
Paediatric gynaecology Gynaecology and obstetrics Reproduction medicine
Article was published inCzech Gynaecology

2010 Issue 5-
All articles in this issue
- Porodnické kleště – překonaná porodnická technika?
- Vakuumextrakce
- Léze periferních nervů v porodnictví a gynekologii. Přehled
- Analýza děložních ruptur v kraji Vysočina v pětiletém období
- Streptokoky skupiny B v perinatológii
- Analýza souboru rodiček s asthma bronchiale
- Možnosti stanovení fetomaternální hemoragie
- Laboratorní a klinické ukazatele stavu novorozence po porodu
- Změny incidence postižení vývoje u dětí s velmi nízkou a extrémně nízkou porodní hmotností ve 24 měsících korigovaného věku, narozených v letech 1997–2007
- Psychosociální intervence při porodu mrtvého plodu v historii a dnes
- Rekurentný spontánny ovariálny hyperstimulačný syndróm
- Bezpečnost TVT-O z anatomického pohledu
- Roční zkušenost s léčbou závažného PMS/PMDD hormonální antikoncepcí s drospirenonem v ambulantní praxi
- Efekt hormonálnej liečby hyperandrogénneho syndrómu
- Czech Gynaecology
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Laboratorní a klinické ukazatele stavu novorozence po porodu
- Vakuumextrakce
- Léze periferních nervů v porodnictví a gynekologii. Přehled
- Roční zkušenost s léčbou závažného PMS/PMDD hormonální antikoncepcí s drospirenonem v ambulantní praxi
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career


