-
Medical journals
- Career
Srovnání histopatologických a klinických prognostických faktorů spinocelulárních karcinomů ústní dutiny
Authors: J. Michálek 1; R. Pink 2; Z. Dvořák 2,3; S. Brychtová 1; D. Král 2; P. Tvrdý 2; Z. Kolář 1
Authors‘ workplace: Ústav klinické a molekulární patologie, Lékařská fakulta Univerzity Palackého a Fakultní nemocnice, Olomouc 1; Klinika ústní, čelistní a obličejové chirurgie, Lékařská fakulta Univerzity Palackého a Fakultní nemocnice, Olomouc 2; Klinika plastické a estetické chirurgie, Lékařská fakulta Masarykovy univerzity a Fakultní nemocnice u sv. 3
Published in: Česká stomatologie / Praktické zubní lékařství, ročník 119, 2019, 3, s. 68-79
Category: Original articles
Overview
Úvod: Nádory ústní dutiny jsou v současné onkologii nezanedbatelnou složkou nádorových onemocnění, jejich incidence v posledních letech trvale narůstá. K nejdůležitějším histopatologickým faktorům ovlivňujícím léčbu a prognózu orálních spinocelulárních karcinomů patří lokalizace, velikost, hloubka invaze, histologický typ, stupeň diferenciace tumoru, intravaskulární a perineurální invaze, pozitivita resekčních okrajů a vzdálenost nádoru od okrajů, metastázy v regionálních lymfatických uzlinách a extrakapsulární šíření, invaze a typ invaze do kosti.
Cílem práce je posoudit na souboru pacientů operovaných pro spinocelulární karcinomy ústní dutiny korelaci vybraných histopatologických a klinicko-patologických parametrů se stadiem nádorového onemocnění.
Metody: Soubor tvořilo 42 pacientů (33 mužů a devět žen) operovaných v letech 2005–2015 pro spinocelulární karcinomy ústní dutiny, u kterých byla následně provedena i rekonstrukční fáze operace. Histologické vzorky resekátů byly odečítány prospektivně (po roce 2013), popřípadě šlo o revizi nálezů s doplněním chybějících histopatologických údajů u biopsií před rokem 2013. Hodnoty jednotlivých klinických a patologických ukazatelů onemocnění byly analyzovány metodami deskriptivní statistiky a jejich korelace porovnávány Pearsonovým χ2 testem (Statistica 12, StatSoft), hodnoty p < 0,05 byly považovány za statisticky signifikantní.
Výsledky: Nejčastější lokalizace nádorů byla na spodině ústní dutiny a jazyka, s přechodem na alveolární výběžek dolní čelisti. U 26 % pacientů bylo léčení zahájeno ve II. stadiu onemocnění, u 19 % ve III. stadiu a u 55 % ve IV. stadiu. Se zvyšujícím se stadiem onemocnění stoupá četnost uzlinových metastáz (p = 0,00004), extrakapsulární šíření nádoru (p = 0,004), maximální hloubka invaze (průměrně od 8 mm ve II. stadiu, přes 9,4 mm ve III. stadiu až po 17 mm ve IV. stadiu), četnost nízké diferenciace nádorů (p = 0,001), výskyt recidiv (p = 0,039) a úmrtnost (p = 0,003). Ve třetím a čtvrtém stadiu onemocnění byl dále zaznamenán trend nárůstu frekvence perineurálního šíření nádorových buněk (p = 0,07). Lokální recidiva nádoru, v naprosté většině případů spojená s předchozím pozitivním resekčním okrajem, je u pacientů ve IV. stadiu onemocnění až v 92,85 % případů asociována s úmrtím na nádorové onemocnění.
Závěr: V onkologii nádorů ústní dutiny je důležitá těsná spolupráce všech odborníků podílejících se na diagnostice a terapii těchto nádorů (stomatolog, chirurg, patolog, onkolog). Histopatologické vyšetření resekátu ústní dutiny je důležitou součástí komplexní péče o pacienta a poskytuje nejdůležitější prognostické informace. Cílem správného naplánování celého onkochirurgického výkonu je kompletní odstranění nádoru do mikroskopicky zdravé tkáně s dobrým estetickým a funkčním výsledkem.
Klíčová slova:
dlaždicobuněčné karcinomy hlavy a krku – nádory ústní dutiny
ÚVOD
Maligní nádory ústní dutiny představují asi 30 % všech nádorů hlavy a krku. Histologicky se v 95 % případů jedná o spinocelulární karcinom (OSCC) [1]. Ročně je diagnostikováno přibližně 300 000 nových OSCC, z toho asi dvě třetiny případů připadají na rozvojové země. Oblasti charakteristické vysokou incidencí jsou jižní a jihovýchodní Asie, východní Evropa a část latinské Ameriky [2]. U mužů, s výjimkou nemelanomových nádorů kůže, patří spinocelulární karcinomy ústní dutiny, hltanu a hrtanu mezi šest nejčastějších novotvarů z hlediska incidence a představují pátou nejčastější příčinu úmrtí na rakovinu [3]. Více než 95 % OSCC vzniká u pacientů starších 40 let, muži jsou oproti ženám postiženi dvakrát častěji [3, 4].
Hlavními rizikovými faktory jsou kouření, abúzus alkoholu a žvýkání betelu [5]. Těžcí kuřáci a uživatelé alkoholu mají až osmatřicetkrát větší riziko vzniku nádoru oproti nekuřákům a abstinentům [2]. Lidský papilomavirus (HPV) hraje důležitou roli u karcinomu orofaryngu. V případě OSCC je role HPV méně důležitá, přičemž orálních karcinomů, které lze přičíst infekci HPV, jsou asi čtyři procenta případů [6]. Ukazuje se, že část orofaryngeálních karcinomů může souviset s anogenitální infekcí HPV, přičemž se uplatňuje nejen sexuální aktivita, ale i možnost autoinokulace [7]. HPV infekce je zároveň nezávislým příznivým prognostickým faktorem, čemuž odpovídá i možnost snížení dávky radioterapie u HPV asociovaných nádorů orofaryngu [8].
Přibližně u třetiny pacientů je OSCC diagnostikován ve stadiu I a II, pětileté přežití je v těchto případech 80 % (stadium I) a 65 % (stadium II). Bohužel většina OSCC je diagnostikována v pokročilých stadiích choroby (III a IV) s pětiletým přežitím menším než 50 % a celkovým přežitím 30 %, a to zejména proto, že se u těchto pacientů často vyskytne recidiva nebo vzdálené metastázy [2, 9, 10]. Za posledních několik let byla navržena řada histopatologických znaků, které se dnes už běžně využívají ke stanovení patologického stadia a mají klíčový dopad na pooperační léčbu [11]. Patří k nim lokalizace, velikost, hloubka invaze, histologický typ, stupeň diferenciace tumoru, intravaskulární a perineurální invaze, pozitivita resekčních okrajů a vzdálenost nádoru od okrajů, metastázy v regionálních lymfatických uzlinách a extrakapsulární šíření, invaze a typ invaze do kosti.
Vzhledem k intimnímu vztahu OSCC k čelistním kostem tyto karcinomy poměrně často vstupují do kostní tkáně (zejména gingivální karcinomy) [12]. Karcinomy, které prorůstají přes kortikalis jsou podle dnešní TNM klasifikace zařazeny do patologického stadia pT4a (klinické stadium IV). Nález povrchové eroze kosti/zubního lůžka primárním nádorem dásně neopravňuje ke klasifikaci nádoru pT4 [13]. Histologicky rozeznáváme tři typy kostní invaze: erozivní, infiltrativní a smíšený. Infiltrativní forma je charakterizována tvorbou nepravidelných hnízd a výběžků nádorových buněk směrem do kosti, jejich penetrací do Haversova systému a přítomností reziduálních kostních ostrůvků uvnitř tumoru. Erozivní forma kostní invaze je naopak charakterizována ostrým přechodem mezi tumorem a kostí, osteoklastickou kostní resorpcí, fibrózou podél tumoru a absencí kostních ostrůvků uvnitř nádoru. Smíšená forma kombinuje oba typy invaze [14–16].
Cílem této práce je posoudit vztah vybraných histopatologických a klinicko-patologických parametrů ke stadiu nádorového onemocnění.
SOUBOR PACIENTŮ A METODIKA
Na Klinice ústní, čelistní a obličejové chirurgie Lékařské fakulty Univerzity Palackého bylo v letech 2005–2015 provedeno ve spolupráci s pracovníky Oddělení plastické a estetické chirurgie celkem 42 rekonstrukčních výkonů. V sestavě nemocných bylo 33 mužů (79 %) a devět žen (21 %); ve většině případů se jednalo o kuřáky s kladným vztahem k alkoholu. Všichni pacienti byli léčeni pro spinocelulární karcinom s nejčastější lokalizací na spodině ústní dutiny a jazyka, s přechodem na alveol dolní čelisti (graf 1).
Graph 1. Lokalizace karcinomů dutiny ústní
Graph 1 Localization of oral carcinomas
Před chirurgickým výkonem byl každý pacient podrobně vyšetřen; u etyliků bylo provedeno vyšetření koagulace (antitrombin III, anti Xa, fibrin, fibrin degradační produkty, D-dimery) a u každého nemocného byly rovněž stanoveny základní výživové parametry (celková bílkovina, albumin, vápník, fosfor v séru). Vedle běžných zobrazovacích metod (CT hlavy a krku s kontrastní látkou) bylo u objemných nádorů indikováno PET/CT k vyloučení vzdálených metastáz. U laloků s povrchovým průběhem výživující cévy byla k vyšetření krevního průtoku využita dopplerovská flowmetrie (supraklavikulární, submentální a pektorální lalok), naopak před odběrem volné fibuly bylo k ověření kvality, velikosti cévního průtoku a anatomické lokalizace cév bérce dolní končetiny vždy indikováno vyšetření magnetickou rezonancí (MR). Před odběrem předloketního laloku byl využit Allenův test.
Výběr chirurgického přístupu k nádoru vycházel z jeho velikosti a lokalizace. U malých dobře přístupných nádorů byl volen přístup intraorální, naopak k objemným nádorům lokalizovaným v orofaryngu se přistupovalo nejčastěji po mandibulotomii. Volba rekonstrukčního postupu záležela na celkovém stavu pacienta, na stadiu maligního onemocnění a také na tom, zda se jednalo o primární, či sekundární operaci. K vlastní rekonstrukci byly voleny laloky volné (osteomyokutánní, myokutánní) nebo vzdálené. Z volných laloků byl k rekonstrukci dolní čelisti a okolních měkkých tkání (spodina ústní dutiny a jazyka) většinou využit volný fibulární lalok s kožním ostrovem. Tvář byla rekonstruována u dvou nemocných volným lalokem m. latissimus dorsi a ve dvou případech anterolaterálním lalokem, jedenkrát volným lalokem musculus rectus abdominis. U nádorů spodiny ústní dutiny a alveolu dolní čelisti bez hlubší invaze do kosti (podle CT) byla provedena exstirpace nádoru s resekcí dolní čelisti se zachováním kontinuity a následným vykrytím defektu volným muskulokutánním lalokem. Předloketním lalokem s odebranou částí vřetenní kosti byl sekundárně rekonstruován defekt horního rtu a alveolu horní čelisti.
Histologické vzorky resekátů byly odečítány prospektivně (po roce 2013), popřípadě šlo o revizi nálezů s doplněním chybějících histopatologických údajů u biopsií před rokem 2013. Byly využity tkáňové bločky fixované ve formalinu a zalité do parafinu. Pacienti byli následně rozděleni podle klinických stadií nádorového onemocnění (tab. 1) a byl sledován vztah vybraných histopatologických znaků (hloubka invaze, nádorový grade, resekční okraje, perineurální šíření, metastázy v regionálních lymfatických uzlinách, extrakapsulární šíření přes pouzdro lymfatické uzliny) a klinicko-patologických znaků (komplikace po chirurgickém výkonu, výskyt recidiv, přežití) ke stadiu onemocnění. Hodnoty jednotlivých klinických a patologických ukazatelů onemocnění byly pořízeny metodami deskriptivní statistiky a jejich korelace porovnávány Pearsonovým χ2 testem (Statistica 12, StatSoft), hodnoty p < 0,05 byly považovány za statisticky signifikantní.
Table 1. Rozdělení karcinomu dutiny ústní a orofaryngu pomocí TNM klasifikace do jednotlivých stadií
Tab. 1 Classification of oral and oropharyngeal carcinoma stages according to TNM classification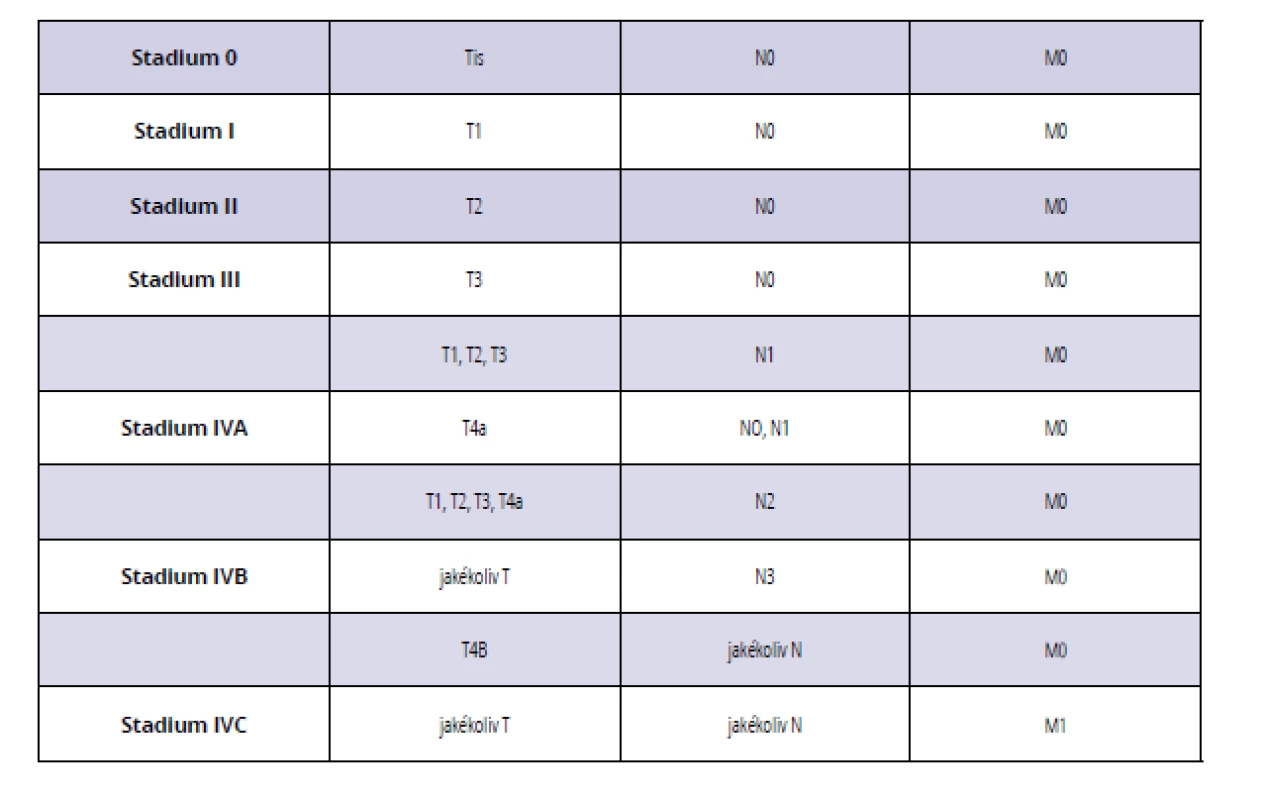
Následná onkologická terapie sestávala ve většině případů z radioterapie (50–60 Gy, rozdělených do 30 až 35 dávek) a celkové chemoterapie (cis-platina). Indikace k onkologické terapii se odvíjela od velikosti nádoru – zatímco u nemocných ve II. stadiu následovala radio-chemoterapie po chirurgickém výkonu u sedmi pacientů (63,6 %), ve IV. stadiu podstoupilo tuto léčbu až jedenadvacet nemocných (91,3 %).
VÝSLEDKY
Medián věku v souboru 42 pacientů byl 57,5 let (rozmezí 36–80 let). V jedenácti případech (26 %) bylo léčení zahájeno ve II. stadiu onemocnění (tab. 2, graf 2 a 3). Průměrná maximální hloubka invaze byla osm milimetrů. Dobře diferencované nádory (grade 1) tvořily 55 %, středně diferencované nádory (grade 2) 36 % a nízce diferencované nádory (grade 3) 9 %. Nádory byly u většiny nemocných odstraněny s bezpečnostním lemem zdravé tkáně ≥ 5 mm (64 %) kromě dvou pacientů (18 %), u kterých byly okraje resekátu pozitivní, nastala u nich recidiva a oba nemocní zemřeli na pokročilost základního nádorového onemocnění. Jen ve dvou případech (18 %) byly okraje nádoru těsné (< 5 mm a > 1 mm), v obou případech ale nádor nerecidivoval. U nemocných léčených ve II. stadiu onemocnění jsme nezaznamenali známky perineurálního šíření nádorových buněk (0 %). Z hlediska pooperačního průběhu a přihojení laloku došlo u dvou pacientů (18 %) k totální a u dalších dvou nemocných (18 %) k parciální nekróze laloku. U jednoho pacienta (č. 5) nastala nekróza anterolaterálního stehenního laloku a defekt spodiny ústní byl rekonstruován v druhé době pektorálním lalokem. U jednoho nemocného (č. 27) znekrotizoval v celém rozsahu pektorální lalok a k vyplnění defektu spodiny ústní dutiny a jazyka byl zvolen volný lalok m. latissimus dorsi. Při rekonstrukci tváře volným lalokem m. rectus abdominis (pacient č. 18) došlo k odhojení kůže a podkoží laloku, nicméně svalová vrstva se přihojila v plném rozsahu. Po rekonstrukci dolní čelisti pomocí techniky „wrap around technique“ (pacient č. 31) dolní pól pektorálního svalu podlehl nekróze a obnažená rekonstrukční dlaha byla následně překryta supraklavikulárním lalokem. U pacienta (č. 41), který byl primárně operován pro spinaliom spodiny ústní dutiny s následnou rekonstrukcí supraklavikulárním lalokem, byla pro brzkou recidivu nádoru resekována mandibula s exstirpací okolních měkkých tkání a defekt rekonstruován volnou fibulou s kožním ostrovem. Jeden pacient zemřel na srdeční selhání 12 let po výkonu.
Graph 2. Vyhodnocení přežití nemocných, recidiv a lokálních komplikací podle klinických stadií *označuje statistickou signifikanci p < 0,05, **označuje statistickou signifikanci p < 0,01
Graph 2 Evaluation of survival, relapses and local complications according to clinical stages *indicates statistical significance p < 0.05, **indicates statistical significance p < 0.01
Graph 3. Vyhodnocení histopatologických ukazatelů podle klinických stadií *označuje statistickou signifikanci p < 0,05, **označuje statistickou signifikanci p < 0,01 ECS – extrakapsulární šíření
Graph 3 Evaluation of histopathological parameters according to clinical stages *indicates statistical significance p < 0.05, **indicates statistical significance p < 0.01 ECS – extracapsular spread
Table 2. Přehled histopatologických a klinických parametrů u pacientů léčených ve II. stadiu onemocnění
Tab. 2 Summary of histopathological and clinical parameters of patients in stage II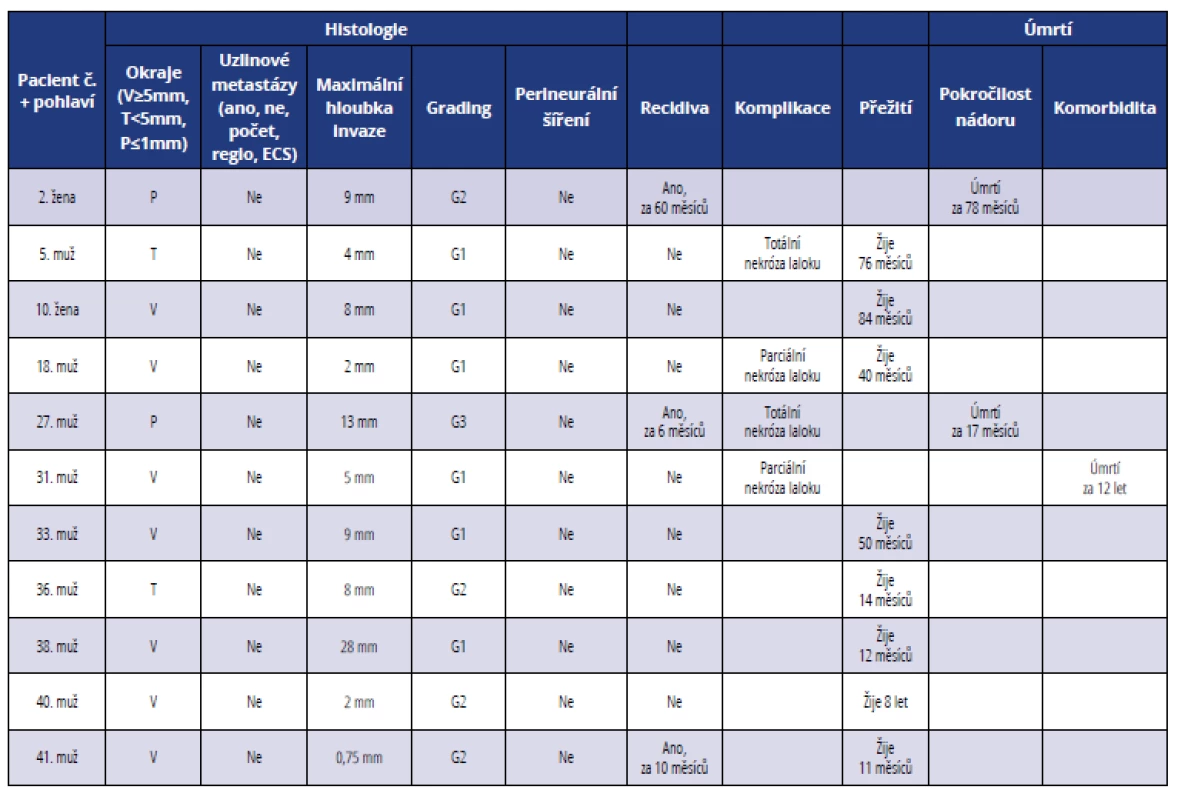
U osmi pacientů (19 %) byla léčba zahájena ve III. stadiu maligního onemocnění (tab. 3, graf 2 a 3). Průměrná maximální hloubka invaze byla 9,4 mm. Dobře diferencované nádory nebyly diagnostikovány, středně diferencované nádory tvořily 62,5 % a nízce diferencované nádory 37,5 %. Ve většině případů byly okraje resekátu těsné, tj. < 5 mm a > 1 mm (62,5 %), pouze u dvou nemocných byly okraje volné, tj. ≥ 5 mm (25 %) a u jednoho následně zemřelého pacienta byly zaznamenány okraje resekátu pozitivní, tj. ≤ 1 mm (12,5 %). Perineurální šíření nádoru bylo zaznamenáno u tří pacientů (37,5 %). Uzlinové metastázy byly u nemocných léčených ve III. stadiu onemocnění časté (87,5 %), pouze u jednoho pacienta (12,5 %) nádor nemetastazoval lymfatickou cestou. Z pacientů s metastatickým postižením uzlin připadala na jednoho pacienta průměrně jedna metastatická lymfatická uzlina. Extrakapsulární šíření nádoru přes pouzdro uzliny (ECS) nebylo diagnostikováno v žádném případě. Jeden pacient (č. 21) zemřel na lokální recidivu a pokročilost nádoru, v druhém případě (pacient č. 25) se jednalo o komorbiditu základního onemocnění. U jedné nemocné (č. 24) po rekonstrukci dolní čelisti volnou fibulou nastala totální nekróza laloku a defekt musel být znovu rekonstruován lalokem m. serratus s okolním žebrem. U jedné pacientky (č. 39) po rekonstrukci orofaryngu supraklavikulárním lalokem došlo vlivem ischemie k nekróze v terminální části a defekt na kořeni jazyka se zhojil postupnou granulací.
Table 3. Přehled histopatologických a klinických parametrů u pacientů léčených ve III. stadiu onemocnění
Tab. 3 Summary of histopathological and clinical parameters of patients in stage III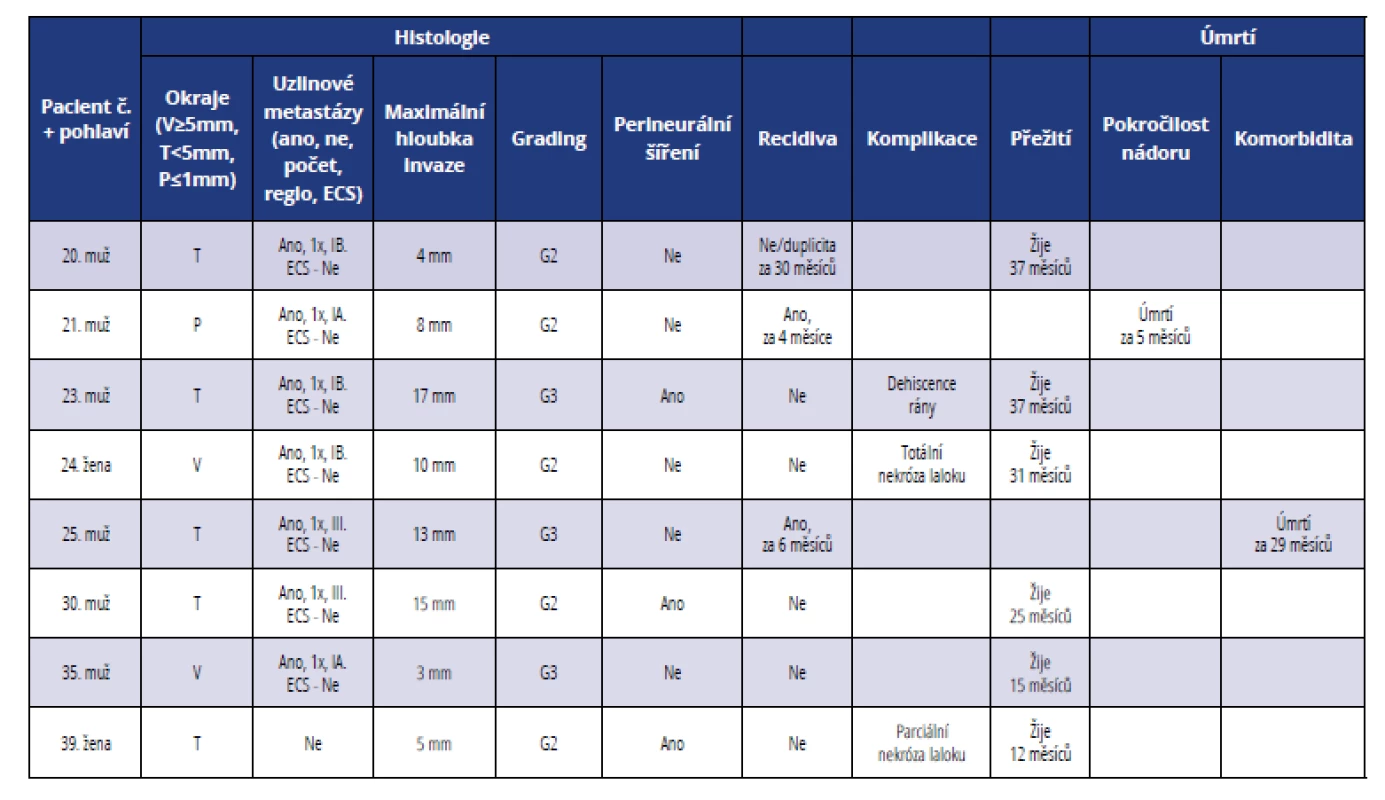
Většina nemocných (55 %) byla léčena ve IV. stadiu onemocnění (tab. 4, graf 2 a 3). Průměrná maximální hloubka invaze byla 17 mm. Dobře diferencované nádory tvořily čtyři procenta, středně diferencované nádory 39 % a nízce diferencované nádory 57 %. Více než polovina pacientů (61 %) zemřela na lokální recidivu, 17 % na komorbiditu. Úmrtí související s pokročilostí nádoru bylo až v 92,85 % spojeno s předchozí recidivou tumoru. Jeden pacient (č. 12) zemřel druhý pooperační den na plicní embolii. Ze souboru 23 pacientů léčených ve IV. stadiu onemocnění je pouze pět přeživších (22 %), z nich až ve čtyřech případech (80 %) bylo dosaženo negativního – volného resekčního okraje a v jednom případě okraje těsného (20 %). Celkově však převažovaly pozitivní okraje ≤ 1 mm (65 %), těsné okraje tvořily 13 % a pouze 22 % okrajů bylo volných ≥ 5 mm. Perineurální šíření nádoru bylo zaznamenáno u osmi pacientů (34,78 %). Uzlinové metastázy byly časté (74 %), pouze u šesti pacientů (26 %) nebyly diagnostikovány uzlinové metastázy. Z pacientů s metastatickým postižením uzlin připadalo na jednoho pacienta průměrně 2,76 metastatických lymfatických uzlin. Extrakapsulární šíření (ECS) nádoru bylo diagnostikováno častěji než v nižších stadiích, a to u devíti nemocných (39 %). U více než poloviny nemocných nádor prorůstal do kosti (52 %), nejčastěji infiltrativní cestou, která je agresivnější než cesta erozivní. Komplikace chirurgické léčby byly časté (35 %). Po rekonstrukci dolní čelisti volnou fibulou (pacient č. 6) došlo k totální nekróze laloku a defekt byl znovu rekonstruován měkkotkáňovým lalokem (m. latissimus dorsi). U pacienta č. 7 došlo k osteomyelitidě rekonstruované bradové části mandibuly s extraorální píštělí. Osteomyelitida byla léčena systémovým a místním podáváním antibiotik a defekt po excidované kožní píštěli v submentální oblasti byl rekonstruován lalokem musculus rectus abdominis. V jednom případě (pacient č. 8) došlo k postradiační osteomyelitidě kostního štěpu volné fibuly, který musel být kompletně odstraněn a defekt měkkých tkání následně rekonstruován pektorálním lalokem. U pacienta č. 13 po rekonstrukci dolní čelisti volnou fibulou se rozvinula nekróza kožního ostrova a měkké tkáně byly následně rekonstruovány pektorálním lalokem. U jedné pacientky (č. 29) po rekonstrukci defektu kořene jazyka submentálním lalokem nastala za čtyři měsíce progrese spinocelulárního karcinomu z metastatické uzliny v submandibulární oblasti. U nemocné č. 34 po rekonstrukci defektu tváře supraklavikulárním lalokem došlo v pooperačním průběhu vlivem infektu k parciální ztrátě vnější části laloku. U nemocného č. 32 byla využita k rekonstrukci dolní čelisti technika „wrap around technique“ a podobně jako u pacienta č. 31 došlo k nekróze distální části pektorálního svalu a defekt byl na přední straně krku následně překryt supraklavikulárním lalokem. Dehiscence ran u pacientů č. 22 a 23 se po odstranění nekróz postupně zhojily granulační tkání.
Table 4. Přehled histopatologických a klinických parametrů u pacientů léčených ve IV. stadiu onemocnění
Tab. 4 Summary of histopathological and clinical parameters of patients in stage IV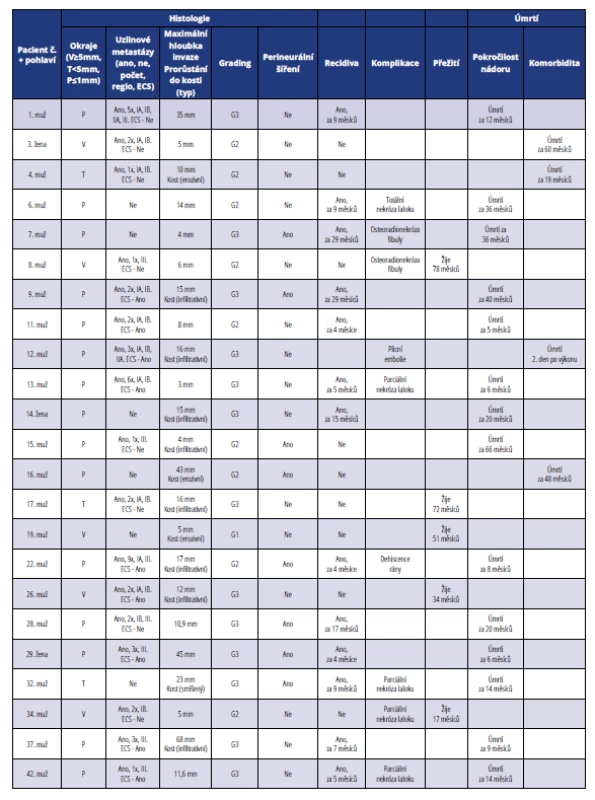
Relativní srovnání hlavních prognostických parametrů u jednotlivých stadií je uvedeno v tabulce 5.
Table 5. Srovnání prognostických faktorů podle klinických stadií
Tab. 5 Comparison of prognostic factors according to clinical stages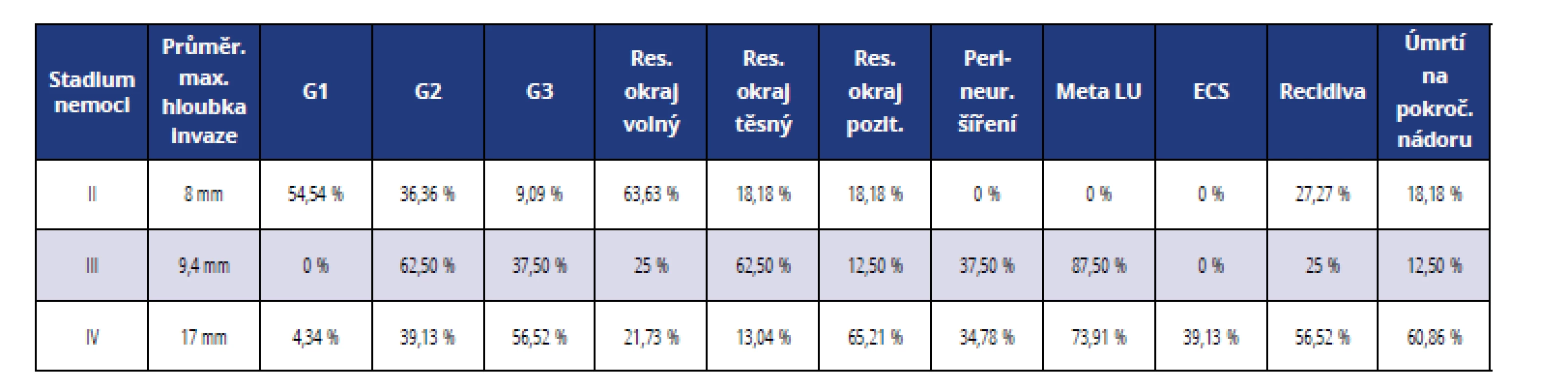
DISKUSE
Problematika nádorových onemocnění ústní dutiny je výjimečná tím, že kromě destrukční části operace se vyžaduje ve většině případů i přiměřená rekonstrukční fáze. Vzhledem k tomu je kladen značný důraz na přesné posouzení nejrůznějších histopatologických faktorů, které mají značný vliv na další prognózu pacienta. Jejich správné zhodnocení umožňuje modifikovat eventuální následnou chirurgickou terapii (reresekce, v případě peroperačního vyšetření dokonce ještě během primárního chirurgického výkonu) i komplexní onkologickou terapii (radioterapie, chemoterapie).
Velikost a hloubka invaze nádoru představují důležitý prognostický ukazatel, ale také rozhodují o operabilitě nádoru. Jak dokládají zahraniční práce, úspěšnost přežití nemocných klesá s velikostí nádoru, se kterou je spojen nejen zvýšený počet pozitivních resekčních okrajů, ale i četnost uzlin s metastázou [17–19]. Zejména hloubka invaze se ukazuje jako faktor, který značně ovlivňuje prognózu pacientů. Její význam dokládá i zavedení tohoto parametru do nejnovější osmé edice TNM klasifikace zhoubných nádorů dutiny ústní, přičemž v předchozí sedmé edici byla kritériem stadií pT1 až pT3 pouze největší velikost nádoru, bez ohledu na hloubku invaze [13]. Naše studie také potvrdila trend stoupající maximální hloubky invaze se vzrůstajícím stadiem nemoci (průměrně 8 mm ve II. stadiu; 9,4 mm ve III. stadiu a 17 mm ve IV. stadiu). Během předoperační klinické diagnostiky je často problematické přesně stanovit hloubku invaze. V současnosti probíhají v zahraničí studie, které porovnávají hloubku invaze určenou pomocí zobrazovacích metod (SONO, MR) s finální histologií. Zdá se, že přesnější a méně zatěžující je stanovení hloubky invaze pomocí speciální ultrazvukové sondy, kdy autoři uvádějí až 95% shodu s histopatologickým vyšetřením [20].
Nádorový grade je mnohdy podceňovaný ukazatel vzhledem k jeho subjektivnímu vyhodnocování, dnes však existují standardní kritéria jeho hodnocení [21]. Grading samotný může být nezávislým prognostickým faktorem OSCC, ale nízce diferencované nádory jsou také častěji spojeny s perineurální a lymfovaskulární invazí. Navíc, nízce diferencované nádory rostou spíše v podobě prstovitých výběžků, malých ostrůvků nebo disperzních jednotlivých buněk v invazivním čele nádoru a tento způsob růstu se ukazuje jako prognosticky nepříznivý [21, 22]. V naší studii byla zjištěna velmi silná asociace mezi vyšším nádorovým gradem a vyšším stadiem nádorového onemocnění (p = 0,001), která potvrzuje neprávem podceňovanou roli nádorového gradu jako prognostického ukazatele.
Pozitivita resekčního okraje nádoru je jedním z nejdůležitějších histopatologických prognostických znaků. Základním předpokladem úspěchu chirurgické léčby orálních karcinomů je radikální odstranění nádoru s bezpečnostním lemem zdravé tkáně o rozsahu pěti milimetrů a více. Okraj nádoru s lemem zdravé tkáně menším než pět milimetrů a větším než jeden milimetr se označuje jako těsný; kompletní odstranění tumoru je v tomto případě nejisté. O pozitivním okraji mluvíme v případech, kdy nádorová tkáň dosahuje do okraje resekátu, eventuálně vzdálenost nádorových buněk od okraje resekátu je méně než jeden milimetr [23]. Pooperační recidiva tumoru je v těchto případech velmi pravděpodobná a úspěch operace nejistý. Pozitivní resekční okraje jsou nejčastější příčinou lokálních recidiv tumoru. V sestavě našich nemocných převažuje pozitivita resekčních okrajů u pacientů léčených ve IV. klinickém stadiu, která signifikantně převyšuje nad pozitivitou okrajů v III. a II. stadiu (p = 0,005). To ukazuje, že výskyt nádorových struktur v blízkosti resekčního okraje může být považován za indikátor agresivnější nemoci, jak vyplývá i ze studie Sutton a kol. [24].
Četnost recidiv nádoru byla statisticky významně vyšší (p = 0,039) ve IV. stadiu onemocnění proti stadiím nižším. Současně se ukázalo, že lokální recidiva nádoru, která byla v naprosté většině případů spojena s předchozím pozitivním resekčním okrajem, byla u pacientů ve IV. stadiu onemocnění až v 92,85 % případů asociována s úmrtím na vlastní nádorové onemocnění. Lze tak usuzovat, že předpokladem přežití nemocných ve IV. stadiu onemocnění je zejména dosažení negativního (volného) resekčního okraje a s tím související pokles výskytu recidivy.
Lokální recidiva souvisí ve většině případů s těsným nebo pozitivním resekčním okrajem, může však hrát roli i perineurální šíření nádorových buněk [25]. U většiny nádorů je možné šíření nádorových buněk podél perineurálního prostoru až do délky dvou centimetrů, takže maligní buňky nejsou odstraněny při chirurgické resekci a radioterapii a dochází k lokální recidivě [11]. V našem souboru byla perineurální invaze ve vyšší frekvenci zjištěna ve III. stadiu (37,5 %) a IV. stadiu nemoci (34,78 %) ve srovnání s II. stadiem (0 %), statistická signifikance nebyla významná (p = 0,07).
Metastázy v regionálních lymfatických uzlinách představují jeden z nejvýznamnějších prognostických údajů, ovšem nejde jen o samotnou pozitivitu uzlin, ale i o další faktory, jako je počet postižených lymfatických uzlin, anatomická lokalizace uzlin, velikost metastáz a zejména extrakapsulární šíření nádorových buněk do extranodálních měkkých tkání (ECS). ECS je významným determinantem prognózy vzhledem k jeho spojení se zvýšeným rizikem recidivy a vzdálenými metastázami [26] a byl začleněn do TNM klasifikace jako další determinanta složky pN [13]. Naše práce je v souladu s předpokladem, že se zvyšujícím se stadiem onemocnění výrazně signifikantně stoupá četnost uzlinových metastáz (p = 0,00004), průměrný počet postižených lymfatických uzlin u jednoho pacienta a extrakapsulární šíření nádoru v postižených uzlinách (p = 0,004). ECS bylo prokázáno pouze u pacientů s pokročilými nádory IV. stadia, a je tedy jednoznačným ukazatelem velice špatné prognózy.
Invaze do kosti mandibuly/maxilly je známkou IV. stadia nemoci (pT4a podle TNM klasifikace). Tato klasifikace však nerozlišuje typ kostní invaze (erozivní, infiltrativní, smíšený), přičemž existují důkazy o tom, že prognóza jednotlivých typů kostní invaze se může lišit. Infiltrativní léze mají větší pravděpodobnost lokoregionální nebo vzdálené recidivy nádoru [4]. Tato hypotéza je v souladu s výsledky naší studie, kde v případě infiltrativního typu kostní invaze byla četnost recidiv vyšší ve srovnání s erozivním typem (57 % vs. 0 %).
V případě následných komplikací po rekonstrukčních výkonech nebyly zaznamenány signifikantní rozdíly mezi jednotlivými stadii nádorového onemocnění (p = 0,998), což asi spíše souvisí se zdravotním stavem pacienta a úspěšností provedení rekonstrukčního výkonu.
ZÁVĚR
Z histopatologického hlediska se zdají být prognosticky nejdůležitější následující parametry (tab. 5 a 6):
- pozitivní nebo těsný resekční okraj,
- nádorový grade,
- počet uzlinových metastáz, zejména ve spojení s extrakapsulárním šířením,
- hloubka invaze nádoru.
Table 6. Statistická významnost vybraných histopatologických a klinicko-patologických parametrů ve vztahu ke stadiu nádorového onemocnění
*označuje statistickou signifikanci p < 0,05,
**označuje statistickou signifikanci p < 0,01
Tab. 6 Statistical significance of selected histopathological and clinical parameters in relation to the stage of cancer
*indicates statistical significance p < 0.05,
**indicates statistical significance p < 0.01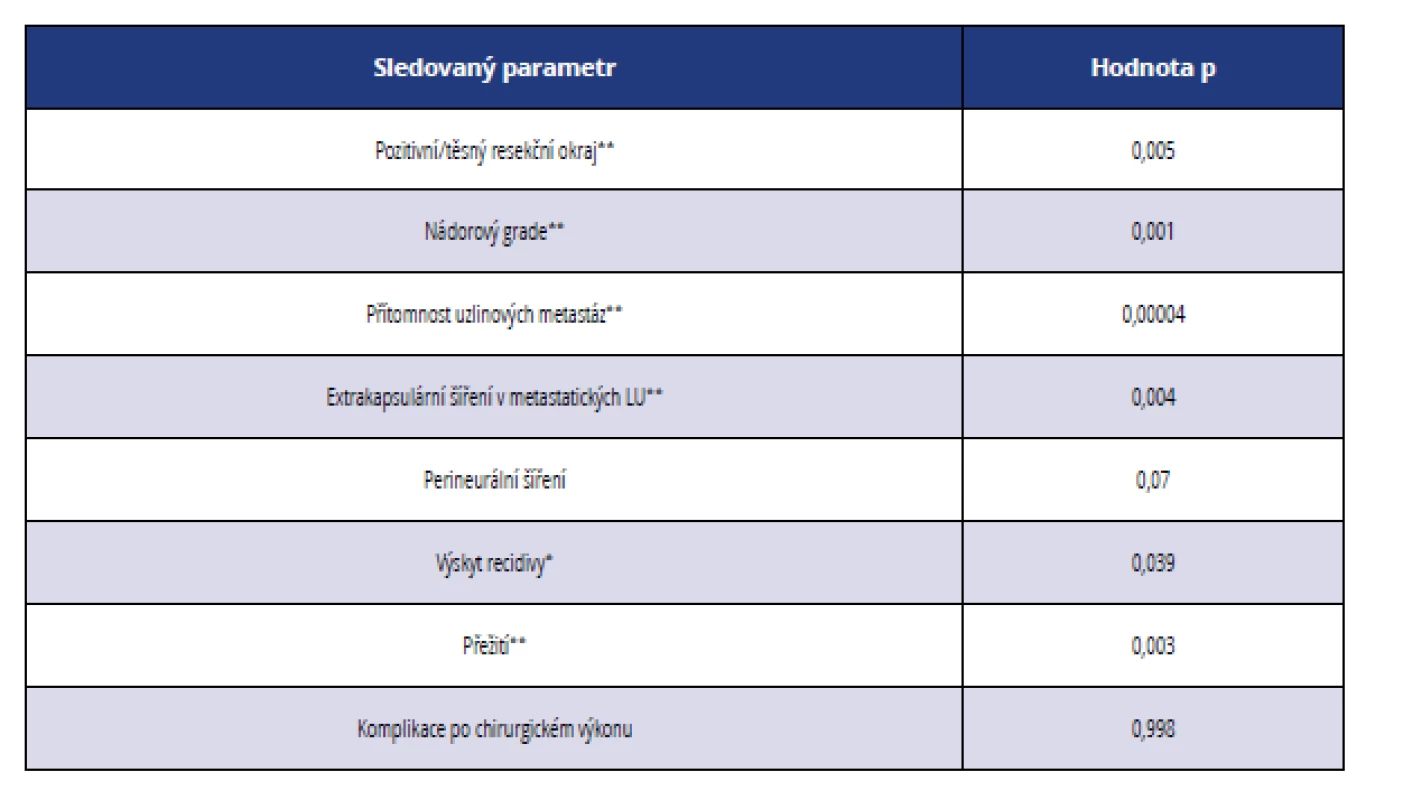
Dobře provedený kurabilní chirurgický výkon v orofaciální onkologii znamená kompletní odstranění nádoru do zdravé tkáně. Destruktivní část výkonu by neměla být svazována obavami chirurga, zda a jakým způsobem bude možné defekt rekonstruovat. Proto je třeba před chirurgickým výkonem přihlédnout k několika hlediskům a najít mezi nimi co nejlepší rovnováhu, jejímž výsledkem musí být i dobrá funkčnost (schopnost vyslovovat, žvýkat a polykat) a estetika. Proto můžeme konstatovat, že v moderní onkologii hlavy a krku představuje radikální odstranění nádoru s následnou rekonstrukcí dvě spojené nádoby.
MUDr. Jaroslav Michálek
Ústav klinické a molekulární patologie
LF UP a FN
Hněvotínská 3
775 15 Olomouc
e-mail: michalek.j@centrum.cz
Sources
1. Wong RJ, Keel SB, Glynn RJ, Varvares MA. Histological pattern of mandibular invasion by oral squamous cell carcinoma. Laryngoscope. 2000; 110 : 65–72.
2. Warnakulasuriya S. Global epidemiology of oral and oropharyngeal cancer. Oral Oncol. 2009; 45 : 309–316.
3. Institute of Health Information and Statistics of the Czech Republic: Cancer incidence in the Czech republic, 2016 [cit. 10.6.2019] Dostupné z: http://www.uzis.cz/katalog/
zdravotnicka-statistika/novotvary.
4. Jimi E, Furuta H, Matsuo K, Tominaga K, Takahashi T, Nakanishi O. The cellular and molecular mechanisms of bone invasion by oral squamous cell carcinoma. Oral Dis. 2011; 17(5): 462–468.
5. Karaca IR, Ozturk DN. Oral cancer: Etiology and risk factors. J Cancer Res Ther. 2019; 15(3): 739.
6. Castellsagué X, Alemany L, Quer M, et al. HPV involvement in head and neck cancers: comprehensive assessment of biomarkers in 3680 patients. J Natl Cancer Inst. 2016; 108: djv403.
7. Sehnal B, Podlešák T, Kmoníčková E, Nipčová M, Driák D, Sláma J, Zikán M. Anogenital HPV infection as the potential risk factor for oropharyngeal carcinoma. Klin Onkol. 2018; 31(2): 103–109.
8. Slávik M, Kazda T, Selingerová I, Šána J, Ahmad P, Gurín D, Hermanová M, Novotný T, Červená R, Dymáčková R, Burkoň P, Slabý O, Šlampa P. Vliv velikosti nádorové masy a stavu p16 na léčebné výsledky – dosažení kompletní remise u prospektivně sledovaných pacientů s nádory orofaryngu. Klin Onkol. 2019; 32(1): 58–65.
9. Kumar M, Nanavati R, Modi TG, Dobariya C. Oral cancer: Etiology and risk factors:
A review. J Cancer Res Ther. 2016; 12(2): 458–463.
10. Rivera C. Essentials of oral cancer. Int J Clin Exp Pathol. 2015; 8(9): 11884–11894.
11. Jadhav KB, Gupta N. Clinicopathological prognostic implicators of oral squamous cell carcinoma: need to understand and revise. N Am J Med Sci. 2013; 5(12): 671–679.
12. Shah J, Lydiatt WM. Buccal mucosa, alveolus, retromolar trigone, floor of mouth, hard palate and tongue tumors. In: Thawley SE, ed. Comprehensive management of head and neck tumors. 2nd ed. WB Saunders: Philadelphia, 1999 : 686–693.
13. Brierley JD, Gospodarowicz MK, Wittekind C. TNM Classification of Malignant Tumours.
8th ed. Wiley Blackwell; 2017.
14. Totsuka Y, Usui Y, Tei K, Fukuda H,Shindo M, Iizuka T, Amemiya A. Mandibular involvement by squamous cell carcinoma of the lower alveolus: analysis and comparative study of histologic and radiologic features. Head Neck. 1991; 13 (1): 40–50.
15. Slootweg PJ, Müller H. Mandibular invasion by oral squamous cell carcinoma. J Craniomaxillofac Surg. 1989; 17(2): 69–74.
16. Carter RL, Tsao SW, Burman JF, Pittam MR, Clifford P, Shaw, HJ. Patterns and mechanisms of bone invasion by squamous carcinomas of the head and neck. Am J Surg. 1983; 146(4): 451–455.
17. Shah JP, Gil Z. Current concepts in management of oral cancer-surgery. Oral Oncol. 2009; 45(4–5): 394–401.
18. Mohit-Tabatabai MA, Sobel HJ, Rush BF, Mashberg A. Relation of thickness of floor of mouth stage I and II cancers to regional metastasis. Am J Surg. 1986; 152 : 351–353.
19. Urist MM, O’Brien CJ, Soong SJ, Visscher DW, Maddox WA. Squamous cell carcinoma of the buccal mucosa: analysis of prognostic factors. Am J Surg. 1987; 154 : 411–414.
20. Lodder WL, Teertstra HJ, Tan IB, Pameijer FA, Smeele LE, van Velthuysen ML, van den Brekel MW. Tumour thickness in oral cancer using an intra-oral ultrasound probe. Eur Radiol. 2011; 21(1): 98–106.
21. Akhter M, Hossain S, Rahman QB, Molla MR. A study on histological grading of oral squamous cell carcinoma and its co-relationship with regional metastasis. J Oral Maxillofac Pathol. 2011; 15(2): 168–176.
22. Thomas B, Stedman M, Davies L. Grade as a prognostic factor in oral squamous cell carcinoma: a population-based analysis of the data. Laryngoscope. 2014; 124(3): 688–694.
23. Shah AK. Postoperative pathologic assessment of surgical margins in oral cancer: A contemporary review. J Oral Maxillofac Pathol. 2018; 22(1): 78–85.
24. Sutton DN, Brown JS, Rogers SN, Vaughan ED, Woolgar JA. The prognostic implications of the surgical margin in oral squamous cell carcinoma. Int J Oral Maxillofac Surg. 2003; 32(1): 30–34.
25. Binmadi NO, Basile JR. Perineural invasion in oral squamous cell carcinoma: a discussion of significance and review of the literature. Oral Oncol. 2011; 47(11): 1005–1010.
26. Agarwal JP, Kane S, Ghosh-Laskar S, Pilar A, Manik V, Oza N, Wagle P, Gupta T, Budrukkar A, Murthy V, Swain M. Extranodal extension in resected oral cavity squamous cell carcinoma: more to it than meets the eye. Laryngoscope. 2019; 129(5): 1130–1136.
Labels
Maxillofacial surgery Orthodontics Dental medicine
Article was published inCzech Dental Journal

2019 Issue 3
Most read in this issue- Skeletálně kotvené dlahy typu bollard u pacientů s progenním stavem
- Srovnání histopatologických a klinických prognostických faktorů spinocelulárních karcinomů ústní dutiny
- Cytokompatibilita anodizovaných povrchů implantačních materiálů
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

