-
Medical journals
- Career
MERKELŮV KARCINOM VÍČEK (KLINICKO - HISTOLOGICKÁ STUDIE)
Authors: J. Krásný 1; J. Šach 2; V. Kolín 2; J. Zikmund 3
Authors‘ workplace: Oční klinika FN Královské Vinohrady, Praha, přednosta: prof. MUDr. Pavel Kuchynka, CSc. 1; Ústav patologické anatomie FN Královské Vinohrady a 3. LF UK, Praha, přednosta: doc. MUDr. Tomáš Jirásek, PhD. 2; Klinika dětí a dorostu FN Královské Vinohrady, Praha, přednosta: doc. MUDr. Felix Votava, PhD. 3
Published in: Čes. a slov. Oftal., 74, 2018, No. 5, p. 198-205
Category: Original Article
doi: https://doi.org/10.31348/2018/5/5Overview
Cíl:
Seznámit s problematikou karcinomu z Merkelových buněk (mMCC) při postižení víčka a s jeho chirurgickým řešením.
Vlastní sestava:
mMCC horního víčka vpravo byl na Oční Klinice FN Královské Vinohrady poprvé zastižen v roce 1998 u 78leté ženy. Následující dvojí pozorování mMCC na horním víčku vlevo u dvou žen ve věku 48 a 67 let bylo zaznamenáno v rámci retrospektivní studie. Histologicky bylo vyšetřeno 1033 operovaných nádorů víček v letech 2007 až 2015, z toho 47,5% bylo benigních a 52,5 % maligních. Nejčastější z maligních procesů byl bazaliom v 77,3 % a dlaždicobuněčný karcinom v 15,7 %.
Výsledky:
Nejstarší pacientka s MCC zemřela po třech letech na kardiopulmonální selhání. 48-letá pacientka (věk diagnózy MCC) byla po dobu sledování pěti let bez recidivy či prokázaných metastáz. Onkologický počáteční staging byl negativní. Následovalo ultrazvukové vyšetření lymfatických uzlin krku každého půl roku. Další 67-letá pacientka (věk diagnózy MCC) byla sledována 2,5 roku. Bylo vysloveno podezření na metastatický proces ve stejnostranné slinné žláze a v plicích, proto následovala chemoterapie. Definitivně tento proces nebyl potvrzen, dále pokračoval jen onkologický follow up bez lokální recidivy či rozsevu.
Závěr:
Autoři potvrdili vzácný výskyt MCC, a to jen v 0,37 % mezi maligními nádory víček. Zásadní význam pro úspěšnou léčbu představuje dostatečně radikální výkon potvrzený histologickou verifikací a současně je nezbytná následná plastika víčka.
Klíčová slova:
karcinom z Merkelových buněk, nádor víčka, ultrazvukové vyšetření uzlin
Úvod
Merkelův karcinom neboli karcinom z Merkelových buněk (Merkel cell carcinoma - MCC) je vzácný primární neuroendokrinní karcinom kůže s vysokou mírou rekurencí s následujícími excizemi a se sklonem k metastatickému šíření přes spádové lymfatické uzliny. Polovina nádorů je lokalizovaná na hlavně a krku. Oční lokalizací bývá především horní víčko. Klinicky se prezentuje jako fialové vaskularizované kožní noduly. Friedrich Sigmund Merkel v roce 1875 popsal oválné, nondendritické, epidermální čiré buňky [28]. Histologicky byly charakterizovány prakticky o sto let později jako buňky s čirou cytoplasmou bohatou na různé organely v úzkém lemu okolo oválného jádra. Tato charakteristika se stala základem klinického popisu MCC. Vzhledem k vzácnému výskytu především ve víčkové oblasti a zatím jediné kasuistice víčkového postižení, spolu s dalším orbitálním pozorováním, dosud publikované v základním časopise ČOS a SOS v roce 2018 [15] jsme se rozhodli podat rozklad několika klinických pozorování. Záchyt MCC jsme dokladovali ve vztahu k dalším kožním nádorům víčkové oblasti. Sdělení jsme doplnili o literární rozbor současných poznatků o etiologii, histologické verifikaci a léčbě MCC.
Vlastní sestava
V roce 1998 byla odeslána na Oční kliniku FN Královské Vinohrady 78letá pacientka s recidivou MCC na horním víčku pravého oka. Prvotní excize tumoru a jeho histologická verifikace byla provedena na očním oddělení spádové krajské nemocnice, kdy do roka nádor recidivoval a následovala zde nová excize. Při další recidivě byla pacientka odeslána na naši kliniku. Při již třetím chirurgickém výkonu radikální extirpaci s plastikou víčka v květnu 1998 byla potvrzena původní diagnóza MCC. Po této operaci se u pacientky neprojevila opětovná recidiva ani šíření tumoru do spádové oblasti mízních uzlin. Po třech letech pacientka zemřela na kardiopulmonání selhání nesouvisející s nádorem, pitva nebyla provedena.
Byla vypracována retrospektivní studie za období září 2007 až září 2015 v rámci atestační práce z oboru patologie v otázce hodnocení histologických nálezu nádorů víček u pacientů sledovaných a operovaných na Oční klinice FNKV či ve spolupráci s Klinikou plastické chirurgie FNKV ve věku 3 až 97 let, medián 61 let. Celkově bylo hodnoceno 1033 nádorů, z toho bylo 47,5 % benigních a 52,5 % maligních. Z benigních nádorů byly nejčastěji zastoupeny epitelové nádory v počtu 247 nálezů, převážně se jednalo seboroickou keratózu (69 %), dále dlaždicobuněčné papilomy (16 %) a adnexální kožní nádory (6 %). Neuroektodermové léze byly zastoupeny u 191 pacientů, které v absolutní většině tvořily névy (97 %). Nejméně byly zastoupeny mezenchymové nádory u 52 pacientů, jejichž zástupcem byl především hemangiom (70 %), vzácněji lipomatózní léze či histocytom.
Tabulka 1 uvádí diagnostické rozdělení maligních nádorů, kde převládal bazaliom. Mezi ostatními ojedinělými nádory se objevil také 4x sebaceózní karcinom, 3x lymfom, 2x DLBCL (difuzně velkobuněčný lymfom) a jednou CLL (chronická lymfatická leukémie) či dediferencovaný sarkom. Tabulka ukazuje také na poměrné procentuální zastoupení při současném zařazení i benigních nádorů. Kromě pravých nádorů byly také histologicky popsány pseudotumory u 195 lézí, což tvořilo z 13 % celkového počtu 1228 excizí z očních víček. Etiologicky se jednalo o chronické záněty (45x chalazion a 15x pyogenní granulom) či cystické útvary nebo degenerativní změny. Mezi sledovanými diagnózami byly i dva případy MCC, proto jsme je zařadili k počátečnému pozorování z roku 1998 jako dvě samostatné kasuistiky.
Table 1. Procentuální rozdělení maligních nádorů víčkové oblasti 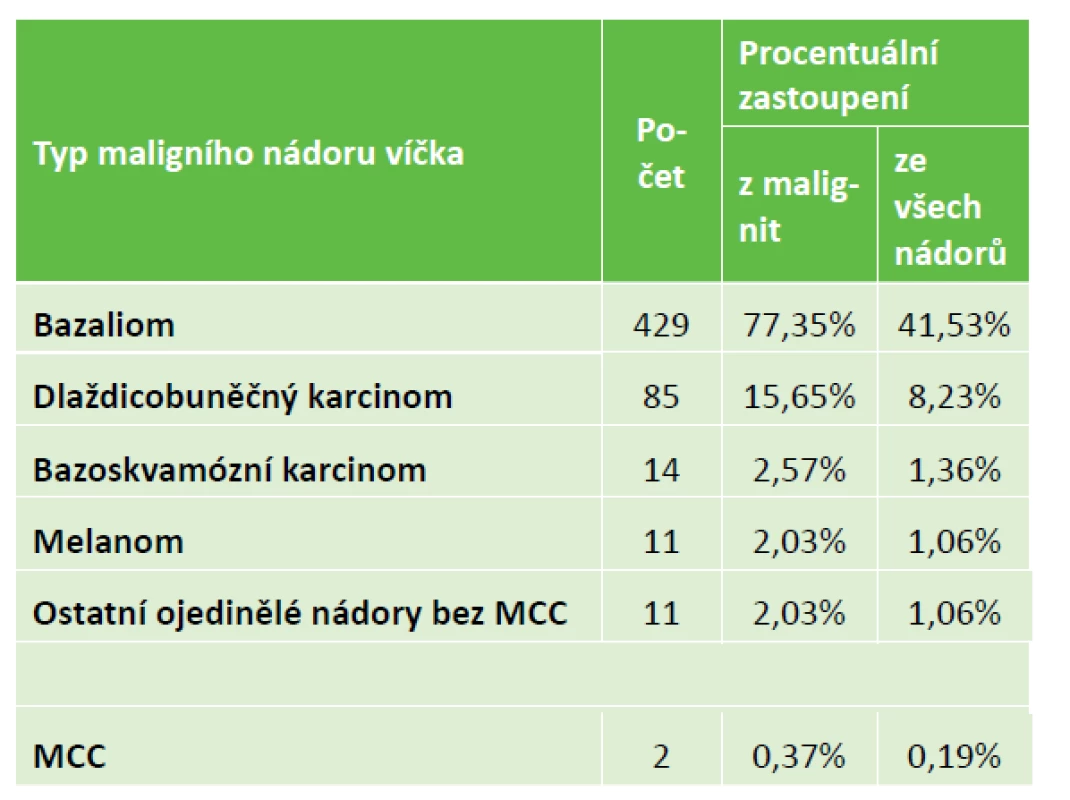
Kasuistika č. 1
Na konci července 2012 se dostavila na všeobecnou ambulanci Oční kliniky FN Královské Vinohrady v Praze 48letá žena se sedm týdnů trvajícím zarudnutím horního víčka vlevo v podobě mírně bolestivé rezistence nad okrajem víčka. Bylo vysloveno podezření na chalazion, které bylo a po dvou týdnech extirpováno (bez histologického ověření), ale stav se nezlepšil. S odstupem šesti týdnů byla provedena již probatorní excize v lokální anestézii pro získání histologické verifikace procesu, která odhalila MCC. Pacientka byla na začátku října t.r. hospitalizována k totální exstirpaci nádoru horního víčka vlevo v celkové anestézii. Klinickým obrazem byla lividní, tuhá a solidní rezistence nejméně 6 mm nad úrovní s četnými povrchovými cévami, oproti spodině nepohyblivá. Její velikost byla 13 x 10 mm (obrázek 1A). Řez byl veden v místě původní probatorní excize, následovala preparace na hranu nádoru (obrázek 1B) nahoře pod kůži dále do hloubi k hraně tarzu, od které postupně byl odpreparován a resekován. Vzhledem k tomu, že před margem je tkáň trvale prorostlá tumorem následovala i resekce okraje víček i s řasami (obrázek 1C). Výkon byl provázen profúzním krvácením. Odběr kontrolních vzorků byl proveden z podkožní tkáně směrem k tarzu, z nasálního a temporálního okraje kůže u tarzu. Následovala plastická úprava zahrnující kožní posun nahoře a zároveň nástřih tarzu. Obě tkáně se posunuly, aby se vytvořila kontinuita okraje víčka. Rána byla uzavřena jednotlivými zanořenými resorbovatelnými stehy, a to Vicrylem7-0 (Ethicon, USA): tarzus ke kůži – „end to end“ (obrázek 1D).
Image 1. Klinický nález solidního MCC horního víčka u 48-leté pacientky (A) operační postup: odstranění tu víčka (B,C) s jeho plastikou (D) 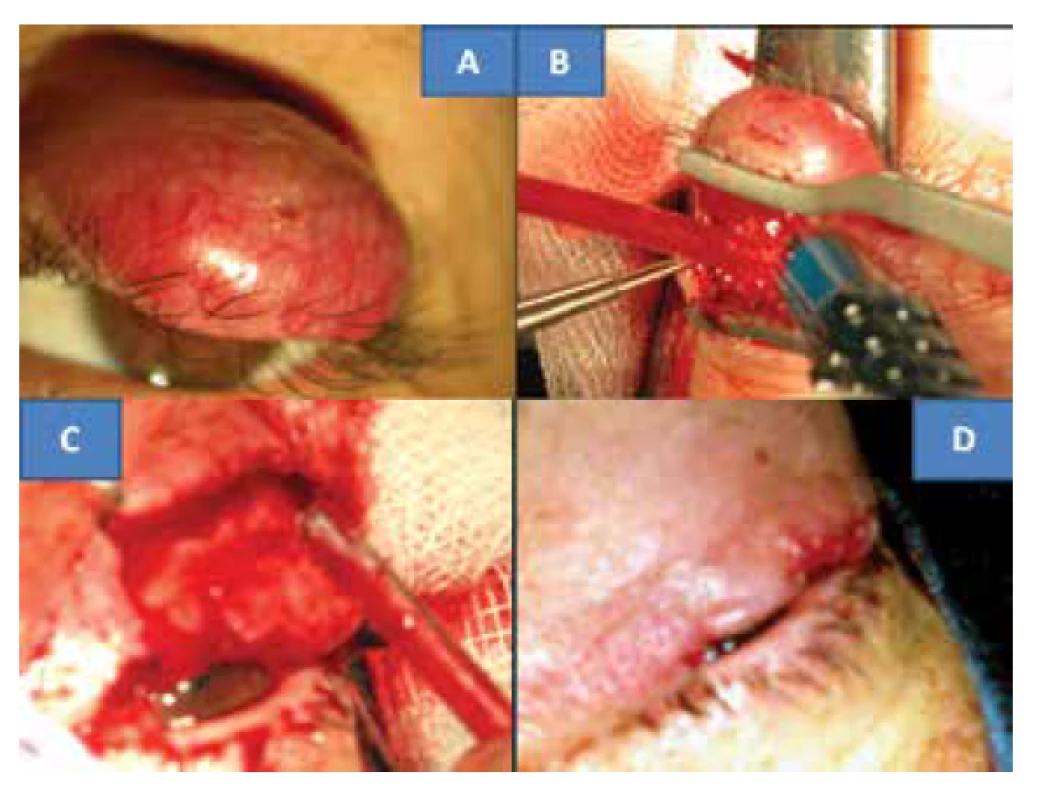
Histologická verifikace prokázala tumor s mikroskopickým obrazem charakteristickým pro MCC. Potvrdila se radikalita výkonu v podobě nenádorové tkáně na okrajích hlavního vzorku (obrázek 2A) a správnost rozhodnutí o resekci okraje víčka s tarzem, neboť nádor obkružoval folikuly řas (obrázek 2B). Hraniční vzorek z podkožní tkáně sice prokazuje infiltraci MCC, ale jeho zevní okraje jsou bez tumorózních projevů. Nasální a temporální kožní vzorky byly bez tumorózní infiltrace. Toto také potvrdilo dostatečnou radikalitu výkonu. Diagnóza byla potvrzena také škálou imunohistochemických vyšetření. Současně byly v nádoru pozitivní jak epitelové markery (cytokeratin CK116 a AE1-3), tak i neuroendokrinní markery chromogranin (obrázek 2C) a NSE byly v nádoru výrazně pozitivní. Proliferační marker Ki67 (MIB1) byl pozitivní v kolísající intenzitě až v cca 98 % buněk (obrázek 2D). Infiltrace T-lymfocyty (CD3 pozitivní) a B-lymfocyty (CD20 pozitivní) nebyla v nádoru nalezena. Pozitiva byla pouze v reaktivním lymfocytární infiltrátu v okolí nádoru – kontrolní vzorky, s výraznou převahou T-lymfocytů CD3. Mohlo by to svědčit pro nástup vlastní imunitní obranyschopnosti proti nádoru.
Image 2. Rozsáhlá infiltrace víčka MCC s nenádorovou tkání v okrajích, barvení HE – zvětšení 100x (A) infiltrace nádorem v okolí folikulů řas, barvení HE – zvětšení 200x (B), neuroendokrinní marker – chromogranin, zvětšení 400x (C), proliferační marker Ki67 zvětšení 400x (D) 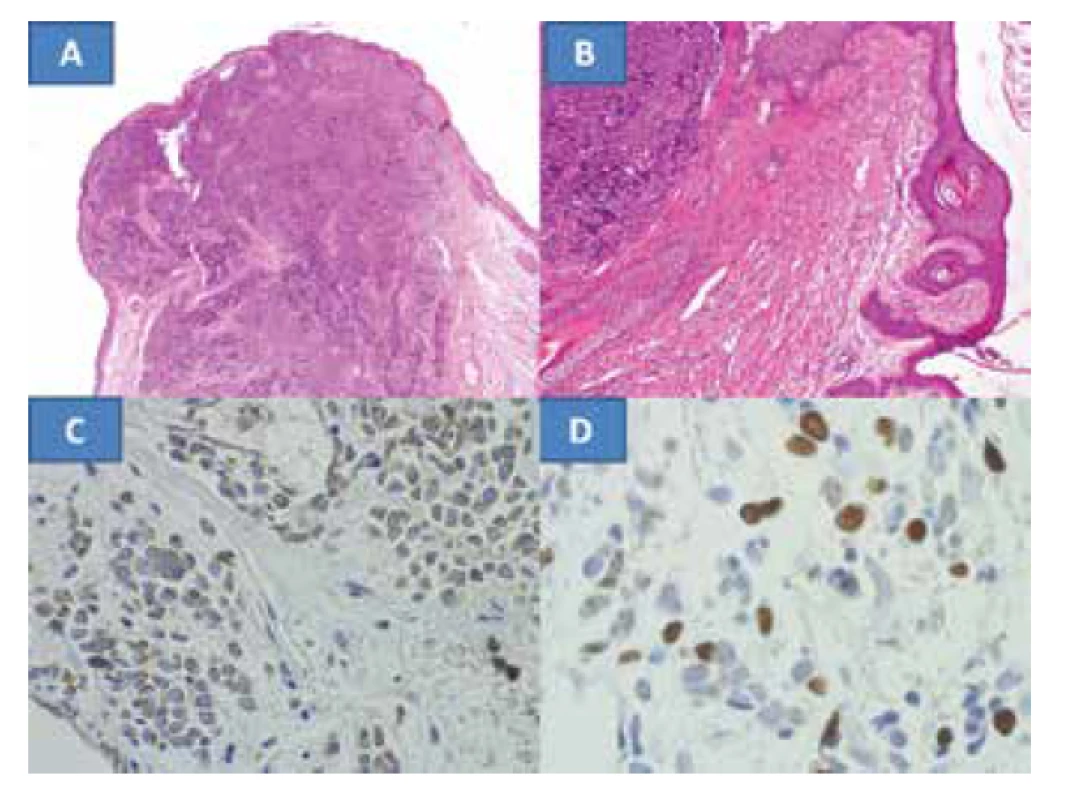
Pooperační průběh proběhl bez komplikací, lokální recidiva do poslední kontroly v září 2017 se neobjevila. Horní víčko dobře konturovalo oční štěrbinu nahoře i přes lehce nepravidelný okraj, řasy zůstaly jen při obou koncích bez projevů trichiázy (obrázek 3A). Víčko dobře doléhalo k bulbu a spontánně byla oční štěrbina uzavřena. (obrázek 3B). Nitrooční nález oboustranně symetrický a fyziologický, VOP = VOL 5/5 nat.
Doporučený onkologický staging po histologické verifikaci se skládal z rtg plic, sonografie jater, krevního obrazu s podrobným diferenciálním obrazem a jaterních testů. Veškerá vyšetření byla z onkologického pohledu negativní. Ultrazvukové vyšetření uzlin krku uzlin (přístroje Sonoline Versa Plus, lineární sonda 7,5 MHz a od roku 2015 UZ přístroj Login S7 firmy GE) neprokázalo podezření na malignitu. Pouze kaudálně od pravé slinné žlázy se nacházela drobná plochá, anechogenní reaktivní uzlinka velikosti 8 x 3 mm v podélném řezu (obrázek 3C). Štítná žlázaa slinné žlázy byly bez patologie. Onkologický závěr stanovil pouze další ultrazvukové kontroly krku a výše uvedené krevní odběry. Při dalším sledování byly nadále krevní testy negativní a ultrazvukový nález na krku nezaznamenal progresi ve výskytu uzlin v dané oblasti. Výše popsaná uzlina přetrvávala beze změn. Poslední vyšetření v září 2017 neprokázalo maligní postižení krčních lymfatických uzlin.
Image 3. Klinický nález horního víčka pět let po operaci MCC u nyní 53-leté pacientky (A), spontánní dovření oční štěrbiny (B), typická plochá benigní reaktivní uzlina v oblasti musculus sternokleidomastoideus vpravo u naší pacientky (C) a pro srovnání ukázka paketu maligních převážně skoro kulovitých uzlin s jasným echogenním stromatem (archiv MUDr. J. Zikmund, CSc.) ve stejné oblasti (D) 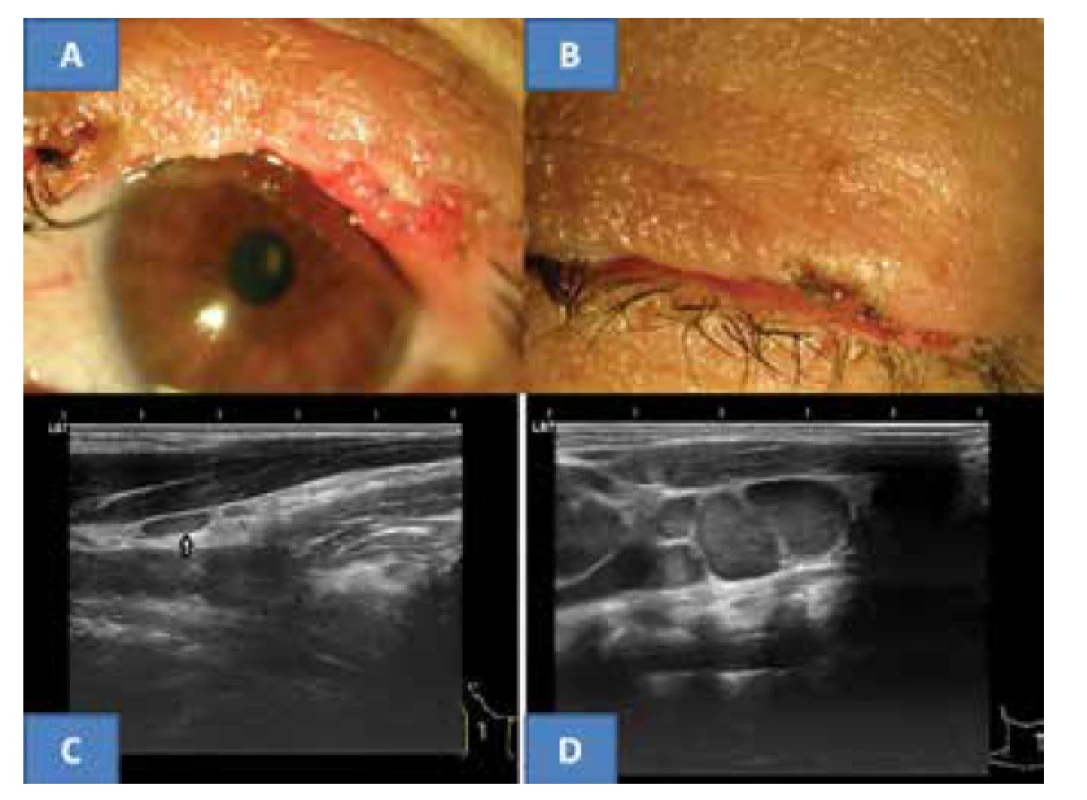
Kasuistika č. 2
V listopadu 2015 byla na Oční kliniku FN Královské Vinohrady v Praze odeslána 67letá žena s MCC, který byl verifikován v říjnu t.r. z probatorní excize v místní krajské nemocnici. Tentýž měsíc jsme provedli totální extirpaci nodulárního útvaru 6 x 8 mm červenofialové barvy na hraně levého horního víčka (obrázek 4B) s následnou plastickou úpravou. Nádor byl odeslán k histologické verifikaci. Byly odebrány hraniční tkáně směrem nahoru do podkoží, do tarzu a kožní vzorky nazálně a temporálně od nádoru. Ve všech hraničních vzorcích nebyla již prokázaná přítomnost nádoru, jen v hraniční tkáni nasálně směrem k exstirpovanému nádoru byla infiltrace prokázána, excize zde byla velmi těsná, ale další obsah vzorku byl bez nádorové tkáně. Stav jsme mohli uzavřít jako totální odstranění MCC víčka.
Image 4. MCC víčka u 78leté pacientky (A), MCC víčka u 67leté pacientky (B), Charakteristický histologický nález MCC je tvořený oválnými, nondendritickými, epidermálními čirými buňkami s mitózami – označeny kroužkem (C), barvení HE, zvětšení 300x 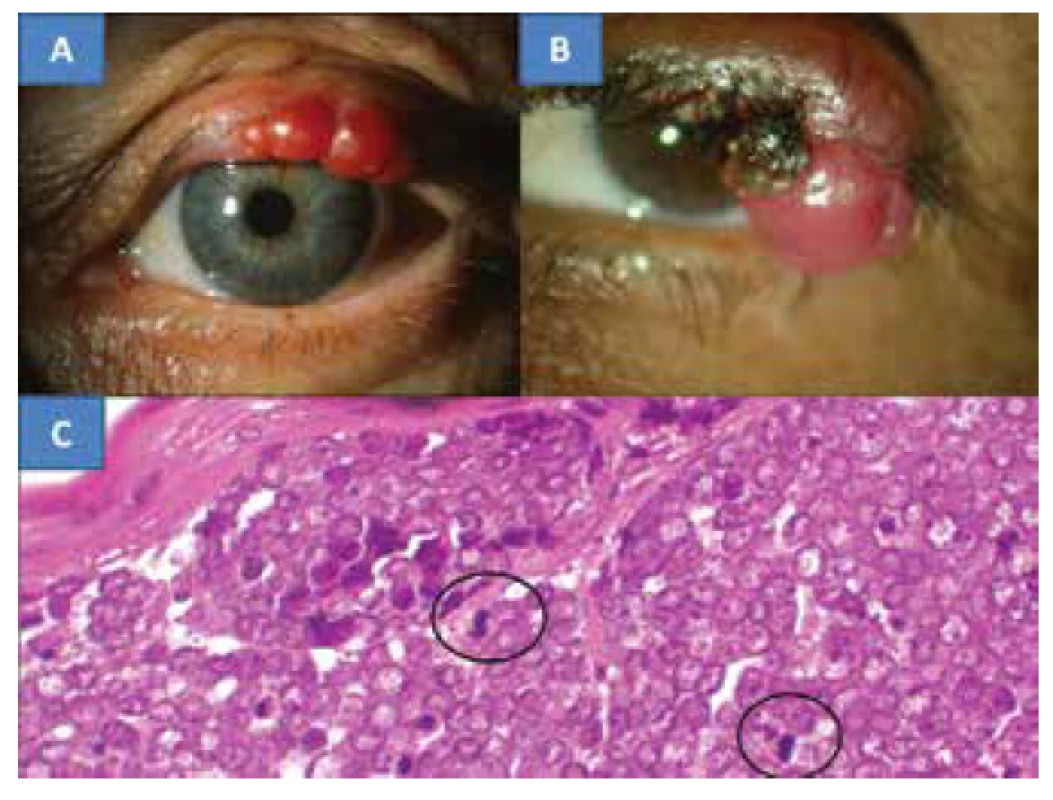
Histologické vyšetření opět prokázalo MCC. Nádorové buňky měly objemná oblá až oválná jádra s jemně disperzně rozptýleným chromatinem a s patrnými drobnými jadérky. Vlastní cytoplasma nádorových buněk byla nehojná a vytvářela jen úzký lem okolo buněčných jader. (obrázek 4C)V jádrech byla přítomná mitotická aktivita. Diagnóza byla podpořena škálou imunohistochemických vyšetření. Epitelové markery zahrnovaly cytokeratiny CK20, CAM 5,2 a AE1-3 – byly vždy silně pozitivní. Neuroendokrinní markery, a to chromogranin a NSE byly rovněž pozitivní. Proliferační marker Ki67 (MIB1) byl pozitivní v 25 % buněk.
Před propuštěním bylo provedeno UZ vyšetření krku (Sonoline Versa Plus, lineární sonda 7,5 MHz) s tímto závěrem: uzliny podél kývačů anaechogenní a homogení a nezvětšené, štítná žláza s kalcifikací, na povrchu levé slinné žlázy byla detekovaná anechogenní cystička o rozměrech 5x3x3 mm. Pacientka byla předána do místa bydliště, kde nebyla v rámci onkologických kontrol zaznamenaná recidiva v oblasti víčka. Vzhledem k podezření podle PET-CT na možnost metastáz v levé slinné žláze, v plicích v podobě tří drobných uzlíků ve středním laloku pravé plíce a pro zvýšený fokus kumulace v levém jaterním laloku byla zahájena chemoterapie v lednu 2016 (sedm cyklů cisplatiny a etoposidu). V únoru 2017 bylo konstatováno, že kumulace v játrech nemusela být v korelátu s rozvíjející se metastázou, ale s cirhózou. Nález na plicích byl dlouhodobě stabilní, tzn. drobné noduly benigní a postinfekční povahy, neboť měly fibrózní charakter a ložisko v levé slinné žláze bez progrese. Tento nález byl potvrzen i v říjnu 2017, kdy nebyla prokázaná krční, axilární ani hilová lymfadenopatie. Pacientka zůstala v onkologické dispenzarizaci. Oční nález také z října 2017 v místě bydliště neprokázal lokální recidivu, v horním víčku vlevo pouze na rozhraní zevní a střední třetiny marga mělký ztrátový kolobom s ojedinělou trichiázou jemných řas. Nitrooční nález byl oboustranně symetrický a odpovídal věkové normě, VOP = VOL 5/5 s +0,75.
Diskuse
MCC patří mezi vzácně se vyskytující kožní nádory, přesto jeho míra výskytu narůstá. Incidence v roce 1999 byla 0,23/100 000 za rok [29] a stoupla na 0,6/100 000 za rok v roce 2007 [3]. Má tedy rychle stoupající trend s meziročním nárůstem o 8 % [2], což potvrzují i poslední studie [39]. MCC byl poprvé popsán v roce 1972 Cyrilem Tokerem jako trabekulární karcinom kůže u pěti pacientů [44]. O té doby byl označován také jako kutání APUDom, neuroendokrinní karcinom kůže, malobuněčný karcinom kůže, anaplastický karcinom kůže, primární nediferencovaný karcinom kůže. V současné době se již používá převážně název Merkelův karcinom nebo karcinom z Merkelových buněk [32]. Nejčastější lokalizací MCC jsou slunci exponované části těla, z toho polovina je lokalizovaná na hlavě a krku ve 44 % [41], a to v rozmezí 40–70 % [11]. Podrobné zpracování literárních podkladů uvádí 86 postižení víček z celkového počtu 1200 pozorování MCC, což představuje 7 % [33]. Dalším lokalitami MCC mohou být končetiny, horní končetina v 23% a dolní končetina v 13 % [41], dále trup v rozmezí 10–20 % [11]. Vzhledem k malé incidenci víčkových projevů MCC se zpočátku v literatuře objevují jen jednotlivé kasuistiky z jednotlivých pracovišť v osmdesátých letech minulého století na horních víčkách [21,23]. Na přelomu století jsou již sdělení početnější, po dvou pacientech, třikrát horní víčko a jednou dolní víčko [10,16] nebo o třech pacientech [30,37] na šesti horních víčcích jako u našeho sdělení. Byl zaznamenán současných výskyt MCC na obou víčkách stejného oka [26]. Jednoznačně tedy převažuje postižení horního víčka, což souvisí s jeho větší sluneční expozicí [30]. Zhodnocení většího počtu nemocných s víčkovou formou MCC se uskutečnilo pomocí multicentrické studie ze sedmi pracovišť [33], bylo zachyceno 14 pacientů, a to devět žen a pět mužů, postiženo bylo 11 horních víček, dvě dolní víčka a jednou kantus. Věk nemocných se pohyboval mezi 48 roky až 96 roky, v průměru 72 roků. Nejpočetnější studie z let 1988 až 2011 zahrnuje 375 pacientů s MCC všech typů s průměrným věkem 75 let, z čehož bylo 70 % žen [41]. Vyšší zastoupení žen v 64 % potvrzuje multicentrická studie také u postižení samotných víček [33]. Absolutní počty žen s MCC víček uvádí publikace o malém počtu nemocných [16,21,23] ve shodě s naším pozorováním. Pacienti mladší 50 let s MCC jsou zastoupeni jen v 5 % [2]. Byly již popsány zcela raritní případy pozorování MCC u jedinců mladších 18 let, v anglosaské literatuře k roku 2011 bylo možno vyhledat jen 9 kasuistik [2]. Musí se proto vyzdvihnout systematická dětská onkologická péče v ČR a její screeningový program, neboť bylo zaznamenáno dvojí pozorování MCC u dětí. Pražští dětští onkologové popisují vůbec nejmladšího pacienta s MCC, dvouletého batolete ženského pohlaví [31]. Brněnští dětští onkologové sledovali devítiletou dívku s MCC hlavy s dlouhodobým přežíváním více než 10 let po absolvování komplexní terapie (excize tumoru, radioterapie 40 Gy, disekce spádových lymfatických uzlin s chemoterapií) [2].
Klinický obraz MCC u našich tří pacientek se lišil. U dvou starších (obrázek 4A a 4B) se jednalo o klasický nudulární polokulovitý, nebolestivý a tuhý červenofialový nádor [34], zatím co u mladší se nález podobal chronickému chalaziu. Teprve progrese a nepříznivá odpověď na exkochleaci vedly k provedení probatorní excize. Chalazion patří do diferenciální diagnózy MCC, byl veden jako primární diagnóza u dvou pacientek [10]. Mementem je čínská kasuistika, kdy po odstranění „chalazia“ horního víčka bez histologické verifikace se po třech letech objevily plicní obtíže způsobené metastázami a ulcerózní změny v orbitální oblasti na již dříve postižené straně [7]. Obdobné pozorování zaznamenali i slovenští autoři počáteční eletrokauterizaci po šesti měsících následovala exkochleace „tzv. chalazia“. Po dalších třech měsících byl aplikován do ložiska diprophos. Až po roce následuje totální odstranění již histologicky diagnostikovaného MCC [15]. Přes komplexní onkologickou terapii oba případy skončily letálně. Chalazion patřil na první místo diferenciální diagnózy multicentrické studie víčkových projevů MCC v 36 % [33]. Rychlá recidiva jakéhokoliv chalazia u pacientů středního věku nebo starších pacientů by měla být indikací pro jeho histologickou verifikaci, aby se vyloučila možnost vzniku maligního nádoru [10]. Úvahu o nutnosti histologické verifikace u nejasných lézí jsme potvrdili u 60 nemocných se zánětlivým pseudotumorem v retrospektivní studii. Mezi benigní nádory víček do diferenciální diagnózy patří kavernózní hemangiom a hemangiolymfangiom [2], řadící se k vaskulárním hamartomům [34]. U maligních procesů víček je to především maligní lymfom, amelanotický melanom, skvamózní karcinom, bazaliom (bazocelulární karcinom) [34,35] a sebaceozní karcinom [43]. Tyto nádory byly zastoupeny také v našem více než tisícičlenném souboru.
MCC je označovaný také jako neuroendokrinní karcinom, neboť cytoplasma obsahuje hodně volných ribosomů, vlákna obsahující cytoplazmatické „hroty“, která bývají obvykle spojena s nervovými zakončeními. Charakteristická jsou granula s vazbou na membránu považovaná za neurosekretorickou. Přítomnost neuroskretorických granulí vedla k analogiím mezi MCC a systémem zahrnující amine precursor uptake decarboxylation (APUD) [38], z čehož vznikl dnes již historický název kutánní APUDom. Toker popsal trabekulární karcinom kůže jako nediferencovanou lézi vykazující časté mitózy, složené z anastomózujících „trabekulů“ a hnízd buněk [44]. Verifikace MCC se v současnosti opírá kromě mikroskopického obrazu i o imunohistochemická vyšetření, ke kterým patří pozitivita na epitelové a neuroektodermové markery [17,34]. Stávají hlavním diagnostickým kritériem. Slovenští autoři u svých dvou pozorování je neuvádějí [15]. Vzhledem k tomu, že diagnóza MCC může být závislá na imunofenotypu nádorových buněk, hledají se stále nové markery. Mezi ně patří nově: Insulinoma-associated 1, což je faktor transkripce projevující se v tkáních podstupujících terminální kožní neuroendokrinní neoplasmatickou diferenciaci [35]. Rovněž i vinohradští patologové zařadili do palety markerů dosud nepoužívaný typ pro časnou fázi neuronální diferenciaci u neuroendokrinních MCC, a to III beta-tubulin s 91 % výtěžností [18]. Navíc potvrdili u rekurentních nádorů možnost změny exprese jednotlivých markerů [18,19]. My jsme navázali na jejich práci a k paletě [19] epitelových a neuroektodermových markerů jsme přiřadili proliferační marker Ki67.
Nadměrná expozice slunečního či ultrafialového záření spolu s imunitní supresí a pokročilý věk jsou hlavní rizikové faktory pro vznik MCC [39]. V etiologii procesu se uvažuje o významném vlivu polyomavirové infekce Merkelových buněk. Merkel Cell Polyomavirus (MCPyV či MCP) je malý DNA virus s cirkulárním a dvouvláknovým DNA genomem. MCP je virus často zjištěný na zdravé lidské kůži, což naznačuje, že jeho infekce je rozšířená v obecné populaci a stal se celoživotní složkou kožní flory. Primární infekce se vyskytuje v dětství [24]. Sérologické studie ukazují až 88% přítomnost protilátek MCP u dospělých a více než 40% přítomnost u dětí mladších pěti let. Objev MCP v 80 % MCC podporuje virovou etiologii [8,24], zatímco zbývajících 20 % nádorů má velké množství mutací spojených s UV zářením. Uvažuje se proto, že MCP může být zodpovědný za maligní transformaci a ultrafialové záření vyvolávající poškození DNA se podílí na vzniku MCP negativních nádorů [8]. Důležitým faktorem je, že UV-indukovaný antigen u virově negativních nádorů i MCP onkogenetický antigen jsou nutné pro růst nádoru, jsou tedy imunogenetické. Obranné T-lymfocyty specifické pro tyto antigeny jsou u pacientů často vyčerpány a inhibiční molekuly PD-1 zůstávají přítomny v nádorech [8]. Souvislost s rozvojem nádorů MCC naznačuje zpětnou virovou příčinnou vazbu, neboť existuje vyšší výskyt MCC u pacientů s imunosupresivní terapií a u transplantací orgánů [18]. Vlivem transplantací orgánů a B-lymfocytárních malignit narůstá výskyt MCC u těchto nemocných, ale nebyl prokázán vyšší počet MCC na kohortě 300 000 nemocných s AIDS. Riziko vzniku u této nemocí koresponduje se zdravou populací [14]. Sekundární malignity rovněž provázejí MCC, jsou to skvamózní karcinomy jinde na kůži či adenokarcinom ovarií a prsu [6] či hematologické malignity [6,42]. Obě tyto studie se dotýkají populace Israelitů. Při srovnání pacientů s MCC a kontrolní zdravou skupinou byla identifikovaná MCP odvozená subpopulace CD 8 s T-lymfocytární odpovědí proti 35 rozdílným peptidovým sekvencím. Byl také identifikován jeden epitop vázaný na HLA-A24 [25]. Morfologické hodnocení ukázalo, že Merkelovy buňky s negativní MCP mají nepravidelná jádra a bohatší složení cytoplasmy, zatímco u Merkelových buněk s pozitivním MCP jsou jednotně oválná jádra a chudší složení cytoplasmy [17]. Imunologický jev spontánní regrese metastatického procesu poukazuje na důležitost imunitního systému při této nemoci [9]. Od roku 1997 bylo zaznamenáno v literatuře šest dalších pozorování. V lymfatických uzlinách byla následně prokázána fibróza a kumulace makrofágů a dalších chronických zánětlivých krevních buněk, což vedlo k domněnce o T-lymfocyty vyvolané imunitní reakci [46].
MCC je agresivní tumor s vysokou tendencí pro lokání recidivy a vzdálené šíření, což ovlivňuje charakter léčby [27]. Terapie MCC jako celku probíhá v několika stadiích podle klinické směrnice pro léčbu a management MCC. Prvotní a zásadní je totální odstranění tumoru s potvrzením nepřesahování tumoru na okrajích chirurgické excize. Bloková disekce lymfatických uzlin je indikovaná jen při prokázaném nálezu tumorózní infiltrace [32]. Radioterapie má vzrůstající roli, je alternativní metodou pro lymfatickou disekci, u pacientů s neúplným chirurgickým výkonem, který nelze již doplnit a jako paliativní postup u inoperabilních stavů [32] a redukuje riziko lokálních recidiv [27]. Změnu kvality života způsobenou nemocí a léčbou nelze často přesně oddělit. Zvláště je to důležité pro pacienty, kteří by se mohli vyhnout nepříznivým vedlejším účinkům spojeným s radioterapií. Samotná operace by mohla poskytnout obdobný prospěch jako operace s adjuvantní radioterapií než agresivní ozáření, což může být vhodnější u nevyléčitelných stavů [36]. Systémová chemoterapie často doplňuje chirurgický a radioterapeutický postup a následuje lymfatickou disekci. Chemoterapie je také indikovaná pro diseminovanou formu při vzdálených metastázách [32], přesto klinický benefit pro celkové přežití je nejasný [39]. Existuje široký výběr cytostatik: např. eposide a cisplatina, které byly použity u naší pacientky, dále se doporučuje doxorubicin a paclitaxen. Všechny uvedené látky se i vzájemně v léčebných protokolech kombinují [4]. Nová terapeutická strategie využívá inhibicí a stimulací imunitní reakce proti tumorózním buňkám infikovanými MCP pomocí imunostimulátorových cytokinů zahrnující interferon a interleukin-2 [48]. Imunokompromitovaní pacienti s tumorovým PD-1 byli schváleni FDA pro testování imunoterapie pomocí protilátky anti-PD-1: avelumabu [5]. U 88 pacientů neodpovídající příznivě na chemoterapii, byla objektivní odpověď na avelumab u 28, z toho u 8 z nich byl kompletní léčebný efekt [20].
Terapie víčkových projevů MCC se opírá o dostatečnou resekci tumoru do zdravé tkáně [30,33], což jsme potvrdili i u našich nemocných. Nutnost doplňující terapie ze sledovaných 7 studií [10,16,21,23,30,33,37] včetně našich probandů byla nutná v 24% z 29 pacientů. Jednalo se o samostatnou radioterapii u dvou nemocných před rokem 2000 [13,16]. U dvou pacientů, včetně námi sledované byla uplatněna samotná chemoterapie [33], přičemž u naší nemocné se jednalo o paliativní formu k zabránění růstu bez cíle zlikvidovat nádor, což se ukázalo za správný postup. Jednalo se spíše o prevenci, neboť nebyl nakonec s jistotou prokázán skutečný metastatický rozsev. Tím se zabránilo eventuálním výrazným vedlejším účinkům cytostatik při klasickém použití agresivní chemoterapie s cílem likvidovat nádorové buňky rozeseté po organismu. Kombinovaná terapie se týkala tří pacientů, a to radioterapie s chemoterapií dvakrát a jednou nodulární disekce, která byla zajištěna radioterapií [33]. Vzdálené metastázy MCC se mohou projevit v kostech, mozku, játrech a plicích krevní cestou, časnější fází jejich šíření představují metastázy lymfatickou cestou do regionálních uzlin [30,33,41]. Byly popsány zcela ojedinělé nitrooční metastázy MCC do uveální tkáně [22,40,45], tedy krevní cestou.
Klasické zobrazovací metody: rtg plic a sonografie jater jsou součástí každého onkologického stagingu, které slouží k záchytu eventuálních patologických změn v daných orgánech. Toto vyšetření jsme vždy provedli i u našich pacientek. Staging MCC zahrnuje kompletní vyšetření kůže a lymfatického systému a pokud je uvedeno, může zahrnovat i speciální znázorňovací metody (CT, MR nebo PET-CT) [32]. Pro lymfatický systém je to především scintigrafie, která může při periokulární primární lokalizaci detekovat patologický proces v preaurikulárních a submandibulárních uzlinách [12]. My jsme pro detekci eventuálních patologických změn lymfocytárního systému a slinných žláz využívali ultrazvukové vyšetření s použitím sondy o frekvenci 7,5–10 MHz. Současné moderní přístroje umožňují detekovat změny od velikosti 0,1 mm. Na základě zhodnocení charakteru uzlin (velikosti, tvaru, povrchu, echogenity, struktury a vaskularizace) lze vyslovit podezření na možnou malignitu či metastatické postižení [1,13,47]. Zároveň provedená fotodokumentace sloužící k srovnání nálezů v čase. Vyšetření není zatěžující a je kdykoliv proveditelné zkušeným odborníkem.
Pro neokulární MMC platí, že se vrací v 66 % a úmrtnost je 33%. Zatím nebyl zaznamenán výrazný rozdíl v prognóze metastatických MCC s pozitivním či negativním MCP [17]. Budoucnost ukáže, jak významná bude imunomodulační léčba i dalším anti-PD1 protilátkami pembrolizumab a nivolumab, kromě povoleného FAD avelumabu ke studiím [9]. Důsledné sledování těchto pacientů je doporučeno kvůli možnému vysokému výskytu recidiv s možnou infiltrací lymfatického systému [30]. Velmi vzácně vznikají MCC v oblastech chráněných proti slunci, jako jsou genitálie a ústa, kde východiskem je mukózní membrána. Charakterizuje je zvláště špatná prognóza [17]. Nebezpečí úmrtí představuje zvětšující se velikost nádoru především s pozitivním nálezem přítomnosti MCC v regionálních uzlinách, což potvrdila studie 375 pacientů [41]. Prognóza byla stanovena v dlouhodobě sledovaných studiích víčkových nádorů MCC o třech pacientech, kdy průměrná sledovací doba byla 50 měsíců [30] nebo 2 roky či 4,6 a 6 let [37], obdobně jako u naší sestavy. Další 14-ti členná studie měla dobu sledování v průměru 33 měsíců [33]. Bylo zaznamenáno jen jedno úmrtí na základě metastázy do slinné žlázy i přes kombinovanou radiochemoterapii [33], což ukazuje jen na 4 % zátěž.
Závěr
Potvrdili jsme raritní výskyt MCC v oftalmologické lokalizaci. V našem osmiletém rozboru všech nádorů víček byl zastoupen jen v 0,19 %, z toho v části souboru s maligními nádory v 0,37 %. Zásadní význam pro úspěšnou léčbu MCC představuje dostatečně radikální výkon potvrzený histologickou verifikací a současně je nezbytná následná plastika víčka. Onkologický přístup se u obou pacientek zásadně lišil. Při negativním stagingu u mladší z nich následovala jen kontrolní vyšetření včetně ultrazvukového vyšetření krčních uzlin, které bylo důležité pro časný eventuální záchyt metastáz. Doba pozorování byla pět let, to znamená z onkologického hlediska vyléčený pacient. U starší pacientky pro podezření z metastáz bylo použita chemoterapie. Naštěstí nakonec se metastázy nebyly potvrzeny, proto po dvou letech tato léčba mohla být ukončena, pacientka bude dále sledovaná s předpokládanou dobrou prognózou.
Předneseno na XXI. výročním sjezdu ČOS v Brně, 2013.
Autoři práce prohlašují, že vznik i téma odborného sdělení a jeho zveřejnění není ve střetu zájmů a není podpořeno žádnou farmaceutickou firmou.
Do redakce doručeno dne: 25. 7. 2018
Do tisku přijato dne: 24. 10. 2018
MUDr. Jan Krásný
Škrobárova 50
10 034 Praha 10
Sources
1. Ahuja, AT., Ying, M., Ho, SY. et al.: Ultrasound of malignant cervical lymph nodes. Cancer Imaging, 8; 2008 : 48–56.
2. Bajčuiová, V.: Merkelův karcinom u mladé dívky. Somatuline bulletin 3; 2012 : 9–13.
3. Bichakjian, CK., Lowe, L., Lao, CD. et al.: Merkel cell carcinoma: critical review with the guidelines for multidisciplinary management. Cancer, 110; 2007 : 1–12.
4. Becker, JC., Lorenz, E., Ugurel, S., et al.: Evalution of real-world treatment outcome in patients with distant metastatic Merkel cell carcinoma following second-line chemotherapy in Europe. Oncotarget, 8; 2017 Jul, doi: 10.18632/oncoterget.19218
5. Bommareddy, PK., Kaufman, HK.: Avelumab and other recent advances in Merkel cell carcinoma. Future Onkol, 13; 2017 Dec, doi: 10.2217/fon-2017-0305
6. Brenner, B., Sulkes, A., Rakowsky, E., et al.: Second neoplasma in patient with Merkel cell carcinoma. Cancer, 91, 2001 : 1358–1362.
7. Chen, L., Zhu, L., Wu, J., et al.: Giant Merkel cell carcinoma of eyelid: a case report and review of the literature., Word J Surg Oncol, 9; 2011 May, doi: 10.186/1477-7819-9-58.
8. Colunga, A., Pulliam, T., Nghiem, P.: Merkel cell carcinoma in the age of immunotherapy: afacts and hopes. Clin Cancer Res, 1, 2017 Dec, doi: 10.1158/ccr-17-0439.
9. Connelly, TJ., Kowalcyk, AP.: Another case of spontaneous regression of Merkel cell (neuroendocrine) carcinoma. Dermatol Srg, 23; 1997 : 588–590.
10. Di Maria, A., Carnevali, L., Redaelli, C., et al.: Primary neuroendocrine carcinoma (Merkel cell tumor) of the eyelid: a report of two cases. Orbit, 19, 2000 : 171–177.
11. Duprat, JP., Landman, G., Salvajoli, JV., et al.: A review of the epidemiology and treatment of Merkel cell carcinoma. Clinics, 66; 2011 : 1817–1823.
12. Echegoyen, JC., Hirabavashi, KE., Lin, KY., et al.: Imaging of eyelid lymphatic drainage. Saudi J Ophthalmol, 4; 2012 : 441–443.
13. Eisenmenger, LB., Wigging, RH. 3rd.: Imaging of head and neck lymph nodes. Radio Clin North A, 53; 2015 : 115–132.
14. Engel, EA., Frisch, M., Goedert, JJ., et al.: Merkel cell carcinoma and HIV infection. Lancet, 359, 2002 : 497 – 498.
15. Furdová, A., Michálková, M., Javorská, L.: Karcinóm z Merkelových buniek mihalnice a očnice. Ces Slov Oftal, 74, 2018 : 37–43.
16. Gäckle, HC., Spraul, CW., Wagner, P. et al.: Merkel cell tumor of the eyelids: review of the literature and report of 2 patients. Klin Monbl Augenheilkd, 216; 2000 : 10–16.
17. Jaeger, T., Ring, J., Andres, C.: Histological, immunohistological, and clinical features of Merkel cell carcinoma in correlation to Merkel cell polyomavirus status. J Skin Cancer, 7; 2012 May, doi: 10.1155/2012/983421
18. Jirásek, T., Mandys, V., Viklický, V.: Expression of class III beta-tubulin in neuro-endocrine tumors of gastrointestinal tract. Folia Histochem Cytobiol, 40, 2002 : 305–310.
19. Jirásek, T., Matěj, R., Pock, L. et al.: Karcinom z Merkelových buněk - imunohistochemická studie v souboru 11 pacientů. Ces Slov Patol, 45, 2009 : 9–13.
20. Kaufman, HL., Russell, J., Hamod, O. et al.: Avelumab in patients with chemotherapy-refractory metastatic Merkel cell carcinoma: a multicentre, single-group, open-label, phase 2 trial. Lancet Oncol, 17; 2016 : 1374–385.
21. Kirkham, N., Cole, MD.: Merkel cell carcinoma: a malignant neuroendocrine tumour of the eyelid. Brit J Ophthalmol, 67; 1983 : 600–603.
22. Kirwan, C., Carney, D., O´Keefe, M.: Merkel cell carcinoma metastasis ot the iris in a 23 year old female. Ir Med J, 102; 2009 : 53–54.
23. Lamping, K., Fischer, MJ., Vareska, G., et al.: A Merkel cell carcinoma of the eyelid. Ophthalmology, 90; 1983 : 1399–1402.
24. Liu, W., MacDonald, M., You, J.: Merkel cell polyomavirus infection and Merkel cell carcinoma. Curr Opin Virol, 20; 2016 : 20–27.
25. Lyngaa, R., Pedersen, NW., Schrama, D., et al.: T-cell responses to ontogenic Merkel cell polyomavirus proteins distinguish Merkel cell carcinoma patients from healthy donors. Clin Cancer Res, 20; 2017 : 1768–1778.
26. Marshmann, WE., McNab, AA.: Merkel cell tumour occurring simultaneously in the upper and lower eyelids. Austral N Z J Ophthalmol, 24; 1996 : 377–380.
27. Medina-Franco, H., Urist, MM., Fiveash, J. et al.: Multimodality treatment of Merkel cell carcinoma: case series and literature review of 1024 cases. Ann Surg Oncol, 8, 2001 : 204–208.
28. Merkel, F.: Tastzellen und Tastkorperchen bei den Haustieren und Menschen. Arkiv für Mikroskopische Anatomie und Entwicklungsmechasnik, 11; 1875 : 636–652.
29. Miller, RW., Rabkin, CS.: Merkel cell carcinoma and melanoma. ethiological similarities and differences. Cancer Epidemiol Biomarkers Prev, 8; 1999 : 153–158.
30. Missotten, GS., de Wolff-Rouendaal, D., de Keizr, RJW.: Merkel cell carcinoma of the Eyelid. Review of the Literature and Report of Patients with Merkel Cell Carcinoma Showing Spontaneos Regression. Ophthalmology, 115; 2008 : 195–201.
31. Mottl, H., Abrhámová, J.: Nádor z Merklových buněk u dvouleté dívky – kasuistika. Klin Onkol, 3; 1990 : 19–21.
32. NCCN Merkel Cell Carcinoma Panel Members. NCCN Clinical Practice Guidelines: Merkel cell carcinoma V.1.2010. National Comptrehesive Cancer Network, PA, USA, 2010 ww.nccn.org/index.asp.
33. Peters GB., Meyer, DR., Shields JA., et al.: Management and prognosis of Merkel cell carcinoma of the eyelid. Ophthalmology, 108; 2001 : 1575–1579.
34. Rodoers, R., Jakobiec, FA., Hidayat, AA.: Eyelid tumor of apocrine, endocrine and pilar origins. In Albert, D.M., Jakobiec, F.S.: Principes and Practice of Ophthalmiology (vol. 3), W. Saunder Comp., Philadelphia, 1994, p. 1771–1798.
35. Rush, PS., Rosenbaum, JN., Roy, M., et al.: Insulinoma-associated 1: a novel nuclear marker in Merkel cell carcinoma (cutaneous neuroendorine carcinoma). J Cutan Pathol, 1, 2017 Nov, doi: 10.1111/cup. 13079.
36. Rish, Z., Fields, RC., Lee, N., et al.: Radiation therapy in the management of Merkel cell carcinoma current perspectives. Excerpt Rev Dermatol, 6, 2011 : 395–404.
37. Saadi, AK., Danks, JJ., Cree, IA., et al.: Merkel cell tumor: case report and review. Orbit, 18; 1999 : 45–52.
38. Sassani, JW., Jakobiec, FA., Hidayat, AA.: Usual eyelid tumors. In Albert, D.M., Jakobiec, F.S.: Principes and Practice of Ophthalmiology (vol. 3), W. Saunder Comp., Philadelphia, 1994, p. 1812–1823.
39. Schadendorf, D., Lebbé, C., Zur Hausen, A. et al.: Merkel cell carcinoma. epidemiology, prognosis, therapy and unmed medical needs. Eur J Cancer, 71, 2017 : 53–69.
40. Smal, KW., Rosenwasser, GO., Alexander, E. et al.: Presumed chorioidal metastasis of Merkel cell carcinoma. Ann Ophthalmol, 22; 1990 : 187–190.
41. Smith, FO., Yue, B., Marzban, SS., et al.: Both tumor depth and diameter predictive of sentinel lymph nodules. Status and survival in Merkle cell carcinomas. Cancer, 15; 2015 : 3252–3260.
42. Tadmor, T., Liphshitz, I., Aviv, A. et al.: Increased incidence of chronic lymphocytic leukaemia and lymphomas in patients with Merkel cell carcinoma – a population bases study of 335 cases with neuroendocrine skin tumour. Br J Haematol, 157, 2912 : 457–462.
43. Tanahashi, J., Kashima, K., Daa, T. et al.: Merkel cell carcinoma co-existent with sebaceous carcinoma of the eyelid. J Cutan Pathol, 36; 2009 : 383–386.
44. Toker, C.: Trabecular carcinoma of the skin: an ultrastructural study. Arch Dermatol, 105; 1972 : 107–110.
45. Trichopoulos, N., Augsburger, JJ.: Neuroendocrine tumors metastatic to the uvea: diagnosis by fine needle aspiration biopsy. Graefes Arch Clin Exp Ophthalmol, 244; 2006 : 524–528.
46. Wooff, JC., Tritnes, JR., Walsh, NM., et al.: Complete spontaneous regression of metastatic Merkel cell carcinoma: a case report and review of the literature. Am J Dermatopathol, 32, 2010 : 614–617.
47. Ying, M., Bhatia, KSS., Lee, YP, et al: Review of ultrasonography of malignant neck nodes. Cancer Imaging, 13; 2013 : 658–669.
48. Zanetti, I., Coati, I., Alaibac, M. Interaction between Merkel cell carcinoma and the immune system: pathogenetic and terapeutic aplications. Mol Clin Oncol, 7; 2017, doi: 10.3892/mco. 2017.1406
Labels
Ophthalmology
Article was published inCzech and Slovak Ophthalmology

2018 Issue 5-
All articles in this issue
- OČNÍ PROJEVY GRANULOMATÓZY S POLYANGIITIDOU
- VÝTĚŽNOST ZOBRAZOVACÍCH MODULŮ ROHOVKOVÉHO TOMOGRAFU PRO VČASNOU DIAGNOSTIKU ROHOVKOVÝCH EKTÁZIÍ
- CENTRÁLNÍ TLOUŠŤKA ROHOVKY U NORMOTENZNÍCH A HYPERTENZNÍCH GLAUKOMŮ
- PILOTNÍ VÝSLEDKY IMPLANTACE NOVÉ HYDROFOBNÍ NITROOČNÍ ČOČKY ZEISS LUCIA 611P
- MERKELŮV KARCINOM VÍČEK (KLINICKO - HISTOLOGICKÁ STUDIE)
- PACHYCHOROIDNÍ CHOROBA MAKULY – KAZUISTIKA
- Czech and Slovak Ophthalmology
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- OČNÍ PROJEVY GRANULOMATÓZY S POLYANGIITIDOU
- MERKELŮV KARCINOM VÍČEK (KLINICKO - HISTOLOGICKÁ STUDIE)
- PACHYCHOROIDNÍ CHOROBA MAKULY – KAZUISTIKA
- PILOTNÍ VÝSLEDKY IMPLANTACE NOVÉ HYDROFOBNÍ NITROOČNÍ ČOČKY ZEISS LUCIA 611P
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

