-
Medical journals
- Career
Pyridoxin dependentní epilepsie – kazuistiky
Authors: Š. Aulická 1; L. Fajkusová 2; P. Šilerová 2; L. Elstnerová 3; T. Jimramovský 3; E. Dortová 4; H. Ošlejšková 1
Authors‘ workplace: Centrum pro epilepsie Brno, Klinika dětské neurologie LF MU a FN Brno 1; Centrum molekulární biologie a genové terapie, Interní hematoonkologická klinika LF MU a FN Brno 2; Pediatrická klinika LF MU a FN Brno 3; Neonatologické oddělení, FN Plzeň 4
Published in: Cesk Slov Neurol N 2017; 80/113(3): 346-349
Category: Case Report
doi: https://doi.org/10.14735/amcsnn2017346Tento projekt byl podpořen Lékařskou fakultou Masarykovy Univerzity (číslo grantu ROZV/ 24/ / LF/ 2016).
Overview
Pyridoxin dependentní epilepsie je autozomálně recesivně dědičné onemocnění, které se prenatálně, neonatálně a v časném dětství do 3 let projevuje farmakorezistentními epileptickými záchvaty. Jde o dědičné poruchy metabolizmu pyridoxinu asociované s mutacemi v genech ALDH7A1 nebo ALDH4A1. Pyridoxin dependentní epilepsie jsou úspěšně léčitelné vysokými dávkami pyridoxinu. Diagnostika je založena na genetickém a biochemickém vyšetření. Prezentovány jsou kazuistiky tři pacientů s typickým průběhem pyridoxin dependentní epilepsie a geneticky potvrzenou mutací v ALDH7A1 genu.
Klíčová slova:
pyridoxin – pyridoxal-fosfát – pyridoxin dependentní epilepsie – pyridoxin dependentní záchvatyÚvod
Pyridoxin dependentní epilepsie (PDE) jsou autozomálně recesivně dědičná onemocnění, která se projevují farmakorezistentními epileptickými záchvaty prenatálně, neonatálně a v časném dětství do 3 let věku. Jde o poruchy metabolizmu pyridoxinu asociované s mutacemi v genech ALDH7A1 nebo ALDH4A1. Incidence se uvádí v rozmezí 1 : 276 000 – 1 : 100 000.
Patofyziologie
Pyridoxin je (vedle pyridoxalu a pyridoxaminu) součástí komplexu vitaminu B6. Všechny tyto látky, společně se svými fosfáty, se účastní metabolizmu aminokyselin a sacharidů. Všechny formy vitaminu B6 se vyskytují v potravě a jsou vstřebávány ze střeva. Aktivní formou tohoto vitaminu je pyridoxal-5-fosfát, důležitý kofaktor enzymů.
Table 1. Genetické a biochemické vyšetření u PDE. 
α-AASA – semialdehyd kyseliny α-aminoadipové, P5C – pyrrolin-5-karboxylát, CSF – mozkomíšní mok, PDE – pyridoxin dependentní epilepsie. PDE jsou podmíněny defektem enzymu α-AASA dehydrogenázy (semialdehyd kyseliny α-aminoadipové dehydrogenáza), který je způsoben mutacemi v genu ALDH7A1/ antikvitin. α-AASA dehydrogenáza se zúčastňuje degradace lysinu v mozku: odbourává meziprodukty P6C (piperidin-6-karboxylát) a α-AASA (semialdehyd kyseliny α-aminoadipové) na kyselinu α-aminoadipovou. Při defektu α-AASA dehydrogenázy se v mozku kumuluje P6C, který inaktivuje pyridoxalfosfát. Ve zvýšené míře se tvoří i kyselina pipekolová, která působí jako modulátor kyseliny γ-aminomáselná (GABA).
Podtypem PDE je hyperprolinemie typu II – porucha podmíněná defektem enzymu pyrrolin-5-karboxylát dehydrogenázy, který zabezpečuje konverzi P5C (pyrrolin-5-karboxylát) – přes semialdehyd kyseliny glutamové – na glutamát. Tento enzymový defekt je způsoben mutacemi v genu ALDH4A1.
Chybná degradace lysinu, event. prolinu tedy vede ke kumulaci meziproduktů metabolických drah, které následně inaktivují pyridoxal-fosfát. Tento funkční deficit pyridoxal-fosfátu je možné překonat vysokými dávkami pyridoxinu (ze kterého následně pyridoxal-fosfát vzniká).
Klinický obraz
Pyridoxin dependentní záchvaty (PDS) se v typickém případu projevují jako paroxysmy generalizovaných tonicko-klonických křečí, často prolongovaných, výjimkou není status epilepticus. Vzácněji jsou popisovány paroxysmy atonické, myoklonické a infantilní spazmy. K přidruženým příznakům patří psychomotorická retardace, retardace expresivní složky řeči, iritabilita, obstrukční gastrointestinální příznaky a syndrom dechové tísně.
Lze odlišit dvě formy PDE: klasickou formu a atypickou formu.
Klasická forma PDE
V „klasickém“ případě se PDS objevují již v prvních hodinách po narození. Anamnesticky lze v některých případech zjistit i intrauterinní výskyt záchvatů od pátého měsíce gestace (vnímání klonických trhavých pohybů plodu v trvání 5 – 15 min). Intrauterinní záchvaty často vedou k hypoxii plodu, což v perinatálním období může vést k chybné diagnóze post-hypoxických křečí. Typickým znakem je rezistence na terapii běžnými antiepileptiky (AEDs) a rychlá odpověď na parenterální podání pyridoxinu intravenózně (i.v.) nebo intramuskulárně [1,2].
Atypická forma PDE
V „atypickém“ případě se pyridoxinová dependence projeví později, většinou kolem 18 měsíců věku (vzácněji až kolem 3 let věku). V neonatálním období diagnostiku komplikuje pozitivní efekt AEDs (nejčastěji fenobarbitalu), který se však postupně vytrácí. Pyridoxinový test provedený v tomto období bývá obvykle negativní. U dětí s refrakterními záchvaty do 18 měsíců (resp. až do 3 let věku) je proto vždy potřeba myslet na PDE a pyridoxinový test zopakovat [1,2].
Kritéria pyridoxinové dependence [1,3,4]:
- pozitivní pyridoxinový test – přerušení záchvatu po parenterálním podání pyridoxinu,
- kompletní kontrola nad záchvaty při monoterapii pyridoxinem,
- recidiva záchvatu po vysazení pyridoxinu,
- rezistence na AEDs,
- intrauterinní nebo časné novorozenecké záchvaty,
- pozitivní rodinná anamnéza.
Diagnostika
V diagnostice PDE se uplatňuje anamnéza, klinické vyšetření, EEG, zobrazovací metody (CT, MR mozku), biochemické a genetické vyšetření.
EEG
Elektroencefalografický obraz je bez specifického korelátu pro PDE. Iktálně nacházíme většinou vysokovoltážní bilaterálně synchronní komplexy hrot – pomalá vlna s frekvencí 1 – 4 Hz. Interiktálně je často přítomno difuzní zpomalení základní aktivity.
CT, MR mozku
U pacientů postižených PDE byly zjištěny určité asociace v CT a MR obraze mozku: atrofie šedé a bílé hmoty, hydrocefalus nejasné geneze, dysgeneze/ ageneze corpus callosum, leukoencefalopatie.
Genetické a biochemické vyšetření
Přehled genů, jejichž mutace jsou asociovány s poruchami metabolizmu pyridoxinu a biochemických markerů spojených s PDE, uvádí tab. 1 [3 – 6]. Molekulárně genetická analýza těchto genů byla zahájena v roce 2009 v Centru molekulární biologie a genové terapie, FN Brno.
Terapie a její rizika
PDE je úspěšně léčitelná vysokými dávkami pyridoxinu. V literatuře není jednoznačné doporučení pro dávkování – pohybuje se v širokém rozmezí 20–300 mg/den [1]. Optimální je takové dávkování, při kterém už jsou pod kontrolou epileptické záchvaty, a současně ještě nejsou vyjádřeny nežádoucí účinky u konkrétního pacienta [1]. U pacientů užívajících dlouhodobě vysoké dávky pyridoxinu byly jako nežádoucí účinky léčby popsány polyneuropatie, poruchy citlivosti, ataxie a titubace. V případě bolusového parenterálního podání vysoké dávky pyridoxinu může dojít k útlumu kardiorespiračních a neurologických funkcí se závažnými následky (bradykardie, apnoe, hypotonie) [1]. Bezpečná dávka pyridoxinu u dětí je 100 mg/den, kterou v případě nedostatečného efektu navyšujeme.
Soubor pacientů a výsledky
Prezentujeme soubor 25 pacientů, u kterých bylo ve FN Brno v období 5/2009–3/2015 provedeno genetické vyšetření na PDE (tab. 2). Vstupním kritériem pro genetické vyšetření byly refrakterní novorozenecké křeče s pozitivním nebo parciálně pozitivním pyridoxinovým testem. Do souboru byli zařazeni i pacienti s rozvojem křečí do 1 roku života, u kterých byla přítomna rezistence ke konvenční antiepileptické léčbě a nebyla objasněna příčina epilepsie. U 19 pacientů došlo k rozvoji křečové aktivity v novorozeneckém věku (v prvních hodinách až dnech života). V této skupině byla diagnóza PDE potvrzena u tří pacientů (u všech pacientů se jednalo o mutaci v ALDH7A1 genu). U zbylých šesti pacientů ve věku 3 – 12 měsíců byla zvažována atypická forma PDE. Tato diagnóza však nebyla potvrzena u žádného z nich.
V další části práce budeme prezentovat kazuistiky pacientů s potvrzenou diagnózou PDE.
Kazuistika 1
Chlapec J. CH. narozený v roce 2009, rodinná anamnéza bez pozoruhodností, porod spontánně záhlavím ve 37. týdnu. Před porodem pozorována decelerace ozev, během porodu zkalená plodová voda, Apgar skóre 7 – 8 – 9, porodní hmotnost 2 700 g/46 cm. V prvních hodinách po porodu byly přítomny nespecifické symptomy: neklid, třes, a vzhledem k dušnosti a vzedmutému břichu byla zvažována časná novorozenecká sepse, která nebyla potvrzena. V následujících dnech se zdravotní stav postupně stabilizoval a pacient byl 8. poporodní den propuštěn. Čtrnáctý poporodní den došlo k rozvoji generalizovaných klonických křečí s cyanózou a přechodem do status epilepticus. Tento akutní stav byl řešen i.v. fenobarbitalem, současně musel být pacient neodkladně zaintubován, byla zahájena umělá plicní ventilace (UPV). Přes adekvátní dávkování fenobarbitalu nedošlo k plné kontrole křečí, proto byl současně podán bolus pyridoxinu 100 mg i.v., po kterém křeče vymizely. Provedli jsme genetické vyšetření na PDE. Byly nalezeny dvě heterozygotní mutace v ALDH7A1 genu (c.503_506delTCTT a c.1008+3_1008+6delGAGT), čímž byla diagnóza PDE potvrzena. U obou rodičů a sourozence byla nalezena jedna z těchto mutací (u matky mutace c.503_506delTCTT, u otce mutace c.1008+3_1008+6delGAGT a u sourozence c.1008+3_1008+6delGAGT). Z komplementárních vyšetření byla provedena MR mozku a EEG – obojí s normálním nálezem.
Pacient má aktuálně 4,5 roku a je bez křečových projevů na dávce pyridoxinu 80 mg/ kg/ den. Přestože byl iniciálně přítomen centrální hypotonický syndrom, neurologický nález je nyní normální, psychomotorický vývoj odpovídá širší věkové normě.
Table 2. Soubor pacientů. 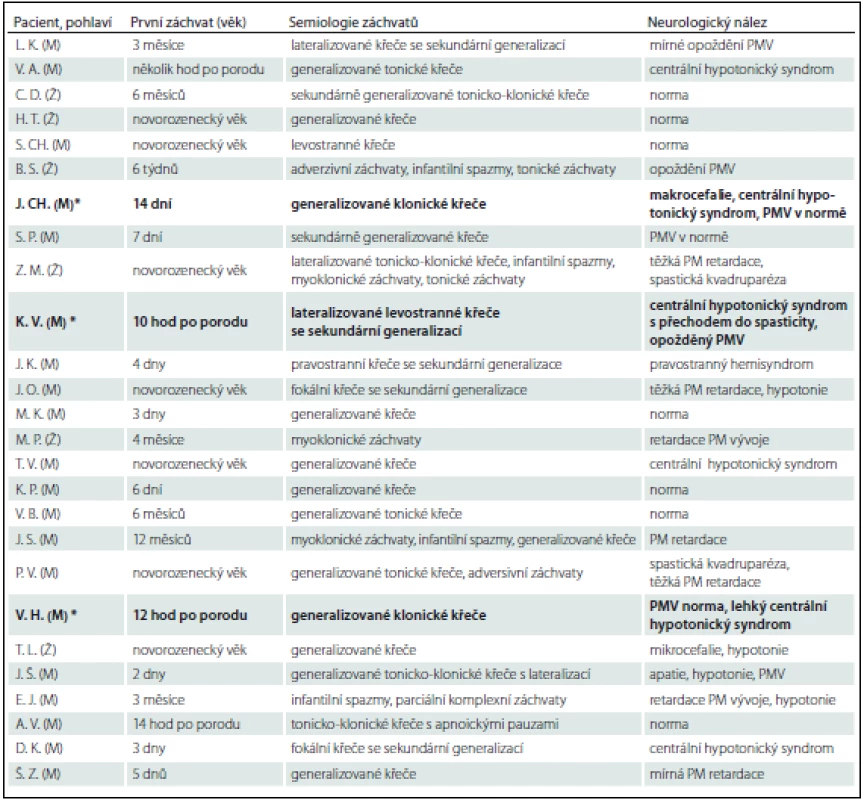
PMV – psychomotorický vývin, PM – psychomotorický. *Pacienti s geneticky potvrzenou diagnózou PDE. Kazuistika 2 (pacient z jiného pracoviště, anamnestická data jsou limitována)
Chlapec V. H. narozený v roce 2011. V rodinné anamnéze exitus letalis sourozence na refrakterní status epilepticus v 1,5 roce věku (generalizované klonické záchvaty měl od novorozeneckého věku). Porod proběhl v termínu sekcí. Generalizované klonické křeče se objevily 12 hod po porodu. Vzhledem k rodinné anamnéze byl akutně proveden pyridoxinový test (podáno bolusově 100 mg pyridoxinu i.v.), po kterém křeče hned vymizely. Podezření na PDE bylo následně potvrzeno genetickým vyšetřením – byly nalezeny dvě heterozygotní mutace v ALDH7A1 genu (c.871+2dupT a c.886_887GA>AT, p.(E268I)). U obou rodičů byla zjištěna jedna z těchto mutací (u matky mutace c.871+2dupT, u otce mutace p.(E268I)).
Pacientovi jsou nyní 4 roky a je bez křečových projevů při dávce pyridoxinu 10 mg/ kg/ den. Dávkování je aktuálně navyšováno pro lehké opoždění v psychomotorickém vývoji.
Kazuistika 3
Chlapec K. V. narozený v roce 2014. Rodinná anamnéza bez pozoruhodností, těhotenství bylo rizikové pro suspektní insuficienci placenty. Porod proběhl v termínu spontánně záhlavím, Apgar skóre 9 – 10 – 10, porodní hmotnost 3 670 g/52 cm. Rozvoj lateralizovaných levostranných křečí s postupnou sekundární generalizací a přechodem do status epilepticus s nutností intubace a UPV nastal 10 hod po porodu. V akutním iktálním EEG záznamu zjištěn burst suppression vzorec. Léčba byla zahájena standardně – bolusem fenobarbitalu v dávce 20 mg/ kg i.v. – bez efektu, rovněž midazolam v dávce 0,15 mg/ kg i.v. bez efektu. Vzhledem k neúčinnosti této konvenční antiepileptické léčby bylo následně přistoupeno k provedení pyridoxinového testu: po i.v. bolusu 100 mg pyridoxinu křeče ustoupily a vymizel burst suppression vzorec v EEG. Akutně provedená MR prokázala difuzní vazogenní mozkový edém bílé hmoty s vícečetnými hemoragiemi periventrikulárně bilaterálně. Ve věku 7 měsíců se objevily záchvaty charakteru infantilních spazmů, po navýšení pyridoxinu na dávku 80 mg/ kg/ den se již neopakovaly.
Aktuálně má pacient 9 měsíců a na kombinované terapii fenobarbital (5 mg/ kg/ den) a pyridoxin 80 mg/ kg/ den je bez křečových projevů. EEG bez specifické patologie, kontrolní MR mozku již s normálním nálezem. Iniciálně přítomný centrální hypotonický syndrom přechází do spasticity. Psychomotorický vývoj je opožděn – aktuálně na úrovni přelomu I./ II. trimenonu. Genetickým vyšetřením byly prokázány dvě heterozygotní mutace v ALDH7A1 genu (c.796C>T, p.(R266*) a c.517+2T>A). U obou rodičů byla zjištěna jedna z těchto mutací (u matky mutace p.(R266*), u otce mutace c.517+2T>A). Vzhledem ke klinickému obrazu, iniciálnímu MR nálezu, efektivitě pyridoxinu a pozitivitě genetického vyšetření se tedy nejspíše jedná o kombinaci PDE a symptomatické epilepsie na podkladě periventrikulárního krvácení.
Závěr
Hlavním smyslem diagnostiky PDE je možnost kauzální léčby, která signifikantně snižuje morbiditu a mortalitu pacientů. Předpokládáme, že v České republice se jedná o značně poddiagnostikované onemocnění a že jeho incidence bude s rozvojem nových diagnostických možností narůstat. Tento předpoklad podporuje skutečnost, že od roku 2009 – kdy byla ve FN Brno zavedena genetická diagnostika – jsme diagnózu PDE potvrdili u tří pacientů z celkového počtu 26 vyšetřených.
Seznam použitých zkratek
α-AASA – semialdehyd kyseliny α-aminoadipové
AEDs – antiepileptika
ALDH4A1 gen – aldehyde dehydrogenase 4 family, member A1
ALDH7A1 gen – aldehyde dehydrogenase 7 family, member A1
CSF – mozkomíšní mok
EDTA – kyselina etylendiamintetraoctová
GABA – kyselina γ-aminomáselná
PDE – pyridoxin dependentní epilepsie
PDS – pyridoxin dependentní záchvaty
P5C – pyrrolin-5-karboxylát
P6C – piperidin-6-karboxylát
3-MT – 3-metoxytyrozin
MUDr. Štefánia Aulická, Ph.D.
Centrum pro epilepsie Brno
Klinika dětské neurologie
LF MU a FN Brno
Černopolní 9
613 00 Brno
e-mail: stefania. aulicka@gmail.cz
Přijato k recenzi: 11. 10. 2016
Přijato do tisku: 13. 3. 2017
Sources
1. Parish A, Nissen MD, O’Neil C, et al. Vitamin B 6 Dependency Syndromes. eMedicine Paediatrics 2008. [accessed 2017 20 Mar]. Available from URL: http://emedicine.medscape.com/article/985667-overview.
2. Rusnáková Š, Fajkusová L, Jansová E, et al. Pyridoxin dependentní epilepsie – nové trendy v diagnostice a terapii. Neurol Praxi 2010;11(5):322 – 5.
3. Gospe SM. Pyridoxine-dependent seizures: new genetic and biochemical clues to help with diagnosis and treatment. Curr Opin Neurol 2006;19(2):148 – 53.
4. Plecko B, Paul K, Paschke E, et al. Bio chemical and molecular characterization of 18 patients with pyridoxine-dependent epilepsy and mutations of the antiquitin (ALDH7A1) gene. Hum Mutat 2007;28(1):9 – 26.
5. Baxter P. Pyridoxine-dependent seizures: a clinical and biochemical conundrum. Biochim Biophys Acta 2003;1647(1 – 2):36 – 41.
6. Farrant RD, Walker V, Mills GA, et al. Pyridoxal phosphate de-activation by pyrroline-5-carboxylic acid. Increased risk of vitamin B6 deficiency and seizures in hyperprolinemia type II. J Biol Chem 2001;276(18):15107 – 16.
Labels
Paediatric neurology Neurosurgery Neurology
Article was published inCzech and Slovak Neurology and Neurosurgery

2017 Issue 3-
All articles in this issue
- Vertebrogenní algický syndrom – medicína založená na důkazech a běžná klinická praxe. Existuje důvod něco změnit?
- Výsledky endokrinních funkcí hypofýzy po transsfenoidálních operacích afunkčních makroadenomů
- Radiologické nálezy u donošených novorozenců s hypoxicko-ischemickou encefalopatií
- Token test – validační studie české verze u osob vyššího věku a pacientů s neurodegenerativním onemocněním mozku
- Měření simulace – Test mince v ruce
- Efekty cílené orofaciální rehabilitace u pacientů s poruchou řečových funkcí po cévní mozkové příhodě
- Zobrazení difuzních tenzorů u pacientů s idiopatickým normotenzním hydrocefalem
- Anti-NMDAR protilátky u demyelinizačních onemocnění
- Pyridoxin dependentní epilepsie – kazuistiky
- Klasifikace nádorů centrálního nervového systému – WHO 2016 Update
- Kvalita života u soběstačných pacientů po cévní mozkové příhodě
- Myotonická dystrofie – jednota v různosti
- Febrilní křeče – méně je někdy více
- Riziko poškození plodu v důsledku rentgenových výkonů u gravidních žen
- Úspěšná léčba meningoencefalitidy vyvolané Cryptococcus gattii Ommaya rezervoárem a intratékální injekcí amfotericinu B – kazuistika
- Diferenciální diagnostika bithalamické a palidální hypointenzity – kazuistika s mutací HEXB
- Signifikantní edém mozku u neprasklé arteriovenózní malformace – kazuistika
- Czech and Slovak Neurology and Neurosurgery
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Myotonická dystrofie – jednota v různosti
- Riziko poškození plodu v důsledku rentgenových výkonů u gravidních žen
- Vertebrogenní algický syndrom – medicína založená na důkazech a běžná klinická praxe. Existuje důvod něco změnit?
- Febrilní křeče – méně je někdy více
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

