-
Medical journals
- Career
Deprese u vybraných neurologických onemocnění
Authors: I. Štětkářová 1; J. Horáček 2
Authors‘ workplace: Neurologická klinika 3. LF UK a FN Královské Vinohrady, Praha 1; Psychiatrická klinika 3. LF UK a NÚDZ, Praha 2
Published in: Cesk Slov Neurol N 2016; 79/112(6): 626-638
Category: Minimonography
doi: https://doi.org/10.14735/amcsnn2016626Overview
Deprese patří mezi nejčastější psychiatrická onemocnění, která se vyskytují u řady neurologických nemocí. Někdy jsou depresivní příznaky přímo součástí nemoci nebo se nejprve objeví deprese a poté se projeví neurologické onemocnění. Je důležité depresi včas diagnostikovat a léčit, protože jinak má neurologické onemocnění horší a těžší průběh, který se obtížněji ovlivňuje. Důsledné rozpoznání a vhodná léčba depresivních příznaků významně zvyšují kvalitu života nemocného. Přesná příčina vzniku deprese zatím stále není známa. Na jejím rozvoji se podílí vzájemná interakce mnoha rizikových faktorů. Mezi ně se řadí biologické, psychologické a sociální vlivy i faktory prostředí. Mezi hlavní klinické příznaky deprese patří poruchy nálady, myšlení, vnímání a poruchy psychomotorického tempa. Diferenciálně diagnosticky je třeba odlišit hlavně demenci. Mezi další stavy náleží depresivní syndrom navozený psychoaktivními látkami a různými léky. Typický akutně probíhající depresivní syndrom označujeme jako depresivní fázi. Ta může probíhat v lehké‚ střední nebo těžké formě. Základními metodami léčby deprese je podávání antidepresivních léků a psychoterapie. Léčebný efekt ve vztahu k hlavním symptomům deprese se po nasazení antidepresiv projeví většinou do 6 – 8 týdnů od začátku léčby. Detailně je charakterizován výskyt deprese u cévní mozkové příhody, roztroušené sklerózy, chronické bolesti, migrény, epilepsie a Parkinsonovy nemoci vč. současných doporučených léčebných postupů.
Klíčová slova:
deprese – cévní mozkové příhody – roztroušená skleróza – demence – chronická bolest – migréna – epilepsie – Parkinsonova nemocÚvod
Deprese je časté onemocnění, které se v populaci vyskytuje kolem 10 – 15 % [1 – 3]. Jsou patrné geografické odlišnosti ve výskytu deprese. V Africe (Maroko) se v současné době udává prevalence deprese 13,7 % [4], zatímco v Evropě (Švédsko) uvádí depresi při použití subjektivního dotazníku v běžné populaci jen 9,5 % respondentů [5]. Deprese se vyskytuje častěji u žen než u mužů (2 : 1). Po menopauze se riziko depresivní epizody u obou pohlaví vyrovnává. Výskyt stoupá s věkem, ale v poslední době je výraznější výskyt i v nižších věkových skupinách. Příčina je pravděpodobně v lepší diagnostice a účinnější zdravotnické osvětě, která usnadňuje záchyt již časnějších stadií depresivní poruchy.
Ve vyspělých státech představuje deprese jednu z nejčastějších příčin pracovní neschopnosti. V těchto zemích je zdravotnické osvětě věnována výrazná péče, ale přesto existuje poměrně značné procento osob, které se s depresivní epizodou k odborníkovi nedostaví. Deprese se často skrývá také za tělesnými stesky a zvláště u osob ve vyšším věku mohou v klinickém obraze dominovat polymorfní somatické potíže a smutek nemusí být přítomen. Deprese se velmi často vyskytuje společně se somatickým onemocněním. Jedním z typů deprese je tzv. sezónní deprese, kterou trpí kolem 5 % osob. Podle odhadů může průměrný praktický lékař v České republice očekávat, že až 10 % pacientů, kteří ho navštíví, trpí depresí [6].
U neurologicky nemocných osob je deprese velmi častá [7]. Vyskytuje se po cévní mozkové příhodě (CMP), u roztroušené sklerózy (RS), u epilepsie, Parkinsonovy nemoci (PN), Huntingtonově chorobě, nemocných s chronickou bolestí, u Alzheimerovy demence, po úrazech hlavy či u migrény [8 – 11]. Deprese provází také nemocné s polyneuropatií, akutní nebo chronickou infekcí nervového systému anebo osoby s nádorovým onemocněním. Výskyt depresivní epizody v pozdním věku má dvojnásobně vyšší riziko vzniku demence [12].
Je třeba pomýšlet i na farmakologicky navozené deprese [13]. Depresogenní potenciál mají antihypertenziva (např. beta blokátory), hormonální kontraceptiva, kortikosteroidy (prednizon, metylprednizolon), antiparkinsonika (levodopa, amantadin), opioidy (fentanyl, morfin), klasická antipsychotika, nesteroidní antirevmatika (diklofenak, ibuprofen), benzodiazepiny, antiulceróza (cimetidin, ranitidin), cytostatika (vinkristin, vinblastin, prokarbazin) nebo některá antibiotika (penicilin, tetracyklin). Potvrzením, že jde o depresi navozenou léky, je to, že k odeznění depresivních příznaků dojde po vysazení léku a obtíže se opět objeví po nasazení léčby.
Neléčená nebo nedostatečně léčená deprese zhoršuje celkovou kvalitu života těchto nemocných vč. kognitivních schopností a funkční kapacity nemocného [7]. Zhoršuje se průběh rehabilitace, více se zatěžují pečovatelé, zvyšují se náklady na léčbu a celkově se zhoršuje kvalita života nemocného. Problematická bývá i diagnostika deprese. Přítomnost některých neurologických příznaků (afázie, dysartrie apod.) znemožňuje validní sdělení stavu pacienta. Nemocní většinou popisují tělesné obtíže, úzkost a beznaděj místo příznaků smutku. Dalším problematickým příznakem je anergie nebo chronická únava [14], která rovněž patří k příznakům deprese. Diagnostické rozpaky mohou zvyšovat i jiné společné příznaky, např. zhoršení koncentrace, poruchy spánku a poruchy příjmu potravy. U řady neurologicky nemocných osob se psychické problémy mohou vyvinout teprve v průběhu choroby nebo brzy po stanovení diagnózy.
Cílem práce je seznámit čtenáře s diagnostikou a léčbou deprese u vybraných neurologických onemocnění, u kterých se deprese vyskytuje poměrně často a významně interferuje se základním neurologickým onemocněním.
Definice deprese
Deprese patří mezi závažná psychická onemocnění. Je definována jako patologicky smutná nálada, která neodpovídá daným okolnostem svou hloubkou nebo délkou trvání. Je ale třeba mít na paměti, že ne každá porucha nálady se může označit jako deprese.
Hlavním klinickým projevem je nepřiměřeně skleslá nálada provázená snížením fyzické aktivity a neschopností prožívat radost, vegetativními příznaky, úbytkem energie k vykonávání běžných denních činností a typickými změnami v cirkadiánní rytmicitě (poruchy spánku, kolísání nálady během dne). Tyto obtíže by měly trvat alespoň dva týdny. Deprese bývá také spojena se zpomalením psychomotorického tempa; jde o inhibovanou depresi. Doprovází-li depresi intenzivnější anxieta, může naopak nabýt agitované formy, která je velmi nebezpečná z hlediska rizika sebevraždy. Depresivní náladu typicky doprovázejí změny myšlení ve spektru počínajícím prostými pocity viny a vlastní insuficience, pesimizmem až po plně vyjádřené mikromanické bludy.
Příčiny vzniku deprese
Podobně jako v případě většiny psychických poruch se i na rozvoji deprese podílí vzájemná interakce mnoha rizikových faktorů. Mezi ně se řadí biologické vlivy (genetické a epigenetické faktory, úraz, nemoc apod.), psychologické vlivy (temperamentové vlastnosti a rysy jedince), faktory prostředí (závažné životní události, výchova) a sociální vlivy (rodina, škola, kulturní vlivy). Hovoříme o tzv. biopsychosociálním modelu nemoci [3].
Zajímavé je, že u více než 30 % nemocných s depresí se v rodině vyskytuje ještě další člen s depresivní poruchou. Předpokládá se vrozená dispozice spojená s narušením regulace neurotransmiterů a neuroplasticity v mozku těchto nemocných. Roli hrají i další faktory, z nichž nejdůležitější je stres. Výrazná životní ztráta (např. úmrtí blízké osoby, nemoc, ztráta zaměstnání, rozvod apod.) se řadí k nejvýznamnějším stresorům, které předcházejí rozvoji depresivní epizody. Více jsou ohroženi lidé, kteří tváří v tvář životní zátěži prožívají pocit bezmoci a neschopnosti danou situaci zvládnout. Tento koncept „naučené bezmocnosti“ může představovat fenotyp, který se v postižených rodinách předává mezi generacemi a podílí se tak na hereditě depresivní poruchy. Důležitý vliv na rozvoj depresivní epizody tedy má prostředí, a to jak rodinné, tak i společenské. Riziko depresivní poruchy je dáno interakcí rizikových genů a negativních životních událostí [15,16]. Nositelé rizikových alel tak reagují na negativní životní události vyšším rizikem rozvoje deprese [17,18]. Deprese není civilizační nemoc.
Proč deprese vzniká, zatím stále není jasné. Dříve se předpokládalo, že příčinou je porušená rovnováha monoaminů v mozku. Za významnou je dodnes považována porucha serotonergního přenosu [19]. V současnosti se má za to, že deprese vzniká v důsledku narušení synaptické denzity a neuronálních okruhů, které zahrnují mediofrontální kortex, hipokampus a další limbické struktury [20]. Osoby trpící depresí mají prokazatelně snížený objem mozkové tkáně v oblastech hipokampu, amygdaly i bazálních ganglií spolu se změnami neurotransmiterů [19,20].
Významné je rovněž narušení neuronální a behaviorální rytmicity, které se klinicky odráží např. v narušení spánku nebo ranních pesimech [1]. Důležitou roli hraje také imunitní systém, kdy se předpokládá zhoršená adaptace na stres spolu se zvýšenou tvorbou cytokinů [21]. Podíl na rozvoji sezónní deprese (dříve tzv. atypické zimní deprese, dnes označované jako sezónní afektivní porucha; SAD) má pak nedostatek světla v zimních měsících s dopadem na serotonergní systém mozku.
Klinické příznaky deprese
Mezi hlavní klinické příznaky deprese patří poruchy nálady (smutná nálada, anhedonie, ztráta zájmů, nižší nebo malá motivace pro jakoukoliv aktivitu, inhibice a apatie nebo naopak úzkost), poruchy myšlení a vnímání (snížená koncentrace, nerozhodnost, ztráta sebevědomí, pocity viny, beznaděj, přání zemřít a konečně u nejtěžších depresí také mikromanické, insuficientní, ruinační, hypochondrické a další bludy), poruchy psychomotorického tempa (zpomalení až ztuhlost, nebo naopak zvýšená aktivita až agitovanost) (tab. 1). Klinické příznaky musí trvat alespoň dva týdny. Měly by být v dostatečné tíži po většinu dnů a měly by se vyskytovat po delší dobu během dne.
Table 1. Časté klinické příznaky deprese. 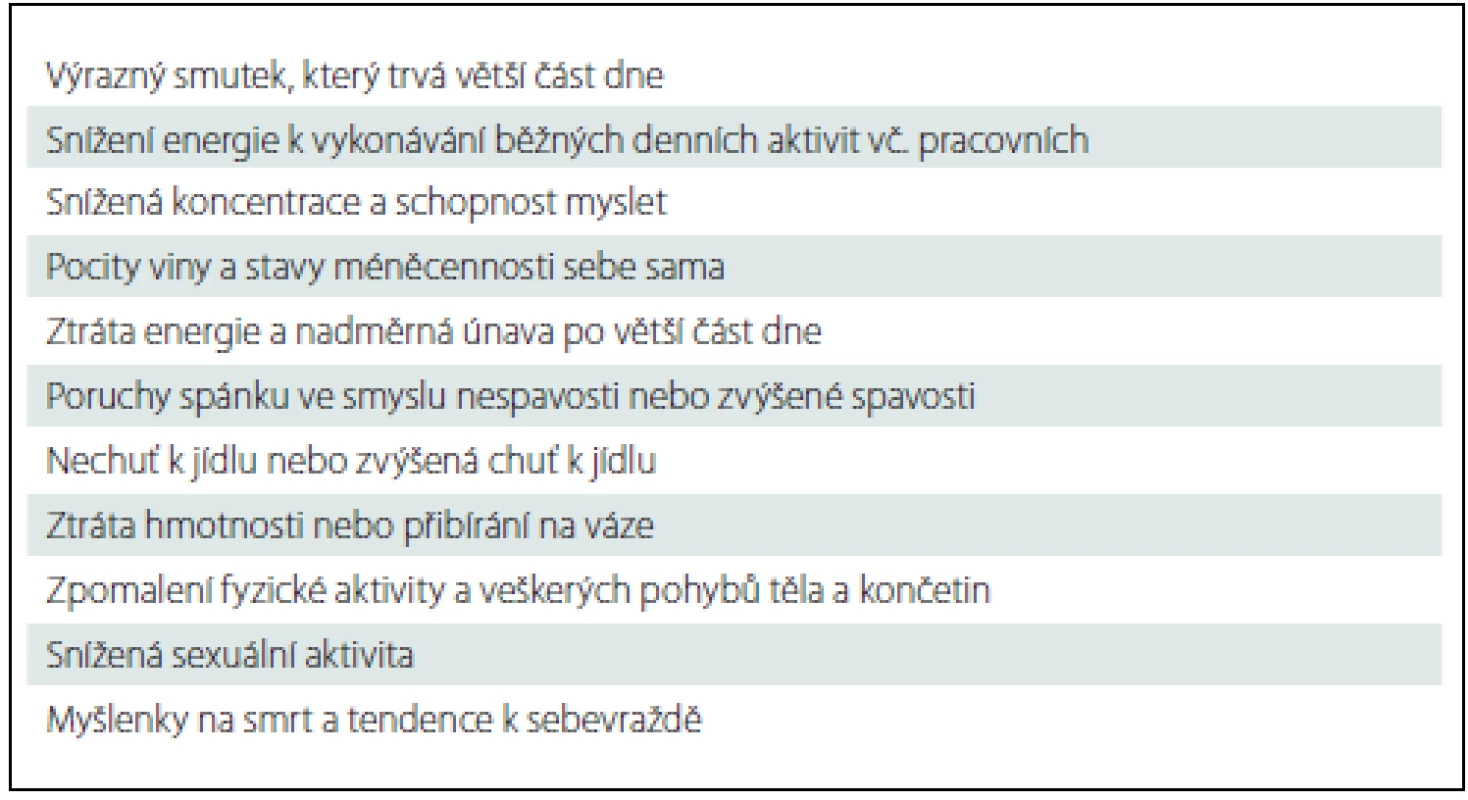
Častými dalšími příznaky jsou somatické obtíže jako nespavost nebo zvýšená spavost (především u zimních depresí), snížená nebo zvýšená chuť k jídlu, snížená až zcela vymizelá sexuální touha a aktivita, neurčité tupé bolesti těla, pálení, pocity tlaku, pocity těžkých končetin, nepříjemné kardiovaskulární nebo gastrointestinální senzace [1]. Nemocný pociťuje výraznou chronickou únavu a zároveň se při jakékoli aktivitě snadno akutně unaví. Má pocit snížené životní energie. Závažné jsou sebevražedné myšlenky (má je více než 50 % nemocných s depresí), těžké úzkostné poruchy, apatie, autoakuzace apod., které vyžadují akutní psychiatrickou péči.
Diagnostika deprese
Při stanovení diagnózy deprese vycházíme ze strukturovaného rozhovoru, který reflektuje kritéria pro depresivní fázi podle MKN-10. Ptáme se na charakter změny nálady, délku trvání příznaků a jejich charakteristiku, hodnotíme stupeň psychomotorického tempa, pracovního výkonu, míry soustředění, úzkosti, komunikační schopnosti, narušení spánku (především předčasná probouzení) a cirkadiánní změny nálady (klinicky závažná jsou zhoršení v časných ranních hodinách), přítomnost nadměrné únavy, sexuální obtíže, snížení chuti k jídlu vč. ztráty na váze, a další somatické potíže [22].
K rychlému skríningu možné deprese mohou také pomoci sebeposuzovací dotazníkové metody, které v běžných klinických podmínkách může administrovat a vyhodnocovat podle manuálu i sestra. Zungova škála deprese je založena na 20 jednoduchých otázkách. Poskytuje detailní záchyt depresivních příznaků i při zachování jednoduchosti administrace a velmi krátkého času nutného k jejímu vyplnění a vyhodnocení. Další výhodou této škály je možnost identifikovat nepozorné nebo náhodné odpovědi (jde o střídání otázek koncipovaných na vzestupném a sestupném hodnocení míry depresivních příznaků). K posouzení přítomnosti depresivních příznaků lze využít také sebeposuzující dotazníky PHQ (Patient Health Questionnaire) se dvěma (PHQ-2) nebo devíti otázkami (PHQ-9) [23]. V ordinacích praktických lékařů se osvědčilo skríningové používání dotazníku PrimeMD2, kde pacienti odpovídali pouze na dvě otázky cílené na depresivní náladu a anhedonii [6]. Všechny uvedené škály jsou u nás k dispozici v českém překladu.
Nutno zdůraznit, že výše uvedené nástroje slouží pouze ke skríningu, resp. k identifikaci osob, které by měly být lékařem vyšetřeny. Vlastní diagnózu depresivní fáze provádí lékař na základě přítomnosti příznaků uvedených v kritériích MKN-10. K hodnocení intenzity depresivních příznaků a její změny v průběhu léčby pak slouží subjektivní (např. Beckova sebeposuzovací stupnice deprese; BDI) nebo objektivní (např. škála Hamiltonova; HAMD; nebo škála Montgomery/ Asberg; MADRS) psychometrické stupnice. Je-li indikováno vyšetření u psychologa, jde o vyšetření doplňkové a slouží k určení osobnostních a psychogenních faktorů podílejících se na vzniku deprese, a není tedy podkladem vlastní diagnózy.
V případě podezření na středně těžkou nebo těžkou depresi je nutné vyšetření psychiatrem.
U neurologicky nemocných osob je diagnostika deprese problematická. Důležité je pozorovat nemocného, jak se chová v určitých situacích či jak na jednoduché zadané úlohy reaguje. Somatické příznaky (poruchy spánku, únavnost, nechutenství, porucha koncentrace, sexuální poruchy apod.) se mohou vzájemně kombinovat. Mohou být součástí základního onemocnění, ale také mohou být již průvodními příznaky deprese.
Diferenciální diagnostika
Častým diferenciálně diagnostickým problémem u seniorů je rozlišení demence a deprese. Tyto stavy se navíc též mohou vyskytovat společně. U pacienta s demencí je začátek obtíží pozvolný. Nemocný má proměnlivou náladu a obtížně se orientuje v okolním prostředí; jeho výkon je horší během dne a večer. U depresivního pacienta je začátek obtíží relativně náhlý a v prostředí se orientuje bez potíží. Vlastní narušení nálady může být u depresivních seniorů nahrazeno stížnostmi na nižší kognitivní výkon, což přináší značný diagnostický problém. Pro potvrzení depresivní etiologie tohoto kognitivního deficitu se tedy orientujeme na další typické známky depresivního syndromu, jako je zhoršení stavu v časných ranních hodinách (ranní pesima), předčasné probouzení, snížení hedonie vč. chuti k jídlu, zintenzivnění somatických stesků a celkový průběh stavu. Deprese je (na rozdíl od demence) fázické onemocnění s detekovatelným začátkem a v horizontu týdnů či maximálně několika měsíců obvykle také koncem.
Mezi další stavy, které lze s depresivní poruchou zaměnit, patří depresivní syndrom navozený psychoaktivními látkami (vč. odvykacího stavu) a různými léky. Je třeba také odlišit depresi v rámci bipolární nebo schizoafektivní poruchy, dystymii (dlouhodobě konstitučně mírně pokleslá nálada) a pokleslou náladu v rámci fyziologického smutku. Smutek je méně intenzivní, neinterferuje s běžnou denní aktivitou, nevykazuje typické známky narušené cirkadiánní rytmicity a předčasného probouzení, má zjevnou příčinu a spontánně odezní do tří měsíců. Svízelné může být rovněž odlišení od úzkostně depresivní poruchy, kterou řadíme mezi neurotická onemocnění. Od deprese se liší nižší intenzitou příznaků, kontinuálním průběhem (pravá deprese probíhá ve fázích) a absencí typických změn cirkadiánní rytmicity.
K častým diagnostickým chybám patří podcenění subjektivních stesků a obtíží nemocného, zejména záměna úzkosti za příznaky somatického onemocnění (bušení srdce, dušnost apod.). Neléčená deprese zhoršuje komorbidní onemocnění, proto je na místě vždy pátrat po jejích příznacích. Typickou chybou v diagnostice může být nerozpoznání deprese nebo naopak její chybná diagnostika u fyziologického smutku (např. truchlení po ztrátě blízkého). Od běžného smutku nebo rozladěnosti se deprese liší zejména v tom, že je intenzivnější a hlubší, trvá déle a nepříznivě ovlivňuje výkonnost. Při depresi nejde jen o nepříjemný emoční prožitek, ale jde o onemocnění celého organizmu vč. vegetativní, imunitní a endokrinní dysregulace s dopadem na průběh somatické komorbidity.
Problémem může být deprese larvovaná. Tato forma je někdy označována jako somatizovaná deprese nebo „deprese bez deprese“ a je charakterizována vyjádřeným depresivním syndromem, ve kterém, podobně jako u některých depresí v séniu, chybí vlastní pocit smutku. Ten je nahrazen polymorfními somatickými obtížemi, bolestmi a stesky. V diagnostice nám může pomoci průkaz sezónnosti, narušení cirkadiánní rytmicity a dalších typických charakteristik periodické deprese. Problém záměny s některou z úzkostných a neurotických poruch nebývá klinicky příliš závažný, protože tyto stavy se stejně jako deprese léčí antidepresivy.
Klasifikace a typy deprese
Typický akutně probíhající depresivní syndrom označujeme jako depresivní fázi. Ta může probíhat v lehké‚ střední nebo těžké formě. V případě těžké depresivní fáze pak ještě rozlišujeme, zda ji doprovázejí psychotické příznaky, které jsou nejčastěji reprezentovány některým z mikromanických bludů (autoakuzační, insuficientní, hypochondrický, ruinační, eternity apod.), které mohou být spojeny případně také s paranoidně perzekuční komponentou. Velmi vzácně se vyskytují i halucinace, většinou tělové nebo chuťové, které pak odpovídají obsahu bludu. Periodická (rekurentní) depresivní porucha je charakterizována opakovanými fázemi deprese bez přítomnosti samostatné fáze zvýšené nálady a energie (mánie). Mohou se objevit krátké fáze lehkého zvýšení nálady a zvýšené aktivity (hypomanie)‚ které se dostavují bezprostředně po depresivní fázi. Tyto krátké změny nálady bývají někdy vyvolány antidepresivní léčbou. V případě periodické depresivní poruchy pak v diagnóze určujeme, o jakou depresivní fázi se jedná nebo zda je pacient v remisi.
Depresivní fáze typicky odezní i spontánně bez léčby. Toto období může trvat až 6 – 12 měsíců (při delším trvání nutno uvažovat o změně diagnózy na dystymii).
Lehčí formy deprese mohou léčit vše obecní lékaři, internisté i neurologové. K psychiatrovi je pak pacient odesílán v případě, že:
- a) se jedná o těžkou depresivní fázi (s psychotickými příznaky nebo bez nich);
- b) nedošlo k odpovědi na léčbu prvním nebo druhým antidepresivem;
- c) jsou přítomny suicidální myšlenky;
- d) deprese vykazuje atypické rysy;
- e) jsou přítomna závažnější omezení ve volbě antidepresiv (příkladem je těhotenství).
Těžké a komplikované formy musí léčit psychiatr vždy, a to účelně a rychle, zejména je-li riziko sebevražedných myšlenek nebo doprovází - li depresi psychotická produkce.
Léčebné cíle u deprese
Hlavním cílem léčby v akutní fázi je během několika týdnů potlačit klinické příznaky depresivní epizody a dosáhnout plné remise obtíží [22]. Pokračovací léčba má za cíl udržet pozitivní trendy akutní léčby a preventivně bránit vzniku relapsu již zaléčené fáze. Profylaktická léčba zabraňuje rekurenci (znovuobjevení příznaků v období úzdravy). Dobrá odpověď (response) na léčbu je charakterizována alespoň 50% snížením příznaků deprese proti stavu před léčbou. Remise je vymizení všech depresivních příznaků a má trvat minimálně osm týdnů. Uzdravení se udává po 6 – 12 měsících remise. Relaps je znovuobjevení příznaků deprese v období remise. Rekurence je návrat symp tomů v období úzdravy. Jedná se tedy o novou depresivní fázi.
Pokud není vhodně vedena akutní léčba s navazující adekvátní pokračovací a profylaktickou léčbou, je vysoké riziko návratu deprese. Návrat deprese v budoucnu se týká více než poloviny nemocných po první depresivní fázi. Různé příznaky mohou přetrvávat různě dlouho. Náhlým a předčasným ukončením léčby vystavujeme pacienta riziku vzniku nového relapsu. Jde o nejčastější chybu v terapii, která je odpovědná za přechod od prosté první depresivní fáze do fyzického opakování depresivních epizod, jež je typické pro periodickou depresivní poruchu.
Základní metody léčby deprese
Základními metodami léčby většiny depresí je v současné době podávání antidepresivních léků (tab. 2) a psychoterapie [24]. Léčebný efekt ve vztahu k hlavním symptomům deprese se po nasazení antidepresiv projeví většinou do 6 – 8 týdnů od začátku léčby, u některých nemocných často i po 3 – 4 týdnech od nasazení léčby. Podle nejnovějších názorů je racionální vyčkat terapeutického efektu po dobu šesti týdnů. Maximální doba léčby jedním antidepresivem bez dosažení částečné odpovědi je osm týdnů. Poté je vhodné lék změnit.
První fázi depresivní poruchy je tedy nutné léčit minimálně osm týdnů v akutním režimu. Následuje dalších 4 – 9 měsíců v pokračovací léčbě. Profylaktická léčba s cílem zabránit výskytu nové depresivní poruchy je dlouhodobá a může trvat až 3 – 5 let. Obecně platí, že čím více depresivních fází nemocný prodělal, tím by udržovací léčba měla být delší. U některých organicky podmíněných depresí a depresí s četnými recidivami je nutná léčba trvalá. Léčba by měla být vysazována postupně, vždy po konzultaci s lékařem.
Z psychoterapeutických technik se nejvíce využívají techniky kognitivně-behaviorální, interpersonální, rodinná a krátká psychodynamická psychoterapie. Samostatně lze jejich použití doporučit jen u lehké formy deprese. Tato léčba je také účinná u nemocných, kteří mají řadu problémů a stesků z oblasti psychosociální. Psychoterapie může být orientována na práci s aktuálně přítomnými depresivními příznaky nebo na odstranění psychologických faktorů, které disponují jedince k depresi (např. naučená bezmocnost, depresivní kognitivní styl, traumata v minulosti, sebepojetí nemocného apod.).
Table 2. Přehled nejčastěji používaných antidepresiv v České republice. 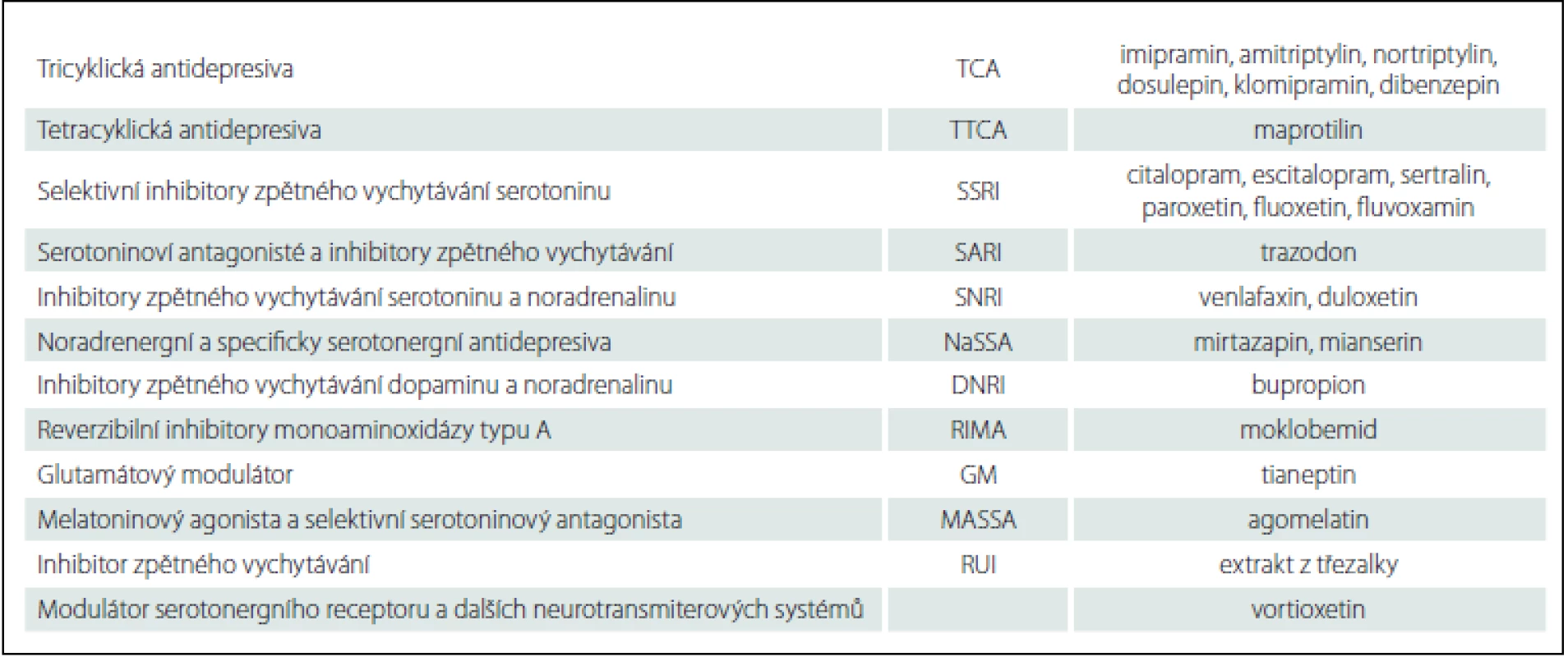
Další léčebné biologické prostředky, např. repetitivní transkraniální magnetická stimulace (rTMS), přímá transkraniální stimulace elektrickým proudem (tDCS), hluboká mozková stimulace (DBS) nebo elektrokonvulzivní léčba (ECT), patří do rukou specializovaných odborníků v oboru psychiatrie. Z těchto biologických metod je robustní antidepresivní efekt prokázán pro ECT, kterou volíme u nejzávažnějších depresí s psychotickými příznaky nebo vysokým rizikem suicidia. Bývá časnější nástup antidepresivního efektu, často již po prvním týdnu léčby. ECT se dále využívají u těžších farmakorezistentních depresí nebo u gravidních pacientek, kdy jsou z hlediska vývoje plodu ECT bezpečnější nežli antidepresiva ve vyšších dávkách. Zbývající formy biologické léčby (DBS, rTMS, tDCS) jsou zatím na rozhraní mezi výzkumem a zavedením do léčebné praxe [25,26]. Fototerapie jasným bílým světem vykazuje efekt především u sezónní afektivní poruchy, která se projevuje zimními depresivními fázemi spojenými s hypersomnií, zvýšenou chutí k jídlu a souvisejícím nárůstem na váze.
Léčba antidepresivy
Po stanovení diagnózy je třeba začít léčbu vhodným lékem co nejdříve, a to v pravidelných intervalech a v dostatečné dávce. Správný výběr antidepresiva závisí na mnoha faktorech. Například je dobré vědět, jakým lékem byl nemocný úspěšně léčen v minulosti (jde o nejlepší prediktor antidepresivní odpovědi), jaké antidepresivum se osvědčilo u příbuzného nemocného, pokud měl podobné onemocnění. Velkou roli ve výběru hrají i jiná onemocnění (neurologická, interní, metabolická), která mohou volbu antidepresiva výrazně zúžit. Je důležité nemocnému sdělit, že efekt se neobjeví s první podanou tabletou, ale dostaví se až za několik týdnů. Při správné volbě a užívání léku je patrný první klinický účinek po 3 – 4 týdnech u 60 – 80 % nemocných. Vyjma antidepresiv využíváme v léčbě deprese také další typy psychofarmak s cílem rychlé symptomatické úlevy. Nejčastěji volíme anxiolytika a hypnotika (v případě úzkosti a insomnie) nebo antipsychotika, která rychle odstraňují bludy, ale mohu být využita i pro zklidnění u agitovaných nemocných.
Selektivní inhibitory zpětného vychytávání serotoninu
Lékem první volby v současnosti jsou antidepresiva typu SSRI (selektivní inhibitory zpětného vychytávání serotoninu), mezi něž patří citalopram, escitalopram, fluoxetin, fluvoxamin, sertralin, paroxetin. Zvyšují množství serotoninu na synapsích. Podávají se nejčastěji jednou denně v tabletové formě. Citalopram podáváme v dávce 10–20 mg denně; může se zvýšit max. na 40 mg denně. Účinná dávka escitalopramu je kolem 5 – 10 mg denně; někteří nemocní pak profitují z dávky až 20 mg. Sertralin nasazujeme v dávce 50 mg denně, obvykle se pak efektivní dávka pohybuje v rozmezí 50 – 150 mg/ den. U některých preparátů je možné jejich podání i v kapkách nebo infuzi (escitalopram, citalopram). SSRI prokázaly svou efektivitu i bezpečnost podávání v řadě klinických studií. Jejich výhoda je v poměrně rychlém nástupu účinku, malém riziku nežádoucích účinků při předávkování a minimální interakci s dalšími léčivy. Nežádoucí účinky jsou hlavně na počátku léčby a projevují se nevolností a pocity na zvracení. Tyto potíže většinou přestanou do tří týdnů od nasazení léčby.
Vzácně se na začátku léčby může objevit tzv. aktivační syndrom, který je charakterizován prudkým zvýšením úzkosti, neklidu i suicidálními tendencemi. Vedlejším účinkem léčby může být také prodloužení QTc intervalu na EKG. Vzácně mohou mít někteří nemocní během léčby pocit emoční plochosti nebo „odříznutí od emocí“ vč. neschopnosti plakat, apod. Při nasazení léčby je třeba věnovat pozornost možnosti vzniku serotoninového syndromu, který se projevuje zmateností, třesem, zvýšeným pocením, hypertenzí, hyperpyrexií, agitovaností nebo epileptickými záchvaty. Tento syndrom je vzácný a může být také po předávkování nebo při nevhodné kombinaci antidepresiv (např. SSRI a IMAO či RIMA). Při současném užívání nesteroidních antirevmatik je vyšší riziko krvácení do gastrointestinálního traktu. Při delším užívání se mohou objevit sexuální potíže (snížení libida, oddálení nebo až vymizení orgazmu a ejakulace), které vedou předek vysazení léčby. SSRI mají nespornou výhodu v tom, že nemocného netlumí a mají nízký potenciál toxicity při předávkování. Pozor je třeba dávat na současné podávání např. s tramadolem nebo selegilinem. Při současném užívání perorálních antikoagulancií (warfarin) je na začátku a při ukončení léčby doporučeno pečlivé sledování koagulace. SSRI mají také anxiolytické účinky, kterých se využívá k léčbě úzkostných poruch. Na rozdíl od benzodiazepinů je nástup anxiolytického efektu oddálený a dostavuje se obvykle po 6 – 8 týdnech léčby. Při ukončení léčby se může objevit syndrom z vysazení, který bývá častěji přítomen při léčbě paroxetinem a fl uvoxaminem. Mezi typické příznaky patří závratě, podrážděnost, bolesti hlavy, pocity na omdlení, únava, úzkost, průjem, nespavost či třes. Léky je proto potřeba snižovat postupně nejlépe po dobu několika málo týdnů.
Tricyklická antidepresiva
Nejdéle užívanými léky na léčbu deprese jsou tricyklická antidepresiva (TCA), mezi něž patří např. amitriptylin, imipramin, klomipramin, dosulepin apod. Blokují zpětné vychytávání serotoninu, dopaminu a noradrenalinu a v různém poměru zvyšují jejich nabídku v limbické části centrálního nervového systému. Předpokládá se změna v presynaptické i postsynaptické receptorové odpovědi, které jako v případě dalších antidepresiv vedou k indukci neuroplastických změn. Nevýhodou TCA je působení na další receptory (cholinergní, histaminergní, adrenergní), které vedou k vysoké kardiotoxicitě, útlumu, zvýšené spavosti, zácpě, suchosti v ústech, nárůstu hmotnosti, poruchám sexuálních funkcí apod. Vzhledem k velkému spektru nežádoucích účinků je pravděpodobnost přerušení léčby pacientem poměrně vysoká. U seniorů TCA nepodáváme, neboť mohou vyvolat závažné komplikace (např. srdeční arytmii, zhoršení paměti až amenci nebo retenci moči) a jsou nevhodná i kvůli hypotenzi se zvýšeným rizikem pádů. TCA mají také analgetické účinky, kterých se využívá při léčbě chronických bolestivých stavů. Obvykle se u amitriptylinu začíná s dávkou 25 – 50 mg. Terapeutická dávka je 150 – 300 mg, podaná ve 2 – 3 dílčích dávkách. Pokud se rozhodneme k vysazení, tak je nutné volit pozvolnou redukci dávky o 25 % týdně. Letální dávka při předávkování odpovídá jedno - až dvoutýdenní dávce terapeutické. Na tuto skutečnost je třeba myslet v případě nemocných s rizikem sebevražedného chování.
Selektivní inhibitory zpětného vychytávání serotoninu a noradrenalinu
Selektivní inhibitory zpětného vychytávání serotoninu a noradrenalinu (SNRI) potlačí velmi dobře depresi a účinkují i na chronickou bolest. Představiteli pro léčbu deprese jsou venlafaxin a duloxetin. Tyto přípravky většinou volíme u nemocných, kteří neodpověděli na předchozí terapii SSRI. Tyto léky mají jen mírné nežádoucí účinky, i když se může vyskytnout nevolnost, ospalost nebo závrať. U venlafaxinu se mohou objevit také arytmie a změny krevního tlaku. Duloxetin je v České republice hrazen pouze k léčbě bolestivé diabetické neuropatie. Vysazování venlafaxinu může být kratší, obvykle 1 – 2 týdny.
Serotoninový agonista a parciální inhibitor jeho zpětného vychytávání
Trazodon patří mezi SARI (serotoninový agonista a parciální inhibitor jeho zpětného vychytávání) a má také sedativní účinky, které lze využít k léčbě poruch spánku při depresi. Na léčbu nespavosti se používají dávky nižší, mezi 50 a 150 mg na noc. Při zahájení léčby je dobré postupně zvyšovat dávku o 50 mg každé tři dny. Účinné rozmezí léčby deprese je mezi 150 a 300 mg. Nebývá výskyt sexuálních dysfunkcí, naopak může dojít k jejich zlepšení.
Inhibitory zpětného vychytávání dopaminu a noradrenalinu
Dalším představitelem duálních antidepresiv je bupropion, který patří mezi DNRI (inhibitory zpětného vychytávání dopaminu a noradrenalinu). Zvyšuje koncentraci dopaminu a noradrenalinu v mozkových synapsích. Doporučuje se např. k léčbě inhibované deprese s poklesem koncentrace pozornosti nebo při depresi u PN. Jeho výhodou je minimální negativní vliv na sexuální funkce.
Antidepresiva s centrální noradrenergní a serotonergní aktivitou
Mirtazapin stimuluje centrální noradrenergní a serotonergní aktivitu a označuje se NaSSA. Má výrazné hypnotické působení a příznivě ovlivňuje architekturu spánku. Kromě antidepresivních a kvalitních hypnotických účinků má i anxiolytický efekt. Jeho nevýhodou je zvýšení chuti k jídlu s nárůstem hmotnosti, který je u některých nemocných limitujícím faktorem léčby. V průběhu terapie je tedy vhodné monitorovat tělesnou hmotnost a pacienty adekvátně edukovat (především o omezení příjmu potravy ve večerních hodinách). Vzácně může vyvolat syndrom neklidných nohou. Začíná se dávkou 15 mg denně, účinná dávka je pak 30 – 45 mg denně.
Inhibitory monoaminoxidázy
U organicky podmíněných depresí a u depresí seniorů lze rovněž využít inhibitory monoaminoxidázy (IMAO). Hlavní výhodu IMAO je absence anticholinergního působení a pozitivní efekt na kognitivní funkce. Z této skupiny je dostupný reverzibilní IMAO moklobemid. Antidepresivní efekt lze rovněž někdy pozorovat po selegilinu (selektivní IMAO-B). Je třeba dávat pozor na možné riziko interakcí s látkami, které mají serotonergní působení.
Extrakt z třezalky
V léčbě lehké formy deprese je oblíbený extrakt z třezalky. Jeho účinnost není prokázána u středně těžké a závažné deprese. Je slabým inhibitorem zpětného vychytávání monoaminů, GABA a glutamátu a je také induktor CYP3A4 s rizikem receptorových a metabolických interakcí. Působí analogicky jako IMAO a vyvolávající odbourávání neurotransmiterů serotoninu, dopaminu a noradrenalinu. Významný je i jeho účinek anxiolytický. Pozor je nutné dát na možnou interakci s intenzivním slunečním zářením (fotosenzitivita). Zejména je nutné myslet na interakci se standardními antidepresivy, neboť třezalka vykazuje IMAO aktivitu.
Jiná antidepresiva
Vortioxetin je nové antidepresivum, které lze použít u depresivní epizody, jež nedostatečně reaguje na SSRI nebo když se při této léčbě objeví nežádoucí účinky (gastrointestinální, sexuální apod.). Vortioxetin je modulátor serotonergního 5-HT3 receptoru a inhibitor přenašeče serotoninu. Moduluje následně celou řadu dalších neurotransmiterových systémů, např. dopaminergní, serotonergní, noradrenergní, glutamátový, cholinergní či GABA. Tímto širokým farmakodynamickým efektem zlepšuje také kognitivní funkce, jejichž deficit často doprovází depresivní poruchu.
Dalšími používanými léky v léčbě deprese jsou agomelatin a tianeptin. Tianeptin působí na rozdíl od jiných antidepresiv zvýšení zpětného vychytávání serotoninu, napravuje důsledky dlouhodobého stresu v hipokampu. Nezvyšuje tělesnou hmotnost. Je vhodný u nemocných s kardiovaskulárním onemocněním. Agomelatin, agonista melatoninových receptorů MT1 a MT2, je také antagonistou serotoninových receptorů 5-HT2C. Resynchronizuje cirkadiánní rytmus a působí rovněž anxiolyticky bez sedativního účinku. Nezpůsobuje sexuální dysfunkce. Vzhledem k možné hepatotoxicitě je nutné vyšetřit jaterní funkce před léčbou a dále je sledovat během celé léčby.
Strategie léčby deprese
První klinický efekt na léčbu deprese se může objevit velmi časně, tj. v 1. – 3. týdnu po nasazení antidepresiva. Do nástupu antidepresivního efektu (obvykle 4 – 6 týdnů) lze nemocnému ulevit od úzkosti či nespavosti benzodiazepinovými anxiolytiky a hypnotiky. Jakmile se však efekt antidepresiva dostaví, důsledně vedeme pacienta k postupnému vysazení této přídatné medikace. Pokud se nedostaví, teprve pak se volí změna léku (většinou z jiné skupiny) nebo přidání dalšího léku do kombinace (např. lithium, trijodtyronin, antiepileptikum, jiné antidepresivum apod.). V této fázi léčba patří do rukou psychiatra. Malý klinický účinek může být způsobem např. nízkou dávkou léku a je vhodné dávku zvyšovat postupně. Velkou roli hraje také dostatečná adherence k léčbě, tj. pochopení nutnosti léčby a dodržování stanovených pravidel léčby. Je nutná úzká spolupráce lékaře a nemocného, který dávky užívá správně dle doporučení. Až 20 – 30 % nemocných, které léčí pro depresi lékař prvního kontaktu, doporučené antidepresivum nakonec neužívá.
Na počátku léčby je třeba pacienta sledovat nejméně jedenkrát týdně. Důvodem není jen naše snaha zachytit včas nežádoucí účinky, ale také skutečnost, že deprese se může zhoršovat i v období po nasazení antidepresiva. Řada léků má totiž aktivující účinek, který se může projevit zvýšenou tenzí až agitovaností, a to ještě dříve než se dostaví antidepresivní činek. V této fázi narůstá riziko suicidia, a tak neváháme dočasně přidat anxiolytika nebo i nižší dávky antipsychotik. Po zmírnění příznaků stačí kontroly jednou měsíčně. Při udržovací léčbě je možné sledovat pacienta jednou za 2 – 3 měsíce.
Pokud léčbou dosáhneme během několika týdnů plné remise obtíží, není vhodné léky hned vysadit. Doporučuje se pokračovat v léčbě alespoň půl roku v případě první depresivní epizody. Tento postup významně snižuje riziko relapsu obtíží. Nemá-li nemocný příznaky deprese po dobu šesti měsíců, je možné začít postupně antidepresiva vysazovat. Doporučuje se pozvolné vysazování po dobu dvou měsíců, abychom zabránili příznakům z vysazení, které jsou sice poměrně vzácné, ale mohou se projevit nespavostí, bolestmi, nevolností či návratem depresivních obtíží. Nemocné je třeba poučit, aby se dostavili na kontrolu ihned, pokud se objeví znova příznaky deprese. U opakovaných depresivních epizod se doporučuje léčba dlouhodobá až pět let. Nemocní po opakovaných depresivních fázích musí užívat lék dokonce celoživotně.
Doporučuje se kombinovat systematickou psychoterapii s farmakoterapií. Týká se to zejména případů, u kterých byla předchozí medikamentózní léčba neúspěšná a kdy dominovaly psychosociální problémy. U některých nemocných s depresí je možné použít léčbu světlem (fototerapie) nebo spánkovou deprivací, která však vykazuje jen krátkodobý efekt.
U těžkých farmakorezistentních depresí s psychotickými projevy, tendencemi k sebepoškozování, s odmítáním stravy, s vysokým rizikem suicidia nebo při depresi v těhotenství, kdy jsou z důvodu rizika pro plod možnosti antidepresiv limitovány, se za hospitalizace na psychiatrii může použít elektrokonvulzivní terapie. Indikaci provádí psychiatr. Při aplikaci ECT spolupracuje s internistou a anesteziologem.
Pacientovi je třeba zdůraznit, že antidepresiva představují moderní a především kauzální léčbu deprese, protože v době nasazení léku je největší riziko nespolupráce. Důležitá je příprava na možnost výskytu přechodných i déle trvajících nežádoucích účinků, např. sucho v ústech, zácpa, útlum, závratě, nevolnost či sexuální dysfunkce. Pacient má být povzbuzován, aby s léčbou nepřestával a nespojoval si pocit zdraví s aktem vysazení antidepresiv, což je nejčastější omyl vedoucí k relapsu. Pokud podpora a ujištění o zvládnutí nežádoucích účinků nestačí, je možné upravit dávkování nebo změnit časové schéma podání léku tak, aby to nemocnému více vyhovovalo. Možné je i přidání další medikace, např. anxiolytika při nespavosti nebo úzkosti (pouze v akutní fázi léčby) či laxativa při zácpě. Pokud pacient přesto lék nasnáší, je vhodné zvolit jinou medikaci. Často pomůže i změna za jiný lék ze stejné skupiny nebo dokonce i jinou galenickou formu téhož přípravku.
Metaanalýza 117 randomizovaných kontrolovaných studií (25 928 účastníků) z let 1991 – 2007 [27], kde byla porovnávána bezpečnost a účinnost akutní léčby deprese pomocí citalopramu, escitalopramu, fluoxetinu, fluvoxaminu, paroxetinu, sertralinu, bupropionu, venlafaxinu, duloxetinu, milnacipranu, mirtazapinu, ukázala, že mirtazapin, escitalopram, venlafaxin a sertralin byly výrazně účinnější než podávání duloxetinu, fluoxetinu, fluvoxaminu a paroxetinu. Z hlediska účinnosti, přijatelnosti a bezpečnosti byl nejlépe hodnoceným antidepresivem sertralin a escitalopram. V jiné metaanalýze [28] byla potvrzena vysoká účinnost escitalopramu ve srovnání s jinými SSRI a SNRI.
Deprese u neurologicky nemocných
V další části článku se budeme více zabývat depresí u vybraných neurologických nemocí, u kterých je deprese velmi častou komorbiditou: CMP, RS, chronická bolest, epilepsie, PN a migréna. Deprese se vyskytuje i u dalších nemocí nervového systému, např. u neurodegenerativních chorob, úrazů mozku, infekcí nervového systému, nádorů mozku, apod., ale tyto nemoci nejsou součástí tohoto vybraného přehledu. K podrobnějšímu studiu odkazujeme na příslušné kapitoly v učebnicích neurologie a psychiatrie.
Deprese po cévní mozkové příhodě
Výskyt deprese po krvácivé nebo ischemické CMP je vysoký, udává se dle různých literárních studií mezi 20 – 70 % [7,29]. Název v anglosaské literatuře je „post-stroke depres sion“ (PSD). Nejvyšší výskyt je po prvních třech měsících od příhody [30] a vrcholí do roku od vzniku CMP. Až u 50 % osob s PSD se depresivní epizoda může spontánně upravit. Bylo však prokázáno, že neléčená deprese vede k zhoršení kognitivních schopností, k prohloubení pohybových poruch a celkově směřuje ke snížení kvality života [29]. Nemocný hůře komunikuje s okolím. Celkově vede neléčená deprese u CMP k vyšší mortalitě a morbiditě; zvyšuje se riziko výskytu sebevražd [31]. Obtížné je odlišení od demence, neboť samotná deprese vede ke zhoršení kognitivních funkcí. Významně nám pak pomohou diferenciálně diagnostické známky uvedené výše. Důležité je také komunikovat s rodinou, která upřesní časovou souslednost vývoje potíží a pacientovo chování i prožívání.
Deprese se objevuje bezprostředně po CMP u hospitalizovaných nemocných, ale také u nemocných v domácím ošetřování nebo v sociálních ústavech. Bylo zjištěno, že i po pěti letech po CMP je výskyt PSD poměrně značný.
Základním problémem neléčené deprese po CMP je to, že zhoršuje celkově zdravotní stav nemocného i jeho další prognózu. Dochází ke zhoršení funkční kapacity nemocného, zhoršuje se paměť, zpomaluje se psychomotorické tempo, zhoršuje se pozornost nemocného. Bohužel PSD je správně diagnostikována ve 20 % a adekvátně léčena jen v 10 % [32].
Příčina vzniku deprese po cévní mozkové příhodě
Vznik PSD je podmíněn strukturální a metabolickou poruchou mozkové tkáně po CMP [33], kdy dochází k poruše rovnováhy jednotlivých neurotrasmiterových systémů, zejména serotoninu, noradrenalinu a dopaminu. Podíl má i samotná stresová reakce a adaptační mechanizmy na mozkový inzult. Dalšími faktory jsou porušená glutamátová transmise, maladaptační neuroplastické změny, vaskulární dysregulace a změny v bílé hmotě mozku [29]. Nelze však dávat rovnítko mezi intenzitou postižení mozkové tkáně a hloubkou depresivní epizody. Deprese byla ve vysokém procentu diagnostikována i u nemocných po CMP, u kterých se po příhodě klinický nález normalizoval. V některých studiích dávají autoři do souvislosti vztah mezi výskytem deprese a poruchou v oblasti prefrontální mozkové kůry [34] nebo při postižení v oblasti bazálních ganglií. Dosud však nebyl prokázán přímý vztah mezi tíží neurologického deficitu, rozsahem a lokalizací léze a rozvojem depresivních příznaků.
Rizikové faktory vzniku deprese po cévní mozkové příhodě
Jasným rizikovým faktorem vzniku deprese po CMP je přítomnost depresivní epizody v minulosti, předchozí CMP, rodinný výskyt depresivní poruchy, závažné stresové situace v minulosti, ale i mladší věk, nepříznivé sociální podmínky a přítomnost dalších komorbidit [35]. Významněji vyšší výskyt PSD se uvádí u dlouhodobě hospitalizovaných nemocných v sociálních ústavech, u osob žijících osaměle a u těch, kteří jsou sociálně slabí a vyžadují sociální podporu. Mezi významné rizikové faktory, které přispívají k rozvoji PSD, patří rozsáhlejší funkční a kognitivní deficit, větší závislost na pečovatelích a rodině, poruchy fatických funkcí a apraxie [36]. Jako nejvýraznější nepříznivý faktor se ve fázi rekonvalescence po iktu jeví právě porucha hybnosti a porucha kognitivních funkcí.
Diagnostika deprese po cévní mozkové příhodě
Při stanovení diagnózy deprese vycházíme ze strukturovaného rozhovoru s nemocným, při kterém uplatňujeme obecné principy diagnostiky depresivní poruchy. Důležité je pozorovat nemocného, jak se chová v určitých situacích a jak reaguje na jednoduché úlohy. Řada příznaků je somatických (poruchy spánku, únavnost, nechutenství, porucha koncentrace, sexuální poruchy apod.) a ty se mohou překrývat se základním onemocněním, ale také mohou být již průvodními příznaky deprese. Vhodné je použití některých diagnostických škál ke stanovení deprese. Specifickým příznakem deprese u CMP je výrazná apatie, ztráta zájmu o sebe i okolí, sociální izolace, zhoršení činností běžného denního života (plánování a řešení problémů, organizování jednotlivých činností apod.). Doporučujeme použití MMSE k odlišení mírného kognitivního deficitu, který se objevuje jako časný příznak demence.
Léčba deprese po cévní mozkové příhodě
Léčba PSD je dnes představována antidepresivy a psychoterapií zaměřenou na zvládání aktuálních příznaků. Včasné nasazení antidepresiv urychluje regenerační proces, zlepšuje fyzickou a psychickou kondici nemocného po iktu v dlouhodobém horizontu [29].
Z antidepresiv se doporučuje používat SSRI, které nemají vliv na převodní systém srdeční ani nezvyšují možnost ortostatické hypotenze. Pozor na možné interakce s antikoagulační léčbou, neboť řada nemocných je léčena warfarinem (např. při fibrilaci síní). Citalopram, escitalopram a sertralin patří k nejbezpečnějším antidepresivům v kombinaci s warfarinem. SSRI (především citalopram) mají rovněž překvapivě dobrý efekt na tzv. spastický pláč (záchvatovitá a psychologicky nemotivovaná silná emoční reakce doprovázená lakrimací) a další organické psychické komplikace. Lékem druhé volby jsou SNRI (ovlivňující zpětné vychytávání serotoninu a noradrenalinu), např. venlafaxin.
Tricyklická antidepresiva jsou u těchto nemocných nevhodná, protože mají řadu nežádoucích účinků na kardiovaskulární i nervový systém (poruchy paměti, amence nebo akcelerovaný rozvoj demence). Prostřednictvím svého anticholinergního působení mohou také vyvolat halucinace, amentní a delirantní stavy.
Deprese u roztroušené sklerózy
Deprese se u RS vyskytuje poměrně často (v 20 – 50 %), což představuje zhruba třikrát vyšší výskyt, než je u běžné populace [37]. Řada nemocných trpí depresivní epizodou ještě před vypuknutím onemocnění RS nebo se příznaky projeví po stanovení diagnózy. Deprese není vázána jen na akutní vzplanutí zánětlivého procesu (při atace RS), ale řada nemocných může onemocnět depresí v dalším průběhu nemoci.
Příčiny vzniku deprese u roztroušené sklerózy
Příčiny vzniku deprese u RS jsou multifaktoriální. Vliv má chronický zánětlivý proces probíhající v centrálním nervovém systému. Negativní roli hrají např. prozánětlivé cytokiny, které jsou uvolňovány aktivovanými makrofágy (např. mikroglií) v autoimunitních reakcích [38]. Bylo zjištěno, že podání cytokinů zdravým dobrovolníkům vyvolává příznaky splňující kritéria deprese. V morfologických studiích byla prokázána souvislost s výskytem deprese a lézemi v levé suprainzulární bílé hmotě v oblasti fasciculus arcuatus a s výskytem atrofie v přední části temporálního laloku [39]. Vliv na vznik deprese má i chronická demyelinizační léze a axonální ztráta [40]. Nezanedbatelnou příčinou vzniku deprese jsou vedlejší účinky léčby RS. Zejména to platí pro podávání vysokých dávek kortikoidů, které jsou lékem první volby v akutní atace. Dlouhodobá protizánětlivá léčba pomocí léků modifikujících průběh choroby (Disease Modifying Drugs; DMD), tedy léčba zabraňující atakám RS, je rovněž vyvolávajícím faktorem vzniku deprese. Nejčastěji vzniká depresivní epizoda po podávání interferonu beta [41]. Riziko deprese stoupá s nezaměstnaností, dlouhodobým pobytem pouze v domácím prostředí, při nízkém životním standardu a při progresi nemoci, charakterizované narůstající disabilitou [42].
Nejvyšší riziko výskytu depresivní epizody se uvádí v prvních měsících po stanovení diagnózy RS (až u 40 % nemocných). Dalším závažným faktorem deprese u RS je zvýšené riziko sebevražd, a to zejména u mužů s časným nástupem nemoci (před 30. rokem) a u osob, které trpěly v minulosti depresí. Dalším nepříznivým faktorem je abúzus alkoholu a jiných návykových látek a sociální izolace nemocného [43]. Toto riziko je vysoké zejména v prvních pěti letech od stanovení diagnózy RS. Významným problémem u RS je vyšší výskyt úzkosti (až v 90 %), který je třeba léčebně ovlivnit.
Diagnostika deprese u roztroušené sklerózy
Diagnózu deprese stanovujeme strukturovaným rozhovorem, většinou v ordinaci neurologa, ke kterému pacient dochází do specializovaného centra pro léčbu RS [44]. Málokdy nemocný s RS vyhledá se svými potížemi psychiatra sám. Kromě rozhovoru s pacientem je důležité znát i názor rodiny. Pomoci nám může dotazník nebo jednoduchá škála, která zvýrazní příznaky deprese, jichž si pacient sám není vědom. Problémem je např. posouzení chronické únavy, která se u nemocných s RS vykytuje kolem 75 – 80 %, ale patří rovněž k příznakům deprese [14]. Fyzická únava u RS je spojena se zvýšenou svalovou slabostí při vykonávání běžných denních činností. Psychická únava se týká rychlého vyčerpání koncentrace a paměťových schopností. Pacient má i další somatické potíže, např. poruchu spánku, nechutenství, zpomalené tempo [40]. Proto je důležité odlišit příznaky RS od deprese, neboť pokud se u závažnější deprese vyskytnou sebevražedné myšlenky, je nutné nemocného odeslat co nejrychleji do péče psychiatrické.
Léčba deprese u roztroušené sklerózy
Důležité je opět léčbu zahájit včas [44]. Lékem první volby jsou antidepresiva typu SSRI. Účinným antidepresivem je sertralin [45] a paroxetin. Uvažuje se neuroprotektivním účinku fluoxetinu [46]. Vzhledem k často přítomné úzkosti je vhodné začínat pozvolna s malými dávkami. Pokud jsou příznaky závažné, je nutná vyšší dávka a rychlá konzultace psychiatra. Možné je nasazení tricyklických antidepresiv, která jsou účinná, ale mají nežádoucí účinky, jež často vedou k přerušení léčby deprese. Je možné podávat i jiná antidepresiva (např. SNRI). Nejčastěji se doporučuje se kombinace antidepresiv s psychoterapií [47].
Chronická bolest
Bolest patří k jednomu z nejdůležitějších ochranných mechanizmů člověka. Je definována jako nepříjemná senzorická a emoční zkušenost spojená s aktuálním nebo potenciálním poškozením tkáně. Dělí se na akutní a chronickou. Akutní bolest chrání organizmus před poškozením prostřednictvím obranných reflexů. Je způsobena známým podnětem, trvá krátce a přestává po zhojení tkáňového poškození. Naproti tomu chronická bolest již nemá varovnou biologickou funkci a stává se zdrojem tělesných, duševních a sociálních útrap. Trvá-li déle než šest měsíců, je považována za samostatné onemocnění s bio-psycho-sociální charakteristikou. Kromě fyzických útrap se u nemocného objevují i změny v psychice spojené se změnou osobnosti a s negativním ovlivněním sociálních vazeb (rodina, zaměstnání). Takto postižený jedinec nemůže kvalitně pracovat ani vykonávat běžné denní činnosti. Bolest negativně ovlivňuje celou řadu funkcí vč. sexuálních a kognitivních, působí na náladu, ruší spánek, zvyšuje úzkost a zhoršuje depresi. Přesný výskyt chronické bolesti v populaci není znám, ale předpokládá se, že zhruba 20 % osob trpí chronickou bolestí. Velmi často je chronická bolest ve starším věku spojena s kloubními potížemi a s bolestmi zad. Nemocní s nádorovým onemocněním mají až v 50 % bolesti v různých fázích nemoci.
Příčiny vzniku deprese u chronické bolesti
Existuje řada teorií vztahu bolesti a deprese. Podle jedné hypotézy deprese předchází vznik chronické bolesti. Podle další teorie je naopak deprese důsledkem chronické bolesti. Společné patogenetické mechanizmy bolesti a deprese se týkají změněné hladiny serotoninu a noradrenalinu. Roli může hrát i GABA a glutamát. Úbytek biogenních aminů oslabuje descendentní antinocicepční inhibiční systém a tím zesiluje vnímání bolesti. Při dlouhotrvající bolesti vznikají v mozku funkční i strukturální změny [48]. U nemocných s chronickou bolestí zad a osob s fibromyalgií bylo zjištěno snížení denzity šedé hmoty v dorzolaterální prefrontální kůře a v thalamu [49]. Mediátorové systémy, odpovědné za vznik depresivních poruch, jsou totožné s těmi, které tlumí bolesti. U depresivních pacientů se suicidálními pokusy byly opakovaně prokázány snížené hladiny metabolitu serotoninu v mozkomíšním moku. U deprese i bolesti se projevuje dysfunkce noradrenergního systému.
Diagnostika deprese u chronické bolesti
Diagnóza chronické bolesti se stanovuje na základě rozhovoru. Vhodné je doplnit vyšetření psychologické, které určí typ osobnosti a hloubku prožitku bolestivého stavu.
Pacient s chronickou bolestí a depresí ztrácí zájem o své okolí, o práci, koncentruje se na své problémy, zanedbává i svou rodinu a přátele. Často je přítomna fyzická a psychická únava. Může se objevit snížená koncentrace a omezení paměťových schopností. Pacient má i další somatické potíže (poruchu spánku, nechutenství, zpomalené psychomotorické tempo). Deprese sama má výrazný dopad na subjektivní prožitek bolesti. Pacient trpící bolestí bude hodnotit svou bolest jako silnější než pacient bez deprese, neboť při depresi se snižuje práh bolesti.
Léčba deprese u chronické bolesti
V léčbě chronické bolesti se stále používají TCA, i když mají řadu nežádoucích účinků. Stačí velmi nízká denní dávka, nejlépe je podat jednu dávku na noc (např. 25 – 50 mg amitryptilinu). Vhodné je také použít SSRI, které potlačí depresi i úzkost. Bolest však ovlivní méně. V léčbě přidružené úzkosti, nespavosti a bolesti u pacientů s depresí nebyl prokázán významný rozdíl mezi jednotlivými antidepresivy ze skupiny SSRI [50]. Venlafaxin a duloxetin potlačí velmi dobře depresi i bolest. Duloxetin se používá k tlumení neuropatické bolesti u diabetické neuropatie s postižením tenkých bolestivých vláken. Je účinný i u fibromyalgie, kde ovlivňuje kognitivní složku a zbavuje výrazné únavy [51]. Doporučuje se kombinace antidepresiv s psychoterapií, ale léčba má být individualizována a měněna podle její efektivity [52].
Deprese u migrény
Migréna je chronické záchvatovité onemocnění charakterizované atakami převážně jednostranné pulzující bolesti hlavy střední nebo těžké intenzity, trvající obvykle 4 – 72 hod [53]. Prevalence migrény u žen je 15 – 20 %, u mužů 6 %. U žen se vyskytuje třikrát častěji než u mužů. Patofyziologie migrény je velmi komplikovaná a komplexní, což dokumentuje mimo jiné také skutečnost, že migréna je často asociována s dalšími nemocemi (např. s epilepsií, cerebrovaskulárním onemocněním, hypertenzí nebo úzkostnými a afektivními poruchami). Není jednoznačně spojena se zvýšeným rizikem závislostí a zneužíváním návykových látek [54]. Deprese se vyskytuje u nemocných s migrénou často (10 – 50 %). Metaanalýza těchto studií potvrdila u postižených migrénou 2,2krát vyšší riziko vzniku deprese [55]. V kombinaci s poruchami nálady se častěji vyskytuje migréna s aurou než bez aury. Deprese má negativní dopad na vlastní průběh migrény, počet záchvatů i léčebnou efektivitu.
Příčiny vzniku deprese u migrény
Příčiny vzniku deprese u migrény nejsou doposud objasněny. Migréna častěji předchází rozvoji depresivní poruchy, než je tomu naopak. Na druhou stranu vzniká migréna jako druhá v případě komorbidní úzkostné poruchy [54].
Ve studiu patofyziologických mechanizmů komorbidity migrény a deprese je značná pozornost věnována serotoninovým receptorům a transportérům, což je v souladu s léčebným efektem triptanů. Klinická validita těchto úvah je mj. podpořena tím, že TCA, SSRI i SNRI jsou léky, které mohou výrazně snižovat frekvenci migrenózních záchvatů a jsou také v této indikaci využívány jako profylaktika [56].
Diagnostika deprese u migrény
Diagnostika je i v tomto případě založena na typických příznacích depresivního syndromu, které by měly trvat minimálně několik dní, a nemělo by se jednat o prostou reakci na bolest hlavy.
Léčba deprese u migrény
Migréna je dnes často léčena triptany, agonisty serotoninových 5-HT 1B, 1D receptorů. Na základě 27 kazuistik vydala v roce 2011 americká FDA (U.S. Food and Drug Administration) varování, že podávání triptanů společně se SSRI a SNRI zvyšuje riziko serotoninového syndromu. Ačkoliv bylo rozhodnutí FDA následně kritizováno [57] a není příliš oprávněné ani farmakodynamicky (serotoninový syndrom je mediovaný 5-HT2A receptory, na které triptany nepůsobí). Je třeba při současné léčbě triptany a antidepresivy titrovat antidepresiva pomalu. Na druhou stranu jsou tato antidepresiva účinná v profylaxi migrenózních záchvatů a jejich nasazení může výrazně snížit výskyt migrenózních záchvatů.
Deprese u epilepsie
Deprese je u epilepsie nejčastější komorbiditou [58]. Bývá u 11 – 62 % pacientů s epilepsií [59]. Depresivní epizoda se hlavně vyskytuje v období mezi záchvaty (až u 60 % nemocných s epilepsií), ale bývá také v období záchvatu a může být přímo jeho součástí. Časté jsou stavy úzkosti, zmatenosti a agitovanosti po prodělaném záchvatu. U epileptických pacientů je 4 – 5krát vyšší výskyt deprese a suicidia ve srovnání se zdravou populací [59].
Příčiny deprese u epilepsie
Nejvíce se objevuje u nemocných s temporální epilepsií, což bývá spojeno s poruchou limbického systému. Jsou snahy nalézt vztah mezi strukturální poruchou, tj.epileptickým ložiskem a vznikem deprese. Morfologické nálezy jsou ale zatím nejednotné a kontroverzní. Vlivy mají neurobiologické a psychosociální faktory vč. klinických projevů epilepsie (frekvence záchvatů, lokalizace, typ epilepsie apod.); rizikem je pozitivní rodinná anamnéza psychiatrického onemocnění (zejména výskyt deprese a úzkosti), nedostatečná kompenzace léčby epilepsie, iatrogenní příčiny (farmakologické a chirurgické).
Diagnostika deprese u epilepsie
Diagnózu deprese stanovíme z rozhovoru s pacientem, můžeme použít i škály, které umožní nalézt a specifikovat příznaky depresivní epizody, jež by mohly uniknout pozornosti. Obvykle depresi u nemocného s epilepsií stanoví neurolog, ke kterému pacient dochází do specializovaného centra pro léčbu epilepsie. Závažnější stavy deprese, zejména pokud jsou spojeny se sebevražednými myšlenkami, je nutné poslat na psychiatrii.
Léčba deprese u epilepsie
Některá antiepileptika není vhodné podávat, neboť mohou mít depresogenní účinky. Mezi ně patří např. fenytoin, primidon nebo vigabatrin. Doporučují se antiepileptika, která fungují jako stabilizátory nálady, např. gabapentin nebo lamotrigin. Gabapentin se do monoterapie epilepsie příliš nehodí, je vhodné ho zvolit jako přídatný lék. Léčba antiepileptiky i vlastní průběh nemoci s malou predikovatelností záchvatů mohou výrazně akcentovat smutek i snižovat sebevědomí [58]. V případě komorbidní epilepsie a deprese jsou antiepileptika více účinná v udržovací léčbě depresivní poruchy, v případě akutně probíhající depresivní fáze je třeba podat antidepresiva.
Lékem volby depresivní epizody u epilepsie jsou antidepresiva ze skupiny SSRI nebo SNRI, která jsou bezpečná i v dlouhodobém používání [60]. Velmi dobré efekty jsou popisovány při podávání citalopramu, escitalopramu, sertralinu. Opatrnosti je třeba u používání bupropionu, klomipraminu a maprotilinu, které snižují práh pro vznik epileptického záchvatu. Případné zhoršení frekvence záchvatů souvisí s dávkou, tj. je výraznější s vyšší dávkou antidepresiva. Nedoporučuje se proto překračovat maximální denní dávku. Riziko je ale malé a nemělo by být překážkou nasazení antidepresivní léčby. Je třeba doporučit vhodně vedenou psychoterapii, která v kombinaci nebo samostatně nemocnému pomůže.
Deprese u Parkinsonovy nemoci
Neuropsychiatrické symptomy jsou u PN velmi časté a mohou být dominantními příznaky, které ovlivňují kvalitu života nemocného [61]. Jsou často spojeny s vlastním průběhem nemoci, ale mohou souviset i s dlouhodobou léčbou základního onemocnění. Deprese, úzkost a apatie [62] často předcházejí vzniku motorických příznaků. Naopak kognitivní poruchy, demence a psychózy jsou častější v pozdějších stadiích onemocnění. Deprese se u PN vyskytuje poměrně často, až u 40 – 50 % nemocných. Depresivní epizoda může být prvním příznakem PN, který pacienta dovede do ordinace lékaře. Výskyt deprese ani její hloubka nezávisí na stadiu ani průběhu nemoci.
Příčiny vzniku deprese u Parkinsonovy nemoci
Vznik psychických poruch u PN má řadu příčin. Úbytek dopaminu ovlivňuje i další funkční okruhy v mozku, zejména oblasti limbického systému, které hrají důležitou roli v regulacích různých mentálních funkcí [61]. Porušená tvorba i jiných neurotransmiterů (deficit acetylcholinu v mozkové kůře nebo úbytek serotoninu v nucleus raphe) přispívá ke zhoršování kognitivních funkcí [63]. Nezanedbatelný vliv má i dlouhodobá léčba pomocí antiparkinsonik. U nemocných s PD a depresí bylo zjištěno snížení funkční konektivity v prefrontální a limbické oblasti [61].
Diagnostika deprese u Parkinsonovy nemoci
Základem diagnózy deprese je rozhovor s nemocným. Sama PN však může vést k problémům se stanovením diagnózy deprese, neboť některé somatické a emoční projevy si mohou být velmi podobné nebo se mohou překrývat. Příkladem je zpomalení hybnosti a zpomalení psychomotorického tempa, snížená mimika obličejových svalů, pomalost a tichost řeči, ztuhlé držení těla apod. Depresivní příznaky u PN jsou spojeny s vyšší úzkostí, výraznější a neadekvátní podrážděností, nadměrným smutkem. Nemocní s PN a depresí nemívají manifestní pocity viny a většinou mají menší riziko sebevražedného jednání.
Léčba deprese u Parkinsonovy nemoci
Nejvhodnějším lékem deprese u PN jsou antidepresiva typu SSRI. Vzhledem k velmi dobré bezpečnosti a účinnosti se doporučuje escitalopram, citalopram a sertralin. Při léčbě je nutné dát pozor na lékové interakce SSRI v kombinaci se selegilinem, neboť nemocný s PN je ohrožen vznikem serotoninového syndromu spojeného s hypertenzní krizí. Selegilin je nutné vysadit minimálně tři týdny před nasazením léčby SSRI. Dávky selegilinu nepřesahující 10 mg denně byly bezpečně užívány s citalopramem. Někteří autoři doporučují i tricyklická antidepresiva k léčbě deprese a klozapin k ovlivnění psychotických stavů [64]. V léčbě lze použít i repetitivní magnetickou stimulaci, která ovlivní depresi a navíc může zlepšit motorické funkce [65].
Závěr
Včasná diagnostika a léčba deprese má u neurologicky nemocných pacientů výrazně pozitivní vliv na celý průběh nemoci vč. stabilizace i úpravy hybných a kognitivních funkcí. Jednoznačně zlepšuje kvalitu života a umožňuje nemocnému efektivnější zapojení do běžných denních aktivit. Závěrem je třeba zdůraznit, že v ambulanci neurologa lze diagnostikovat a léčebně zvládat jen lehkou a nekomplikovanou středně těžkou depresi; pokud je léčba neúspěšná nebo jde o stavy těžší (zejména při výskytu suicidálních tendencí), je nutné vyšetření psychiatrem s následnou léčebnou intervencí.
Práce byla podpořena projekty PRVOUK P34 a MŠMT č. LO1611 v rámci programu NPU I.
Recenzenti
doc. MUDr. Edvard Ehler, CSc. prof. MUDr. Pavel Mohr, Ph.D. prof. MUDr. Jan Roth, CSc.
prof. MUDr. Ivana Štětkářová, CSc.
Neurologická klinika 3. LF UK a FN Královské Vinohrady
Ruská 87
100 00 Praha 10
e-mail: ivana.stetkarova@fnkv.cz
Přijato k recenzi: 22. 9. 2016
Přijato do tisku: 14. 10. 2016
prof. MUDr. Ivana Štětkářová, CSc.
Ivana Štětkářová promovala summa cum laude v roce 1987 na LF UK v Praze, kde získala cenu ministra školství za mimořádné studijní výsledky. Nastoupila do interní aspirantury v SZÚ v Praze, kde pracovala ve výzkumné skupině průmyslové neurologie a neurotoxikologie. V roce 1993 obhájila kandidátskou práci na téma „Somatosenzorické evokované potenciály u osob exponovaných organickým rozpustidlům“. Od roku 1988 do 1991 pracovala na Neurologické klinice FTN Krč, kde byla rovněž asistentkou ILF. V roce 1992 získala stipendium a nastoupila roční pobyt jako Postdoctoral Fel low na Baylor College of Medicine v Houstonu. Stážovala i na dalších prestižních pracovištích v zahraniční (University Hospital v Innsbrucku, Shulthess Klinik v Zurichu, Mississippi Methodist Rehabilitation Center v Jacksonu, Guttmann Institute v Badaloně, University Hospital v Basileji, apod). V letech 1995 – 2011 pracovala na neurologickém oddělení Nemocnice Na Homolce a zároveň již od roku 2000 přednášela na Neurologické klinice 3. LF UK a FN Královské Vinohrady. Po úspěšné obhajobě práce „Mícha a její funkce v klinické neurofyziologii“ byla v roce 2003 jmenována docentkou neurologie na Karlově univerzitě v Praze a v letošním roce byla jmenována profesorkou neurologie. Od roku 2011 je přednostkou Neurologické kliniky 3. LF UK a FN Královské Vinohrady, vedoucí Centra pro léčbu roztroušené sklerózy a vedoucí Centra pro léčbu spasticity. Od roku 2004 prosazuje projekt léčby těžké spasticity intratékálním baklofenem; v současné době je hlavním specialistou v České republice na tuto léčbu. Dále se zabývá problematikou iktů, chronické bolesti, roztroušené sklerózy, neuromuskulárních a spinálních chorob. Je členkou zahraničních odborných společností (International Society for Restorative Neurology and Human Neurobiology, International Neuromodulation Society, Eurospine), je ve výboru České neurofyziologické společnosti, České společnosti pro míšní léze, České neuromodulační společnosti, členkou České spondylochirurgické společnosti. Je recenzentkou řady našich i zahraničních časopisů (ČSNN, European Spine Journal, Spinal Cord, Journal of Neural Transmission). Přednesla více než 250 přednášek, z toho řadu v zahraničí. Je autorka a spoluautorka více než 80 publikací (polovina prací je s IF). Je hlavní autorka monografií Spasticita a její léčba (Maxdorf 2012) a Moderní farmakoterapie v neurologii (Maxdorf 2015), které obě získaly cenu za nejlepší monografii roku České neurologické společnosti.
Sources
1. Hoschl C, Libiger J, Švestka J. Psychiatrie. Peraha: Tigis 2004.
2. Praško J, Látalová K, Sandoval A. Depresivní epizoda. In: Praško J, Látalová K, et al (eds). Psychiatrie v primární praxi. Praha: Mladá fronta a.s. 2013 : 408 – 41.
3. Engel GL. The need for a new medical model: a challenge for biomedicine, Science 1977;196(4286):129 – 36.
4. Oneib B, Sabir M, Abda N, et al. Epidemiological study of the prevalence of depressive disorders in primary health care in Morocco. J Neurosci Rural Pract 2015;6(4):477 – 80. doi: 10.4103/ 0976-3147.169768.
5. Lundin A, Hal lgren M, Theobald H, et al. Validity of the 12-item version of the General Health Questionnaire in detecting depression in the general population. Public Health 2016;136 : 66 – 74. doi: 10.1016/ j. puhe.2016.03.005.
6. Laňková J. Screening deprese v primární péči – první výsledky studie SCREEDEP. Practicus 2007;10 : 17 – 8.
7. Price A, Rayner L, Okon-Rocha E, et al. Antidepressants for the treatment of depression in neurological disorders: a systematic review and meta-analysis of randomised controlled trials. J Neurol Neurosurg Psychiatry 2011;82(8):914 – 23. doi: 10.1136/ jn np.2010.230 862.
8. Štětkářová I. Deprese u neurologických onemocnění. Praha: Maxdorf 2012 : 1 – 36.
9. Mirza SS, Wolters FJ, Swanson SA, et al. 10-year trajectories of depressive symptoms and risk of dementia: a population-based study. Lancet Psychiatry 2016;3(7):628 – 35. doi: 10.1016/ 2215-0366(16)00097-3.
10. Bombardier CH, Hoekstra T, Dikmen S, et al. Depression trajectories dur ing the first year after traumatic brain injury. J Neurotrauma 2016. In pres s.
11. Anders M, Uhrová T, Roth J, et al. Depresivní porucha v neurologické praxi. Praha: Galén 2005.
12. Cherbuin N, Kim S, Anstey KJ. Dementia risk estimates as sociated with measures of depression: a systematic review and meta-analysis. BMJ Open 2015;5(12):e008853. doi: 10.1136/ bmjopen-2015-008853.
13. Krombholz R. Farmakologicky navozené deprese. Psychiat Praxi 2008;9(5):209 – 12.
14. Mohr DC, Hart SL, Goldberg A. Eff ects of treatment for depression on fatigue in multiple sclerosis. Psychosom Med 2003;65(4):542 – 7.
15. Caspi A, Sugden K, Moffitt TE, et al. Influence of life stress on depression: moderation by a polymorphism in the 5-HTT gene. Science 2003;301(5631):386 – 9.
16. Van de Leemput J, Glatt SJ, Tsuang MT. The potential of genetic and gene expression analysis in the diagnosis of neuropsychiatric disorders. Expert Rev Mol Diagn 2016;16(6):677 – 95. doi: 10.1586/ 4737159.2016.1171714.
17. Demirkan A, Lahti J, Direk N, et al. Somatic, positive and negative domains of the Center for Epidemiological Studies Depression (CES-D) scale: a meta-analysis of genome-wide association studies. Psychol Med 2016;46(8):1613 – 23. doi: 10.1017/ S0033291715 002081.
18. Donev R, Alawam K. Alterations in Gene Expression in Depression: Prospects for Personalize Patient Treatment. Protein Chem Struct Biol 2015;101 : 97 – 124. doi: 10.1016/ bs.apcsb.2015.07.005.
19. Del l‘Os so L, Carmas si C, Mucci F, et al. Depression, Serotonin and Tryptophan. Curr Pharm Des 2016;22(8): 949 – 54.
20. Fakhoury M. New insights into the neurobiological mechanisms of major depressive disorders. Gen Hosp Psychiatry 2015;37(2):172 – 7. doi: 10.1016/ j.genhosppsych. 2015.01.005.
21. Jeon SW, Kim Y. Neuroinfl am mation and cytokine abnormality in major depression: cause or consequence in that il lnes s? World J Psychiatry 2016;6(3):283 – 93. doi: 10.5498/ wjp.v6.i3.283.
22. Praško J, Látalová K, Sandoval A. Depresivní epizoda. In: Praško J, Látalová K. et al (eds). Psychiatrie v primární praxi. Praha: Mladá fronta a.s. 2013 : 408 – 41.
23. Raboch J, Laňková J. Deprese. Doporučený diagnostický a léčebný postup pro všeobecné praktické lékaře. Praha: CDP-PL 2008 : 16.
24. Štětkářová I, Horáček J. Deprese u neurologických onemocnění. In: Štětkářová I. et al (eds). Moderní farmakoterapie v neurologii. Praha: Maxdorf 2015 : 327 – 38.
25. Blumberger DM, Hsu JH, Daskalakis ZJ. A review of brain stimulati on treatments for late-life depression. Curr Treat Options Psychiatry 2015;2(4):413 – 21.
26. Palm U, Hasan A, Strube W, et al. tDCS for the treatment of depression: a comprehensive review. Eur Arch Psychiatry Clin Neurosci 2016. Inpres s.
27. Cipriani A, Furukawa TA, Salanti G, et al. Comparative efficacy and acceptability of 12 new-generation antidepressants: a multiple-treatments meta-analysis. Lancet 2009;373(9665):746 – 58. doi: 10.1016/ S0140-6736 (09)60046-5.
28. Ken nedy SH, Andersen HF, Thase ME. Escitalopram in the treatment of major depres sive disorder: a meta analysis. Curr Med Res Opin 2009;25(1):161 – 75. doi: 10.1185/ 03007990802622726 .
29. Robinson RG, Jorge RE. Post-stroke depression: a review. Am J Psychiatry 2016;173(3):221 – 31. doi: 10.1176/ appi.ajp.2015.15030363.
30. Göthe F, Enache D, Wahlund LO, et al. Cerebrovascular diseases and depres sion: epidemiology, mechanisms and treatment. Panminerva Med 2012;54(3):161 – 70.
31. Salter KL, Foley NC, Zhu L, et al. Prevention of poststroke depression: does prophylactic pharmacotherapy work? J Stroke Cerebrovasc Dis 2012;22(8):1243 – 51. doi: 10.1016/ j.jstrokecerebrovasdis.2012.03.013
32. Ayerbe L, Ayis S, Crichton S, et al. The natural history of depression up to 15 years after stroke: the South London Stroke Register. Stroke 2013;4(4): 1015 – 20. doi: 10.1161/ STROKEAHA.111.679340.
33. Nishiyama Y, Komaba Y, Ueda M, et al. Early depressive symp toms after ischemic stroke are as sociated with a left lenticulocapsular area lesion. J Stroke Cerebrovasc Dis 2010;19(3):184 – 9. doi: 10.1016/ j.jstrokecerebrovasdis. 2009.04.002.
34. Singh A, Black SE, Herrmann N, et al. Functional and neuroanatomic correlations in poststroke depression: the Sun nybrook Stroke Study. Stroke 2000;31(3): 637 – 44.
35. Hirata S, Ovbiagele B, Markovic D, et al. Key factors associated with major depression in a national sample of stroke survivors. J Stroke Cerebrovasc Dis 2016;25(5):1090 – 5. doi: 10.1016/ j.jstrokecerebrovasdis. 2015.12.042.
36. De Ryck A, Brouns R, Fransen E, et al. A prospective study on the prevalence and risk factors of poststroke depression. Cerebrovasc Dis Extra 2013;3(1):1 – 13. doi: 10.1159/ 000345557.
37. Wal lin MT, Wilken JA, Turner AP, et al. Depression and multiple sclerosis: review of a lethal combination. J Rehabil Res Dev 2006;43(1):45 – 62.
38. Havrdová E, et al. Roztroušená skleróza. Praha: Mladá fronta 2013.
39. Feinstein A, Roy P, Lobaugh N, et al. Structural brain abnormalities in multiple sclerosis patients with major depression. Neurology 2004;62(4):586 – 90.
40. Görnerová N. Sclerosis multiplex a psychiatrická komorbidita. Psychiatrie 2014;18(4):177 – 85.
41. Kappos L, Polman CH, Freedman MS, et al. Treatment with interferon beta-1b delays conversion to clinically definite and McDonald MS in patients with clinically isolated syndromes. Neurology 2006;67(7):1242 – 9.
42. Papar rigopoulos T, Ferentinos P, Kouzoupis A, et al. The neuropsychiatry of multiple sclerosis: focus on disorders of mood, aff ect and behaviour. Int Rev Psychiatry 2010;22(1):14 – 21. doi: 10.3109/ 09540261003589 323.
43. Goldman Consensus Group. The Goldman Consensus statement on depression in multiple sclerosis. Mult Scler 2005;11(3):328 – 37.
44. Vachová M, Dušánková J, Zámečník L. Symptomatická léčba roztroušené sklerózy. Neurol Praxi 2008;9(4):226 – 31.
45. Mohr DC, Boudewyn AC, Goodkin DE, et al. Comparative outcomes for individual cognitive-behavior therapy, supportive-expres sive group psychotherapy, and sertraline for the treatment of depression in multiple
sclerosis. J Consult Clin Psychol 2001;69(6):942 – 9.
46. Skokou M, Soubasi E, Gourzis P. Depression in multiple sclerosis: a review of assessment and treatment approaches in adult and pediatric populations. ISRN Neurol 2012;2012 : 427102. doi: 10.5402/ 2012/ 427102.
47. Mohr DC, Epstein L, Luks TL, et al. Brain lesion volume and neuropsychological function predictefficacy of treatment for depression in multiple sclerosis. J Consult Clin Psychol 2003;71(6):1017 – 24.
48. Apkarian AV, Sosa Y, Sonty S, et al. Chronic back pain is associated with decreased prefrontal and thalamic gray matter density. J Neurosci 2004;24(46):10410 – 5.
49. Kuchinad A, Schweinhardt P, Seminowicz DA, et al. Accelerated brain gray matter loss in fibromyalgia patients: premature ag ing of the brain? J Neurosci 2007;27(15):4004 – 7.
50. Thaler KJ, Morgan LC, Van Noord M, et al. Comparative effectiveness of second-generation antidepressants for accompany ing anxiety, insomnia, and pain in depressed patients: a systematic review. Depress Anxiety 2012;29(6):495 – 505. doi: 10.1002/ da.21951.
51. Arnold LM, Clauw D, Wang F, et al. Flexible dosed duloxetine in the treatment of fibromyalgia: a randomized, double-blind, placebo-control led trial. J Rheumatol 2010;37 : 2578 – 86. doi: 10.3899/ jrheum.100 365.
52. Mann ing JS, Jackson WC. Depression, pain, and comorbid medical conditions. J Clin Psychiatry 2013;74(2):e03. doi: 10.4088/ JCP.12049vs3c.
53. Medová E, Štětkářová I. Primární bolesti hlavy a obličeje. In: Štětkářová I, et al (eds). Moderní farmakoterapie v neurologii. Praha: Maxdorf 2015 : 108 – 24.
54. Antonaci F, Nappi G, Gal li F, et al. Migraine and psychiatric comorbidity: a review of clinical findings. J Headache Pain 2011;12(2):115 – 25. doi: 10.1007/ s10194-010 - 0282-4.
55. Arulmozhi DK, Veeranjaneyulu A, Bodhankar SL. Migraine: current concepts and emerging therapies. Vascul Pharmacol 2005;43(3):176 – 87.
56. Evers S. Treatment of migraine with prophylactic drugs. Expert Opin Pharmacother 2008;9(15):2565 – 73. doi: 10.1517/ 14656566.9.15.2565.
57. Kogut SJ. Do triptan antimigraine medications interact with SSRI/ SNRI antidepres sants? What does your decision support system say? J Manag Care Pharm 2011;17(7):547 – 51.
58. Keezer MR, Sisodiya SM, Sander JW. Comorbidities of epilepsy: current concepts and future perspectives. Lancet Neurol 2016;15(1):106 – 15. doi: 10.1016/ S1474 - 4422(15)00225-2.
59. Błaszczyk B, Czuczwar SJ. Epilepsy coexist ing with depression. Pharmacol Rep 2016;68(5):1084 – 92. doi: 10.1016/ j.pharep.2016.06.011.
60. Johannessen Landmark C, Henning O, Johannessen SI. Proconvulsant effects of antidepres sants – what is the current evidence? Epilepsy Behav 2016;61(6):287 – 91. doi: 10.1016/ j.yebeh.2016.01.029.
61. Cooney JW, Stacy M. Neuropsychiatric issues in Parkinson‘s disease. Curr Neurol Neurosci Rep 2016;16(5):49. doi: 10.1007/ s11910-016-0647-4.
62. Wen MC, Chan LL, Tan LC, et al. Depression, anxiety, and apathy in Parkinson‘s disease: insights from neuroimag ing studies. Eur J Neurol 2016;23(6):1001 – 19. doi: 10.1111/ ene.13002.
63. Huot P, Fox SH, Brotchie JM. Monoamine reuptake inhibitors in Parkinson‘s disease. Parkinsons Dis 2015;2015 : 609428. doi: 10.1155/ 2015/ 609428.
64. Aarsland D, Kramberger MG. Neuropsychiatric Symptoms in Parkinson‘s Disease. J Parkinsons Dis 2015;5(3):659 – 67. doi: 10.3233/ JPD-150604.
65. Xie CL, Chen J, Wang XD, et al. Repetitive transcranial magnetic stimulation (rTMS) for the treatment of depression in Parkinson’s disease: a meta-analysis of randomized controlled clinical trials. Neurol Sci 2015;36(10):1751 – 61. doi: 10.1007/ s10072-015-2345-4.
Labels
Paediatric neurology Gynaecology and obstetrics Neurosurgery Neurology General practitioner for adults Psychiatry Clinical psychology Pain management
Article was published inCzech and Slovak Neurology and Neurosurgery

2016 Issue 6-
All articles in this issue
- Deprese u vybraných neurologických onemocnění
- Návrh bezpečnostní MR monitorace u pacientů s roztroušenou sklerózou léčených natalizumabem
- Netestuj, ale POBAV – písemné záměrné Pojmenování OBrázků A jejich Vybavení jako krátká kognitivní zkouška
- Neuropsychologické abnormity v exekutivních funkcích u pacientů s blefarospazmem
- Význam testování termických prahů v detekci neuropatie tenkých vláken u diabetiků 1. typu
- Případ závažného průběhu HIV-1 meningoencefalitidy a lues secundaria
- Autoimunitní encefalitidy – kazuistiky
- Přední osteofyty krční páteře způsobující polykací a dechové potíže – dvě kazuistiky
- Strach související s bolestí u pacientů s chronickou bolestí dolní části zad
- Možnosti transkraniální sonografie na neuropsychiatrickém pomezí
- Úvod do neuromuskulární ultrasonografie
- Chirurgická liečba rozsiahlej fibróznej dysplázie v kraniofaciálnej oblasti – kazuistika
- Předoperační výkony v oblasti vizuální paměti jako prediktivní faktor kognitivních změn po hluboké mozkové stimulaci subthalamického jádra u Parkinsonovy nemoci
- Orbitocelulitida jako komplikace akutní rhinosinusitidy – naše zkušenosti s léčbou u dospělých pacientů
- Spinálny gossypibóm 20 rokov po lumbálnej diskektómii – kazuistika
- Czech and Slovak Neurology and Neurosurgery
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Přední osteofyty krční páteře způsobující polykací a dechové potíže – dvě kazuistiky
- Deprese u vybraných neurologických onemocnění
- Autoimunitní encefalitidy – kazuistiky
- Chirurgická liečba rozsiahlej fibróznej dysplázie v kraniofaciálnej oblasti – kazuistika
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career


