-
Medical journals
- Career
Současný pohled na imunopatogenezi myasthenia gravis
Authors: M. Jakubíková 1; J. Piťha 1,2
Authors‘ workplace: Neurologická klinika a Centrum klinických neurověd, 1. LF UK a VFN v Praze 1; MS Centrum Teplice, Neurologické oddělení, Krajská zdravotní, a. s. – Nemocnice Teplice o. z. 2
Published in: Cesk Slov Neurol N 2015; 78/111(6): 649-654
Category: Review Article
Overview
Myasthenia gravis (MG) je autoimunitní onemocnění, v jehož důsledku dochází k poruše nervosvalového přenosu. Dřívější představy o dominující roli patologických autoprotilátek namířených proti cílovým antigenům (nikotinovému acetylcholinovému receptoru, svalově specifické tyrozinkináze a nízkodenzitnímu lipoproteinovému receptoru) byly korigovány nálezem imunitní dysregulace na úrovni T lymfocytů – mezi Th1 a Th2 a/ nebo mezi T regulačními lymfocyty a Th17 buňkami, proliferací CD8+ lymfocytů, chemokinů, cytokinů a dalších molekul. K dysfunkci imunitního systému může dojít na různých úrovních imunitní odpovědi: pomocné CD4+ T lymfocyty, cytotoxické CD8+ T lymfocyty, regulační CD4+CD25+ T lymfocyty, Th17 lymfocyty, B lymfocyty i plazmatické buňky. Dominující roli v imunopatologických dějích má u mladších pacientů thymus, u nemocných starších se uplatňují extrathymické mechanizmy. Odlišné imunopatologické mechanizmy působí u myasthenie asociované s thymomem.
Klíčová slova:
myasthenia gravis – thymus – autoprotilátky – T lymfocyty – B lymfocyty – cytokinyÚvod
Myasthenia gravis (MG) je onemocnění nervosvalového přenosu charakterizované kolísavou slabostí a unavitelností příčně pruhovaných svalů. MG je autoimunitní onemocnění, kde několik typů autoprotilátek pod vlivem buněčných imunitních mechanizmů interferuje se strukturami nervosvalového spojení, které mohou vést k poruše jeho funkce [1].
Imunopatogeneze MG
Imunopatogeneze onemocnění je komplexní. Autoimunitní nemoci mají některé společné vlastnosti, z čehož vyplývá, že k jejich rozvoji vedou společné patogenní mechanizmy. Predisponující jsou faktory genetické, epigenetické, hormonální, nedostatek vitaminu D a možné spouštěcí faktory (infekce, chronický stres), které interagují s imunitním systémem. MG je autoprotilátkami zprostředkovaná nemoc, kde kromě patologie thymu hraje, dle poznatků z poslední doby, podstatnou roli i dysregulace pomocných a regulačních T lymfocytů [1].
Thymus a MG
Thymus je lymfoepiteliální orgán, jehož hlavní úlohou je maturace T lymfocytů (tzv. thymopoeza), tj. selekce buněk, které vytvoří repertoár zralých T buněk, a zároveň delece lymfocytů, jež reagují s autoantigeny [2]. Zásadní je rozlišovat mezi nethymomatózní (bez přítomnosti nádoru thymu – thymomu) a thymomatózní (paraneoplastickou) formou MG. U nethymomatózní formy MG se jedná z histopatologického hlediska buď o folikulární hyperplazii, nebo atrofii thymu.
Nethymomatózní autoimunitní forma MG
U mladších pacientů s protilátkami proti acetylcholinovému receptoru (AChR) dochází v thymu k indukci exprese AChR, která následuje po jeho uvolnění z thymických myoidních buněk. Myoidní buňky jsou u MG zdrojem antigenních epitopů, které jsou v kontextu s molekulami MHC II. třídy rozpoznávány T buněčnými receptory autoreaktivních CD4+ T lymfocytů jako cizorodé. V součinnosti se zánětlivými cytokiny dochází k aktivaci dalších autoreaktivních T lymfocytů, ale i B lymfocytů, které se vymknou kontrole T regulujících lymfocytů. To způsobí jak v thymu, tak i na periferii stimulaci specifických B lymfocytů, které produkují protilátky proti AChR. Dochází k novotvorbě drobných arteriol, jež napomáhají zvýšené atrakci lymfocytů do lymfoidních orgánů. Morfologickým důsledkem je tvorba germinativních center na rozhraní dřeně a kůry brzlíku s tzv. folikulární hyperplazií [2]. V nich jsou nahromaděny autoreaktivní T a B lymfocyty, hlavně fenotypy CD4+/ CD8 – a CD4 – / CD8+. Dřeňové epiteliální struktury obsahují nezralé formy svalových buněk (myoidní buňky), na kterých jsou lokalizovány AChR [3]. Předpokládá se, že autoagresivní reakce proti AChR může být iniciována přímo v thymu a že germinální centra jsou evidentně místo, kde dochází k protilátkové odpovědi B lymfocytů proti AChR [4]. Celá řada studií prokázala v hyperplastickém thymu navíc další důležité procesy, které odrážejí intenzivní aktivaci imunitního systému. V hyperplastickém thymu jsou na rozdíl od kontrolních thymů přítomny buňky produkující zánětlivé cytokiny jako IL‑12, IFN-gama, IL‑1 a IL‑6 [5]. Tento nález folikulární hyperplazie je patrný zejména u nemocných mladšího věku (do 45 – 50 let) s tzv. séropozitivní formou AChR + MG. Až u 50 % séronegativních pacientů, kteří nemají autoprotilátky proti AChR, se v thymu nalézají změny popisované jako „thymitis like“ infiltráty, což jsou podobné změny jako u folikulární hyperplazie thymu séropozitivních pacientů s MG, jen počet germinativních center je výrazně nižší [6]. U starších pacientů je zřetelná atrofie (involuce) thymu, v imunopatogenezi se účastní extrathymické mechanizmy.
Thymomatózní paraneoplastická forma MG
Asi 10 – 15 % pacientů má MG asociovanou s thymomem (MGAT) [7], 1/ 3 z nich tvoří maligní thymomy s invazivním růstem. Imunopatogeneze MGAT je heterogenní, uplatňují se jak centrální imunitní mechanizmy (thymus, thymom), tak periferní extrathymické mechanizmy. Paraneoplastická MGAT začíná v thymomu vývojem abnormálních netolerogenních T lymfocytů vůči AChR, které se následně exportují do periferních imunitních orgánů (lymfatické uzliny, slezina, kostní dřen a často i normální thymus mimo thymomu). Tady dochází k aktivaci T lymfocytů, k interakcím s B lymfocyty a nakonec k produkci autoprotilátek proti AChR [8]. To také vysvětluje fakt, proč po odstranění thymomu i s reziduální tkání thymu nedochází k poklesu titru protilátek proti AChR [9]. Všechny thymomy u pacientů s MG také vyplavují zralé naivní T lymfocyty do periferie a zejména autoreaktivním CD4+ T lymfocytům se přičítá významná role v patogenezi MGAT [10]. Proto při léčbě MGAT má kromě thymektomie rozhodující význam imunosupresivní léčba. Autoimunitní regulátor (AIRE) je transkripční faktor, který je produkován subpopulací medulárních epiteliálních buněk thymu a je nevyhnutný pro expresi tkáňově specifických antigenů, takže se považuje za klíčový faktor v centrální toleranci thymu. U většiny MGAT byly nalezeny hrubé defekty v expresi AIRE [11], nicméně byly také pozorovány u thymomů, které nebyly spojeny s MG, což naznačuje, že samotný nedostatek AIRE nevede k rozvoji MG.
Autoprotilátky
Patologické autoprotilátky jsou v cca 80 % případů namířeny proti nikotinovému AChR na postsynaptické membráně nervosvalové ploténky (AChR + MG) nebo v 5 – 10 % proti svalově specifické tyrozinkináze (MuSK, MuSK + MG). V roce 2011 byly u japonských myasteniků objeveny nové autoprotilátky proti receptoru, který je spojen s nízkodenzitním lipoproteinem (Low ‑ density lipoprotein 4; Lrp4), následně byly referovány i v Německu a USA [12]. Existují i tzv. séronegativní formy onemocnění, kde běžně dostupnými metodami neprokážeme v séru žádné známé protilátky asociované s MG. U této formy se velmi pravděpodobně jedná o velmi nízké titry výše uvedených cirkulujících autoprotilátek (tzv. nízkoafinitní protilátky), které nejsou detekovatelné dostupnými metodami.
V důsledku aktivace autoreaktivních B lymfocytů dochází k produkci protilátek proti AChR, které se zpočátku vážou na dva sousední receptory a následně blokují a destruují AChR tzv. membrány atakujícím komplexem. Aktivuje se komplement, oxid dusíku a zánětlivé cytokiny. Dochází k internalizaci AChR, vyhlazení junkčních záhybů, redukci AChR a následné blokádě nervosvalového přenosu. Pokud není zničení AChR kompenzováno jeho zvýšenou syntézou, důsledkem je snížení funkčních AChR na postsynaptické membráně, což vede k manifestaci myastenických příznaků [13]. Autoprotilátky proti AChR jsou polyklonální a hlavně z podskupin IgG1 a IgG3 (komplement aktivující). Z klinického hlediska titry protilátek jsou mezi pacienty značně variabilní a jejich hodnoty nekorelují s klinickou závažností MG. U pacientů léčených imunosupresivy mohou být protilátky proti AChR falešně negativní nebo se jejich hladina může snížit. Po plazmaferéze rovněž dochází k snížení hladiny protilátek spolu s klinickým zlepšením [14]. Protilátky proti AChR jsou často nalezeny i u pacientů s dlouhodobou klinickou remisí [15].
Pacienti s thymomem mají ve většině případů pozitivní protilátky proti AChR [16]. Naopak falešně pozitivní protilátky proti AChR můžeme nalézt u pacientů s thymomem bez MG, přičemž jejich nález nijak nepredikuje vznik MG [17]. Je popisován výskyt protilátek proti AChR i u jiných autoimunitních chorob.
Imunopatologický vliv autoprotilátek je zřejmý u 80 – 85 % nemocných. Tato forma choroby se označuje jako séropozitivní AChR + MG. U 40 % tzv. séronegativních pacientů byly nalezeny protilátky proti MuSK, což je povrchový transmembránový receptorický protein, který je součástí membrány svalového vlákna a má podstatnou roli pro zabudování AChR do postsynaptické membrány nervosvalové ploténky, tzv. clustering (shlukování) AChR [18]. Hoch et al v roce 2001 zjistili, že část pacientů se séronegativní formou MG má autoprotilátky proti MuSK, hlavně třídy IgG4 [19]. Autoprotilátky jsou namířeny proti extracelulární části MuSK a způsobují inhibici aktivace MuSK indukované agrinem, tzn. poruchu agregace, clusteringu AChR a následně postsynaptické selhání neuromuskulární transmise. U pacientů s protilátkami proti MuSK je thymus většinou atrofický. Nejnovějším objevem na poli výzkumu autoprotilátek u MG jsou již zmiňované anti‑Lrp4 protilátky, které patří hlavně do podtříd IgG1 a IgG2. Lrp4 je člen rodiny strukturně příbuzných transmembránových proteinů, které vykonávají různé funkce ve vývoji nervosvalového spojení, vč. signální transdukce a receptorem zprostředkované endocytózy. Lrp4 je specificky exprimován v dobře diferencovaných myotubulech a je soustředěn na nervosvalové ploténce [20]. Extracelulární doména molekuly Lrp4, která slouží jako funkční receptor, je v interakci s agrinem a tato vazba aktivuje MuSK, což vede k tvorbě většiny agregátů obsahujících AChR v junkční oblasti plazmatické membrány [21]. Lrp4 a MuSK mohou tvořit komplex i v nepřítomnosti ligandu agrinu, nicméně agrin prostřednictvím vazby na Lrp4 zvyšuje interakci mezi Lrp4 a MuSK [22,23]. Velká mezinárodní studie [24] odhalila, že podíl těchto autoprotilátek u tzv. dvojitě séronegativních pacientů (anti‑AChR negat., anti‑MuSK negat.) tvoří až 19 % z celkového počtu. U většiny pacientů s nálezem thymomu se nacházejí protilátky antistriatální (ScMAb), které způsobují postižení svalových vláken s mikroskopickým nálezem lymforhagií. Tyto protilátky reagují s epitopy na svalových bílkovinách titinu, ryanodinového receptoru, kortaktinu a dalších, a dle některých autorů můžou korelovat se závažností MG [25]. Klasifikace MG zahrnuje jednak povahu protilátek, věk nástupu onemocnění a zapojení thymu (tab. 1). MG je prototyp autoimunitního onemocnění s přítomností receptorově specifických protilátek.
Table 1. Klinicko-patologická charakteristika autoprotilátek u MG. 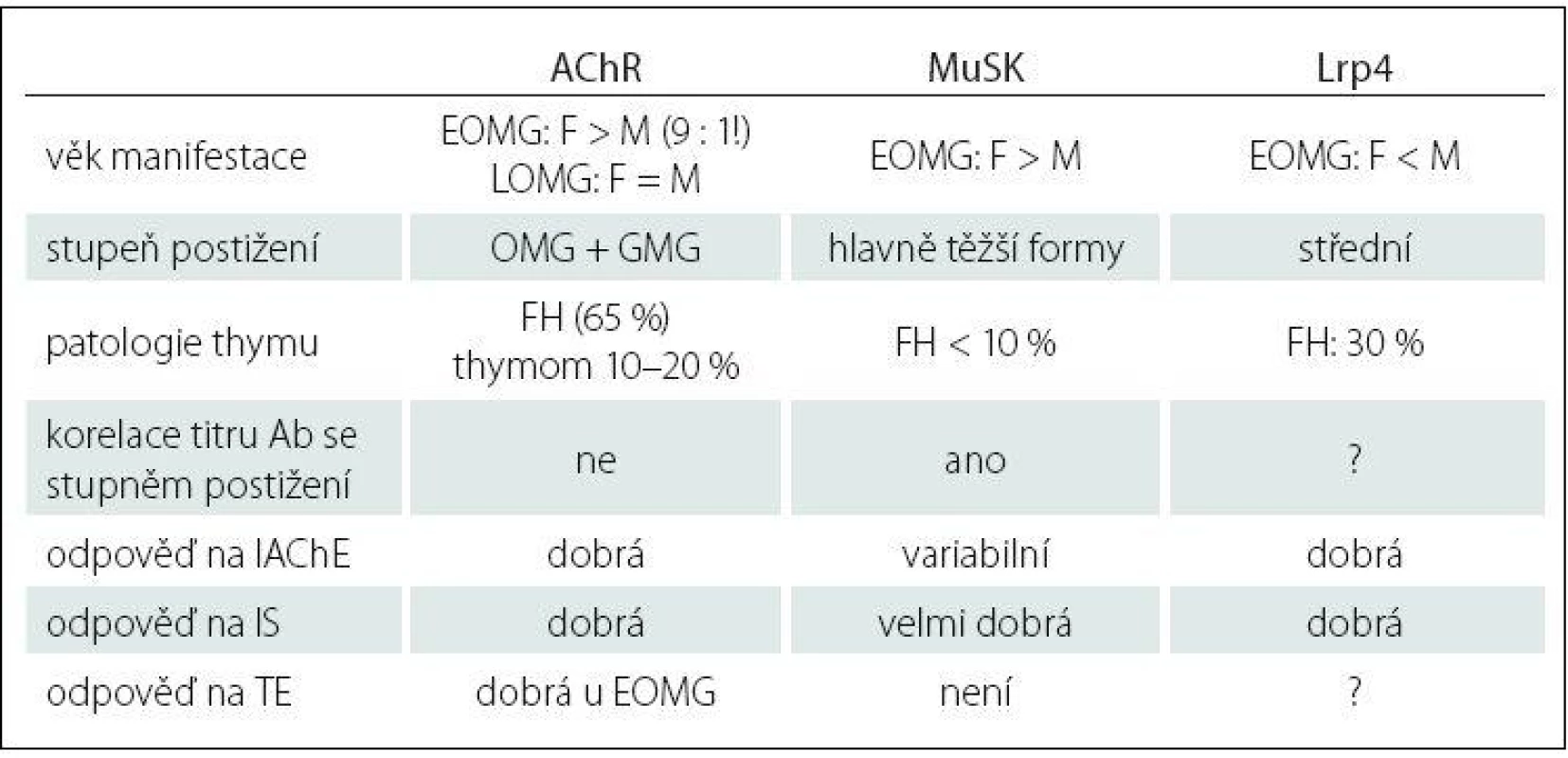
Ab – protilátky, AChR – acetylcholinový receptor, EOMG – early onset, FH – folikulární hyperplazie, GMG – generalizovaná MG, IAChE – inhibitory acetylcholinesterázy, IS – imunosupresiva, LOMG – late onset, Lrp4 – nízkodenzitní lipoprotein 4, MuSK – svalově specifi cká tyrozin kináza, OMG – okulární MG, TE – thymektomie. Upraveno podle [1]. Účast jednotlivých subpopulací lymfocytů na imunopatogenezi MG
T lymfocyty – buněčná odpověď specifické imunity
AChR ‑ reaktivní CD4+ T buněčné klony, které se nacházejí v thymu a periferní krvi, hrají důležitou roli v patogenezi MG tím, že pomáhají B lymfocytům produkovat anti‑AChR protilátky [26,27]. AChR ‑ specifické CD4+ T buňky jsou přítomny v krvi pacientů s MG, ale jsou obzvláště bohaté na brzlíku, což podporuje myšlenku, že k autosenzibilizaci T buněk dochází v thymu [28]. Studie, které využívají model buněčného přenosu u experimentální autoimunitní MG (EAMG) ukazují stěžejní roli AChR specifických CD4+ T buněk na rozvoj EAMG. Thymektomie a specifická terapie monoklonálními protilátkami proti CD4+ T lymfocytům zlepšuje klinické příznaky u tohoto modelu, což dokazuje, že CD4+ T buňky mohou být zapojeny v iniciaci humorální autoimunitní odpovědi u MG [29]. Po transplantaci fragmentů thymu nebo směsi lymfocytů od pacientů s MG produkují SCID myši protilátky proti lidským AChR a manifestuje se u nich myastenická slabost. Tyto nálezy prokazují, že autoreaktivní CD4+ T buňky jsou nezbytně nutné pro produkci patogenních protilátek proti AChR [30].
Z hlediska periferních mechanizmů autotolerance je velmi důležitou skupinou CD4+ T lymfocytů subpopulace regulačních buněk, které jsou charakterizovány molekulami CD4, CD25 a Foxp3 (transkripční faktor). CD4+CD25+ (T-regulační lymfocyty) mají nejdůležitější roli v udržování autotolerance a potlačení rozvoje autoimunity [31]. Snížení buněčné aktivity Treg je popisováno u pacientů s různými autoimunitními onemocněními [32]. Tak např. funkční aktivita cirkulujících CD4+CD25+ T buněk byla u pacientů s RS nižší ve srovnání se zdravými kontrolami [33]. Jejich mechanizmus účinku ochrany organizmu před T lymfocyty zprostředkovanými autoimunitními nemocemi je buď přímý inhibiční účinek na B lymfocyty nebo nepřímo přes inhibici diferenciace T pomocných lymfocytů [34,35].
Vzhledem k faktu, že CD4+CD25+ regulační T buňky jsou thymického původu a hrají důležitou roli při rozvoji autoimunitních onemocnění, je zajímavé zkoumat jejich role v patogenezi MG. Aricha at al pozorovali, že se v periferní krvi u myastenických potkanů nachází významně nižší počet Treg v porovnání se zdravými kontrolami a že Treg buňky od zdravých dárců mohou suprimovat EAMG u hlodavců [36]. Rovněž Treg buňky od myastenických potkanů jsou méně účinné než Treg buňky od zdravých kontrol [37]. Pacienti s MG mají funkční deficit thymických Treg buněk [38]. Množství Treg buněk dle některých autorů dramaticky narůstá po thymektomii a koreluje se zlepšením klinických příznaků [39]. Také kortikoidy vedou k zlepšení funkční aktivity Treg buněk.
T lymfocyty, které exprimují na svém povrchu molekulu CD8 a antigen rozpoznávají v kontextu molekul MHC I. třídy, představují tzv. cytotoxické CD8+ T lymfocyty. Jejich role v imunopatogenezi MG není zcela jasná. Mají spíše regulující funkci. CD8+ T lymfocyty jsou zapojeny do zastavení destruktivního účinku zánětlivé odpovědi a udržení vlastní imunotolerance; CD8+ T buněčná deplece zvyšuje vnímavost myší k EAMG [40]. Lisak et al ukázali, že deplece CD8+ T buněk z krevních mononukleárních buněk u pacientů s MG vedla ke zvýšené produkci autoprotilátek, což znamená, že autologní CD8+ T buňky vykazují určitou regulační kontrolu nad anti‑AChR CD4+ T buňkami u MG [41].
B lymfocyty a plazmatické buňky – humorální odpověď specifické imunity
Zvýšený počet B buněk se nalézá v thymu u folikulární hyperplazie při SPMG s časným začátkem, a to hlavně u žen [42]. Poměrně typický nález, který svědčí pro účast humorálních mechanizmů v imunopatogenezi MG, je výskyt germinálních center v thymu. Zvýšené hladiny estrogenu nebo prolaktinu pravděpodobně umožňují autoreaktivním B buňkám vyhnout se mechanizmům tolerance, hromadit se a v dostatečném počtu způsobit autoimunitní onemocnění. Senzibilizované autoreaktivní B lymfocyty produkují protilátky zejména proti AChR. Wang et al zjistili, že u pokusných hlodavců s EAMG se buňky secernující autoprotilátky nacházejí v lymfatických uzlinách, slezině a thymu a přednostně jsou produkovány proti nativnímu AChR, a to hlavně alfa‑podjednotce [43]. Kromě toho, u pacientů s MG se objevily důkazy o klonální expanzi B lymfocytů ve srovnání s kontrolami [44]. Aktivační faktory B lymfocytů (APRIL (proliferaci indukující ligand B lymfocytů) a aktivační faktor B lymfocytů (B ‑ cell Activating Factor; BAFF))jsou TNF‑like chemokiny, které podporují přežití a diferenciaci B buněk. Zvýšené sérové hladiny BAFF a APRIL můžeme najít u několika typů autoimunitních onemocnění – systémový lupus erythematodes (SLE), diabetes mellitus 1. typu, roztroušená skleróza, ale i u MG [45]. Inhibitory BAFF nebo BAFF/ APRIL byly již úspěšně použity u myšího modelu několika autoimunitních nemocí [46].
Bylo prokázáno, že belimumab, monoklonální protilátka, která neutralizuje BAFF, je účinná v léčbě SLE a rovněž již byla za tímto účelem schválena [47]. Fáze II klinické studie ověřující bezpečnost a klinický efekt u MG v současné době probíhá.
Cytokiny IL‑17, IFN‑ γ, TNF‑α a IL‑6
Interleukin 17 je tvořen paměťovými aktivovanými CD4+ T lymfocyty a pravděpodobně patří k časným iniciátorům zánětlivých reakcí závislých na T buňkách. Ukazuje se, že rovnováha mezi T-pomocnými buňkami (Th1, Th2, Th17 a Treg) je při rozvoji EAMG narušena tím, že dochází ke kolísání hladiny IL‑17, která při progresi onemocnění stoupá. Z toho vyplývá, že nerovnováha jednotlivých subpopulací pomocných T lymfocytů hraje u EAMG významnou roli a že patogenetické mechanizmy související s produkcí IL‑17 mohou představovat potenciální terapeutické cíle [48].
U pacientů s MG byly prokázány zvýšené hladiny IL‑17 [49] a rovněž u paraneoplastické formy MG byla popsána zvýšená frekvence výskytu IL‑17 produkujících CD4+ T lymfocytů, která dokonce korelovala s hladinami protilátek proti AChR [50]. Zvýšená produkce IL‑17 byla také popsána u folikulární hyperplazie při SPMG [51]. Podle nejnovějších poznatků IL‑17 produkující CD4+ T lymfocyty přispívají ke ztrátě tolerance B lymfocytů u experimentální autoimunitní MG [52].
Chronický zánět přítomný v thymech pacientů MG, který zahrnuje řadu cytokinů, jako je TNF‑α, IL‑17 a IFN ‑ γ, zřetelně přispívá ke snížení počtu Treg buněk a dysregulaci jejich imunosupresivní aktivity. V mechanizmu této chronické imunitní aktivace hrají výše popisované cytokiny ústřední roli [53].
TNF‑α hraje klíčovou úlohu u imunoregulačních poruch pozorovaných u MG. Argumenty podporující tento závěr jsou: Hladina TNF‑α je významně zvýšená nejen v celém thymu, ale i v séru pacientů s MG a že i pacienti s lehčími formami onemocnění mají vysoké hladiny TNF‑α. To naznačuje, že u pacientů s MG je chronický nadbytek TNF‑α [54]. TNF‑α snižuje funkci Treg buněk. Anti‑TNF‑α léčba je úspěšná u mnoha experimentálních modelů autoimunitních chorob vč. EAMG a současně obnovuje supresivní funkce Treg [55].
Sekrece IL‑6 je odpověď na sekreci TNF‑α a IL‑1. Je produktem aktivovaných T lymfocytů, pro B lymfocyty je hlavním růstovým faktorem v závěrečných fázích jejich diferenciace. Podporuje tak tvorbu protilátek (je také růstovým faktorem pro plazmocyty). Některé studie ukázaly, že IL‑6 se podílí na rozvoji MG [56,57], což je v souladu s jeho činností jako promotoru B-buněčné diferenciace a proliferace, a následné indukci tvorby plazmatických buněk a protilátek [58]. Již dříve bylo prokázáno, že léčba protilátkou anti‑IL‑6 potlačuje probíhající MG u krys [59]. Je zajímavé, že IL6 – / IL6 – myši jsou rezistentní k indukci EAMG [60]. Uznání role IL‑6 v imunopatogenezi některých autoimunitních onemocnění vedlo k použití monoklonální protilátky proti lidskému IL‑6 receptoru (tocilizumabu) pro léčbu revmatoidní artritidy, juvenilní idiopatické artritidy a Castlemanovy nemoci. Klinické účinky této léčby u pacientů s MG nejsou známy, zatím nebyl použit v klinických studiích. Jeden experimentální model prokázal, že léčba anti‑IL‑6 protilátkou potlačuje probíhající EAMG prostřednictvím mechanizmů, které zahrnují inhibici Th1, Th17 buněk a posléze i B buněk (schéma 1) [59].
Schéma 1. Účast thymu, subpopulací lymfocytů a cytokinů na imunopatogenezi MG. 
AChR – acetylcholinový receptor, B – B lymfocyty, EV – endoteliální venuly, IFN-γ – interferon gamma, IL – interleukin, MHC – hlavní histokompatibilní komplex, TEB – thymické epiteliální buňky, Th – pomocné T lymfocyty, TNF-α – tumor nekrotizující faktor alfa, Treg – regulační T lymfocyty Závěr
V posledních letech jsme svědky velkého pokroku v poznání imunopatologických dějů u autoimunitních chorob. U řady z nich nacházíme společné imunopatogenetické mechanizmy, které vedou k poruše funkce či k destrukci cílové tkáně. Zánětlivé prostředí v cílovém orgánu mění funkci a plasticitu CD4+ buněk, což vede k poškození funkce Treg lymfocytů. Tento mechanizmus je typický pro celou řadu autoimunitních onemocnění. Nové možnosti biologické terapie zaměřené na konkrétní cílový antigen dávají nové naděje pacientům s refrakterními formami jednotlivých autoimunitních onemocnění.
Tato práce vznikla za podpory Grantové agentury Univerzity Karlovy v rámci projektu č. 351011/ 2011 s názvem „Klinická, laboratorní a socioekonomická analýza u pacientů s myasthenia gravis v České republice“. Dále byla podpořena výzkumným programem PRVOUK ‑ P26/ LF1/ 4 a Specifickým vysokoškolským výzkumem č. 254260020.
Autoři deklarují, že v souvislosti s předmětem studie nemají žádné komerční zájmy.
Redakční rada potvrzuje, že rukopis práce splnil ICMJE kritéria pro publikace zasílané do biomedicínských časopisů.
Přijato k recenzi: 11. 9. 2015
Přijato do tisku: 27. 10. 2015
MUDr. Michala Jakubíková
Neurologická klinika a Centrum klinických neurověd
1. LF UK a VFN v Praze
Kateřinská 30
120 00 Praha 2
e-mail: michala.jakubikova@vfn.cz
Sources
1. Berrih ‑ Aknin S, Le Panse R. Myasthenia gravis: a comprehensive review of immune dysregulation and etiological mechanisms. J Autoimmun 2014; 52 : 90 – 100. doi: 10.1016/ j.jaut.2013.12.011.
2. Marx A, Wilisch A, Schultz A, Gattenlöhner S, Nenninger R, Müller ‑ Hermelink HK. Pathogenesis of myasthenia gravis. Virchows Arch 1997; 430(5): 355 – 364.
3. Kaminski HJ, Ruff RL. Structure and kinetic properties of the acetylcholine receptor. In: Engel AG (ed.) Myasthenia gravis and myasthenic disorders. Oxford: University Press 1999 : 40 – 64.
4. Kuks JBM. The thymus and myasthenia gravis. Doctoral thesis. Groningen: University of Groningen 1992.
5. Emilie D, Crevon MC, Cohen ‑ Kaminski S, Peuchmaur M, Devergne O, Berrih ‑ Aknin S et al. In situ production of interleukins in hyperplastic thymus from myasthenia gravis patients. Hum Pathol 1991; 22(5): 461 – 468.
6. Lauriola L, Ranelletti F, Maggiano N, Guerriero M, Punzi C, Marsili F et al. Thymus changes in anti‑MUSK ‑ positive and - negative myasthenia gravis. Neurology 2005; 64(3): 536 – 538.
7. Špalek P. Myastenia gravis – autoimunitné spektrum a imunopatogenetická klasifikácia. Neurologia 2009; 4 : 25 – 30.
8. Ströbel P, Chuang WY, Marx A. Thymoma‑associated paraneoplastic myasthenia gravis. In: Kaminski HJ (ed.). Myasthenia gravis and related disorders. New York: Humana Press 2009 : 105 – 117.
9. Špalek P, Schnorrer M, Krajč T. Imunopatogenéza paraneoplastickej myastenie gravis asociovanej s tymómom. Neurologia 2010; 5 : 7 – 11.
10. Ströbel P, Helmreich M, Menioudakis G, Lewin SR, Rüdiger T, Bauer A et al. Paraneoplastic myasthenia gravis correlates with generation of mature naive CD4(+) T cells in thymomas. Blood 2002; 100(1): 159 – 166.
11. Marx A, Hohenberger P, Pfannschmidt J, Wiebe K, Willcox N, Stro P. The autoimmune regulator AIRE in thy-moma biology: autoimmunity and beyond. J ThoracOncol 2010; 5 (Suppl 4): S266 – S272. doi: 10.1097/ JTO.0b013e3181f1f63f.
12. Motomura M, Narita Masuda T. Autoantibodies in myasthenia gravis. Brain Nerve 2013; 65(4): 433 – 439.
13. Engel AG, Fumagalli G. Mechanisms of acetylcholine receptor loss from the neuromuscular junction. Ciba Found Symp 1982; 90 : 197 – 224.
14. Dau PC. Plasmapheresis therapy in myasthenia gravis. Muscle Nerve 1980; 3(6): 468 – 482.
15. Limburg PC, The TH, Hummel ‑ Tappel E, Oosterhuis HJ. Anti‑acetylcholine receptor antibodies in myasthenia gravis. Part 1. Relation to clinical parameters in 250 patients. J Neurol Sci 1983; 58(3): 357 – 370.
16. Špalek P. Tymómy a paraneoplastická autoimunita. Cesk Slov Neurol N 2002; 65/ 98(3): 367 – 373.
17. Seybold ME, Lindstrom JM. Patterns of acetylcholine receptor antibody in myasthenia gravis. Ann N Y Acad Sci 1981; 377 : 292 – 306.
18. Conti‑Fine BM, Diethelm ‑ Okita B, Ostlie N. Imunopathogenesis of myasthenia gravis. In: Kaminski HJ (ed.). Myasthenia gravis and related disorders. New York, Humana Press 2009 : 43 – 70.
19. Hoch W, McConville J, Helms S, Newsom ‑ Davis J, Melms A, Vincent A. Autoantibodies to the receptor tyrosine kinase MuSK in patients with myasthenia gravis without acetylcholine receptor antibodies. Nat Med 2001; 7(3): 365 – 368.
20. Weatherbee SD, Anderson KV, Niswander LA. LDL‑receptor‑related protein 4 is crucial for formation of the neuromuscular junction. Development 2006; 133(24): 4993 – 5000.
21. Pevzner A, Schoser B, Peters K, Cosma NC, Karakatsani A, Schalke B et al. Anti‑LRP4 autoantibodies in AChR ‑ and MuSK ‑ antibody ‑ negative myasthenia gravis. J Neurol 2012; 259(3): 427 – 435. doi: 10.1007/ s00415 ‑ 011 ‑ 6194 ‑ 7.
22. Gomez AM, Burden SJ. The extracellular region of Lrp4 is sufficient to mediate neuromuscular synapse formation. Dev Dyn 2011; 240(12): 2626 – 2633. doi: 10.1002/ dvdy.22772.
23. Zhang B, Luo S, Wang Q, Suzuki T, Xiong WC, Mei L. LRP4 Serves as a coreceptor of agrin. Neuron 2008; 60(2): 285 – 297. doi: 10.1016/ j.neuron.2008.10.006.
24. Zisimopoulou P, Evangelakou P, Tzartos J, Lazaridis K, Zouvelou V, Mantegazza R et al. A comprehensive analysis of the epidemiology and clinical characteristics of anti‑LRP4 in myasthenia gravis. J Autoimmun 2014; 52 : 139 – 145. doi: 10.1016/ j.jaut.2013.12.004.
25. Romi F, Skeie GO, Gilhus NE, Aarli JA. Striational antibodies in myasthenia gravis: reactivity and possible clinical significance. Arch Neurol 2005; 62(3): 442 – 446.
26. Lindstrom J, Shelton D, Fujii Y. Myasthenia gravis. Adv Immunol 1988; 42 : 233 – 284.
27. Harcourt GC, Sommer N, Rothbard J, Willcox HN, Newsom ‑ Davis J. A juxta ‑ membrane epitope on the human acetylcholine receptor recognized by T cells in myasthenia gravis. J Clin Invest 1988; 82(4): 1295 – 1300.
28. Melms A, Schalke BCG, Kirchner T, Müller ‑ Hermelink HK, Albert E, Wekerle H. Thymus in myasthenia gravis: isolation of T‑lymphocyte lines specific for the nicotinic acetylcholine receptor from thymuses of myasthenic patients. J Clin Invest 1988; 81 : 902 – 908.
29. Ahlberg R, Yi Q, Pirskanen R, Matell G, Swe-rup C, Rieber EP et al. Treatment of myasthenia gravis with anti‑CD4 antibody: improvement correlates to decreased T cell autoreactivity. Neurology 1994; 44(9): 1732 – 1737.
30. Wang ZY. Myasthenia in SCID mice grafted with myasthenic patient lymphocytes: role of CD4+ and CD8+ cells. Neurology 1999; 52(3): 484 – 497.
31. Beissert S, Schwarz A, Schwarz T. Regulatory T cells. J Invest Dermatol 2006; 126(1): 15 – 24.
32. Sakaguchi S, Yamaguchi T, Nomura T, Ono M. Regulatory T cells and immune tolerance. Cell 2008; 133(5): 775 – 787. doi: 10.1016/ j.cell.2008.05.009.
33. Viglietta V, Baecher ‑ Allan C, Weiner HL, Hafler DA. Loss of functional suppression by CD4+CD25+ regulatory T cells in patients with multiple sclerosis. J Exp Med 2004; 199(7): 971 – 979.
34. Bystry RS, Aluvihare V, Welch KA, Kallikourdis M, Betz AG. B cells and professional APCs recruit regulatory T cells via CCL4. Nat Immunol 2001; 2(12): 1126 – 1132.
35. Shevach EM. CD4+CD25+ suppressor T cells: more questions than answers. Nat Rev Immunol 2002; 2(6): 389 – 400.
36. Aricha R, Feferman T, Fuchs S, Souroijon MC. Ex vivo regulatory T cells modelate experimental myasthenia gravis. J Immunol 2005; 175(12): 7898 – 7904.
37. Gertel ‑ Lapter S, Mizrachi K, Berrih ‑ Aknin S, Fuchs S, Souroujon MC. Impairment of regulatory T cells in myasthenia gravis: studies in an experimental model. Autoimmun Rev 2013; 12(9): 894 – 903. doi: 10.1016/ j.autrev.2013.03.009.
38. Balandina A, Lécart S, Dartevelle P, Saoudi A, Berrih ‑ Aknin S. Functional defect of regulatory CD4(+)CD25+ T cells in the thymus of patients with autoimmune myasthenia gravis. Blood 2005; 105(2): 735 – 741.
39. Sun Y, Qiao J, Lu CZ, Zhao CB, Zhu XM, Xiao BG. Increase of circulating CD4+CD25+ T cells in myasthenia gravis patients with stability and thymectomy. Clin Immunol 2004; 112(3): 284 – 289.
40. Zhang GX, Xiao BG, Bakhiet M, van der Meide P, Wigzell H, Link H et al. Both CD4+ and CD8+ T cells are essential to induce experimental autoimmune myasthenia gravis. J Exp Med 1996; 184(2): 349 – 356.
41. Lisak RP, Laramore C, Zweiman B, Moskovitz A. In vitro synthesis of antibodies to acetylcholine receptor by peripheral blood mononuclear cells of patients with myasthenia gravis. Neurology 1983; 33(5): 604 – 608.
42. Berrih ‑ Aknin S, Ragheb S, Le Panse R, Lisak RP. Ectopic germinal centers, BAFf and anti‑B ‑ cell therapy in myasthenia gravis. Autoimmun Rev 2013; 12(9): 885 – 893. doi: 10.1016/ j.autrev.2013.03.011.
43. Wang ZY, Link H, Qiao J, Olsson T, Huang WX. Cell autoimmunity to acetylcholine receptor and its subunits in Lewis rats over the course of experimental autoimmune myasthenia gravis. J Neuroimmunol 1993; 45 : 103 – 112.
44. Vrolix K, Fraussen J, Losen M, Stevens J, Lazaridis K, Molenaar PC et al. Clonal heterogeneity of thymic B cells from early ‑ onset myasthenia gravis patients with antibodies against the acetylcholine receptor. J Autoimmun 2014; 52 : 101 – 112. doi: 10.1016/ j.jaut.2013.12.008.
45. Kim JY, Yang Y, Moon JS, Lee EY, So SH, Lee HS et al. Serum BAFf expression in patients with myasthenia gravis. J Neuroimmunol 2008; 199(1 – 2): 151 – 154. doi: 10.1016/ j.jneuroim.2008.05.010.
46. Davidson A. Targeting BAFf in autoimmunity. Curr Opin Immunol 2010; 22(6): 732 – 739. doi: 10.1016/ j.coi.2010.09.010.
47. Berrih ‑ Aknin S, Ragheb S, Le Panse R, Lisak RP. Ectopic germinal centers, BAFf and anti‑B ‑ cell therapy in myasthenia gravis. Autoimmun Rev 2013; 12 : 885 – 893. doi: 10.1016/ j.autrev.2013.03.011.
48. Mu L, Sun B, Kong Q, Wang J, Wang G, Zhang S et al. Disequilibrium of T helper type 1,2 and 17 cells and regulatory T cells during the development of experimental autoimmune myasthenia gravis. Immunology 2009; 128 (Suppl 1): 826 – 836. doi: 10.1111/ j.1365 ‑ 2567.2009.03089.x.
49. Roche JC, Capablo JL, Larrad L, Gervas ‑ Arruga J, Ara JR, Sanchez A et al. Increased serum interleukin‑17 levels in patients with myasthenia gravis. Muscle Nerve 2011; 44(2): 278 – 280. doi: 10.1002/ mus.22070.
50. Wang Z, Wang W, Chen Y, Wei D. T helper type 17 cellsexpand in patients with myasthenia‑associated thymoma. Scand J Immunol 2012; 76 : 54 – 61. doi: 10.1111/ j.1365 ‑ 3083.2012.02703.x.
51. Cordiglieri C, Marolda R, Franzi S, Cappelletti C, Giardina C, Motta T et al. Innate immunity in myasthenia gravis thymus: pathogenic effects of Toll‑like receptor 4signaling on autoimmunity. J Autoimmun 2014; 52 : 74 – 89. doi: 10.1016/ j.jaut.2013.12.013.
52. Schaffert H, Pelz A, Saxena A, Losen M, Meisel A, Thiel A et al. IL‑17 – producing CD4+ T cells contribute to the loss of B cell tolerance in experimental autoimmune myasthenia gravis. Eur J Immunol 2015; 45(5): 1339 – 1347. doi: 10.1002/ eji.201445064.
53. Berrih ‑ Aknin S, Le Panse R. Myasthenia gravis: a comprehensive review of immune dysregulation and etiological mechanisms. J Autoimmun 2014; 52 : 90 – 100. doi: 10.1016/ j.jaut.2013.12.011.
54. Gradolatto A, Nazzal D, Truffault F, Bismuth J, Fa-del E, Foti M et al. Both Treg cells and Tconv cells aredefective in the myasthenia gravis thymus: roles of IL‑17 and TNF‑α. J Autoimmun 2014; 52 : 53 – 63. doi: 10.1016/ j.jaut.2013.12.015.
55. Valencia X, Stephens G, Goldbach ‑ Mansky R, Wilson M, Shevach EM, Lipsky PE. TNF downmodulates the function of human CD4+CD25 T ‑ regulatory cells. Blood 2006; 108(1): 253 – 261.
56. Cohen ‑ Kaminski S, Delattre RM, Devergne O, Klingel ‑ Schmitt I, Emilie D, Galanaud P et al. High IL‑6 gene expression and production by cultured human thymic epithelial cells from patients with myasthenia gravis. Ann N Y Acad Sci 1993; 681 : 97 – 99.
57. Endo S, Hasegawa T, Sato Y. Inhibition of IL‑6 overproduction by steroid treatment before transsternal thymectomy for myasthenia gravis: does it help stabilize perioperative condition? Eur J Neurol 2005; 12(10): 768 – 773.
58. Takatsu K. Cytokines involved in B cell differentiation and their sites of action. Proc Soc Exp Biol Med 1997; 215(2): 121 – 133.
59. Aricha R, Mizrachi K, Fuchs S, Souroujon MC. Blocking of IL‑6 suppresses experimental autoimmune myasthenia gravis. J Autoimmun 2011; 36(2): 135 – 141. doi: 10.1016/ j.jaut.2010.12.001.
60. Deng C, Goluczko E, Tuzun E, Yang H, Christa-doss P. Resistance to experimental autoimmune myasthenia gravis in IL‑6 - deficient mice is associated with reduced germinal center formation and reduced C3 production. J Immunol 2002; 169(2): 1077 – 1083.
Labels
Paediatric neurology Neurosurgery Neurology
Article was published inCzech and Slovak Neurology and Neurosurgery

2015 Issue 6-
All articles in this issue
- Nádory očnice
- Překrývání neurodegenerativních demencí
- Současný pohled na imunopatogenezi myasthenia gravis
- Roztroušená skleróza, neplodnost a její léčba
- Delirium u kriticky nemocných – prospektivní studie
- Poruchy srdečního rytmu u mladých pacientů s kryptogenní ischemickou cévní mozkovou příhodou
- Novinky ze světa NOAK – „Dienerovo pravidlo 1- 3- 6- 12“ a první antidotum s potvrzeným účinkem
- Mobilita medianu před dekompresí karpálního tunelu a po ní
- Měření úrovně emočního uvědomění – pilotní studie ověřující základní psychometrické vlastnosti české verze Škály úrovně emočního uvědomění LEAS
- Psychometrické vlastnosti české verze Epworthské škály spavosti
- Naše zkušenosti s chirurgickou léčbou tumorů periferních nervů
- Kraniocervikální pneumatizace provázená neurologickou symptomatikou – kazuistika
- Familiární amyloidová polyneuropatie – kazuistika
- Časná rotace intratékální baklofenové pumpy – kazuistika
- Czech and Slovak Neurology and Neurosurgery
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Nádory očnice
- Novinky ze světa NOAK – „Dienerovo pravidlo 1- 3- 6- 12“ a první antidotum s potvrzeným účinkem
- Psychometrické vlastnosti české verze Epworthské škály spavosti
- Familiární amyloidová polyneuropatie – kazuistika
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

