-
Medical journals
- Career
Poruchy srdečního rytmu u mladých pacientů s kryptogenní ischemickou cévní mozkovou příhodou
Authors: D. Šaňák 1; M. Hutyra 2; M. Král 1; History Study Group *
Authors‘ workplace: Komplexní cerebrovaskulární centrum, Neurologická klinika LF UP a FN Olomouc 1; 1. interní klinika – kardiologická LF UP a FN Olomouc 2
Published in: Cesk Slov Neurol N 2015; 78/111(6): 669-674
Category: Original Paper
doi: https://doi.org/10.14735/amcsnn2015669*HISTORY study group: T. Veverka, A. Bártková, A. Kunčarová, T. Dorňák, D. Franc, P. Kaňovský (Neurologická klinika LF UP a FN Olomouc), M. Fedorco, J. Galuzska, D. Vindiš, T. Skála, M. Táborský (1. interní klinika – kardiologická LF UP a Olomouc), E. Čecháková, Z. Tüdös, M. Černá, M. Köcher, (Radiologická klinika LF UP a FN Olomouc), J. Úlehlová, L. Slavík (Hemato-onkologická klinika LF UP a FN Olomouc), J. Zapletalová, K. Langová (Ústav lékařské biofyziky, biometrie a statistiky, LF UP v Olomouci), R. Herzig (Neurologická klinika LF UK a FN Hradec Králové), D. Školoudík (Ústav ošetřovatelství, Fakulta zdravotních věd, UP v Olomouci).
Overview
Úvod a cíl:
U mladých pacientů bývá velmi často příčina ischemické cévní mozkové příhody (iCMP) kryptogenní. Ve starší populaci jsou za možnou příčinu považovány nedetekované poruchy srdečního rytmu. Cílem této prospektivní studie bylo stanovit výskyt srdečních arytmií u mladých pacientů s kryptogenním iktem pomocí dlouhodobého EKG ‑ Holter monitoringu a podkožně implantovaného srdečního monitoru.Soubor a metodika:
Soubor tvoří konsekutivní pacienti s akutní iCMP do 50 let zařazení do prospektivní studie HISTORY (Heart and Ischemic STrOke Relationship studY). Kryptogenní iCMP byla definována dle TOAST kritérií. U všech pacientů byla mozková ischemie potvrzena na CT/ MR, provedeno vstupní EKG, vyšetření sérových kardiomarkerů, trombofilní skríning vč. genetického vyšetření, neurosonologie, jícnová echokardiografie (TEE), 24hod EKG ‑ Holter a třítýdenní holterovský EKG monitoring. Vybraným pacientům s negativním třítýdenním EKG ‑ Holterem byl následně implantován podkožní srdeční monitor.Výsledky:
Z 838 pacientů zařazených do studie HISTORY mělo 123 pacientů méně než 50 let. Z nich bylo 102 (83 %) identifikováno jako kryptogenní iCMP (56 mužů, průměrný věk 39 ± 8,5 let). Srdeční arytmie byla zachycena celkem u 12 (12 %) pacientů (devět mužů, průměrný věk 43 ± 4,2 let). V devíti (75 %) případech se jednalo o fibrilaci síní. U tří pacientů byla arytmie zaznamenána během 24hod EKG ‑ Holteru a u zbývajících devíti pak během třítýdenního monitoringu. Podkožní monitor byl implantován 12 pacientům, u žádného ale nedošlo k záchytu arytmie během sledovaného období (medián 122 dní).Závěr:
Arytmie byla detekována u 12 % mladých pacientů s kryptogenní iCMP. Prodloužení holterovského EKG monitoringu významně zvýšilo jejich záchyt. Clinical Trial Registration: http:/ / www.clinicaltrials.gov. Unique identifier: NCT01541163.Klíčová slova:
kryptogenní ischemická cévní mozková příhoda – poruchy srdečního rytmu – fibrilace síní – EKG-Holter monitoringÚvod
Velmi častou příčinu ischemických cévních mozkových příhod (iCMP) představuje kardioembolizace, při které dochází k embolizaci do mozkové cévy ze srdce na podkladě strukturální patologie srdečních oddílů nebo častěji v důsledku poruchy srdečního rytmu [1 – 4]. V některých případech však zůstává příčina iCMP nejasná – kryptogenní. Ve starší populaci kryptogenních iCMP jsou za příčinu obvykle považovány nedetekované poruchy srdečního rytmu s embolizačním potenciálem, zejména fibrilace síní (FiS) [5 – 8]. V mladší populaci je frekvence kryptogenní iCMP podstatně vyšší [9 – 11]. Mezi známé příčiny iktu v této věkové skupině patří mimo tepennou disekci, migrénu a hyperkoagulační stavy také srdeční abnormity [12 – 13]. Poruchy srdečního rytmu se vyskytují i v mladší populaci, a proto se předpokládá, že u části pacientů může být příčinou kryptogenní iCMP nedetekovaná arytmie [5,12,14].
Nejčastější arytmií s embolizačním potenciálem je FiS, která je příčinou až 85 % všech kardioemboligenních iCMP [2,4,15]. V neselektovaném populačním vzorku se prevalence FiS uvádí v širokém rozmezí 1 – 6 % a exponenciálně narůstá s věkem [6 – 18]. Spolehlivé údaje o výskytu FiS u pacientů s iCMP však nejsou dosud k dispozici, zvláště pak u mladých pacientů. Hlavním důvodem je problematická detekce paroxyzmální formy FiS, neboť vyžaduje časově náročnou diagnostiku pomocí dlouhodobého EKG monitoringu. Ta bývá často podceňována, ačkoliv paroxyzmální FiS představuje stejné riziko recidivy iktu jako permanentní forma této arytmie [17,18].
Několik málo předchozích studií referuje záchyt FiS u cca 3 – 4 % mladých pacientů do 50 let v době přijetí pro akutní iCMP [10,11,19]. I když může použití standardního 24hod EKG ‑ Holteru zvýšit detekci arytmie [20], přesto je záchyt FiS stále považován za nízký v důsledku nedostatečné délky monitorace srdečního rytmu pro detekci paroxyzmální formy FiS [21]. Výsledky nedávno publikované studie EMBRACE (cardiac Event Monitor Belt for Recording Atrial fibrillation after a Cerebral ischemic Event) potvrzují nutnost dostatečné délky monitorace; při použití 30denního EKG ‑ Holteru došlo k záchytu paroxyzmální FiS u 16,1 % pacientů nad 55 let s kryptogenní iCMP [8].
Alternativu holterovského monitoringu představují implantabilní podkožní srdeční monitory, které umožňují dlouhodobé a velmi přesné kontinuální snímání srdečního rytmu po dobu několika měsíců až let. Použití těchto zařízení významně zvyšuje záchyt paroxyzmální FiS ve srovnání s konvenčním EKG ‑ Holter monitoringem [22 – 24].
I přes publikované pozitivní výsledky dosud nepanuje mezi odbornými společnostmi a autoritami jasný konsenzus v délce monitorace srdečního rytmu u pacientů s kryptogenní iCMP vč. mladých jedinců [25].
Cílem této prospektivní studie bylo stanovit výskyt srdečních arytmií u mladých pacientů s kryptogenním iktem do 50 let věku pomocí dlouhodobého EKG ‑ Holter monitoringu a podkožně implantovaného srdečního monitoru. Získané výsledky by mohly přispět k diskuzi o racionálním managementu holterovského EKG monitoringu v této populaci pacientů s kryptogenní iCMP.
Soubor a metodika
Prezentovaný soubor tvoří konsekutivní pacienti s akutní iCMP do 50 let zařazení do prospektivní studie HISTORY (Heart and Ischemic STrOke Relationship studY) registrované na ClinicalTrials.org (identifier NCT01541163) [26]. U všech pacientů byla mozková ischemie potvrzena na CT nebo MR. Protokol studie byl v souladu s Helsinskou deklarací z roku 1975 (revize 2004 a 2008), byl schválen etickou komisí naší nemocnice a všichni pacienti dali souhlas se zařazením. U všech zařazených pacientů byla získána základní epidemiologická a socioekonomická data a údaje o výskytu rizikových faktorů; od většiny pacientů ve formě vyplněného strukturovaného dotazníku. Neurologické postižení bylo kvantifikováno pomocí škály National Institutes of Health Stroke Scale (NIHSs). Všichni zařazení pacienti podstoupili následující diagnostický algoritmus: 1. vstupní standardní EKG, 2. série laboratorních odběrů, 3. ultrazvuk krčních a mozkových tepen, 4. jícnová echokardiografie (TEE) s podáním kontrastní látky pro provedení tzv. „bubble“ testu, 5. 24hod a třítýdenní EKG ‑ Holter monitoring.
Série laboratorních odběrů obsahovala tyto testy: 1. standardní biochemický panel, 2. standardní koagulační parametry a markery trombofílie vč. genetického skríningu; 3. sérové srdeční markery; N‑terminal probrain natriuretický peptid (NT ‑ proBNP) a ultra ‑ senzitivní Troponin T (hs TnT); 4. glykovaný hemoglobin a sérové lipidy.
Všechna vstupní EKG byla hodnocena zaslepenými kardiology. Čtyřiadvacetihodinový EKG ‑ Holter byl proveden na přístroji Philips ‑ Zymed DigiTrack plus/ DigiTrack XT (Philips, Nizozemí) a hodnocen zaslepenými kardiology. Třítýdenní EKG ‑ Holter byl realizován na přístroji MDT Vitaphone Loop 3100 BT (Vitaphone GmbH, Německo). Všechny záznamy z třítýdenního Loop Holteru byly zpracovány v externím centru a hodnoceny trénovanými a zaslepenými kardiology. Nález FiS byl definován jako přítomnost minimálně jedné epizody arytmie trvající alespoň 30 s a nesplňující kritéria pro jinou diagnózu [27,28].
Vybraným pacientům s negativním nálezem na 24hod a třítýdenním EKG ‑ Holteru, kteří byli léčeni IV trombolýzou nebo mechanickou trombektomií pro symptomatický uzávěr mozkové tepny a u kterých byl předpoklad emboligenní etiologie iktu, byl následně implantován v lokální anestezii podkožní srdeční monitor k dlouhodobému monitoringu.
Pro statistické analýzy byl použit SPSs software (verze 15.0; SPSs Chicago, USA). Všechny parametry s nenormálními distribucemi dat jsou uvedeny jako průměry se standardní odchylkou a mediány. Pro srovnání parametrických proměnných byl použit Fisherův test. Všechny testy byly provedeny na úrovni alfa významnosti < 0,05.
Výsledky
Z celkem 838 pacientů s akutní iCMP zařazených do studie HISTORY mělo 123 pacientů (71 mužů, průměrný věk 39,7 ± 8,4 let) méně než 50 let. V tab. 1 jsou uvedeny zjištěné příčiny iCMP. Kryptogenní iCMP byla určena dle TOAST kriterií u 102 (83 %) pacientů (56 mužů, průměrný věk 39 ± 8,5 let). Základní demografické a klinické charakteristiky pacientů jsou uvedeny v tab. 2. V tab. 3 jsou pak uvedeny vybrané laboratorní parametry a TEE nálezy.
Table 1. Zjištěné příčiny iCMP u pacientů do 50 let dle TOAST kritérií. 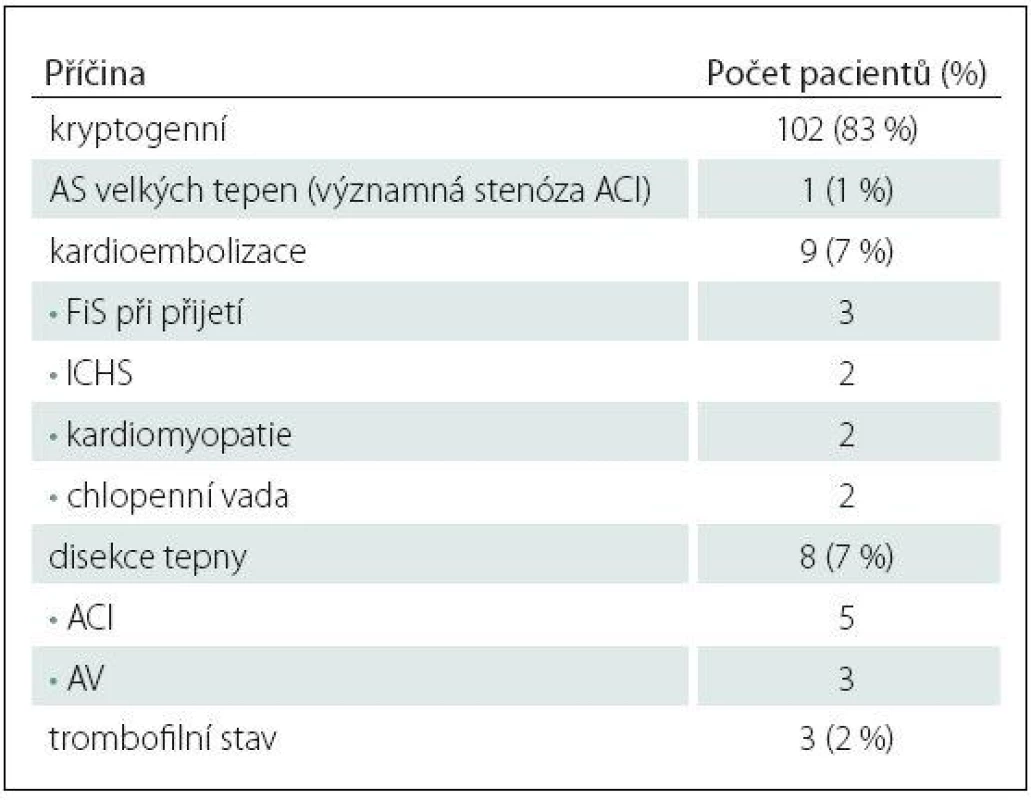
ACI – arteria carotis interna, AS – ateroskleróza, AV – arteria vertebralis, ICHS – ischemická choroba srdeční, FiS – fibrilace síní. Table 2. Základní demografické a klinické charakteristiky pacientů do 50 let s kryptogenní iCMP dle TOAST kritérií. 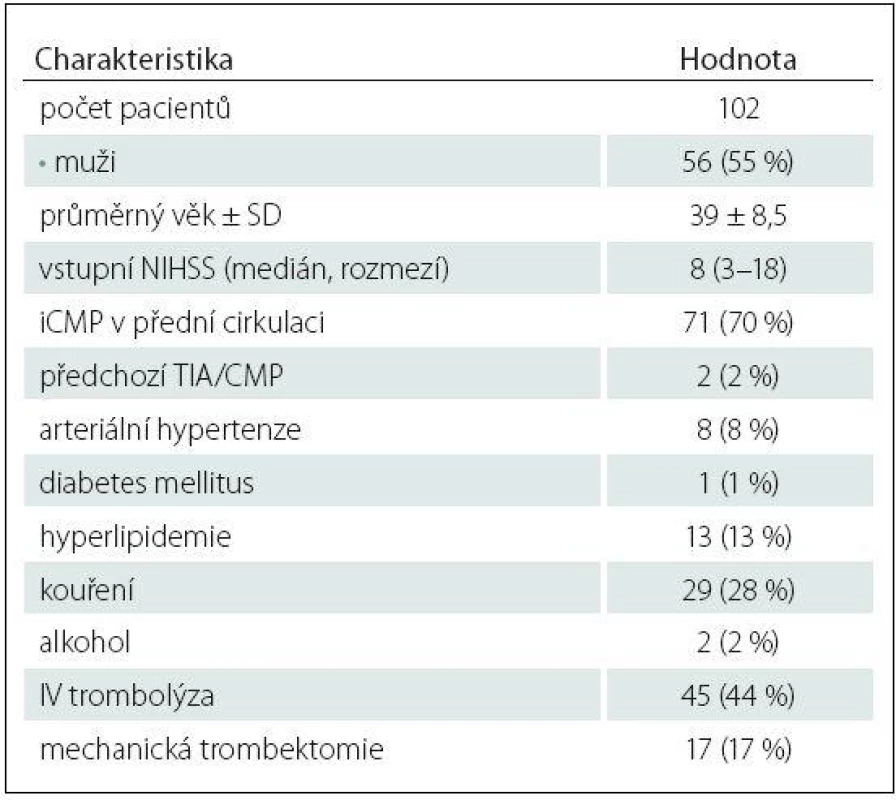
iCMP – ischemická cévní mozková příhoda, IV – intravenózní, NIHSS – National Institutes of Health Stroke Scale, SD – standardní odchylka, TIA – tranzitorní ischemická ataka. Table 3. Laboratorní parametry a TEE nálezy pacientů do 50 let s kryptogenní iCMP dle TOAST kritérií. 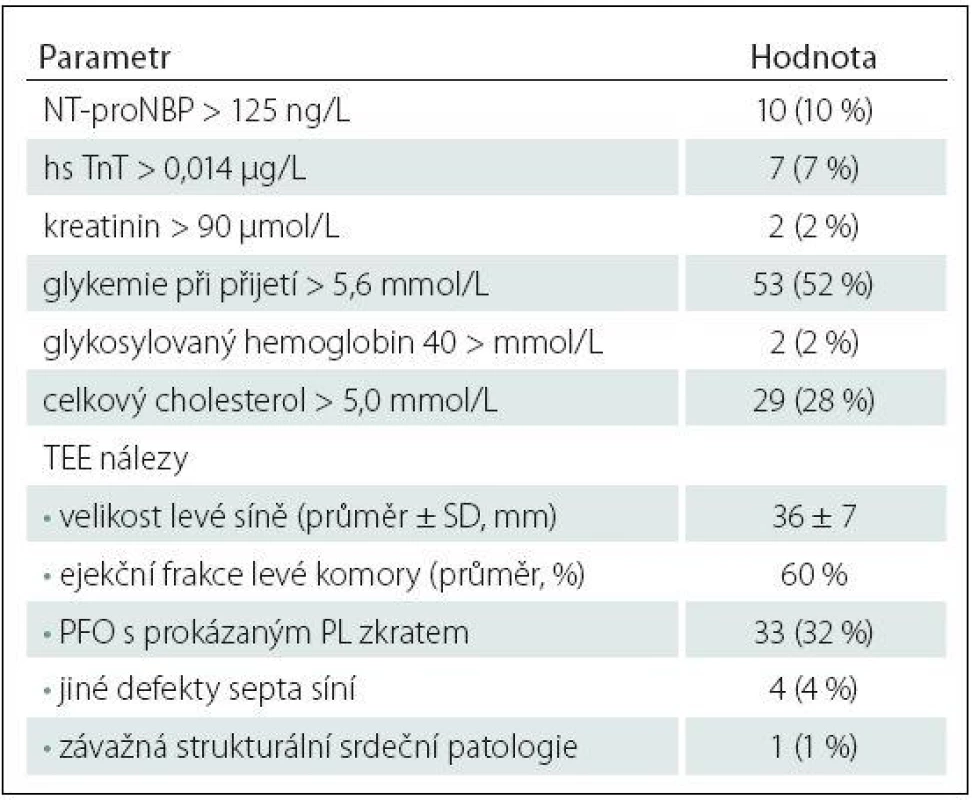
hs TnT – hypersenzitivní troponin T, NT-proNBP – N-terminální fragment mozkového natriuretického peptidu, PFO – patentní foramen ovale, PL – pravo-levý, TEE – transezofageální echokardiografie. 24hod EKG ‑ Holter byl zahájen průměrně 4,9 dne po přijetí a třítýdenní monitoring průměrně 39 dní po přijetí pacienta. Dlouhodobý Holter monitoring byl pacienty obecně dobře tolerován a proběhl bez významných technických potíží.
Srdeční arytmie byla zachycena během Holter monitoringu celkem u 12 (12 %) pacientů (devět mužů, průměrný věk 43 ± 4,2 let). V devíti (75 %) případech se jednalo o paroxyzmální FiS, ve zbývajících třech případech o nepravidelnou supraventrikulární arytmii, jejíž délka trvání nesplňovala časové kritérium diagnózy paroxyzmální FiS (tab. 4). U tří pacientů byla arytmie zaznamenána během 24hod EKG ‑ Holteru, přičemž ve dvou případech se jednalo o FiS. U zbývajících devíti pacientů byla arytmie zaznamenána během třítýdenního monitoringu; v sedmi případech se jednalo o FiS. Průměrný interval od zahájení třítýdenního monitoringu k první detekci arytmie byl 14,5 ± 4,2 dne.
Pacienti s detekovanou srdeční arytmií během Holter monitoringu měli častěji zvýšené vstupní hodnoty sérových kardiomarkerů oproti ostatním pacientům s kryptogenní iCMP: NT ‑ proBNP: 50 vs. 4 %; p = 0,0001; hs TnT: 42 vs. 2 %; p < 0,0001 (tab. 3, 4). Naopak nebyl mezi skupinami zjištěn významný rozdíl v přítomnosti patentního foramen ovale (PFO) s prokázaným pravo ‑ levým tokem při TEE (17 vs. 34 %; p = 0,328) a v dalších zjištěných strukturálních srdečních abnormitách (tab. 3, 4).
Table 4. Vybrané demografické, klinické, laboratorní parametry a TEE nálezy pacientů s detekovanou srdeční arytmií během EKG-Holter monitoringu. 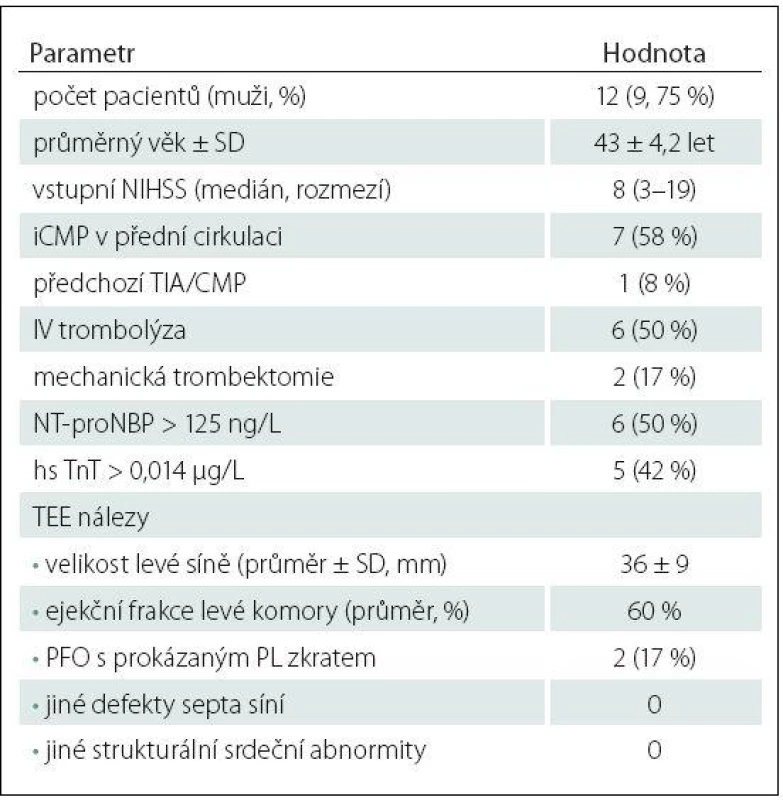
hs TnT – hypersenzitivní troponin T, IV – intravenózní, NT-proNBP – N-terminální fragment mozkového natriuretického peptidu, PFO – patentní foramen ovale, PL – pravo-levý, SD – standardní odchylka, TEE – transezofageální echokardiografie. Všem pacientům se zjištěnou paroxyzmální FiS byla následně v rámci sekundární prevence nastavena adekvátní antikoagulační terapie.
Vybraným 12 pacientům (osm mužů, průměrný věk 34,1 ± 8,4 let) s kryptogenní iCMP a negativním třítýdenním EKG ‑ Holterem byl implantován podkožní srdeční monitor; čtyřem pacientům přístroj BioMonitor (Biotronic™), dvěma pacientům Reveal XT (Medtronic™) a zbývajícím šesti pacientům Reveal LINQ (Medtronic™). Přístroj byl implantován průměrně 133 dní (medián 122 dní) od vzniku iktu. Základní demografické, klinické a laboratorní charakteristiky implantovaných pacientů jsou uvedeny v tab. 5. Ve sledovaném období nebyla u žádného z pacientů detekována klinicky významná arytmie, přičemž průměrná délka analyzované monitorace byla 440 dní (tab. 5). U žádného z pacientů nebyla zaznamenána komplikace v souvislosti s implantací monitoru a všichni pacienti podkožní monitor dobře tolerovali.
Table 5. Charakteristiky pacientů s implantovaným podkožním srdečním monitorem. 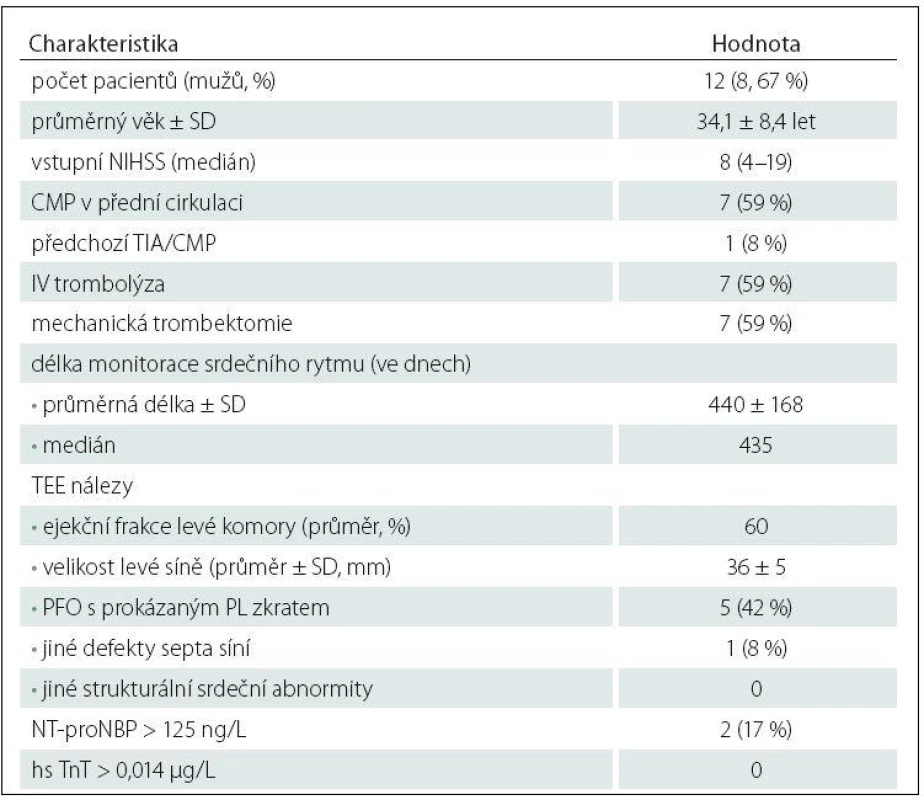
hs TnT – hypersenzitivní troponin T, NT-proNBP – N-terminální fragment mozkového natriuretického peptide, PFO – patentní foramen ovale, PL – pravo-levý, SD – standardní odchylka, TEE – transezofageální echokardiografie. Diskuze
V prezentované studii byla srdeční arytmie detekována během EKG ‑ Holter monitoringu celkem u 12 % mladých pacientů do 50 let s kryptogenním iktem. Vždy se jednalo o nepravidelnou supraventrikulární tachykardii, přičemž v 75 % případů byla určena jako paroxyzmální FiS. Ve zbylých případech byla zaznamenána krátká nepravidelná tachykardie, která však nesplňovala arbitrární časové kritérium trvání epizody arytmie 30 s nutné pro diagnózu FiS [27,28]. V minulosti provedené studie s TEE však prokázaly, že i kratší intervaly trvání FiS mohou generovat trombus, a měly by být proto považovány za klinicky relevantní [29,30].
Paroxyzmální FiS představuje stejné riziko pro vznik recidivy ischemického iktu jako permanentní forma [18], přičemž frekvence epizod arytmie v čase narůstá a FiS se může stát perzistentní [31]. V našem souboru byla paroxyzmální FiS zachycena celkem u 9 % pacientů, což je méně, než bylo referováno při použití sedmidenního EKG ‑ Holteru (12 – 13 %) [5,6]. Tento rozdíl si vysvětlujeme podstatně mladší populací v našem souboru (< 50 let) při známé věkové závislostí výskytu FiS [6]. U mladých pacientů s iCMP použití 24hod EKG ‑ Holteru a jeho prodloužení až na sedmidenní monitoring nezvýšilo obecně nízký záchyt FiS do 5 % [5,6,32,33]. V naší studii však prodloužení Holter monitoringu na tři týdny vedlo k více než dvojnásobnému zvýšení záchytu FiS oproti 24hod Holteru. Nedávno publikované výsledky randomizované studie EMBRACE (cardiac Event Monitor Belt for Recording Atrial fibrillation after a Cerebral ischemic Event), ve které byl použit 30denní Holter monitoring, prokázaly významně vyšší záchyt paroxyzmální FiS oproti standardnímu 24hod monitoringu: 16,1 vs. 3,2 % .[8]. Populace pacientů s kryptogenní iCMP zařazených do této studie však byla významně starší (≥ 55 let) ve srovnání s naším souborem.
Slibnou alternativu klasického Holter monitoringu představují implantabilní srdeční monitory nebo záznamníky, které umožňují kontinuální a přesnější detekci případných arytmií. Na rozdíl od tzv. smyčkových „loop“ rekordérů (obvykle používaných při dlouhodobém Holter monitoringu) jsou tyto implantabilní srdeční monitory schopny krom pacientem aktivovaných epizod zaznamenat také předem definované epizody poruch srdečního rytmu nebo automaticky všechny epizody [29,30]. Výsledkem randomizované studie CRYSTAL AF (Cryptogenic Stroke and Underlying AF) byl záchyt FiS pouze u 8,9 % pacientů nad 40 let po šestiměsíčním monitoringu pomocí monitoru Reveal XT (Medtronic™) [23]. Jedním z důvodů menšího záchytu FiS by mohl být nižší průměrný věk pacientů oproti studii EMBRACE. Vyšší záchyt paroxyzmální FiS u pacientů s kryptogenní iCMP pomocí insertabilního monitoru (Reveal LINQ) v reálné praxi ukázaly výsledky nedávno publikované observační studie s více než tisícem pacientů [24]. Paroxyzmální FiS byla detekována u 11,8 % pacientů ve sledovaném období 182 dní, což je relativní nárůst o 37 % oproti studii CRYSTAL AF. Zachycené epizody arytmie trvaly nejčastěji 2 – 6 min a nejvíce pacientů mělo nejdelší epizodu v intervalu 1 – 6 hod. V našem souboru implantovaných pacientů však nebyla ve sledovaném období detekována žádná arytmie. Tuto skutečnost si vysvětlujeme zejména malým počtem implantovaných pacientů a vlivem předchozí selekce pacientů s negativním třítýdenním EKG ‑ Holterem. Dalším faktorem mohl být podstatně nižší věk našich pacientů ve srovnání se studií CRYSTAL AF a výše zmiňovanou observační studií Zieglera et al [24].
I přes stále chybějící konsenzus v délce monitorace srdečního rytmu u pacientů s kryptogenní iCMP [25] se již v současnosti doporučuje až 30denní Holter monitorace srdečního rytmu [34]. Nicméně významný počet pacientů má zachycenu paroxyzmální FiS až po 30 dnech, a to při použití podkožního srdečního monitoru [23,34 – 36].
Zjištěné zvýšené sérové hodnoty specifických srdečních kardiomarkerů u pacientů s FiS v našem souboru korespondují s předchozím průkazem asociace elevace hs TnT a NT ‑ proBNP a přítomnosti FiS. Navíc, NT-proBNP je obecně považován za silný prediktor výskytu této arytmie, zejména u mladších pacientů [37,38]. Dle našeho názoru tak může stanovení sérových hodnot Tn TnT a NT ‑ proBNP pomoci lépe identifikovat pacienty s akutní iCMP a dosud nezjištěnou FiS, u kterých by mělo smysl vyvinout větší diagnostické úsilí pro detekci/ vyloučení paroxyzmální FiS. To představuje zejména dostatečně dlouhý EKG ‑ Holter monitoring nebo implantaci srdečního monitoru.
Pacienti se zjištěnou FiS v našem souboru neměli významně častěji zjištěny srdeční abnormity na TEE oproti ostatním pacientům s kryptogenní iCMP (tab. 3, 4). Prefasi et al referovali o přítomnosti organického postižení srdce až u 71 % mladých pacientů po iktu se zjištěnou FiS [20]. V našem souboru ale neměl žádný pacient s FiS zjištěno organické postižení srdce. Tento rozdíl si vysvětlujeme tím, že v našem souboru se jednalo pouze o paroxyzmální arytmie a pravděpodobně i s krátkou historií trvání.
Relativně malý počet pacientů v prezentovaném souboru představuje určitou limitaci naší studie, nicméně ischemické ikty v mladé populaci nejsou tak časté a proto byl nábor do studie limitován. Interval od vzniku iktu k provedení třítýdenního EKG ‑ Holteru byl relativně delší, což souviselo s aktuální dostupností přístroje. K monitoraci byl použit tzv. smyčkový „loop“ rekordér s omezenou schopností detekce arytmií. Nemůžeme tedy vyloučit možnost vyššího záchytu arytmií v případě analýzy záznamů z bedside monitoringu při pobytu pacientů na JIP, při použití kontinuální telemetrie nebo implantabilního srdečního monitoru u všech pacientů.
Závěrem lze konstatovat, že paroxyzmální poruchy srdečního rytmu (FiS) mohou být příčinou kryptogenní iCMP i u mladých pacientů. Dlouhodobý EKG ‑ Holter monitoring může významně zvýšit úspěšnost záchytu arytmií. Stanovení sérových hodnot srdečních kardiomarkerů a morfologické vyšetření srdce může pomoci lépe identifikovat rizikové pacienty.
Práce byla podpořena grantem Interní grantové agentury MZ ČR, č. NT14288-3/2013.
Autoři deklarují, že v souvislosti s předmětem studie nemají žádné komerční zájmy.
Redakční rada potvrzuje, že rukopis práce splnil ICMJE kritéria pro publikace zasílané do biomedicínských časopisů.
Přijato k recenzi: 12. 10. 2015
Přijato do tisku: 3. 11. 2015
doc. MUDr. Daniel Šaňák, Ph.D., FESO
Neurologická klinika
LF UP a FN Olomouc
I. P. Pavlova 6
775 20 Olomouc
e-mail: daniel.sanak@fnol.cz
Sources
1. Grau AJ, Weimar C, Buggle F, Al ‑ Khalaf A, Werle E, Valois N et al. Risk factors, outcome, and treatment in subtypes of ischemic stroke: the German stroke data bank. Stroke 2001; 32(11): 2559 – 2566.
2. Kolominsky ‑ Rabas PL, Weber M, Gefeller O, Neundoerfer B, Heuschmann PU. Epidemiology of ischemic stroke subtypes according to TOAST criteria: incidence, recurrence, and long‑term survival in ischemic stroke subtypes: a population‑based study. Stroke 2001; 32(12): 2735 – 2740.
3. Wohlfahrt J, Stahrenberg R, Weber ‑ Krüger M, Gröschel S, Wasser K, Edelmann F et al. Clinical predictors to identify paroxysmal atrial fibrillation after ischaemic stroke. Eur J Neurol 2014; 21(1): 21 – 27. doi: 10.1111/ ene.12198.
4. Go AS, Mozzaffarian D, Roger VL, Benjamin EJ, Berry JD, Dai S et al. Heart disease and stroke statistics – 2014 update: a report from the American Heart Association. Circulation 2014; 129(3): e28 – e292. doi: 10.1161/ 01.cir.0000441139.02102.80.
5. Stahrenberg R, Weber ‑ Krüger M, Seegers J, Edelmann F, Lahno R, Haase B et al. Enhanced detection of paroxysmal atrial fibrillation by early and prolonged continuous Holter monitoring in patients with cerebral ischemia presenting in sinus rhythm. Stroke 2010; 41(12): 2884 – 2888. doi: 10.1161/ STROKEAHA.110.591958.
6. Wachter R, Weber ‑ Krüger M, Seegers J, Edelmann F, Wohlfahrt J, Wasser K et al. Age ‑ dependent yield of screening for undetected atrial fibrillation in stroke patients: the Find ‑ AF study. J Neurol 2013; 260(8): 2042 – 2045. doi: 10.1007/ s00415 ‑ 013 ‑ 6935 ‑ x.
7. Hart RG, Diener HC, Connolly SJ. Embolic strokes of undetermined source: support for a new clinical construct – authors‘ reply. Lancet Neurol 2014; 13(10): 967. doi: 10.1016/ S1474 ‑ 4422(14)70196 ‑ 6.
8. Gladstone DJ, Spring M, Dorian P, Panzov V, Thorpe KE, Math M et al. Atrial fibrillation in patients with cryptogenic stroke. N Engl J Med 2014; 370(26): 2467 – 2477. doi: 10.1056/ NEJMoa1311376.
9. Cerrato P, Grasso M, Imperiale D, Priano L, Baima C, Giraudo M et al. Stroke in young patients: etiopathogenesis and risk factors in different age classes. Cerebrovasc Dis 2004; 18(2): 154 – 159.
10. Putaala J, Metso AJ, Metso TM, Konkola N, Kraemer Y. Analysis of 1,008 consecutive patients aged 15 to 49 with first ‑ ever ischemic stroke: the Helsinki young stroke registry. Stroke 2009; 40(4): 1195 – 1203. doi: 10.1161/ STROKEAHA.108.529883.
11. Putaala J, Haapaniemi E, Metso AJ, Metso TM, Artto V, Kaste M et al. Recurrent ischemic events in young adults after first ‑ ever ischemic stroke. Ann Neurol 2010; 68(5): 661 – 671. doi: 10.1002/ ana.22091.
12. Ferro JM, Massaro AR, Mas JL. Aetiological diagnosis of ischaemic stroke in young adults. Lancet Neurol 2010; 9(11): 1085 – 1096. doi: 10.1016/ S1474 ‑ 4422(10)70251 ‑ 9.
13. Varona JF, Guerra JM, Bermejo F, Molina JA, Gomez de la Camara A. Causes of ischemic stroke in young adults, and evolution of the etiological diagnosis over the long term. Eur Neurol 2007; 57(4): 212 – 218.
14. Seet RC, Friedman PA, Rabinstein AA. Prolonged rhythm monitoring for the detection of occult paroxysmal atrial fibrillation in ischemic stroke of unknown cause. Circulation 2011; 124(4): 477 – 486. doi: 10.1161/ CIRCULATIONAHA.111.029801.
15. Wolf PA. Awareness of the role of atrial fibrillation as a cause of ischemic stroke. Stroke 2014; 45(2): e19 – e21. doi: 10.1161/ STROKEAHA.113.003282.
16. Gattellari M, Goumas C, Aitken R, Worthington JM. Outcomes for patients with ischaemic stroke and atrial fibrillation: the PRISM study (a Program of Research Informing Stroke Management). Cerebrovasc Dis 2011; 32(4): 370 – 382. doi: 10.1159/ 000330637.
17. Potpara TS, Lip GY. Ischemic stroke and atrial fibrillation – a deadly serious combination. Cerebrovasc Dis 2011; 32(5): 461 – 462. doi: 10.1159/ 000332030.
18. Hart RG, Pearce LA, Rothbart RM, McAnulty JH, Asinger RW, Halperin JL. Stroke with intermittent atrial fibrillation: incidence and predictors during aspirin therapy. Stroke Prevention in Atrial Fibrillation Investigators. J Am Coll Cardiol 2000; 35(1): 183 – 187.
19. Chatzikonstantinou A, Wolf ME, Hennerici MG. Ischemic stroke in young adults: classification and risk factors. J Neurol 2012; 259(4): 653 – 659. doi: 10.1007/ s00415 ‑ 011 ‑ 6234 ‑ 3.
20. Prefasi D, Martinez ‑ Sanchez P, Rodrıguez ‑ Sanz A, Fuentes B, Filgueiras ‑ Rama D, Ruiz ‑ Ares G et al. Atrial fibrillation in young stroke patients: do we underestimate its prevalence? Eur J Neurol 2013; 20(10): 1367 – 1374. doi: 10.1111/ ene.12187.
21. Fonseca AC, Ferro JM. Cryptogenic stroke. Eur J Neurol 2015; 22(4): 618 – 623. doi: 10.1111/ ene.12673.
22. Winkler S, Axmann C, Schannor B, Kim S, Leuthold T, Scherf M et al. Diagnostic accuracy of a new detection algorithm for atrial fibrillation in cardiac telemonitoring with portable electrocardiogram devices. J Electrocardiol 2011; 44(4): 460 – 464. doi: 10.1016/ j.jelectrocard.2011.01.011.
23. Sanna T, Diener HC, Passman RS, Di Lazzaro V, Bernstein RA, Morillo CA et al. Cryptogenic stroke and underlying atrial fibrillation. N Engl J Med 2014; 370(26): 2478 – 2486. doi: 10.1056/ NEJMoa1313600.
24. Ziegler PD, Rogers JD, Ferreira SW, Nichols AJ, Sarkar S, Koehler JL et al. Real ‑ world experience with insertable cardiac monitors to find atrial fibrillation in cryptogenic stroke. Cerebrovasc Dis 2015; 40(3 – 4): 175 – 181. doi: 10.1159/ 000439063.
25. Favilla CG, Ingala E, Jara J, Fessler E, Cucchiara B, Messé SR et al. Predictors of finding occult atrial fibrillation after cryptogenic stroke. Stroke 2015; 46(5): 1210 – 1215. doi: 10.1161/ STROKEAHA.114.007763.
26. Kral M, Skoloudik D, Sanak D, Veverka T, Bartkova A, Dornak T et al. Assessment of relationship between acute ischemic stroke and heart disease – protocol of a prospective observational trial. Biomed Pap Med Fac Univ Palacky Olomouc Czech Repub 2012; 156(3): 284 – 289. doi: 10.5507/ bp.2012.094.
27. Fuster V, Ryden LE, Cannom DS, Crijns HJ, Curtis AB, Ellenbogen KA et al. ACC/ AHA/ ESC 2006 guidelines for the management of patients with atrial fibrillation: a report of the American College of Cardiology/ American Heart Association Task Force on Practice Guidelines and the European Society of Cardiology Committee for Practice Guidelines (writing committee to revise the 2001 guidelines for the management of patients with atrial fibrillation): developed in collaboration with the European Heart Rhythm Association and the Heart Rhythm Society. Circulation 2006; 114(7): e257 – e354.
28. Kirchhof P, Auricchio A, Bax J, Crijns H, Camm J, Diener HC et al. Outcome parameters for trials in atrial fibrillation: recommendations from a consensus conference organized by the German Atrial Fibrillation Competence Network and the European Heart Rhythm Association. Europace 2007; 9(11): 1006 – 1023.
29. Stoddard MF, Dawkins PR, Prince CR, Ammash NM. Left atrial appendage thrombus is not uncommon in patients with acute atrial fibrillation and a recent embolic event: a transesophageal echocardiographic study. J Am Coll Cardiol 1995; 25(2): 452 – 459.
30. Manning WJ, Silverman DI, Waksmonski CA, Oettgen P, Douglas PS. Prevalence of residual left atrial thrombi among patients with acute thromboembolism and newly recognized atrial fibrillation. Arch Intern Med 1995; 155(20): 2193 – 2198.
31. Kerr CR, Humphries KH, Talajic M, Klein GJ, Connolly SJ, Green M et al. Progression to chronic atrial fibrillation after the initial diagnosis of paroxysmal atrial fibrillation: result from the Canadian Registry of Atrial Fibrillation. Am Heart J 2005; 149(3): 489 – 496.
32. Rizos T, Güntner J, Jenetzky E, Marquardt L, Reichardt C, Becker R et al. Continuous stroke unit electrocardiographic monitoring versus 24 - hour Holter electrocardiography for detection of paroxysmal atrial fibrillation after stroke. Stroke 2012; 43(10): 2689 – 2694.
33. Grond M, Jauss M, Hamann G, Stark E, Veltkamp R, Nabavi D et al. Improved detection of silent atrial fibrillation using 72 - hour Holter ECG in patients with ischemic stroke: a prospective multicenter cohort study. Stroke 2013; 44(12): 3357 – 3364. doi: 10.1161/ STROKEAHA.113.001884.
34. Kernan WN, Ovbiagele B, Black HR, Bravata DM, Chimowitz MI, Ezekowitz MD et al. Guidelines for the prevention of stroke in patients with stroke and transient ischemic attack: a guideline for healthcare professionals from the American Heart Association/ American Stroke Association. Stroke 2014; 45(7): 2160 – 2236. doi: 10.1161/ STR.0000000000000024.
35. Ritter MA, Kochhäuser S, Duning T, Reinke F, Pott C, Dechering DG et al. Occlut atrial fibrillation in cryptogenic stroke: detection by 7 - day electrocardiogram versus implantable cardiac monitors. Stroke 2013; 44(5): 1449 – 1452. doi: 10.1161/ STROKEAHA.111.676189.
36. Cotter PE, Martin PJ, Ring L, Warburton EA, Belham M, Pugh PJ. Incidence of atrial fibrillation detected by implantable loop recorders in unexplained stroke. Neurology 2013; 80(17): 1546 – 1550. doi: 10.1212/ WNL.0b013e31828f1828.
37. Anegawa T, Kai H, Adachi H, Hirai Y, Enomoto M, Fukami A et al. High‑sensitive troponin T is associated with atrial fibrillation in a general population. Int J Cardiol 2012; 156(1): 98 – 100. doi: 10.1016/ j.ijcard.2011.12.117.
38. Patton KK, Heckbert SR, Alonso A, Bahrami H, Lima JA, Burke G et al. N‑terminal pro‑B‑type natriuretic peptide as a predictor of incident atrial fibrillation in the Multi‑Ethnic Study of Atherosclerosis: the effects of age, sex and ethnicity. Heart 2013; 99(24): 1832 – 1836. doi: 10.1136/heartjnl ‑ 2013 ‑ 304724.
Labels
Paediatric neurology Neurosurgery Neurology
Article was published inCzech and Slovak Neurology and Neurosurgery

2015 Issue 6-
All articles in this issue
- Nádory očnice
- Překrývání neurodegenerativních demencí
- Současný pohled na imunopatogenezi myasthenia gravis
- Roztroušená skleróza, neplodnost a její léčba
- Delirium u kriticky nemocných – prospektivní studie
- Poruchy srdečního rytmu u mladých pacientů s kryptogenní ischemickou cévní mozkovou příhodou
- Novinky ze světa NOAK – „Dienerovo pravidlo 1- 3- 6- 12“ a první antidotum s potvrzeným účinkem
- Mobilita medianu před dekompresí karpálního tunelu a po ní
- Měření úrovně emočního uvědomění – pilotní studie ověřující základní psychometrické vlastnosti české verze Škály úrovně emočního uvědomění LEAS
- Psychometrické vlastnosti české verze Epworthské škály spavosti
- Naše zkušenosti s chirurgickou léčbou tumorů periferních nervů
- Kraniocervikální pneumatizace provázená neurologickou symptomatikou – kazuistika
- Familiární amyloidová polyneuropatie – kazuistika
- Časná rotace intratékální baklofenové pumpy – kazuistika
- Czech and Slovak Neurology and Neurosurgery
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Nádory očnice
- Novinky ze světa NOAK – „Dienerovo pravidlo 1- 3- 6- 12“ a první antidotum s potvrzeným účinkem
- Psychometrické vlastnosti české verze Epworthské škály spavosti
- Familiární amyloidová polyneuropatie – kazuistika
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

