-
Medical journals
- Career
Vztah atrofie amygdaly a dalších vybraných mozkových struktur k emocionální agnozii u Alzheimerovy nemoci
Authors: K. Bechyně 1,5; A. Varjassyová 1; D. Lodinská 1; M. Vyhnálek 1; M. Bojar 1; J. Brabec 2; P. Petrovický 2; Z. Seidl 4; I. Schenk 5; J. Hort 1
Authors‘ workplace: Neurologická klinika 2. LF UK a FN v Motole, Praha 1; Anatomický ústav 1. LF UK v Praze 2; Neurochirurgická klinika ÚVN Praha 3; Radiodiagnostická klinika 1. LF UK a VFN v Praze 4; Neurologické oddělení Nemocnice Písek 5
Published in: Cesk Slov Neurol N 2008; 71/104(6): 675-681
Category: Original Paper
Poděkování: Rádi bychom poděkovali pacientům a jejich rodinám za jejich čas a spolupráci. Tento projekt byl podpořen grantem GAČR 309/05/0693 a IGA MZ ČR 2006, NR 8931-4.
Overview
Úvod:
Amygdala a další struktury limbického systému jsou odpovědné za analýzu signálů s emocionálním nábojem. Postižení limbického systému neurodegenerativním procesem může vést ke změně emocionálního vnímání nebo až k emoční agnozii. Předkládaná práce hodnotí vztah mezi in vivo naměřenými objemy amygdaly, hippocampu, předního cingulárního kortexu, pólu temporálního laloku a emocionální agnozií u pacientů s Alzheimerovou nemocí v porovnání s kontrolní populací.Materiál a metodika:
26 pacientů s Alzheimerovou nemocí a 17 členů kontrolní skupiny absolvovalo vyšetření magnetickou rezonancí a neuropsychologické vyšetření včetně testu rozpoznávání emocí podle výrazu obličeje. Metodou MR volumetrie byly změřeny objemy amygdaly, hippocampu, předního cingulárního kortexu a pólu temporálního laloku.Výsledky:
Všechny naměřené regionální objemy a výsledky neuropsychologických testů byly u pacientů s AN signifikantně horší oproti kontrolní skupině. Při srovnání regionálních objemů a výsledku testu rozeznávání emocí signifikantně korelovaly: objem levé amygdaly a schopnost rozpoznávat radost (r = 0,54, p < 0,01) a smutek (r = 0,49, p < 0,05), objem pravé amygdaly se schopností rozpoznávat strach (r = 0,34, p < 0,05) a smutek (r = 0,56, p < 0,01), objem obou hippocampů se schopností rozpoznávat hněv (r = 0,55 pravý a r = 0,58 levý, p < 0,01).Závěr:
Zjištěný vztah mezi sníženým objemem amygdaly a sníženou schopností rozeznávat některé emoce u pacientů s AN podporuje hypotézu, že emocionální agnozie u AN je podmíněna atrofií amygdaly a dalších struktur limbického systému.Klíčová slova:
Alzheimerova nemoc – emoční agnozie – amygdala – MR volumetrieÚvod
Amygdala je klíčovou strukturou pro zpracovávání informací s emočním obsahem jak při samostatných stimulech, tak i v komplexních situacích [1,2]. Bylo zjištěno, že lidská amygdala je nezbytná pro správné vnímání sociálních vazeb a chování osob podle výrazu jejich tváře. Při analýze aktuálního emočního výrazu obličeje dochází ke konfrontaci s informacemi uloženými v paměti. Amygdala v tomto procesu zřejmě hraje úlohu prostředníka [3].
Pacienti s oboustrannou lézí amygdaly, např. při vzácné Urbach-Wietheho chorobě, mají při hodnocení emocí z výrazu obličeje chybný úsudek [4]. Snížená schopnost rozpoznávání emocí z výrazu tváře při poškození amygdaly se váže zejména na averzivní stimuly, jako je strach nebo hněv. Role amygdaly při zpracovávání emocionálních podnětů byla prokázána též pomocí funkčních zobrazovacích metod [5,6] a MR volumetrie [7].
Na analýze emocí participují i další limbické struktury, jako je přední cingulární kortex a pól temporálního laloku [8,9]. Vztah mezi poruchou emocionálního systému, včetně snížené schopnosti analýzy emocí, a atrofií limbického systému byl již dříve popsán. Hesslinger et al popisují signifikantní korelaci úbytku objemu hippocampu, amygdaly a pravého předního cingulárního kortexu u pacientů s hraniční poruchou osobnosti a poruchou emocionality [10]. Další důkaz o vztahu emocionální agnozie a atrofie limbického systému přinášejí ve své práci Rosen a Keanová, zkoumající skupinu pacientů s frontální variantou frontotemporální demence [11,12]. Olson et al shrnují dosavadní zkušenosti s výzkumem rozpoznávání a analýzy emocí v přehledu prací vztahujících se k pólu temporálního laloku [13]. Temporální lalok je paralimbická struktura, která má podobně jako amygdala [14] též četná spojení se senzorickými systémy. Spojuje tak komplexní senzorické vjemy s emocionální odpovědí, sociální a sémantickou pamětí [13].
Mediotemporální struktury včetně amygdaly a pólu temporálního laloku jsou postiženy již v časné fázi AN. Do klinického obrazu AN patří i narušení emocionálního vnímání a z něj plynoucí změny chování [15].
Při atroficko‑degenerativní demenci se redukuje objem mozkové tkáně, především šedé hmoty. Tyto objemové změny se dají kvantifikovat pomocí MR volumetrie in vivo [16]. Porovnáním in vivo měřených objemů s výsledky neuropsychologických testů lze získat informace o vztahu měřených mozkových struktur k jejich funkci [17].
Bylo zjištěno, že atrofie amygdaly koreluje s deficitem dlouhodobé emocionální paměti u pacientů s AN [18]. U pacientů s AN byla též nalezena snížená schopnost rozpoznávat význam emoce z výrazu tváře [19]. Emocionální agnozie může být příčinou některých dalších abnormalit v chování pacientů s AN, jako je např. obsesivní a kompulzivní porucha (OCD), emocionální oploštění, ztráta soucitu a empatie. Poškození emocionálního vnímání může způsobit změny v sociálním chování, které je rozpoznáváním emocí částečně podmíněno. Z hlediska patofyziologie vzniku OCD se uvažuje o frontálním laloku a hippocampo-amygdalárním komplexu. Například Szeszko et al nalezli signifikantní snížení objemů amygdaly, frontálního kortexu u pacientů trpících OCD [20].
Vztahu emocionální agnozie a atrofie limbických a paralimbických struktur u pacientů s AN nebyla doposud v písemnictví věnována příliš velká pozornost. Pokud je nám známo, existuje jen jediná práce zabývající se obdobnou symptomatologií, a to u pacientů s frontotemporální demencí [11]. Naším cílem bylo zjistit, zda existuje vztah mezi emoční agnozií a atrofií amygdaly, předního cingulárního kortexu, hippocampu a pólu temporálního laloku u pacientů s AN.
Soubor a metodika
Vyšetřované osoby
Do studie bylo zařazeno 23 pacientů (13 mužů, 10 žen; věk 67,3 ± 7,9), ambulantně navštěvujících Poradnu pro poruchy paměti při Neurologické klinice 2. LF UK a FN v Motole, kteří splnili kritéria pravděpodobné AN podle NINDCS-ADRDA (National Institute of Neurological and Communicative Disorders and Stroke and the Alzheimer‘s Disease and Related Disorders Association) [21] a podepsali informovaný souhlas schválený etickou komisí FN v Motole. Do studie byli zařazeni pouze pacienti, kteří dosáhli v Mini Mental-State Examination (MMSE) testu 15 a více bodů. Kontrolní skupina se skládala z rodinných příslušníků pacientů nebo příbuzných ošetřujícího personálu. U 17 členů kontrolní skupiny (10 mužů, 7 žen; věk 65,4 ± 5,4) nebyla anamnesticky zaznamenána neurologická či psychiatrická onemocnění. Tyto osoby neměly významné známky ischemie na MR a jejich skóre na Hachinského škále bylo méně než 4. Mezi vyšetřovanou a kontrolní skupinou nebyly nalezeny statisticky významné rozdíly věku, pohlaví, ani dosaženého vzdělání (Mann Whitney, chí-kvadrát test).
Pacienti a členové kontrolní skupiny nejprve podstoupili vyšetření neurologické a neuropsychologické a následně vyšetření MR mozku.
MR volumetrie
MR vyšetření mozku bylo prováděno standardní hlavovou cívkou s magnetickým polem 1.5 T (Intera Philips, Best, Nizozemí, 2004). Byla pořízena sekvence 175 kontinuálních koronárních milimetrových řezů (TR 25, TE 5, flip angle, FOV 256, image matrix 256 × 204). Oblasti měření (Region Of Interest, ROI) byly zakresleny ručně pomocí kurzoru myši (přední cingulární kortex, hippocampus, amygdala). Pól temporálního laloku byl zakreslen automaticky softwarem [22].
Zobrazení byla před měřením vždy vycentrována ve třech základních rovinách pro korekci odlišného postavení hlavy jednotlivých vyšetřovaných při pořízení MR snímku. Koronární a horizontální řezy byly orientované podle fissura longitudinalis cerebri, sagitální řezy podle spojnice commisura anterior a commisura posterior. Pro korekci individuálních rozdílů velikostí mozkových struktur byly jednotlivé výsledky měření vztaženy k intrakraniálnímu objemu (ICV). Referenční hodnota pro intrakraniální objem byla určena ručním obkreslením okraje dura mater na úrovni prvního rostrálního řezu commissura anterior [23]. Střední čas mezi datem MR vyšetření a datem klinického vyšetření byl 0,24 měsíce pro pacienty s AN a 4,3 měsíce pro kontrolní skupinu.
Anatomické hranice
Definování anatomického ohraničení jednotlivých struktur vycházelo z rozličných zdrojů zahrnujících histologické řezy autorů (JB, PP) a neuroanatomické atlasy. Celý proces měření již byl detailně popsán dříve [24,25].
Měření objemu amygdaly odpovídá konceptu klasické amygdaly zahrnující v sobě jádra a oblasti, které jsou k ní v běžné anatomické literatuře započítávány. Přední pól amygdaly je přibližně 7 mm kaudálně od frontotemporální junkce (limen insulae) [26]. Nejprve jsme opatřili značkami přední hranici amygdaly v sagitální a transverzální rovině. Tyto značky pak byly (softwarem) převedeny do roviny koronárního pohledu. Podobným postupem jsme amygdalu ohraničili vůči hippocampu na její ventrokaudální hranici. Jakmile byla definována přední hranice amygdaly a její kaudální odlišení, pokračovali jsme v obkreslování tvaru amygdaly na jednotlivých koronárních řezech rostrokaudálně. Během celého procesu zakreslování všech ROI byly pozice kurzoru kontrolovány na projekcích ve všech třech ortogonálních rovinách (obr. 1).
Image 1. Manuální ohraničení amygdaly v koronárních řezech u pacienta s AN. 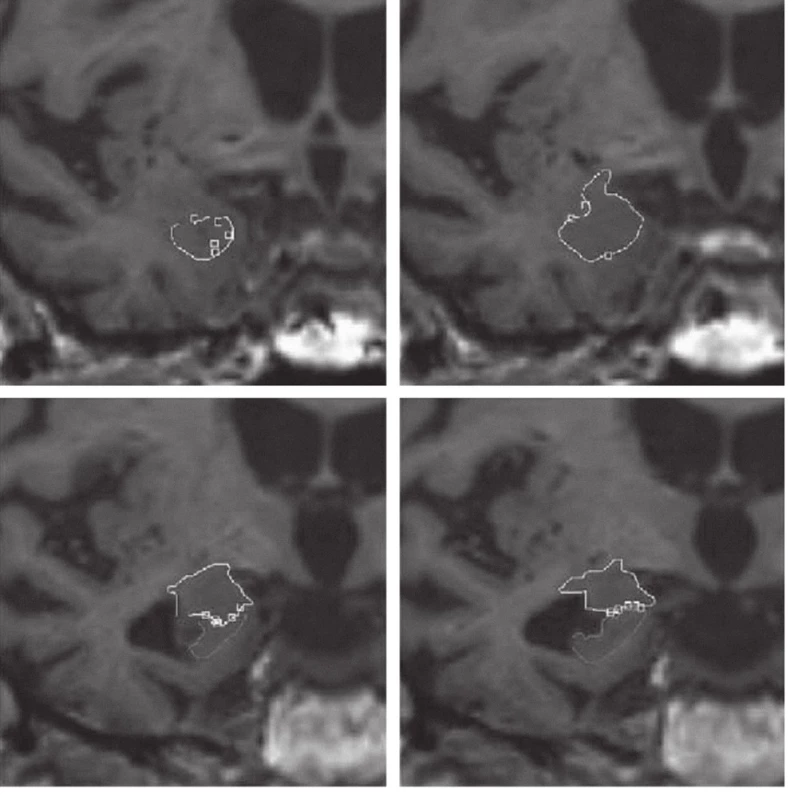
Do objemu hippocampu bylo zahrnuto Cornu Ammonis 1–3, subiculum a gyrus dentatus. Kaudální část hippocampu a fornix byly z měření vyloučeny.
Pól temporálního laloku byl jako jediná struktura měřen automaticky. Hranice mezi mozkovým parenchymem a likvorem byla generována softwarem Scanview na podkladě rozdílu intenzit signálu [22]. Kaudální hranicí pro měření byl první rostrální řez frontotemporální junkce.
Přední cingulární kortex byl definován pomocí horního a dolního cingulárního sulku. Za jeho kaudální hranici byl považován první rostrální řez, na kterém bylo možné definovat cavum septi pellucidi, přední hranici jsme určili ze sagitální projekce pomocí bodů, podobně jak bylo popsáno u amygdaly. Při měření bylo využito všech tří ortogonálních projekcí.
Variabilita měření
Všechna volumetrická vyšetření byla zpracována dvěma členy týmu (KB a AV), školenými ve volumetrické technice, a slepě ke klinickým datům. 10 subjektů bylo měřeno opakovaně pro stanovení spolehlivosti měření. Intraindividuální koeficienty spolehlivosti (průměr absolutní hodnoty rozdílu mezi dvěma měřeními dělený jejich průměrem) byly pro měření intrakraniálního objemu 0,99, pro nekorigovaný objem amygdaly 0,92, pro nekorigovaný objem hippocampu 0,94 a pro nekorigovaný objem předního cingulárního kortexu 0,81.
Neuropsychologické testy
Neuropsychologické vyšetření zahrnovalo Mini Mental-State Examination (MMSE) [27], deklarativní paměť byla testována modifikovanou verzí Grober-Buschkeova testu [28], k testování vizuální paměti byl použit Bentonův test [29].
Součástí baterie byl dále test identifikace známých a neznámých tváří a test identifikace emocí podle výrazu obličeje.
Bentonův vizuální retenční test, administrace A
Test sleduje vizuální percepci a paměť. Je koncipovaný jako předkládání jednodušších geometrických obrazců při definovaném časovém limitu 10 s. Následně je vyšetřovaný požádán o reprodukci obrazce na papír bez časového omezení. Hodnotí se forma, tvar a aranžmá výsledné kopie.
Modifikovaný test Grober-Buschke, test 16 slov
Při testu se používá sada 16 obrázků předmětů, zvířat apod. V iniciální fázi testu jsou vyšetřovanému předkládány obrázky v sériích po čtyřech a je vyzván, aby obrázky pojmenoval. Následně jsou obrázky zakryty a pacient je vyzván, aby pojmenování zopakoval.
Proces se opakuje v jednotlivých sériích, dokud vyšetřovaný není schopen najednou vyjmenovat všechna čtyři vyobrazení. Po absolvování všech čtyř sérií je vyšetřovaný vyzván, aby si vybavil, co vše na obrázcích viděl, nejprve bez nápovědy a následně s možnou nápovědou.
Identifikace známých a neznámých tváří
Vycházeli jsme z práce Keanové et al [12]. Pro naše účely vytvořený test jsme validizovali na skupině 20 zdravých dobrovolníků. 10 veřejnosti známých tváří (prezident republiky, předseda vlády, populární umělci) a 10 neznámých tváří bylo předkládáno ve fixním pseudorandomizovaném pořadí. Pacienti byli dotazováni, zda je jim osoba na obrázku známa či ne. Výsledné skóre testu bylo stanoveno podle počtu správných odpovědí. Maximum činilo 20 bodů.
Rozpoznání emocí podle výrazu obličeje
Pro sérii jsme použili 24 fotografií z Ekman-Friesenova souboru [30] reprezentující šest základních emocí – štěstí, překvapení, strach, smutek, znechucení a hněv.
Každá ze šesti emocí byla vyobrazena na čtyřech fotografiích. Vybraná série byla vyhodnocena na normální populaci jako nejreprezentativnější [31]. Fotografie byly prezentovány po jedné ve fixním pseudorandomizovaném pořadí. Účastník byl vyzván, aby přiřadil ke každému předkládanému obličeji jednu z uvedených šesti možností vyznačených pod každou fotografií.
Statistická analýza
Ke zjišťování rozdílů v neuropsychologických testech a rozdílů v regionálních mozkových objemech (korigovaných k ICV) bylo použito Mann‑Whitney U testu. Ke stanovení případného vztahu mezi regionálními mozkovými objemy a výsledky neuropsychologických testů, identifikačním testem a testem rozeznávání emocí byl použit Spearmanův koeficient.
Výsledky
Podle očekávání byly výsledky v MMSE u AN nižší než v kontrolní skupině; podobných výsledků bylo dosaženo i v testech deklarativní paměti (tab. 1).
Table 1. Srovnání výsledků neuropsychologických testů u nemocných s AN a kontrolní skupiny. 
Emocionální rozpoznávání bylo u AN postiženo specificky pro negativní emoce. V celkovém skóre testu rozpoznávání emocí byly signifikantní rozdíly mezi oběma skupinami: průměr kontrolní populace 19,6 z 24 (± 2,7) a 15,55 (± 3,9, p < 0,05) u pacientů s AN.
Regionální objemy mozku byly v kontrolní skupině signifikantně větší, s výjimkou pólu temporálního laloku a levého předního cingulárního kortexu (graf 1).
Graph 1. Rozdíly mezi relativními objemy mozkových struktur u nemocných s AN v porovnání s kontrolní skupinou. Statisticky významné rozdíly jsou vyznačeny hvězdičkou (p < 0,01). 
Nalezli jsme korelaci mezi objemem pólu levého temporálního laloku s výsledky testu identifikace známých a neznámých tváří (p < 0,05). Objemy pravého a levého hippocampu korelovaly s výsledky testů na deklarativní paměť. Nenašli jsme žádný významný vztah mezi výsledky testů deklarativní paměti a naměřenými amygdalárními objemy (tab. 2).
Table 2. Korelace výsledků neuropsychologických testů s regionálními mozkovými objemy. 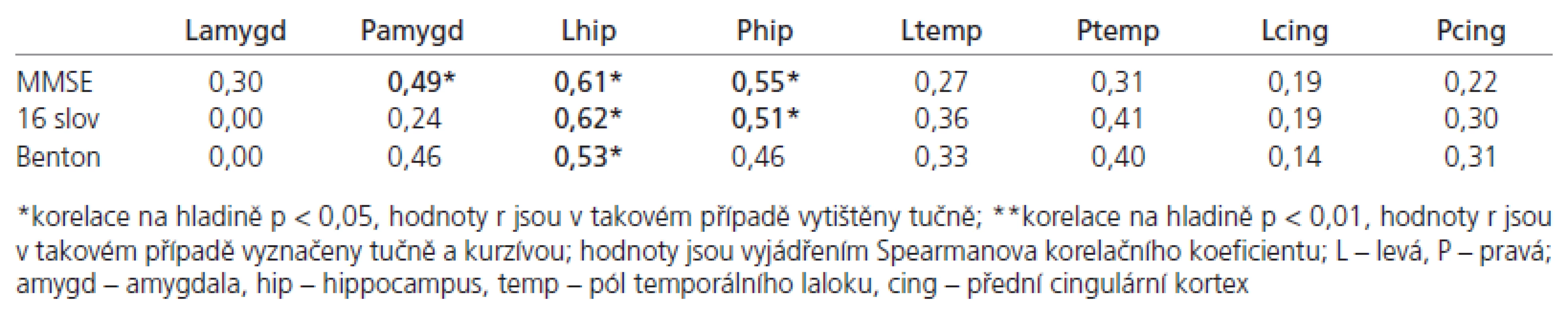
Korelační analýza testu rozpoznávání emocí prokázala několik signifikantních výsledků ve vztahu k některým ROI (tab. 3): změny objemu levé amygdaly korelovaly s rozeznáváním štěstí (r = 0,54, p < 0,01), hněvu (r = 0,49, p < 0,05) a s celkovým skóre v testu rozeznávání emocí (r = 0,54, p < 0,01); změny objemu pravé amygdaly korelovaly se smutkem (r = 0,34, p < 0,05) a hněvem (r = 0,56, p < 0,01). Zjistili jsme též vztah mezi objemy obou hippocampů a rozpoznáváním hněvu (r = 0,55 pro pravý, 0,58 pro levý, p < 0,01).
Table 3. Korelace regionálních mozkových objemů s počtem jednotlivých rozpoznaných emocí. 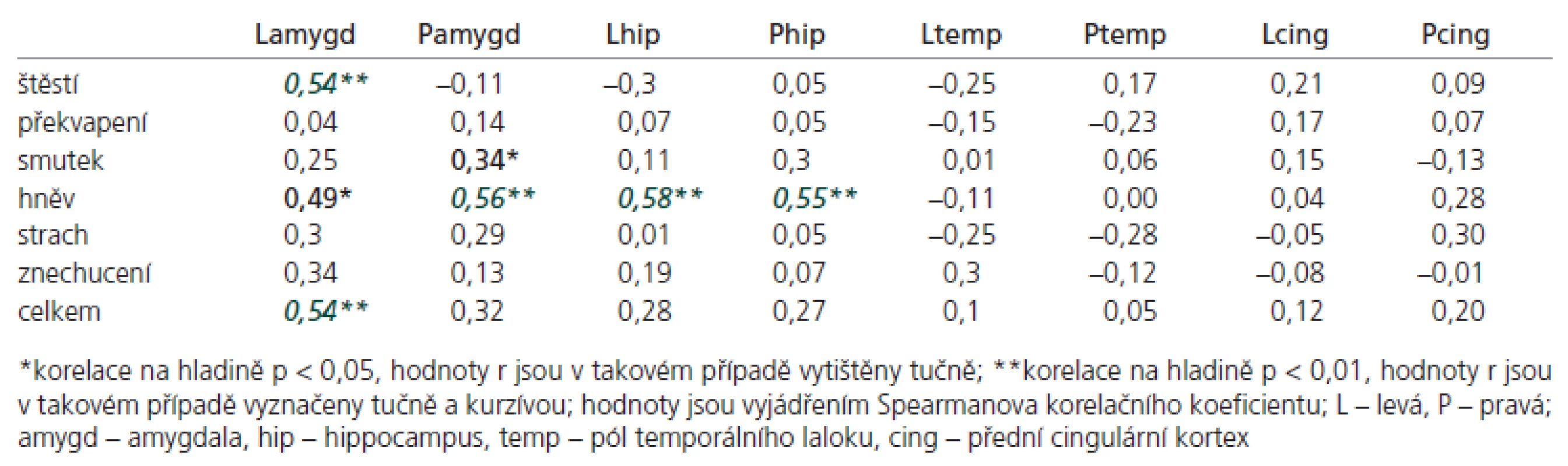
Diskuze
Cílem této studie bylo prozkoumat možný vztah mezi emocionální agnozií a regionálními mozkovými objemy u pacientů s AN.
Některé volumometrické studie používají metodu Voxel Based Morphometry (VBM, morfometrie založená na voxelech). VBM metoda je automatická, a tudíž opakovaná měření nejsou zatížena intraindividuální chybou, avšak její výsledky nemusí být vždy s manuálním měřením srovnatelné. Její limity se objevují především při měření oblastí s vysokou anatomickou variabilitou. Manuální metoda volumometrie je tedy v případě anatomicky složitých struktur, jakými je amygdala nebo hippocampus, stále považována za zlatý standard měření [32].
Naším měřením nebyl zjištěn významný rozdíl v objemech pólu temporálního laloku a levého předního cingulárního kortexu mezi pacienty s AN a kontrolní skupinou. Důvodem může být vysoká anatomická variabilita cingulárního gyru [33], která výrazně snižuje spolehlivost volumetrického měření. Absence rozdílu v objemech pólu temporálního laloku mezi skupinou s AN a kontrolní skupinou může souviset s faktem, že jsme testovali pacienty v časné fázi AN, a neurodegenerativní změny tudíž ještě nepostihly neokortex temporálního laloku v takové intenzitě, aby změny objemu byly rozlišitelné na MR.
Korelace hippocampálních objemů a paměťových testů byly ve shodě s výsledky předcházejících volumetrických studií [23,34]. Nepřítomnost korelace mezi objemy amygdaly a testem Grober‑Buschke a Bentonovým může být způsobena méně vyjádřenou účastí amygdaly v procesech deklarativní paměti.
Výsledky testu identifikace tváří byly ve významné korelaci s atrofií pólu temporálního laloku, avšak vztah mezi atrofií pólu temporálního laloku a emoční agnozií jsme nenašli. Tento výsledek lze interpretovat tak, že pól temporálního laloku se může účastnit procesu identifikace tváří, ale není zahrnut do procesu rozpoznávání emocí z výrazu tváře. Některé funkční neurozobrazovací studie používající fMR a PET metodu porovnávaly aktivizaci temporálního laloku ve vztahu s vizuálním podnětem obličeje. Obličeje důvěrně známých lidí a rodinných příslušníků vyvolávaly vyšší aktivitu temporálního laloku než obličeje cizích lidí [35,36]. Olson et al uvádějí, že pól temporálního laloku hraje zásadní roli při asociaci specifických vzpomínek ve vztahu k obličejům. Dále se také spoluúčastní emocionálního zpracovávání jednotlivých senzorických vjemů, ale pouze pokud jsou dostatečně komplexní (hudba, humor, film atd.). Při rozpoznávání emocí z výrazu obličeje není zřejmě funkce temporálního pólu dominantní [13].
Stupeň emoční agnozie koreloval s atrofií ROI pouze v případě amygdaly a hippocampu. Našli jsme rozdíly v lateralitě atrofie amygdaly a sníženou schopností rozpoznávat některé emoce: štěstí v případě levé, hněv v případě pravé amygdaly. Funkční vztah mezi levou amygdalou a rozpoznáváním štěstí byl demonstrován již v minulosti [37,38]. Tato zjištění jsou stejná jako u autorů, kteří lokalizují pozitivní emoce do levé hemisféry [38]. Rozpoznání hněvu korelovalo s atrofií pravé i levé amygdaly a hippocampu. Je ale nutné poznamenat, že nebyla provedena korekce na počet měření v případě korelací.
Hippocampus a amygdala vytvářejí reciproční spojení a jejich interakce je nedílnou součástí procesů emoční paměti [39,40]. Nicméně deficit emoční paměti je u AN více vztažen k míře poškození amygdaly než hippocampu [7]. V práci Rosena et al byla snížená schopnost rozeznávání emocí z výrazu tváře sdružena s bilaterální atrofií amygdaly u nemocných s temporální variantou FTD [41]. Podmínka oboustranné atrofie amygdaly byla splněna i v našem souboru.
H. Burnhamová srovnávala skupinu 13 pacientů s AN s 13člennou kontrolní skupinou zdravých jedinců v rozpoznávání jednotlivých emocí (smutek, znechucení, strach, štěstí, zloba a překvapení) ve dvou variantách testů. První test obsahoval přiřazování pojmenování emocí podle výrazu obličeje na fotografii, ve druhém testu bylo úkolem párovat fotografie tváří vyjadřující identickou emoci. Pacienti s AN dosáhli v obou variantách testu horších výsledků, avšak signifikantní rozdíl mezi kontrolní skupinou a pacienty s AN byl zjištěn pouze v úkolu párování fotografií obličejů se stejným emocionálním výrazem. Ačkoliv testovaný soubor byl malý a pacienti s AN neměli stejný stupeň demence, práce prokazuje specifickou emoční agnozii u diagnózy AN [42]. Důvod, proč i v prvním testu nebyl nalezen dostatečný statistický rozdíl mezi pacienty a kontrolní skupinou, by se dal vysvětlit i malým počtem vyšetření.
Podle některých studií je příčinou emoční agnozie u nemocných s AN spíše narušení celkových kognitivních schopností než selektivní porucha rozpoznávání emocí [43,44]. Z tohoto důvodu jsme zahrnuli do vyšetřovací baterie vedle testu rozeznávání emocí i test identifikace známých a neznámých tváří. Pacienti s AN dosáhli v testu rozeznávání emocí výrazně horších výsledků než v testu identifikace známých a neznámých tváří.
Ve studii Killgoreho a Yurgelun-Todda byla prokázána asociace mezi rozpoznáváním tváří vyjadřujících štěstí a aktivací přední části gyrus cinguli a amygdaly a mezi rozpoznáváním hněvu s částečnou aktivací levého cingulárního gyru [45]. Naše měření oproti tomu nezjistila vztah mezi atrofií pravého, resp. levého předního cingulárního kortexu a výsledky v testech emoční paměti. Na tento výsledek je však třeba hledět obezřetně vzhledem k nízké spolehlivosti měření v případě cingulárního kortexu.
U povšechné atrofie mozku v rámci AN je hodnocení vztahu mezi atrofií amygdaly a emoční agnozií obtížné, avšak námi nalezený významný vztah mezi amygdalární atrofií a sníženou schopností rozeznávat některé emoce u pacientů s AN podporuje hypotézu, že vazba mezi atrofií amygdaly a deficitem v rozeznávání emocí u AN existuje.
MUDr. Jakub Hort, Ph.D.
Neurologická klinika
2. LF UK a FN v Motole
V Úvalu 84
150 06 Praha 5
e‑mail: jakub.hort@seznam.cz
Přijato k recenzi: 13. 9. 2007
Přijato do tisku: 8. 9. 2008
Sources
1. Anderson AK, Phelps EA. Lesions of the human amygdala impair enhanced perception of emotionally salient events. Nature 2001; 411(6835): 305–309.
2. McGaugh JL, Ferry B, Vazdarjanova A, Roozendaal B. Amygdala: role in modulation of memory storage. In: Aggleton JP (ed). The Amygdala: A Functional Analysis. New York: Oxford University Press 2000 : 391–424.
3. Damasio AR. On some functions of the human prefrontal cortex. Ann N Y Acad Sci 1995; 769 : 241–251.
4. Markowitsch HJ, Calabrese P, Würker M, Durwen HF, Kessler J, Babinsky R et al. The amygdala‘s contribution to memory – a study on two patients with Urbach-Wiethe disease. Neuroreport 1994; 5(11): 1349–1352.
5. Morris JS, Ohman A, Dolan RJ. Conscious and unconscious emotional learning in the human amygdala. Nature 1998; 393(6684): 467–470.
6. Anderson AK, Phelps EA. Expression without recognition: contributions of the human amygdala to emotional communication. Psychol Sci 2000; 11(2): 106–111.
7. Mori E, Ikeda M, Hirono N, Kitagaki H, Imamura T, Shimomura R. Amygdalar volume and emotional memory in Alzheimer‘s disease. Am J Psychiatry 1999; 156(2): 216–222.
8. Blair RJ, Morris JS, Frith CD, Perrett DI, Dolan RJ. Dissociable neural responses to facial expressions of sadness and anger. Brain 1999; 122(5): 883–893.
9. Dolan RJ, Fletcher P, Morris J, Kapur N, Deakin JF, Frith CD. Neural activation during covert processing of positive emotional facial expressions. Neuroimage 1996; 4(3): 194–200.
10. Hesslinger B, Tebartz van Elst L, Thiel T, Haegele K, Henning J, Ebert D. Frontoorbital volume reductions in adult patients with attention deficit hyperactivity disorder. Neurosci Lett 2002; 328(3): 319–321.
11. Rosen HJ, Perry RJ, Murphy J, Kramer JH, Mychack P, Schuff N et al. Emotion comprehension in the temporal variant of frontotemporal dementia. Brain 2002; 125(10): 2286–2295.
12. Keane J, Calder AJ, Hodges JR, Zouny AW. Face and emotion processing in frontal variant frontotemporal dementia. Neuropsychologia 2002; 40(6): 655–665.
13. Olson IR, Plotzker A, Ezzyat Y. The Enigmatic temporal pole: a review of findings on social and emotional processing. Brain 2007; 130(7): 1718–1731.
14. Gloor P, Olivier A, Quesney LF, Andermann F, Horowitz S. The role of the limbic system in experiential phenomena of temporal lobe epilepsy. Ann Neurol 1982; 12(2): 129–144.
15. Zola-Morgan S, Squire LR, Alvarez-Royo P, Clower RP. Independence of memory functions and emotional behavior: separate contributions of the hippocampal formation and the amygdala. Hippocampus 1991; 1(2): 207–220.
16. Horínek D, Varjassyová A, Hort J. Magnetic resonance analysis of amygdalar volume in Alzheimer‘s disease. Curr Opin Psychiatry 2007; 20(3): 273–277.
17. Horínek D, Petrovický P, Hort J, Krásenský J, Brabec J, Bojar M et al. Amygdalar volume and psychiatric symptoms in Alzheimer‘s disease: an MR analysis. Acta Neurol Scand 2006; 113(1): 40–45.
18. Mori E, Ikeda M, Hirono N, Kitagaki H, Imamura T, Shimomura R. Amygdalar volume and emotional memory in Alzheimer’s disease. Am J Psychiatry 1999; 156(2): 216–222.
19. Lavenu I, Pasquier F, Lebert F, Petit H, Van der Linden M. Perception of emotion in frontotemporal dementia and Alzheimer disease. Alzheimer Dis Assoc Disord 1999; 13(2): 96–101.
20. Szeszko PR, Robinson D, Alvir JMJ, Binder RM, Lencz T, Ashtari M et al. Orbital frontal and amygdala volume reductions in obsessive-compulsive disorder. Arch Gen Psychiatry 1999; 56(10): 913–919.
21. McKhann G, Drachman D, Folstein M, Katzman R, Price D, Stadlan EM. Clinical diagnosis of Alzheimer’s disease: report of the NINCDS-ADRDA Work Group under the auspices of the Department of Health and Human Services Task Force on Alzheimer’s disease. Neurology 1984; 34(7): 939–944.
22. Rasova K, Krasensky J, Havrdova E, Obenberger J, Seidl Z, Dolezal O et al. Is it possible to actively and purposely make use of plasticity and adaptability in the neurorehabilitation treatment of multiple sclerosis patients? A pilot project. Clin Rehabil 2005; 19(2): 170–181.
23. Laakso MP, Soininen H, Partanen K, Lehtovirta M, Hallikainen M, Hänninen T et al. MRI of the hippocampus in Alzheimer‘s disease: sensitivity, specificity, an analysis of the incorrectly classified subjects. Neurobiol Aging 1998; 19(1): 23–31.
24. Brabec J. Jednoduchá metoda stanovení velikosti striata pro klinické diagnostické účely. Cesk Slov Neurol N 2005; 68/101(3): 179–182.
25. Hořínek D, Hort J, Brabec J, Bojar M, Krásenský J, Seidl Z et al. Objem amygdaly je snížen u nemocných s Alzheimerovou chorobou. Cesk Slov Neurol N 2005; 68/101(4): 235–240.
26. Amaral DG, Insausti R. The human hippocampal formation. In: Paxinos G (ed). The Human Nervous System. San Diego: Academic Press 1990 : 711–755.
27. Folstein MF, Folstein SE, McHugh PR. „Mini‑mental State“. A practical method for the grading the cognitive state of patients for the clinician. J Psychiat Res 1975(3); 12 : 189–198.
28. Buschke H. Cued recall in amnesia. J Clin Neuropsychol 1984; 6(4): 433–440.
29. Benton AL. Revised Visual Retention Test: clinical and experimental applications. Iowa City: State University of Iowa 1955.
30. Ekman P, Friesen WV. Pictures of facial affect. Palo Alto CA: Consulting Psychologists Press 1976.
31. Gray JM, Young AW, Barker WA, Curtis A, Gibson D. Impaired recognition of disgust in Huntington‘s disease gene carriers. Brain 1997; 120(11): 2029–2038.
32. Tisserand DJ, Pruessner JC, Sanz Arigita EJ, van Boxtel MP, Evans AC, Jolles J et al. Regional frontal cortical volumes decrease differentially in aging: An MRI study to compare volumetric approaches and voxel‑based morphometry. Neuroimage 2002; 17(2): 657–669.
33. Paus T, Tomaiuolo F, Otaky N, MacDonald D, Petrides M, Atlas J et al. Human cingulate and paracingulate sulci: pattern, variability, asymmetry, and probabilistic map. Cereb Cortex 1996; 6(2): 207–214.
34. Jack CR jr, Petersen RC, Xu YC, O’Brien PC, Smith GE, Ivnik RJ et al. Prediction of AD with MRI‑based hippocampal volume in mild cognitive impairment. Neurology 1999; 52(7): 1397–1403.
35. Gorno–Tempini ML, Price CJ, Josephs O, Vandenberghe R, Cappa SF, Kapur N et al. The neural systems sustaining face and proper–name processing. Brain 1998; 121(11): 2103–2118.
36. Leveroni CL, Seidenberg M, Mayer AR, Mead LA, Binder JR, Rao SM. Neural systems underlying the recognition of familiar and newly learned faces. J Neurosci 2000; 20(2): 878–886.
37. Schneider F, Grodd W, Weiss U, Klose U, Mayer KR, Nägele T et al. Functional MRI reveals left amygdala activation during emotion. Psychiatry Res 1997; 76(2–3): 75–82
38. Canli T. Hemispheric asymmetry in the experience of emotion: a perspective from functional imaging. Neuroscientist 1999; 5 : 201–207.
39. Pitkänen A. Connectivity of the rat amygdaloid complex. In: Aggleton JP (ed). The Amygdala: A Functional Analysis. Oxford: Oxford University Press 2000 : 31–115.
40. Richardson MP, Strange B, Dolan RJ. Encoding of emotional memories depends on the amygdala and hippocampus and their interactions. Nat Neurosci 2004; 7(3): 278–285.
41. Rosen HJ, Perry RJ, Murphy J, Kramer JH, Mychack P, Schuff N et al. Emotion comprehension in the temporal variant of frontotemporal dementia. Brain 2002; 125(10): 2286–2295.
42. Burnham H, Hogervorst E. Recognition of facial expressions of emotion by patients with dementia of the Alzheimer type. Dement Geriatr Cogn Disord 2004; 18(1): 75–79.
43. Whitwell JL, Sampson EL, Watt HC, Harvey RJ, Rossor MN, Fox NC. A volumetric magnetic resonance imaging study of the amygdala in frontotemporal lobar degeneration and Alzheimer‘s disease. Dement Geriatr Cogn Disord 2005; 20(4): 238–244.
44. Boccardi M, Sabattoli F, Laakso MP, Testa C, Rossi R, Beltramello A et al. Frontotemporal dementia as a neural system disease. Neurobiol Aging 2005; 26(1): 37–44.
45. Killgore WD, Yurgelun-Todd DA. Activation of the amygdala and anterior cingulate during nonconscious processing of sad versus happy faces. Neuroimage 2004; 21(4): 1215–1223.
Labels
Paediatric neurology Neurosurgery Neurology
Article was published inCzech and Slovak Neurology and Neurosurgery

2008 Issue 6-
All articles in this issue
- Spánková apnoe dospělého věku
- Monitorování mozkové oxygenace
- Roztroušená skleróza mozkomíšní a magnetická rezonance: současnost a nové trendy
- Vztah atrofie amygdaly a dalších vybraných mozkových struktur k emocionální agnozii u Alzheimerovy nemoci
- Farmakoepidemiologická studie souboru 427 pacientů léčených pro epilepsii
- Vyšetřování proteinu 14-3-3 v mozkomíšním moku – klinicko‑patologická korelace
- Syndrom kubitálního kanálu. Srovnání operačních technik prosté dekomprese a přední transpozice ulnárního nervu
- Endonazální endoskopická transsfenoidální resekce selárních lézí
- Přední krční mikroforaminotomie v řešení unilaterální monosegmentální radikulopatie (prospektivně vedená pilotní studie – 15 pacientů)
- Extraoperativní mapování pomocí kortikálního gridu před resekcí difuzního oligodendrogliomu v řečově dominantní hemisféře – alternativa „awake kraniotomie“ – kazuistika
- Status absencí u geriatrického pacienta s recentní diagnózou idiopatické generalizované epilepsie – kazuistika
- Subakutně probíhající reverzibilní hypertenzní leukoencefalopatie – kazuistika
- Rozdíly v počtu CAG opakování mezi pohlavími a jejich korelace s klinickým obrazem u Huntingtonovy choroby
- Czech and Slovak Neurology and Neurosurgery
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Roztroušená skleróza mozkomíšní a magnetická rezonance: současnost a nové trendy
- Spánková apnoe dospělého věku
- Subakutně probíhající reverzibilní hypertenzní leukoencefalopatie – kazuistika
- Vyšetřování proteinu 14-3-3 v mozkomíšním moku – klinicko‑patologická korelace
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

