-
Medical journals
- Career
Metabolický syndróm u pacientov po alogénnej transplantácii kmeňových krvotvorných buniek
Authors: Ľ. Harvanová 1,2; L. Petríková 3; E. Bojtárová 1; B. Žiaková 1; M. Martišová 1; V. Lábska 1; M. Hrubiško 1,2; A. Bátorová 1; B. Mladosievičová 4
Authors‘ workplace: Klinika hematológie a transfuziológie LF UK, LF SZU a UN Bratislava, Slovenská republika 1; Katedra hematológie a transfuzológie, LF SZÚ, Bratislava, Slovenská republika 2; Klinika onkohematológie LF UK a NOÚ, Bratislava , Slovenská republika 3; Ústav patologickej fyziológie LF UK, Bratislava, Slovenská republika 4
Published in: Klin Onkol 2022; 35(2): 132-138
Category: Original Articles
doi: https://doi.org/10.48095/ccko2022132Overview
Východiská: Alogénna transplantácia kmeňových krvotvorných buniek (TKB) sa stala liečebnou modalitou pre mnohé malígne a nemalígne ochorenia. Počet dlhodobo prežívajúcich pacientov sa neustále zvyšuje. Transplantácia môže zapríčiniť poškodenia rôznych orgánov a tkanív – od minimálnych potenciálne progredujúcich subklinických zmien až po život ohrozujúce stavy. Cieľom tejto práce bolo zistiť prevalenciu metabolického syndrómu (MS) u pacientov po alogénnej TKB. Pacienti a metódy: Vyhodnotili sme 74 pacientov s mediánom veku 35 rokov v čase TKB a mediánom doby od transplantácie 5 rokov (2–23 rokov). MS sme vyhodnocovali podľa definície National Cholesterol Education Program – Adult Panel III (NCEP ATP III) a podľa definície International Diabetes Federation (IDF). Výsledky: Prevalencia MS po TKB podľa definície NCEP ATP III bola v našom súbore 40,5 % a podľa definície IDF 39,2 %, čo predstavuje 2,02 násobne vyšší výskyt ako v bežnej slovenskej populácii. MS sa častejšie vyskytoval u mužov a medzi najčastejšie komponenty patrila centrálna obezita, artériová hypertenzia a hypertriacylglycerolémia. Najnižšia prevalencia MS bola vo vekovej skupine 20–29 ročných, najvyššia v skupine 60–69 ročných pacientov. Desaťročná kumulatívna incidencia MS bola 32,5 %. Medzi rizikové faktory rozvoja MS patrilo celotelové ožiarenie, pozitívna rodinná anamnéza kardiovaskulárnych ochorení a vek > 40 rokov v čase TKB. U 7 pacientov (9,45 %) sa objavila kardiovaskulárna komplikácia. Medián všeobecného kardiovaskulárneho rizika pre mužov predstavoval hodnotu 13,3 % a pre ženy 6,68 %. Záver: Potvrdený zvýšený výskyt MS u pacientov prežívajúcich > 2 roky po TKB môže byť ďalším stimulom pre prospektívne štúdie a pre intervencie potrebné pre ich prevenciu.
Klíčová slova:
metabolický syndrom – alogénna transplantácia kmeňových krvotvorných buniek – neskoré komplikácie
Úvod
Metabolický syndróm (MS) je definovaný zoskupením piatich faktorov ako je hyperglykémia, hypertriacylglycerolémia, dyslipidémia, hypertenzia a obezita (meraná obvodom pásu) [1,2]. Prevalencia MS je približne u štvrtiny obyvateľstva [3]. Pacienti po transplantácii krvotvorných kmeňových buniek (TKB) majú zvýšené riziko rozvoja metabolického syndrómu, ktorý je dôležitým rizikovým faktorom rozvoja kardiovaskulárnych ochorení [4,5]. Údaje o prevalencii metabolického syndrómu u pacientov po alogénnej TKB sa rôznia od prevalencie 7,5 % predovšetkým v detskej populácii až po prevalenciu 49 % u dospelých [4,6–8]. Autori Majhail et al zistili 2,2-násobne vyššiu prevalenciu metabolického syndrómu u pacientov po TKB v porovnaní s kontrolnou skupinou [8].
Štúdie v bežnej populácii ukázali vzťah medzi komponentmi metabolického syndrómu na jednej strane a hormonálnym deficitom, hypomagnezémiou a endoteliálnou dysfunkciou na druhej strane. Tieto zmeny sú pravidelne pozorované po protinádorovej liečbe, a preto by mohli byť dôležitým etiologickým faktorom v rozvoji metabolického syndrómu u onkologických pacientov [9,10]. Lokálna a systémová terapia môžu spôsobiť poruchy hypotalomopituitárnej osi a jej endokrinných orgánov, ako deficit rastového hormónu a gonadálnych hormónov, ktoré hrajú úlohu v rozvoji metabolického syndrómu. Nízke hladiny testosterónu korelujú s viacerými komponentmi metabolického syndrómu u mužov (väčší objem viscerálneho tuku, vyššie BMI a pomer pás/boky, znížený „high density lipoprotein“ (HDL) cholesterol, vazokonstrikcia v krvnom riečisku, strata antiischemického účinku testosterónu). Dlho je známy kardioprotektívny účinok estrogénov (znižujú celkový a „low density lipoprotein“ (LDL) cholesterol, triglyceridy, hrajú dôležitú úlohu v regulácii vaskulárnej funkcie a krvného tlaku). Deficit rastového hormónu spôsobuje hypertriacylglycerolémiu, nízky HDL cholesterol, inzulínovú rezistenciu, koagulopatiu, hypertenziu a poškodenie endoteliálnej funkcie. Hypotyreoidizmus má negatívny vplyv na kardiovaskulárny systém, jednak priamym účinkom na srdce a vedľajším účinkom na sérové lipidy. Systémová chemoterapia môže poškodzovať aj nehormonálne systémy, napr. metabolizmus horčíka. Okrem toho má priamy a škodlivý účinok na krvné cievy a ich endotel a hrá úlohu v iniciácii metabolického syndrómu [9,10]. Dyslipidémia, porucha glukózovej tolerancie a arteriálna hypertenzia po alogénnej TKB môžu byť následkom prolongovanej a intenzívnej imunosupresívnej terapie vrátane glukokortikoterapie [11]. Úlohu v patogenéze by však mohla zohrávať aj hyperleptinémia. Potenciálna interakcia medzi cirkulujúcim leptínom, komponentami metabolického syndrómu a imunitnou funkciou by mohla vysvetliť úlohu leptínu v sprostredkovaní kardiovaskulárneho rizika po TKB [12].
Cieľom tejto práce bolo zistiť prevalenciu a rizikové faktory metabolického syndrómu, ako aj riziko kardiovaskulárnych ochorení v populácii dospelých pacientov po alogénnej TKB v Slovenskej republike.
Súbor pacientov
Súbor tvorilo 74 dospelých pacientov (41 mužov a 33 žien), ktorí boli aspoň 2 roky od alogénnej TKB. Medián veku v čase transplantácie bol 35 rokov (rozsah 12–63 rokov) a medián doby od transplantácie bol 5 rokov (rozsah 2–23 rokov). Tridsaťšesť (48,6 %) pacientov bolo pred TKB liečených antracyklínom (ANT) s mediánom kumulatívnej dávky (prepočítanej na doxorubicín) 280 mg/m2 (125–450), 14 pacientov dostalo rádioterapiu (RT) na CNS v celkovej dávke 24 Gy a 3 pacienti RT na mediastinum v celkovej dávke 24 Gy. Charakteristiky pacientov sú uvedené v tab. 1.
Table 1. Charakteristika súboru. 
ATG – antitymocytový globulín, BU – busulfan, CY – cyklofosfamid, FLU – fludarabín, IDA – idarubicín, TBI – celotelové ožiarenie, VP-16 – etopozid Práca bola schválená Etickou komisiou Univerzitnej nemocnice v Bratislave. Každý pacient bol poučený a podpísal informovaný súhlas.
Metódy
Pri pravidelnej kontrole 74 pacientov na transplantačnej ambulancii Kliniky hematológie a transfuziológie v Bratislave bol odmeraný tlak krvi, obvod pása, výška a hmotnosť, následne odobratá krv, kde sme vyšetrovali hladinu glykémie nalačno a parametre lipidového profilu (celkový cholesterol, HDL cholesterol a triacylglyceroly). Anamnesticky sme zisťovali údaje o fajčení, užívaní hormonálnej substitučnej terapie a rodinnú anamnézu rizikových faktorov vzniku kardiovaskulárneho ochorenia, taktiež sme sa informovali o prítomnosti a eventuálnej liečbe hypertenzie, ako aj diabetu mellitu alebo poruchy glukózovej tolerancie a liečby dyslipidémie.
Metabolický syndróm sme diagnostikovali na základe definície National Cholesterol Education Program – Adult Treatment Panel III (NCEP ATP III), pričom museli byť prítomné tri alebo viac z piatich diagnostických kritérií [2]:
- centrálna obezita: obvod pása >102 cm u mužov a 88 cm u žien;
- glykémia nalačno > 5,6 mmol/l alebo liečba diabetu mellitu;
- hypertriacylglycerolémia: hodnota > 1,7 mmol/l;
- nízka hladina HDL cholesterolu: < 1,0 mmol/l u mužov, a pod 1,3 mmol/l u žien;
- hodnoty krvného tlaku: > 130/85 mmHg alebo liečba hypertenzie.
Podobne sme prevalenciu MS vyrátali aj na základe definície International Diabetes Federation (IDF), kde absolútnou podmienkou je obvod pása > 94 cm u mužov a > 80 cm u žien a súčasne musí mať pacient aspoň 2 kritériá z nasledujúcich [1]:
- glykémia nalačno > 5,6 mmol/l alebo liečba diabetu mellitu;
- hypertriacylglycerolémia: hodnota > 1,7 mmol/l;
- nízka hladina HDL cholesterolu: < 1,0 mmol/l u mužov, a < 1,3 mmol/l u žien;
- hodnoty krvného tlaku: > 130/85 mmHg alebo liečba hypertenzie.
Na porovnanie prevalencie s našim súborom sme použili údaje zo štúdie autorov Galajda et al, v ktorej sa zúčastnilo 1 517 pacientov a údaje autorov Miláček et al v ktorej bolo zahrnutých 876 pacientov [13,14].
Za možné rizikové faktory vzniku MS u transplantovaných pacientov sme hodnotili vek v čase transplantácie, pohlavie, predchádzajúcu liečbu antracyklínmi alebo rádioterapiou, použitie TBI v rámci prípravného režimu, chronickú reakciu štepu proti hostiteľovi (graft versus host diseae – GvHD), ako aj všeobecné rizikové faktory (pozitívna rodinná anamnéza, fajčenie).
Súčasne sme sledovali prítomnosť kardiovaskulárneho ochorenia ako komplikácie po TKB. Pravdepodobnosť 10-ročného kardiovaskulárneho rizika sme vyrátali na základe kalkulátora z Framighamskej štúdie [15]. Tento kalkulátor je aplikovateľný u pacientov vo veku 30–74 rokov.
Štatistické analýzy
Základné charakteristiky súboru pacientov, ako vek v čase TKB a kumulatívna dávka antracyklínu, boli vyjadrené ako medián a rozsah. V prípade nepreukázania normality rozloženia parametrov sme na porovnanie použili Mann-Whitneyov test a Wilcoxonov test, pri preukázaní normality rozloženia parametrov sme použili Studentov t-test. Signifikantnosť vybraných rizikových faktorov bola vyhodnocovaná pomocou multivariantnej logistickej regresie. Na štatistické spracovanie sme použili štatistický program MedCalc, verzia 18. Za signifikantný rozdiel sme považovali pravdepodobnosť nulovej hypotézy < 5 % (p < 0,05).
Výsledky
Prevalencia metabolického syndrómu
Prítomnosť metabolického syndrómu sme podľa definície NCEP ATP III zistili u 30 pacientov, čo predstavovalo prevalenciu 40,5 %. Podľa definície IDF sme zistili MS u 29 pacientov (39,2 %). Metabolický syndróm sa častejšie vyskytoval u mužov ako u žien (48,7 vs. 30 %).
Na porovnanie výskytu MS v našom súbore a výskytu MS v bežnej populácii sme použili výsledky práce autorov Galajda et al, kde bolo vyšetrených 1 517 pacientov so zistenou 20% prevalenciou MS [13]. Prevalencia MS v našom súbore bola 2,02-násobne vyššia (95% CI 1,5–2,7; p < 0,01) ako v bežnej populácii. Podľa definície IDF bol výskyt MS u pacientov po TKB až 1,3-násobne vyšší u žien a 1,28-násobne vyšší u mužov v porovnaní s bežnou populáciou [14].
Najvyššia prevalencia MS bola vo vekovej skupine 60–69 rokov, najnižšia v skupine 20–29 rokov. Z výsledkov vyplýva, že výskyt MS u transplantovaných pacientov sa zvyšuje s vekom, podobne ako je tomu v bežnej populácii. Prevalenciu MS v jednotlivých vekových kategóriách zobrazuje graf 1.
Graph 1. Prevalencia metabolického syndrómu v jednotlivých vekových skupinách. 
Parametre metabolického syndrómu
Z jednotlivých sledovaných parametrov sa u pacientov s MS najviac vyskytovala abdominálna obezita (96 %), artériovú hypertenziu sme zistili u 23 pacientov (76 %) a hypertriacylglycerolémiu alebo užívanie hypolipidemickej liečby u 21 pacientov (70 %). Najmenej zastúpené boli hyperglykémia alebo liečený diabetes (20 pacientov; 66 %) a znížený HDL cholesterol (13 pacientov; 43 %). Percentuálne zastúpenie jednotlivých komponentov zobrazuje graf 2.
Graph 2. Percentuálne zastúpenie jednotlivých parametrov u pacientov s metabolickým syndrómom. 
Metabolický syndróm je definovaný ako prítomnosť troch a viacerých komponentov MS. Zastúpenie počtu jednotlivých komponentov MS v celom súbore pacientov zobrazuje graf 3.
Graph 3. Znázornenie počtu jednotlivých komponentov metabolického syndrómu. 
Kumulatívna incidencia metabolického syndrómu
Výskyt neskorých komplikácií po TKB sa s narastajúcim časom od transplantácie zvyšuje. Desaťročná kumulatívna incidencia MS v našom súbore bola 32,5 % s nárastom na 74,5 % po 20 rokoch od TKB (graf 4).
Graph 4. Kumulatívna incidencia metabolického syndrómu po transplantácii kmeňových krvotvorných buniek. 
Rizikové faktory vzniku metabolického syndrómu
Medzi rizikové faktory vzniku metabolického syndrómu v našom súbore patrila pozitívna rodinná anamnéza kardiovaskulárnych ochorení (p = 0,04), celotelové ožiarenie v rámci prípravného režimu (p = 0,03) a vek v čase TKB vyšší ako 40 rokov (p < 0,01).
Predchádzajúca rádioterapia a liečba kortikoidmi, chronická GvHD ani fajčenie neboli štatisticky významným rizikovým faktorom v našom súbore.
Kardiovaskulárne komplikácie
Kardiovaskulárne komplikácie sa v našom súbore vyskytli u siedmi pacientov s prevalenciou 9,45 %. Traja pacienti mali ischemickú chorobu srdca, dvaja pacienti prekonali infarkt myokardu, jeden pacient mal arteriálnu trombózu na dolnej končatine a u jedného pacienta bola zistená chronická renálna insuficiencia na podklade hypertenzie.
Všeobecné kardiovaskulárne riziko
Jedným z cieľov našej práce bola aj predikcia kardiovaskulárneho rizika transplantovaných pacientov. Vychádzali sme z teoretického poznatku, že pacienti s MS majú väčšiu pravdepodobnosť rozvoja kardiovaskulárneho ochorenia a s tým súvisiacej predčasnej smrti v porovnaní s bežnou populáciou.
Na základe hodnôt veku, tlaku krvi, celkového a HDL cholesterolu, pohlavia a pozitívnej anamnézy fajčenia bolo vyrátané „Framingham risk“ skóre. Medián všeobecného kardiovaskulárneho rizika pre mužov predstavoval hodnotu 13,3 % (95% CI 8,3–28,1) a pre ženy 6,68 % (95% CI 2,88–14,29).
V rámci nášho súboru sme 53 % pacientov zaradili do kategórie nízkeho rizika a takmer polovicu pacientov do kategórie stredného a vysokého rizika rozvoja kardiovaskulárneho ochorenia (tab. 2).
Table 2. Skóre 10-ročného kardiovaskulárneho rizika u pacientov po transplantácii kmeňových krvotvorných buniek. 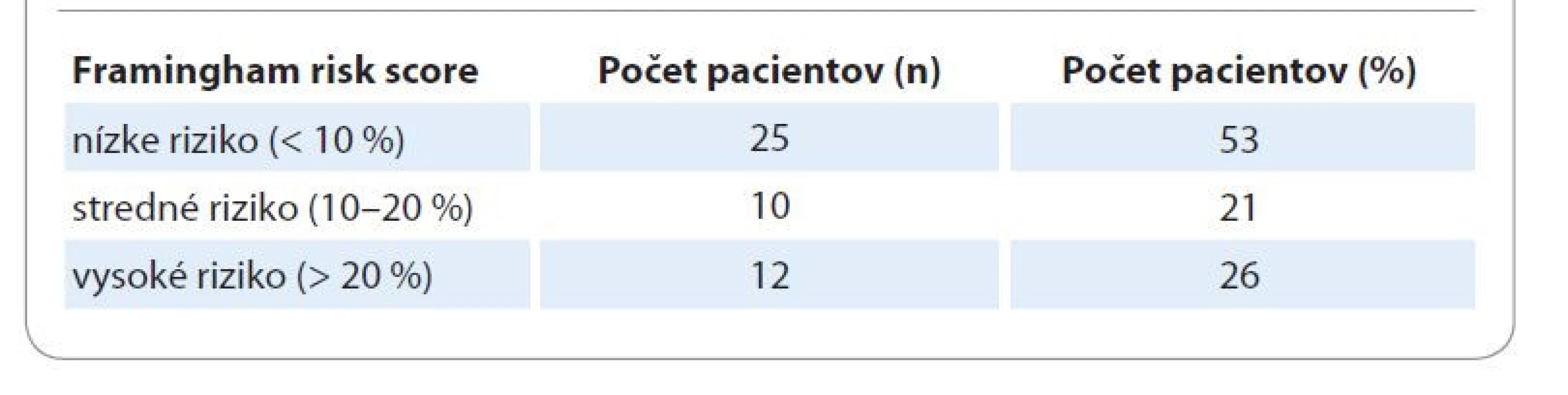
Diskusia
Predložená štúdia prezentuje reálne dáta o výskyte metabolického syndrómu u dospelých pacientov po alogénnej TKB potvrdzujúce zvýšený výskyt prevalencie MS v tejto skupine pacientov (40,5 % podľa NCEP ATP III a 39,2 % podľa IDF). Výskyt MS stúpal s vekom, čo podporuje vekovo závislý neskorý následok po TKB vo vysokej miere spojený s kardiovaskulárnymi komplikáciami.
Táto prevalencia MS je veľmi podobná údajom z nedávno publikovanej najväčšej štúdie, kde podľa NCEP ATP III kritérií bola prevalencia 42,9 % a podľa IDF definície u 36,4 % alogénne transplantovaných pacientov. Vyššiu prevalenciu v našom súbore sme zaznamenali u mužov ako u žien, čo by sme si mohli čiastočne vysvetliť aj užívaním hormonálnej substitučnej liečby a jej protektívnym účinkom na kardiovaskulárny systém.
Výskyt metabolického syndrómu v skupine pacientov po TKB bol 2,02-násobne vyšší ako v bežnej slovenskej populácii [13]. Podobne aj autori Majhail et al zistili 2,2-násobne vyššie riziko vzniku MS u pacientov po TKB oproti kontrolnej skupine [8].
Najčastejšie sa vyskytujúcim komponentom MS v našej práci bola abdominálna obezita, ktorá sa objavila u 96 % pacientov s MS. Medzi ďalšie komponenty s vysokou frekvenciou výskytu patrila artériová hypertenzia a hypertriacylglycerolémia, ktoré sa vyskytovali u 76 % a 70 % pacientov s MS. Autori Paris et al podobne ako my uviedli abdominálnu obezitu ako najfrekventovanejší komponent s výskytom u 73 % pacientov s MS [6]. Naopak v detskej populácii patrila medzi najčastejší komponent MS porucha glukózového metabolizmu [16].
Prevalencia MS sa u našich pacientov zvyšovala so stúpajúcim vekom. Vo vekovej skupine 60–69 rokov sme zaznamenali výskyt MS u 88,8 % a naopak MS sa vyskytol iba u 8,8 % pacientov vo veku 20–29 rokov. Podobne aj práce sledujúce výskyt MS u detí po TKB popisujú nižšiu prevalenciu MS (10,5 %) ako práce na súboroch dospelých pacientov [17].
V našom súbore sme sa tiež zamerali na pacientov, ktorí mali prítomných 4 alebo všetkých 5 komponentov MS. Táto skupina pacientov predstavovala až tretinu pacientov z celkového počtu pacientov s MS. Je pritom známe, že vyšší počet jednotlivých komponentov MS znamená pre pacienta vyššie riziko vzniku kardiovaskulárneho ochorenia, ktoré môže byť až fatálne. Iba u 22,9 % pacientov sme nezaznamenali ani jeden komponent MS. V súbore autorov Majhail et al malo až 78 % pacientov prítomných dva alebo viac komponentov MS, u nás bolo toto percento o niečo nižšie a dosahovalo 58 % [8].
Medzi rizikové faktory rozvoja MS u pacientov po TKB patrí vyšší vek v čase TKB, použitie TBI v rámci prípravného režimu, chronická GvHD a dlhodobá imunosupresívna liečba a zo všeobecných rizikových faktorov je to fajčenie a pozitívna rodinná anamnéza. Spomedzi uvedených rizikových faktorov sme v našom súbore potvrdili úlohu TBI, vek nad 40 rokov v čase transplantácie a pozitívnu rodinnú anamnézu za signifikantný rizikový faktor rozvoja MS. Autori Paris et al vo svojej práci uviedli za signifikantný rizikový faktor kortikoterapiu [6]. Podľa autorov Chow et al boli signifikantné rizikové faktory vzniku MS ožiarenie krania a rodinná anamnéza kardiometabolického ochorenia [18]. Podľa autorov Oudin et al je celotelové ožiarenie významným rizikovým faktorom rozvoja MS [19].
Desaťročná kumulatívna incidencia rozvoja MS v našom súbore bola 32,5 %. Počet prípadov MS sa zvyšoval s predlžujúcim sa časom od TKB. Iní autori zistili nižšie hodnoty 10-ročnej kumulatívnej incidencie, autori Armenian et al vyjadrili 10-ročnú kumulatívnu incidenciu pre jednotlivé komponenty MS: hypertenziu (37,7 %), diabetes mellitus (18,1 %) a dyslipidémiu (46,7 %) [20].
Kardiovaskulárne komplikácie sa v našom súbore vyskytli s prevalenciou 9,45 %. Iné práce zistili až 25% výskyt kardiovaskulárnych ochorení u pacientov s MS [4]. Pri hodnotení 10-ročného rizika kardiovaskulárnych ochorení sme vychádzali z Framighamských kritérií. V našom súbore sme 53 % pacientov zaradili do kategórie nízkeho rizika a takmer polovicu pacientov do kategórie stredného a vysokého rizika rozvoja kardiovaskulárneho ochorenia. Na porovnanie s našimi výsledkami sme použili údaje zo štúdie autorky Jurkovičová et al, ktorej sa zúčastnilo 1 342 pacientov vo veku 18–65 rokov. Na základe Framinghamského skórovania sa v pásme nízkeho rizika nachádzalo 90,5 % osôb, v pásme stredného rizika 8,6 % osôb a v pásme vysokého rizika len 1% [21]. Z výsledkov vyplýva, že všeobecné kardiovaskulárne riziko je u pacientov po TKB výrazne vyššie ako vo všeobecnej slovenskej populácii.
Záver – odporúčania pre prax
Vzhľadom k vysokému výskytu MS u pacientov po TKB oproti bežnej populácii, je nevyhnutné doživotné sledovanie týchto pacientov nielen z hemato-onkologického, ale aj z kardio-onkologického hľadiska.
U pacientov po TKB sa odporúča včasné zahájenie liečby jednotlivých kardiovaskulárnych rizikových faktorov (diabetu mellitu, hypertenzie a dyslipidémie). Krvný tlak sa odporúča kontrolovať aspoň každé 2 roky. Liečba hypertenzie sa odporúča pri hodnotách TK nad 140/90 mmHg pri dvoch po sebe idúcich návštevách s odstupom jedného týždňa. Nakoľko jednou z hlavných príčin je dlhodobá liečba kalcineurínovými inhibítormi, v liečbe hypertenzie sa odporúčajú kalciové blokátory. Lipidový profil sa odporúča vyšetrovať každých 5 rokov u mužov nad 35 rokov a u žien nad 45 rokov. Skríning diabetu je indikovaný u ľudí s vysokým TK alebo dyslipidémiou. U ľudí nad 45 rokov by mala byť kontrola vykonaná každé 3 roky [22]. Iní autori odporúčajú v rámci sledovania neskorých komplikácií aj vyšetrovanie orálneho glukózového tolerančného testu a glykozylovaného hemoglobínu [23].
Potrebná je aj edukácia o zásadách zdravého životného štýlu (pravidelná pohybová aktivita, udržiavanie optimálnej hmotnosti, diétne opatrenia, nefajčenie).
Autoři deklarují, že v souvislosti s předmětem studie nemají žádné komerční zájmy.
The authors declare they have no potential conflicts of interest concerning drugs, products, or services used in the study.
Redakční rada potvrzuje, že rukopis práce splnil ICMJE kritéria pro publikace zasílané do biomedicínských časopisů.
The Editorial Board declares that the manuscript met the ICMJE recommendation for biomedical papers.doc. MUDr. Ľubica Harvanová, PhD.
Klinika hematológie
a transfuziológie LF UK, LF SZU a UN
Antolská 11
Bratislava 85107
Slovenská republika
e-mail: lubica.roziakova@gmail.com
Obdŕžané/Submitted: 29. 8. 2021
Prijaté/Accepted: 11. 10. 2021
Sources
1. International Diabetes Federation. The IDF consensus worldwide definition of the metabolic syndrome. [online]. Available from: https: //www.idf.org.
2. Third report of the National Cholesterol Education Program (NCEP) Expert Panel on Detection, Evaluation, and Treatment of High Blood Cholesterol in Adults (Adult Treatment Panel III). Circulation 2002; 106 (25): 3143–3421.
3. Saklayen MG. The global epidemic of the metabolic syndrome. Curr Hypertens Rep 2018; 20 (2): 1–8. doi: 10.1007/s11906-018-0812-z.
4. Greenfield DM, Salooja N, Peczynski C et al. Metabolic syndrome and cardiovascular disease after haematopoietic cell transplantation (HCT) in adults: an EBMT cross-sectional non-interventional study. Bone Marrow Transplant 2021; 56 (11): 2820–2825.
5. Roziaková L, Bojtárová E, Mistrík M et al. Neskoré následky u pacientov liečených alogénnou transplantáciou kmeňových krvotvorných buniek. Klin Onkol 2011; 24 (6): 453–459.
6. Paris C, Yates L, Lama P et al. Evaluation of metabolic syndrome after hematopoietic stem cell transplantation in children and adolescents. Pediatr Blood Cancer 2012; 59 (2): 306–310. doi: 10.1002/pbc.24104.
7. Bajwa R, Skeens M, Garee A et al. Metabolic syndrome and endocrine dysfunctions after HSCT in children. Pediatr Transplant 2012; 16 (8): 872–878. doi: 10.1111/petr.12002.
8. Majhail NS, Flowers ME, Ness KK et al. High prevalence of metabolic syndrome after allogeneic hematopoietic cell transplantation. Bone Marrow Transplant 2009; 43 (1): 49–54. doi: 10.1038/bmt.2008.263.
9. Muhic E, Mathiesen S, Nielsen MM et al. Metabolic syndrome in male survivors of pediatric allogeneic hematopoietic stem cell transplantation: impact of total body irradiation, low-grade inflammation, and hypogonadism. Transplant Cell Ther 2021; 27 (9): 778.e1–778e.8. doi: 10.1016/j.jtct.2021.05.025.
10. Nuver J, Smit AJ, Postma A et al. The metabolic syndrome in long-term cancer survivors, an important target for secondary preventive measures. Cancer treatment reviews 2002; 28 (4): 195–214. doi: 10.1016/s0305-7372 (02) 00038-5.
11. Couriel DR, Saliba R, Escalón MP et al. Sirolimus in combination with tacrolimus and corticosteroids for the treatment of resistant chronic graft-versus-host disease. Br J Haematol 2005; 130 (3): 409–417. doi: 10.1111/j.1365-2141.2005.05616.x.
12. Airaghi L, Usardi P, Forti S et al. A comparison between metabolic syndrome post-hematopoietic stem cell transplantation and spontaneously occurring metabolic syndrome. J Endocrinol Invest 2011; 34 (1): 6–11. doi: 10.1007/BF03346702.
13. Galajda P, Mokáň M, Prídavková D et al. Prevalencia metabolického syndrómu na Slovensku. Interná Med. 2007; 7 (6): 325–331.
14. Miláček D, Volkovová K, Gajdoš M et al. A considerable proportion of metabolic syndrome-free adults from Bratislava Region, Slovakia, display an increased cardiometabolic burden. Can J Physiol Pharmacol 2021; 99 (9): 974–982. doi: 10.1139/cjpp-2020-0707.
15. Coronary heart disease risk calculator. [online]. Available from: http: //www.medcalc.com /heartrisk.html.
16. Guner Ozenen G, Aksoylar S, Goksen D et al. Metabolic syndrome and risk factors after hematopoietic stem cell transplantation in children and adolescents. J Pediatr Endocrinol Metab 2021; 34 (4): 485–493. doi: 10.1515/jpem-2020-0584.
17. Bielorai B, Weintraub Y, Hutt D et al. The metabolic syndrome and its components in pediatric survivors of allogeneic hematopoietic stem cell transplantation. Clin Transplant 2017; 31 (3). doi: 10.1111/ctr.12903.
18. Chow EJ, Simmons JH, Roth CL et al. Increased cardiometabolic traits in pediatric survivors of acute lymphoblastic leukemia treated with total body irradiation. Biol Blood Marrow Transplant 2010; 16 (12): 1674–1681. doi: 10.1016/j.bbmt.2010.05.016.
19. Oudin C, Simeoni MC, Sirvent N et al. Prevalence and risk factors of the metabolic syndrome in adult survivors of childhood leukemia. Blood 2011; 117 (17): 4442–4448. doi: 10.1182/blood-2010-09-304899.
20. Armenian SH, Sun CL, Vase T et al. Cardiovascular risk factors in hematopoietic cell transplantation survivors: role in development of subsequent cardiovascular disease. Blood 2012; 120 (23): 4505–4512. doi: 10.1182/blood-2012-06-437178.
21. Jurkovičová J. Hodnotenie celkového kardiovaskulárneho rizika. In: Jurkovičová J. Vieme zdravo žiť? Bratislava: Lekárska fakulta Univerzity Komenského 2005 : 137–150.
22. Majhail NS, Rizzo JD, Lee SJ. Recommended screening and preventive practices in long-term survivors after hematopoietic stem cell transplantation. Biol Blood Marrow Transplant 2012; 18 (3): 348–371. doi: 10.1016/ j.bbmt.2011.12.519.
23. Polgreen LE, Thomas W, Macmillan ML et al. First phase insulin release and glucose tolerance in children with fanconi anemia after hematopoietic cell transplantation. Pediatr Blood Cancer 2009; 53 (2): 191–196. doi: 10.1002/pbc.22043.
Labels
Paediatric clinical oncology Surgery Clinical oncology
Article was published inClinical Oncology

2022 Issue 2-
All articles in this issue
- Předsednictví Francie a České republiky v Radě Evropské unie – informace k významným akcím v oblasti onkologie
- Akupunktura z pohledu medicíny založené na důkazech – možnosti klinického využití na podkladě doporučení National Comprehensive Cancer Network (NCCN)
- Hepatocelulární karcinom – prognostická kritéria individualizované léčby
- Rehabilitácia a pohybová aktivita pri gynekologických onkologických ochoreniach
- Radioterapie a radiosenzitivní syndromy u mutací genů reparace DNA
- Koherencí řízená holografická mikroskopie – nástroj pro hledání nových biomarkerů dlaždicobuněčného karcinomu hlavy a krku
- Metabolický syndróm u pacientov po alogénnej transplantácii kmeňových krvotvorných buniek
- Kombinovaná chemoradioterapie karcinomu hrdla děložního – retrospektivní hodnocení vlastního souboru
- Aktuality z odborného tisku
- Informace z České onkologické společnosti
- Pozdní nástup plicní a srdeční toxicity u pacienta léčeného checkpoint inhibitorem v monoterapii
- Ruptura podklíčkové tepny hrozící po chemoradioterapii
- Clinical Oncology
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Akupunktura z pohledu medicíny založené na důkazech – možnosti klinického využití na podkladě doporučení National Comprehensive Cancer Network (NCCN)
- Radioterapie a radiosenzitivní syndromy u mutací genů reparace DNA
- Hepatocelulární karcinom – prognostická kritéria individualizované léčby
- Rehabilitácia a pohybová aktivita pri gynekologických onkologických ochoreniach
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

