-
Medical journals
- Career
Rádiobiologické aspekty reožarovania a ich modelovanie pri stanovení tolerančnej dávky u orgánov v riziku
Authors: P. Matula; J. Končik; M. Jasenčak; P. Dubinský
Published in: Klin Onkol 2020; 33(Suppl 1): 31-37
Category: Review
doi: https://doi.org/10.14735/amko2020S31Overview
Východiská: Reožarovanie, v kombinácii so systémovou a biologickou liečbou, sa v súčasnosti stáva významnou opciou pre recidivujúce tumory a „in-field“ sekundárne malignity, pokiaľ je chirurgia kontraindikovaná. Rozvoj zobrazovacích metód a nových ožarovacích techník v rádioterapii vytvorili priestor pre vývoj a aplikáciu presnejších postupov reožarovania s využitím rádiobiologického modelovania účinkov v režimoch hypofrakcionácie a jej extrémneho módu – stereotaxie. Normálne tkanivá a orgány po rádioterapii dokážu regenerovať a opraviť svoje poškodenie. Zvyšková tolerančná dávka orgánov v riziku (OaR) je však značne rozdielna. Pri tkanivách so skorou odpoveďou dochádza temer ku kompletnej obnove v priebehu niekoľkých mesiacov, takže druhá séria ožiarenia by mohla byť aplikovaná skoro v rovnakej výške dávky. Pre tkanivá a orgány s neskorou odpoveďou rozsah poškodenia závisí na výške celkovej dávky z ožiarenia, štruktúre funkčných subjednotiek a na intervale medzi sériami. Výrazná obnova prebieha do 3–6 mesiacov u kože, sliznice, miechy a pľúc. Iné tkanivá, napr. obličky, srdce, mechúr, disponujú len malou regeneračnou kapacitou.
Cieľ: Príspevok, fokusovaný na reožarovanie, poskytuje prehľad o hodnotách kumulatívnej biologickej efektívnej dávky (BEDcum) jednotlivých orgánov v riziku (OaR) extirpovaných z retrospektívnych štúdii, metodike stanovenia reziduálnych dávok s popisom pôvodného modelu autorov príspevku zapracovaného do výpočtu pravdepodobnosti komplikácií normálnych tkanív (normal tissue complication probability – NTCP) pri individuálnych ožarovacích plánoch reožarovania pomocou programu „BioGray“ vyvinutom na pracovisku autorov.
Klíčová slova:
reožarovanie – kumulatívna BED – model REG pre zvyškovú tolerančnú dávku OaR pri reožarovaní – NTCP – SW BioGray
Úvod
Problematika reožarovania v prípadoch relapsu nádorového ochorenia či „infield“ sekundárnych malignít predstavuje podstatne náročnejší proces rozhodovania v posúdení jeho benefitu vs. rizika pre pacienta v porovnaní s procesom pri iniciálnej rádioterapii. Retrospektívne štúdie síce poskytujú odhad prípustných kumulatívnych dávok na OaR, neposkytujú však algoritmy a metódy pre stanovenie zvyškovej (dodatkovej) tolerančnej dávky v zložitých individuálnych klinických situáciách reožarovania.
Panely expertov v článkoch [3,7] pocielených multi-institucionálnych prieskumoch manažmentu postupov reožarovania u tumorov hlavy a krku i u extrakranialnych tumorov dospeli k záveru, že súčasný stav je charakterizovaný:
- vysokou heterogenitou postupov reožarovania medzi inštitúciami
- nedostatočnou databázou poznatkov z retrospektívnych štúdii
- kritickým výberom pacientov na reožarovanie.
Skupiny expertov z uvedených prehľadov odporučili dodržiavanie nasledovných podmienok pre indikáciu reožarovania:
- kontraindikácie chirurgie!
- priaznivá lokalizácia recidívy resp. sekundárneho tumoru
- reožarovanie s kuratívnym zámerom vyžaduje ekvivalentnú biologickú dávku EQD2 ≥ 60 Gy a malo by byť spojené s chemoterapiou (zahrňujúcou biologickú liečbu)
- realistické možnosti minimalizácie dávky v OaR
- dostatočný interval od iniciálnej RT ≥ 6 mesiacov
- dobre definovateľný objem recidívy resp. sekundárneho tumoru (klinický cieľový objem – CTV)
- využitie dokonalejších terapeutických technológií a režimov hypofrakcionácie: rádioterapia s modulovanou intenzitou (IMRT), objemovo modulovaná oblúková rádioterapia (VMAT), stereotaktická rádiochirurgia (SRS) a frakcionovaná stereotaktická rádiochirurgia (FSRT).
V kontexte s týmito odporúčaniami, stanovenie akceptovateľného plánu pre 2. sériu s paliatívnym či kuratívnym zámerom je vlastne riešením multiparametrickej funkcie pravdepodobnosti komplikácií normálnych tkanív (normal tissue complication probability – NTCP) s parametrami:
NTCP = F (BED1, DVH1, REGpauza, BED2, DVH2) (1)
kde DVH1 a DVH2 sú dávkovo-objemové histogramy dostupné z plánovacieho systému (TPS); BED1 a BED2 sú biologicky efektívne dávky v 1. a 2. sérii; REGpauza je funkcia regenerácie OaR = F (X), ktorá bude popísaná nižšie.
Riešenie tejto komplexnej úlohy vyžaduje kvantitatívne zahrnutie a simultánne posúdenie uvedených parametrov nielen z plánovacieho systému (TPS), ale i použitie vhodného softwaru pre rádiobiologické modelovanie BED/ (EQD2) a dvoch bioštatistických mier: pravdepodobnosť lokálnej kontroly nádoru (tumor control probability –TCP) /normal tissue complication probability (NTCP). Takýto nástroj v súčasnosti, žiaľ, nie je štandardným vybavením rádioterapeutických pracovísk.
Cieľom príspevku je poskytnúť:
- tabuľkový prehľad o reziduálnych tolerančných dávkach v EQD2 pre vybrané OaR stanovených z retrospektívnych štúdií reožarovania
- popis analytického modelu REGpause pre výpočet reziduálnej tolerančnej dávky na OaR
- ukážky výstupov z programu BioGray pri rôznych klinických scenároch reožarovania.
Materiál a metodika
Z retrospektívnych štúdií [2,6–9,11,12] bolo zistené, že regenerácia tkanív a orgánov v riziku (OaR) s neskorou odpoveďou umožňuje aplikáciu 2. série do úrovne 50–80 % biologicky efektívnej dávky (BED) vo vzťahu k iniciálnemu ožiareniu. To znamená, pokiaľ hladina tolerancie orgánu v 1. sérii už dosiahla hranicu akceptovateľnej tolerancie, v 2. sérii môžu OaR tolerovať kumulatívnu dávku BED v hodnotách 150–180 % iniciálnej dávky. V situácii, že orgán v 1. sérii bol ožiarený len na úrovni napr. 50 % svojej tolerancie, v 2. sérii možno aplikovať dávku podstatne vyššiu (o vypočítaný rozdiel nedosiahnutej hladiny tolerancie). Významnú úlohu zohráva tiež volumová závislosť tolerancie OaR pri reožarovaní a interval medzi iniciálnou rádioterapiou a reožarovaním. Regenerácia OaR je prevažne saturovaná do 2 rokov [2,9]. Pre odhad resp. stanovenie zvyškovej tolerancie OaR navrhla F. Stewart [12] koncept tzv. „kumulatívnej percentuálnej dávky” (%BEDcum), ktorý možno vyjadriť vzťahom (2):
%BEDcum = %BEDI séria + %BEDretr.
Grafické zobrazenie vzťahu %BEDretr. vs. %BED1.seria pre štyri vybrané tkanivá (koža, pľúca, miecha a obličky) je demonštrovaný na obr. 1.
Image 1. Demonštrácia pojmov %BED 2. séria vs. %BED 1. séria pre štyri tkanivá. Súradnica X určuje veľkosť iniciálnej dávky v percentách tolerančnej dávky na príslušný orgán, súradnica Y určuje dávku v percentách pri reožarovaní, prerušovaná priamka predstavuje hladinu tolerancie pri hypotetickej – nulovej regenerácii tkaniva. Body nad prerušovanou čiarou predstavujú úspešné výsledky reožarovania, body pod prerušovanou čiarou predstavujú výsledky nedostatočnej regeneračnej kapacity orgánu (obličky) [12]. ![Demonštrácia pojmov %BED 2. séria vs. %BED 1. séria pre štyri tkanivá. Súradnica X určuje veľkosť iniciálnej dávky v percentách tolerančnej dávky na príslušný orgán, súradnica Y určuje dávku v percentách pri reožarovaní, prerušovaná priamka predstavuje hladinu tolerancie pri hypotetickej – nulovej regenerácii tkaniva. Body nad prerušovanou čiarou predstavujú úspešné výsledky reožarovania, body pod prerušovanou čiarou predstavujú výsledky nedostatočnej regeneračnej kapacity orgánu (obličky) [12].](https://www.prolekare.cz/media/cache/resolve/media_object_image_small/media/image_pdf/f22e7f3e1de540cf9f2785dd00f96443.png)
BED – biologicky efektívna dávka, kidney – obličky, lung – pľúca, skin – koža, spinal cord – miecha Rádiobiologická veličina BED sa častejšie vyjadruje v termíne normalizovanej totálnej dávky (NTD) alebo ekvivalentnej biologickej dávky (EQD2) vzťahovanej ku konvenčnej frakcionácii s dávkou na frakciu = 2 Gy denne definovanej vzťahom (3):
kde RE vyjadruje relatívnu efektívnosť novej frakcionácie v tvare: RE = (1 + dnew/ (α/β)) Nnew = počet frakcii, dnew = dávka/frakciu, α/β = koeficient radiosenzibility.
Z retrospektívnej štúdie [6] venovanej reožarovaniu mozgu pri 3 terapeutických modalitách – konformálnej externej terapii (CRT), stereotaktickej chirurgie (SRS) a frakcionovanej stereoradioterapie (FSRT) boli získané dáta o výške tolerovateľnej kumulatívnej dávky vyjadrenej v EQD2, ktoré neviedli k rádionekrózam mozgu.
Výsledky sú zhrnuté v tab. 1.
Table 1. Výsledky retrospektívnej analýzy tolerancie mozgu pri reožarovaní. 
CRT – konformálna rádioterapia, EQD – ekvivalentná biologická dávka, FSRT – frakcionovaná stereoradioterapia, RT – rádioterapia, SRS – stereotaktická chirurgia Uvedená retrospektívna analýza poskytla ešte dva ďalšie významné závery:
- od intervalu > 1 rok neexistuje korelácia výskytu rádionekróz a intervalom medzi iniciálnou rádioterapiou a 2. sériou – reožarovaním;
- existuje štatisticky významná korelácia medzi výskytom rádionekróz a ožarovaným objemom mozgu (p = 0,016).
V práci [11] venovanej retrospektívnej analýze reožarovaní miechy boli získané nasledovné závery:
- prípustná cumEQD2 ≥ 60 Gy (cum %EQD2 ≤ 140 %);
- nebola zistená signifikantná korelácia radiačných myelitíd pri intervale > 1 rok.
V práci [2] boli sumarizované akceptovateľné kumulatívne dávky pre ďalšie OaR, ktoré sme, pre potrebu konzistencie s terminológiou v tab. 1 a prehľadnosti v nasledujúcich tabuľkách, konvertovali do hodnôt EQD2.
V tab. 2 sú uvedené reziduálne tolerančné dávky EQD2 pre OaR v oblasti hlavy a krku a v tab. 3 pre extrakraniálnu oblasť.
Table 2. Kumulatívne a reziduálne tolerančné dávky EQD2 pre oblasť hlavy a krku. 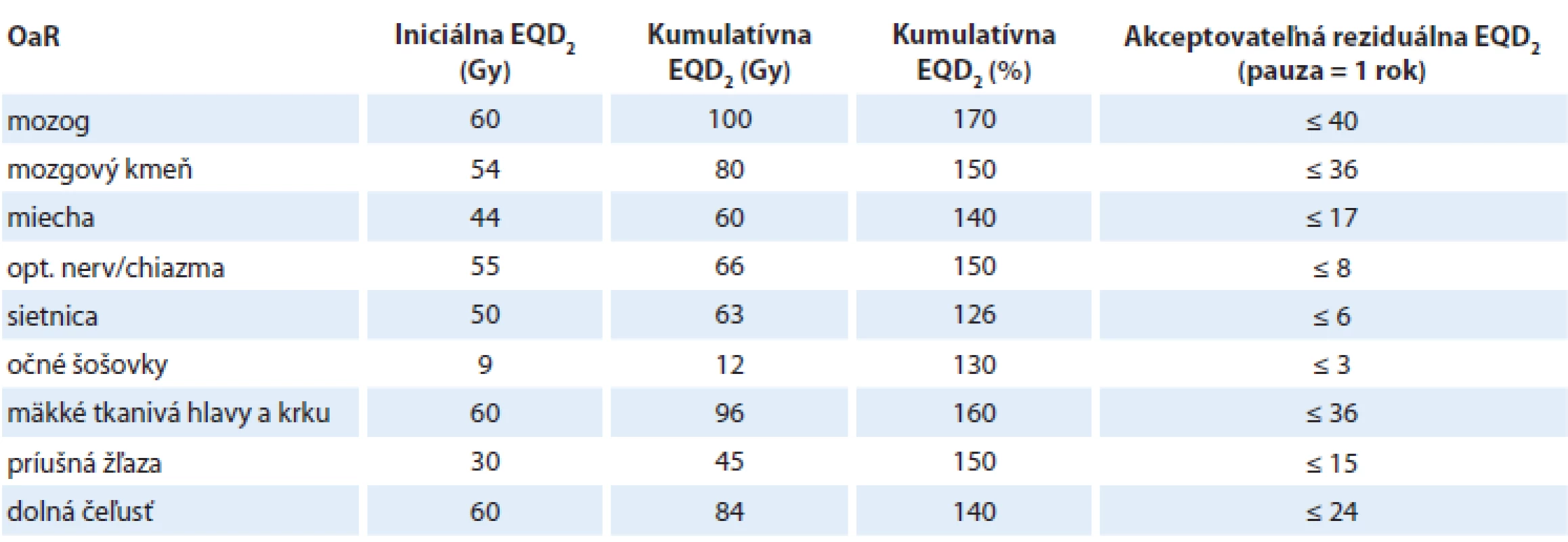
EQD – ekvivalentná biologická dávka Table 3. Kumulatívne a reziduálne dávky EQD2 pre OaR v extrakraniálnej oblasti. 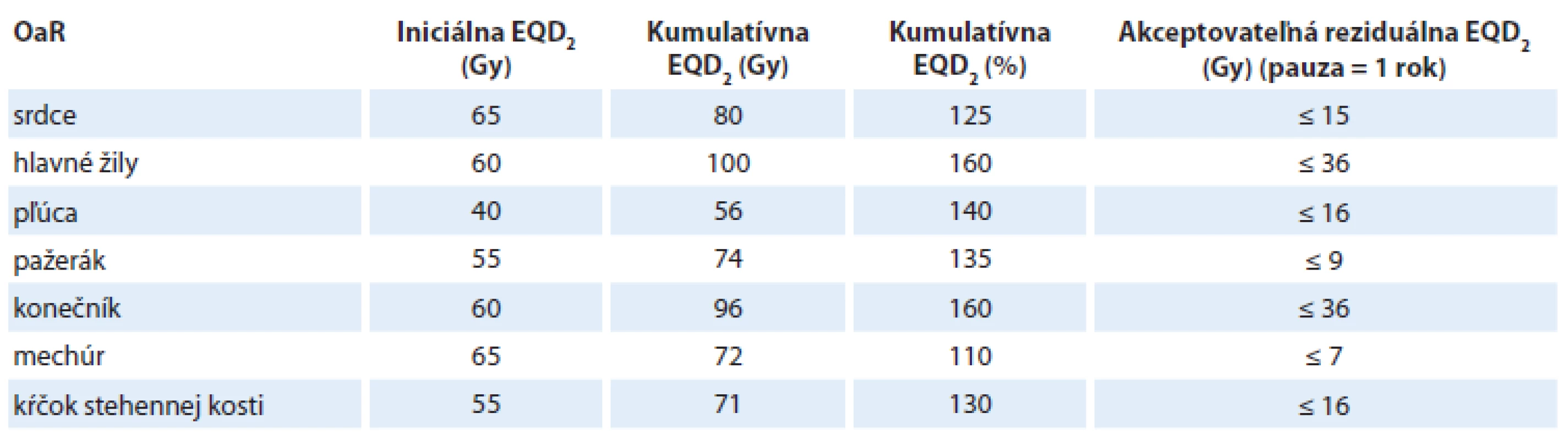
EQD – ekvivalentná biologická dávka Je potrebné poznamenať a zdôrazniť, že odhad tolerančných reziduálnych dávok v poslednom stĺpci tabuliek 2 a 3 predstavuje len prvú hrubú aproximáciu vzťahovanú na nasledovné podmienky:
- iniciálna séria RT bola aplikovaná na hranici tolerančnej dávky OaR (stĺpec 2);
- je stanovená k pauze medzi sériami = 1 rok;
- nezahrňuje variabilitu tolerancie OaR v závislosti od ožiareného objemu OaR.
Z uvedeného vyplýva, že reziduálne tolerančné dávky môžu byť výrazne vyššie pri nižšej dávkovo-volumovej záťaži OaR (z DVH) v iniciálnej sérii, ale aj v sérii reožarovania. Tieto závislosti možno komplexne riešiť len pomocou vhodného softwaru zahrnujúceho reálne údaje z DVH plánovacích systémov (TPS), výpočtov EQD2 a reálnej pauzy medzi sériami.
S využitím extirpovaných dát z retrospektívnych štúdii zhrnutých v tab. 2 a 3 o akceptovateľných kumulatívnych EQD2 sme sa pokúsili vytvoriť analytický model, ktorý by umožnil výpočet zvyškovej tolerančnej dávky a simulovať predikciu NTCP v konkrétnych klinických prípadoch.
Metodika výpočtu reziduálnej tolerančnej dávky
Obnova u OaR s neskorou odpoveďou začína po 7–8 týždňoch od začiatku rádioterapie a končí prevažne po 2 rokoch. Tento proces regenerácie tkaniva však nie je lineárny. Autori príspevku preto navrhli analytický model, ktorý nahradzuje lineárny priebeh regenerácie tkanív sigmoidálnou krivkou vyjadrenou Poissonovou funkciou v tvare (4):
x = počet dní pauzy medzi iniciálnou sériou a sériou reožarovania; λ = d (inf) = 10,2 Gy = dávka v inflexnom bode sigmoidálnej krivky v (Gy).
Fitovaním konštanty λ modelu REG (pauza) = F (x) pre miechu sme z retrospektívnych dát [10,11] stanovili hodnotu λ =10,2 Gy pri pauze 230 dní. Model takto umožňuje odhad zvyškovej tolerančnej dávky pre ľubovoľný časový interval medzi iniciálnou sériou a reožarovaním.
Rovnakým postupom ako bolo popísané pre miechu, boli vyfitované parametre Poissonovej funkcie F (x) pre zvyškové tolerančné dávky ostatných OaR uvedených v tab. 2 a 3. Tieto dáta budú postupne spresňované z nových klinických dát retrospektívnych štúdií. Algoritmus výpočtu pomocou modelu REGpause je implementovaný do programu BioGray [4] a v interaktívnom dialógu (zmenou počtu frakcii resp. d/frakciu, pauza) možno simulovať rôzne scenáre pre optimálny plán reožarovania.
Výsledky
Použitie navrhnutého modelu REGpause pre stanovenie zvyškovej tolerancie pri reožarovaní je demonštrované na príklade reožarovania pacienta s karcinómom laryngis. Pacient absolvoval primárnu liečbu s TD = 70 Gy v 35F/2Gy. Po 23 mesiacov došlo k indikácii sekundárnej malignity s lokalizáciou CTV posunutého kraniálne o 3–3,5 cm. Plán reožarovania spočíval v RT technikou IMRT s kuratívnym zámerom TD = 70 Gy v 35F/2 Gy.
Na obr. 2 sú ukázané izodózové plány s CTV aplikované v 1. sérii v r. 2015 a v 2 sérii. 2017. Z obrázku je zrejmé, že CTV sekundárnej malignity je posunuté kraniálne o 3–3,5 cm, pri ktorom v ožarovacom pláne už dochádza k minimálnemu zaťaženiu miechy pri reožarovaní. Na obr. 3 je výstup z SW BioGray pre reálny scenár 1. a 2. série s odlišnou polohou CTV v 2. sérii. Na obr. 4 je výstup pre hypotetický scenár – s rovnakou polohou CTV v oboch sériách.
Image 2. Izodózové plány v laterálnej rovine z iniciálnej série v r. 2015 a reožarovania v r. 2017. 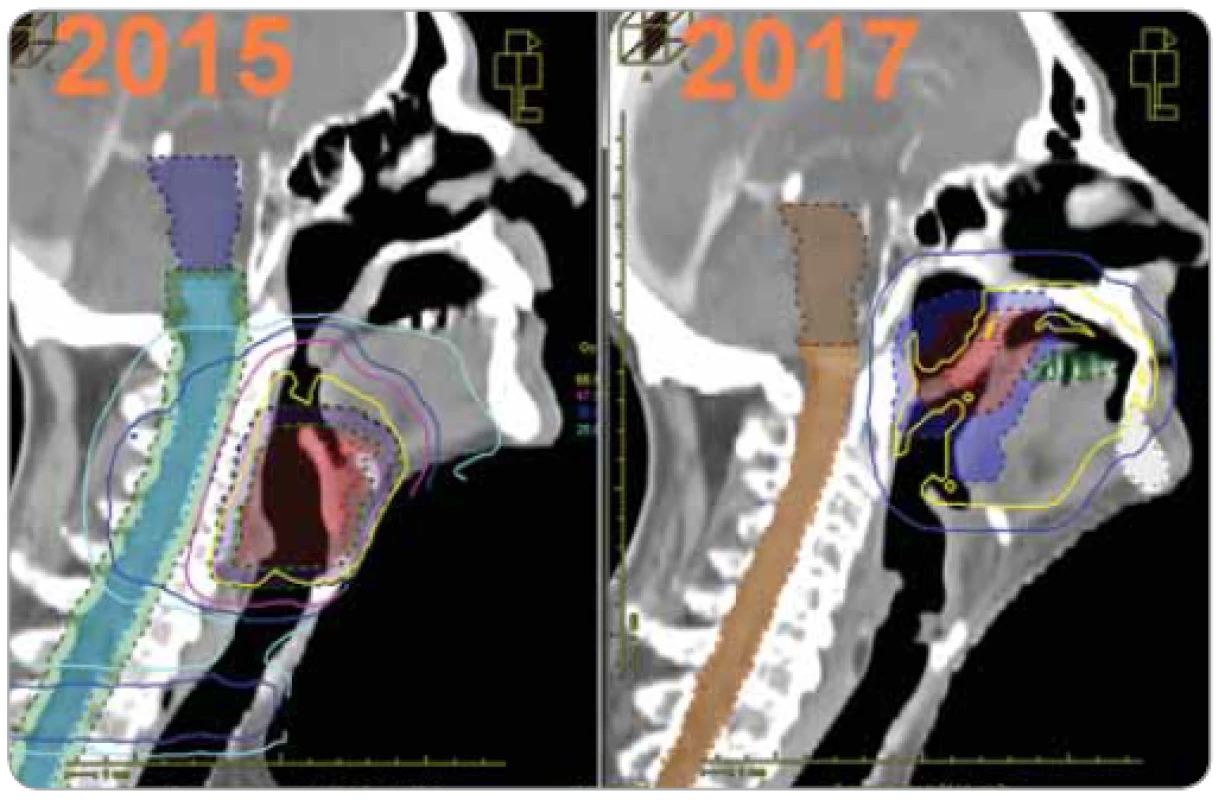
Z obrázku je zrejmé, že klinický cieľový objem sekundárnej malignity je posunutý kraniálne o 3–3,5 cm, pri ktorom v ožarovacom pláne už dochádza k minimálnemu zaťaženiu miechy pri reožarovaní. Image 3. Grafické zobrazenie TCP a NTCP pri reálnom scenári – rozdielnych CTV v prvej a druhej sérii. NTCP so zahrnutím regenerácie = 0,3 %, pri nezahrnutí = 26 % [4]. ![Grafické zobrazenie TCP a NTCP pri reálnom scenári – rozdielnych CTV v prvej a druhej sérii. NTCP so zahrnutím regenerácie = 0,3 %, pri nezahrnutí = 26 % [4].](https://www.prolekare.cz/media/cache/resolve/media_object_image_small/media/image_pdf/5018eb7be92cfcd95142cbc666adbcf7.png)
brain stem – mozgový kmeň, CTV – klinický cieľový objem, DVH – dávkovo-objemový histogram, larynx – hrtan, LKB – Lyman-Kutcher-Burmanov model, NTCP – pravdepodobnosť komplikácií normálnych tkanív, spinal cord – miecha, TCP – pravdepodobnosť kontroly nádoru Image 4. Výstup z SW BioGray pre hypotetický scenár totožných CTV v prvej a druhej sérii. NTCP (miecha) pri zahrnutí regenerácie = 33 %, pri nezahrnutí 100 %. 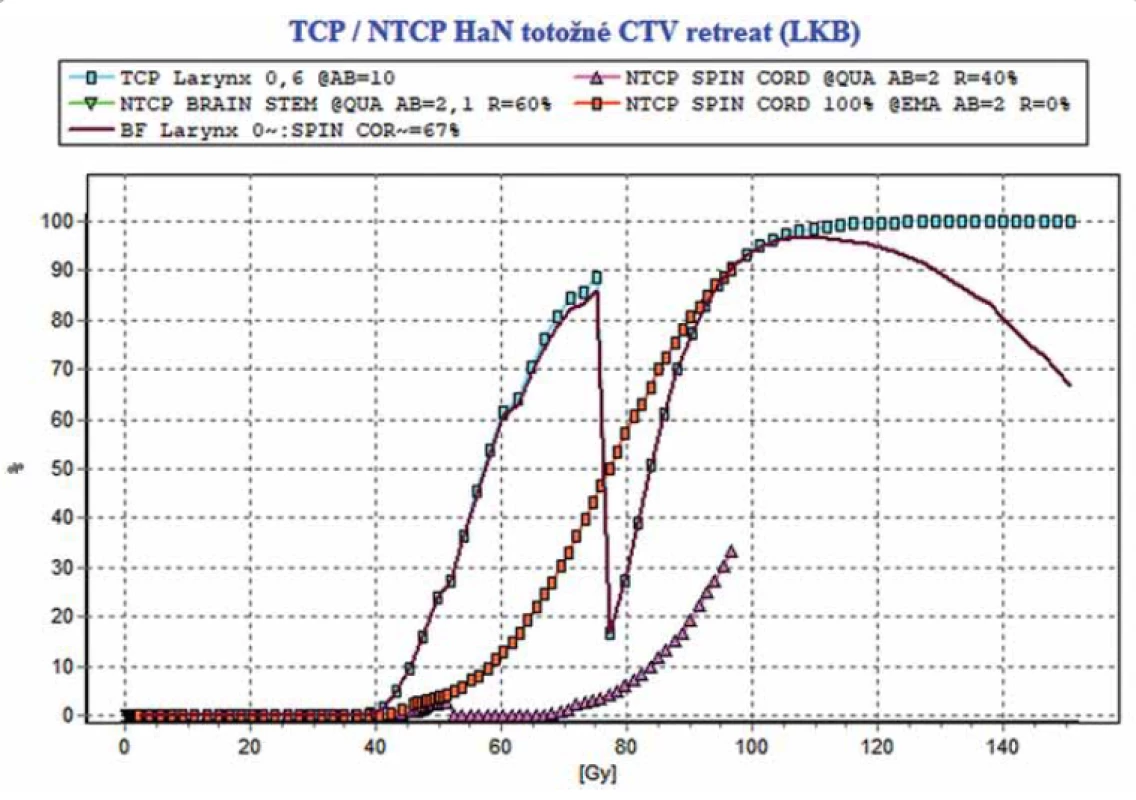
brain stem – mozgový kmeň, CTV – klinický cieľový objem, Cum EQD2 – kumulatívna ekvivalentná biologická dávka, DVH – dávkovo-objemový histogram, larynx – hrtan, LKB – Lyman-Kutcher-Burmanov model, NTCP – pravdepodobnosť komplikácií normálnych tkanív, spinal cord – miecha, TCP – pravdepodobnosť kontroly nádoru, TD – celková dávka Na oboch obrázkoch č. 3 a 4 – výstupoch z programu BioGray sú súčasne zobrazené i krivky NTCP odpovedajúce hypotetickej situácii, pri ktorej by miecha nedisponovala žiadnou regeneračnou kapacitou. V reálnom scenári – rozdielnych CTV by NTCP so zahrnutím regenerácie bolo = 0,3 %, bez zahrnutia regenerácie = 26 %, Pri totožných CTV by NTCP so zahrnutím regenerácie bolo = 33 % a bez zahrnutia regenerácie = 100 %. Tieto výsledky demonštrujú kľúčový význam potreby získania detailných podkladov o polohách CTV v 1. a 2. sérii a ich dopadu na možné prekročenie tolerancie OaR.
V prvom – reálnom prípade (rozdielnej polohy CTV) miecha v 2. sérii bola ožiarená nízkou dávkou (9 Gy), čo umožnilo aplikovať reožarovanie s kuratívnym zámerom.
V druhom – hypotetickom – scenári pri rovnakých CTV by požadovaný ožarovací plán viedol k neakceptovateľnej vysokej dávke na miechu, čo by spôsobilo fatálne prekročenie tolerancie miechy EQD2 = 66 Gy a NTCP = 33,0 %.
Diskusia
Súčasná databáza poznatkov o reožarovaní je stále nedostatočná. Chýbajú práce s detailnejším popisom manažmentu reožarovania so zahrnutím dostupných rádiobiologických poznatkov. Medzinárodné odporúčania nezahrnujú poznatkovú databázu z pozorovaných výstupov akceptovaných kumulatívnych BED. Príspevok je pokusom kvantitatívne posúdiť zložité vzťahy v procese reožarovania s využitím dávkovo-volumovej štatistiky, využitia matematických modelov pre popis procesu regenerácie OaR a ich implementáciu do výpočtu NTCP. Využitie metodiky rádiobiologického modelovania by mohlo viesť k posunu od paradigma verbalizmu v manažmente reožarovania ku kvantitatívnemu hodnoteniu týchto procesov a poznatkov z translačného výskumu prepojeného so súčasnými technologickými možnosťami aplikácie reožarovania technikami IMRT, VMAT, SRS a FSRT.
Záver
Kvantifikácia reziduálnych tolerančných dávok na OaR z retrospektívnych štúdií a implementácia navrhnutého modelu REGpauza, popisujúceho časovú závislosť regenerácie OaR po iniciálnej rádioterapii a využívajúceho dávkovo-volumovú dokumentáciu z TPS, otvára možnosti podrobnej rádiobiologickej analýzy a simulácie rôznych scenárov v procese rozhodovania pri reožarovaní. Tento model a postup je v súčasnosti zabudovaný do opcii programu BioGray a stal sa dostupným pre jeho užívateľov. Zvýrazňuje sa nutnosť ďalšieho cieleného výskumu v manažmente reožarovania s využitím nástrojov, ktoré môže poskytovať – a už v súčasnosti poskytuje – „kráľovná vied“ matematika v rôznych odboroch medicíny, vrátane radiačnej onkológie.
Sources
1. Dale RG, Jones B. Radiobiological modelling in radiation oncology. [online]. Available from: https: //doi.org/10.1259/9780905749839.
2. Das S, Patro KC, Mukherji A. Recovery and tolerance of the organs at risk during re-radiation. [online]. Available from: http: //www.journalofcurrentoncology.org/article.asp?issn=2589-8892; year=2018; volume=1; issue=1; spage=23; epage=28; aulast=Das
3. Krauze AV, Attia A, Braunstein S et al. Expert consensus on reiradiation for recurrent glioma. Radiat Oncol 2017; 12 (1): 194. doi: 10.1186/s13014-017-0928-3.
4. Matula P. Contribution of simultaneous modelling radiobiological effects in radiation oncology. Habilitation work: Universitis Trnaviensis 2009.
5. Matula P, Končík J. Key to radiobiological modelling effects in radiation oncology. Lambert Academic Publishing 2018.
6. Mayer R, Sminia P. Reirradiation tolerance of the human brain. Int J Radiat Oncol Biol Phys 2008; 70 : 1350–1360. doi: 10.1016/j.ijrobp.2007.08.015.
7. McDonald MW, Lawson J, Garg MK et al. ACR appropriateness criteria retreatment of recurrent head and neck cancer after prior definitive radiation: expert panel on radiation oncology – head and neck cancer. Int J Radiat Oncol Biol Phys 2011; 80 (5): 1292–1298. doi: 10.1016/j.ijrobp.2011.02.014.
8. Kim MS, Kim W, Park IH et al. Radiobiological mechanisms of stereotactic body radiation therapy and stereotactic radiation surgery. Radiat Oncol J 2015; 33 (4): 265–275. doi: 10.3857/roj.2015.33.4.265.
9. Nieder C. Second re-irradiation. A delicate balance between safety and efficacy. Phys Med 2019; 58 : 155–158. doi: 10.1016/j.ejmp.2019.01.004.
10. Oinam SA, Singh L, Shukla A et al. Dose Volume Histogram analysis and comparison of different radiobiological models using in-house developed software. J Med Phys 2011; 36 (4): 220–229. doi: 10.4103/0971-6203.89971.
11. Sminia P, Oldenburger F, Slotman BJ et al. Re-irradiaton of human spinal cord. Strahlenther Onkol 2002; 178 (8): 453–456. doi: 10.1007/s00066-002-0948-1.
12. Stewart FA. Retreatment tolerance of normal tissues. In: Steel G. Basic Clinical Radiobiology. 3rd ed. London: ARNOLD Publishers 2006.
Labels
Paediatric clinical oncology Surgery Clinical oncology
Article was published inClinical Oncology

2020 Issue Suppl 1-
All articles in this issue
- Onkologie využívá paprsky X už 125 let…
- Ozařování pacientů s implantovanými elektronickými přístroji
- Genová terapie v radiační onkologii
- Prostorová analýza recidiv glioblastomů v závislost na taktice adjuvantní radioterapie (stanovení cílových objemů dle RTOG vs. EORTC): představení akademické studie
- Výživa během radioterapie u onkologických pacientů
- Rádiobiologické aspekty reožarovania a ich modelovanie pri stanovení tolerančnej dávky u orgánov v riziku
- Postavení radioterapie v léčbě karcinomu
- Sekundární nádory a radioterapie
- Strava a její vliv na karcinom prostaty, se zaměřením na rostlinnou stravu
- Cyberknife boost 5–10 Gy u lokálně pokročilých karcinomů nazofaryngu
- TSEI u pacientů s mycosis fungoides – klinické výsledky
- Hypofrakcionovaná akcelerovaná radioterapie karcinomu prostaty
- Clinical Oncology
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Sekundární nádory a radioterapie
- Výživa během radioterapie u onkologických pacientů
- Strava a její vliv na karcinom prostaty, se zaměřením na rostlinnou stravu
- TSEI u pacientů s mycosis fungoides – klinické výsledky
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career



