-
Medical journals
- Career
HPV 16 v patogenéze nádorov horného aerodigestívneho traktu
Authors: Barbora Uhliarová 1; Michal Smitka 2
Authors‘ workplace: Oddelenie otorinolaryngológie, Fakultná nemocnica s poliklinikou F. D. Roosevelta, Banská Bystrica, Slovenská republika 2 Martinské bioptické centrum, s. r. o., Banská Bystrica, Slovenská republika 1
Published in: Klin Onkol 2020; 33(2): 132-137
Category: Original Articles
doi: https://doi.org/10.14735/amko2020132Overview
Úvod: Ľudský papilomavírus (human papillomavirus – HPV) je celosvetovo najrozšírenejšie pohlavne prenosné ochorenie. V etiopatogenéze karcinómov hlavy a krku, predovšetkým orofaryngu, sa v posledných rokoch pripisuje významná úloha aj HPV infekcii.
Materiál a metodika: Prospektívna štúdia 236 pacientov so skvamocelulárnym karcinómom (squamous cell carcinoma – SCC) horného aerodigestívneho traktu (dutina ústna, orofarynx, hypofarynx, larynx). Sledovali sme výskyt p16 pozitivity v nádorovom tkanive a súvislosť k lokalizácii, výskytu rizikových faktorov (fajčenie, alkohol, sexuálne správanie), histopatologickému nálezu a štádiu ochorenia.
Výsledky: Fajčenie a pravidelnú konzumáciu alkoholu sme zaznamenali u 72 % pacientov so SCC horného aerodigestívneho traktu. Rizikové sexuálne správanie bolo prítomné iba v skupine pacientov s SCC orofaryngu (42 %). Na základe imunohistochemického vyšetrenia sme p16 detegovali v 20 % nádorov horného aerodigestívneho traktu, najčastejšie v resekátoch z orofaryngu (30 %). Pacienti s p16 pozitívnym SCC orofaryngu boli mladší, rizikové sexuálne správanie priznalo 94 % z nich. Fajčenie a pravidelná konzumácia alkoholu sa častejšie vyskytovali u pacientov s p16 negatívnym SCC orofaryngu (90 %).
Záver: Infekcia HPV 16 má vplyv prioritne na vznik karcinómu orofaryngu. V ostatných lokalizáciách horného aerodigestívneho traktu je hlavným rizikovým faktorom fajčenie a nadmerné užívanie alkoholu. Stanovenie HPV v nádorovom tkanive z orofaryngu je neoddeliteľnou súčasťou histopatologického vyšetrenia. Imunohistochemické vyšetrenie expresie proteínu p16 v nádorovom tkanive predstavuje dostačujúcu metódu na stratifikáciu pacientov do HPV pozitívnej/negatívnej skupiny karcinómov orofaryngu.
Klíčová slova:
karcinómy hlavy a krku – orofaryngeálny karcinóm – etiopatogenéza – HPV infekcia – rizikové faktory
Úvod
Infekcia ľudským papilomavírusom (human papillomavirus – HPV) je celosvetovo najrozšírenejšie pohlavne prenosné ochorenie. HPV sú malé DNA vírusy, ktoré postihujú obe pohlavia. Doteraz bolo identifikovaných približne 120 genotypov. Podľa onkogénneho potenciálu sa HPV delia na dve skupiny – vysoko rizikové (high-risk – HR) a nízko rizikové (low-risk – LR). Z HR HPV ide predovšetkým o HPV 16 a 18, ktoré spôsobujú malígne nádory urogenitálnej oblasti (krčok maternice, vulva, vagína, konečník, penis). Z LR HPV sa najčastejšie identifikuje typ 6 a 11, ktorý spôsobuje kožné a genitálne bradavice ako aj papilómy slizníc. V hornom aerodigestívnom trakte sa uplatňujú podobné typy HPV ako v urogenitálnej oblasti [1,2].
HPV spolu s Helicobacter pylori a vírusmi hepatitídy B a C patria k najčastejším infekčným príčinám malignít. Odhaduje sa, že v dôsledku HPV infekcie vzniká celosvetovo asi 5 % malignít. Z celkového množstva 12,8 miliónov nových karcinómov na svete v roku 2008 asi 700 000 vzniklo v lokalizáciách, ktoré sú spájané s HPV asociovanými karcinómami a 610 000 ich skutočne vzniklo v dôsledku HPV infekcie [2].
Aj keď ide o tumory s blízkou anatomickou lokalizáciou, nádory hlavy a krku predstavujú heterogénnu skupinu nádorov. V klinickej praxi, vrátane klinických štúdií, termín „nádory hlavy a krku“ označuje nádory horného aerodigestívneho traktu, tj. pery a dutiny ústnej, orofaryngu, hypofaryngu a laryngu. Histologicky vo > 90 % prípadov ide o skvamocelulárne karcinómy (squamous cell carcinoma – SCC). Osobitne sa vyčleňujú nádory nosohltana, nosovej dutiny, prinosových dutín a slinných žliaz, ktoré sa svojou incidenciou zaraďujú medzi zriedkavé nádory tejto oblasti. Etiológia, histopatológia aj liečba týchto nádorov sa odlišujú od „klasickej skupiny nádorov hlavy a krku“.
SCC horného aerodigestívneho traktu tvoria 4 % novodiagnostikovaných malignít ročne. Ide o siedmu najčastejšiu malignitu u mužov a trinástu u žien [3]. V etiopatogenéze nádorov horného aerodigestívneho traktu zohráva dôležitú úlohu fajčenie a pravidelná nadmerná konzumácia alkoholu. Z ďalších rizikových faktorov je to žuvanie tabaku, malnutrícia, avitaminóza, zlá hygiena ústnej dutiny a extraezofageálny reflux. U väčšiny pacientov sa rizikové faktory kombinujú. V posledných rokoch sa významná úloha pripisuje aj HPV infekcii, predovšetkým HR HPV 16, ktorý je zodpovedný za celosvetový nárast incidencie karcinómu orofaryngu [3,4]. Výskyt HPV pozitívneho karcinómu orofaryngu je okolo 50 % v Severnej Amerike, Japonsku a Austrálii, o niečo nižší (38 %) je v severnej, západnej a východnej Európe. V južnej Európe sa udáva podiel HPV pozitívnych orofaryngeálnych karcinómov iba v 17 % [2,3].
Materiál a metodika
Dizajn štúdie
Do prospektívnej štúdie bolo zaradených 236 pacientov, ktorým bol na oddelení otorinolaryngológie (ORL) Fakultnej nemocnice s poliklinikou (FNsP) F. D. Roosevelta v Banskej Bystrici v rokoch 2016–2018 diagnostikovaný SCC horného aerodigestívneho traktu (dutina ústna, oropharynx, hypopharynx, larynx).
Zo súboru boli vyradení pacienti:
- s iným histopatologickým typom nádoru horného aerodigestívneho traktu;
- so zriedkavými nádormi hlavy a krku (tj. nosohltan, nosová dutina, prinosové dutiny, ušné nádory, slinné žľazy);
- s metastázou (MTS) do lymfatických uzlín krku pri neznámom primárnom tumore, MTS do lymfatických uzlín krku pri tumore mimo ORL oblasť;
- s kožnými nádormi, nádormi štítnej žľazy a lymfoproliferatívnym ochorením;
- bez úplnej dokumentácie.
V sledovanom súbore sme sledovali výskyt rizikových faktorov, histopatologický nález a štádium ochorenia.
Všetci pacienti boli informovaní o charaktere štúdie a podpísali informovaný súhlas. Štúdia bola schválená etickou komisiou FNsP F. D. Roosevelta v Banskej Bystrici.
Rizikové faktory
Z rizikových faktorov sme sa zamerali na fajčenie, konzumáciu alkoholu a sexuálne správanie. Rizikové faktory sme zisťovali pomocou dotazníka.
Za fajčiara bol považovaný jedinec, ktorý fajčí 20 cigariet denne najmenej 10 rokov.
Za nadmernú konzumáciu alkoholu sme považovali u žien konzumáciu > 3 nápojov denne alebo 7 nápojov týždenne, a u mužov > 4 nápoje denne alebo 14 nápojov týždenne. Jeden alkoholický nápoj (1 drink) predstavuje 12–15 g alkoholu, tj. 0,5 l piva, 0,2 l vína alebo 0,05 l destilátu.
Zo sexuálnej anamnézy sme zisťovali vek koitarché (zahájenie sexuálneho života) a počet sexuálnych partnerov. Za rizikové sme považovali počet sexuálnych partnerov > 15.
Rozsah ochorenia
Všetkým pacientom bolo realizované endoskopické vyšetrenie v celkovej anestézii, pri ktorom sme určili lokálny rozsah ochorenia a odobrali vzorku nádorového tkaniva na histopatologické vyšetrenie. Všetkým pacientom bolo doplnené vyšetrenie krku a hrudníka výpočtovou tomografiou a vyšetrenie brucha výpočtovou tomografiou/ultrasonografiou. Podľa výsledkov vyšetrení sme následne určili rozsah ochorenia. Štádium choroby sme stanovili na základe platnej TNM (tumor-nodes-metastasis) klasifikácie (7. vydanie pre nádory diagnostikované do 31. 12. 2017 a 8. vydanie pre nádory diagnostikované od 1. 1. 2018).
Histopatologické vyšetrenie
Vzorky nádorového tkaniva odobratého počas endoskopického vyšetrenia v celkovej anestézii boli ihneď fixované roztokom 10% formaldehydu a zaliate parafínom. Z každej vzorky boli pripravené 4–5 μm hrubé rezy. Všetky rezy boli kontrastne zafarbené Weigertovým hematoxylínom (Bamed).
Stupeň diferenciácie SCC sme stanovili na základe klasifikácie Svetovej zdravotníckej organizácie tumorov hlavy a krku z roku 2017 [5]: grade I (GI, dobre diferencovaný); grade II (GII, stredne diferencovaný); grade III (GIII, zle diferencovaný).
Proteín 16 v tkanive nádoru sme určovali imunohistochemicky. Na imunohistochemické stanovovanie p16 sme použili myšiu monoklonálnu protilátku, klon E6H4®, namierená proti ľudskému p16INK4a proteínu (Roche). Výsledok sme kvantifikovali percentuálne na základe pozitivity imunohistochemického vyšetrenia pre p16 v bunkách nádoru.
Štatistická analýza
Charakteristiku súboru pacientov a sledované dáta sme vyhodnotili pomocou frekvenčnej sumarizácie a deskriptívnej štatistiky (priemer, medián, smerodajná odchýlka, kvartil minima a maxima). Rozdiely medzi sledovanými parametrami sme vyhodnotili použitím testov – Pearsonov χ2-test s Yatesovou koreláciou, Mann-Whitneyho U test, Kruskal-Wallisov test a dvojfaktorová ANOVA s post hoc Duncan testom. Za štatisticky významné sme v rámci všetkých použitých testov považovali hodnoty hladiny významnosti p < 0,05. Na štatistickú analýzu sme použili program STATISTICA Cz 10.
Výsledky
Do súboru bolo zaradených 236 pacientov, ktorým bol novodiagnostikovaný SCC horného aerodigestívneho traktu na ORL oddelení FNsP F. D. Roosevelta v Banskej Bystrici v období 1/2016–12/2018. V súbore bolo 208 (88 %) mužov, vek 62 ± 8 rokov a 28 (12 %) žien, vek 60 ± 9 rokov. SCC ústnej dutiny sa zistil v 4 %, orofaryngu v 51 %, hypofaryngu v 11 % a hrtana v 34 %. Charakteristika primárneho tumoru horného aerodigestívneho traktu je uvedená v tab. 1.
Table 1. Charakteristika primárneho tumoru – horný aerodigestívny trakt. 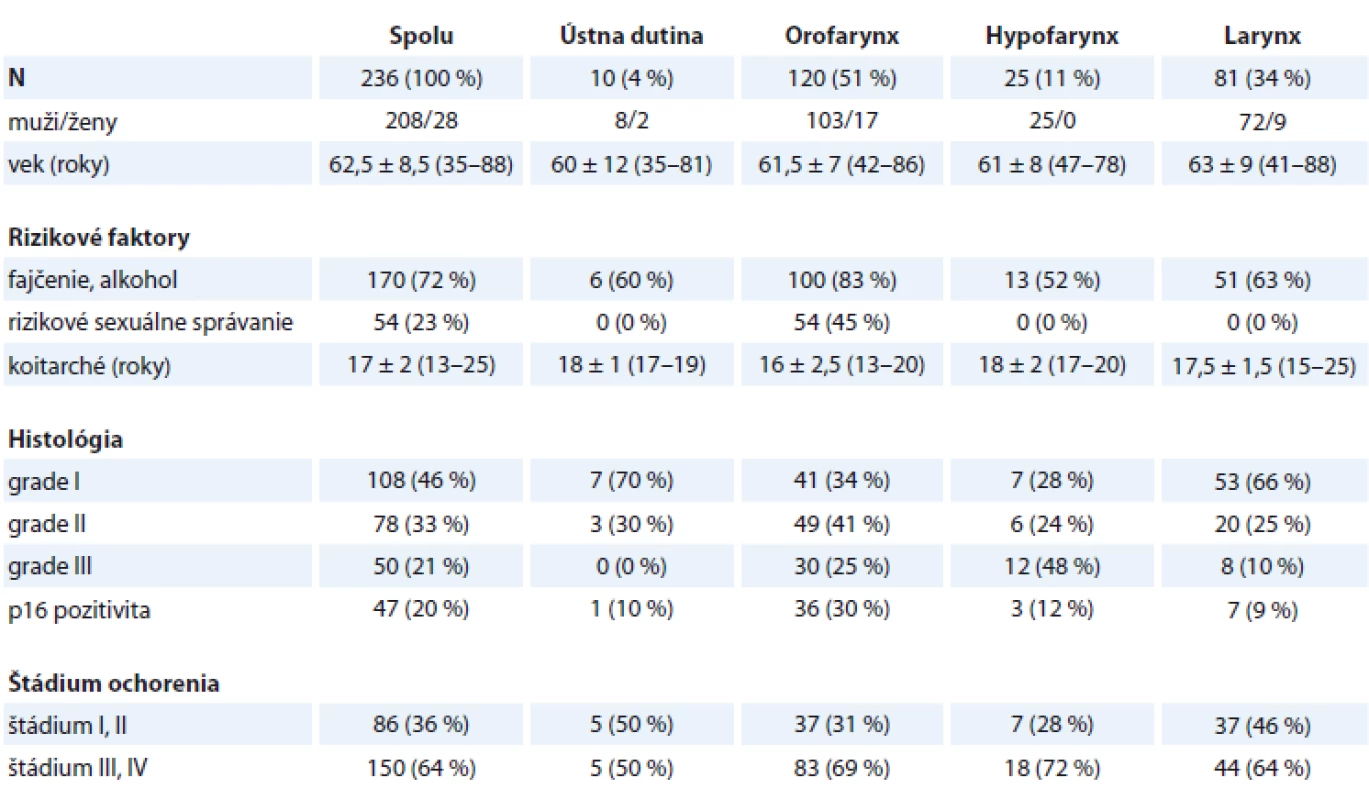
Typické rizikové faktory – fajčenie a pravidelná nadmerná konzumácia alkoholu – boli prítomné u 72 % pacientov, rizikové sexuálne správanie sa vyskytovalo u 23 %. Rizikové faktory boli častejšie prítomné u pacientov s orofaryngeálnym karcinómom (fajčenie, alkohol p = 0,007, resp. rizikové sexuálne správanie p < 0,0001). Vek zahájenia sexuálneho debutu bol 17 ± 2 roky, bez významnejších rozdielov medzi lokalizáciou primárneho tumoru (p = 0,266) (tab. 1).
Nádory horného aerodigestívneho traktu sa diagnostikovali v pokročilom štádiu ochorenia (štádium III a IV) u 149 (63 %) pacientov, bez významnejších rozdielov medzi jednotlivými lokalitami (p = 0,081) (tab. 1).
Histopatologickým vyšetrením sa častejšie diagnostikovali dobre a stredne diferencované SCC (GI a GII; 46 a 33 %; p = 0,003 a p = 0,005). Zle diferencovaný SCC (GIII) sa častejšie detegoval v nádoroch lokalizovaných v hypofaryngu (48 %; p = 0,008) a orofaryngu (25 %; p = 0,031) (tab. 1).
Na základe imunohistochemického vyšetrenia sme p16 detegovali v 20 % nádorov horného aerodigestívneho traktu, najčastejšie v resekátoch z orofaryngu (30 %; p = 0,018) (tab. 1, obr. 1).
Image 1. Imunohistochemický dôkaz p16 pozitivity v nádorovom tkanive tonzilárneho SCC (zväčšenie 200×; p16 pozitívne nádorové bunky sa imunohistochemicky farbia nahnedo). Zdroj: archív Martinského bioptického centra, s.r.o., prevádzka Banská Bystrica.
A. P16 pozitívny orofaryngeálny SCC. B. P16 negatívny orofaryngeálny SCC. SCC – skvamocelulárny karcinóm
Vzhľadom na nízky počet p16 pozitívnych nádorov v ostatných lokalitách ako aj negatívne rizikové sexuálne správanie sme ďalej sledovali rozdiely medzi p16 pozitívnymi a p16 negatívnymi nádormi iba pre orofaryngeálne SCC (tj. 120 pacientov, p16 pozitivita u 36). V obidvoch skupinách sa orofaryngeálny SCC vyskytoval častejšie u mužov, avšak v prípade p16 pozitívnych nádorov bol pomer muži: ženy nižší (graf 1). Pacienti s p16 pozitívnym karcinómom boli mladší (p16 pozitívny: 54 ± 9 rokov; p16 negatívny: 62 ± 8 rokov) (graf 2). Rizikové sexuálne správanie priznalo až 94 % pacientov, ktorým bol diagnostikovaný p16 pozitívny orofaryngeálny SCC (p < 0,0001). Fajčenie a pravidelná nadmerná konzumácia alkoholu sa zase častejšie vyskytovali u pacientov s p16 negatívnym SCC orofaryngu (90 %; p < 0,0001) (graf 3). P16 pozitívne nádory boli častejšie zle diferencované SCC (GIII) (69%; p = 0,004) (graf 4). Rozdiely v štádiách ochorenia sme nedetegovali (p = 0,733) (graf 5).
Graph 1. Skvamocelulárny karcinóm orofaryngu – rozdiely medzi p16 pozivitou a pohlavím. 
Graph 2. Skvamocelulárny karcinóm orofaryngu – rozdiely medzi p16 pozivitou a vekom 
Graph 3. Skvamocelulárny karcinóm orofaryngu – rozdiely medzi p16 pozivitou a rizikovými faktormi 
Graph 4. Skvamocelulárny karcinóm orofaryngu – rozdiely medzi p16 pozivitou a stupňom diferenciácie karcinómu. 
Graph 5. Skvamocelulárny karcinóm orofaryngu – rozdiely medzi p16 pozivitou a štádiom ochorenia. 
Diskusia
Epidemiológia nádorov horného aerodigestívneho traktu sa v posledných rokoch zmenila. Tieto nádory sú častejšie u mužov, pomer mužov a žien je viac než 3 : 1, ale za posledné desaťročia incidencia všetkých oblastí rakoviny hlavy a krku u žien stúpa, čo úzko súvisí so zvyšujúcou sa konzumáciou tabaku a alkoholu u žien [3]. Aj v našom súbore sa signifikantne častejšie vyskytovali muži (88 %).
Doteraz bol typický ORL onkologický pacient muž vo veku 60 rokov, dlhoročný fajčiar, pravidelný konzument alkoholu, nižšieho vzdelania, často nezamestnaný, slobodný alebo rozvedený [6]. V poslednom období však narastá počet pacientov nefajčiarov, nepravidelných konzumentov alkoholu, vyššieho vzdelania a spoločenského postavenia, ktorým bol diagnostikovaný malígny nádor hlavy a krku. Vznik karcinómu sa tu pripisuje HPV infekcii. V etiopatogenéze HPV pozitívnych karcinómov hlavy a krku sa uplatňuje predovšetkým typ HPV 16, ktorý sa deteguje u 90–95 % HPV pozitívnych karcinómov horného aerodigestívneho traktu [3,4,6].
V oblasti hlavy a krku je výskyt HPV asociovaných nádorov najvyšší v orofaryngu, predovšetkým v podnebných mandliach a koreni jazyka. Metaanalýzou štúdií týkajúcich sa európskych krajín (roky 2002–2012) sa zistila celková prevalencia HPV v karcinómoch hlavy a krku 40 %, pričom najvyššia prevalencia bola v karcinómoch tonzily (66,4 %) a bázy jazyka (47,2 %) [7]. Táto skutočnosť sa dáva do súvisu s perzistenciou infekcie v tonzilárnych kryptách, ktoré predstavujú vhodné miesto na replikáciu vírusu. HPV infekcia sa deteguje aj u malého počtu karcinómov dutiny ústnej, hypofaryngu a laryngu, avšak na rozdiel od karcinómov orofaryngu je v neaktívnej forme, preto sa na kancerogenéze pravdepodobne nepodieľa [6,8,9]. Aj v našom súbore sme v porovnaní s ostatnými lokalizáciami horného aerodigestívneho traktu p16 pozitivitu detegovali signifikantne najčastejšie v nádorovom tkanive z orofaryngu (30 %).
HPV asociovaný karcinóm orofaryngu nie je spájaný s fajčením či abúzom alkoholu, ale s rizikovým sexuálnym správaním. Štatisticky významne vyššia incidencia orofaryngeálneho karcinómu bola zistená u osôb s vyšším počtom sexuálnych partnerov (> 26), orálnych sexuálnych partnerov (> 6), ak bol prvý pohlavný styk vo veku < 18 rokov. Sexuálne správanie je teda významný rizikový faktor, no HPV asociovaný karcinóm sa tiež vyskytuje aj u ľudí s konzervatívnejším sexuálnym správaním. Vyšší počet tonzilárneho karcinómu bol zistený napr. u manželov žien s karcinómom krčka maternice [3,4,9].
V sledovanom súbore sme zaznamenali typické rizikové faktory – fajčenie a pravidelnú nadmernú konzumáciu alkoholu u 72 % pacientov so SCC horného aerodigestívneho traktu. Rizikové sexuálne správanie (počet sexuálnych partnerov >15) bolo prítomné iba v skupine pacientov s karcinómom orofaryngu (42 %). Rozdiely vo veku koitarché a lokalizáciou primárneho tumoru sme nezistili.
HPV 16 asociovaný SCC orofaryngu bol častejší u mužov, avšak pomer muži: ženy bol v porovnaní s p16 negatívnym orofaryngeálnym SCC ako aj ostatnými SCC horného aerodigestívneho traktu nižší. Pacienti s p16 pozitívnym SCC orofaryngu boli tiež signifikantne mladší, rizikové sexuálne správanie priznalo až 94 % z nich. Fajčenie a pravidelná konzumácia alkoholu sa častejšie vyskytovali u pacientov s p16 negatívnym SCC orofaryngu (90 %).
Rozdiely sú aj v histopatologickom náleze – HPV pozitívne SCC sú typicky nízkodiferencované, nekeratinizujúce, často bazaloidného typu. Okrem toho sa u pacientov s HPV pozitívnym SCC často stretávame s objemnou, cystickou MTS na krku a malým primárnym nádorom, kdežto pri HPV negatívnych karcinómoch väčšinou koreluje T a N štádium ochorenia [3].
Aj v našej štúdii boli p16 pozitívne orofaryngeálne SCC častejšie zle diferencované (GIII). Rozdiely v štádiách ochorenia sme nedetegovali.
Detekcia HPV v nádore
Od 1. 1. 2018 je HPV status potrebný na určenie TNM štádia orofaryngeálnych karcinómov, preto je v súčasnosti stanovenie HPV v nádorovom tkanive neoddeliteľnou súčasťou histopatologického vyšetrenia [10]. Okrem toho poskytuje dôležitú prognostickú informáciu a je pravdepodobné, že v blízkej budúcnosti bude rozhodovať aj o spôsobe liečby, napr. o použití deintenzifikovanej chemo/rádioterapie. Určenie HPV statusu sa odporúča aj v rámci manažmentu pacientov s MTS SCC z neznámeho origa do lymfatických uzlín krku. Dôkaz HPV môže efektívne nasmerovať diagnostiku a cielenú liečbu na oblasť orofaryngu. Aj keď je s HPV infekciou asociovaná aj časť non-orofaryngeálnych SCC hlavy a krku, rutinné HPV testovanie týchto nádorov nie je vzhľadom na nedostatok dôkazov o prognostickom význame vyšetrenia v súčasnosti odporúčané [11].
Napriek zjavnému významu a dôležitosti HPV testovania neexistuje všeobecný konsenzus, akú stratégiu a ktoré z viacerých dostupných metód na dôkaz HPV treba použiť. Výber metodiky by mal vychádzať zo zistení, že klinicky dobrá prognóza HPV pozitívnych orofaryngeálnych SCC je limitovaná iba na nádory s transkripčne aktívnou HPV infekciou [11–13]. Ideálny test by mal mať vysokú senzitivitu a špecificitu, primeranú cenu a mal by byť dostatočne jednoduchý na rutinné použitie. Jedným z najpraktickejších a najpoužívanejších spôsobov je screeningové imunohistochemické vyšetrenie expresie proteínu p16 [11]. Túto metodiku sme zvolili aj v našej štúdii. V súčasnosti sa táto metóda považuje za dostačujúcu na stratifikáciu pacientov do HPV pozitívnej/negatívnej skupiny karcinómov orofaryngu. Za pozitívny výsledok sa považuje jadrová a cytoplazmatická expresia ≥ 70 % nádorových buniek [11,14]. Na druhej strane nemožno zabúdať ani na nevýhody imunohistochemickej detekcie p16, predovšetkým nižšiu citlivosť a neschopnosť rozlíšiť jednotlivé kmene HPV. Samotná imunohistochemická expresia p16 sa môže považovať za marker aktívnej HPV infekcie iba v prípade, ak má karcinóm charakteristickú histopatologickú morfológiu. V prípade, že sa jedná o p16 pozitívny karcinóm s variantnou morfológiou alebo v prípade imunohistochemickej negativity v nekeratinizujúcom SCC orofaryngu, je nutné doplniť HPV špecifický test [11].
HPV infekciu v nádorovom tkanive je možné detegovať na základe dôkazu E6/E7 mRNA metódou reverznej transkripcie a polymerázovej reťazovej reakcie. Vysoko senzitívnym vyšetrením je detekcia HPV DNA vyšetrením polymerázovej reťazovej reakcie, stanovenia HPV DNA in situ hybridizáciou a najnovšie aj HPV RNA in situ hybridizáciou. Ide však o technicky, časovo aj finančne náročnejšie vyšetrenia [11].
Záver
V súlade s výsledkami iných štúdií aj v našej práci sme dokázali, že infekcia HPV 16, ktorý patrí medzi tzv. high-risk HPV, má vplyv prioritne na vznik karcinómu orofaryngu. V ostatných lokalizáciách horného aerodigestívneho traktu nemá HPV infekcia vplyv na vznik nádoru a v týchto lokalizáciách je hlavným rizikovým faktorom fajčenie a nadmerné užívanie alkoholu. HPV asociovaný karcinóm orofaryngu nie je spájaný s fajčením ani abúzom alkoholu, ale s rizikovým sexuálnym správaním.
HPV asociované karcinómy orofaryngu predstavujú novú skupinu nádorov, čo odzrkadľuje aj nová TNM klasifikácia (8. vydanie, platná od 1. 1. 2018). Stanovenie HPV v nádorovom tkanive z orofaryngu je neoddeliteľnou súčasťou histopatologického vyšetrenia. Imunohistochemické vyšetrenie expresie proteínu p16 v nádorovom tkanive sa v súčasnosti považuje za dostačujúcu metódu na stratifikáciu pacientov do HPV pozitívnej/negatívnej skupiny karcinómov orofaryngu.
Autoři deklarují, že v souvislosti s předmětem studie nemají žádné komerční zájmy.
Redakční rada potvrzuje, že rukopis práce splnil ICMJE kritéria pro publikace zasílané do biomedicínských časopisů.
MUDr. Barbora Uhliarova, Ph.D.
Oddelenie otorinolaryngológie
Fakultná nemocnica s poliklinikou
F. D. Roosevelta
Nám. L. Svobodu 1
974 01 Banská Bystrica
Slovenská republika
e-mail:b.uhliarova@gmail.com
Obdržané: 19. 6. 2019
Prijaté: 31. 12. 2019
Sources
1. Sehnal B, Podlešák T, Kmoníčková E et al. Anogenitální HPV infekce jako potenciální rizikový faktor orofaryngeálního karcinomu. Klin Onkol 2018; 31 (2): 103–109. doi: 10.14735/amko2018103.
2. Sehnal B, Rozsypal H, Nipčová M et al. Prevalence, incidence, perzistence a možnosti prenosu infekce lidským papilomavirem (HPV). Epidemiol Mikrobiol Imunol 2017; 66 (4): 198–209.
3. Štefanička P. Ľudským papilomavírusom asociovaný karcinóm orofaryngu. Onkologia (Bratisl.) 2015; 10 (3): 189–192.
4. Young D, Xiao CC, Murphy B et al. Increase in head and neck cancer in younger patients due to human papillomavirus (HPV). Oral Oncol 2015; 51 (8): 727–730. doi: 10.1016/j.oraloncology.2015.03.015.
5. El-Naggar AK, Chan JK, Grandis JR et al. WHO classification of head and neck tumours. 4th ed. Lyon: WHO Press 2017.
6. Binková H, Horáková Z, Kostřica R et al. Narůstající incidence HPV pozitivních orofaryngeálních karcinomů. Otorinolaryng a Foniat (Prague) 2015; 64 (4): 205–212.
7. Abogunrin S, Di Tanna GL, Keeping S et al. Prevalence of human papillomavirus in head and neck cancers in European populations: a meta-analysis. BMC Cancer 2014; 14 : 968. doi: 10.1186/1471-2407-14-968.
8. Syrjänen S. HPV infections and tonsillar carcinoma. J Clin Pathol 2004; 57 (5): 449–455. doi: 10.1136/jcp.2003.008656.
9. Partlová S, Bouček J, Kloudová K et al. Imunitní systém u pacientů s nádory hlavy a krku. Klin Onkol 2015; 28 (Suppl 4): 86–94. doi: 10.14735/amko20154S86.
10. Brierley JD, Gospodarowicz MK, Wittekind CH et al. TNM classification of malignant tumours. 8th ed. Oxford: Wiley Blackwell 2017.
11. Švajdler M, Laco J, Ondič O et al. HPV-asociované karcinómy hlavy a krku: Aktualizácia poznatkov a odporúčania pre prax. Cesk Patol 2016; 52 (3): 130–138.
12. Kašpírková J, Ondič O, Černá K et al. Možnosti průkazu biologicky relevantní papilomavirové infekce u maligních nádorů hlavy a krku v diagnostické patologii. Cesk Patol 2013; 49 (1): 29–34.
13. Bishop JA, Lewis JS Jr, Rocco JW et al. HPV-related squamous cell carcinoma of the head and neck: An update on testing in routine pathology practice. Semin Diagn Pathol 2015; 32 (5): 344–351. doi: 10.1053/j.semdp.2015.02. 013.
14. Grøn øj Larsen C, Gyldenløve M, Jensen DH et al. Correlation between human papillomavirus and p16 overexpression in oropharyngeal tumours: a systematic review. Br J Cancer 2014; 110 (6): 1587–1594. doi: 10.1038/bjc.2014.42.
Labels
Paediatric clinical oncology Surgery Clinical oncology
Article was published inClinical Oncology

2020 Issue 2-
All articles in this issue
- Pohybová liečba ako prevencia a podporná liečba onkologických ochorení
- Využití extrakraniální stereotaktické radioterapie při oligometastatickém postižení lymfatických uzlin
- HPV 16 v patogenéze nádorov horného aerodigestívneho traktu
- Invazívna rino-orbito-cerebrálna forma mukormykózy u detskej pacientky s akútnou leukémiou
- Využití indocyaninové zeleně k peroperační diagnostice zdroje chylózního ascitu a autologního tkáňového lepidla (Vivostatu) k jeho ošetření
- Protirakovinný účinek melatoninu s radioprotektivní a radiosenzitivní vlastností
- Karcinom děložního hrdla
- Léčba karcinomu hrdla děložního s postižením paraaortálních uzlin – retrospektivní hodnocení vlastního souboru
- Aktuality z odborného tisku
- Vzpomínka na prof. RNDr. M. Lokajíčka, DrSc.
- Účinek kapecitabinu v léčbě triple negativního karcinomu prsu
- Metformin v onkologii – jak daleko jsme od jeho etablování coby protinádorového léku?
- Asociace polymorfizmu NAD (P) H chininové oxidoreduktázy 1 rs1800566 s karcinomem močového měchýře a prostaty – systematický přehled a metaanalýza
- Clinical Oncology
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Karcinom děložního hrdla
- Pohybová liečba ako prevencia a podporná liečba onkologických ochorení
- HPV 16 v patogenéze nádorov horného aerodigestívneho traktu
- Metformin v onkologii – jak daleko jsme od jeho etablování coby protinádorového léku?
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

