-
Medical journals
- Career
Pseudomyxom peritonea
Authors: Petr Bartoška 1; František Antoš 1; Pavel Vítek 2; Josef Marx 1; Jiří Kopic 1; Petra Holečková 3
Authors‘ workplace: Chirurgická klinika 1. LF UK a Nemocnice Na Bulovce, Praha 1; Protonové centrum, Praha 2; Ústav radiační onkologie, 1. LF UK a Nemocnice Na Bulovce, Praha 3
Published in: Klin Onkol 2019; 32(5): 329-332
Category: Review
doi: https://doi.org/10.14735/amko2019329Overview
Východiska: Pseudomyxom peritonea je vzácné nádorové onemocnění charakterizované různým stupněm malignity, produkcí mucinu a gelatinózních hmot. Jeho rozvoj je velmi často spojován s rupturou mucinózních nádorů apendixu a ostatních mucinózních nádorů trávicího traktu a ovaria. Pseudomyxom peritonea je obvykle dělen do tří skupin – low-grade, high-grade a high-grade s výskytem buněk pečetního prstene. Rozsah onemocnění je určován pomocí skórovacího systému PCI (peritoneal carcinoma index). Klinický obraz je značně variabilní, závisí na rozsahu onemocnění. S progresí vývoje nádorových hmot se postupně rozvíjí typický nález „jelly belly“ – „syndrom rosolovitého břicha“. Diagnostika je založena na stanovení předoperačního PCI pomocí zobrazovacích metod, zejména pak výpočetní tomografie.
Metody: Od 90. let 20. století se uplatňuje metoda Paula H. Sugarbakera založená na maximálním možném odstranění nádorových hmot, tzv. cytoredukční chirurgii, a následné peroperační aplikaci horkého cytostatika do dutiny břišní, tzv. hypertermické intraperitoneální chemoterapii, s cílem dosažení co nejefektivnější likvidace nádorového procesu.
Výsledky: Literární i naše výsledky jsou srovnatelné, potvrzují vysokou efektivitu zmíněné metody. Uvádějí statisticky velmi významné prodloužení celkového přežití, intervalu bez známek onemocnění s akceptabilní letalitou 0–12 % i morbiditou 27–56 %. Tyto výsledky u vybraných pacientů potvrzují použití metody jako zlatého standardu pro léčbu pseudomyxomu peritonea.
Klíčová slova:
pseudomyxom peritonea – PCI – cytoredukční chirurgie – hypertermická intraperitoneální chemoterapie – HIPEC
Úvod
Chorobu lze definovat jako nádorové onemocnění s různým stupněm maligního potenciálu charakterizované produkcí mucinu a gelatinózních hmot v peritoneální dutině. Tyto hmoty se vyskytují v dutině břišní volně, nebo vázané na viscerální či parietální peritoneum. Postižení peritonea (peritoneální karcinomatóza) je přítomné vždy. Velmi často bývá postiženou oblastí omentum – tzv. omental cake (obr. 1). Ostatní predilekční oblasti, jako parakolické prostory, malá pánev a oba podbrániční prostory, odpovídají cirkulačním cestám peritoneální tekutiny [1]. Onemocnění vychází z MUC2 pozitivních pohárkových buněk, při imunohistochemickém vyšetření se prokazuje vysoký výskyt hlenu MUC2, bývá pozitivní cytokeratin 20 a negativní cytokeratin 7 [2,3].
Image 1. Karcinomatóza omenta – „omental cake“. 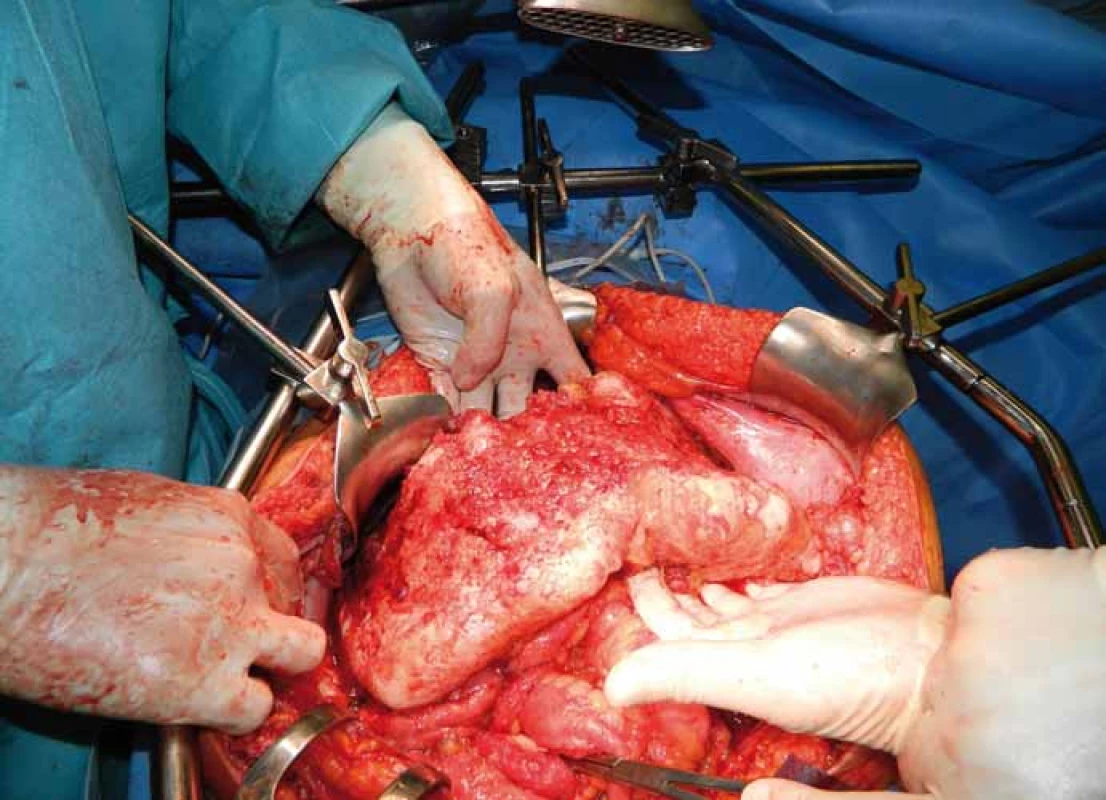
Epidemiologie
Jde o poměrně vzácné onemocnění s výskytem přibližně 1 pacienta na 1 milion obyvatel za rok. Nejčastěji se objevuje jako komplikace nezhoubných mukokél apendixu, hlenotvorných neoplazií apendixu (70–80 %), střeva a hlenotvorných ovariálních nádorů (2–5 %). Sporadický výskyt lze nalézt i u cystických nádorů pankreatu, nádorů žaludku, žlučových cest a močového měchýře. Příčinou vzniku onemocnění je nezřídka bezpříznaková nebo peroperační ruptura hlenotvorných nádorů.
Dělení a klasifikace
- Dle Ronnetta se pseudomyxom peritonea (PMP) dělí do tří histologických typů: 1) diseminovaná peritoneální adenomucinóza (DPAM); 2) intermediate/discordant-přechodný podtyp (PMCA/ID); 3) peritoneální mucinózní karcinomatóza (PMCA). V praxi je však spíše používáno histopatologické dělení jen do dvou skupin – DPAM a PMCA.
- Vodítkem pro rozdělení do těchto skupin je přítomnost vzhledu epitelové složky, přítomnost buněk typu pečetního prstene a známky kribriformně tubulárního uspořádání nádoru.
- DPAM-diseminovaná peritoneální adenomucinóza je velmi často recidivujícím typem nádoru majícím oproti PMCA lepší prognózu, je zde obvykle prokázán vztah s benigním hlenotvorným nádorem apendixu. Pětileté přežití u tohoto typu nádoru je v literatuře udáváno 80–81 %. Vzácněji se vyskytující skupinou je PMCA-peritoneální mucinózní karcinomatóza, která je v podstatě považována za projev generalizace maligního tumoru gastrointestinálního traktu s masivní produkcí hlenu. Prognóza i přežití pacientů s tímto typem nádoru je udávána okolo 50–59 %.
- Klasifikace Světové zdravotnické organizace dělí PMP na low-grade a high-grade. Low-grade PMP je charakterizován pomalou progresí a lepší prognózou, nádor nemá schopnost destrukce střevní stěny. Není pro něj typický invazivní růst a tvorba metastáz. Je spojován s mucinózním tumorem apendixu. Naproti tomu pro biologické chování high-grade PMP je typická invazivita, agresivita a destrukce. Může tvořit hematogenní i lymfogenní metastázy, je spojován s high-grade mucinózním adenokarcinomem. Jako další histologický podtyp high-grade PMP je popisován tumor charakterizovaný přítomností buněk pečetního prstene (signet ring cells), jehož chování je velmi invazivní a agresivní [4].
- Konsenzus Mezinárodní skupiny léčby malignit peritoneálního povrchu (The Peritoneal Surface Oncology Group International – PSOGI) z roku 2016 definuje PMP jako intraperitoneální akumulaci hlenu způsobenou hlenotvorným nádorem charakterizovaným redistribučním fenoménem. Dělí se do tří kategorií: low-grade, high-grade a high-grade s výskytem buněk typu pečetního prstene. Low-grade odpovídá již citovanému DPAM a high-grade PMP, PMCA. Tato klasifikace byla všeobecně přijata a měla by být používána jednotlivými centry z důvodu dosažení jednotné terminologie [5].
U PMP lze provést kompletní odstranění nádoru i při PCI (peritoneal carcinoma index) skóre okolo 28, inkompletní pak i u vyšších hodnot PCI [6,7].
Specifická diagnostika
Opírá se o anamnézu a klinický nález, které se zpravidla různí v závislosti na rozsahu onemocnění. Na jedné straně nalézáme pacienty asymptomatické, s minimálním klinickým nálezem, na druhé straně pak pacienty s různě rozvinutou neprůchodností střevní, ascitem či tumorózními rezistencemi, tzv. jelly belly syndromem („rosolovité břicho“) (obr. 2). Základním úkolem je verifikace procesu a jeho histologická klasifikace, což vyžaduje odběr dostatečného množství nádorového materiálu k histopatologickému zpracování. Vzhledem ke vzácnému výskytu onemocnění je někdy k potvrzení diagnózy nutné i opakované čtení zkušeným centrovým patologem [8,9].
Image 2. Rosolovité břicho – „jelly belly“. 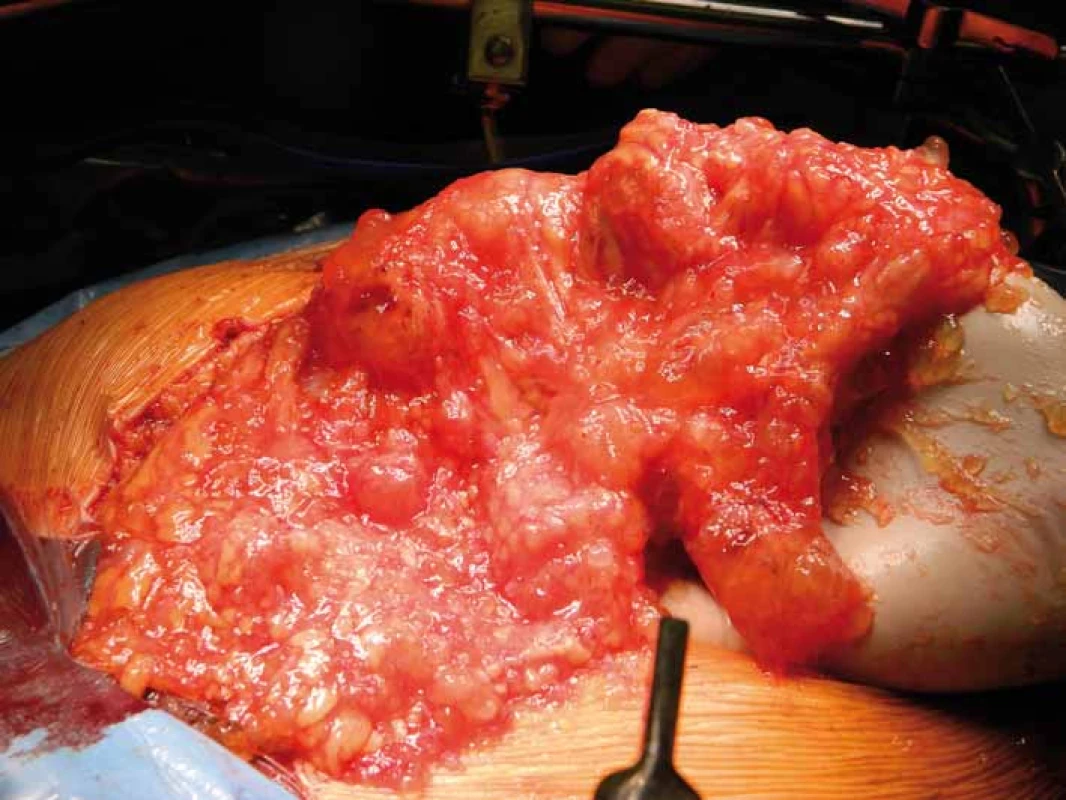
Z laboratorních vyšetření je kromě běžných vyšetření nutných k posouzení stavu pacienta a únosnosti chirurgického výkonu doporučováno provádět i odběry CEA, Ca 19-9 a Ca 125. Hladina těchto onkologických markerů může být dalším faktorem predikce rozsahu postižení dutiny břišní PMP, event. operability, celkového přežití (overall survival – OS) i přežití bez progrese onemocnění (progression-free survival – PFS) [10,11].
Terapie
Cytoredukce dle Sugarbakera je v případě pokročilého pseudomyxomu peritonea prováděna v několika krocích závislých na rozsahu nádorové infiltrace:
- Totální odstranění velkého omenta a pravostranná parietální peritonektomie s/bez resekce pravé poloviny kolon.
- Pánevní peritonektomie s/bez resekce sigmatu, hysterektomie a oboustranná adnexektomie.
- Omentektomie malé předstěry a disekce oblasti lig. hepatoduodenale s/bez antrektomie či cholecystektomie.
- Peritonektomie horního pravého kvadrantu a odstranění Glissonova pouzdra jater.
- Peritonektomie levého horního kvadrantu a levostranná parietální peritonektomie s/bez splenektomie.
- Ostatní střevní a jiné resekce břišních nádorových mas [12].
I v případě inoperabilního nálezu je u PMP žádoucí zvážit debulking s hypertermickou intraperitoneální chemoterapií (HIPEC). Cílem tohoto postupu je redukce nádorových mas a snížení tvorby ascitu, což výrazně zlepší kvalitu dalšího života. Konstrukce anastomóz i stomií se obvykle provádí až po aplikaci HIPEC. Okluze stomií u těchto pacientů je zvažována obyčejně po 3–6 měsících od primární operace, přičemž může jít i o součást tzv. second look operace či re-do chirurgie (revize cytoredukční chirurgií – cytoreductive surgery (CRS) a HIPEC). Četnost obnovení kontinuity po CRS a HIPEC je srovnatelná s jinými kolorektálními operacemi, udává se okolo 50 % [13].
Indikace k CRS a HIPEC u PMP:
- histologická verifikace PMP;
- performance status 0–2, Karnofského index > 70;
- klasifikace dle Americké společnosti anesteziologů (ASA) ≤ II;
- přítomnost maligních buněk ve výpotku;
- přítomnost peritoneálních metastáz i u pacientů s PCI ≥ 20 (u ostatních nádorů ≤ 20) – pacienti s vysokým rizikem peritoneální diseminace (ileus, perforace, prorůstání tumorů do ostatních orgánů).
Kontraindikace k CRS a HIPEC u PMP
- celkové: performance status ≥ 3, Karnofského index < 70, ASA ≥ III;
- další komorbidity – obvyklé interní kontraindikace identické s ostatními břišními operacemi;
- generalizace procesu (extraperitoneální manifestace onemocnění);
- přítomnost chirurgicky neřešitelných vzdálených metastáz (mozek, plíce, kosti);
- přítomnost maligního pleurálního výpotku;
- lokální nález břišní – invazivní růst do retroperitonea, postižení retroperitoneálních lymfatických uzlin – těžké postižení mezenteria s jeho retrakcí;
- těžké postižení (separace a četné stenózy) tenkého střeva, při jehož resekci by hrozil vznik syndromu krátkého střeva, obstrukce žlučových cest a hydronefróza [14–21].
Výsledky
Výsledky CRS a HIPEC u PMP udávané v literatuře naší i cizojazyčné jsou relativně příznivé. Dvouleté přežití se pohybuje okolo 90 %, 3leté 60–90 %, 5 a 10leté přežití po kompletní CRS a HIPEC se udává přes 80–85 %, resp. 60–68 % u CRS inkompletní; 15leté přežití pak okolo 55–60 %. Retrospektivní analýza registru pacientů s PMP (všech histologických typů), kteří podstoupili CRS a HIPEC, udává medián PFS 98 měsíců a medián OS 196 měsíců. Dvacetileté přežití pacientů s CRS a HIPEC pro low-grade PMP vznikajícího na základě nádorového onemocnění apendixu při srovnání s užitím pouze systémové chemoterapie je 70 vs. 0 %.
Recidiva onemocnění se objevuje u PMP po kompletní CRS a HIPEC obvykle ve 25–30 %, cca 22–30 měsíců od primárního výkonu, s časovým mediánem okolo 26 měsíců.
U 25–30 % pacientů postižených recidivou PMP lze provést re-do chirurgii, u 50–60 % z nich je pak možná i kompletní CRS. Perioperativní morbidita 15–76 %, mortalita 0–17 % [22–24].
Re-do chirurgie
Je doporučována u recidiv PMP. Opakovaný chirurgický zákrok (CRS a HIPEC) pacientovi přináší statisticky podstatně vyšší OS. Tříleté přežití je udáváno až ve 100 % a 5leté v 90 %. Mortalita u opakovaných výkonů je srovnatelná s operacemi primárními. Morbidita se pohybuje mezi 15–76 % [25].
Závěr
CRS a HIPEC je metodou volby u vybraných pacientů s onemocněním (syndromem) PMP. Pacienti vhodní pro tuto metodu by měli být diskutováni předem ve specializovaných multidisciplinárních týmech jednotlivých CRS a HIPEC center. Vzhledem k vysoké morbiditě, náročnosti operace a pooperační péče by tato metoda měla být prováděna výhradně a jen v těchto centrech (doporučení PSOGI z roku 2015). V léčbě PMP je CRS a HIPEC vysoce efektivní při zachování velmi nízké mortality, výrazně prodlužuje PFS i OS.
Ze strany pacientů je CRS a HIPEC chirurgie hodnocena velmi pozitivně, 80 % pacientů, kteří podstoupili CRS a HIPEC, byli spokojeni a uváděli, že zmíněná léčba neměla negativní dopad na kvalitu jejich následného života [26].
Podpořeno MZ ČR – RVO (NNB, 00064211).
Autoři deklarují, že v souvislosti s předmětem studie nemají žádné komerční zájmy.
Redakční rada potvrzuje, že rukopis práce splnil ICMJE kritéria pro publikace zasílané do biomedicínských časopisů.
Přijato/Accepted: 5. 8. 2019
MUDr. Petr Bartoška
Chirurgická klinika Nemocnice Na Bulovce
Budínova 67/2
180 81 Praha 8
e-mail: bartoska.petr@centrum.cz
Sources
1. Antoš F, Petr Dytrych P. Peritoneální nádory. Chirurgická onkologie. Praha: Grada publishing 2014 : 601–613.
2. Baratti D, Kusamura S, Nonaka D et al. Pseudomyxoma peritonei: clinical pathological and biological prognostic factors in patients treated with cytoreductive surgery and hyperthermic intraperitoneal chemotherapy (HIPEC). Ann Surg Oncol 2008; 15 (2): 526–534. doi: 10.1245/s10434-007-9691-2.
3. Kocián R. Pseudomyxoma peritonei. Actual Gyn 2013; 5 : 10–13.
4. AJCC Cancer staging manual. 8th ed. New York: Springer 2017 : 237–239.
5. Carr NJ, Cecil TD, Mohamed F et al. Consensus for classification and pathologic reporting of pseudomyxoma peritonei and associated appendiceal neoplasia: the results of the Peritoneal Surface Oncology Group International (PSOGI) modified delphi process. Am J Surg Pathol 2016; 40 (1): 14–26. doi: 10.1097/PAS.0000000000000535.
6. Antoš F. Léčení diseminovaných nádorů dutiny břišní pomocí peritonektomie a peroperační hypertermické chemoterapie s možností profylaktického užití u kolorektálních karcinomů – závěrečná zpráva grantového projektu. IGA MZ ČR NR 8414/5.
7. Antoš F, Vítek P, Kopic J et al. Cytoreduktivní chirurgie a hypertermická peroperativní chemoterapie (HIPEC) v léčbě malignit peritoneálních povrchů. Onkologická Revue 2018; 5 (2): 62–67.
8. Dineen SP, Royal RE, Hughes MS et al. A simplified preoperative assessment predicts complete cytoreduction and outcomes in patients with low-grade mutinous adenocarcinoma of the appendix. Ann Surg Oncol 2015; 22 (11): 3640–3646. doi: 10.1245/s10434-015-4446-y.
9. Flicek K, Ashfaq A, Johnson CD. Correlation of radiologic with surgical peritoneal cancer index scores in patients with pseudomyxoma peritonei and peritoneal carcinomatosis: how well can we predict resectability? J Gastrointest Surg 2016; 20 (2): 307–312. doi: 10.1007/s11605-015-2880-6.
10. Canbay E, Ishibashi H, Sako S et al. Preoperative carcinoembryonic antigen level predicts prognosis in patients with pseudomyxoma peritonei treated with cytoreductive surgery and hyperthermic intraperitoneal chemotherapy. World J Surg 2013; 37 (6): 1271–1276. doi: 10.1007/s00268-013-1988-7.
11. Kusamura S, Baratti D, Hutanu I et al. The role of baseline inflammatory-based scores and serum tumor markers to risk stratify pseudomyxoma peritonei patients treated with cytoreduction (CRS) and hyperthermic intraperitoneal chemotherapy (HIPEC). Eur J Surg Oncol 2015; 41 (8): 1097–1105. doi: 10.1016/j.ejso.2015.04. 005.
12. Sugarbaker PH. Peritonectomy procedure. Ann Surg 1995; 221 (1): 29–42. doi: 10.1097/00000658-199501000-00004.
13. Riss S, Chandrakumaran K, Dayal S et al. Risk of definitive stoma after surgery for peritoneal malignancy in 958 patients: comparative study between complete cytoreductive surgery and maximal tumor debulking. Eur J Surg Oncol 2015; 41 (3): 392–395. doi: 10.1016/ j.ejso.2014.09.002.
14. Spiliotis J, Halkia E, de Bree E. Treatment of peritoneal surface malignancies with hyperthermic intraperitoneal chemotherapy – current perspectives. Curr Oncol 2016; 23 (3): 266–275. doi: 10.3747/co.23.2831.
15. Lansom J, Alzahrani N, Liauw W et al. Cytoreductive surgery and hyperthermic intraperitoneal chemotherapy for pseudomyxoma peritonei and appendix tumours. Indian J Surg Oncol 2016; 7 (2): 166–176. doi: 10.1007/s13193-015-0478-9.
16. Qu ZB, Liu LX. Management of pseudomyxoma peritonea. World J Gastroenterol 2006; 12 (38): 6124–6127. doi: 10.3748/wjg.v12.i38.6124.
17. Shaligram A. Management of peritoneal surface malignancies in laparoscopic era: a concise review. Int J Surg Oncol (NY) 2016; 1 (2): e05. doi: 10.1097/IJ9.000 0000000000005.
18. Moran B, Baratti D, Yan TD et al. Consensus statement on the loco-regional treatment of appendiceal mucinous neoplasm with peritoneal dissemination (pseudomyxoma peritonei). J Surg Oncol 2008; 98 (4): 277–282. doi: 10.1002/jso.21054.
19. MacArthur KM, Nicholl MB. Principles and innovations in peritoneal surface malignancy treatment. World J Oncol 2013; 4 (3): 129–136. doi: 10.4021/wjon 660w.
20. Kulu Y, Muller-Stich B, Büchler MW et al. Surgical treatment of peritoneal carcinomatosis: current treatment modalities. Langenbecks Arch Surg 2014; 399 (1): 41–53. doi: 10.1007/s00423-013-1144-8.
21. Halkia E, Gavriel S, Spilioti J. Management of peritoneal surface malignancy: a review of the recent literature. JBUON 2014; 19 (3): 618–626.
22. Saxon A, Yan TD, Chua TC et al. Critical assessment of risk factors for complications after cytoreductive surgery and perioperative intraperitoneal chemotherapy for pseudomyxoma peritonei. Ann Surg Oncol 2010; 17 (5): 1291–1301. doi: 10.1245/s10434-009-0875-9.
23. Iversen LH, Rasmussen PC, Hagemann-Madsen R et al. Cytoreductive surgery and hyperthermic intraperitoneal chemotherapy for peritoneal carcinomatosis: the Danish experience. Colorectal Dis 2013; 15 (7): 365–372. doi: 10.1111/codi.12185.
24. Chua TC, Moran BJ, Sugarbaker PH et al. Early-and long-term outcome data of patients with pseudomyxoma peritonei from appendiceal origin treated by a strategy of cytoreductive surgery and hyperthermic intraperitoneal chemotherapy. J Clin Oncol 2012; 30 (20): 2449–2456. doi: 10.1200/JCO.2011.39. 7166.
25. Delhorme JB, Honoré C, Benhaim L et al. Long-term survival after aggressive treatment of relapsed serial or distant pseudomyxoma peritonei. Eur J Surg Oncol 2017; 43 (1): 159–167. doi: 10.1016/j.ejso.2016.08.021.
26. Kirby R, Liauw W, Zhao J et al. Quality of life study following cytoreductive surgery and intraperitoneal chemotherapy for pseudomyxoma peritonei including redo procedures. Int J Surg Oncol 2013; 2013 : 461041. doi: 10.1155/2013/461041.
Labels
Paediatric clinical oncology Surgery Clinical oncology
Article was published inClinical Oncology

2019 Issue 5-
All articles in this issue
- Maligní nádory peritonea – úvod do problematiky
- Pseudomyxom peritonea
- Maligní peritoneální mezoteliom a jeho léčba
- Léčba a profylaxe peritoneálních metastáz kolorektálního karcinomu
- Možnosti léčby peritoneální karcinomatózy u karcinomu žaludku
- Peritoneální karcinomatóza ovariálních nádorů – současný pohled na efekt cytoredukční chirurgie a intraperitoneální hypertermické chemoterapie
- Alopecie a poškození vlasů indukované onkologickou terapií
- Má amygdalin své místo v integrativní protinádorové léčbě?
- Lymfangioleiomyomatóza
- Lymfo/plazmocytární infiltrace chemoterapií neovlivněných triple negativních karcinomů prsu – koreláty s morfologickými a klinicko-patologickými parametry
- 68Ga-DOTA-TOC PET/CT vyšetření u pacienta s gastroenteropankreatickým neuroendokrinním nádorem – první vyšetření v České republice
- Peritoneální nádory
- Aktuality z odborného tisku
- Onkologie v obrazech
- Asociace polymorfizmů MTHFR 677C>T, 1298A>C a MTR 2756A>G s rizikem rozvoje retinoblastomu
- Použití regorafenibu a SBRT při léčbě plicních metastáz kolorektálního karcinomu
- Clinical Oncology
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Alopecie a poškození vlasů indukované onkologickou terapií
- Pseudomyxom peritonea
- Maligní peritoneální mezoteliom a jeho léčba
- Maligní nádory peritonea – úvod do problematiky
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career


