-
Medical journals
- Career
Prevalence symptomů úzkosti a deprese a jejich vliv na kvalitu života u pacientů v paliativní onkologické léčbě – projekt PALINT
Authors: L. Světláková 1; O. Sláma 1; M. Světlák 2; L. Pochop 1; J. Šedo 1; R. Alexandrová 1; O. Bílek 1; R. Vyzula 1
Authors‘ workplace: Klinika komplexní onkologické péče, Masarykův onkologický ústav, Brno 1; Ústav psychologie a psychosomatiky, LF MU, Brno 2
Published in: Klin Onkol 2019; 32(3): 201-207
Category: Original Articles
doi: https://doi.org/10.14735/amko2019201Overview
Východiska: Úzkost, deprese a psychologický distres jsou časté syndromy u pacientů v pokročilých stadiích nádorových nemocí. V kontrastu s tím však tyto symptomy explicitně nemonitorujeme a jejich management je většinou jen na úrovni farmakoterapie. Vzhledem ke komplexitě etiologie těchto symptomů je pouze biomedicínský přístup nedostatečný a neefektivní.
Materiál a metody: Prezentujeme výsledky longitudinálního hodnocení symptomů psychického distresu, úzkosti, deprese a pocitu kvality života vzešlé ze souboru 126 pacientů léčených paliativní protinádorovou léčbou v rámci studie PALINT. Psychické symptomy byly hodnoceny v pravidelných intervalech pomocí dotazníků Hospital Anxiety and Depression Scale (HADS); kvalita života byla hodnocena pomoci dotazníků The European Organisation for Research and Treatment of Cancer Quality of Life Questionnaire (EORTC QLQ-C30).
Výsledky: Na začátku paliativní onkologické léčby byly klinicky významné hodnoty psychického distresu zjištěny u 32,6 %, úzkost u 35,9 % a deprese u 56,5 % pacientů. Po 2 a 4 měsících lze sledovat trend v podobě poklesu prevalence distresu (19,4 a 16,3 %), úzkosti (20,9 a 16,3 %) a deprese (46,3 a 46,9 %). Tento rozdíl ale nedosáhl statistické významnosti. Přítomnost symptomů úzkosti a deprese signifikantně negativně korelovala s celkovým pocitem zdraví dle dotazníku kvality života.
Závěr: Vysoká prevalence úzkosti, deprese a distresu představuje silný argument pro zavedení plošného screeningu psychického distresu a systematické psychologické a psychosociální podpory pacientů v celém průběhu onkologické léčby. Dotazník HADS se pro účely screeningu jeví jako vhodný nástroj.
Klíčová slova:
paliativní léčba – úzkost – deprese
Úvod
Úzkost a deprese představují nejčastější psychiatrické symptomy u pacientů s onkologickým onemocněním. Studie, které využívaly strukturovaných psychiatrických interview, dokládají, že prevalence velké depresivní poruchy je u pacientů s pokročilým nádorovým onemocněním přibližně 15 % [1]. Studie, které využívaly sebeposuzovací škály, dokládají prevalenci příznaků stresu (např. úzkost, deprese, somatické obtíže jako nespavost, nervozita atd.) u 30–40 % pacientů v různém stupni vývoje nádorového onemocnění [2,3]. Klinická zkušenost a stejně tak citované studie v této oblasti jednoznačně dokládají, že neléčená úzkost a deprese nejen zhoršují celkovou kvalitu života [4], ale mají významný vliv na bolest [5] a další tělesné symptomy. Bylo také opakovaně navrženo a nepřímo prokázáno, že přetrvávající aktivace osy hypotalamus – hypofýza – kůra nadledvin (HPA osa) v reakci na chronický stres a také u deprese oslabuje imunitní odpověď a může přispívat k vývoji a progresi určitých typů nádorů [6]. Jestliže úzkost a deprese představují důležitý psychiatrický příznak, je monitorování, kontrola a léčba těchto příznaků zcela zásadní v celém průběhu onkologické léčby.
Paliativní péče (palliative care – PC) je v onkologii tradičně chápána jako přístup, který je indikován v pozdních stadiích nemoci po ukončení protinádorové terapie. V posledním desetiletí však vzrůstá evidence o pozitivním vlivu časného zahájení PC (early integration of palliative care – EPC) současně se standardní onkologickou léčbou [7]. V tomto kontextu začíná být PC chápána jako důsledná prevence a léčba všech symptomů ovlivňujících kvalitu života a utrpení, a to po celou dobu života s nevyléčitelnou nemocí, v průběhu protinádorové léčby i po jejím ukončení [8]. Výsledky četných studií opakovaně prokázaly, že EPC vede ke zlepšení kvality života, lepší kontrole symptomů, racionálnějšímu čerpání zdravotní péče a prodloužení života v lepší kvalitě [9,10]. EPC má pozitivní vliv i na pacientovy blízké a pečující. V kontrastu s tím z některých studií vyplývá, že léčba bolesti a ostatních symptomů není i přes současné možnosti dostatečná a velká část onkologických pacientů ve standardním módu onkologické péče zbytečně trpí [11,12]. Pro psychické symptomy platí podobné zásady jako pro symptomy tělesné. Adekvátní léčba všech symptomů a složek utrpení vyžaduje správné hodnocení, dostatek času a zkušeností. Zásadně důležitým faktorem pro stanovení plánu PC je pacientovo správné pochopení vlastního zdravotního stavu, tedy diagnózy, předpokládané prognózy a možného přínosu a rizik protinádorové léčby [5]. Řada studií naznačuje, že onkologové v rutinní praxi své pacienty o předpokládané prognóze neinformují nebo odhad délky přežití a přínosu protinádorové léčby výrazně nadhodnocují [13–17]. V tomto kontextu je stále aktuální otázka, do jaké míry má EPC vliv na kvalitu života pacientů a do jaké míry je tedy integrace EPC smysluplná a racionální.
Abychom mohli odpovědět na tuto stále aktuální otázku, byla realizována randomizovaná kontrolovaná studie s cílem ověřit, jaký vliv má integrace EPC formou pravidelné konzultace s lékařem specialistou na paliativní medicínu při standardní onkologické léčbě na kvalitu života pacientů a jejich příznaky úzkosti a deprese ve srovnání s pacienty, kteří podstupují standardní onkologickou léčbu. Předpokládáme, že pacienti, kteří podstupují EPC, budou mít vyšší kvalitu života a nižší úroveň celkového distresu ve srovnání s pacienty, kteří podstupují standardní onkologickou léčbu.
Soubor a metodika
Struktura studie
Do studie byli zařazeni dospělí pacienti s nově diagnostikovaným pokročilým nádorem plic, slinivky, žaludku, hlavy a krku a také pacienti, u kterých byla zahájena 1. linie nekurativní systémové protinádorové léčby, a dále také pacienti s kolorektálním karcinomem předléčení 2 liniemi systémové léčby s předpokládanou prognózou celkového přežití 12 měsíců. Všichni pacienti byli do studie zařazeni max. do 6 týdnů od zahájení paliativní systémové léčby. Možnost účasti ve studii byla pacientům nabídnuta jejich primárním ošetřujícím onkologem. V případě pacientova zájmu o účast ve studii byl pacient následně kontaktován koordinátorkou studie anebo jedním z lékařů paliativního týmu, kteří pacientovi podrobně vysvětlili účel a obsah studie. Pokud pacient s účastí souhlasil, byl následně randomizován v poměru 1 : 1 (počítačem generované zařazení) do intervenčního ramene (systematická PC + standardní onkologická péče) nebo do kontrolního ramene studie (standardní onkologická péče). Interval plánovaných konzultací s paliatrem v rámci intervenčního ramene studie byl 6–8 týdnů. Kromě tohoto plánovaného setkání zahrnovala péče v intervenčním rameni studie také možnost paliativního konzilia na žádost ošetřujícího onkologa nebo v případě potřeby na žádost pacienta či jeho blízkých. Obsahem konzultace s lékařem specialistou na paliativní medicínu byl kromě standardní léčby symptomů spojených s pokročilým nádorovým onemocněním také rozhovor o psychosociálních souvislostech pacientova onemocnění, o tom, jak nemoc zvládá, jaké jsou zdroje jeho sociální a spirituální podpory a také co snižuje pacientovu kvalitu života kromě zmíněných medicínských příznaků. První konzultace s lékařem specialistou na paliativní péči trvala v průměru 45 min, následné konzultace pak v průměru 20 min. V případě potřeby byla upravena farmakoterapie symptomů a někdy také doporučena konzultace s dalšími členy paliativního týmu (psycholog, kaplan, sociální pracovník). Primárním cílem studie bylo hodnocení kvality života a míry příznaků úzkosti a deprese u pacientů v obou ramenech studie, a to na začátku studie a pak po 2 a 4 měsících od randomizace. Sekundárními výstupy studie byly kvantitativní a kvalitativní hodnocení samotné protinádorové léčby v posledních 30 dnech života (farmakoterapie), doba přežití, frekvence využití hospicové péče a místo úmrtí. V době přípravy primárních výstupů pokračují někteří pacienti v léčbě v obou ramenech studie. Sekundární výstupy studie nejsou tedy ještě aktuálně dostupné.
Soubor
V období od 1. září 2015 do 31. prosince 2017 byla účast ve studii PALINT nabídnuta 156 pacientům, kteří splňovali zařazovací kritéria. S účastí ve studii souhlasilo 126 pacientů. Celkem 60 pacientů bylo zařazeno do intervenčního ramene, 66 pacientů do kontrolního ramene. Obě ramena byla srovnatelná z hlediska sociodemografických charakteristik a zastoupení jednotlivých diagnóz (tab. 1). Soubor dotazníků byl pacientům administrován v opakovaných intervalech po 6–8 týdnech. Dotazníky vyplňovali pacienti při hospitalizaci nebo po ambulantním ošetření za přítomnosti vyškolené zdravotní sestry, které se mohli zeptat na cokoli v případě nejasností při vyplňování. Vyplnění baterie trvalo přibližně 20 min.
Table 1. Popisná statistika výběrového souboru. 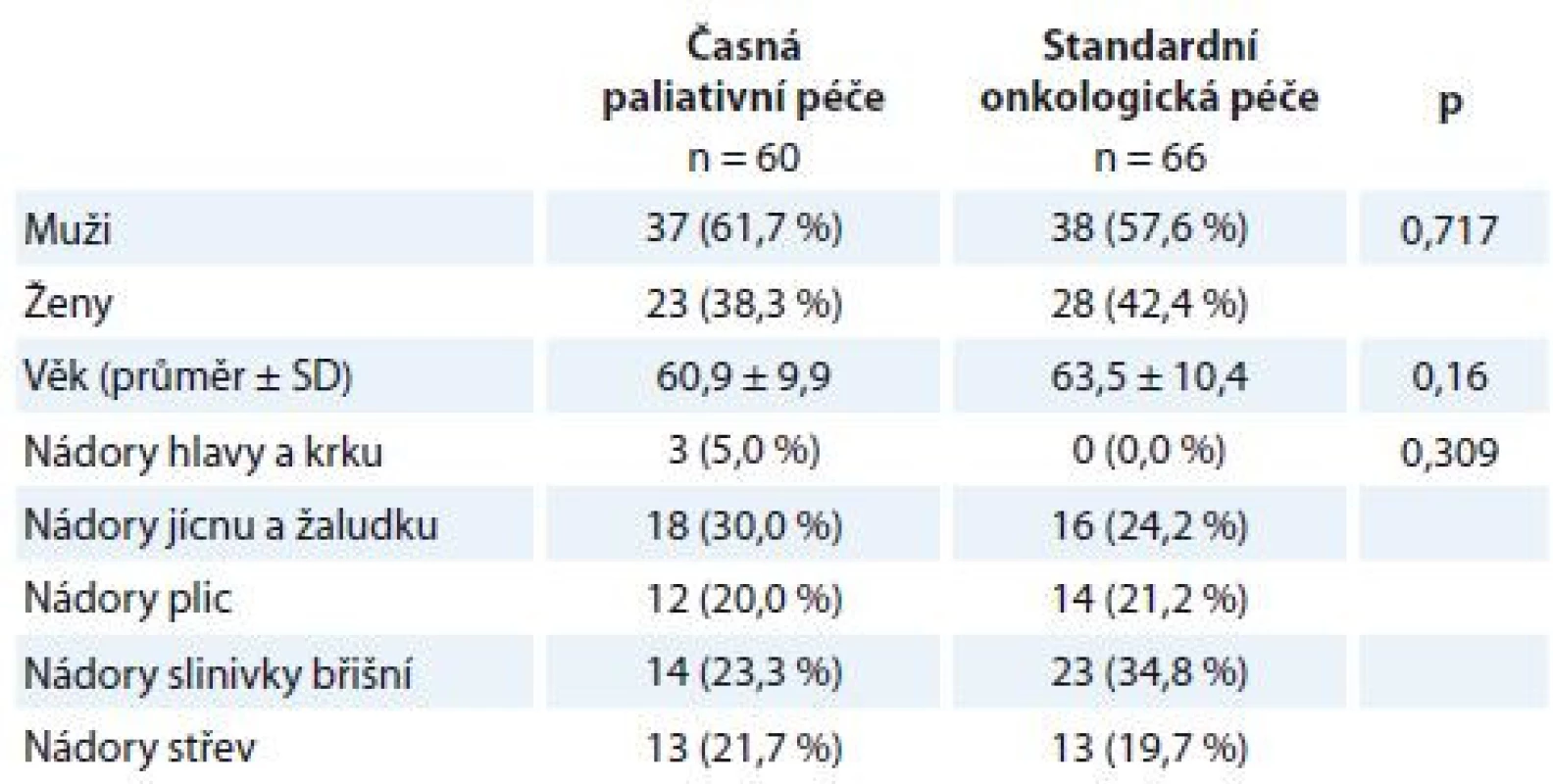
Kategoriální data jsou popsána jako absolutní a relativní frekvence. Věk je popsán jako průměr a směrodatná odchylka. Statistická významnost rozdílů mezi skupinami byla testována Fisherovým exaktním testem a párovým t-testem pro věk. SD – směrodatná odchylka Použité metody
Škála nemocniční úzkosti a deprese HADS
Škála HADS (Hospital Anxiety and Depression Scale) [18] sestává ze dvou subškál. Každá subškála má sedm položek. Subškála HADS-A (anxiety) měří příznaky úzkosti a subškála HADS-D (depression) pak příznaky deprese. Někdy se také používá celková škála HADS-T (total). HADS-T odráží také celkovou míru distresu [19]. Původně šlo o škálu, která měla kvantifikovat míru úzkosti a deprese u pacientů. Ukázalo se však, že její spolehlivost coby diagnostického nástroje je diskutabilní. Nejspolehlivěji funguje jako screeningová metoda a takto se také v medicínském prostředí používá nejčastěji. Nedávná metaanalýza Mitchella et al [19] dokládá, že HADS představuje spolehlivý screeningový nástroj s uspokojivou mírou specifity a senzitivity škály. Subškála deprese se zaměřuje na anhedonii bez přímého dotazování se na pokleslou náladu a dále se dotazuje na ztrátu zájmu a potěšení. Bodové normy jsou pro obě kategorie nejčastěji uváděny následovně: 0–7 bodů norma, 8–10 bodů hraničně abnormální pásmo, 11–21 bodů abnormální pásmo. Nejčastěji uváděné cut-off point pro jednotlivé subškály [19] jsou následující: HADS-T 15 bodů, HADS-D 8 bodů, HADS-A 8 bodů.
Dotazník kvality života EORTC QLQ-C30
Dotazník The European Organisation for Research and Treatment of Cancer Quality of life Questionnaire (EORTC QLQ-C30) [20] je třicetipoložkový sebeposuzovací dotazník, který se skládá z devíti subškál a šesti samostatných položek. Prvních pět subškál se zaměřuje na hodnocení úrovně fungování v oblasti fyzické, vztahové nebo rolové, emoční, kognitivní a sociální. Tři subškály se zaměřují na symptomy jako únava, bolest a nevolnost/zvracení. Poslední je pak dvoupoložková subškála celkového zdraví. Na ní pacient posuzuje svůj celkový stav pomocí sedmibodové škály, kde 1 znamená velmi špatné a 7 pak výborné. Každá položka je hodnocena na čtyřbodové škále: 1 vůbec ne, 2 trochu, 3 dost a 4 velmi hodně. Jednopoložkové subškály se pak dotazují na dušnost, nespavost, chuť k jídlu, zácpu, průjem, finanční potíže. Čím vyššího skóre pacient na škále dosáhne, tím horší jsou jeho příznaky a tím nižší je kvalita jeho života.
Statistická analýza dat
Statistická analýza získaných dat byla provedena v programu IBM SPSS verze 21. Kategoriální data byla popsána jako absolutní a relativní frekvence. Věk pacientů je popsán průměrem a směrodatnou odchylkou. Rozdíly mezi skupinami v četnosti pohlaví a diagnóz byly testovány Fisherovým exaktním testem, rozdíly ve věku byly testovány párovým t-testem a rozdíly ve škále celkového zdraví byly testovány Mann-Whitneyho U testem. Pro srovnání sledovaných proměnných v čase byl použit Wilcoxonův test. Abychom se vyhnuli riziku získání falešně pozitivních výsledků v důsledku problému násobného testování hypotéz, byla hladina významnosti stanovena na p = 0,008 (0,05/počet měření 6) dle Bonferroniho korekce. Hodnoty jsou popsány jako mediány a v závorkách jsou uvedeny minimální a maximální dosažené hodnoty. Rozdíly v míře úzkosti, deprese a celkového distresu jsou hodnoceny podle počtu pacientů, jejichž dosažené skóre bylo vyšší nebo rovno cut-off hranici škály. Vztah mezi skóre škály HADS a QLQ-C30 je vyjádřen Spearmanovou korelací.
Výsledky
Dynamika úzkosti a deprese
Statistické srovnání intenzity příznaků úzkosti a deprese měřené škálou HADS a pocitu celkového zdraví měřeného škálou EORTC QLQ-C30 mezi pacienty v časné paliativní péči a pacienty podstupujícími standardní onkologickou léčbu neprokázalo významné rozdíly mezi oběma skupinami (tab. 2 a 3). Významný rozdíl nebyl nalezen v žádném z opakovaných měření. Vzhledem k tomu, že se pacienti v obou ramenech studie od sebe neliší, další srovnání a korelační analýza byla provedena souhrnně pro všechny pacienty.
Table 2. Prevalence symptomů úzkosti a deprese dle HADS v intervenční a kontrolní skupině. 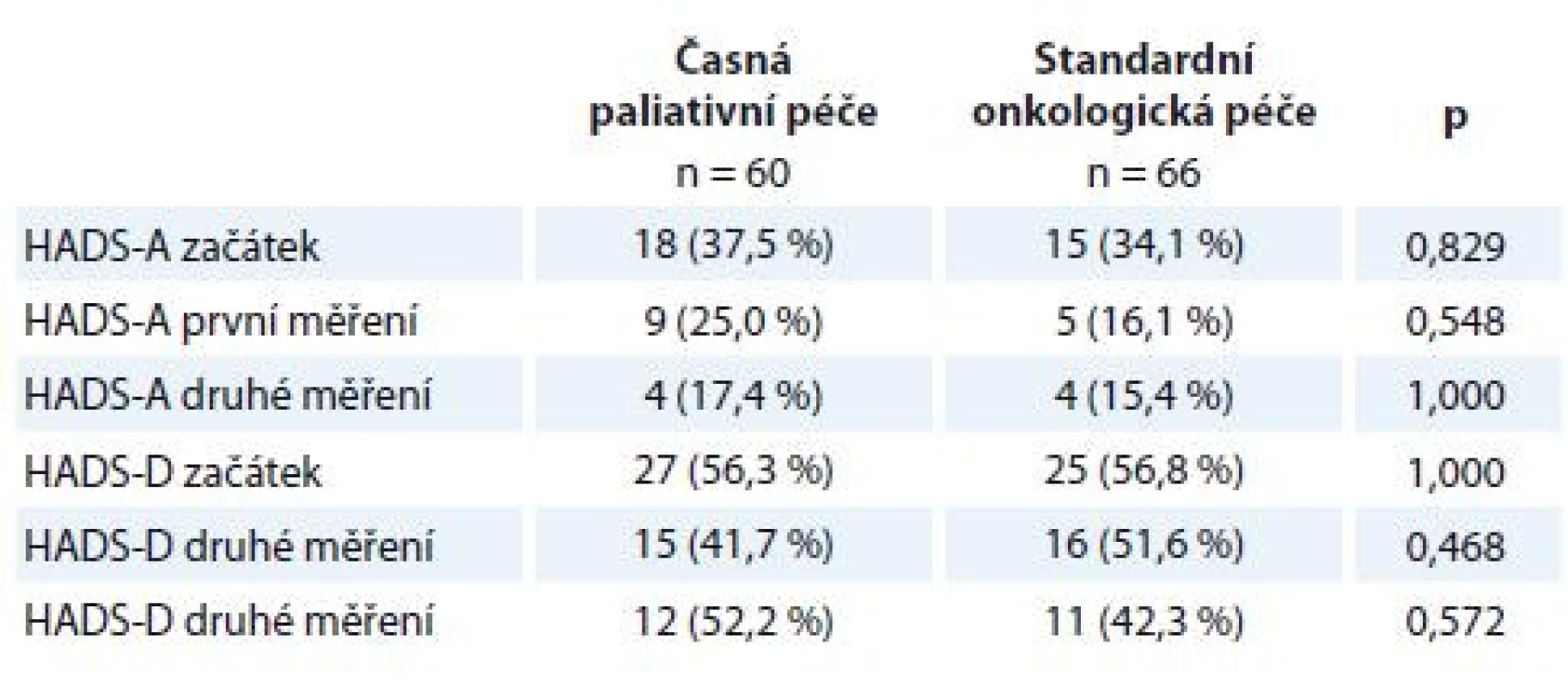
HADS-T (celkový skór; distres) cut-off 15 bodů, HADS-D (deprese) cut-off 8 bodů, HADS-A (úzkost) cut-off 8 bodů. Kategoriální data jsou popsána jako absolutní a relativní frekvence. Statistická významnost rozdílů mezi skupinami byla testována Fisherovým exaktním testem.
HADS – Hospital Anxiety and Depression ScaleTable 3. Rozdíl mezi rameny studie v úrovni subjektivně hodnoceného celkového zdraví škálou EORTC QLQ-C30. 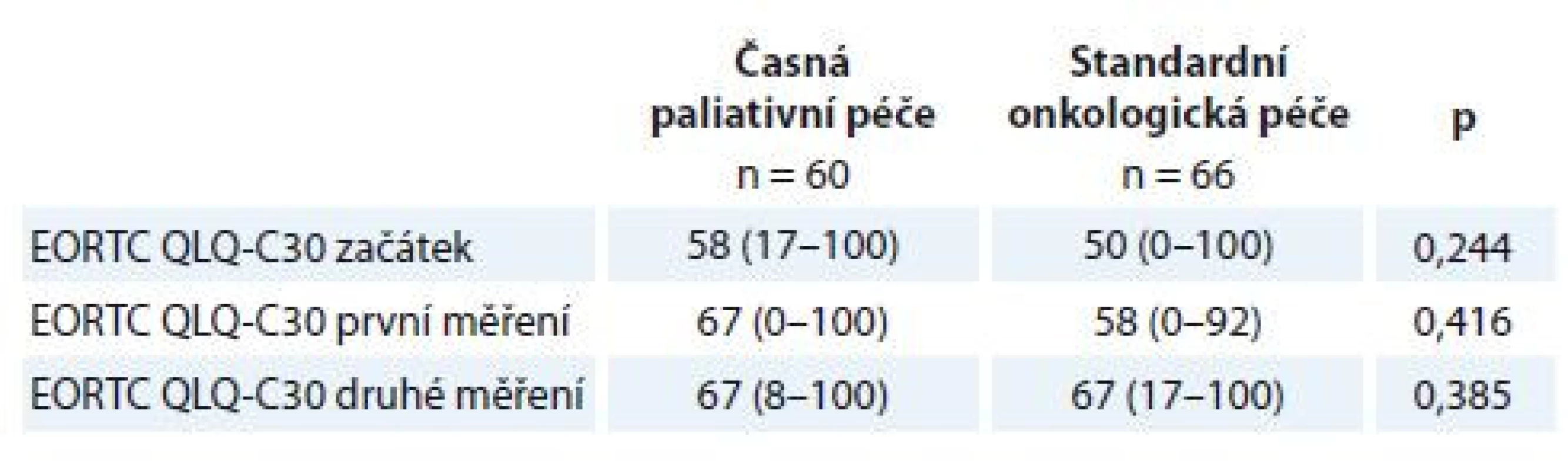
Proměnné jsou popsány mediánem a rozmezím naměřených výsledků (min. a max.). Statistická významnost rozdílů mezi skupinami byla testována Mann-Whitneho U testem.
EORTC QLQ-C30 – The European Organisation for Research and Treatment of Cancer Quality of Life QuestionnaireStatistické srovnání opakovaných měření škálou HADS u všech pacientů ve studii nedoložilo významné rozdíly ve střední hodnotě (medián) intenzity příznaků deprese, úzkosti a celkového distresu (tab. 4). Rovněž nebyly nalezeny žádné významné rozdíly v subjektivním hodnocení celkového zdraví měřené dotazníkem EORTC QLQ-C30 při opakovaných měřeních.
Table 4. Rozdíly v míře úzkosti a deprese při opakovaných měřeních. 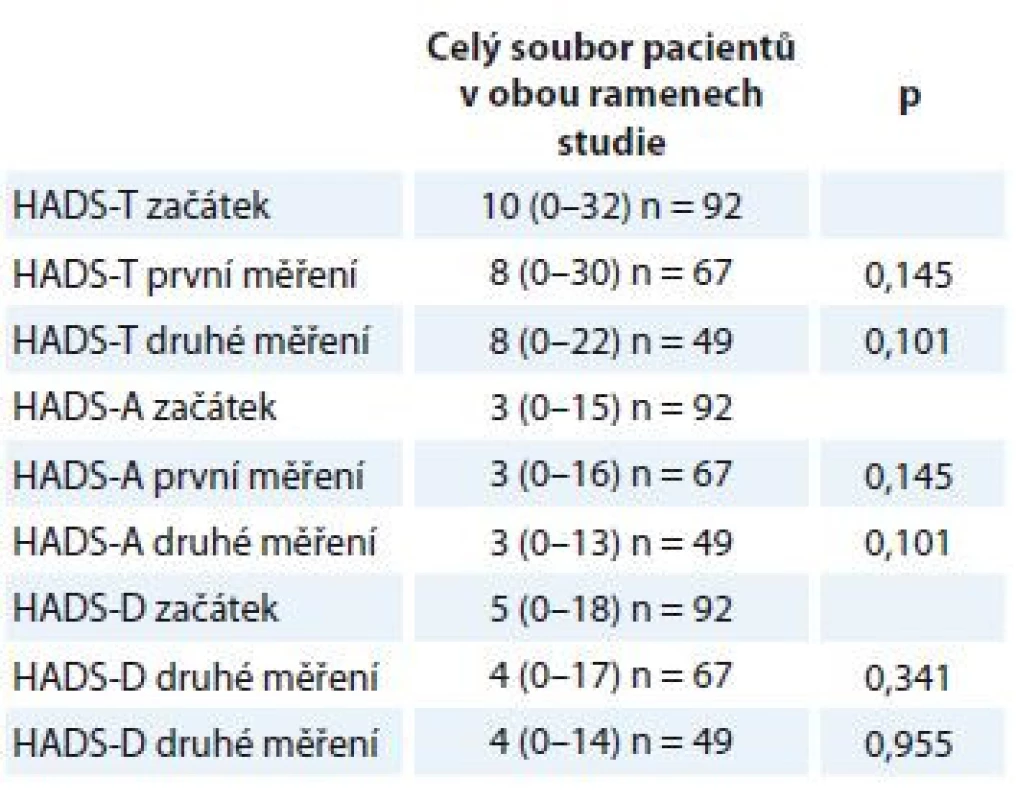
HADS-T (celkový skór; distres) cut-off 15 bodů, HADS-D (deprese) cut-off 8 bodů, HADS-A (úzkost) cut-off 8 bodů. Proměnné jsou popsány mediánem a rozmezím naměřených výsledků (min. a max.). Statistická významnost rozdílů mezi skupinami byla testována Wilcoxonovým párovým testem. HADS – Hospital Anxiety and Depression Scale Přestože střední hodnoty distresu, úzkosti a deprese zůstávaly pro celý soubor pacientů při opakovaných měřeních stejné, porovnání počtu pacientů, kteří dosáhli nebo překročili klinicky významné hodnoty (cut-off) na škále celkového distresu a subškálách pro úzkost a depresi, naznačuje rozdíly v jejich prevalenci v průběhu času (tab. 5). Na úrovni trendu lze pozorovat, že se počet osob s významnými příznaky distresu, úzkosti a deprese snižuje.
Table 5. HADS – Rozdíl v počtu pacientů v jednotlivých měřeních, kteří dosáhli nebo překročili cut-off škály, a subškál. 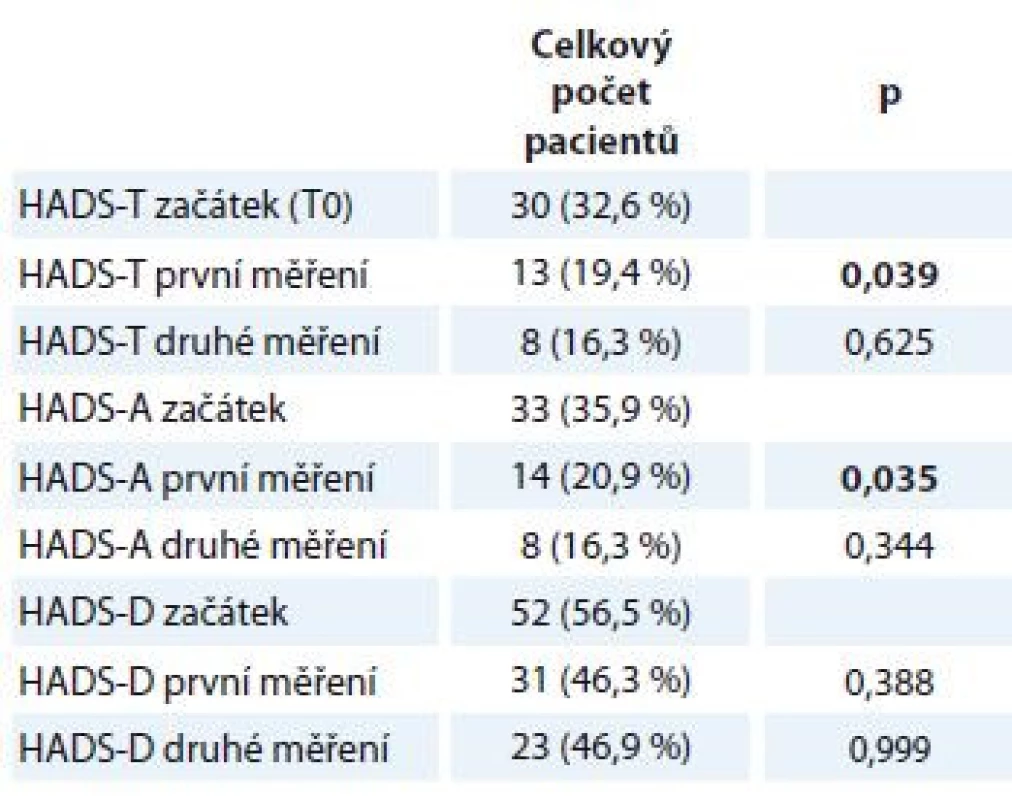
HADS-T (celkový skór; distres) cut-off 15 bodů, HADS-D (deprese) cut-off 8 bodů, HADS-A (úzkost) cut-off 8 bodů. Kategoriální data jsou popsána jako absolutní a relativní frekvence. Statistická významnost rozdílů mezi skupinami byla testována McNemarovým testem. HADS – Hospital Anxiety and Depression Scale Vztah úzkosti a deprese a celkové kvality života
Korelační analýza doložila významný vztah mezi mírou deprese a úzkosti měřených škálou HADS a celkovou úrovní subjektivně hodnoceného zdravotního stavu pacientů měřenou škálou EORTC QLQ-C30 (tab. 6). Výsledky dokládají, že čím více pacienti zažívají příznaky úzkosti a deprese, tím hůře hodnotí svůj celkový pocit fyzického zdraví.
Table 6. Korelace subškál HADS a QLQ-C30. 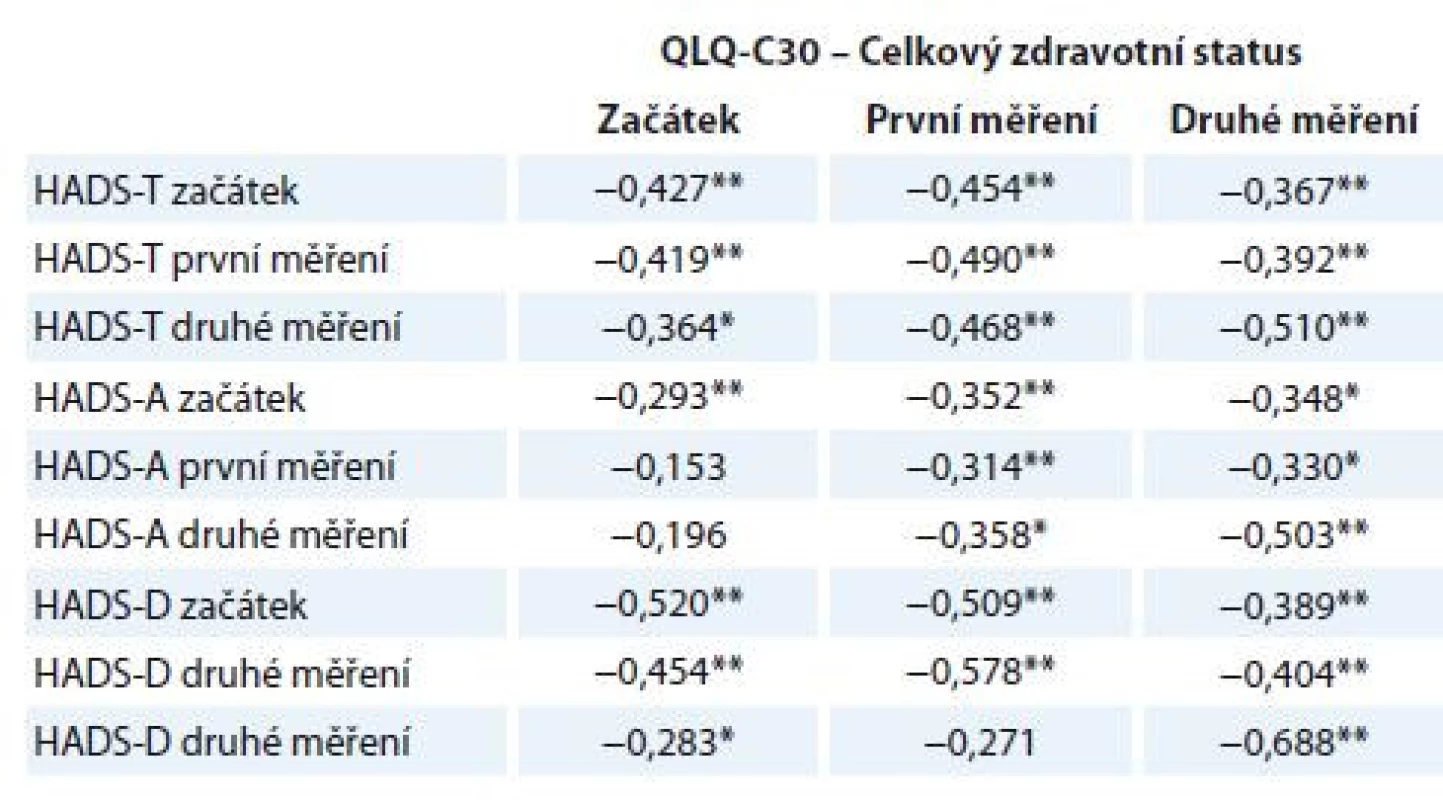
*p < 0,05; **p < 0,01. Korelace vypočítána jako Spearmanův korelační koefi cient. HADS – Hospital Anxiety and Depression Scale, EORTC QLQ-C30 – The European Organisation for Research and Treatment of Cancer Quality of Life Questionnaire, HADS-T – celkový skór; distres, HADS-D – deprese, HADS-A – úzkost Diskuze
Výsledky naší randomizované kontrolované studie neprokázaly předpokládaný významný rozdíl v míře příznaků úzkosti, deprese, celkového distresu a pocitu celkového zdraví mezi pacienty, u nichž byla integrována EPC jako součást standardní onkologické léčby, a těmi, kteří podstoupili standardní onkologickou léčbu. Nepodařilo se rovněž prokázat významné rozdíly ve sledovaných proměnných při opakovaných měřeních ve dvouměsíčních intervalech, tedy ne v mezích stanovené statistické významnosti. Přesto však výsledky stávající studie přinášejí důležité informace o prevalenci příznaků úzkosti, deprese a celkového distresu ve vybrané populaci pacientů s onkologickým onemocněním. Ukazuje se, že více než 30 % pacientů dosahuje na začátku léčby úrovně zvýšeného rizika pro rozvoj nebo přítomnost úzkostné nebo depresivní poruchy (distres 32,6 %, úzkost 35,9 %, deprese 56,5 %). V případě depresivních příznaků je to dokonce více než 50 % pacientů. Nalezen byl rovněž nenáhodný vztah mezi příznaky deprese, úzkosti a celkového distresu se subjektivně hodnocenou kvalitou života, resp. s hodnocením celkové úrovně zdraví.
Výsledky četných studií opakovaně dokládají, že EPC vede ke zlepšení kvality života, lepší kontrole symptomů, racionálnějšímu čerpání zdravotní péče a prodloužení života v lepší kvalitě a že má pozitivní vliv i na pacientovy blízké a pečující [9,10,12]. Tato zjištění jsou také v souhlasu s naší klinickou zkušeností. To, že naše výsledky neodpovídají zmíněným pozorováním, může odrážet fakt, že námi použité škály HADS a subškála celkového zdraví EORTC QLQ-C30 nejsou dostatečně senzitivní ke změnám, které jsme původně předpokládali. Lze očekávat, že rozdíly mezi jednotlivými rameny studie budou patrné až při srovnání samotné protinádorové léčby v posledních 30 dnech života (farmakoterapie), doby přežití, frekvence využití hospicové péče a místa úmrtí. Tyto další výstupy však nejsou vzhledem k pokračování studie aktuálně dostupné. Důležitým limitem studie je absence operacionalizované definice obsahu EPC provedené v paliativním rameni. PC v tomto rameni byla vymezena počtem konzultací, časem jejich trvání a tím, že rozhovor vedl specialista, paliatr. Nebylo však sledováno, co bylo obsahem těchto konzultací a zdali se lišily oproti konzultacím s onkology v rámci standardní onkologické léčby na odděleních a v ambulancích. Nevíme také, jak moc se pacienti odlišovali v míře znalostí o onemocnění a jeho prognóze. Nelze tedy v tuto chvíli jednoznačně posoudit, v čem se intervence z hlediska jejich obsahu přesně lišily.
Výsledky týkající se prevalence příznaků úzkosti, deprese a distresu ve vybrané populaci pacientů s onkologickým onemocněním odpovídají zjištěním i jiných autorů v této oblasti. Studie, které používaly sebeposuzovací škály, dokládají prevalenci příznaků stresu (např. úzkost, deprese, somatické obtíže jako nespavost, nervozita atd.) u 30 % pacientů v různé fázi nádorového onemocnění [2] a u 40 % a více pacientů pak uvádějí obtěžující psychické obtíže [3]. Zjištění, že příznaky deprese zůstávají na stejné úrovni, dokládají, že protrahovaný smutek, tak jak je definovaný škálou HADS, přetrvává u pacientů bez ohledu na léčbu a čas. Procento pacientů se zvýšenou intenzitou příznaků deprese, a tudíž zvýšeným rizikem pro rozvoj depresivní poruchy, je z našeho pohledu alarmující (téměř 50 % osob). Lze si představit, že adaptace se projevuje zejména jako pokles úzkosti a celkového distresu (pacienti vědí, co je čeká, mají větší kontrolu nad léčbou), zatímco příznaky deprese vyjadřují ztrátu životní jistoty a neřešitelnost situace. Výsledek z našeho pohledu jednoznačně dokládá, že management psychiatrických příznaků a zejména příznaků deprese představuje základní pilíř PC. Zjištění, že se subjektivně hodnocené příznaky úzkosti a deprese u některých pacientů při opakovaných měřeních nemění, odpovídá zjištěním, že i když dojde u pacientů k remisi onemocnění, referují o přetrvávající negativní emotivitě spojené se strachem z relapsu, popisují příznaky, které lze označit za posttraumatický stres, a dále pak také úzkost a depresi [21]. Tyto výsledky jen dokládají, jak významná je u vybraných pacientů psychoterapeutická a psychosociální podpora v průběhu celé léčby. Je také zřejmé, že opakovaný screening těchto příznaků by měl být nedílnou součástí každé kontroly u onkologa nebo paliatra.
Důležitost sledování příznaků deprese a úzkosti také podtrhuje další zjištění naší studie, a sice že míra úzkosti, deprese a distresu významně souvisí se subjektivně hodnocenou kvalitou života, resp. s hodnocením celkové úrovně zdraví. Korelační analýza samozřejmě nevysvětluje směr vztahu. Úzkost a deprese mohou zhoršovat celkový subjektivní pocit zdraví, ale může to být také naopak, tedy že dobrý management příznaků povede k poklesu úzkosti a deprese a distresu. Nejpravděpodobněji je tento vztah cirkulárně kauzální, tedy všechny příznaky se navzájem ovlivňují. Léčba jakéhokoli symptomu pak povede k ovlivnění ostatních symptomů.
Naše práce nepřímo dokládá, že screeningová metoda HADS představuje dostupný, jednoduchý, spolehlivý, pacienty nezatěžující a snadno vyhodnotitelný nástroj. Vzhledem k míře a frekvenci příznaků distresu u onkologických pacientů, které byly zjištěny v naší i jiných studiích, se nabízí otázka, zdali by použití screeningu úzkosti a deprese nemělo být standardní součástí kontroly u onkologa nebo paliatra, a to u všech pacientů a v různých fázích a modech léčby. Cílem není pacienty psychiatrizovat, nicméně se ukazuje, že klinické pozorování není vždy zcela spolehlivé. Například ve studii Söllnera et al [22] se ukázalo, že onkologové byli schopní rozpoznat závažný stres jen u 11 pacientů z 30, u kterých byl významný stres předem diagnostikován. Doporučení onkologů ohledně dalšího podpůrného poradenství nebo psychoterapie nekorelovalo se závažností prožívaného stresu pacientů, ale spíše s progresí onemocnění a větší otevřeností pacientů. Výsledky studie jen dokládají, jak je důležitá edukace onkologů v této oblasti, ale také skutečnost, že na klinický úsudek se v této oblasti nelze zcela spolehnout. O to častěji by mělo být indikováno psychologické nebo psychiatrické konzilium. To je ovšem ekonomicky a časově nemožné, a proto je třeba využívat standardizovaných sebeposuzovacích škál určených právě ke screeningu příznaků úzkosti a deprese. Ideální je takový nástroj, který je dostatečně senzitivní ke zmíněným příznakům, je snadno vyhodnotitelný samotným lékařem nebo zdravotní sestrou a zároveň příliš nezatíží pacienta.
Práce byla podpořena grantem MZ ČR AZV 15-33590A.
Autoři deklarují, že v souvislosti s předmětem studie nemají žádné komerční zájmy.
Redakční rada potvrzuje, že rukopis práce splnil ICMJE kritéria pro publikace zasílané do biomedicínských časopisů.
Obdrženo: 3. 12. 2018
Přijato: 24. 3. 2019
MUDr. Lucie Světláková
Klinika komplexní onkologické péče
Masarykův onkologický ústav
Žlutý kopec 7
65 653 Brno
e-mail: lucie.svetlakova@mou.cz
Sources
. Vodermaier A, Linden W, Siu C. Response: Screening for emotional distress in cancer patients: A systematic review of assessment instruments. J Natl Cancer Inst 2010; 102 (7): 508. doi: 10.1093/jnci/djq047.
2. Carlson LE, Angen M, Cullum J et al. High levels of untreated distress and fatigue in cancer patients. Br J Cancer 2004; 90 (12): 2297–2304. doi: 10.1038/sj.bjc.6601 887.
3. Grassi L, Sabato S, Rossi E et al. Use of the diagnostic criteria for psychosomatic research in oncology. Psychother Psychosom 2005; 74 (2): 100–107. doi: 10.1159/000083 168.
4. Anderkova L, Elfmarkova N, Sverak T et al. Change in quality of life measured over time in Czech women with breast cancer. Klin Onkol 2016; 29 (2): 113–121. doi: 10.14735/amko2016113.
5. Sochor M, Sláma O. Management of chronic and acute pain in patients with cancer diseases. Klin Onkol 2015; 28 (2): 94–98. doi: 10.14735/amko201594.
6. Reiche EMV, Nunes SOV, Morimoto HK. Stress, depression, the immune system, and cancer. Lancet Oncol 2004; 5 (10): 617–625. doi: 10.1016/S1470-2045 (04) 01 597-9.
7. Gaertner J, Wolf J, Voltz R. Early palliative care for patients with metastatic cancer. Curr Opin Oncol 2012; 24 (4): 357–362. doi: 10.1097/CCO.0b013e328352ea20.
8. Sochor M, Slama O, Loucka M. Early integration of palliative care into standard oncology care – benefits, limitations, barriers and types of palliative care. Klin Oncol 2015; 28 (3): 171–176. doi: 10.14735/amko2015171.
9. Parikh RB, Kirch RA, Smith TJ et al. Early specialty palliative care – translating data in oncology practice. N Engl J Med 2013; 369 (24): 2347–2351. doi: 10.1056/ NEJMsb1305469.
10. Šmíd D, Skalický T, Fichtl J et al. The influence of palliative chemotherapy on the quality of life of patients with gastric cancer. Klin Onkol 2016; 29 (4): 279–286. doi: 10.14735/amko2016279.
11. Von Roenn JH, Cleeland CS, Gonin R et al. Physician attitudes and practice in cancer pain management. A survey from the Eastern Cooperative Oncology Group. Ann Intern Med 1993; 119 (2): 121–126.
12. Breuer B, Fleishman SB, Cruciani SA et al. Medical oncologists’attitudes and practice in cancer pain management: a national survey. J Clin Oncol 2011; 29 (36): 4769–4775. doi: 13.1200/ JCO.2011.35.0561.
14. Mack JW, Wolfe J, Cook EF et al. Hope and prognostic disclosure. J Clin Oncol 2007; 25 (35): 5636–5642. doi: 10.1200/JCO.2007.12.6110.
15. Wright AA, Zhang B, Ray A et al. Associations between end-of-life discussions: patient mental health, medical care near death, and caregiver bereavement adjustments. JAMA 2008; 300 (14): 1665–1673. doi: 10.1001/ jama.300.14.1665.
16. Weeks JC, Catalano PJ, Cronin A et al. Patients’ expectations about eff ects of chemotherapy for advanced cancer. N Engl J Med 2012; 367 (17): 1616–1625. doi: 10.1056/ NEJMoa1204410.
17. Mack JW, Weeks JC, Wright AA et al. End-of-life discussions, goal attainment, and distress at the end of life: predictors and outcomes of receipt of care constistent with preferences. J Clin Oncol 2010; 28 (7): 1203–1208. doi: 10.1200/ JCO.2009.25.4672.
18. Zigmond AS, Snaith RP. The hospital anxiety and depression scale. Acta Psychiatr Scand 1983; 67 (6): 361–370. doi: 10.1111/j.1600-0447.1983.tb09716.x.
19. Mitchell AJ, Meader N, Symonds P. Diagnostic validity of the hospital anxiety and depression scale (HADS) in cancer and palliative settings: A meta-analysis. J Affect Disord 201; 126 (3): 335–348. doi: 10.1016/j.jad.2010.01. 067.
20. Aaronson NK, Ahmedzai S, Bergman B et al. The european organization for research and treatment of cancer QLQ-C30: A quality-of-life instrument for use in international clinical trials in oncology. J Natl Cancer Inst 1993; 85 (5): 365–376. doi: 10.1093/jnci/85.5. 365.
21. Yi JC, Syrjala KL. Anxiety and depression in cancer survivors. Med Clin North Am 2017; 101 (6): 1099–1113. doi: 10.1016/j.mcna.2017.06.005.
22. Söllner W, DeVries A, Steixner E et al. How successful are oncologists in identifying patient distress, perceived social support, and need for psychosocial counselling? Br J Cancer 2001; 84 (2): 179–185. doi: 10.1054/ bjoc.2000.1545.
Labels
Paediatric clinical oncology Surgery Clinical oncology
Article was published inClinical Oncology

2019 Issue 3-
All articles in this issue
- MikroRNA v mozkomíšním moku jako biomarkery u pacientů s nádory mozku
- Sledování prognózy HPV pozitivních a negativních orofaryngeálních karcinomů v závislosti na léčebné modalitě
- Nanočásticemi modifikovaný apoferritinový nanotransportér pro cílený transport cytostatik
- Prevalence symptomů úzkosti a deprese a jejich vliv na kvalitu života u pacientů v paliativní onkologické léčbě – projekt PALINT
- Rhabdomyosarkom gluteus maximus – kazuistika, přehled literatury a terapeutické cíle
- Neoadjuvantní užití hypertermické izolované perfuze končetiny v léčbě nediferencovaného vřetenobuněčného sarkomu dolní končetiny s dosažením kompletní patologické odpovědi
- Primární intrakraniální sarkomy, myxoidní meningeální sarkom – kazuistika a přehled literatury
- Osamelosť pacientov v predterminálnom a terminálnom štádiu nádorovej choroby, sociálny rozmer zomierania
- Současný FIGO staging karcinomu děložního hrdla a léčba jednotlivých stadií
- Asociace TNF-α -308G>A polymorfizmu s citlivostí na karcinom děložního čípku a prsu – systematický přehled a metaanalýza
- Clinical Oncology
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Současný FIGO staging karcinomu děložního hrdla a léčba jednotlivých stadií
- Rhabdomyosarkom gluteus maximus – kazuistika, přehled literatury a terapeutické cíle
- Prevalence symptomů úzkosti a deprese a jejich vliv na kvalitu života u pacientů v paliativní onkologické léčbě – projekt PALINT
- Osamelosť pacientov v predterminálnom a terminálnom štádiu nádorovej choroby, sociálny rozmer zomierania
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

