-
Medical journals
- Career
Cytogenetické vyšetření lymfocytů periferní krve po stimulaci IL‑2 a CpG oligonukleotidem DSP30 u pacientů s chronickou lymfocytární leukemií
Authors: K. Štěpanovská 1; G. Vaňková 1; V. Némethová 1; L. Tomášiková 1; P. Šmuhařová 1; E. Divíšková 1; V. Vallová 2; P. Kuglík 2; K. Plevová 1; A. Oltová 1; M. Doubek 1,3; Š. Pospíšilová 1,3; J. Mayer 1,3
Authors‘ workplace: Interní hematologická a onkologická klinika, Centrum molekulární biologie a genové terapie, LF MU a FN Brno2 Oddělení lékařské genetiky, laboratoř molekulární cytogenetiky, LF MU a FN Brno3 CEITEC – Středoevropský technologický institut, MU, Brno 1
Published in: Klin Onkol 2013; 26(4): 263-270
Category: Original Articles
Overview
Východiska:
Chromozomové změny patří u chronické lymfocytární leukemie (CLL) mezi významné prognostické faktory. Hlavní metodou využívanou k detekci těchto chromozomových změn je fluorescenční in situ hybridizace (FISH), klasické cytogenetické vyšetření vyžadující buňky v metafázi je u CLL problematické kvůli nízké proliferační schopnosti maligních B-lymfocytů in vitro. V roce 2006 byla publikována metoda umožňující získat metafázní B-lymfocyty u CLL s využitím stimulace pomocí IL‑2 a CpG oligonukleotidem DSP30. Cílem naší studie bylo ověřit účinnost stimulace a zhodnotit využitelnost této metody v rutinní praxi.Soubor pacientů a metody:
Celkem u 369 pacientů s diagnózou CLL byla vyšetřována periferní krev klasickou cytogenetickou metodou a současně metodou FISH pro oblasti 13q14, 11q22 – 23, CEP12 a 17p13.Výsledky:
Pro klasické cytogenetické vyšetření se stimulací podařilo získat metafázní buňky u 307 (83 %) z 369 pacientů. Chromozomové změny byly nalezeny u 243 (79 %) ze 307 hodnocených pacientů. Kromě aberací vyšetřovaných metodou FISH byly nalezeny další specifické změny v karyotypu např. del(6q), del(14q), t(14;18)(q32;q21), t(11;14)(q13;q32) a t(18;22)(q21;q11). U 103 (42 %) pacientů byly cytogenetickým vyšetřením nalezeny komplexní změny karyotypu, které metodou FISH detekovány nebyly.Závěr:
Stimulace pomocí IL‑2 a oligonukleotidu DSP30 účinně navozuje dělení maligních B‑lymfocytů a umožňuje zachytit velké množství chromozomových změn u CLL, které by při vyšetřování metodou FISH pro základní čtyři aberace zůstaly skryty. Používání této metody v rutinní praxi se osvědčilo hlavně při identifikaci pacientů s komplexními změnami karyotypu.Klíčová slova:
cytogenetika – chronická lymfocytární leukemie – interleukin‑2 – CpG ‑ ODN DSP30 – fluorescenční in situ hybridizace – kultivace – chromozomálníVýchodiska
Chronická lymfocytární leukemie (chronic lymphocytic leukemia – CLL) je nejčastější typ leukemie u dospělých v Evropě a Severní Americe [2]. Tvoří 25 – 30 % všech leukemií a vyskytuje se zejména u starší populace (medián věku pacienta při stanovení diagnózy je 65 let). Jedná se o onemocnění s variabilním klinickým průběhem i dobou přežití pacientů, proto je při posuzování vývoje nemoci a rozhodování, zda nasadit léčbu, nutné řídit se spolehlivými prognostickými faktory [3]. V současné době se k těmto prognostickým faktorům řadí také chromozomové změny v genomu B‑lymfocytu, které je možné identifikovat pomocí cytogenetických a molekulárně cytogenetických metod.
Standardně se k detekci chromozomových změn u CLL používá metoda fluorescenční in situ hybridizace (FISH), která poskytuje výhodu v tom, že ji lze provádět na buňkách v interfázi. Rutinně jsou touto metodou vyšetřovány lokusy pro čtyři nejčastější chromozomové změny u CLL: del(13q14), del(11q22 – 23), trizomie 12 a del(17p13), z nichž zejména nález del(17p13), která postihuje gen TP53, je spojen s velmi špatnou prognózou [4]. Klasická cytogenetická metoda vyžadující kultivaci kostní dřeně pro získání buněk v metafázi byla v minulých letech využívána jen omezeně, z důvodu nízké proliferační schopnosti maligních B‑lymfocytů in vitro, dokonce i v přítomnosti různých mitogenů [5]. Navíc v případech, kdy se podařilo získat buňky v metafázi a sestavit karyotyp buňky, byla kvalita chromozomů velmi špatná nebo se podařilo vykultivovat pouze B‑lymfocyty bez chromozomových změn. Překonat tento problém se podařilo až v roce 2006, kdy Dicker et al publikovali studii zabývající se kultivací B‑lymfocytů periferní krve v médiu s CpG oligonukleotidem DSP30 a interleukinem 2 [1,6]. Kultivace buněk s těmito stimulanty umožnila získat metafázní buňky ke zhodnocení až v 99 % případů a chromozomové změny byly nalezeny u více než 80 % z nich. Cílem naší studie bylo zavést tuto metodu do naší laboratoře a zhodnotit její využitelnost a přínos pro rutinní praxi.
Soubor pacientů a metody
Pacienti
Do studie bylo zařazeno celkem 369 pacientů s diagnózou CLL, jejichž vzorky byly analyzovány v naší laboratoři v období listopad 2009 až červenec 2012. Soubor pacientů byl tvořen 236 muži a 133 ženami, medián jejich věku byl 65 let (rozmezí 30 – 86 let). U všech pacientů byl získán písemný informovaný souhlas. U 65 pacientů byly získány 2 – 4 vzorky periferní krve v rámci kontrolních vyšetření v průběhu času, u zbylých pacientů jsme měli 1 vzorek (1 odběr).
Příprava preparátů pro cytogenetické vyšetření a FISH
Pacientům byla odebrána periferní krev do zkumavek s heparinem. Periferní krev byla následně kultivována v kultivačním médiu RPMI ‑ 1640 (Sigma) s přídavkem IL‑2 (200 U/ ml, Peprotech) a DSP30 (2 µmol/ l, TIB MolBiol). Množství krve přenesené do kultivačního média (0,2 – 1,5 ml) bylo určeno počtem leukocytů ve vzorku, který byl stanoven z posledního krevního obrazu pacienta před odběrem periferní krve pro cytogenetické vyšetření. Kultivace probíhala 72 hod při 37 °C v termostatu s 5% CO2. Kolchicin byl přidán 5 – 6 hod před zpracováním. Zpracování vzorku a barvení chromozomů bylo následně prováděno podle standardního protokolu [7]. Nalezené metafázní buňky byly hodnoceny pomocí softwaru LUCIA KARYO (Laboratory Imaging) a chromozomové změny byly zapsány podle pravidel ISCN 2009 (International system for human cytogenetic nomenclature) [8]. Za úspěšnou kultivaci byly považovány případy, kdy se podařilo získat nejméně pět metafázních buněk.
Preparáty pro metodu FISH byly připraveny ze stejné buněčné suspenze jako pro cytogenetické vyšetření. Metoda FISH byla prováděna podle standardního protokolu [9]. U všech pacientů byly použity sondy LSI p53/ LSI ATM a LSI D13S319/ LSI 13q34/ CEP12 Multi‑Color Probe Sets (Abott Molecular ‑ Vysis)nebo sondy XL ATM/ p53 a XL DLEU/ LAMP/ /12cen (MetaSystems). Na základě cytogenetického vyšetření byly došetřovány některé nálezy: del(6q) byla ověřována sondou ON 6q21/ MYC (8q24) (Kreatech), del(14q) byla ověřována sondou XL IGH plus pro oblast 14q32 (MetaSystems), t(14;18)(q32;q21) byla ověřována sondou LSI IGH/ BCL2 Dual Color Dual Vision Translocation Probe (Abott Molecular ‑ Vysis) nebo sondou XL IGH/ BCL2 (MetaSystems). Translokace t(11;14)(q13;q32) byla ověřována sondou LSI IGH/ CCND1 Dual Color Dual Vision Translocation Probe (Abott Molecular ‑ Vysis) a t(18;22)(q21;q11) byla ověřována sondou LSI MALT1 (18q21) Dual Color BreakApart Rearramgement Probe (Abott Molecular ‑ Vysis). Nalezené změny byly zapsány podle pravidel ISCN 2009 [8].
Výsledky
V naší laboratoři jsme vyšetřili pomocí klasického cytogenetického vyšetření (G - pruhování) s využitím stimulace oligonukleotidem DSP30 a IL‑2 a pomocí metody FISH vzorky periferní krve celkem od 369 pacientů s CLL. U 304 pacientů jsme vyšetřovali periferní krev pouze z jednoho odběru, u 65 pacientů jsme měli k dispozici další odběry z následujících kontrolních vyšetření v průběhu času. U 16 z nich se nepodařilo podruhé získat hodnotitelné preparáty, u zbylých 49 pacientů jsme pak měli možnost ověřit, zda se nálezy z jednotlivých odběrů shodují, a sledovat případné další změny v karyotypu. U 37 pacientů byly v následujících odběrech nalezeny stejné aberace, u 11 pacientů byly kromě dříve nalezených aberací přítomny další změny, u jednoho pacienta po léčbě byl v následujícím odběru nalezen normální karyotyp. Metodou FISH byly u všech pacientů vyšetřovány čtyři lokusy (tzv. CLL čtyřpanel): 13q14, 11q23, cep12 a 17p13. Úspěšně se podařilo zhodnotit všechny čtyři lokusy u 362 pacientů (98 %) z 369, u tří pacientů byl celý čtyřpanel nehodnotitelný, u dvou pacientů byly nehodnotitelné lokusy pro 13q14 a 11q23 a u dvou pacientů pouze lokus pro 13q14.
Kultivací krve se stimulanty se podařilo získat metafázní buňky ke zhodnocení karyotypu u 298 pacientů (81 %) z 369, u zbylých 71 pacientů (19 %) byly preparáty nehodnotitelné nebo se nepodařilo získat dostatečný počet metafázních buněk. Ovšem u devíti pacientů, jejichž vzorky krve byly při prvním vyšetření nehodnotitelné, jsme z dalšího odběru získali metafázní buňky, takže celková kultivační úspěšnost v celém souboru pacientů byla 83 % (307 pacientů) (graf 1). Nejnižší počet metafázních buněk, při němž jsme vzorek považovali za hodnotitelný, byl stanoven na pět. Pouze u 16 % pacientů se podařilo získat méně než deset metafázních buněk, naopak u 30 % pacientů jsme zhodnotili 20 a více metafázních buněk.
Graph 1. Grafické znázornění podílu pacientů, u nichž byly pomocí klasické cytogenetické metody získány hodnotitelné preparáty. 
Z 307 pacientů s hodnotitelnými preparáty byly pomocí klasické cytogenetické metody nalezeny chromozomové změny u 243 (79 %), 64 pacientů (21 %) mělo normální karyotyp (graf 2). Pacienty jsme rozdělili do tří skupinpodle počtu chromozomových změn v karyotypu (skupina 1: jeden chromozomový zlom nebo jedna numerická změna; skupina 2: strukturní a/ nebo numerické změny zahrnující dva chromozomy; skupina 3: komplexní změny karyotypu). Výsledky ukázaly, že 42 % pacientů (103) mělo komplexní změny karyotypu. Podrobněji jsou počty nalezených chromozomových změn popsány v grafu 3.
Graph 2. Grafické znázornění podílu pacientů s hodnotitelnými preparáty, u nichž byly nalezeny chromozomové změny. 
Graph 3. Počet chromozomových změn nalezených u pacientů s CLL klasickou cytogenetickou metodou. Skupina 1 – jeden chromozomový zlom nebo jedna numerická změna; skupina 2 – strukturní a/nebo numerické změny zahrnující dva chromozomy; skupina 3 – komplexní změny karyotypu. 
Nálezy při cytogenetickém vyšetření byly následně srovnávány s nálezy metodou FISH. Bylo zjištěno, že z 307 pacientů byly ve 149 případech (49 %) cytogenetickým vyšetřením nalezeny další chromozomové změny kromě aberací vyšetřovaných ve čtyřpanelu. U 158 pacientů (51 %) se výsledky obou metod shodovaly, přičemž u 40 z nich byly navíc metodou FISH detekovány změny, které cytogenetické vyšetření neodhalilo. Jednalo se zejména o monoalelickou nebo bialelickou deleci v oblasti 13q14, která je vzhledem k rozlišovací schopnosti cytogenetického vyšetření obtížně detekovatelná, případně byla aberace přítomna pouze v malém procentu interfázních jader.
Do skupiny 149 pacientů, u kterých byly cytogenetickým vyšetřením nalezeny další chromozomové změny, patřilo všech 103 pacientů s komplexními změnami karyotypu. Vzhledem k tomu, že všichni pacienti byli vyšetřováni pouze na CLL čtyřpanel, byla metoda FISH úspěšná v odhalení komplexních změn pouze u čtyř pacientů. Navíc u 14 pacientů s komplexními změnami byla metoda FISH negativní pro celý čtyřpanel. Na obr. 1 jsou ukázky karyotypu vybraných pacientů s komplexními změnami karyotypu.
Image 1. Ukázka karyotypu dvou pacientů s komplexními změnami. Červenými šipkami jsou označeny aberantní chromozomy. 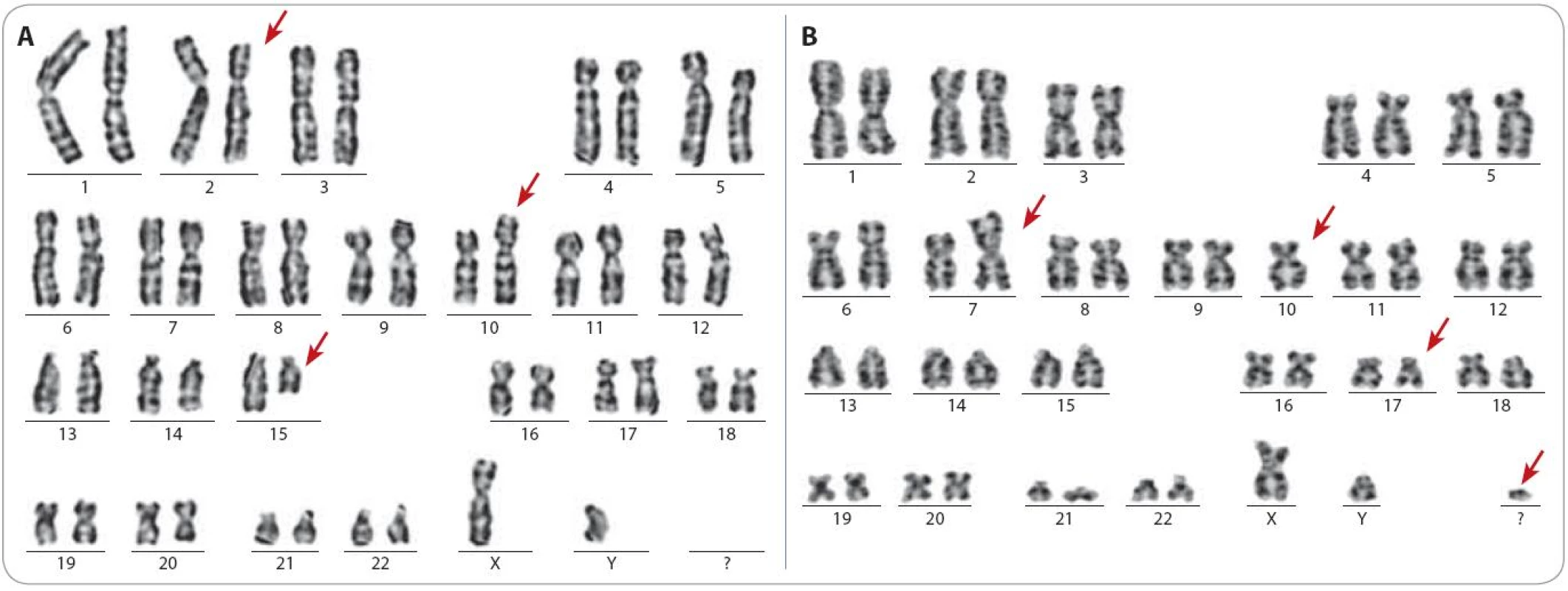
Podrobnější informace o pacientech s komplexními změnami karyotypu jsou uvedeny v tab. 1. U těchto pacientů jsme nezjistili žádnou závislost na RAI stadiu, ve kterém se v době odběru materiálu pro cytogenetické vyšetření nacházeli. Jednalo se však o heterogenní skupinu pacientů, protože pouze u části pacientů bylo cytogenetické vyšetření provedeno při stanovení diagnózy. Zbývající část pacientů byla vyšetřována již v průběhu nemoci, zatím bez léčby, nebo již po léčbě. Podobně nebyly nalezeny žádné chromozomové změny, které by byly u pacientů s komplexními změnami častější než u celého souboru pacientů, kromě del(17p13) zahrnující gen TP53. Nejčastější změnou byla del(13q14) u 40 pacientů z celkových 103 pacientů, del(11q22 – 23) u 28 pacientů. Del(17p) byla nalezena u 24 pacientů.
Table 1. Charakteristika pacientů s komplexními změnami karyotypu detekovanými klasickým cytogenetickým vyšetřením (n = 103). 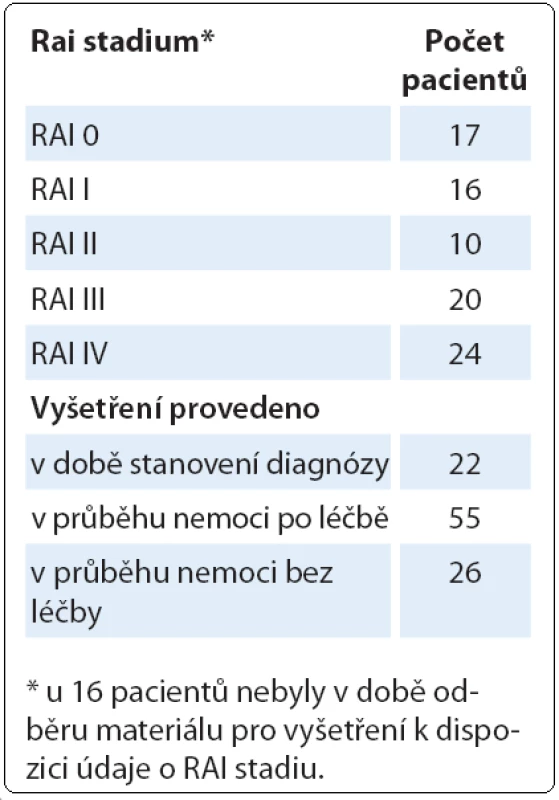
Dále jsme analyzovali, jaké chromozomové změny se v celém našem souboru pacientů vyskytovaly nejčastěji (tab. 2). V případě početních změn jsme nejčastěji nacházeli trizomii 12, a to u 34 z 307 pacientů (11 %). U dvou pacientů jsme dále našli trizomii 8, u dvou pacientů trizomii 18, u šesti pacientů nulisomii Y a u tří pacientů monosomii 22. Nejčastější strukturní změnou byla del(13q14), kterou jsme detekovali u 129 pacientů (42 %). Druhou nejčastější strukturní změnou byla del(11q22 – 23) nalezená u 68 pacientů (22 %). U 34 pacientů (11 %) jsme pak našli del(17p13) nebo ztrátu chromozomu 17; u 27 z nich se jednalo o klasickou del(17p13), u tří pacientů došlo ke ztrátě p ramena v důsledku vzniku i(17q), u tří pacientů došlo ke ztrátě p ramena v důsledku translokace s chromozomy 13, 15 nebo 18.
Table 2. Nejčastější chromozomové změny nalezené klasickou cytogenetickou metodou (n = 307). 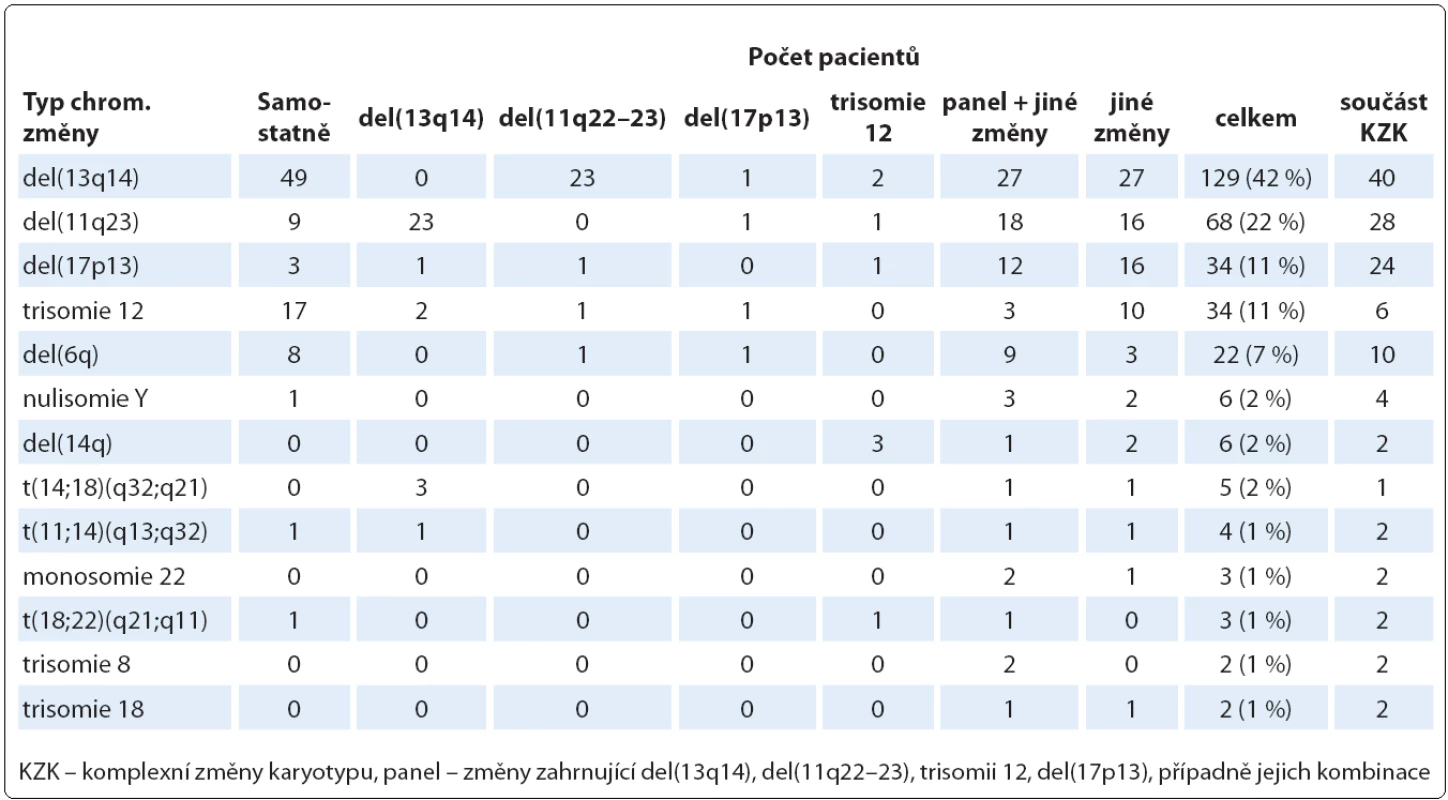
Kromě čtyř nejčastějších aberací, které jsou u CLL známé a standardně se vyšetřují metodou FISH ve čtyřpanelu, jsme nalezli i další změny, např. u 22 pacientů (7 %) byla přítomna del(6q) a u šesti pacientů (2 %) del(14q). Del(6q) byla ověřována metodou FISH použitím sondy pro oblast 6q21. U osmi pacientů to byla jediná změna v karyotypu, u zbylých 14 pacientů byly v karyotypu přítomny další chromozomové změny (u 10 z nich se jednalo o komplexní změny karyotypu). Del(14q) byla ověřována sondou pro oblast 14q32. U všech šesti pacientů byla přítomna spolu s dalšími změnami, z toho ve třech případech v klonu s trizomií 12.
Dále jsme u pacientů v našem souboru odhalili tři typy translokací typických pro lymfomy (obr. 2). U pěti pacientů to byla t(14;18)(q32;q21), která se u čtyř z těchto pacientů vyskytovala v klonu s del(13q14). U čtyř pacientů jsme našli t(11;14)(q13;q32), která byla u dvou pacientů opět v klonu s del(13q14). U tří pacientů byla přítomna t(18;22)(q21;q11), z toho dvakrát s trizomií 12. U žádného z těchto pacientů s translokacemi typickými pro lymfomy nedošlo na základě nalezené translokace k přehodnocení diagnózy, skutečně se jednalo o CLL. Kromě těchto translokací jsme u pacientů našli i další typy translokací, které se však vyskytovaly pouze u jednoho nebo dvou pacientů.
Image 2. Translokace nalezené při cytogenetickém vyšetření. Obr. 2 A. 46,XX,del(13q14),t(11;14)(q13;q32), Obr. 2 B. 45,XY,-17,t(18;22)(q21;q11), Obr. 2 C. 47,XY,+12,del(13q14),t(14;18)(q32;q21). 
Diskuze
Chromozomové změny, které jsou pravidelně nacházeny u pacientů s CLL, patří mezi prognostické faktory napomáhající odhadnout, jak se bude nemoc u konkrétního pacienta dále vyvíjet [3]. Hlavní metodou pro vyšetření chromozomových změn u těchto pacientů je fluorescenční in situ hybridizace, která je dostatečně citlivá a má velkou výhodu v tom, že ji lze provádět i na interfázních buňkách. Právě nízká schopnost dělení maligních B‑lymfocytů in vitro neumožňovala samostatně používat klasickou cytogenetickou metodu jako rutinní metodu pro vyšetřování pacientů. Často se nedařilo získat hodnotitelné preparáty a pokud ano, chromozomové změny byly zaznamenávány pouze ve 40–50 % případů, protože pro sestavení karyotypu byly většinou získány normální lymfocyty v metafázi místo těch maligních, které se velmi špatně dělí [5]. I přes tyto limitace je ale klasické cytogenetické vyšetření velmi přínosné v tom, že poskytuje možnost zhodnotit celou chromozomovou výbavu B‑lymfocytu, což metodou FISH nelze.
K navození dělení B‑lymfocytů byla v minulosti použita řada mitogenů, ale žádný z nich nepřinesl uspokojivé výsledky. K významnému posunu došlo až ve studii Dickera et al z roku 2006 o využití kombinace interleukinu 2 a oligonukleotidu DSP30 jako stimulantů při kultivaci periferní krve pacientů s CLL [1]. Této skupině se podařilo získat hodnotitelné preparáty u 95 % pacientů, z nichž 81 % mělo chromozomové změny. Stejná skupina o rok později publikovala rozsáhlou studii na 506 pacientech s CLL, kde stimulací lymfocytů IL‑2 a DSP30 dosáhli dokonce ještě lepších výsledků, hodnotitelné preparáty získali v 98,8 % případů, z nichž 83 % vykazovalo chromozomové změny [6]. Jejich výsledky však doposud nebyly ověřeny na větším souboru pacientů, jediná studie, ve které byl přesně zopakován navržený postup, zahrnovala pouze 24 pacientů s CLL [10]. Aby bylo možné zhodnotit, jestli je metoda navržená Dickerem et al [1] přínosná a použitelná pro rutinní vyšetření, provedli jsme v naší laboratoři cytogenetické vyšetření periferní krve pomocí stimulace IL‑2 a DSP30 podle navrženého postupu celkově u 369 pacientů s CLL.
Kultivací periferní krve pacientů s CLL v kultivačním médiu se stimulanty se podařilo získat hodnotitelné preparáty u 83 % pacientů ze souboru. Podíl nehodnotitelných případů byl tedy větší než ve svých studiích uváděli Dicker et al [1] a Haferlach et al [6] (17 % vs 5 %, resp. 1 %), ačkoliv množství přidávaných stimulantů byla stejná. Stejně tak dosáhla nižší úspěšnosti skupina, která tímto postupem vyšetřila 24 pacientů s CLL [10]. Hodnotitelné preparáty byly získány pouze v 75 % případů, je ale třeba vzít do úvahy, že u tak malého počtu pacientů nelze objektivně zhodnotit úspěšnost metody. Srovnatelnou úspěšnost jako v našem případě vzhledem k zisku hodnotitelných preparátů zaznamenaly dvě skupiny, které také testovaly vhodnost IL‑2 a DSP30 jako stimulantů pro CLL, ale kultivaci prováděly s odlišným množstvím IL‑2. Struski et al [11] úspěšně získali mitózy v 82 % případů z celkových 80, Put et al [12] v 83 % případů z 217.
Chromozomové změny jsme nalezli u 79 % hodnotitelných pacientů. Nález chromozomových změn u tak vysokého počtu pacientů je v souladu s výsledky Dickera et al [1] a Haferlacha et al [6], kteří zaznamenali abnormality konkrétně v 81 % a 83 % případů. Použití žádného jiného stimulantu dělení lymfocytů dosud neumožnilo odhalit chromozomové změny u tak vysokého počtu pacientů, srovnatelné výsledky přineslo pouze použití CD40L, kdy byly abnormality objeveny u 89 % pacientů [13]. Z důvodu technicky náročného postupu ale CD40L nelze rutinně využívat ke stimulaci buněk, na rozdíl od kultivace s IL‑2 a DSP30, která kromě samotných stimulantů vyžaduje pouze média a chemikálie standardně používané ke kultivaci a zpracování vzorků.
Kvůli vyloučení možnosti, že samotná kultivace s IL‑2 a DSP30 vytváří v lymfocytech chromozomové změny, provedli Dicker et al kontrolní vyšetření na pěti zdravých osobách. Ani u jedné z nich se po kultivaci nenašly chromozomové změny. Nedávno se otázkou vzniku chromozomových změn při kultivaci vzorku s CpG oligonukleotidy zabývalo CLL Research Consortium (CRC) [14]. Ve své studii nechali vyšetřit vzorky od 12 pacientů s CLL v pěti různých laboratořích, ve čtyřech z těchto laboratoří byl použit ke stimulaci přímo CpG oligonukleotid DSP30 v kombinaci s IL‑2 a IL‑15. Z výsledků vyplývá, že kultivační podmínky samy o sobě nevyvolávají chromozomové změny, protože u všech 12 pacientů se klonální nálezy z pěti různých laboratoří shodovaly a je velmi nepravděpodobné, že by se jednalo o stejné náhodné změny vzniklé na pěti různých pracovištích.
Nejčastější klonální chromozomové změny, které jsme našli u pacientů v našem souboru, byly delece standardně vyšetřované metodou FISH jako součást tzv. CLL čtyřpanelu. Převažovala del(13q14), která byla nalezena u 42 % hodnotitelných pacientů. Druhou nejčastější delecí byla del(11q22 – 23) zaznamenaná u 22 % hodnotitelných pacientů. Třetí delece vyšetřovaná ve čtyřpanelu, del(17p13), která je považovaná za výrazně negativní prognostický faktor, byla nalezena u 11 % pacientů. Nejčastější početní změnou nalezenou v našem souboru pacientů byla trizomie 12, zaznamenaná u 11 % pacientů.
Další aberací, kterou se podařilo zachytit v našem souboru pacientů, byla del(6q), která se vyskytovala u 7 % pacientů. Del(6q) není zahrnutá do čtyřpanelu pro CLL, takže se u pacientů standardně nevyšetřuje a ani její prognostický význam není tak dobře prozkoumán jako např. u del(13q14) nebo del(17p13). Nicméně se u pacientů s CLL objevuje pravidelně, její výskyt při detekci metodou FISH se v literatuře odhaduje na 7 % [15].
Další delecí, která se v našem souboru vyskytovala opakovaně, byla del(14q) u 2 % pacientů, což se shoduje s údaji od Haferlacha et al, kteří nalezli tuto deleci ve 3 % případů. Del(14q) nebyla u těchto pacientů ani v jednom případě jedinou změnou v karyotypu B‑lymfocytu, v polovině případů byla v klonu s trizomií 12. Na del(14q) se mnoho studií nezaměřuje a prognostický význam pro pacienty s CLL je velmi málo prozkoumán. V literatuře bylo zaznamenáno přibližně 60 až 70 případů CLL s del(14q), ale většinou byl pouze zmíněn nález této změny v karyotypu lymfocytu a bližší informace o vývoji nemoci a délce doby přežití pacienta poskytnuty nebyly [16]. Je zmíněno, že se objevovala buď samostatně, nebo i s jinými změnami, často s trizomií 12, a byla popsána i jako součást komplexních změn karyotypu [17]. Delece byly ve většině případů terminální, stejně jako u všech šesti pacientů z našeho souboru. V literatuře jsou ale popisovány také intersticiální delece, nejčastěji v oblasti 14q24 – q32. Kromě CLL byly delece na chromozomu 14 nalezeny i u dalších B buněčných malignit, např. difuzního velkobuněčného lymfomu nebo akutní lymfoblastické leukemie.
Zajímavým nálezem byly reciproké translokace typické pro některé typy lymfomů. Jednalo se konkrétně o t(11;14)(q13;q32), t(18;22)(q21;q11) a t(14;18)(q32;q21). Tyto translokace byly ověřovány metodou FISH, takže díky znalosti sekvence použitých sond je možné určit, že zlomy na chromozomech nastaly v oblastech 14q32, 18q21, 11q13 a 22q11, kde jsou lokalizovány významné geny. V oblasti 14q32 leží lokus pro gen IgH, v oblasti 18q21 potom gen Bcl‑2, významný člen rodiny antiapoptotických genů. V oblasti 11q13 se nachází gen Bcl‑1, který kóduje cyklin D, a v oblasti 22q11 gen IgL. Translokace zahrnující imunoglobulinové geny se celkově u B buněčných malignit vyskytují poměrně často, názory na výskyt u CLL se však liší [18,19].
Translokace (14;18)(q32;q21) je charakteristická pro folikulární lymfom, kde bývá přítomna u 85 % případů [20]. Kromě folikulárního lymfomu byla nalezena také u 15–20 % případů difuzního velkobuněčného lymfomu. Případů, kdy byla zaznamenána u pacientů s CLL, je v literatuře popsáno přibližně 20, Haferlach et al [6] ve své studii uvádějí sedm případů. Tato translokace se objevuje jako jediná abnormalita v karyotypu lymfocytu nebo spolu s dalšími abnormalitami, např. s trizomií 12. Prognostický význam (14;18)(q32;q21) u CLL není dobře prozkoumán, názory na spojitost s průběhem nemoci se liší [18,19].
Translokace t(11;14)(q13;q32) se objevuje zejména u lymfomů z plášťových buněk (65 % případů), ale nalezena byla také u B prolymfocytární leukemie, plazmacelulární leukemie, splenického lymfomu s vilózními lymfocyty a také u CLL [16]. Dvě větší studie o t(11;14)(q13;q32) u pacientů s CLL publikovali Cuneo et al [21] a De Angeli et al [22]. Zjistili, že t(11;14)(q13;q32) se vyskytuje hlavně u případů s atypickou CLL a že je často přítomná spolu s del(13q14). V našem souboru se spolu vyskytovaly u dvou pacientů ze čtyř. Prognostický význam t(11;14)(q13;q32) je u CLL zatím nejasný.
Podobně o t(18;22)(q21;q11) a jejím prognostickém významu není mnoho známo. V literatuře bylo popsáno přibližně 10 případů, kdy se vyskytovala samostatně nebo s dalšími změnami, což souhlasí i s nálezem u pacientů z našeho souboru [16].
Vzhledem k tomu, že všichni pacienti v našem souboru byli současně vyšetřováni metodou FISH na CLL čtyřpanel, měli jsme možnost srovnat, jaké jsou rozdíly ve schopnosti těchto dvou metod zachycovat chromozomové změny. Prokázalo se, že každá metoda měla své limitace. Cytogenetickým vyšetřením byly u téměř poloviny všech pacientů s hodnotitelnými preparáty (149 pacientů) nalezeny chromozomové změny, které nemohla metoda FISH zachytit, protože pro ně nebyly použity sondy. Nejvíce byl rozdíl v záchytu patrný u pacientů s komplexními změnami karyotypu, kterých bylo pomocí klasického cytogenetického vyšetření odhaleno celkem 103 (tato skupina tvořila 42 % ze všech pacientů, u kterých se podařilo najít nějakou chromozomovou změnu). Pouze metoda FISH by tyto komplexní změny odhalila jen u čtyřech z nich, a 14 z těchto pacientů mělo dokonce negativní celý čtyřpanel. Z výsledků proto vyplývá, že metoda FISH nemá schopnost zachytit značnou část chromozomových změn u pacientů s CLL. Zatím není jasné, jaký význam tyto komplexní změny v karyotypu mají a jakým způsobem ovlivňují prognózu pacienta. Vzhledem k tomu, že do našeho souboru pacientů byli kromě nově diagnostikovaných a dosud neléčených pacientů zařazeni i pacienti, kteří už léčbu dostávali, nebylo možné tuto skupinu podrobněji analyzovat. Nicméně detailnější studie na jednotném souboru pacientů by mohly např. ukázat, jestli se u těchto pacientů vyskytují specifické chromozomové změny už v době diagnózy nemoci a jestli nějakým způsobem ovlivňují průběh nemoci.
Na druhou stranu určité limitace se prokázaly také u cytogenetického vyšetření, protože metodou FISH byly detekovány abnormality, které cytogenetické vyšetření nezachytilo. Cytogenetické vyšetření selhalo převážně v záchytu del(13q14), monoalelické nebo bialelické. Ovšem ve všech případech se jednalo o intersticiální deleci, která je cytogeneticky velmi těžce rozeznatelná, protože klasické cytogenetické vyšetření nemá tak vysokou rozlišovací schopnost jako metoda FISH a delece malé oblasti na chromozomu je poměrně obtížné zachytit. V ostatních případech se buď podařilo stimulací získat jen malý počet metafázních buněk, nebo se při vyšetření FISH prokázalo, že tyto chromozomové změny byly přítomny pouze v malém počtu buněk. Je proto možné, že pokud by byl získán větší počet metafázních buněk a sestaven u nich karyotyp, cytogenetické vyšetření by úspěšné bylo.
Závěr
Závěrem lze tedy shrnout, že cytogenetické vyšetření stimulované periferní krve výrazně napomáhá zvýšit záchyt chromozomových změn u pacientů s CLL a umožňuje odhalit i jiné, méně časté změny, které nejsou rutinně vyšetřovány metodou FISH. Na rozdíl od metody FISH také umožňuje odhalit komplexní změny karyotypu. Jedná se o technicky nenáročnou metodu prováděnou na periferní krvi, proto zavedení této metody do běžné praxe nepřináší žádnou další zátěž pro pacienta ani pro laboratoř.
Práce byla podpořena grantovými projekty IGA MZ ČR NT11218-6/2010 a NT13493--4/2012, projekty MŠMT OPVK SuPReMMe CZ.1.07/2.3.00/20.0045 a VaVPI CEITEC CZ.1.05/1.1.00/02.0068, Českou leukemickou skupinou pro život „CELL“ a projektem (Ministerstva zdravotnictví) koncepčního rozvoje výzkumné organizace 65269705 (FN Brno).
Autoři deklarují, že v souvislosti s předmětem studie nemají žádné komerční zájmy.
Redakční rada potvrzuje, že rukopis práce splnil ICMJE kritéria pro publikace zasílané do bi omedicínských časopisů.
Mgr. Kristina Štěpanovská
Interní hematologická a onkologická klinika
Centrum molekulární biologie a genové terapie
LF MU a FN Brno
Černopolní 9
625 00 Brno
e-mail: kristina.stepanovska@fnbrno.cz
Obdrženo: 11. 10. 2012
Přijato: 10. 6. 2013
Sources
1. Dicker F, Schnittger S, Haferlach T et al. Immunostimulatory oligonucleotide‑induced metaphase cytogenetics detect chromosomal aberrations in 80% of CLL patients: a study of 132 CLL cases with correlation to FISH, IgVH status, and CD38 expression. Blood 2006; 108(9): 3152 – 3160.
2. Swerdlow SH, Campo E, Harris NL et al. WHO Classification of tumours of haematopoietic and lymphoid tissues. 4th ed. Lyon: IARC 2008.
3. Adam Z, Šmardová J, Krejčí M et al. Chronická B‑lymfatická leukemie. In: Adam Z, Krejčí M, Vorlíček J et al (eds). Hematologie – přehled maligních hematologických nemocí. 2. vyd. Praha: Grada 2008 : 177 – 196.
4. Malciková J, Smardová J, Rocnová L et al. Monoallelic and biallelic inactivation of TP53 gene in chronic lymphocytic leukemia: selection, impact on survival, and response to DNA damage. Blood 2009; 114(26): 5307 – 5314.
5. Juliusson G, Oscier D, Gahrton G et al. Cytogenetic findings and survival in B ‑ cell chronic lymphocytic leukemia – 2nd IWCCLL compilation of data on 662 patients. Leuk Lymphoma 1991; 5(1): 21 – 25.
6. Haferlach C, Dicker F, Schnittger S et al. Comprehensive genetic characterization of CLL: a study on 506 cases analysed with chromosome banding analysis, interphase FISH, IgVH status and immunophenotyping. Leukemia 2007; 21(12): 2442 – 2451.
7. Haferlach C, Bacher U. Cytogenetic methods in chronic lymphocytic leukemia. In: Campbell LJ (ed). Cancer cytogenetics: Methods and protocols. 2nd ed. New York: Humana Press 2011 : 119 – 130.
8. Shaffer L, Slovak ML, Campbell L. ISCN 2009: An International System for Human Cytogenetic Nomenclature (2009). 1st ed. Basel: Karger 2009.
9. Swansbury J, Min T, Aruliah S. Fluorescence in situ hybridization methods and troubleshooting applied to fixed cell suspensions. In: Campbell LJ (ed). Cancer cytogenetics: Methods and protocols. 2nd ed. New York: Humana Press 2011 : 13 – 32.
10. Wren C, Moriarty H, Marsden K et al. Cytogenetic investigation of chronic lymphocytic leukemia. Cancer Genet Cytogenet 2010; 198(2): 155 – 161.
11. Struski S, Gervais C, Helias C et al. Stimulation of B ‑ cell lymphoproliferations with CpG ‑ oligonucleotide DSP30 plus IL‑2 is more effective than with TPA to detect clonal abnormalities. Leukemia 2009; 23(3): 617 – 619.
12. Put N, Konings P, Rack K et al. Improved detection of chromosomal abnormalities in chronic lymphocytic leukemia by conventional cytogenetics using CpG oligonucleotide and interleukin‑2 stimulation: A Belgian multicentric study. Gene Chromosomes Cancer 2009; 48(10): 843 – 853.
13. Buhmann R, Kurzeder CH, Rehklau J et al. CD40L stimulation enhances the ability of conventional metaphase cytogenetics to detect chromosome aberrations in B ‑ cell chronic lymphocytic leukaemia cells. Br J Haematol 2002; 118(4): 968 – 975.
14. Heerema NA, Byrd JC, Dal Cin PS et al. Stimulation of chronic lymphocytic leukemia cells with CpG oligodeoxynucleotide gives consistent karyotypic results among laboratories: A CLL Research Consortium (CRC) Study. Cancer Genet Cytogenet 2010; 203(2): 134 – 140.
15. Stilgenbauer S, Bullinger L, Benner A et al. Incidence and clinical significance of 6q deletions in B cell chronic lymphocytic leukemia. Leukemia 1999; 13(9): 1331 – 1334.
16. Mitelman Database of Chromosome Aberrations and Gene Fusions in Cancer (2012) [homepage on the Internet]. Mitelman F, Johansson B and Mertens F (eds). [updated 2012 Aug; cited 2012 Aug 20]. Available from: http:/ / cgap.nci.nih.gov/ Chromosomes/ Mitelman.
17. Pospisilova H, Baens M, Michaux L et al. Interstitial del(14q) involving IGH: a novel recurrent aberration in B ‑ NHL. Leukemia 2007; 21(9): 2079 – 2083.
18. Sen F, Lai R, Albitar M. Chronic lymphocytic leukemia with t(14;18) and trisomy 12. Arch Pathol Lab Med 2002; 126(12): 1543 – 1546.
19. Lu G, Kong Y, Yue C. Genetic and immunophenotypic profile of IGH@ rearrangement detected by fluorescence in situ hybridization in 149 cases of B ‑ cell chronic lymphocytic leukemia. Cancer Genet Cytogenet 2010; 196(1): 56 – 63.
20. Winter JN, Gascoyne RD, Van Besien K. Low ‑ grade lymphoma. Hematology Am Soc Hematol Educ Program 2004 : 203 – 220.
21. Cuneo A, Bigoni R, Negrini M et al. Cytogenetic and interphase cytogenetic characterization of atypical chronic lymphocytic leukemia carrying BCL1 translocation. Cancer Res 1997; 57(6): 1144 – 1150.
22. De Angeli C, Gandini D, Cuneo A et al. BCL ‑ 1 rearrangements and p53 mutations in atypical chronic lymphocytic leukemia with t(11;14)(q13;q32). Haematologica 2000; 85(9): 913 – 921.
Labels
Paediatric clinical oncology Surgery Clinical oncology
Article was published inClinical Oncology

2013 Issue 4-
All articles in this issue
- Moderní zobrazovací techniky pro antracyklinová cytostatika – literární přehled
- Současné trendy adjuvantní chemoterapie u nemalobuněčného karcinomu plic
- Degradace proteinů ubikvitin‑proteazomovou dráhou
- Karcinom pankreatu a faktory životního stylu
- Cytogenetické vyšetření lymfocytů periferní krve po stimulaci IL‑2 a CpG oligonukleotidem DSP30 u pacientů s chronickou lymfocytární leukemií
- Registr neuroendokrinních nádorů (NET) v ČR po třech letech sběru dat
- Je ten istý tyrozín- kinázový inhibítor efektívny aj po vzniku mozgových metastáz? Kazuistika
- Týdenní vs dvoutýdenní aplikace cetuximabu v léčbě metastatického kolorektálního karcinomu – aktuální klinická data
- Dimenze onkochirurgie
- Synchronní bilaterální testikulární tumor ze zárodečných buněk: kazuistika a přehled literatury
-
Onkologie v obrazech
Giant Metastatic Testicular Tumor
- Clinical Oncology
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Registr neuroendokrinních nádorů (NET) v ČR po třech letech sběru dat
- Degradace proteinů ubikvitin‑proteazomovou dráhou
- Současné trendy adjuvantní chemoterapie u nemalobuněčného karcinomu plic
- Cytogenetické vyšetření lymfocytů periferní krve po stimulaci IL‑2 a CpG oligonukleotidem DSP30 u pacientů s chronickou lymfocytární leukemií
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

