-
Medical journals
- Career
Algoritmus separace plazmatických buněk ze vzorků kostní dřeně
Authors: I. Burešová 1; D. Kyjovská 1,2; L. Kovářová 2; J. Moravcová 1; R. Suská 2; T. Perutka 1; J. Čumová 1; R. Hájek 1,2,3
Authors‘ workplace: Babákův výzkumný institut, LF MU Brno 1; Oddělení klinické hematologie, Laboratoř experimentální hematologie a buněčné imunoterapie, FN Brno 2; Interní hematoonkologická klinika FN Brno 3
Published in: Klin Onkol 2011; 24(1): 35-40
Category: Original Articles
Overview
Východiska:
Cílem této práce je představit algoritmus separace plazmatických buněk ze vzorků kostní dřeně pacientů s mnohočetným myelomem. Zisk vysoce čistých buněčných populací je základní podmínkou aplikace moderních výzkumných postupů u tohoto onemocnění.Materiál a metody:
Vzorky kostní dřeně byly získány od pacientů z Interní hematoonkologické kliniky FN Brno. Kostní dřeň byla nejprve zbavena červené složky (metodou hustotní gradientové centrifugace nebo lyzace), plazmatické buňky byly označeny monoklonální protilátkou proti syndecanu-1 (CD138) a separovány magneticky nebo na buněčném sorteru. Čistota separované populace byla vyhodnocena na průtokovém cytometru, případně morfologicky.Výsledky:
Paralelně, magnetickou a fluorescenční separací, bylo zpracováno 28 vzorků kostní dřeně a byla vyhodnocena čistota separovaných frakcí. Na základě statistického hodnocení výsledných čistot jak v celém souboru vzorků, tak ve skupinách podle vstupního zastoupení plazmatických buněk byl navržen algoritmus separace s cut-off hodnotou 5 % plazmatických buněk v mononukleární frakci KD: vzorky s < 5 % plazmatických buněk jsou nadále tříděny na buněčném sorteru, vzorky s ≥ 5 % plazmatických buněk jsou separovány na magnetickém separátoru. Po ročním vyhodnocení uplatnění tohoto algoritmu na souboru 210 vzorků kostní dřeně se medián čistoty separovaných plazmatických buněk zvedl z 62,4 % (0,4–99,6 %) na 94,0 % (23,9–100 %).Závěr:
Zavedení metodiky fluorescenčního třídění výrazně přispělo k celkovému zvýšení úspěšnosti separace plazmatických buněk ze vzorků kostní dřeně, a to především u vzorků s jejich nízkým vstupním zastoupením, kde dosud využívaná metodika magnetické separace není dostatečně účinná. Otevřela se tím také cesta k separaci plazmatických buněk ze vzorků kostní dřeně od jedinců s monoklonální gamapatií nejasného významu, kde je zastoupení plazmatických buněk typicky velmi nízké (desetiny, max. jednotky procent).Klíčová slova:
mnohočetný myelom – plazmatická buňka – monoklonální gamapatie nejasného významu – magnetická separace – buněčný sorterVýchodiska
Základní podmínkou aplikace moderních výzkumných postupů – cytogenetiky, genomiky, proteomiky nebo různých čipových technologií – ve výzkumu monoklonálních gamapatií (MG) je vysoká čistota zkoumané buněčné populace. V podmínkách našeho pracoviště jde především o plazmatické buňky (PB) z kostní dřeně. Typicky se jejich procentuální zastoupení v kostní dřeni pohybuje od velmi nízkých hodnot, pod 0,5 % PB u jedinců s monoklonální gamapatií nejasného významu (monoclonal gammopathy of undetermined significance – MGUS) nebo v remisi mnohočetného myelomu (MM), po velmi vysoké, 50 % a více u pacientů s agresivním onemocněním, což znesnadňuje výběr separační strategie.
Obecně se k separaci buněk využívá fenotypu cílových buněk a značení monoklonálními protilátkami konjugovanými s detekčním prvkem – nejčastěji magnetickou partikulí nebo fluorochromem. Vlastní separace pak probíhá v příslušném detekčním systému (magnet nebo průtokový cytometr se sorterem) postupem pozitivní (detekční systém vybírá cílové buňky) nebo negativní selekce (systém zachycuje nežádoucí buňky).
K izolaci PB je již dlouhodobě a ve velkém rozsahu využívána imunomagnetická separace, a to jak ve formě negativní selekce, spočívající v odstranění jiných buněčných populací než PB [1–2], tak pozitivní, využívající především univerzálního znaku PB, syndecanu-1/CD138 [3–5]. Později, s dostupností nových vysokorychlostních sorterů, se začala využívat i technika fluorescenčního třídění [6]. Ze srovnání těchto postupů (tab. 1) je zřejmé, že každý z nich má své přednosti i nevýhody uplatnění v konkrétních podmínkách.
V naší laboratoři byla technika magnetické separace zavedena již před několika lety [7] a dále optimalizována v podmínkách automatizovaného provozu [8]. Koncem roku 2006 jsme získali vysokorychlostní buněčný sorter a začali testovat metodu fluorescenčního třídění PB. Tato práce představuje výsledky dosažené při srovnání obou separačních postupů, algoritmus separace PB vytvořený na jeho základě a jeho úspěšné ověření během ročního rutinního provozu.
Materiál a metody
Vzorky kostní dřeně (KD) byly odebrány pacientům z ambulance či oddělení Interní hematoonkologické kliniky FN Brno s jejich informovaným souhlasem. Odebraná kostní dřeň (objem 20–40 ml) byla smíchána se stejným objemem IMDM (Iscove‘s Modified Dulbecco‘s Medium, Sigma) s přidaným heparinem a DNázou (Roche Diagnostics) a tentýž den zpracována za účelem separace. Vzorek byl rozdělen na dva díly, které byly zpracovány paralelně jak metodou magnetické separace, tak na buněčném sorteru.
Červená složka KD byla odstraněna lyzací roztokem chloridu amonného (0,83% NH4Cl) nebo denzitní gradientovou centrifugací na Histopaque 1077 [7]. Zastoupení CD138+ buněk v mononukleární frakci (dále vstupní infiltrace) bylo stanoveno průtokovou cytometrií.
Magnetická separace mononukleární frakce (mononuclear cells – MNC) byla prováděna patentovanou technologií MACS (Miltenyi Biotec) na separátoru AutoMACS dle doporučení výrobce. Separace byla prováděna postupem pozitivní selekce pomocí protilátky namířené proti syndecanu-1 a konjugované s magnetickou kuličkou (CD138 Microbeads; Miltenyi Biotec). Pro separaci jsme používali program possels s pomalejším průchodem jednou kolonou.
Separace na buněčném sorteru byla provedena jednak po lyzaci, jednak po izolaci MNC (viz výše). MNC nebo lyzovaná KD byly inkubovány (30 min, 4 °C) s fluorescenčně značenou protilátkou proti syndecanu-1 (CD138-PE, Beckman-Coulter nebo Exbio). Po promytí byly buňky resuspendovány studeným PBS a tříděny na vysokorychlostním buněčném sorteru FACSAria (BD Biosciences). Sorter pracoval s intermediárním nastavením čistoty proti výtěžku, ke třídění byly vybírány buňky se silnou expresí znaku CD138 a z třídění byly vyloučeny dublety negativních a pozitivních buněk. PB byly tříděny do zkumavek se 2 ml sběrného média (10% telecí fetální sérum v RPMI médiu).
Čistota pozitivní a negativní frakce byla hodnocena pomocí průtokové cytometrie jako % CD38+ CD138+ nebo CD138+ buněk a podle možností i morfologicky (cytospin a prohlédnutí po panoptickém obarvení) jako % PB. Aby mohly být separované buňky využity pro další analýzy, bylo potřeba dosáhnout alespoň 70% zastoupení PB/CD138+ buněk v pozitivní frakci.
Vyhodnocení srovnání magnetické a fluorescenční separace bylo provedeno v souboru všech 28 vzorků, ale také po rozdělení vzorků do třech skupin – podle vstupní infiltrace. V první skupině byly vzorky s infiltrací < 5 %, ve druhé s infiltrací 5–10 % a ve třetí s infiltrací > 10 %. Výsledky byly hodnoceny neparametrickým Kruskall-Wallis ANOVA testem a Mann-Whitney testem (na hladině významnosti 5 %).
Výsledky
Bylo zpracováno 28 vzorků kostní dřeně s mediánem vstupní infiltrace 9,3 % (0,8–67,2 %). Pozitivní frakce po magnetickém zpracování měla medián čistoty 80,4 % (8,6–99,6 %) při morfologickém a 74,0 % (8,1–97,1 %) při cytometrickém hodnocení. U tříděných lyzovaných buněk byla čistota pozitivní frakce 97,4 % (50,0–100,0 %) při morfologickém a 95,4 % (24,3–99,3 %) při cytometrickém hodnocení a u tříděné mononukleární frakce byly získány hodnoty 98,2 % (50,0–100,0 %) a 96,9 % (55,4–99,3 %). Čistoty pozitivních frakcí při rozdělení vzorků do skupin podle vstupní infiltrace jsou uvedeny v tab. 2. Rozdíly mezi čistotami pozitivních frakcí při různých způsobech zpracování byly statisticky významné (p = 0,003 při morfologickém a p < 0,001 při cytometrickém hodnocení). Po rozdělení vzorků do skupin podle vstupní infiltrace byl při morfologickém hodnocení statisticky významný rozdíl potvrzen jen ve skupině vzorků s infiltrací < 5 % (p = 0,013), při cytometrickém hodnocení se tento rozdíl projevil ve všech třech skupinách (tab. 3). Další statistická analýza prokázala statisticky významný rozdíl mezi čistotami pozitivních frakcí magneticky separovaných buněk a tříděných buněk, bez ohledu na způsob jejich přípravy před tříděním (nedokumentováno).
Analyzovali jsme závislost získané čistoty pozitivní frakce na vstupní infiltraci a zjistili jsme, že nemá charakter pozitivní korelace: hodnoty korelačních koeficientů mezi vstupní infiltrací a čistotou pozitivní frakce magneticky separovaných, tříděných lyzovaných a tříděných mononukleárních buněk byly 0,524, 0,170 a -0,399 při morfologickém a 0,524, 0,367 a -0,371 při cytometrickém hodnocení. Nicméně se stoupající vstupní infiltrací rostla úspěšnost dosažení požadované minimální 70% čistoty (tab. 4).
Negativní frakce po magnetickém zpracování měla medián zastoupení reziduálních PB/CD138+ buněk 2,4 % (0,2–38,0 %) při morfologickém a 1,3 % (0,2–25,7 %) při cytometrickém hodnocení. U tříděných lyzovaných buněk bylo nalezeno 0,4 % (0,0–3,2 %) reziduálních PB/CD138+ buněk při morfologickém a 0,1 % (0,0–1,0%) při cytometrickém hodnocení. U tříděné mononukleární frakce byly získány hodnoty 1,6 % (0,0–4,0 %) a 0,1 % (0,0–0,1 %) reziduálních PB/CD138+ buněk. Výsledky čistoty negativních frakcí při rozdělení vzorků do skupin podle vstupní infiltrace jsou uvedeny v tab. 5. Rozdíly mezi čistotami negativních frakcí byly statisticky významné (p < 0,001 při morfologickém i cytometrickém hodnocení), a to jak v celém souboru vzorků, tak při jeho rozdělení do skupin (tab. 3). Další statistická analýza prokázala statisticky významné rozdíly mezi všemi typy separace (nedokumentováno).
Na základě výše uvedených statistických analýz byl vytvořen algoritmus separace PB z KD, který jako rozhodovací parametr využívá 5% zastoupení PB v MNC (obr. 1). Podle uvedeného algoritmu separace bylo v období 12 měsíců (září 2008–září 2009) zpracováno celkem 210 odběrů KD s mediánem vstupní infiltrace 3,1 % (0,05–85,2 %). Medián čistoty pozitivní frakce byl 94,0 % (23,9–100 %) oproti 62,4 % (0,4–99,6 %) z doby před zavedením algoritmu. Zlepšila se úspěšnost v dosažení vysoké čistoty vzorků: pro skupiny vzorků s infiltrací < 5 %, 5–10 % a > 10 % byla úspěšnost dosažení alespoň 70% čistoty před zavedením algoritmu 28,6 %, 66,7 % a 81,8 %, kdežto po zavedení algoritmu 95,5 %, 85,3 % a 84,7 %.
Image 1. Algoritmus separace PB z KD (PB-MNC = zastoupení CD38+CD138+ buněk v KD). 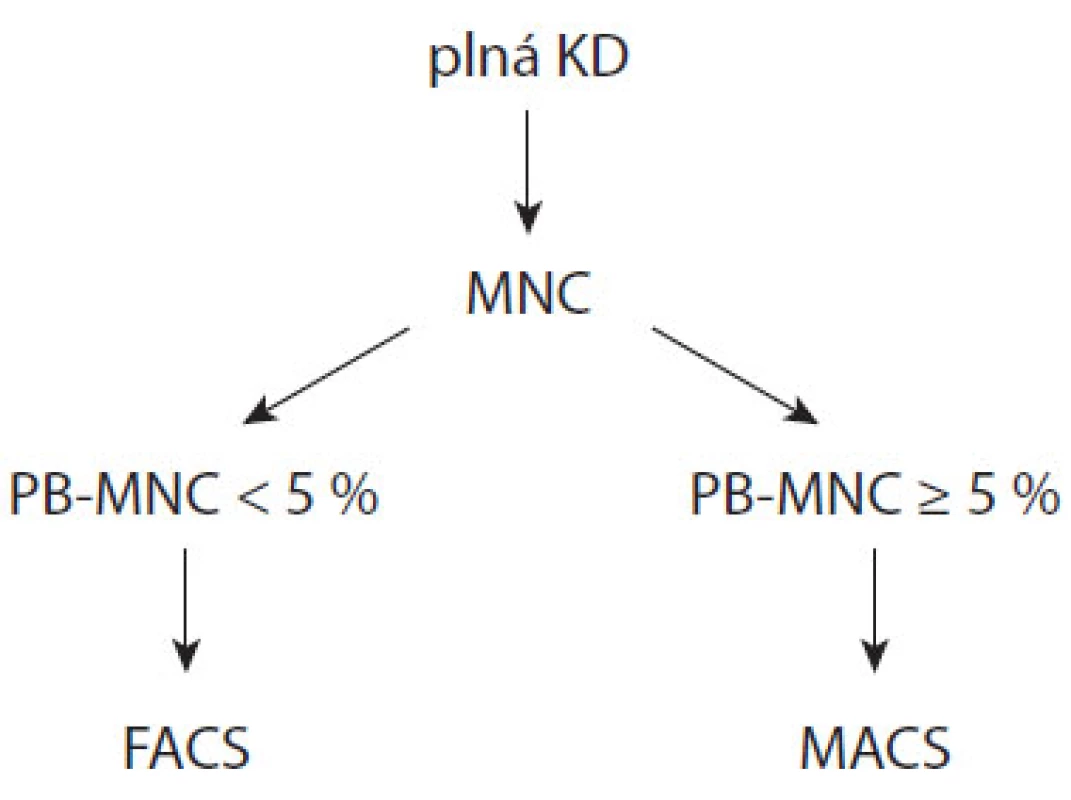
Diskuze
Naším cílem je využívat co nejefektivněji dostupnou přístrojovou techniku (magnetický separátor AutoMACS a vysokorychlostní sorter FACSAria) pro separaci PB z KD. Proto jsme provedli paralelní srovnání obou typů separace a analýzu výsledků separací s cílem vytvořit algoritmus poskytující optimální výsledky čistoty v optimálním čase a za rozumnou cenu.
Pro značení buněk před separací používáme protilátku proti znaku CD138 (syndecan-1; pro magnetické značení klon B-B4, pro fluorescenční klon B-A38 – oba odvozeny od buněčné linie U266). Oběma typy separace tak získáváme obdobné buňky. Znak CD138 nesou patologické i normální PB [9] a byl již dříve akceptován jako vhodný a vysoce reprezentativní marker pro selekci PB a pro většinu následných genetických studií [10]. Jak magneticky, tak fluorescenčně značené protilátky proti tomuto znaku jsou běžně komerčně dostupné. Použití pozitivní selekce na základě jednoho znaku s sebou nese výhodu nižší ceny, i když historicky byla preferována negativní selekce [1–2].
Zatímco magnetickou separaci máme optimalizovánu pro mononukleární buňky [7–8], před tříděním jsme vyzkoušeli dvě metody přípravy – přípravu mononukleárních buněk odstředěním na hustotním gradientu a lyzaci červené složky kostní dřeně. Obě metody jsou různými pracovišti používány a i my jsme si ověřili, že z hlediska čistoty získaných frakcí jsou obě použitelné. Separace mononukleárních buněk s sebou nese výhodu redukce celkového počtu buněk, což znamená jednak úsporu protilátek nutných pro označení cílové populace, jednak u fluorescenčního třídění také významné snížení doby nutné pro separaci.
Pro vyhodnocení čistoty získaných populací jsme používali dva různé přístupy – morfologické hodnocení po cytospinu a hodnocení průtokovou cytometrií. Hodnoty čistoty, stanovené uvedenými postupy, se u jednotlivých vzorků v různé míře lišily a projevilo se to i v rozdílech ve statistické významnosti. Každá z těchto metod pracuje s jinou chybou stanovení – zatímco průtoková cytometrie analyzuje v jednom testu tisíce buněk, morfologické vyhodnocení se provádí v souboru 250 buněk. Průtoková cytometrie podhodnocuje vysoké hodnoty, protože z analýzy nelze nikdy zcela vyloučit nebuněčné příměsi. Každá z těchto metod také pracuje s trochu jiným parametrem. Ne každá CD138+ buňka musí být buňka plazmatická [11] a ne každá plazmatická buňka musí být nutně CD138+/++ [12]. Nicméně přes některé rozdíly ve statistické významnosti nebyly výsledky z těchto dvou pohledů principiálně odlišné nebo rozporné, a nebyly tedy překážkou při vyvození praktických závěrů z této studie.
Hodnotili jsme pouze čistotu separovaných buněk a nezabývali jsme se jejich výtěžkem. Bylo to dáno omezeným množstvím plné KD, které jsme mohli použít. Pokud se u jednoho vzorku sešla nízká infiltrace s nízkým celkovým množstvím buněk, získali jsme v pozitivní frakci třeba jen několik tisíc buněk. Tento počet stačil k ověření čistoty pomocí průtokové cytometrie, ale neumožňoval věrohodné vyhodnocení získaného počtu buněk.
Někteří autoři popsali pozitivní korelaci mezi procentem cílových buněk ve vstupním a separovaném materiálu. Např. pro magnetickou separaci CD34+ buněk z periferní krve pomocí přístroje VarioMACS [13], ale také pro negativní imunomagnetickou selekci plazmatických buněk z kostní dřeně [1-2]. V naší studii jsme takovouto jednoznačnou závislost nepotvrdili. Určitou souvislost se vstupní infiltrací jsme ale pozorovali u všech metod – projevovala se zužováním intervalu dosažených čistot ve skupinách podle stoupající vstupní infiltrace, a to jak u pozitivní, tak negativní frakce a při obou způsobech vyhodnocení (tab. 2, 5). Výraznější byl tento trend u magneticky separovaných buněk. Úspěšnost třídění buněk je na samotné vstupní infiltraci méně závislá a je zřejmě více ovlivněna dalšími faktory (nastavení sorteru, definice separované populace apod).
Jako rozhodovací kritérium pro různé typy separace bylo zvoleno zastoupení PB v MNC stanovené průtokovou cytometrií – toto stanovení je u nás rutinně prováděno a v postupu separace představuje prodlevu max. 60 min. Jako cut-off hodnotu pro volbu typu separace jsme stanovili vstupní infiltraci 5 %. Magnetickou separaci využíváme u vzorků s infiltrací > 5 %, kdy upřednostňujeme jednoduchost a rychlost provedení při přijatelné úspěšnosti dosažení vysoké čistoty vzorku. Fluorescenční třídění se ukázalo jako nenahraditelné u vzorků s infiltrací < 5 %, kde je časová náročnost vyvážena vysokou dosaženou čistotou.
Zvládnutí techniky separace PB umožňuje na jedné straně využití moderních výzkumných molekulárně biologických postupů, podmíněných vysokou čistotou studované populace (RT-PCR, aCGH), na druhé straně rozšíření možností již zavedených metodik, jako je např. FISH, na vzorky s velmi nízkou infiltrací. Metodika cIg-FISH, kdy příslušné chromozomální aberace odečítáme pouze na PB, odlišených od ostatních buněk KD simultánním obarvením lehkých řetězců cytoplazmatických imunoglobulinů, je sice v našich laboratořích standardně využívána [14], u vzorků s infiltrací pod 5 % ale neumožňuje vyšetření 100 PB (dle doporučení workshopu EMN [15]), neboť při menším množství buněk není počet buněk s aberací dostatečně průkazný. Použití separovaných buněk s deklarovanou čistotou je tak přínosem z hlediska vyhodnocení preparátu, navíc představuje i rychlejší a jednodušší proces přípravy a hodnocení z hlediska personálu laboratoře.
V podmínkách naší laboratoře používáme separované buňky jednak ke klinickým (analýza chromozomálních aberací), jednak k výzkumným účelům (RT-PCR, aCGH, proteomická analýza pomocí 2D-elektroforézy a následné hmotnostní spektrometrie). Vyšetřování již zavedených chromozomálních aberací del(13)(q14), del(17)(p13), gain 1q21, t(4;14)(p16;q32), t(11;14)(q13;q32), t(14;16)(q32;q23) a hyperdiploidie je stále aktuální, protože léčba MM prochází v posledních letech překotným vývojem a vztah těchto aberací k „novým lékům“ je ještě stále neujasněný. Vedle klasických prognostických modelů, pracujících s biochemickými či cytogenetickými parametry, jsou publikovány i nové, založené např. na genové expresi [16-18], kterou má smysl provádět právě jen na buněčných populacích s čistotou minimálně 90 %, tedy takovou, která je v neseparované KD nemyslitelná.
Zvládnutí techniky separace plazmatických buněk u vzorků s nízkou infiltrací nám otevírá také cestu k výzkumu indolentních MG – především MGUS. Zde ovšem nebude možné spoléhat jen na separaci, protože množství získaných plazmatických buněk bude i při optimálním nastavení separace omezené a bude předpokládat optimalizaci technik izolace DNA či RNA směrem k minimalizaci nároků na množství vstupního materiálu. Bez separace je nemyslitelný i výzkum tzv. nádorových kmenových buněk, které jsou považovány za příčinu relapsů nádorových onemocnění a původce lékové rezistence. Tyto buňky jsou v posledních letech středem zájmu nejen hematologů, ale i onkologů [19] – u myelomu je situace o to komplikovanější, že jejich povaha zatím zůstává nejasná [20].
Závěr
Separace plazmatických buněk z kostní dřeně pacientů s MM je metodicky složitý problém vzhledem k velmi variabilnímu zastoupení plazmatických buněk v kostní dřeni, od velmi nízkých po velmi vysoké hodnoty. Magnetická separace je jednoduchá objemová metoda, která nevyžaduje velké vstupní investice a je časově nenáročná, neposkytuje ale optimální výsledky čistoty při nízkém vstupním zastoupení PB. Čistota separovaných buněk při fluorescenční separaci je na vstupní infiltraci méně závislá, tento způsob separace je ale časově náročný a vyžaduje vysokou vstupní investici. V podmínkách naší laboratoře se jako optimální ukázalo využití obou metodik. Rozhodovací algoritmus vytvořený na základě srovnání magnetické a fluorescenční separace byl ověřen během prvního roku svého používání. Díky dosaženým výsledkům lze tento algoritmus považovat za validovaný. Optimalizace fluorescenčního třídění nám také otevřela cestu k výzkumu PB u pacientů s MGUS, u kterých jsme nyní schopni získat vysoce čisté populace PB pro náročné výzkumné aplikace.
Poděkování
Děkuji Mgr. Daně Králové za statistické zhodnocení výsledků různých typů separace.
Práce byla podpořena granty MŠMT LC06027, MSM0021622434, IGA NS10406, IGA NS10408, GAČR P304/10/1395.
This work was supported by grants MŠMT LC06027, MSM0021622434, IGA NS10406, IGA NS10408, GAČR P304/10/1395.
Autoři deklarují, že v souvislosti s předmětem studie neamají žádné komerční zájmy.
The authors declare they have no potential conflicts of interest concerning drugs, products, or services used in the study.
Redakční rada potvrzuje, že rukopis práce splnil ICMJE kritéria pro publikace zasílané do bi omedicínských časopisů.
The Editorial Board declares that the manuscript met the ICMJE “uniform requirements” for biomedical papers.
prof. MUDr. Roman Hájek, CSc.
Babákův výzkumný institut
Lékařská fakulta MU
Kamenice 5/pavilon A3
625 00 Brno
e-mail: r.hajek@fnbrno.cz
Obdrženo/Submitted: 26. 4. 2010
Přijato/Accepted: 24. 6. 2010
Sources
1. Fillola G, Müller C, Bousquet R et al. Isolation of bone marrow plasma cells by negative selection with immunomagnetic beads. J Immunol Methods 1996; 190(1): 127–131.
2. Tai YT, Teoh G, Shima Y et al. Isolation and characterization of human multiple myeloma cell enriched populations. J Immunol Methods 2000; 235(1–2): 11–19.
3. Avet-Loiseau H, Facon T, Daviet A et al. 14q32 translocations and monosomy 13 observed in monoclonal gammopathy of undetermined significance delineate a multistep process for the oncogenesis of multiple myeloma. Intergroupe Francophone du Myélome. Cancer Res 1999; 59(18): 4546–4550.
4. Draube A, Pfister R, Vockerodt M et al. Immunomagnetic enrichment of CD138 positive cells from weakly infiltrated myeloma patients samples enables the determination of the tumor clone specific IgH rearrangement. Ann Hematol 2001; 80(2): 83–89.
5. Davies FE, Dring AM, Li C et al. Insights into the multistep transformation of MGUS to myeloma using microarray expression analysis. Blood 2003; 102(13): 4504–4511.
6. Rasillo A, Tabernero MD, Sánchez ML et al. Fluorescence in situ hybridization analysis of aneuploidization patterns in monoclonal gammopathy of undetermined dignificance versus multiple myeloma and plasma cell leukemia. Cancer 2003; 97(3): 601–609.
7. Fišerová S, Hájek R, Doubek M et al. Imunomagnetická separace myelomových buněk. Klin Onkol 2001; 14(2): 46–50.
8. Cumova J, Kovarova L, Potacova A et al. Optimalization of myeloma cell selection from bone marrow purified by magnetic-activated cell sorting. V přípravě.
9. Wijdenes J, Vooijs WC, Clément C et al. A plasmocyte selective monoclonal antibody (B-B4) recognizes syndecan-1. Br J Haematol 1996; 94(2): 318–323.
10. Fonseca R, Barlogie B, Bataille R et al. Genetics and cytogenetics of multiple myeloma: A workshop report. Cancer Res 2004; 64(4): 1546–1558.
11. Witzig T, Kimlinger T, Stenson M et al. Syndecan-1 expression on malignant cells from the blood and marrow of patients with plasma cell proliferative disorders and B-cell chronic lymphocytic leukemia. Leuk Lymphoma 1998; 31(1–2): 167–175.
12. Jourdan M, Ferlin M, Legouffe E et al. The myeloma cell antigen syndecan-1 is lost by apoptotic myeloma cells. Br J Haematol 1998; 100(4): 637–646.
13. Paulus U, Dreger P, Viehmann K et al. Purging Peripheral Blood Progenitor Cell Grafts from lymphoma cells: quantitative comparison of immunomagnetic CD34+ selection systems. Stem Cells 1997; 15(4): 297–304.
14. Kuglík P, Filková H, Vranová V et al. Detection of chromosome 13 abnormalities and 14q32 translocations in multiple myeloma using simultaneous immunofluorescent labelling of malignant plasma cells and FISH. Europ J Hum Genet 2004; 12 (Suppl): 170.
15. Ross FM, Avet-Loiseau H, Drach J et al. European myeloma network recommendations for FISH in myeloma (Abstract). Haematologica 2007; 92 (Suppl 2): 100-101.
16. Zhan F, Huang Y, Colla S et al. The molecular classification of multiple myeloma. Blood 2006; 108(6): 2020–2028.
17. Shaughnessy JD Jr, Zhan F, Burington BE et al. A validated gene expression model of high-risk multiple myeloma is defined by deregulated expression of genes mapping to chromosome 1. Blood 2007; 109(6): 2276–2284.
18. Decaux O, Lodé L, Magrangeas F et al. Intergroupe Francophone du Myélome. Prediction of survival in multiple myeloma based on gene expression profiles reveals cell cycle and chromosomal instability signatures in high-risk patients and hyperdiploid signatures in low-risk patients: a study of the Intergroupe Francophone du Myélome. J Clin Oncol 2008; 26(29): 4798–4805.
19. Ansorgová V, Mačingová Z, Priester P et al. Nádorové kmenové buňky a „niche“ – jako limitující faktor karcinogeneze. Klin Onkol 2009; 22(1): 11–16.
20. Huff CA, Matsui W. Multiple myeloma cancer stem cells. J Clin Oncol 2008; 26(17): 2895–2900.
Labels
Paediatric clinical oncology Surgery Clinical oncology
Article was published inClinical Oncology

2011 Issue 1-
All articles in this issue
- Bazocelulárny karcinóm kože – biologické správanie nádoru a prehľad najvýznamnejších molekulových ukazovateľov progresie ochorenia v praxi patológa
- Vývoj nových léčiv u solidních nádorů – změna pohledu na optimální design klinických studií
- Ischemická choroba srdca a hypertenzia ako neskoré následky liečby nádorov testis – prehľad
- Využití PET/CT vyšetření při plánování radioterapie nemalobuněčných plicních karcinomů
- Algoritmus separace plazmatických buněk ze vzorků kostní dřeně
- Oportunní infekce mozku u pacientů po komplexní terapii nádorového onemocnění
- Vulvárna intraepiteliálna neoplázia
- Antineoplastické účinky simvastatínu u experimentálnej rakoviny prsníka
- Clinical Oncology
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Bazocelulárny karcinóm kože – biologické správanie nádoru a prehľad najvýznamnejších molekulových ukazovateľov progresie ochorenia v praxi patológa
- Vulvárna intraepiteliálna neoplázia
- Využití PET/CT vyšetření při plánování radioterapie nemalobuněčných plicních karcinomů
- Oportunní infekce mozku u pacientů po komplexní terapii nádorového onemocnění
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career






