-
Medical journals
- Career
Využití solubilních cytokeratinových fragmentů v diagnostice jaterních metastáz
Authors: M. Špišáková 1; R. Kučera 1; O. Topolčan 1; M. Šafanda 1; D. Slouka 1; J. Kinkorová 1; V. Třeška 2
Authors‘ workplace: Imunoanalytická laboratoř, FN a LF v Plzni, Univerzita Karlova v Praze 1; Chirurgická klinika, FN a LF v Plzni, Univerzita Karlova v Praze 2
Published in: Klin. Biochem. Metab., 23 (44), 2015, No. 3, p. 95-99
Overview
Cíl studie:
Sledování a vyhodnocení přínosu stanovení solubilních cytokeratinových fragmentů pro diagnostiku jaterních metastáz.Typ studie:
Kombinovaná retrospektivní a prospektivní studie.Materiál a metody:
V období od ledna 2010 do prosince 2014 bylo v Imunoanalytické laboratoři FN Plzeň vyšetřeno sérum 1616 pacientů z plicní a chirurgické kliniky. Pacienti byli rozděleni do skupin podle diagnóz. Skupina C34 byla skupinou pacientů se zhoubnými nádory plic ve stadiu I, II a III. Skupinu C787 tvořili nemocní s metastatickým postižením jater bez rozlišení původu těchto metastáz. Kontrolní skupina se skládala z pacientů léčených na plicní zánětlivá onemocnění a dále pak z pacientů, kteří byli léčeni pro poruchy štítné žlázy či metabolická onemocnění. V době náběru byli v kompenzovaném stavu. U všech pacientů byl stanoven MonoTotal, CYFRA 21-1 a CEA. MonoTotal byl stanoven za použití imunoradiometrické soupravy MonoTotal IRMA (IDL Biotech, Švédsko), CYFRA 21-1 za použití imunoradiometrické soupravy CYFRA 21-1 IRMA (Cisbio Bioassays, Francie) a CEA pak chemiluminiscenční metodou na přístroji Architect i1000 (Abbott Laboratories, USA). Pro veškeré statistické výpočty byl použit statistický software Statistica (StatSoft, Inc., USA).Výsledky:
U jaterních metastáz jsme zjistili výrazně vyšší hladiny všech sledovaných markerů než u primárního plicního nádoru a než u nenádorových diagnóz (shodně p-Value <0,0001). ROC křivky ukazují, že schopnost odlišit spojenou nádorovou skupinu C34 a C787 od kontrolní není u hodnocených markerů příliš výrazná, což potvrzují vypočítané AUC: MonoTotal=0.6924, CYFRA 21-1=0,6398 a CEA=0,5955. Pokud hodnotíme nádorové skupiny odděleně podle diagnóz, ROC křivky jasně ukazují, že schopnost odlišení jaterních metastáz od kontrolní skupiny pomocí hodnocených markerů je výrazně vyšší než odlišení plicního nádoru. Vypočítané AUC pro jaterní metastázy jsou: MonoTotal=0,9497, CYFRA 21-1=0,8758 a CEA=0,7514.Závěr:
U jaterních metastáz jsou hladiny všech sledovaných markerů významně vyšší než u primárního plicního nádoru a než u nenádorových diagnóz. ROC křivky a AUC jasně ukazují, že cytokeratinové markery MonoTotal a CYFRA 21-1 jsou vysoce citlivé markery jaterních metastáz. CEA, které se v minulosti používalo jako marker metastatického procesu, za oběma cytokeratiny výrazně zaostalo. Cytokeratinové markery umožňují časnější záchyt jaterních metastáz a s využitím moderní onkologické a chirurgické léčby umožňují prodloužení doby přežití a zvýšení kvality života pacientů.Klíčová slova:
Cytokeratinové nádorové markery, MonoTotal, CYFRA 21-1, CEA, plicní karcinom, jaterní metastázy.Úvod
Jednou skupinou parametrů pro hodnocení biologické aktivity nádorů jsou proliferativní nádorové markery, které jsou sice určitým způsobem nespecifické, ale jejich zvýšené hodnoty jsou spojeny se zvýšenou proliferací a agresivitou nádorového procesu [1]. V této práci jsme se soustředili na dva markery ze skupiny solubilních cytokeratinových fragmentů MonoTotal a CYFRA 21-1. Jedná se o cirkulující komplexy fragmentů cytokeratinů 8, 18 a 19, které se vyskytují jak v normálním epitelu, tak v nádorových buňkách odvozujících se od daného epitelu [2]. U maligních nádorů v progresi dochází k proteolytickému odštěpování solubilních fragmentů, které se dostávají do krevního oběhu, kde jsou pak detekovány protilátkami různě označovaných komerčních testů. Diagnostická souprava MonoTotal [3] má protilátky namířené proti cytokeratinovým fragmentům 8, 18 a 19, souprava CYFRA 21-1 [4] pak proti cytokeratinovému fragmentu 19. Protože jsme posuzovali schopnost markerů detekovat jaterní metastázy, přibrali jsme do našeho vyhodnocení nádorový marker CEA, který se v minulosti často používal jako marker metastatického procesu [5].
Materiál a metody
V období od ledna 2010 do prosince 2014 bylo v Imunoanalytické laboratoři FN Plzeň vyšetřeno sérum 1616 pacientů z plicní a chirurgické kliniky. Pacienti byli rozděleni do skupin podle diagnóz. Skupina C34 se skládala z pacientů se zhoubnými nádory plic ve stadiu I, II a III. Skupinu C787 tvořili nemocní s metastatickým postižením jater bez rozlišení původu těchto metastáz. Přítomnost jaterních metastáz byla detekována ve většině případů sonograficky a vždy ověřena PET-CT. Pokud byl nemocný operován, současně také při operaci. Kontrolní skupina se skládala z pacientů léčených na plicní zánětlivá onemocnění a dále pak z pacientů, kteří byli léčeni pro poruchy štítné žlázy či metabolická onemocnění. V době náběru byli v kompenzovaném stavu. Definice a základní charakteristika hodnocených souborů pacientů je uvedena v Tabulce 1 a Tabulce 2.
Table 1. Definition of patient group 
Table 2. Base characteristic of patient groups 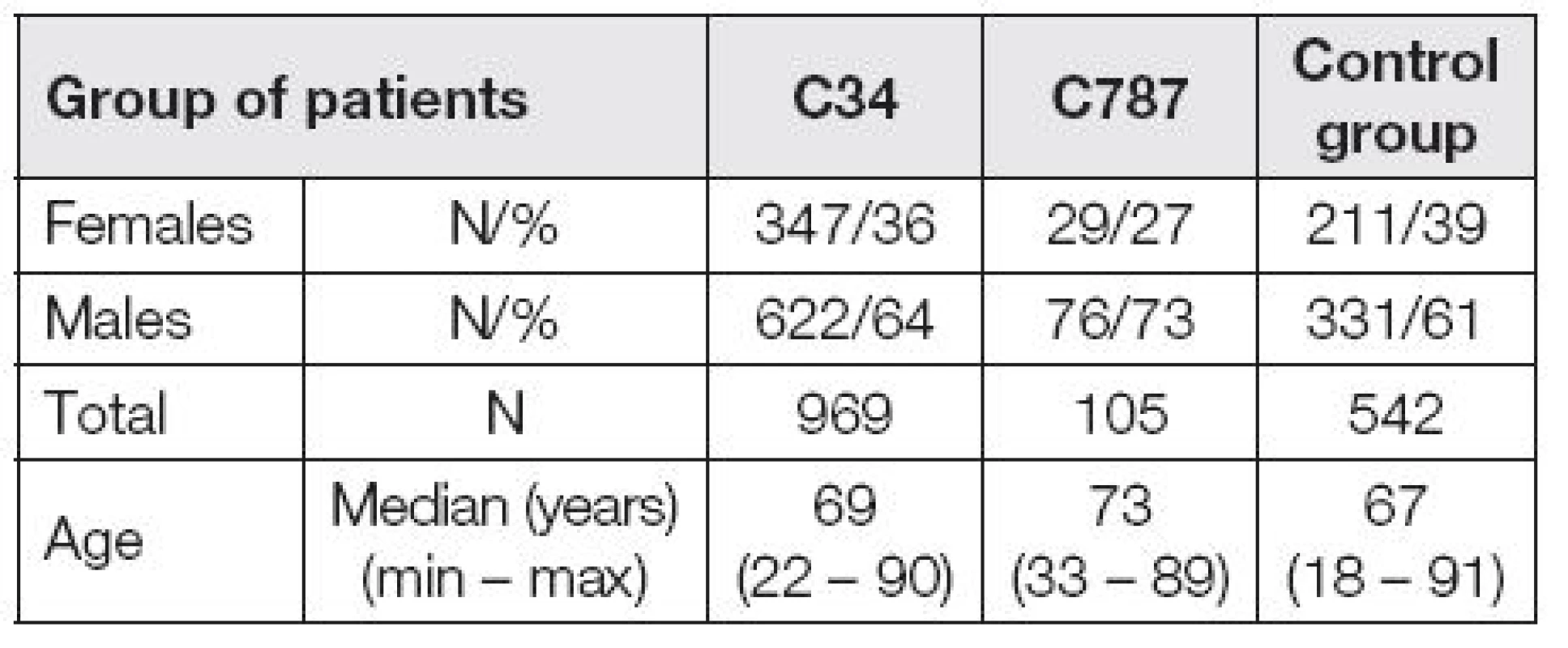
U všech pacientů byl stanoven MonoTotal, CYFRA 21-1 a CEA. MonoTotal byl stanoven za použití imunoradiometrické soupravy MonoTotal IRMA (IDL Biotech, Švédsko), CYFRA 21-1 za použití imunoradiometrické soupravy CYFRA 21-1 IRMA (Cisbio Bioassays, Francie) a CEA pak chemiluminiscenční metodou na přístroji Architect i1000 (Abbott Laboratories, USA). Pro veškeré statistické výpočty byl použit statistický software Statistica (StatSoft, Inc., USA). Byly spočítány deskriptivní statistiky pro všechny hodnocené skupiny pacientů. Dále jsou ve výsledcích spočítány následující parametry: aritmetický průměr, medián, minimum a maximum, dále pak byly spočítány pro vyhodnocení užitečnosti jednotlivých markerů ROC křivky a plochy pod křivkou (AUC). Pro lepší orientaci jsou výsledky vyhodnocení nádorových markerů uváděny nejen v tabulkách, ale i v grafické podobě. Porovnání změn hladin nádorových markerů ve sledovaných skupinách bylo provedeno vzhledem k negaussovskému rozdělení hodnot neparametrickým Wilcoxonovým testem a neparametrickým Kruskal-Wallisovým testem. Všechny provedené testy byly oboustranné a p-hodnota<0,05 indikovala statistickou významnost.
Výsledky
Při vyhodnocení souboru pacientů jsme se zaměřili na změny v hladinách nádorových markerů a na interpretaci výsledků u plicního karcinomu v porovnání s metastázami do jater bez rozlišení původu. Získané výsledky jsou uvedeny v Tabulce 3. P-hodnota Wilcoxonova testu znamená statistickou významnost při porovnání skupin C34 a C787s kontrolní skupinou. Kruskal-Wallisovým testem jsme hodnotili změny nádorových markerů ve všech třech porovnávaných skupinách.
Pro snazší představu o rozložení hodnot jsou výsledky jednotlivých markerů ve všech skupinách zobrazeny v následujících grafech (obr. 1 – 3). Pro větší přehlednost je ve všech box-plot grafech zobrazen přirozený logaritmus hodnoty markeru – ln(marker).
Table 3. Serum levels of MonoTotal, CYFRA 21-1 and CEA 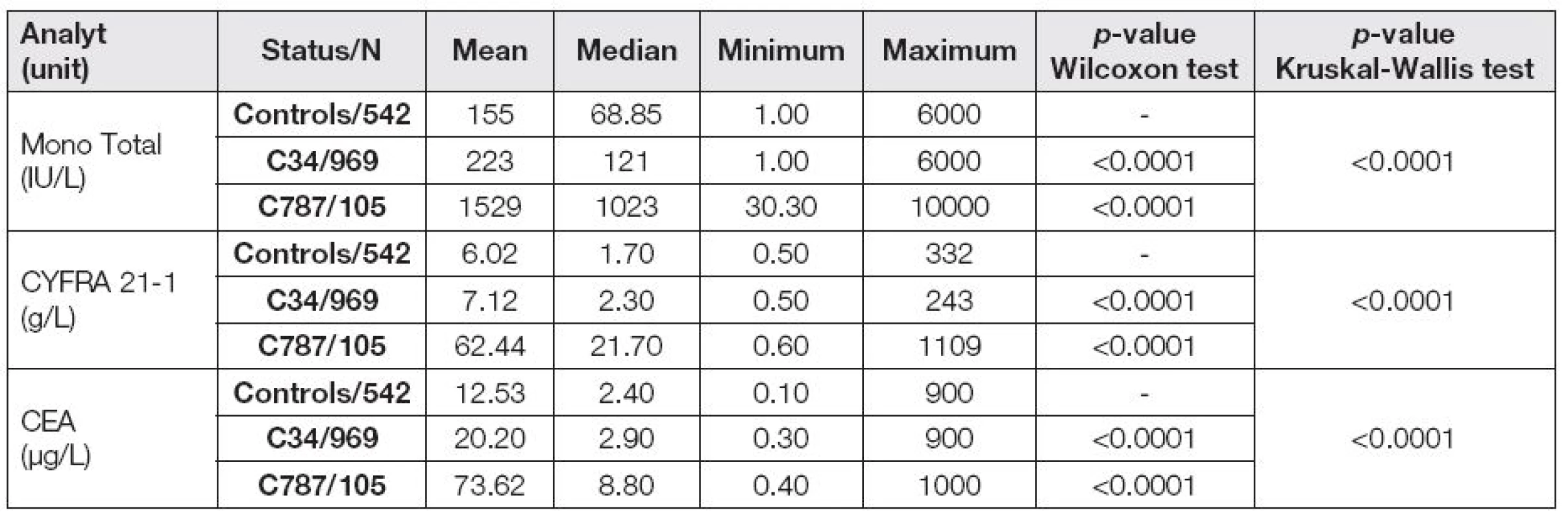
Fig. 1. MonoTotal serum levels in each group 
Fig. 2. CYFRA 21-1 serum levels in each group 
V našem souboru je zřejmé, že primární plicní nádor má výrazně odlišnou charakteristiku s ohledem na hladiny hodnocených nádorových markerů v porovnání s hladinami markerů u jaterních metastáz. U jaterních metastáz jsou hladiny výrazně vyšší než u primárního plicního nádoru
Následující ROC křivky ukazují (obr. 4), že schopnost odlišit spojenou nádorovou skupinu (C34 + C787) od kontrolní skupiny není u hodnocených markerů příliš výrazná, což potvrzuje i následující Tabulka 4., kde jsou uvedeny hodnoty AUC.
Fig. 3. CEA serum levels in each group 
Fig. 4. ROC curve of control group vs. C34 + C787 
Pokud hodnotíme skupiny pacientů odděleně podle diagnóz, jsou dosažené výsledky velmi rozdílné dle skupin. Následující ROC křivky jasně ukazují (obr. 5 a 6), že schopnost odlišení jaterních metastáz od kontrolní skupiny pomocí hodnocených markerů je výrazně vyšší než odlišení plicního nádoru od kontrolní skupiny.
Table 4. AUC of tumor markers in control group vs. C34 and C787 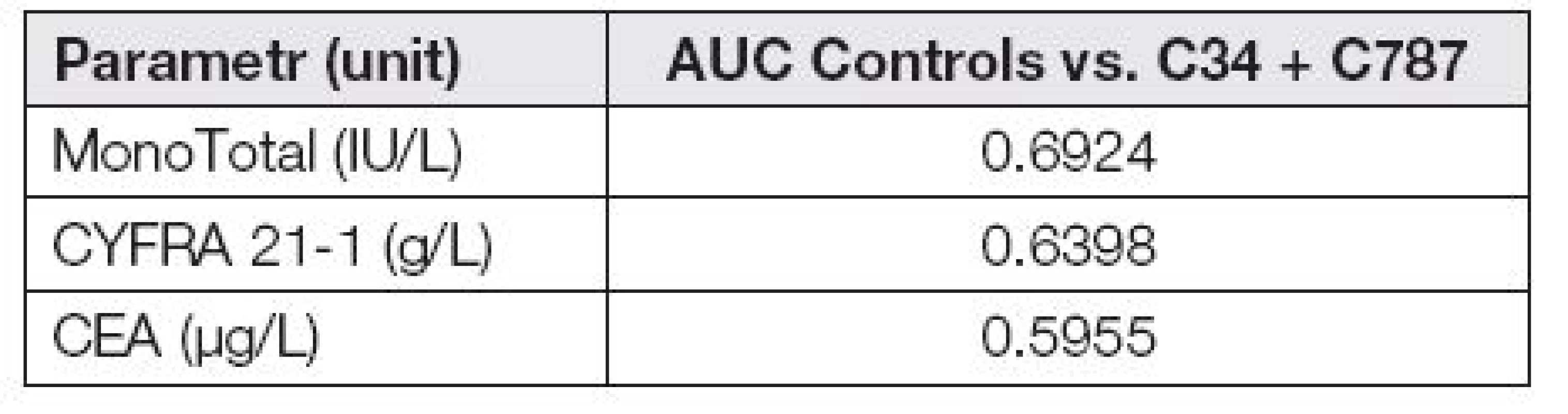
Table 5. AUC of tumor markers in control group vs. C34 and C787 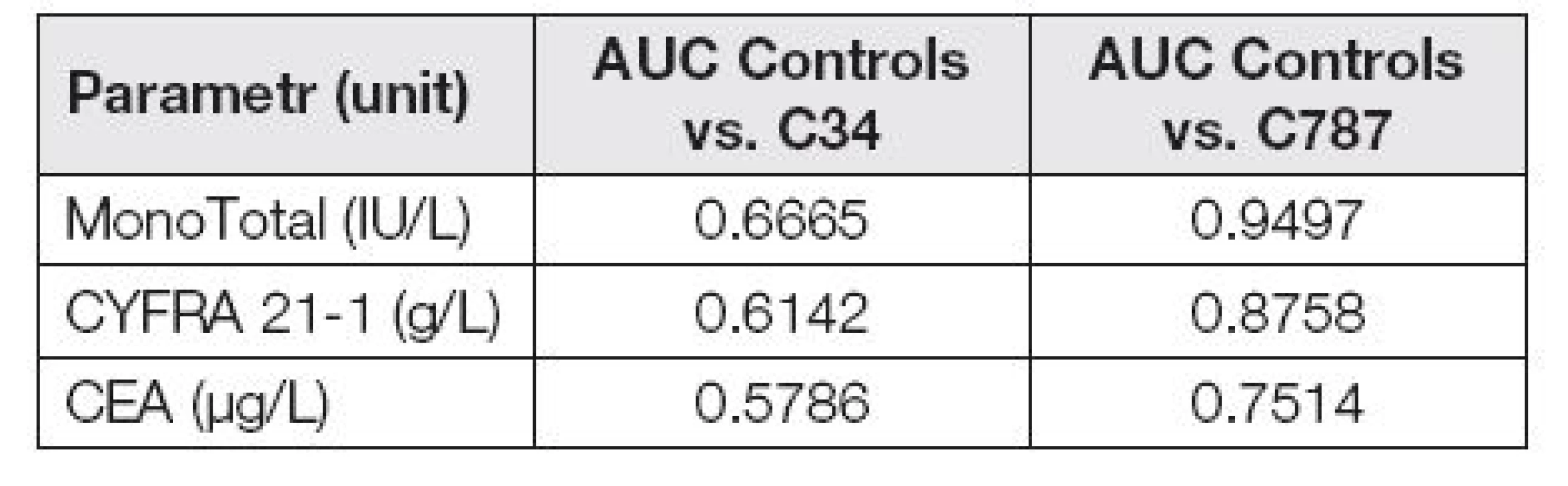
Užitečnost jednotlivých markerů pro odlišení jaterních metastáz od kontrolní skupiny a odlišení plicního nádoru od kontrolní skupiny je možné vidět v Tabulce 5, kde je porovnání vypočítaných AUC.
Fig. 5. ROC curve of control group vs. C34 
Fig. 6. ROC curve of control group vs. C787 
Diskuse
V minulosti byl nález jaterních metastáz velmi závažnou komplikací nádorového onemocnění a odborná lékařská veřejnost celkem oprávněně neviděla velký přínos v nádorových markerech, které by byly schopny nás na tento zvrat ve vývoji onemocnění upozornit [6]. S rozvojem nových metod chirurgické a onkologické léčby se však situace výrazně mění [7]. Jaterní resekce je zlatým standardem jejich léčby nabízející nemocným kvalitní dlouhodobé přežívání. Dále je dnes možné řešit jaterní metastázy řadou léčebných postupů s využitím moderní onkologické léčby [8], embolizace větve portální žíly, metodami aplikace kmenových buněk, vícedobými resekcemi, chemo, nebo radioembolizací či kombinací termoablačních metod s resekcemi jater [9].
Prognóza nemocných závisí na biologické aktivitě jaterních metastáz. A zde se otevírá prostor pro využití právě cytokeratinových nádorových markerů, které mají sice nízkou specificitu, ale úzce souvisí právě s aktivitou nádorových buněk [10]. Zahájení jakékoliv léčby je samozřejmě závislé na potvrzení metastáz zobrazovacími technikami. V praxi to znamená, že vyšetření nádorových markerů při follow-up onemocnění umožňuje včas provést zobrazovací techniku, a tak mnohdy diagnostikovat recidivu s několikaměsíčním předstihem před klinickou manifestací progrese. V našem případě, pozitivní laboratorní nález u 22 pacientů (21%) vedl k následné indikaci zobrazovacích metod, které prokázaly přítomnost jaterních metastáz.
Nyní se podívejme detailněji na tři námi použité nádorové markery. U poměrně nového cytokeratinového markeru MonoTotal jsou k dispozici studie, které ukazují jeho velmi dobrou korelaci s klinickým stavem u nádorů plic. Velice cenná švédská studie sleduje MonoTotal u plicních nádorů v průběhu follow-up pacientů po celou dobu jejich přežití. Hladiny MonoTotalu dobře korelovaly se zhoršujícím se stavem onemocnění [11]. Údaje o chování MonoTotalu v případě jaterních metastáz bez rozlišení původu, ale v dostupné literatuře chybějí. Dále jsou k dispozici též studie o markeru CYFRA 21-1, též u plicních nádorů [12] či jiných primárních nádorů [13]. Korelace s klinickým stavem byla též dobrá. Údaje o hladinách CYFRA 21-1 pouze v případě jaterních metastáz nejsou běžně k dispozici. Marker CEA je zde zařazen proto, že byl po dlouhou dobu považován za signál metastatického procesu [14] a některé studie s ním pracují i v dnešní době [15].
V hodnoceném souboru se objevila některá fakta, které posunují naši představu o využití cytokeratinových nádorových markerů. ROC křivky a hodnoty AUC jsou si velmi podobné u hodnocení spojených souborů C34 + C787 a samostatného souboru pacientů C34. Výrazný posun nastává po vydělení samostatné skupiny C787. Patrná je tedy vysoká užitečnost při odlišování jaterních metastáz u markerů MonoTotal a CYFRA 21-1. Podíváme-li se na hladiny markeru MonoTotal u jaterních metastáz, je poměrně překvapivým zjištěním, jak vysokých hladin koncentrace tohoto markeru dosahuje. Přes dobré reference na jeho využití u nádorů plic, byl MonoTotal v našem souboru pacientů zdaleka nejlepším markerem pro hodnocení metastáz do jater. Vypočítaná hodnota MonoTotal AUC=0,9497 je velmi vysoká. Jako druhý nejlepší marker pro detekci jaterních metastáz byl v tomto souboru vyhodnocen CYFRA 21-1 s AUC=0,8758. I když byl CEA po dlouhou dobu používán jako marker metastatického procesu, jeho hodnota AUC=0,7514 výrazně zaostala za hodnocenými cytokeratiny. Jako dobré řešení, které se jako výstup z tohoto hodnocení nabízí, je kombinace CEA s markery MonoTotal a CYFRA 21-1. U markeru MonoTotal jsou tato zjištění úplně nová, a to na poměrně velkém souboru 1616 pacientů, což eliminuje zkreslení statistického vyhodnocení pro malý počet probandů.
Závěr
Cytokeratinové markery MonoTotal a CYFRA 21-1 dokáží s vysokou spolehlivostí upozornit na možnou přítomnost jaterních metastáz, urychlit provedení zobrazovacích metod a zahájení radikálního řešení. Pokud se podíváme na výsledky CEA dosažené v našem souboru pacientů, pak musíme konstatovat, že CEA zdaleka nenaplňuje předpoklady markeru použitelného pro diagnostiku a prognózu metastatického procesu.
Tato studie byla podpořena projektem Ministerstva zdravotnictví koncepčního rozvoje výzkumné organizace 00669806 - FN Plzeň.
Do redakce došlo 25. 5. 2015
Adresa pro korespondenci
Doc. RNDr. Judita Kinkorová, CSc.
Imunoanalytická laboratoř, Oddělení nukleární medicíny, FN Plzeň
Dr. E. Beneše 13
305 99 Plzeň
e-mail: kinkorovaj@fnplzen.cz
Sources
1. Liška, V., Třeška, V., Holubec, L., Skalický, T., Sunar, A., Topolčan, O., Fínek, J. Prognostické faktory časné recidivy metastatického procesu jater u kolorektálního karcinomu a jejich použití v klinické praxi. Rozhl Chir, 2006, 85, p. 163-168.
2. Barak, V., Goike, H., Panaretakis, K. W., Einarsson, R. Clinical utility of cytokeratins as tumor markers. Clin Biochem, 2004, 37, 529-40.
3. Brattström, D., Wagenius, G., Sandström, P., Dreilich, M., Bergström, S., Goike, H., Hesselius, P., Bergqvist, M. Newly developed assay measuring cytokeratins 8, 18 and 19 in serum is correlated to survival and tumor volume in patients with esophageal carcinoma. Dis Esophagus, 2005, 18, p. 298-303.
4. Giovanella, L., Treglia, G., Verburg, F. A., Salvatori, M., Ceriani, L. Serum cytokeratin 19fragments: a dedifferentiation marker in advanced thyroid cancer. Eur J Endocrinol, 2012, 167, p. 793-7.
5. Fernandez-Cotarelo, M. J., Guerra-Vales, J. M., Colina, F., de la Cruz, J. Prognostic factors in cancer of unknown primary site. Tumori, 2010, 96, p. 111-6.
6. López-Gómez, M., Cejas, P., Merino, M., Fernández-Luengas, D., Casado, E., Feliu, J. Management of colorectal cancer patients after resection of liver metastases: can we offer a tailored treatment? Clin Transl Oncol, 2012, 14, p. 641-58.
7. Třeška, V., Vodička, J., Špidlen, V., Skalický, T., Fichtl, J., Šimánek, V., Šafránek, J., Sutnar, A., Brůha, J. Jaterní a plicní metastázy kolorektálního karcinomu – zkušenosti Chirurgické kliniky FN v Plzni. Rozhl Chir, 2013, 92, p. 488-93.
8. Sakamoto, Y,. Miyamoto, Y., Beppu, T., Nitta, H., Imai, K., Hayashi, H., Baba, Y., Yoshida, N., Chikamoto, A., Baba, H. Post-chemotherapeutic CEA and CA19-9 Are Prognostic Factors in Patients with Colorectal Liver Metastases Treated with Hepatic Resection After Oxaliplatin-based Chemotherapy. Anticancer Res, 2015, 35, p. 2359-68.
9. Hinz, S., Tepel, J., Röder, C., Kalthoff, H., Becker, T. Profile of serum factors and disseminated tumor cells before and after radiofrequency ablation compared to resection of colorectal liver metastases-a pilot study. Anticancer Res, 2015, 35, p. 2961-7.
10. Holdenrieder, S., Stieber, P., Liska, V., Treska, V., Topolcan, O., Dreslerova, J., Matejka, V. M., Finek, J., Holubec, L. Cytokeratin serum biomarkers in patients with colorectal cancer. Anticancer Res, 2012, 32, p. 1971-6.
11. Eriksson, P., Brattström, D., Hesselius, P., Larsson, A., Bergström, S., Ekman, S., Goike, H., Wagenius, G., Brodin, O., Bergqvist, M. Role of circulating cytokeratin fragments and angiogenic factors in NSCLC patients stage IIIa-IIIb receiving curatively intended treatment. Neoplasma, 2006, 53, p. 285-90.
12. Buccheri, G., Ferrigno, D. Lung tumor markers of cytokeratin origin: an overview. Lung Cancer, 2001, 34, p. 65-9.
13. Haas, M., Kern, C., Kruger, S., Michl, M., Modest, D. P., Giessen, C., Schulz, C., von Einem, J. C., Ormanns, S., Laubender, R. P., Holdenrieder, S., Heinemann, V., Boeck, S. Assessing novel prognostic serum biomarkers in advanced pancreatic cancer: the role of CYFRA 21-1, serum amyloid A, haptoglobin, and 25-OH vitamin D3. Tumour Biol, 2015, 36, p. 2631-40.
14. Goldstein, M. J., Mitchell, E. P. Carcinoembryonic antigen in the staging and follow-up of patients with colorectal cancer. Cancer Invest, 2005, 23, p. 338-51.
15. Sakamoto, Y., Miyamoto, Y., Beppu, T., Nitta, H., Imai, K., Hayashi, H., Baba, Y., Yoshida, N., Chikamoto, A., Baba, H. Post-chemotherapeutic CEA and CA19-9 Are Prognostic Factors in Patients with Colorectal Liver Metastases Treated with Hepatic Resection After Oxaliplatin-based Chemotherapy. Anticancer Res, 2015, 35, p. 2359-68.
Labels
Clinical biochemistry Nuclear medicine Nutritive therapist
Article was published inClinical Biochemistry and Metabolism

2015 Issue 3-
All articles in this issue
- Presepsin jako diagnostický a prognostický nástroj při posuzování sepse
- Využití solubilních cytokeratinových fragmentů v diagnostice jaterních metastáz
- Sledování metylace DNA u karcinomu vaječníků pomocí mikročipů.
-
Bias měření základních analytů krevního séra.
Výsledky a interpretace soudobých studií. - Problém přípustných limitů preciznosti v regulačních diagramech
- Ocenění
- Program přednáškových bloků
- Seznam posterů
- Abstrakta přednášek
- Abstrakta posterů
- Rejstřík autorů abstraktů
- Clinical Biochemistry and Metabolism
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Presepsin jako diagnostický a prognostický nástroj při posuzování sepse
-
Bias měření základních analytů krevního séra.
Výsledky a interpretace soudobých studií. - Abstrakta posterů
- Problém přípustných limitů preciznosti v regulačních diagramech
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

