-
Články
Top novinky
Reklama- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
Top novinky
Reklama- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Top novinky
ReklamaKarcinom středního a distálního žlučovodu, retrospektivní analýza, krátkodobé a dlouhodobé výsledky chirurgické léčby
Middle and distal bile duct carcinoma, retrospective analysis & short-term and long-term outcomes of surgical therapy
Introduction: The prognosis of extrahepatic cholangiocarcinoma is dismal and the only way to achieve long-term survival is surgical resection. While pancreatoduodenectomy (PD) is the standard procedure for distal cholangiocarcinoma (distal bile duct cancer; DBDC), bile duct segmental resection (BDR) can be used as an alternative approach for middle bile duct cholangiocarcinoma (middle bile duct cancer; MBDC). The aim of the study was to calculate the short-term and long-term outcomes of curative-intent surgery in distal bile duct cholangiocarcinoma patients.
Methods: A retrospective cohort study of consecutive patients treated for MBDC and DBDC with PD or BDR between 1/2009–12/2019. The patients were divided according to the type of surgical resection (PD and BDR group). Demographic, clinicopathological and histopathological data and overall survival (OS) were evaluated in both groups. OS was estimated using the Kaplan-Meier analysis.
Results: The study comprised a total of 62 patients – 45 patients (72.6%) in the PD group and 17 (27.4%) in the BDR group. Patients undergoing BDR were significantly older than those receiving PD (p=0.048). Men predominated in the PD group (N=34/45; 75.6%) while more women were included in the BDR group (N=10/17; 58.8%). Median age was higher in the BDR group (p=0.048). Serious morbidity (Clavien-Dindo III–V) (33.3% vs 11.8%), 30-day and 90-day mortality (4.4% vs 0.0% and 8.9% vs 5.9%, respectively) predominated in the PD group although the differences were not statistically significant, as well as a longer hospital stay (16.0 days vs 11.0 days; p=0.002). Pathological assessments revealed comparable numbers of positive lymph nodes in both groups, but a significantly higher number of total resected lymph nodes in the PD group (p<0.0001). Similar OS rates at 1, 3 and 5 years were observed in both PD and BDR groups (66.7% vs 64.7%; 37.8% vs 47.0%; and 15.6% vs 17.6%, respectively).
Conclusion: Bile duct segmental resection (BDR) is an acceptable surgical modality for selected MBDC patients with lower morbidity and comparable survival compared to PD. In case of BDR negative bile duct resection margins need to be confirmed in the intraoperative period by frozen section examination.
Keywords:
pancreatoduodenectomy – bile duct resection – distal bile duct cancer – middle bile duct cancer
Autoři: P. Skalický 1
; J. Tesaříková 2; M. Gregořík 1; K. Knápková 1; H. Švébišová 3; D. Kurfúrstová 4; Dušan Klos 2
; M. Loveček 1
Působiště autorů: 1. chirurgická klinika Fakultní nemocnice Olomouc 1; 1. chirurgická klinika Lékařské fakulty Univerzity Palackého v Olomouci 2; Onkologická klinika Fakultní nemocnice Olomouc 3; Ústav klinické a molekulární patologie Fakultní nemocnice Olomouc 4
Vyšlo v časopise: Rozhl. Chir., 2022, roč. 101, č. 9, s. 436-442.
Kategorie: Původní práce
doi: https://doi.org/10.33699/PIS.2022.101.9.436–442Souhrn
Úvod: Cholangiokarcinom extrahepatických žlučovodů má velmi nepříznivou prognózu. Jedinou potenciálně kurativní metodou léčby je chirurgická resekce. U cholangiokarcinomů distálního žlučovodu je to pravostranná pankreatoduodenektomie (PD), u tumorů středního žlučovodu může být alternativním přístupem segmentální resekce žlučových cest (RŽC). Cílem studie je analýza vlastního souboru pacientů operovaných pro cholangiokarcinom středního a distálního žlučovodu a srovnání jejich krátkodobých a dlouhodobých výsledků.
Metody: Retrospektivní analýza pacientů s cholangiokarcinomem středního a distálního žlučovodu operovaných v období 1/2009–12/2019. Pacienti byli rozděleni na skupinu PD a RŽC podle provedeného výkonu. V obou skupinách byly analyzovány demografické, klinickopatologické a histopatologické parametry a celkové přežití.
Výsledky: Soubor tvořilo 62 pacientů, 45 (72,6 %) ve skupině PD a 17 (27,4 %) ve skupině RŽC. Ve skupině PD převažovali muži (N=34/45; 75,6 %) naopak v RŽC ženy (N=10/17; 58,8 %). Medián věku byl vyšší ve skupině RŽC (p=0,048). Ve skupině PD převažovaly, ale statisticky nevýznamně; závažná morbidita (Clavien-Dindo III–V) (33,3 % vs. 11,8 %), 30denní a 90denní mortalita (4,4 % vs. 0,0 %, resp. 8,9 % vs. 5,9 %) a délka hospitalizace (16,0 dní vs. 11,0 dní – p=0,002). Počet pozitivních lymfatických uzlin je v obou skupinách srovnatelný, celkový počet resekovaných lymfatických uzlin je signifikantně vyšší ve skupině PD (p<0,0001). 1leté (66,7 % vs. 64,7 %), 3leté (37,8 % vs. 47,0 %) a 5leté přežití (15,6 % vs. 17,6 %) bylo v obou skupinách srovnatelné.
Závěr: Segmentální resekce žlučových cest představuje u selektované skupiny pacientů akceptovatelnou alternativu chirurgické terapie karcinomů středního žlučovodu s nižší morbiditou i mortalitou oproti PD a srovnatelným dlouhodobým přežíváním. Nezbytnou podmínkou je peroperační potvrzení negativních radiálních resekčních linií na žlučovodu.
Klíčová slova:
pankreatoduodenektomie – resekce žlučových cest – distální cholangiokarcinom – karcinom středního žlučovodu
ÚVOD
Cholangiokarcinom je nejčastějším primárním maligním nádorem žlučových cest, tvoří 3 % všech solidních nádorů GIT, čímž se řadí spíše k méně frekventním nádorům [1]. Na základě dat ÚZIS incidence extrahepatálního karcinomu žlučových cest nenarůstá, na pracovišti autorů však poměr pankreatoduodenektomií pro cholangiokarcinom/ostatní periampulární malignity vzrostl mezi dekádami 2001–2010 z 5 % na 14 % v letech 2011–2020. Na základě SEER databáze NCI (National Cancer Institute) je 5leté relativní přežití nemocných s extrahepatálním cholangiokarcinomem bez ohledu na stadium a lokalizaci 10 %, nemocných s lokalizovaným onemocněním pak 17 %, s regionálním onemocněním (N+) 16 %, se vzdálenými metastázami pak 2 %. Cholangiokarcinom extrahepatálních žlučových cest je tedy podobně jako všechny malignity pankreatobiliární oblasti onemocnění s velmi nepříznivou prognózou. Za jedinou potenciálně kurativní metodu vedoucí k dosažení dlouhodobého přežití je považována chirurgická resekce. U cholangiokarcinomů lokalizovaných v distálním žlučovodu (DBDC – distal bile duct carcinoma) je metodou volby pravostranná pankreatoduodenektomie (PD), u tumorů ve středním žlučovodu (MBDC – middle bile duct carcinoma) může být alternativním přístupem segmentální resekce extrahepatických žlučových cest (RŽC). PD je spojena s morbiditou dosahující 20 % až 60 % [2–4]. Specifickými komplikacemi jsou pankreatická píštěl (POPF), postpankreatektomické krvácení (PPH) a opožděná evakuace žaludku (DGE) [5–7], které spolu se zánětlivými komplikacemi významně ovlivňují pooperační morbiditu a mohou vést k výraznému zhoršení kvality života a nemožnosti podstoupit adjuvantní onkologickou terapii [8]. Dlouhodobými důsledky operačního výkonu je riziko rozvoje pooperačního diabetes mellitus [9,10].
Naproti tomu RŽC u MBDC je technicky jednodušší výkon spojený s nižší pooperační morbiditou a mortalitou [11,12]. Některá data ukazují na nižší počet resekovaných uzlin a vyšší procento R1 resekcí u RŽC v porovnání s PD. Celkové přežití nemocných léčených jak PD, tak RŽC je však velmi podobné [12,13]. Existuje však dosud málo publikovaných prací s limitovaným počtem pacientů, které by tyto parametry u obou typů výkonů hodnotily [11–14].
Cílem studie je analýza demografických, klinickopatologických a histopatologických charakteristik u pacientů s provedenou PD a RŽC pro DBDC a MBDC a srovnání krátkodobých a dlouhodobých výsledků v obou skupinách pacientů.
METODY
Soubor pacientů
Jedná se o retrospektivní studii zahrnující 62 pacientů s karcinomem extrahepatických žlučových cest, kteří podstoupili resekční výkon s kurativním záměrem na I. chirurgické klinice Fakultní nemocnice Olomouc v období 1/2009 až 12/2019. Jednalo se o pacienty s DBDC a MBDC, u kterých proximální hranice tumoru na žlučovodu byla lokalizována extrahepaticky s potenciálem dosažení negativní resekční linie. Podle rozsahu provedeného operačního výkonu byli pacienti rozděleni na skupinu s provedenou PD (45 pacientů, 72,6 %), která byla indikována u všech pacientů s DBDC a u nemocných s MBDC, u kterých byla po supraduodenálním přerušení žlučovodu peroperačně odečtena patologem pozitivní distální resekční linie. Ostatní pacienti s MBDC a negativní distální resekční linií byli řešeni RŽC (17 pacientů, 27,4 %).
U všech nemocných byly sledovány parametry věku, pohlaví, ASA klasifikace, délky operačního výkonu, délky hospitalizace, rehospitalizace, pooperační morbidity dle Clavien-Dindo (CD) [15], 30denní a 90denní mortality. Jako závažné byly hodnoceny komplikace CD III–V. Specifické komplikace pankreatických resekcí – pooperační pankreatická píštěl (POPF), opožděná evakuace žaludku (DGE) a postpankreatektomické krvácení (PPH) – byly klasifikovány na základě definic International Study Group of Pancreatic Surgery [5–7].
Histopatologické hodnocení resekátů zahrnovalo radikalitu (negativitu resekčních okrajů), grading (dobře/ středně/nízce diferencovaný), T-staging, N-staging, celkový počet resekovaných lymfatických uzlin, počet pozitivních lymfatických uzlin, perineurální invazi, angioinvazi a lymfangioinvazi. Hodnocení resekátů bylo provedeno v souladu s TNM klasifikací definovanou UICC (7th edition) a verifikováno dvěma nezávislými patology. Jako R0 resekce byla definována vzdálenost ≥1 mm od mikroskopické hranice tumoru. Celkové přežití nemocných bylo definováno jako doba mezi datem operace a datem úmrtí.
PD zahrnovala en block odstranění extrahepatických žlučových cest s resekčním okrajem nad odstupem ductus cystikus (≥1 cm nad makroskopickým okrajem tumoru), hlavu pankreatu, žlučník, duodenum se zachováním pyloru a standardní lymfadenektomii doporučenou International Study Group for Pancreatic Surgery [16]. Rekonstrukce zahrnovala pankreatojejuno-, hepatikojejuno - a duodenojejunoanastomózu na jednu slepě uzavřenou kličku. RŽC zahrnovala odstranění extrahepatických žlučových cest s resekčními okraji ≥1 cm od makroskopické hranice tumoru a lymfadenektomii uzlin skupiny 12 (hepatoduodenální ligamentum), 8 (společná hepatická tepna) a 13a (horní retropankreatické) dle definice Japan Pancreas Society (JPS) [17].
Kvalitativní parametry jsou uváděny jako absolutní hodnoty a jejich četnost v procentech, kvantitativní parametry jako medián a rozmezí minimum-maximum. Data byla statisticky analyzována pomocí chí-kvadrát testu, resp. Fisherova přesného testu v případě kategoriálních parametrů, pro porovnání kvantitativních parametrů byl použit Mann-Whitney U test. Normalita dat byla ověřena pomocí Shapiro-Wilk testu. Analýza přežití byla provedena pomocí Kaplan-Meierovy analýzy. Ke zpracování byl použit software IBM SPSS Statistics verze 23. Jako statisticky signifikantní je hodnoceno p<0,05.
VÝSLEDKY
Z celkového počtu 62 pacientů zařazených do této studie bylo 45 (72,6 %) pacientů ve skupině PD a 17 (27,4 %) pacientů ve skupině RŽC. Skupina PD byla tvořena převážně muži (N=34/45; 75,6 %) oproti skupině RŽC, kde jejich zastoupení bylo signifikantně nižší (N=7/17; 41,2 %) (p=0,011). Medián věku byl statisticky signifikantně vyšší ve skupině RŽC (p=0,048) (Tab. 1). U všech pacientů vyjma jednoho ze skupiny PD byla předoperačně zajištěna drenáž žlučových cest buď cestou endoskopické retrográdní cholangiopankreatikografie (ERCP) –88,9 % vs. 82,3 %, nebo perkutánní transhepatické cholangiopankreatikografie (PTC) – 8,9 % vs. 17,6 %.
Tab. 1. Demografická a klinickopatologická charakteristika souboru pacientů s cholangiokarcinomem
Tab. 1: Demographic and clinicopathological data for patients with cholangiocarcinoma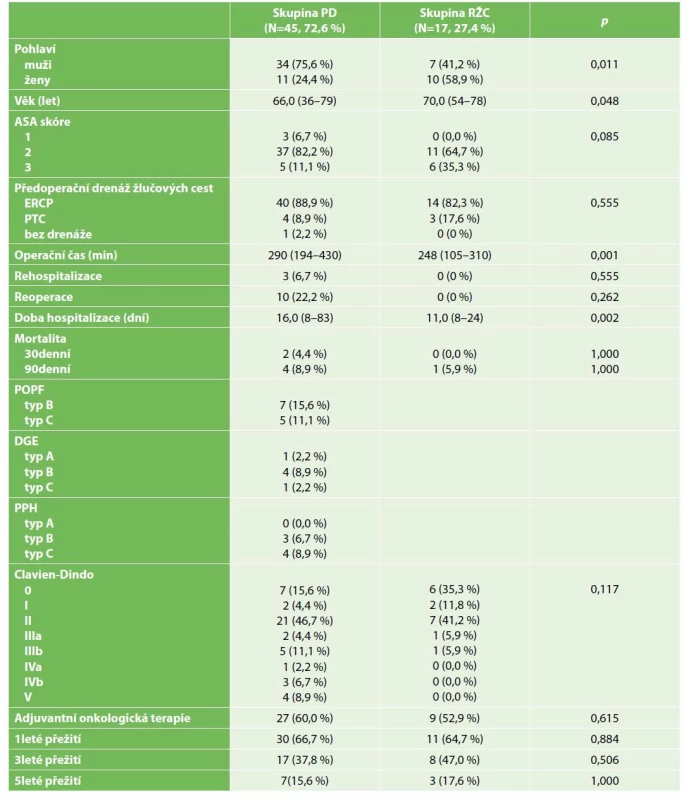
Doba trvání operace byla signifikantně vyšší ve skupině PD (290 vs. 248 min.) (p=0,001). Srovnání ukázalo vyšší závažnou morbiditu (CD III–V) ve skupině PD oproti RŽC (33,3 % vs. 11,8 %), stejně jako 30denní a 90denní mortalitu (4,4 % vs. 0,0 %, resp. 8,9 % vs. 5,9 %). Zatímco u všech úmrtí pacientů skupiny PD se jednalo o komplikace chirurgické léčby, úmrtí nemocného s RŽC bylo 66. pooperační den z důvodu komplikace zahájené onkologické terapie. Závažná morbidita u pacientů s PD byla v převážné většině spojena s výskytem POPF (N=12/45; 26,7 %) a PPH (N=7/45; 15,6 %). Tyto komplikace se také podílely na vyšším počtu reoperací ve skupině PD (24,4 % vs. 0,0 %). Jednalo se buď o drenáže pankreatických kolekcí, nebo dokončení resekce pankreatického remnantu na totální pankreatektomii (3 nemocní, 6,6 %). Celková doba hospitalizace byla statisticky signifikantně vyšší u pacientů s PD (16,0 vs. 11,0 dne) (p=0,002).
Nebyl zjištěn statisticky signifikantní rozdíl v parametrech T-stagingu, N-stagingu, gradingu, perineurální invaze, angioinvaze ani lymfangioinvaze tumorů v obou skupinách pacientů (Tab. 2). Přestože medián počtu pozitivních lymfatických uzlin je ve skupině PD i RŽC srovnatelný, medián celkového počtu resekovaných lymfatických uzlin je statisticky signifikantně vyšší ve skupině PD (9 vs. 3 uzliny) (p<0,0001). Zastoupení pacientů s R0 resekcí bylo signifikantně vyšší ve skupině PD než ŘZC (77,8 % vs. 41,2 %) (p=0,006).
Tab. 2. Histopatologická charakteristika souboru pacientů s cholangiokarcinomem
Tab. 2: Histopathological data for patients with cholangiocarcinoma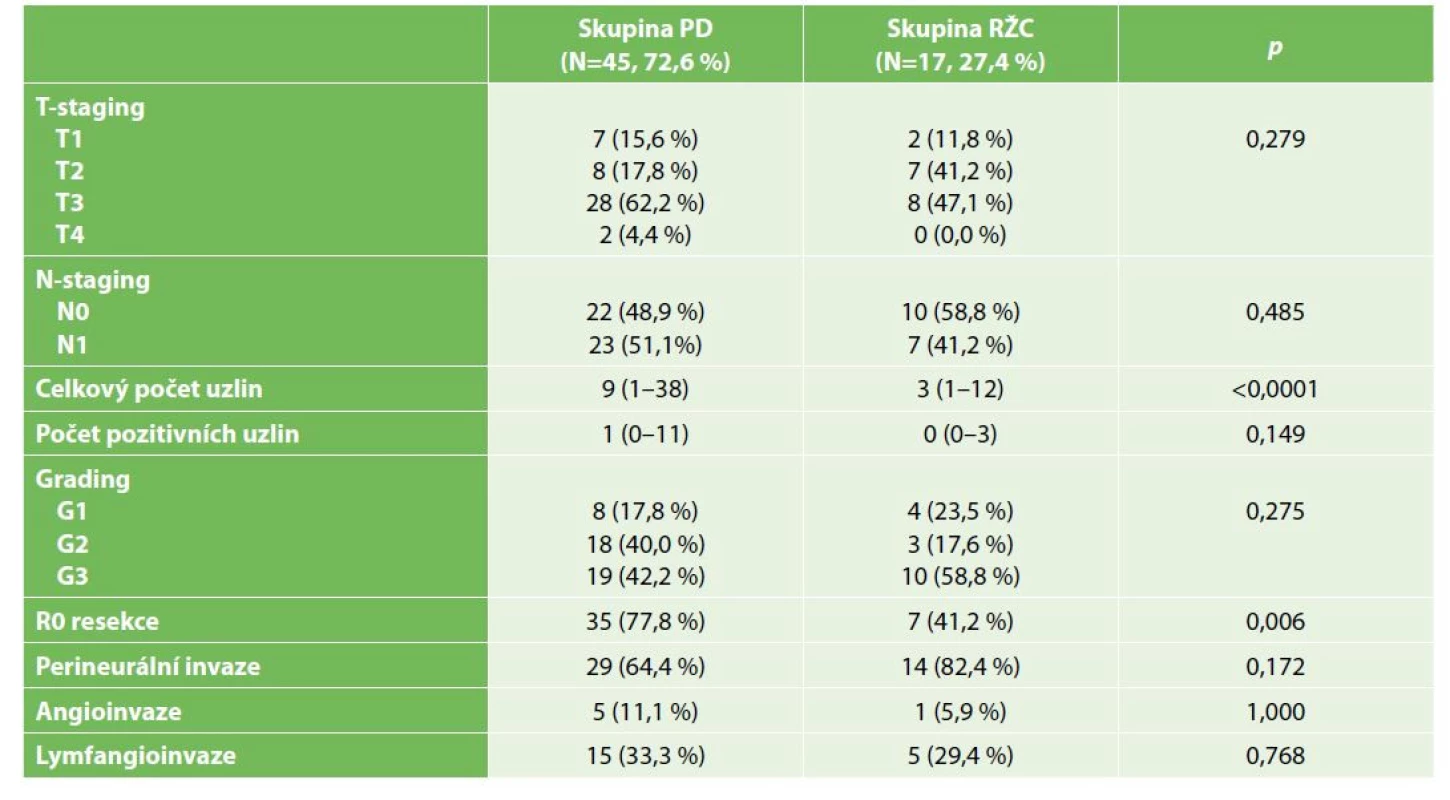
Medián celkového přežití byl 29 měsíců ve skupině PD a 28 měsíců ve skupině RŽC. Srovnatelné v obou skupinách nemocných jsou výsledky 1letého (66,7 % vs. 64,7 %), 3letého (37,8 % vs. 47,0 %) a 5letého přežití (15,6 % vs. 17,6 %) (Graf 1).
Graf 1. Celkové přežití pacientů dle typu operačního výkonu pomocí Kaplan-Meierovy analýzy (p=0,712)
Graph 1: Overall survival stratified by operation type estimated using the Kaplan-Meier analysis (p=0.712)
DISKUZE
Karcinom extrahepatálních žlučových cest patří společně s karcinomy pankreatu k solidním nádorům zažívacího traktu s nejméně příznivou prognózou. Jedinou potenciálně kurativní léčebnou metodou nabízející naději na vyléčení nebo dlouhodobé přežití je radikální resekční výkon. Potenciálně resekabilních je však pouze 10–40 % pacientů s cholangiokarcinomem [18]. Zejména pro nemocné s pozitivními lymfatickými uzlinami (N+) a pozitivními resekčními liniemi (R1) je smysluplné indikovat adjuvantní chemoterapii či chemoradioterapii spíše než radioterapii samotnou. U této skupiny nemocných nelze podobně jako u pankreatického karcinomu považovat resekční výkon jako dostačující, ale jako součást multimodální terapie [18].
Karcinomy žlučových cest jsou klasifikovány jako intrahepatické nebo extrahepatické, přičemž hranicí pro toto dělení je postižení segmentálních žlučovodů (větvení 2. řádu) [19]. Mezi extrahepatické cholangiokarcinomy jsou řazeny perihilární tumory (Klatskinův tumor) a dále distální cholangiokarcinomy. Anatomická hranice mezi nimi není přesně definovaná. Zatímco UICC klasifikace distální cholangiokarcinomy proximálně ohraničuje odstupem ductus cystikus [20], WHO klasifikace je vymezuje od perihilárních tumorů vzdáleností 2 cm od junkce žlučovodů [21]. Anatomická distální hranice extrahepatických cholangiokarcinomů je tvořena Vaterskou papilou, z níž vychází samostatná skupina ampulárních tumorů. Vzhledem k vysoké anatomické variabilitě větvení žlučovodů ve vztahu k jaternímu hilu se z onkochirurgického hlediska jeví jako praktičtější dělení na tumory středního žlučovodu – MBDC, které zahrnují i perihilární tumory Bismuth-Corlette typ I a tumory distálního žlučovodu v užším slova smyslu – DBDC – vymezené jeho intrapankreatickým průběhem.
DBDC tvoří 20–40 % všech cholangiokarcinomů a za adekvátní radikální resekční výkon je považována PD s lymfadenektomií (Obr. 1). MBDC je méně frekventní a „lokální“ radikální resekční výkon v podobě RŽC s lymfadenektomií a hepatikojejunoanastomózou je málokdy možný (Obr. 2). Negativní resekční linie a intaktní žilní a arteriální struktury v hepatoduodenálním vazu jsou nezbytnými předpoklady kompletního výkonu [13]. Zatímco provedení segmentální resekce žlučovodů za těchto podmínek je některými autory považováno za standardní a dostatečně radikální onkochirurgický výkon [22,23], někteří doporučují i u MBDC provedení PD [12,24].
Obr. 1. Pravostranná pankreatoduodenektomie, resekát s cholangiokarcinomem distálního žlučovodu (bílá šipka)
Fig. 1: Pancreatoduodenectomy, specimen with distal bile duct cholangiocarcinoma (white arrow)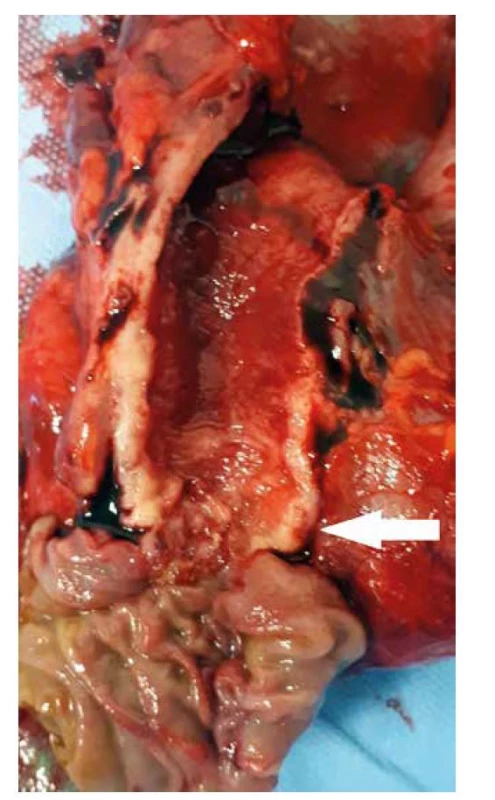
Obr. 2. Segmentální resekce žlučových cest, resekát s cholangiokarcinomem středního žlučovodu (černá šipka)
Fig. 2: Bile duct segmental resection, specimen with middle bile duct cholangiocarcinoma (black arrow)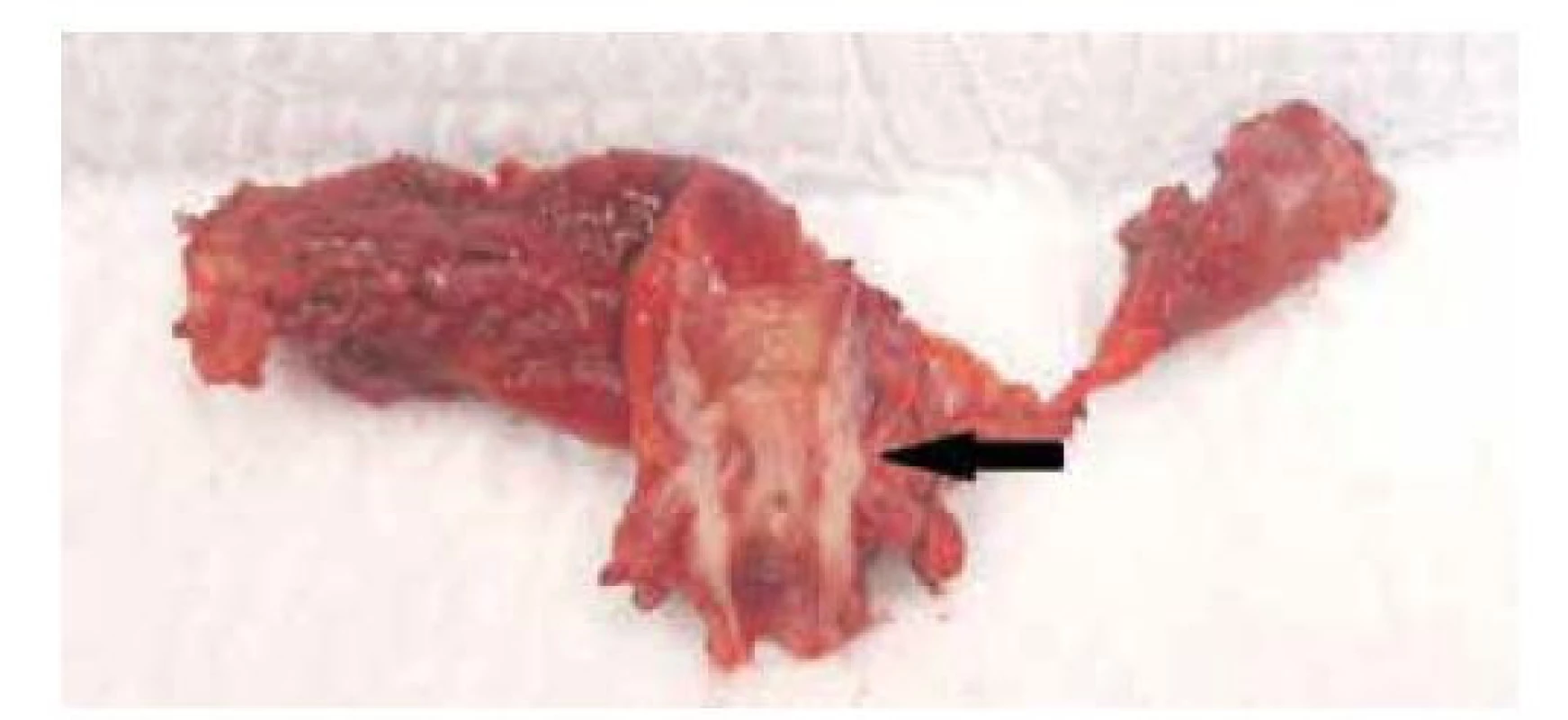
Prezentovaná studie přináší srovnání klinickopatologických a histopatologických charakteristik a pooperačních výsledků obou typů výkonů. RŽC je jednoznačně méně invazivním výkonem s kratší dobou operace i hospitalizace. S ohledem na retrospektivní hodnocení jsme si vědomi bias při vstupní selekci pacientů do jednotlivých skupin operačních výkonů. PD byla indikována u všech nemocných s DBDC a ze skupiny MBDC pouze u těch, u kterých nebylo možno dosáhnout negativní distální resekční linie nad hranou pankreatu. I přes tuto limitaci, která je společná i dalším dříve publikovaným sestavám na toto téma [11,12], se důvodně domníváme, že v parametrech pooperační morbidity a mortality je možné výsledky PD zobecnit i na skupinu všech MBDC, pokud by k PD byly indikovány, a srovnání pro tyto dva alternativní výkony provést.
Závažná morbidita byla ve skupině PD výrazně vyšší než ve skupině RŽC. Rizikovost extenzivnějšího výkonu v podobě PD neplyne z resekční fáze operace, ale z rekonstrukce s nutností vytvoření pankreatojejunální anastomózy. U PD pro cholangiokarciom se jedná o zásah do „zdravého“, základní nemocí nepostiženého pankreatu, který má za následek vyšší riziko výskytu specifických komplikací typu POPF a PPH nežli u stejných výkonů prováděných pro primární pankreatickou patologii [25–29]. S nimi spojená vyšší závažná morbidita vede i k časným úmrtím pacientů, kdy 90denní mortalita je v rozmezí 5,3–9,4 % [30–34]. Tato úmrtí z chirurgické příčiny tvoří významnou část úmrtí v prvním roce života (19–25 %), jak plyne i z naší dříve publikované sestavy PD pro DBDC [14,32]. Morbidita a mortalita PD tak významně ovlivňuje celkové výsledky ve skupině PD a limituje možnosti podání adjuvantní onkologické léčby u nemocných s N+ a R1.
Metaanalýza studií zabývajících se rizikovými prognostickými faktory pro přežití nemocných s resekovaným extrahepatickým cholangiokarcinomem vyhodnotila perineurální invazi, přítomnost uzlinových metastáz, nízce diferencovaný tumor a R1 resekci jako faktory spojené z kratší dobou přežití [34].
Radikalita výkonu je dána jak radiálními resekčními okraji na žlučovodu, tak cirkumferenčním resekčním okrajem preparátu. Rutinní využití peroperační kryoanalýzy obou resekčních linií na žlučovodu, případně využití peroperační cholangioskopie umožňuje významnou redukci pozitivity těchto radiálních resekčních okrajů [35,36]. Ve většině případů MBDC jsou to pozitivní cirkumferenční okraje, které vedou k hodnocení výkonu jako R1 resekce [14].
Důvodem, proč je částí autorů doporučováno u všech MBDC provedení PD, je vyšší procento R0 resekcí ve skupině PD oproti RŽC. Obdobný výsledek platí i pro naši sestavu (77,8 % vs. 41,2 %) (p=0,006). Výraznou limitaci této interpretace výsledků předchozích studií vidíme v již uvedeném bias a nesrovnatelných skupinách s ohledem na lokalizaci tumoru (DBDC vs. MBDC). Domníváme se, že vyšší procento R1 resekcí u MBDC je zdůvodnitelné anatomií hepatoduodenálního vazu, kde bezprostřední okolí žlučovodu tvoří jen menší množství řídké vazivové tkáně oproti většímu objemu parenchymu pankreatu a jeho pouzdra obklopující distální žlučovod. Lze tedy oprávněně vyslovit hypotézu, že rozšíření resekce na PD nemusí vést k navýšení počtu R0 resekcí právě proto, že nedojde k posunutí chirurgické hranice cirkumferenčního okraje MBDC na úrovni hepatoduodenálního ligamenta. Tyto argumenty podporují výsledky práce Schreudera, et al. [24], který uvádí identický podíl R0 resekcí u PD i RŽC pro MDBC. V případě kontaktu cirkumferenčního resekčního okraje s portální žílou či hepatickou tepnou je možná jejich resekce s cévní rekonstrukcí. Ta však pro pacienta nemusí znamenat jednoznačný benefit, protože řada autorů uvádí žilní resekci jako negativní prognostický faktor celkového přežití nemocných [30,32,37,38].
Dle očekávání byl potvrzen signifikantně nižší celkový počet resekovaných lymfatických uzlin ve skupině RŽC (p<0,0001). Naproti tomu zastoupení pacientů s pozitivitou lymfatických uzlin i medián počtu pozitivních lymfatických uzlin je v obou skupinách PD i RŽC srovnatelný. Zůstává tak otázkou, zda extenzivnější výkon typu PD s rozsáhlejší lymfadenektomií v uzlinových skupinách 13b, 17 (peripankreatické uzliny) a 14 (uzliny v okolí arteria mesenterica superior) ovlivní prognózu nemocných. Studie Lin, et al. pak prokazuje, že nemocní se 4–9 odebranými uzlinami vykazují lepší celkové přežití než s 0–3 a s 10 a více odebranými uzlinami [39]. Z analýzy 1, 3 a 5letého přežití souboru našich pacientů se jeví, že spíše nikoliv, protože nebyl zjištěn rozdíl v celkovém přežití mezi skupinami PD a RŽC. Dlouhodobé výsledky (5leté přežití) ve skupině MBDC (17,6 %) i DBDC (15,6 %) v našem souboru korespondují s publikovaným přežitím obdobných sestav včetně dat SEER NCI [11,14,40].
Prezentovaná studie má několik limitací. Jedná se o retrospektivní analýzu dat s nerovnoměrným zastoupením srovnávaných operačních výkonů. Další limitací je nízký počet pacientů zařazených do studie, který vyplývá z kombinace nízké incidence a resekability MBDC a DBDC.
ZÁVĚR
Resekce extrahepatických žlučových cest (RŽC) představuje akceptovatelnou metodu pro chirurgickou terapii MBDC s nízkou morbiditou i mortalitou v porovnání s PD. Nezbytnou podmínkou pro její provedení je peroperační potvrzení negativních radiálních resekčních linií na žlučovodu. Dlouhodobé přežití pacientů s MBDC i DBDC je při dodržení těchto kritérií srovnatelné.
Seznam zkratek:
CD – Clavien-Dindo
DBDC – distal bile duct carcinoma/karcinom distálního žlučovodu
DGE – opožděná evakuace žaludku
ERCP – endoskopická retrográdní cholangiopankreatikografie
MBDC – middle bile duct carcinoma/karcinom středního žlučovodu
PD – pravostranná pankreatoduodenektomie
POPF – pankreatická píštěl
PPH – postpankreatektomické krvácení
PTC – perkutánní transhepatická cholangiopankreatikografie
RŽC – segmentální resekce extrahepatických žlučových cest
Práce je podpořena grantem MZ ČR NV19-09-00088.
Konflikt zájmů
Autoři článku prohlašují, že nejsou v souvislosti se vznikem tohoto článku ve střetu zájmů a že tento článek nebyl publikován v žádném jiném časopise, s výjimkou kongresových abstrakt a doporučených postupů.
doc. MUDr. Martin Loveček, Ph.D
. I. chirurgická klinika Fakultní nemocnice Olomouc
I. P. Pavlova 6
779 00 Olomouc
e-mail: martin.lovecek@fnol.cz
ORCID: 0000-0001-9775-9643
Zdroje
1. Everhart JE, Ruhl CE. Burden of digestive diseases in the United States part III: liver, biliary tract, and pancreas. Gastroenterology 2009;136 : 1134–1144. doi:10.1053/j. gastro.2009.02.038.
2. Balzano G, Zerbi A, Capretti G, et al. Effect of hospital volume on outcome of pancreaticoduodenectomy in Italy. Br J Surg. 2008;95 : 357–36. doi:10.1002/ bjs.5982.
3. Hartwig W, Hackert T, Hinz U, et al. Pancreatic cancer surgery in the new millennium: better prediction of outcome. Ann Surg. 2011;254 : 311–319. doi:10.1097/ SLA.0b013e31821fd334.
4. Pecorelli N, Balzano G, Capretti G, et al. Effect of surgeon volume on outcome following pancreaticoduodenectomy in a high-volume hospital. J Gastrointest Surg. 2012;16 : 518–523. doi:10.1007/ s11605-011-1777-2.
5. Wente MN, Bassi C, Dervenis C, et al. Delayed gastric emptying (DGE) after pancreatic surgery: A suggested definition by the International Study Group of Pancreatic Surgery (ISGPS). Surgery 2007;142 : 761–768. doi:10.1016/j. surg.2007.05.005.
6. Wente MN, Veit JA, Bassi C, et al. Postpancreatectomy hemorrhage (PPH): An International Study Group of Pancreatic Surgery (ISGPS) definition. Surgery 2007;142 : 20–25. doi:10.1016/j. surg.2007.02.001.
7. Bassi C, Marchegiani G, Dervenis C, et al. The 2016 update of the International Study Group (ISGPS) definition and grading of postoperative pancreatic fistula: 11 years after. Surgery 2017;161 : 584–591. doi: 10.1016/j.surg.2016.11.014.
8. Morino K, Seo S, Yoh T, et al. The efficacy and limitations of postoperative adjuvant chemotherapy in patie,nts with extrahepatic cholangiocarcinoma. Anticancer Res. 2019 Apr;39(4):2155–2161. doi:10.21873/anticanres.13329.
9. Kapoor VK. Complications of pancreatoduodenectomy. Rozhl Chir. 2016;95 : 53 – 59.
10. Bock EA, Hurtuk MG, Shoup M, et al. Late complications after pancreaticoduodenectomy with pancreaticogastrostomy. J Gastrointest Surg. 2012;16 : 914–919. doi:10.1007/s11605-011-1805-2.
11. Akita M, Ajiki T, Kimihiko U, et al. Benefits and limitations of middle bile duct segmental resekcion of extrahepatic cholangiocarcinoma. Hepatobiliary and Pancreatic Diseases International 2020;19 : 147 – 152. doi: 10.1016/j.hbpd.2020.01.002.
12. Kim N, Lee H, Min SK, et al. Bile duct segmental resection versus pancreatoduodenectomy for middle and distal common bile duct cancer. Ann Surg Treat Res. 2018;94 : 240–246. doi:10.4174/ astr.2018.94.5.240.
13. Lee HG, Lee SH, Yoo DD, et al. Carcinoma of the middle bile duct: is bile duct segmental resection appropriate? World J Gastroenterol. 2009;15 : 5966–5971. doi:10.3748/wjg.15.5966.
14. Schreuder AM, Engelsman AF, Roessel S, et al. Treatment of mid-bile duct carcinoma: Local resection or pancreatoduodenectomy? European J of Surg Onco. 2019; 45 : 2180–2187. doi:10.1016/j. ejso.2019.06.032.
15. Dindo D, Demartines N, Clavien PA. Classification of surgical complications: A new proposal with evaluation in a cohort of 6336 patients and results of a survey. Ann Surg. 2004;240 : 205–213. doi:10.1097/01. sla.0000133083.54934.ae.
16. Tol JA, Gouma DJ, Bassi C, et al. Definition of a standard lymphadenectomy in surgery for pancreatic ductal adenocarcinoma: a consensus statement by the International Study Group on Pancreatic Surgery (ISGPS). Surgery 2014;156(3):591 – 600. doi:10.1016/j.surg.2014.06.016.
17. Japan Pancreas Society. Classification of pancreatic carcinoma. 4th English edition. Tokyo: Kanehara and Co. Ltd; 2017.
18. Cidon EU. Resectable cholangiocarcinoma: reviewing the role of adjuvant strategies. Clin Med Insights Oncol. 2016;10 : 43 – 48. doi:10.4137/CMO.S32821.
19. DeOliveira ML, Schulick RD, Nimura Y, et al. New staging system and a registry for perihilar cholangiocarcinoma. Hepatology 2011;53 : 1363–1371. doi:10.1002/ hep.24227.
20. Farges O, Fuks D, Le Treut YP, et al. AJCC 7th edition of TNM staging accurately discriminates outcomes of patients with resectable intrahepatic cholangiocarcinoma: by the AFC-IHCC-2009 study group. Cancer 2010; 117 : 2170–2177. doi:10.1002/cncr.25712.
21. Nakanuma, Y., Tsutsui A, Ren XS, et al. Intrahepatic cholangiocarcinoma. International Agency for Research on Cancer [IARC]; Lyon: 2010 : 217–224. doi:10.1155/2014/805973.
22. Becker HD. Chirurgická onkologie. Praha, Grada Publishing 2005 : 396–399.
23. Skalický T, Třeška V, Šnajdauf J, et al. Hepato - pankreato-biliární chirurgie. Maxdorf 2011 : 288–298.
24. Skipworth JRA, Keane MG, Pereira SP. Update on the management of cholangiocarcinoma. Dig Dis. 2014;32(5):570–578. doi:10.1159/000360507.
25. Braga M, Capretti G, Pecorelli N, et al. A prognostic score to predict major complications after pancreaticoduodenectomy. Ann Surg. 2011;254 : 702–707. doi:10.1097/SLA.0b013e31823598fb.
26. Greenblatt DY, Kelly KJ, Rajamanickam V, et al. Preoperative factors predict perioperative morbidity and mortality after pancreaticoduodenectomy. Ann Surg Oncol. 2011;18 : 2126–2135. doi:10.1245/ s10434-011-1594-6.
27. Uzunoglu FG, Reeh M, Vettorazzi E, et al. Preoperative pancreatic resection (PREPARE) score. A prospective multicenter - based morbidity risk score. Annals of Surgery 2014;260(5):857–64. doi:10.1097/SLA.0000000000000946.
28. Loveček M, Skalický P, Köcher M, et al. Krvácení po pankreatektomii (PPH), prevalence, diagnostika a řešení. Rozhl Chir. 2016;95(9):350–357. PMID: 27653303.
29. Loveček M, Havlík R, Köcher M, et al. Wideochir Inne Tech Maloinwazyjne 2014;9(2):297–301. doi:10.5114/ wiitm.2011.38178.
30. Petrova E, Ruckert F, Zach S, et al. Survival outcome and prognostic factors after pancreatoduodenectomy for distal bile duct carcinoma: a retrospective multicenter study. Langenbeck‘s Arch Surg. 2017;402 : 831–840. doi:10.1007/s00423 - 017-1590-9.
31. Byrling J, Andersson R, Sasor A, et al. Outcome and evaluation of prognostic factors after pancreaticoduodenectomy for distal cholangiocarcinoma. Ann of Gastroenterology 2017;30 : 571–517. doi:10.20524/aog.2017.0169.
32. Skalicky P, Urban O, Ehrmann J, et al. The short - and long-term outcomes of pancreatoduodenectomy for distal cholangiocarcinoma. Biomed Pap Med Fac Univ Palacky Olomouc Czech Repub. 2021 Aug 10. doi:10.5507/bp.2021.043.
33. Lovecek M, Skalicky P, Klos D, et al. Longterm survival after resections for pancreatic ductal adenocarcinoma. Single centre experience. Biomed Pap Med Fac Univ Palacky Olomouc Czech Repub. 2016;160(2):280–286. doi:10.5507/ bp.2016.011.
34. Wellner UF, Shen Y, Keck T, et al. The survival outcome and prognostic factors for distal cholangiocarcinoma following surgical resection: a meta-analysis for the 5-year survival. Surg Today 2017;47 : 271 – 279. doi:10.1007/s00595-016-1362-0.
35. Shiraki T, Kuroda H, Takada A, et al. Intraoperative frozen section diagnosis of bile duct margin for extrahepatic cholangiocarcinoma. World J Gastroenterol 2018;24(12):1332–1342. doi:10.3748/wjg. v24.i12.1332.
36. Hajer J, Havlůj L, Whitley A, et al. The role of single-operator cholangioscopy (SpyGlass) in the intraoperative diagnosis of intraductal borders of cholangiocarcinoma proliferation – pilot study. Cas Lek Cesk. 2019;158(2):68–72. PMID: 31109166.
37. Miura F, Sano K, Amano H, et al. Evaluation of portal vein invasion of distal cholangiocarcinoma as borderline resectability. J Hepatobiliary Pancreat Sci. 2015;22 : 294–300. doi:10.1002/jhbp.198.
38. Maeta T, Ebata T, Hayashi E, et al. Nagoya Surgical Oncology Group. Pancreatoduodenectomy with portal vein resection for distal cholangiocarcinoma. Br J Surg. 2017;104 : 1549–1557. doi:10.1002/ bjs.10596.
39. Lin HP, Li SW, Liu Y, et al. Prognostic value of lymph nodes count on survival of patients with distal cholangiocarcinomas. World J Gastroenterol. 2018;24(9):1022 – 1034. doi:10.3748/wjg.v24.i9.1022.
40. www.cancer.org.
Štítky
Chirurgie všeobecná Ortopedie Urgentní medicína
Článek vyšel v časopiseRozhledy v chirurgii
Nejčtenější tento týden
2022 Číslo 9- Metamizol jako analgetikum první volby: kdy, pro koho, jak a proč?
- Stillova choroba: vzácné a závažné systémové onemocnění
- Hojení análních fisur urychlí čípky a gel
- Jak souvisí postcovidový syndrom s poškozením mozku?
-
Všechny články tohoto čísla
- Sekce HPB a biliární chirurgie
- Chirurgická léčba karcinomu extrahepatálních žlučových cest – aktuální důkazy a doporučení
- Chirurgie iatrogenních poranění žlučových cest
- Zhoubné nádory mimojaterních žlučových cest
- Karcinom středního a distálního žlučovodu, retrospektivní analýza, krátkodobé a dlouhodobé výsledky chirurgické léčby
- Intrahepatický cholangiokarcinom: rizikové faktory přežití operovaných nemocných
- Masivní nitrohrudní krvácení jako komplikace difúzní alveolární hemoragie a antikoagulační léčby při covid 19 – 2 kazuistiky
- Allen-Mastersův syndrom jako příčina ileózního stavu – kazuistika
- Parciální resekce jako možnost řešení pozdní infekce nativního i protetického arteriovenózního zkratu – kazuistiky
- Rozhledy v chirurgii
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- Chirurgie iatrogenních poranění žlučových cest
- Zhoubné nádory mimojaterních žlučových cest
- Allen-Mastersův syndrom jako příčina ileózního stavu – kazuistika
- Chirurgická léčba karcinomu extrahepatálních žlučových cest – aktuální důkazy a doporučení
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



