-
Články
Top novinky
Reklama- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
Top novinky
Reklama- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Top novinky
ReklamaSoučasné možnosti terapie věkem podmíněné makulární degenerace
Current treatment options for age-related macular degeneration
Age-related macular degeneration (AMD) is a degenerative disease of the retina that affects its central region, the macula lutea. It is a severe, sight-threatening disease that initially manifests unilaterally in most cases, but half of patients develop involvement of the fellow eye within 5 years of diagnosis. The etiology is multifactorial, with risk factors including age, genetic predisposition, smoking, and status post cataract surgery. There are 2 forms of the disease, namely dry and wet. The dry form of AMD usually progresses slowly, whereas the wet form can rapidly lead to deterioration of visual function. Diagnosis relies primarily on slit-lamp examination of the ocular background and examination by optical coherence tomography and angiography. The treatment of the dry form consists of supportive pharmacotherapy or rheopheresis, while the first-line treatment of the wet form is anti-vascular endothelial growth factor drugs, which are injected directly into the vitreous cavity. There is no prevention of the disease; regular examinations by an ophthalmologist and self-monitoring of vision using the so-called Amsler grid, which is used to detect early signs of the disease, are advisable.
Autoři: Schreiberová Zuzana; Karhanová Marta; Pašková Barbora
Působiště autorů: Oční klinika, Lékařská fakulta Univerzity Palackého a Fakultní nemocnice Olomouc
Vyšlo v časopise: Geriatrie a Gerontologie 2023, 12, č. 4: 172-176
Kategorie: Přehledový článek
Souhrn
Věkem podmíněná makulární degenerace (VPMD) je degenerativní onemocnění sítnice, které postihuje její centrální krajinu, tzv. žlutou skvrnu (macula lutea). Jedná se o závažnou, zrak ohrožující diagnózu, která se v naprosté většině případů nejprve manifestuje jednostranně, ale u poloviny pacientů dochází k postižení druhého oka do pěti let od stanovení diagnózy. Etiologie je multifaktoriální, mezi rizikové faktory řadíme zejména věk, genetickou predispozici, kouření a stav po operaci katarakty. Existují dvě formy onemocnění, a to suchá a vlhká. Suchá forma VPMD většinou progreduje pomalu, zatímco vlhká forma může vést k rychlému zhoršení zrakových funkcí. Diagnostika se opírá především o vyšetření očního pozadí za štěrbinovou lampou a vyšetření pomocí optické koherenční tomografie a angiografie. Léčba suché formy spočívá v podpůrné farmakoterapii, případně rheoferéze, v terapii vlhké formy jsou léky první volby preparáty působící proti vaskulárnímu endotelovému růstovému faktoru, které se aplikují přímo do sklivcové dutiny. Prevence onemocnění neexistuje, vhodné jsou pravidelné prohlídky u oftalmologa a samokontroly vidění pomocí tzv. Amslerovy mřížky, která slouží k včasnému rozpoznání projevů onemocnění.
Úvod
Věkem podmíněná makulární degenerace (VPMD) je degenerativní onemocnění sítnice, které postihuje její centrální krajinu, tzv. žlutou skvrnu (macula lutea). Jedná se o závažnou, zrak ohrožující diagnózu, která se v naprosté většině případů nejprve manifestuje jednostranně, ale u poloviny pacientů dojde k postižení druhého oka do pěti let od stanovení diagnózy.(1) V rozvinutých zemích je VPMD nejčastější příčinou praktické slepoty u obyvatel nad 55 let. Odhaduje se, že v roce 2020 trpělo celosvětově touto nemocí asi 200 milionů lidí a v roce 2040 se počet bude blížit 300 milionům.(2) Etiologie je multifaktoriální a bylo popsáno několik rizikových faktorů, které se podílejí na vzniku a rozvoji onemocnění. Silná asociace byla nalezena mezi VPMD a věkem, genetickou predispozicí, kouřením a stavem po operaci katarakty. Vliv má zřejmě také nízký přísun antioxidantů a vysoký body mass index, zvažuje se i role kardiovaskulárních onemocnění nebo arteriální hypertenze.(3,4)
VPMD se vyskytuje ve dvou formách. Asi 80–90 % pacientů má formu suchou (atrofickou), která je prognosticky příznivější než forma vlhká (exsudativní), kterou trpí 10–20 % postižených. Suchá forma VPMD většinou progreduje pomalu, naopak vlhká forma může mít bez léčby velmi rychlý rozvoj. Rizikem suché formy je zvrat do formy vlhké, který pozorujeme asi v 10 % případů.(5) Suchá forma se vyznačuje degenerativními a dystrofickými změnami vnějších vrstev sítnice (Bruchovy membrány, retinálního pigmentového epitelu a fotoreceptorů), na očním pozadí (OP) nacházíme v makule přesuny pigmentu nebo drúzy (odpadní produkty metabolismu, obr. 1B). Postupně může docházet k atrofizaci sítnice a konečným stadiem je tzv. geografická atrofie. Vlhká forma je charakteristická tvorbou choroideální neovaskulární membrány (CNV), která prorůstá z cévnatky do sítnice. Jde o patologickou cévní síť, která propouští tekutinu do různých vrstev sítnice a způsobuje její edém či prokrvácení (obr. 1C). Příčinou vzniku CNV je nadměrná tvorba růstových faktorů, především vaskulárního endotelového růstového faktoru (VEGF), který je fyziologicky přítomen ve sklivci, ve stáří se však jeho tvorba v důsledku hypoxie zvyšuje a tím indukuje tvorbu CNV. Pokud není vlhká forma VPMD adekvátně a včas léčena, mění se CNV na fibrotickou jizvu, která je terminálním neléčitelným stadiem onemocnění (obr. 1D).
Obr. 1. Fotografie očního pozadí levého oka: 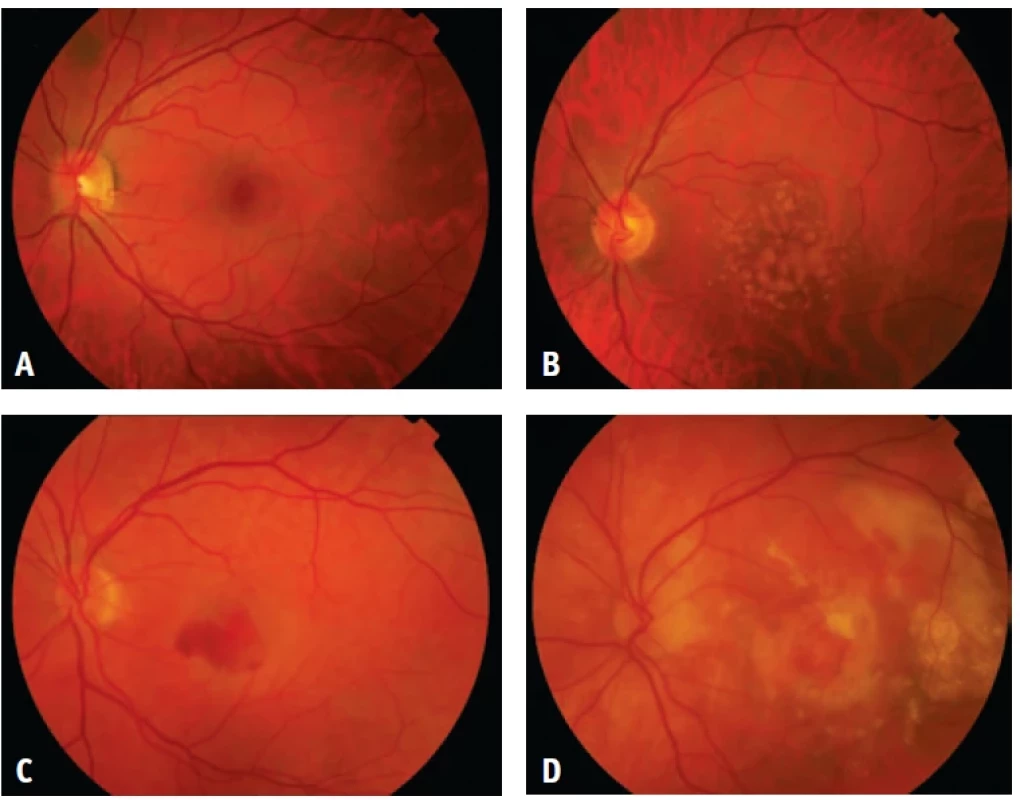
A. fyziologický nález,
B. drúzy při suché formě onemocnění,
C. edém a krvácení při vlhké formě onemocnění,
D. terminální stadium fibrotické jizvyKlinické projevy, diagnostika
Nemocní si stěžují na zhoršení vidění při činnostech na blízkou vzdálenost, jako je čtení, psaní nebo ruční práce. Udávají, že písmena různě přeskakují nebo vypadávají, dříve rovné linie se vlní (tzv. metamorfopsie) a nepoznávají známé obličeje či dopravní značky. Periferní a prostorové vidění zůstává nedotčeno.
Diagnostika choroby se opírá o anamnézu subjektivních potíží pacienta, vyšetření zrakové ostrosti (ZO) na optotypech a biomikroskopické vyšetření OP v arteficiální mydriáze za štěrbinovou lampou (obr. 2A). Klinické vyšetření doplňují zobrazovací metody, především optická koherenční tomografie (OCT; obr. 2B) a optická koherenční angiografie (OCT-A). Jde o rychlé neinvazivní skenování sítnice v oblasti makuly, které nám pomůže zobrazit změny jednotlivých vrstev a většinou i samotnou CNV (obr. 3, obr. 4). Pokud není za pomoci těchto vyšetření diagnóza VPMD zcela jasná, je možné doplnit fluorescenční angiografii (FAg) k ozřejmení patologické CNV. Na rozdíl od OCT a OCT-A jde však o metodu invazivní, vyžadující intravenózní podání kontrastní látky (fluoresceinu), která může mít svá rizika, proto se k ní v této indikaci přistupuje spíše ve výjimečných případech.
Obr. 2. Vyšetřovací metody: 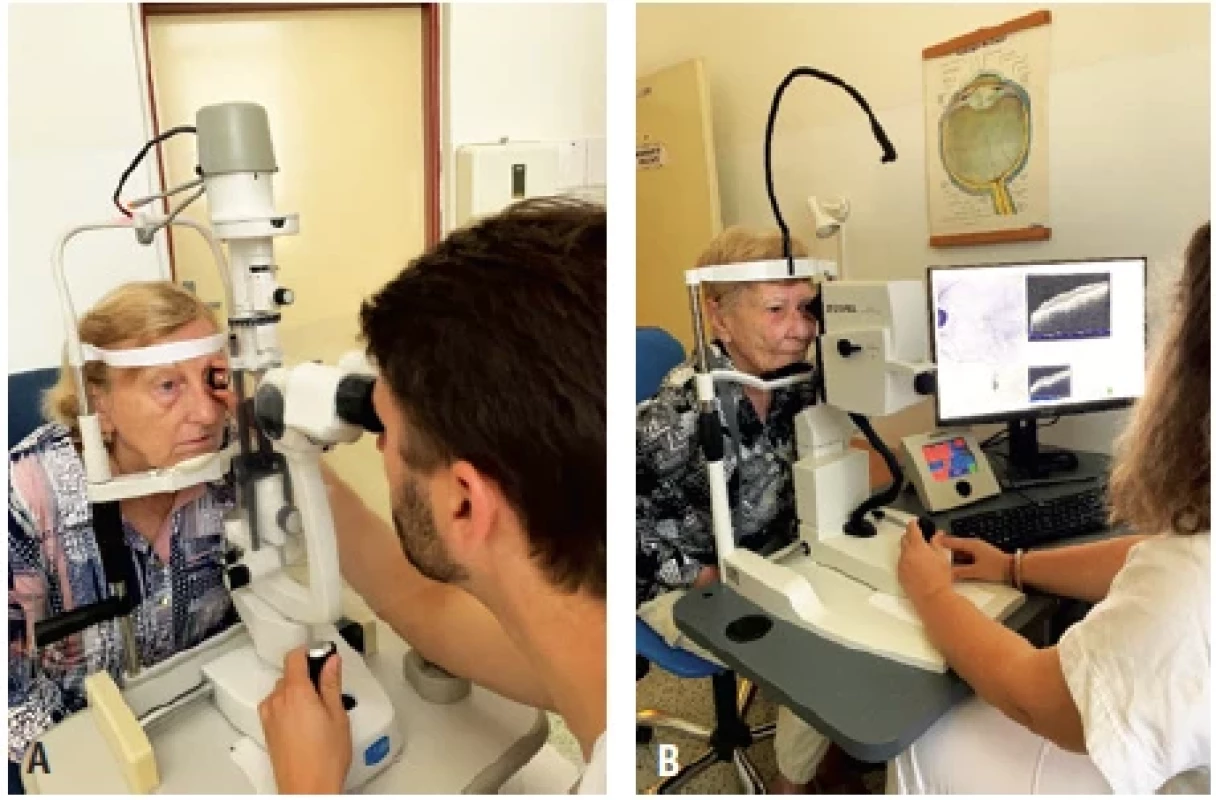
A. vyšetření očního pozadí za štěrbinovou lampou,
B. vyšetření sítnice pomocí optické koherenční tomografie.
Obě pacientky souhlasí se A B zveřejněním fotografie.Obr. 3. Optická koherenční tomografie: 
A. fyziologický nález,
B. drúzy při suché formě onemocnění,
C. edém při vlhké formě onemocnění,
D. terminální stadium fibrotické jizvyObr. 4. Choroideální neovaskulární membrána (šipka) na optické koherenční angiografii 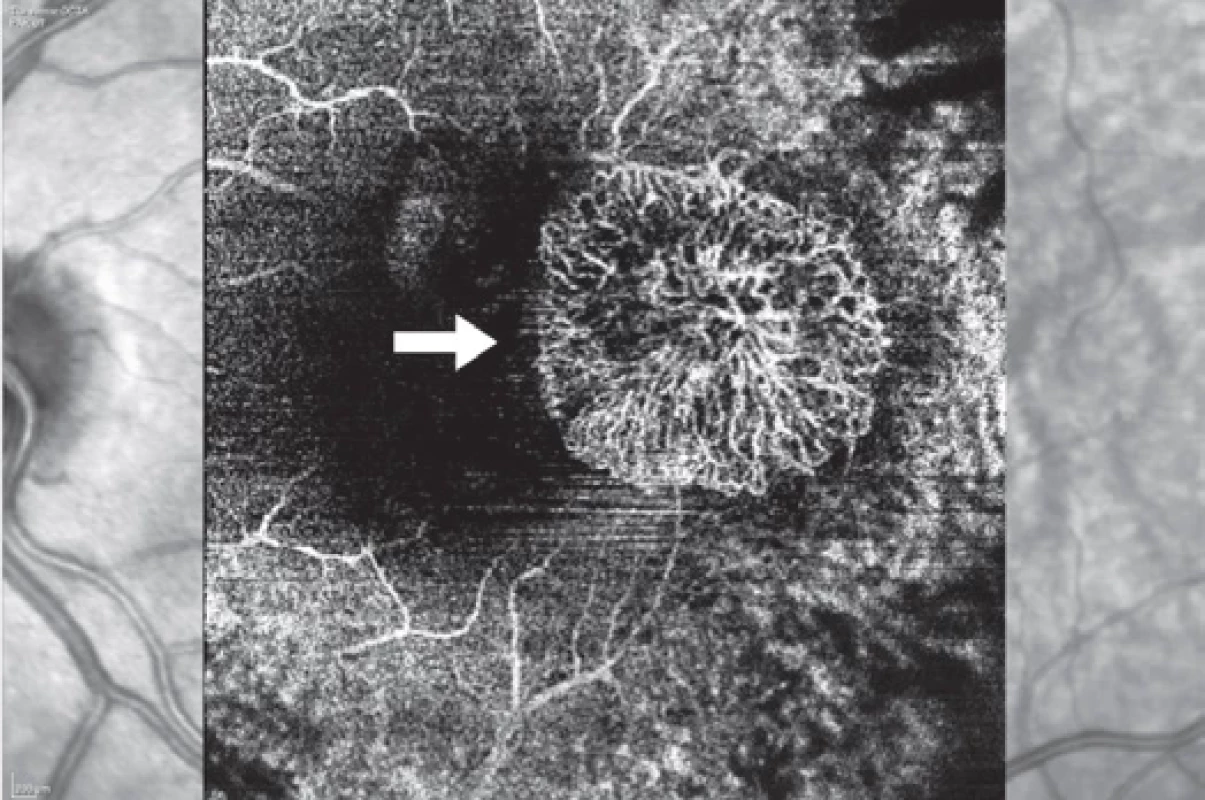
Možnosti terapie VPMD
Léčba obou forem onemocnění se neustále vyvíjí. Při vzniku suché formy hrají významnou roli volné kyslíkové radikály a oxidační stres, proto zde má důležité postavení zejména podpůrná farmakoterapie vitaminy a antioxidanty. Studie AREDS 2 (Age-Related Eye Disease Study 2) prokázala, že přísun vitaminů E, C, luteinu, zeaxanthinu, zinku a mědi má příznivý vliv na zpomalení progrese onemocnění.(6)
V současné době se rozvíjí léčba suché formy VPMD pomocí rheoferézy. Jde o mimotělní metodu očištění krve, kdy je krev odváděná z těla pacienta separována na krevní elementy a plazmu. Plazma dále prochází rheoferetickým filtrem, který zachycuje proteiny o vysoké molekulové hmotnosti (např. 2-makroglobulin, fibrinogen, LDL-cholesterol), a následně je navrácena zpět do krevního oběhu nemocného.(7) Cílem je zlepšit reologické vlastnosti krve, zejména snížit její viskozitu a agregaci erytrocytů a trombocytů, a tím zlepšit krevní průtok mikrocirkulací. Díky tomu dochází ke zlepšení výživy sítnice a ke snížení ischemie a tvorby VEGF.(8) Indikováni jsou pacienti s nálezem tzv. měkkých drúz nebo drúzoidních ablací pigmentového epitelu sítnice. Léčba probíhá ambulantně, nemocný musí mít zajištěn žilní vstup (nejčastěji jsou použity žíly v loketní jamce). Pacient absolvuje osm procedur rheoferézy v 10 týdnech, během kterých je průběžně monitorován klinický stav a základní životní funkce.(8) Nezávažné komplikace se vyskytují jen asi v 5 % případů, nejčastěji se jedná o vazovagální synkopy.(9)
Léčba vlhké formy VPMD se opírá o látky působící proti vaskulárnímu endotelovému růstovému faktoru (anti-VEGF), které se aplikují pomocí intravitreální injekce přímo do sklivcové dutiny postiženého oka. Anti-VEGF preparáty blokují účinek VEGF na jeho receptorech endotelových buněk CNV a sítnicových cév, čímž snižují propustnost cévní stěny a tvorbu neovaskularizací. V současnosti jsou v České republice k léčbě vlhké formy VPMD schváleny následující účinné látky: ranibizumab (Lucentis; Novartis Europharm Limited, Dublin, Irsko), aflibercept (Eylea; Bayer AG, Leverkusen, Německo), brolucizumab (Beovu; Novartis Europharm Limited, Dublin, Irsko), faricimab (Vabysmo; Roche Registration GmbH, Grenzach-Wyhlen, Německo). Poslední jmenovaný přitom nepůsobí pouze proti VEGF, ale má vliv také na růstový faktor angiopoietin 2, a umožňuje tak redukci zánětu a zlepšení stability cévní stěny.(10–13)
Léčba je finančně velmi nákladná, proto je soustředěna do specializovaných center. Ze zdravotního pojištění je hrazena v případě, že pacient splňuje indikační omezení úhrady, která se týkají úrovně vstupní ZO, známek aktivity onemocnění na OCT/FAg, rozsahu léze v makule a rozsahu krvácení. Kontraindikací léčby je aktivní oční infekce či závažný nitrooční zánět.(10–13)
Anti-VEGF terapie se může řídit různými léčebnými režimy. Ve všech režimech pacient absolvuje úvodní nasycovací fázi, kdy během prvních 3–4 měsíců dostane 3–4 injekce (v závislosti na konkrétním preparátu). V současnosti nejčastěji používaném režimu „treat and extend“ se poté prodlužuje nebo zkracuje interval mezi aplikacemi o několik týdnů podle aktuální aktivity onemocnění. Cílem tohoto režimu je najít individuální interval léčby pro každého pacienta, a udržet tak stabilní výsledky vyšetření zraku a/nebo anatomických poměrů. Anti-VEGF látky se aplikují do vymizení aktivity onemocnění, poté je možno nález pouze sledovat a léčbu obnovit při znovuobjevení aktivity. V situacích, kdy dojde k závažnému poklesu ZO pod určitou mez nebo pokud na základě anatomického nálezu v makule nelze očekávat další efekt, je nutné terapii ukončit.(10–13)
Léčba probíhá ambulantně. Na našem pracovišti je nejprve pacient vyšetřen lékařem, který na základě aktivity onemocnění a dalších dříve zmíněných parametrů rozhodne o vhodnosti podání injekce. Nemocný je odeslán na aplikační sál, kde je oko pomocí lokálních anestetik ve formě kapek znecitlivěno a je provedena dezinfekce oka a jeho okolí. Po nasazení očního rozvěrače, který má udržet oko otevřené, je injekce aplikována do oblasti skléry (bělimy), poté jsou jednorázově aplikována antiglaukomatika (kapky na snížení nitroočního tlaku), oko je sterilně zakryto a pacient odchází domů (obr. 5). Tento postup se může podle preference a zkušeností jednotlivých pracovišť mírně lišit. Je vhodné, aby pacienti pár dní po injekci dodržovali klidový režim a vyhnuli se prašnému prostředí kvůli možnému rozvoji infekce.
Nežádoucí účinky léčby jsou ve většině případů nezávažné, jedná se např. o bolest oka, přechodné zvýšení nitroočního tlaku nebo vznik sufuze – krvácení pod spojivku, které pacienta nijak neohrožuje a v řádu dnů či týdnů se spontánně vstřebá. Výjimečně může dojít ke vzniku iatrogenní katarakty, trhliny nebo odchlípení sítnice. Nejzávažnější komplikací je endoftalmitida, což je zrak ohrožující zánět, který postihuje všechny nitrooční struktury a vyžaduje podání antibiotik a většinou i urgentní chirurgické řešení.(10–13)
Vlhká forma VPMD se může výjimečně manifestovat rozsáhlým krvácením pod sítnici, tzv. subretinálním krvácením. V těchto případech je možné intravitreálně (případně subretinálně za pomoci operace pars plana vitrektomie) aplikovat rekombinantní tkáňový aktivátor plazminogenu (rtPA) s malým množstvím expanzního plynu. Cílem je rychlejší resorpce a odsunutí krvácení do periferie sítnice.(3) Samotné podání injekce probíhá stejně jako u anti-VEGF preparátů, avšak po aplikaci rtPA je nezbytné, aby pacient několik dní dodržoval polohu obličejem dolů. Plyn ve sklivcové dutině tak může tlačit na oblast makuly a posunout krvácení do periferie sítnice, kde nebude mít vliv na centrální ZO. Prognóza této varianty VPMD je však nepříznivá.
Obr. 5. Aplikace intravitreální injekce: 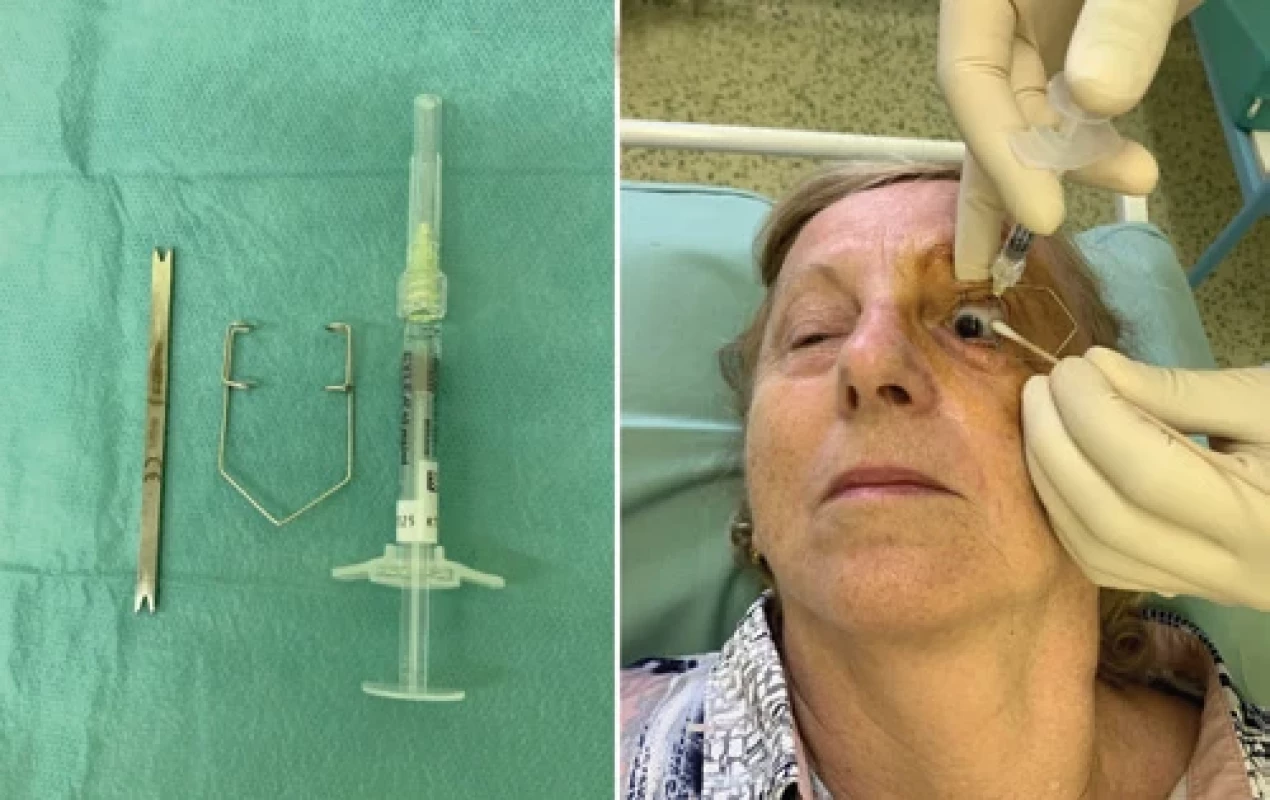
A. zleva měřítko, oční rozvěrač, injekční stříkačka s jehlou,
B. aplikace injekce.
Pacientka souhlasí se zveřejněním fotografie.Prevence a kvalita života s VPMD
Stoprocentně účinná prevence vzniku a rozvoje VPMD neexistuje. Doporučené je užívat podpůrné preparáty s vitaminy, luteinem a zeaxanthinem, omezit nebo zanechat kouření a pravidelně docházet na preventivní oční vyšetření. Pacienti také mohou samostatně doma provádět kontrolu správné funkce makuly pravidelným používáním čtverečkované černobílé sítě, tzv. Amslerovy mřížky. Pacient provádí asi 1× za 2 týdny samovyšetření tak, že si za dobrého osvětlení a po nasazení brýlové korekce do blízka, pokud ji používá, zakryje dlaní jedno oko, ze vzdálenosti 30–40 cm fixuje druhým okem bod ve středu mřížky a současně vnímá, jak vypadají okolní linie – u zdravého oka by měly být všechny rovné, na sebe kolmé, žádná by neměla chybět. Totéž zopakuje i s druhým okem. Jak může mřížku vidět zdravý pacient a pacient s VPMD, znázorňuje obrázek 6.
VPMD významně ovlivňuje kvalitu života – znemožňuje řízení motorových vozidel, rozpoznání tváří nebo provádění aktivit na blízkou vzdálenost, ztěžuje sebeobsluhu. Navzdory neustálému vývoji nových molekul není vždy možné uchovat ZO na náležité úrovni i přes adekvátní léčbu, proto je pacientům v ireverzibilním stadiu onemocnění vhodné nabídnout návštěvu center pro slabozraké a nevidomé pacienty, jako je např. Tyfloservis. Tato centra bezplatně pomáhají s nácvikem využívání zbylých zrakových funkcí, s výběrem optických či neoptických pomůcek pro čtení a nácvikem práce s nimi nebo učí klienty kompenzovat zrakovou vadu ostatními smysly.(14)
Obr. 6. Amslerova mřížka. Vlevo normální vidění, vpravo vidění s vlhkou formou věkem podmíněné makulární degenerace(15) 
Závěr
VPMD může vést v pokročilých stadiích k významnému zhoršení zrakových funkcí nejen u starších lidí, ale také u lidí v produktivním věku. Zatímco suchá forma VPMD má omezené terapeutické možnosti, v léčbě vlhké formy VPMD jsou zlatým standardem anti-VEGF preparáty, kterých je na trhu dostupných hned několik a stále je snaha vyvíjet nové molekuly. Každý pacient s podezřením na VPMD by měl absolvovat vyšetření pomocí OCT, aby byla diagnóza vyloučena či potvrzena a případně včas zahájena odpovídající léčba. Jedině tak může být udržena kvalita života našich pacientů na náležité úrovni. ¡
Korespondenční adresa:
MUDr. Zuzana Schreiberová, FEBO
Oční klinika LF UP a FN Olomouc
Zdravotníků 248/7
779 00 Olomouc
e-mail: zuzana.schreiberova@fnol.czMUDr. Zuzana Schreiberová, FEBO
Je absolventkou Lékařské fakulty Univerzity Palackého v Olomouci. Studium ukončila v roce 2017, od té doby pracuje jako lékařka na Oční klinice LF UP a FN Olomouc. V roce 2022 úspěšně složila specializační zkoušku v oboru oftalmologie a zároveň prestižní mezinárodní zkoušku Evropské oftalmologické společnosti (European Board of Ophthalmology), jejíž se stala členem. Hlavní náplní její práce je péče o pacienty s onemocněním sítnice a cévnatky. Kromě lékařské profese se podílí na výuce oftalmologie studentů Lékařské fakulty a Fakulty zdravotnických věd Univerzity Palackého a v rámci doktorského studia se věnuje i vědecko-výzkumné činnosti.
Zdroje
1. Kuchynka P. Oční lékařství. Praha: Grada Publishing 2016; 936.
2. Vyawahare H, Shinde P. Age-related macular degeneration: epidemiology, pathophysiology, diagnosis, and treatment. Cureus 2022; 14(9): e29583.
3. Salmon JF. Kanski’s clinical ophthalmology. 9th ed. Oxford: Elsevier Books 2020; 956.
4. Chakravarthy U, Wong TY, Fletcher A, et al. Clinical risk factors for age-related macular degeneration: a systematic review and meta-analysis. BMC Ophthalmol 2010; 10 : 31.
5. Hobbs SD, Pierce K. Wet age-related macular degeneration (Wet AMD). In: StatPearls [online]. Jan 2023 [cit. 2023-10-01]. Dostupné z: https://www.ncbi.nlm.nih.gov/books/NBK572147.
6. National Eye Institute. AREDS 2 Supplements for Age-Related Macular Degeneration (AMD) [online]. NEI 2021 [cit. 2023-10-05]. Dostupné z: https://www.nei.nih.gov/learn-about-eye-health/eye-conditions-and-diseases/age-related-macular-degeneration/nutritional-supplements-age-related-macular-degeneration.
7. Paříková A. Rheoferéza a její využití v léčbě chorob s poruchou mikrocirkulace. Přehled. Cesk Slov Oftalmol 2023; 79(1): 3–5.
8. Langrová H, Bláha V, Dvořáková H, et al. Rheoferéza v léčbě věkem podmíněné makulární degenerace. Cesk Slov Oftalmol. 2023; 79(1): 8–24.
9. Blaha M, Lanska M, Tomšova H, et al. Apheresis data registration in WWA registry-10-year experience of our center. Transfus Apher Sci 2017; 56(5): 738–741.
10. European Medicines Agency. Příloha I: Souhrn údajů o přípravku [online]. EMA 2016 [cit. 2023-10-05]. Dostupné z: https://www.ema.europa.eu/documents/product-information/lucentis-epar-product-information_cs.pdf.
11. European Medicines Agency. Příloha I: Souhrn údajů o přípravku [online]. EMA 2017 [cit. 2023-10-05]. Dostupné z: https://www.ema.europa.eu/en/documents/product-information/eylea-epar-product-information_cs.pdf.
12. European Medicines Agency. Příloha I: Souhrn údajů o přípravku [online]. EMA 2020 [cit. 2023-10-05]. Dostupné z: https://www.ema.europa.eu/en/documents/product-information/beovu-epar-product-information_cs.pdf.
13. European Medicines Agency. Příloha I: Souhrn údajů o přípravku [online]. EMA 2022 [cit. 2023-10-05]. Dostupné z: https://www.ema.europa.eu/en/documents/product-information/vabysmo-epar-product-information_cs.pdf.
14. Tyfloservis. Základní informace pro klienty [online]. Tyfloservis 2020 [cit. 2023-09-30]. Dostupné z: https://www.tyfloservis.cz/informace-pro-klienty.
15. Amsler grid. In: drsharangwartikar.com [online]. Sharang Wartikar 2020 [cit. 2023-09-30]. Dostupné z: https://drsharangwartikar.com/wp-content/uploads/I-Amslers-grid.png.
Štítky
Geriatrie a gerontologie Praktické lékařství pro dospělé Protetika
Článek Editorial
Článek vyšel v časopiseGeriatrie a Gerontologie
Nejčtenější tento týden
2023 Číslo 4- Alergie na antibiotika u žen s infekcemi močových cest − poznatky z průřezové studie z USA
- Není statin jako statin aneb praktický přehled rozdílů jednotlivých molekul
- Metamizol jako analgetikum první volby: kdy, pro koho, jak a proč?
- Trazodon pohledem praktického lékaře
- Magnosolv a jeho využití v neurologii
-
Všechny články tohoto čísla
- Editorial
- Gerontologická prevence jako součást geriatrie
- Role lékaře v případě domácího násilí na seniorech
- Nedoslýchavost – s důrazem na presbyakuzi a její řešení
- Současné možnosti terapie věkem podmíněné makulární degenerace
- Určení fází paliativní péče u klientů v domově pro seniory – představení nového dotazníku
- Vliv vybraných faktorů na přisuzovanou důstojnost hospitalizovaných seniorů
- Sklerotizace absolutním alkoholem u obrovských cyst štítné žlázy a adenomů příštítných tělísek jako alternativa k operačnímu výkonu u seniorů
- Myasthenia gravis u geriatrické pacientky
- Významné životní jubileum prof. MUDr. Evy Topinkové, CSc.
- Geriatrie a Gerontologie
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- Gerontologická prevence jako součást geriatrie
- Významné životní jubileum prof. MUDr. Evy Topinkové, CSc.
- Nedoslýchavost – s důrazem na presbyakuzi a její řešení
- Určení fází paliativní péče u klientů v domově pro seniory – představení nového dotazníku
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání




