-
Články
Top novinky
Reklama- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
Top novinky
Reklama- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Top novinky
ReklamaRegulace energetické rovnováhy a jídelního chování
Regulation of energy balance and eating behaviour
Energy balance and eating behaviour are regulated by leptin-melanocortin system that includes afferent signals from peripheral tissues (leptin, ghrelin, insulin, blood glucose), integrative first order neurons in arcuate nucleus, and second order effector neurons in paraventricular and intermediolateral nuclei that express melanocortin receptors. Components of this system have individual genetic and epigenetic coding, with partial impact of environmental factors. Abnormal eating behaviour may be due to pathogenic variants of genes encoding key molecules of eating behaviour. Monogenic obesity is characterized by early-onset obesity – in some cases with insulin resistance and/ or neurodevelopmental delay.
Keywords:
obesity – energy balance – gut microbiome – eating behaviour – monogenic obesity – basal thermogenesis
Autoři: Lebl Jan 1; Malíková Křenek Jana 1; Hainerová Aldhoon Irena 2,3
Působiště autorů: Pediatrická klinika, 2. lékařská fakulta UK, a Fakultní nemocnice v Motole, Praha 1; Klinika dětí a dorostu, 3. lékařská fakulta UK, a Fakultní nemocnice Královské, Vinohrady, Praha 2; Pediatrická klinika, 1. lékařská fakulta UK, a Fakultní Thomayerova, nemocnice, Praha 3
Vyšlo v časopise: Čes-slov Pediat 2023; 78 (1): 48-53.
Kategorie: Epidemie dětské obezity
doi: https://doi.org/10.55095/CSPediatrie2023/009Souhrn
Energetická rovnováha a jídelní chování jsou řízeny leptino-melanokortinovým systémem, který zahrnuje aferentní signály z periferních tkání (leptin, ghrelin, inzulin, glykemie), integrační neurony prvního řádu v nucleus arcuatus a efektorové neurony druhého řádu s expresí melanokortinových receptorů v nuclei paraventriculares a intermediolaterales. Složky tohoto systému jsou individuálně geneticky a epigeneticky kódované. Energetická bilance je spoluovlivněna vnějším prostředím a chováním. Abnormální jídelní chování může být způsobeno patogenní variantou některého z genů, které kódují molekuly zodpovědné za jídelní chování. Pro monogenní obezitu je charakteristická časně nastupující obezita, v některých případech spolu s inzulinovou rezistencí a/nebo neurovývojovým opožděním.
Klíčová slova:
obezita – střevní mikrobiom – energetická rovnováha – jídelní chování – monogenní obezita – bazální termogeneze
Obezita je charakterizována nadměrným množstvím tělesného tuku, které vede k řadě zdravotních komplikací. Obezita je komplexní onemocnění vyvolané souhrou mezi genetickými, resp. epigenetickými faktory a působením vnějšího prostředí.(1)
Obezita není novým fenoménem. Obézní jedinci se vyskytovali ve všech historických dobách a ve všech lidských společenstvích (obr. 1). To nepřímo dokazuje, že obezita je objektivně podmíněný biologický jev, do značné míry nezávislý na vůli jedince.(2)
Obr. 1. A – Věstonická Venuše (výška 11,5 cm; cca 25 000 let př. n. l.).
B – Willendorfská Venuše (výška 10,7 cm; cca 26 000 let př. n. l.).
Oba tyto unikátní archeologické nálezy ze společného precivilizačního okruhu jižní Moravy a Dolních Rakous pocházejí z éry lovců-sběračů, tedy dříve, než se naši předkové usadili v zemědělských komunitách. V té době byla obezita zcela ojedinělým jevem, protože způsob života lovců-sběračů byl dokonalou ochranou před nadměrnou akumulací energie. I přes prvoplánovou interpretaci těchto sošek jako zpodobnění sexuálního symbolu či apoteózy mateřství se současná historická věda přiklání k hypotéze, že obézní jedinci se díky své výjimečnosti těšili mimořádné úctě a získávali božské atributy.(2) Podobné sošky obézních se nacházejí v dalších prehistorických osídleních, např. v prehistorických okrscích na Maltě a Gozu. Je také možné, že naši předkové si povšimli, že obézní jedinci mají lepší předpoklady přečkat období hladu a strádání, což dále posilovalo jejich božský status. Dnes můžeme jen spekulovat, zda obě prehistorické Venuše nesly patogenní varianty genů pro monogenně podmíněnou obezitu, které způsobují jídelní obsesi. Není pochyb, že obezita má silnou dědičnou složku. Tělesná hmotnost a další její atributy (např. distribuce tělesného tuku) je ze 40–70 % podmíněna dědičností.(3,4) Epidemie obezity posledních desetiletí, která se šíří ve všech částech světa a do značné míry postihuje i děti a dospívající, ale otevírá nové otázky: Změnily se naše geny? Jsou příčinou epidemie obezity jen vlivy prostředí? Proč i v éře epidemické obezity zůstávají někteří lidé štíhlí, zatímco jiní jsou extrémně obézní? Zavinil obezitu její nositel nebo u dítěte jeho rodiče? Máme obézního jedince kritizovat, nebo mu máme porozumět a pomoci?
V sérii textů na stránkách Česko-slovenské pediatrie budeme na tyto otázky hledat odpovědi. A spolu s tím budeme hledat cesty, jak epidemii obezity čelit a jak pomáhat jednotlivým pacientům.
Diferenciální diagnostika obezity
Některé formy obezity jsou způsobeny patogenními variantami (mutacemi) jednotlivých genů či abnormální genovou expresí (chromozomálním imprintingem). Odlišujeme syndromickou obezitu – závažnou, časně nastupující obezitu s vývojovým opožděním a/nebo dysmorfickými příznaky či smyslovými vadami. Nesyndromické monogenní formy obezity, které vznikají na základě patogenních genových variant zpravidla v leptino-melanokortinové dráze, nemají tak fenotypicky bohatý klinický obraz a vyznačují se časně vzniklou těžkou obezitou doprovázenou hyperfagií. U každého jedince s obezitou je nutné odlišit ostatní příčiny nárůstu tělesného hmotnosti. Základní diferenciálně diagnostická rozvaha je uvedena v tabulce 1.(1)
Tab. 1. Diferenciální diagnostika dětské obezity, upraveno dle(1) 
Epidemie obezity posledních několika desetiletí je způsobena obezitogenním zevním prostředím. Tomu se lze aktivně bránit, ale vyžaduje to cílevědomost, důslednost a nepřítomnost silných endogenních obezitogenních vloh.(3)
V medicíně je nejen neetické, ale i obsahově chybné dítě nebo jeho rodiče z obezity vinit nebo je za ni odsuzovat. Konkrétní jedinec může být nositelem patogenní varianty v genu MC4R nebo v jiném známém či dosud neznámém genu, který determinuje energetickou bilanci a předurčuje k obezitě. Přesto u laické i odborné veřejnosti přetrvává nesprávné hodnocení obezity jako zaviněné zdravotní komplikace, za kterou zodpovídá její nositel, v případě dítěte spolu s rodiči.
Regulace tělesné hmotnosti a množství tělesného tuku
Zdravé dítě se nepřejídá. Přiměřená tělesná hmotnost spolu s adekvátním obsahem tělesného tuku je zajištěna rovnováhou mezi příjmem a výdejem energie.
Příjem energie je dán kombinací objektivní dostupnosti stravy a individuálního jídelního chování.(5,6)
Na příjmu energie se podílí míra resorpce živin v gastrointestinálním traktu. Tu ovlivňuje mimo jiné individuální střevní mikrobiom. Výdej energie je součtem aktivního tělesného pohybu a bazální termogeneze (obr. 2).
Obr. 2. Schematické znázornění regulace tělesné hmotnosti a obsahu tělesného tuku s uvedením jednotlivých genů, jejichž varianty se v této regulaci nepochybně uplatňují (geny značeny kurzívou) 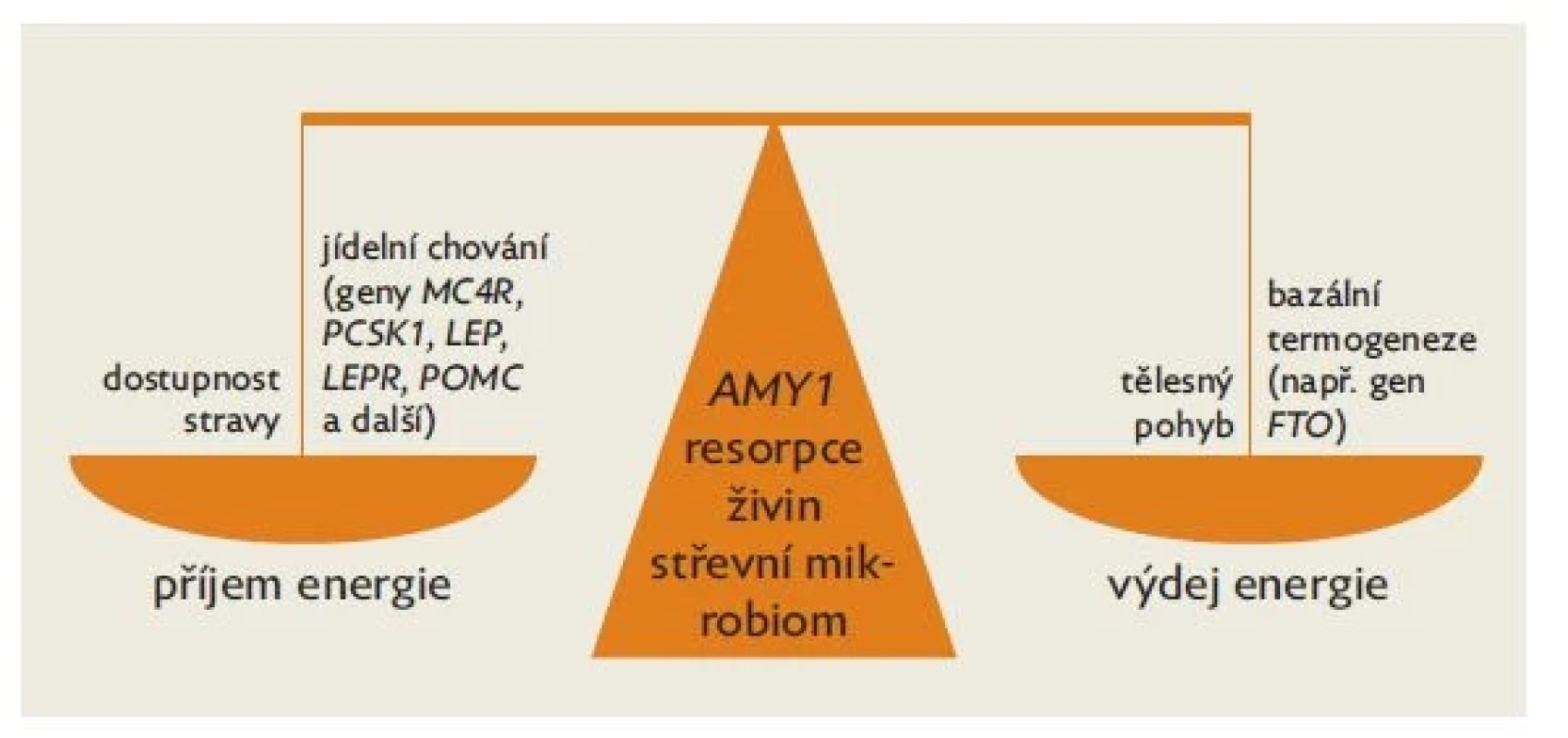
I když střevní mikrobiom a individuálně nastavená úroveň bazální termogeneze přispívají k regulaci tělesné hmotnosti, důležitým faktorem je nepochybně jídelní chování.
Člověk přijímá stravu nárazově, v porcích jídla – podobně jako většina savců. Celkový denní příjem energie tedy závisí na velikosti, četnosti a složení porcí jídla. Pocit hladu a chuť začít jíst jsou řízeny interakcí vrozených a získaných faktorů – genetických, humorálních, cirkadiánních, environmentálních a sociálních. Přirozené jídelní chování vychází ze vzájemného vyváženého působení centra hladu v laterálním hypotalamu a centra sytosti ve ventromediálním hypotalamu. Má dvě složky – „začít jíst“ (signál centra hladu) a „být nasycen a přestat jíst“ (signál centra sytosti).(5,7)
Aferentní signalizace: informace o stavu organismu
Jídelní chování je komplexní systém, pro jehož bližší poznání byl rozhodující objev leptinu v roce 1994. Leptin je secernován adipocyty v závislosti na jejich naplnění tukem. Zvýšená koncentrace leptinu v krvi signalizuje dostatečný obsah tuku v adipocytech, a snižuje tedy pocit hladu. Nízká koncentrace při nedostatečných tukových zásobách naopak pocit hladu vyvolá či posiluje.
Aplikace leptinu jak obézním myším s deficitem leptinu, tak i dětem s mutací genu pro leptin vede ke snížení chutě k jídlu a k úbytku tělesné hmotnosti.(8,9)
Po objevu leptinu následoval intenzivní výzkum řízení jídelního chování, který umožnil porozumět celému komplexnímu systému: neurony prvního řádu v nucleus arcuatus hypotalamu přijímají vstupní (aferentní) informace cestou signálů mechanických (distenze žaludku), neurogenních (nervus vagus a sympatický nervový systém) a humorálních.
Neurony prvního řádu mají především receptory pro leptin – přináší informaci o obsahu tuku v adipocytech; inzulin – informuje o glykemii; a ghrelin – informuje o náplni žaludku (obr. 3).
Obr. 3. Klíčové cesty hypotalamické regulace jídelního chování s vyznačenými aferentními signalizačními cestami k neuronům prvního řádu a s eferentními signalizačními cestami prostřednictvím neuronů druhého řádu. Cílem přirozené regulace jídelního chování je dosažení stavu sytosti, který umožňuje plynulý výdej energie – tedy udržení energetické rovnováhy. Tato regulace je u každého jedince nastavena individuálně. Upraveno volně dle(10) 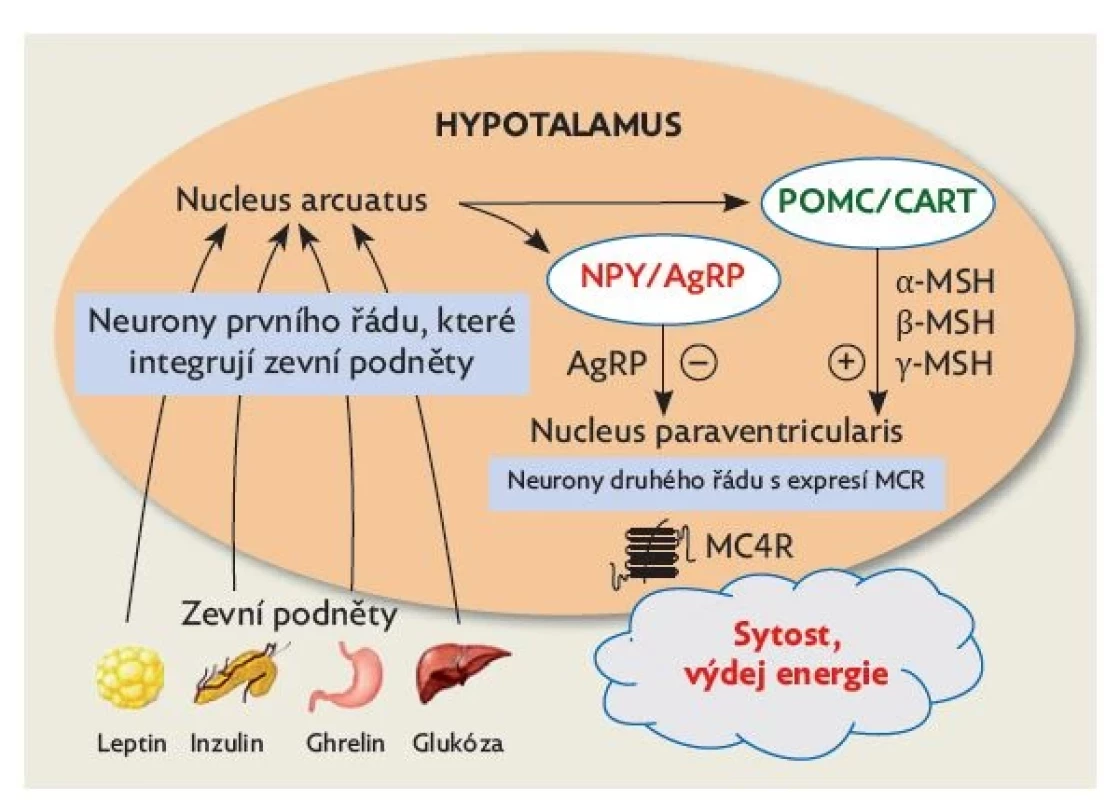
NPY – neuropeptid Y; AgRP – Agouti-related peptid; POMC – proopiomelanokortin; CART – cocaine- and amphetamine-regulated transcript; MSH – melanocyty stimulující hormon (melanokortin); MC4R – melanokortinový receptor 4. typu Další signály do hypotalamu přináší z tukové tkáně hormon adiponektin, z gastrointestinálního traktu cholecystokinin, obestatin, glukagon-like peptid 1, peptid YY a další. Metabolické signály pro hypotalamické neurony zahrnují glykemii, aminokyseliny, mastné kyseliny, laktát a ketolátky.
Centrální melanokortinový systém
Neurony prvního řádu v nucleus arcuatus hypotalamu integrují externí aferentní signály. Výslednou informaci předávají neuronům druhého řádu, které exprimují melanokortinové receptory 3. a 4. typu (viz obr. 3). Ty modifikují informace z nucleus arcuatus vlastní autoinhibiční a autoexcitační aktivitou s cílem regulovat energetickou rovnováhu.( 10)
Vlastním efektorovým systémem jsou neurony v nuclei paraventriculares (PVN) a intermediolaterales (IML), které stimulují či inhibují fyziologické funkce zapojené do energetické rovnováhy. Mezi ně patří bezprostřední příjem stravy a dlouhodobější strategie jídelního chování, kardiovaskulární funkce, metabolismus glukózy a cholesterolu, ale také výdej energie a bazální termogeneze.(11)
Eferentní signalizace: řízení jídelního chování
V eferentní signalizaci se preferenčně aktivuje jedna ze dvou skupin neuronů – orexigenní (stimulují chuť k jídlu) a anorexigenní (tlumí chuť k jídlu).
Po aktivaci anorexigenních neuronů se začne štěpit proopiomelanokortin (POMC) vlivem enzymu proprotein-konvertázy (PCSK1) na melanokortiny – jednotlivé formy melanostimulujícího hormonu (𝛂-MSH, 𝛃-MSH a 𝛄-MSH). Ty aktivují melanokortinové receptory 4. typu (MC4R). Konečným důsledkem je snížení příjmu potravy a zvýšení výdeje energie. Každý z přirozených ligandů tohoto systému (štěpné produkty proopiomelanokortinu ⍺-MSH, β-MSH a γ-MSH) má svůj vlastní profil signalizace a stimuluje specifické složky eferentní signalizační kaskády.(10)
Anorexigenní neurony regulují příjem stravy také pomocí CART (cocaine - and amphetamine-regulated transcript), v některých schématech se tato regulace označuje jako POMC/CART – tj. současná signalizace oběma cestami. Výdej CART se zvyšuje po jídle a tím tlumí příjem potravy. Zvyšuje se také při konzumaci chutných jídel a podílí se na navození příjemných pocitů z jídla. Zdá se, že CART je pojítkem mezi homeostatickou a hédonickou regulací příjmu potravy, protože zprostředkuje emoční odpověď na „odměnu“ – např. na dobré jídlo.
Orexigenní neurony signalizují pomocí neuropeptidu Y (NPY) a agouti-related proteinu (AgRP).
Díky komplexní aferentní signalizaci dokáže nucleus arcuatus koordinovat energetickou homeostázu i z dlouhodobého hlediska. To bylo fyziologicky významné v minulosti, kdy se střídala období dostatku potravy s jejím nedostatkem. V dnešní době tento mechanismus přispívá k selhávání redukčních diet – po snížení obsahu tělesného tuku následuje kompenzační fáze.
Negativní energetická bilance a ztráta tělesného tuku (ke které došlo po období sníženého příjmu potravy) snižuje zpětnovazebnou signalizaci (např. leptinem a inzulinem) a současně zvyšuje hladiny ghrelinu. To aktivuje neurony s produkcí NPY/AgRP (orexigenní osu) a inhibuje neurony produkující POMC (anorexigenní osu). Tato kombinace signálů vede k hyperfagii, pozitivní energetické bilanci a obnovení obsahu tělesného tuku. Stejné mechanismy působí u obézních i u štíhlých jedinců, o tělesné hmotnosti a obsahu tělesného tuku ale rozhoduje především geneticky podmíněné individuální nastavení cílového obsahu tělesného tuku.
Příčiny abnormálního jídelního chování
Abnormální jídelní chování při porušení aferentní nebo eferentní signalizace se projeví patologicky zvýšenou chutí k jídlu. Pacienti schopní svoje pocity verbalizovat uvádějí, že „nemohou zahnat hlad“. Chuť k jídlu je permanentní a klíčovou životní aktivitou od útlého dětství je úsilí získat jídlo. Při některých poruchách se vyskytuje „binge eating“ – nárazová konzumace neobvykle velkých dávek jídla.
Taková porucha jídelního chování může být vrozená nebo získaná. Vrozené poruchy způsobují patogenní varianty genů, které kódují klíčové molekuly aferentní nebo eferentní signalizace (tab. 2): genu pro leptin (LEP), pro leptinový receptor (LEPR), pro ghrelinový receptor (GHS-R1a),(12) pro proopiomelanokortin (POMC), pro štěpný enzym proprotein-konvertázu (PCSK1) a pro melanokortinový receptor 4. typu (MC4R).(7) Většina těchto poruch (monogenní formy obezity) je vzácná. Výjimkou jsou mutace MC4R.(13,14) Populační studie ukázaly, že z dětí s časně nastupující obezitou nebo z dospělých s BMI nad 40 kg/m2 má 5–10 % mutaci v genu MC4R ve stavu homozygotním (těžká nezvládnutelná obezita) nebo heterozygotním (obtížně zvládnutelná obezita, která výjimečně při vysoké permanentní sportovní zátěži může ustoupit do pásma pouhé nadváhy). Nositelé těchto mutací mají v průměru vyšší postavu a zvýšenou kostní denzitu.(15,16)
Tab. 2. Klíčové geny monogenní obezity: leptino-melanokortinová regulační kaskáda 
Postupně se objevují další geny, které se spolupodílejí na regulaci energetické rovnováhy, především na řízení jídelního chování (tab. 3). Každý z nově objevených genů přispívá k porozumění celému komplexnímu systému příjmu a výdeje energie.(17–21)
Tab. 3. Některé další geny monogenní obezity a mechanismy účinku jejich patogenních variant 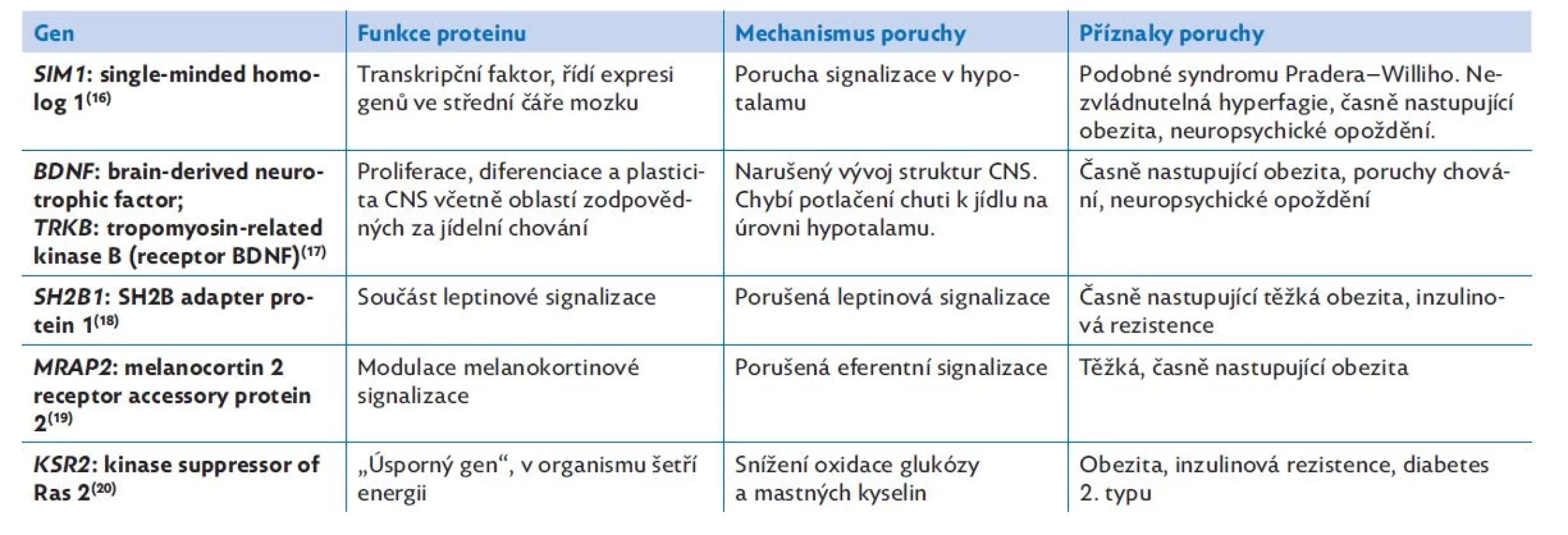
Podobné abnormální jídelní chování mají také pacienti se syndromem Pradera–Williho a příbuznými stavy, kteří mají také narušenou signalizaci sytosti.
Získaná porucha jídelního chování je charakteristická pro pacienty s poškozením středních struktur hypotalamu v důsledku tumoru v oblasti střední čáry (např. kraniofaryngeom), případně s tenzní cystou v této oblasti, a pro pacienty po neurochirurgických operačních výkonech, při kterých nebylo možné vyhnout se poškození ventromediálního hypotalamu. Psychogenní přejídání či zvýšení chuti k jídlu navozené psychofarmaky, kortikoidy či antiepileptiky je další obtížnou oblastí dětské obezitologie.
Klinické odlišení nositelů monogenních forem obezity je obtížné. Deficit leptinu prokážeme velmi nízkou koncentrací leptinu v séru, avšak vyšetření běžné laboratoře neprovádějí. Při defektu leptinového receptoru jsou naopak hladiny leptinu neobvykle vysoké, avšak hyperleptinemie je typická i pro běžné formy obezity. Fenotypický projev nositelů mutace POMC závisí na lokalizaci mutace. Může se projevit nedostatkem všech štěpných produktů proopiomelanokortinu – tedy nejen melanokortinů, ale také ACTH. Je porušeno vnímání sytosti v hypotalamu, pigmentace (nositelé poruchy POMC mají bledou kůži a rusé vlasy) a sekrece kortizolu (hypokortikalismus). Jsou známé případy náhlých úmrtí u jedinců s mutací POMC v důsledku akutní adrenální nedostatečnosti.
Při poruše proprotein-konvertázy vázne štěpení prohormonů na hormony: proprotein-konvertáza katalyzuje štěpení POMC na ACTH a melanokortiny, ale také některých jiných prohormonů – např. proinzulinu na inzulin a proglukagonu na glukagon. Klinicky se projeví malabsorpcí a průjmy, poruchou glukózové tolerance až diabetem v důsledku nízké hladiny inzulinu, hypogonadotropním hypogonadismem, centrální hypotyreózou, deficitem růstového hormonu a hypokortikalismem.
Jedinci s mutacemi MC4R, ač se jedná o nejběžnější formu monogenní obezity, představují klinicky chudou entitu, a to zejména u heterozygotních nositelů mutace. Homozygotní nositelé se vyznačují časným nástupem závažné obezity doprovázené hyperfagií. Diagnózu je možné ve všech případech potvrdit molekulárně-genetickou diagnostikou.
Střevní mikrobiom
Střevní mikrobiom není náhodnou směsicí bakterií a virů. Je samostatným orgánem integrovaným do lidského těla, který je složen ze stovek druhů mikroorganismů, je v trvalé interakci s ostatními tělesnými orgány a reguluje jejich metabolické funkce.
Mikrobiom je souborem všech mikroorganismů (bakterií, virů, plísní, hub, případně i prvoků) přítomných v lidském střevě. Mnohé studie ukázaly, že gastrointestinální mikrobiom může ovlivnit obě strany rovnice energetické bilance; jako faktor ovlivňující využití energie ze stravy a zároveň i jako faktor ovlivňující hostitelské geny regulující výdej a ukládání energie.(22)
Nízká diverzita bakterií ve stolici je spojena s výraznější celkovou adipozitou, zhoršenou homeostázou glukózy a s chronickým zánětem. Obézní jedinci mají vyšší zastoupení bakterií rodu Firmicutes a výrazně nižší zastoupení rodu Bacteroidetes než štíhlí jedinci. Studie srovnávající změny ve fekálním mikrobiomu během diet s odlišným kalorickým obsahem prokázaly, že změněná zátěž živinami vyvolala rychlé změny ve střevní bakteriální komunitě.(23)
Obézní mají jiné složení střevního mikrobiomu než štíhlí. Podle jedné z hypotéz někteří velmi výkonní mikrobi zdokonalí zpracování a trávení potravy a umožní získat více energie, což podpoří rozvoj obezity. Pro obézní je typické vyšší zastoupení bakterií, které produkují vodík, a současně bakterií, které tento vodík využívají k produkci metanu. To pomáhá natrávit rostlinné polysacharidy (vlákninu) a vstřebat jinak nestravitelné složky potravy.
Po žaludečním bypassu se mění střevní mikrobiom. Změna mikrobiomu tedy může být jedním z mechanismů, kterým bariatrické výkony přispívají k úbytku tělesné hmotnosti.
Běžné multialelické varianty počtu kopií genu AMY1 (amylase copy number regulator 1; kóduje slinnou amylázu), které vedou k rozdílné expresi genu a k odlišné hladině sérové amylázy, korelují s BMI.(24) Zajímavé je jak zjištění, že nositelé dvou extrémních variant genu mají osminásobně rozdílné riziko obezity, tak skutečnost, že se navzájem liší svým střevním mikrobiomem. Vliv amylázy na vstřebatelnost živin je tedy jednak přímý, jednak zprostředkovaný vlivem amylázy na střevní mikrobiom.
Bazální termogeneze
Energetickou rovnováhu ovlivňuje výdej energie ve formě tepla. Termogeneze probíhá nepřetržitě v hnědé tukové tkáni v adipocytech bohatých na mitochondrie a nárazově v bílé tukové tkáni. Termogenezi řídí nitrobuněčné mechanismy za přispění sympatického nervového systému (např. agonistů beta-adrenergních receptorů) v reakci na tělesný pohyb, stravu nebo chladné prostředí.
Při celogenomových asociačních studiích byla prokázána silná genetická vazba mezi BMI a genem FTO – běžnou genovou variantou rs1421085, která je v evropské populaci přítomna u 44 % osob a která zvyšuje BMI v průměru o 1,07 kg/ m2.(25) Nositelé obezitogenní (úsporné) varianty FTO mají větší objem adipocytů, které mají méně mitochondrií, sníženou mitochondriální oxidativní kapacitu a nižší termogenezi v reakci na beta-adrenergní stimuly nebo na působení chladu. To vede k hromadění triglyceridů a k vyšší tělesné hmotnosti. Obezitogenní varianta FTO totiž během časné diferenciace preadipocitů zvýšením exprese genů IRX3 a IRX5 způsobí preferenční diferenciaci do bílých adipocytů, které skladují energii. Tím klesne mitochondriální termogeneze o 80 %.
Je zřejmé, že v minulosti v dobách nutričního strádání byla tato úsporná varianta pro svého nositele výhodná a zvyšovala šanci na přežití, zatímco v současném obezitogenním prostředí působí nepříznivě.
Závěr
Tělesná hmotnost je významně geneticky determinována i ovlivněním jídelního chování, střevního mikrobiomu i bazální termogeneze. Interakce genetické výbavy s environmentálními faktory vytváří základ pro index tělesné hmotnosti i obsah tělesného tuku každého lidského jedince. Možnostmi léčebného zásahu do regulace jídelního chování se bude zabývat některý z příštích textů věnovaný epidemii dětské obezity a možnostem jejího řešení.
Korespondenční adresa:
prof. MUDr. Jan Lebl, CSc., FCMA
Pediatrická klinika 2. LF UK a FN Motol
V Úvalu 84
150 06 Praha
Zdroje
1. Poitou C, Mosbah H, Clément K. Mechanisms in endocrinology: Update on treatments for patients with genetic obesity. Eur J Endocrinol 2020; 183(5): R149–R166
2. McDermott L. Self-representation in upper paleolithic female figurines. Current Anthropology 1996; 37(2): 227–75.
3. Styne DM, Arslanian SA, Connor EL, et al. Pediatric obesity-assessment, treatment, and prevention: an endocrine society clinical practice guideline. J Clin Endocrinol Metab 2017; 102(3): 709–57.
4. El-Sayed Moustafa JS, Froguel P. From obesity genetics to the future of personalized obesity therapy. Nat Rev Endocrinol 2013; 9(7): 402–13.
5. Hainerová IA, Lebl J. Mechanisms of appetite regulation. J Pediatr Gastroenterol Nutr 2010; 51 Suppl 3: S123–4.
6. Geserick M, Vogel M, Gausche R, et al. Acceleration of BMI in early childhood and risk of sustained obesity. N Engl J Med 2018; 379 : 1303–12.
7. Farooqi IS, O’Rahilly S. Mutations in ligands and receptors of the leptin - -melanocortin pathway that lead to obesity. Nat Clin Pract Endocrinol Metab 2008; 4(10): 569–77.
8. Allison MB, Myers Jr MG. 20 years of leptin: connecting leptin signaling to biological function. J Endocrinol 2014; 223(1): T25–35.
9. Considine RV, Sinha MK, Heiman ML, et al. Serum immunoreactive-leptin concentrations in normal-weight and obese humans. N Engl J Med 1996; 334(5): 292–5.
10. Kühnen P, Krude H, Biebermann H. Melanocortin-4 receptor signalling: importance for weight regulation and obesity treatment. Trends Mol Med 2019; 25(2): 136–48.
11. Yang LK, Tao YX. Biased signaling at neural melanocortin receptors in regulation of energy homeostasis. Biochim Biophys Acta Mol Basis Dis 2017; 1863(10 Pt A): 2486–95.
12. Gjesing AP, Larsen LH, Torekov SS, et al. Family and population-based studies of variation within the ghrelin receptor locus in relation to measures of obesity. PLoS One 2010; 5(4): e10084.
13. Hainerová I, Larsen LH, Holst B, et al. Melanocortin 4 receptor mutations in obese Czech children: studies of prevalence, phenotype development, weight reduction response, and functional analysis. J Clin Endocrinol Metab 2007; 92(9): 3689–96.
14. Vollbach H, Brandt S, Lahr G, et al. Prevalence and phenotypic characterization of MC4R variants in a large pediatric cohort. Int J Obes 2017; 41(1): 13–22.
15. Hainerová IA, Lebl J. Treatment options for children with monogenic forms of obesity. World Rev Nutr Diet 2013; 106 : 105–12.
16. Farooqi IS, Keogh JM, Yeo GSH, et al. Clinical spectrum of obesity and mutations in the melanocortin 4 receptor gene. N Engl J Med 2003; 348(12): 1085–95.
17. Gonsalves R, Aleck K, Newbern D, et al. Severe early onset obesity and hypopituitarism in a child with a novel SIM1 gene mutation. Endocrinol Diabetes Metab Case Rep 2020; 2020 : 20-0042.
18. Podyma B, Parekh K, Güler AD, et al. Metabolic homeostasis via BDNF and its receptors. Trends Endocrinol Metab 2021; 32(7): 488–99.
19. Giannopoulou EZ, Zorn S, Schirmer M, et al. Genetic obesity in children: overview of possible diagnoses with a focus on SH2B1 deletion. Horm Res Paediatr 2022; 95(2): 137–48.
20. Berruien NNA, Smith CL. Emerging roles of melanocortin receptor accessory proteins (MRAP and MRAP2) in physiology and pathophysiology. Gene 2020; 757 : 144949.
21. Guo L, Costanzo-Garvey DL, Smith DR, et al. Kinase suppressor of Ras 2 (KSR2) expression in the brain regulates energy balance and glucose homeostasis. Mol Metab 2016; 6(2): 194–205.
22. Cho KY. Lifestyle modifications result in alterations in the gut microbiota in obese children. BMC Microbiol 2021; 21(1): 10.
23. Koutoukidis DA, Jebb SA, Zimmerman M, et al. The association of weight loss with changes in the gut microbiota diversity, composition, and intestinal permeability: a systematic review and meta-analysis. Gut Microbes 2022; 14(1): 2020068.
24. Barber TM, Bhatti AA, Elder PJD, et al. AMY1 gene copy number correlates with glucose absorption and visceral fat volume, but not with insulin resistance. J Clin Endocrinol Metab 2020; 105(10): dgaa473.
25. Claussnitzer M, Dankel SN, Kim KH, et al. FTO obesity variant circuitry and adipocyte browning in humans. Engl J Med 2015; 373(10): 895–907.
Štítky
Neonatologie Pediatrie Praktické lékařství pro děti a dorost
Článek vyšel v časopiseČesko-slovenská pediatrie
Nejčtenější tento týden
2023 Číslo 1- Horní limit denní dávky vitaminu D: Jaké množství je ještě bezpečné?
- Isoprinosin je bezpečný a účinný v léčbě pacientů s akutní respirační virovou infekcí
- Syndrom Noonanové: etiologie, diagnostika a terapie
-
Všechny články tohoto čísla
- Význam a interpretace poruch acidobazické rovnováhy
- František Kaván: Zimní krajina
- Tuberkulózní spondylitida neboli Pottova nemoc – relikt minulosti?
- Velmi neobvyklá příčina bolesti břicha
- Co jsme psali
- Akútna intoxikácia preparátom železa u 16-ročnej pacientky
- Neinvazivní monitoring vitálních funkcí u novorozence
- Role dětského podpůrného týmu v rozvoji nemocniční paliativní péče ve Fakultní nemocnici v Motole
- Pět let zkušeností s poskytováním nemocniční paliativní péče dětským pacientům
- Regulace energetické rovnováhy a jídelního chování
- Editorial
- Cena ministra zdravotnictví za zdravotnický výzkum a vývoj
- Pediatrická poezie
- Cyanotické srdeční vady
- Česko-slovenská pediatrie
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- Význam a interpretace poruch acidobazické rovnováhy
- Cyanotické srdeční vady
- Velmi neobvyklá příčina bolesti břicha
- Akútna intoxikácia preparátom železa u 16-ročnej pacientky
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání




