-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Akútna lymfoblastová leukémia
Acute lymphoblastic leukemia
Acute lymphoblastic leukemia (ALL) is the most common malignancy in children. The peak incidence is in 2–5 years old children. Each year there are about 65 new cases diagnosed in the Czech Republic and about 30 new cases of acute lymphoblastic leukemia in the Slovak Republic. Clinical picture is variable and reflects the degree of failure of the bone marrow and extramedullary organ involvement. The key diagnostic tests is cytomorphological examination of bone marrow aspirate. To determine the specific subtype of ALL immunophenotype and genotype of leukemia cells are neccessary. The primary treatment modality is chemotherapy, its intensity is given by the degree of risk of relapse and is carried out according to modern international protocols. The chances of long-term cure are currently about 80%. Despite great success in the treatment of ALL, there are still certain subtypes with very poor prognosis.
Key words:
acute lymphoblastic leukemia, clinical presentation, treatment, diagnosis, prognosis
Autoři: A. Kolenova
Působiště autorů: Klinika detskej hematológie a onkológie DFNsP a LFUK, Bratislava? prednostka doc. MUDr. A. Kolenová, PhD.
Vyšlo v časopise: Čes-slov Pediat 2015; 70 (2): 99-107.
Kategorie: Dětské akutní leukémie
Souhrn
Akútna lymfoblastová leukémia (ALL) je najčastejším malígnym ochorením u detí. Vrchol výskytu je u detí vo veku 2–5 rokov. V Českej republike sa diagnostikuje ročne približne 65 a v Slovenskej republike 30 nových prípadov akútnej lymfoblastovej leukémie. Klinický obraz ALL je variabilný a odzrkadľuje stupeň zlyhávania kostnej drene a postihnutie extramedulárnych orgánov. Základom pre stanovenie definitívnej diagnózy leukémie je cytomorfologické vyšetrenie aspirátu kostnej drene. Na zistenie presného podtypu je nevyhnutné vyšetrenie imunofenotypu a genotypu leukemických buniek. Kombinovaná chemoterapia je primárnou modalitou liečby, jej intenzita je podávaná podľa stupňa rizika relapsu a realizuje sa podľa moderných medzinárodných protokolov. Šanca dlhodobého vyliečenia pacientov je v súčasnosti približne 80 %. Napriek veľkým úspechom v liečbe ALL niektoré podtypy majú stále veľmi nepriaznivú prognózu.
Kľučové slová:
akútna lymfoblastová leukémia, klinický obraz, liečba, diagnostika, prognózaÚvod
Akútna lymfoblastová leukémia (ALL) je najčastejším malígnym ochorením u detí, predstavuje asi 25 % všetkých malígnych ochorení a 80 % všetkých detských leukémií u detí mladších ako 15 rokov [1]. Proporcionálne zastúpenie ALL sa mení s vekom. Ročná incidencia akútnej lymfoblastovej leukémie (ALL) dosahuje maximum 80–90 prípadov/milión vo veku 2–3 rokov, potom významne klesá u detí vo veku 5–6 rokov až na 20 prípadov/milión u 8 - až 11-ročných, a potom ďalej klesá asi na 10 prípadov//milión vo veku 20 rokov [2].
Vrchol výskytu je u detí vo veku 2–5 rokov. Medián veku nástupu ALL je 4,7 roka. Pomer chlapci a dievčatá je 1,3 : 1. Dojčatá do jedného roka tvoria 3–5 % detí s ALL, deti staršie ako 10 rokov predstavujú 30 % [3]. V Českej republike sa diagnostikuje ročne približne 65 a v Slovenskej republike 30 nových prípadov akútnej lymfoblastovej leukémie [4, 5].
História liečby detskej ALL reprezentuje jeden z naj-úspešnejších príbehov medicíny 20. storočia a patrí aj medzi najväčšie liečebné úspechy v hematológii a onkológii vôbec. Ešte na začiatku šesťdesiatych rokov minulého storočia bola šanca na vyliečenie dieťaťa s ALL prakticky nulová. V súčasnosti, v druhej dekáde 21. storočia, má dieťa, liečené na toto ochorenie podľa moderného liečebného protokolu, šancu na úplné vyliečenie približne 80 % [6].
Pod názvom ALL sa dnes nerozumie len jedno homogénne ochorenie, ale zahŕňa celú paletu relatívne presne definovaných podskupín podľa ich imunofenotypových a genotypových charakteristík. Tieto podskupiny sa v klinickom obraze líšia typickým vekom pri nástupe ochorenia, rôznou odpoveďou na cytostatickú liečbu a samozrejme sa odlišujú aj prognózou [7].
Klinický obraz ALL
A. Klinické príznaky
Klinický obraz ALL odzrkadľuje stupeň zlyhávania kostnej drene a postihnutie extramedulárnych orgánov. Úvod ochorenia môže byť variabilný a asi v 2/3 prípadov ide o náhly začiatok ochorenia a diagnóza je stanovená v priebehu 2–6 týždňov. Niekedy sú však prvé príznaky záludné a pretrvávajú týždne až mesiace [8].
Medzi úvodné nešpecifické príznaky patrí nechutenstvo, dráždivosť, letargia a pomerne častým príznakom (u 50–60 % pacientov) je horúčka. Horúčka vzniká indukovaním pyrogenných cytokínov uvoľňovaných z leukemických buniek. Ak sa začne špecifická liečba chemoterapiou, horúčka v priebehu 72 hodín odznieva. U časti pacientov je vzhľadom na neutropéniu a funkčnú poruchu neutrofilov zároveň prítomná aj infekcia a preto je v úvode plne indikovaná liečba širokospektrálnymi antibiotikami. Únava a letargia sú častým prejavom anémie. U viac ako 1/3 detí, a to najmä tých najmladších, sú prvými príznakmi: krívanie, odmietanie chôdze, bolesti kostí a/alebo kĺbov. Bolesti kostí vznikajú ako prejav leukemickej infiltrácie periostu kostí a/alebo v dôsledku rozpínania dreňovej dutiny leukemickými bunkami. U týchto deti bývajú veľmi často normálne hodnoty krvného obrazu, čo môže prispieť k oneskorenému stanoveniu diagnózy [1, 3, 9, 10].
Rôzny rozsah postihnutia extramedulárnych orgánov v úvode ochorenia prispieva k pestrosti klinického obrazu. Respiračné ťažkostí a syndróm hornej dutej žily sa objavujú pri tumore mediastína, najčastejšie pri T ALL. Bolesti hlavy ako následok infiltrácie CNS. Zvracanie, oligúria a anúria pri leukemickej infiltrácii obličiek alebo urátovej nefropatii. Zriedkavo sú pacienti úplne asymptomatickí a diagnóza je stanovená náhodne pri rutinnom vyšetrení [1].
Aj objektívne nálezy pri fyzikálnom vyšetrení môžu byť veľmi variabilné od normálneho až po závažný klinický stav. Medzi príznaky vyplývajúce z leukemickej infiltrácie kostnej drene a potlačenia normálnej krvotvorby patria: bledosť, petéchie a purpura. Hepatomegália alebo splenomegália sa vyskytujú u 60 % pacientov. Častá je aj lokalizovaná alebo generalizovaná lymfadenopatia (krčná, axilárna a inguinálna oblasť). Klasická leukemická trias: hepatosplenomegália, lymfadenomegália a krvácavá diatéza na koži sa vyskytuje asi u 1/3 pacientov [1, 9]. Anémia môže spôsobiť šelest, tachykardiu a zriedkavo až srdcové zlyhanie. Na očnom pozadí sa môže vyskytnúť exsudát leukemickej infiltrácie a zakrvácanie pri trombocytopénii. Občas môžu byť v dôsledku leukemickej infiltrácie uni - alebo bilaterálne nebolestivo zväčšené semenníky. Ako menej časté úvodné príznaky môžu byť subkutánne uzlíky (leukemia cutis), zväčšené slinné žľazy (Mikuliczov syndróm), ochrnutie nervov a nuchálna rigidita (leukemická infiltrácia kraniálnych nervov) [1, 3, 8]. Syndróm hornej dutej žily vzniká ako dôsledok tlaku mediastinálnej lymfadenopatie na hornú dutú žilu. Prekrvenie v oblasti žíl spôsobuje opuch krku. Tvár môže byť pletorická a periorbitálna oblasť opuchnutá. Zriedkavým, ale závažným príznakom je kompresia epidurálneho priestoru, ktorá ak nie je včas liečená chemoterapiou a vysokodávkovanou glukokortikoidnou liečbou, môže mať za následok trvalú paraparézu alebo paraplégiu. Vzhľadom na chemosenzitivitu leukémie v takomto prípade nie sú laminektómia ani rádioterapia všeobecne odporúčané. U niektorých pacientov je vykonaná chirurgická intervencia ešte pred tým, ako je ALL diagnostikovaná, ako napr. pri infiltrácii tonzíl, adenoidov, apendixu alebo mezenteriálnych lymfatických uzlín. U pacientov, najmä s T ALL, u ktorých je prítomná zároveň cerebelárna ataxia s alebo bez mentálnej alebo rastovej retardácie, by malo byť zistené, či sa nejedná o ataxiu-telangiektáziu. Včasné rozpoznanie ochorenia je dôležité, pretože títo pacienti mávajú závažné až fatálne komplikácie po rádioterapii (leukoencefalopatia) a cyklofosfamide (hemorhagická cystitída) [1].
B. Laboratórne vyšetrenia
Krvný obraz: V čase diagnózy býva obyčajne prítomná anémia, abnormálny počet leukocytov a zmenený ich diferenciálny rozpočet a trombocytopénia. Prítomnosť týchto zmien v krvnom obraze odráža stupeň infiltrácie kostnej drene lymfoblastami. U 95 % pacientov je pokles hodnôt aspoň v jednej bunkovej línii. Väčšina pacientov má pokles v dvoch líniách krvotvorby. U 50 % pacientov je počet leukocytov nízky alebo normálny (<= 10 000/µl), ale v diferenciálnom nátere je prítomná neutropénia (absolútny počet neutrofilov je <1000/µl) a malé percento blastov. U 30 % pacientov je počet leukocytov v rozmedzí 10 000–50 000/µl, u 20 % pacientov >50 000/µl a občas >300 000/µl. Blasty možno zvyčajne ľahko rozpoznať v periférnom krvnom nátere pacientov s leukocytózou. U časti pacientov (asi v 10 %) chýbajú cirkulujúce blasty v periférnom nátere. Väčšina pacientov s ALL má znížený počet trombocytov (menej ako 150 000/µl). Závažné krvácanie sa často nevyskytuje ani v prípade, keď je počet trombocytov menej ako 20 000/µl (v prípade ak nie je prítomná ani infekcia ani horúčka). Príležitostne sa vyskytne trombocytóza. Anémia je prítomná u 75 % pacientov, hemoglobín býva menej ako 11 g/dL. Anémia je normochrómna a normocytová a je sprevádzaná s normálnym alebo zníženým počtom retikulocytov. Asi 1 % pacientov má úplne normálny krvný obraz a periférny náter, ale bolesti kostí sú indikáciou na vyšetrenie kostnej drene. Častejšie u pacientov s T ALL môže byť prítomná mierna koagulopatia [1, 3, 8, 9].
Z biochemických parametrov býva zmenená najmä kyselina močová a laktát dehydrogenáza (LDH), v čase diagnózy sú ich hodnoty často zvýšené ako dôsledok spontánneho rozpadu buniek a zvýšeného purínového metabolizmu. Pacienti s masívnou infiltráciou obličiek majú zvýšené hladiny kreatinínu, urey a fosforu [1].
Zobrazovacie vyšetrenia: Na RTG snímke hrudníka sa môže, najmä v prípade T ALL, zistiť rozšírenie mediastína, alebo nádorová masa v prednom mediastíne a obštrukcia trachey ako dôsledok lymfadenopatie alebo infiltrácie týmusu. Sonografia brucha je zameraná na vyšetrenie pečene, sleziny, abdominálnej lymfadenopatie, leukemickej infiltrácie obličiek alebo urátovej nefropatie. Na RTG dlhých kostí a chrbtice môžu byť známky demineralizácie, línie zastavenia rastu alebo kompresie stavcov [2, 9].
C. Diferenciálna diagnostika
Na základe anamnézy a fyzikálneho vyšetrenia prichádzajú do úvahy infekcie spôsobené Epsteinovým-Barrovej vírusom (EBV) a cytomegalovírusom (CMV), ktoré spôsobujú lymfadenopatiu, hepatosplenomegáliu, horúčku a anémiu. Ak dominuje obraz krvácania do kože vo forme petéchií a purpury, je potrebné oddiferencovať imúnnu trombocytopenickú purpuru (ITP). Výrazná bledosť môže byť zapríčinená tranzientnou erytroblastémiou, autoimunitnou hemolytickou anémiou alebo aplastickou anémiou. Horúčka a bolesti kostí s hepatosplenomegáliou alebo bez nej môžu byť príznakom juvenilnej reumatoidnej artritídy. Diagnóza ALL je vysoko pravdepodobná, keď sa v krvnom obraze začína objavovať cytopénia viacerých línií a blasty v periférnom nátere. Leukocytóza s lymfocytózou je typická pre pertussis. V prípade pertussis sú lymfocyty zrelé a zriedkavo sa vyskytuje s neutropéniou. Tabuľka 1 sumarizuje ochorenie v rámci diferenciálnej diagnostiky.
Tab. 1. Diferenciálna diagnostika leukémií. 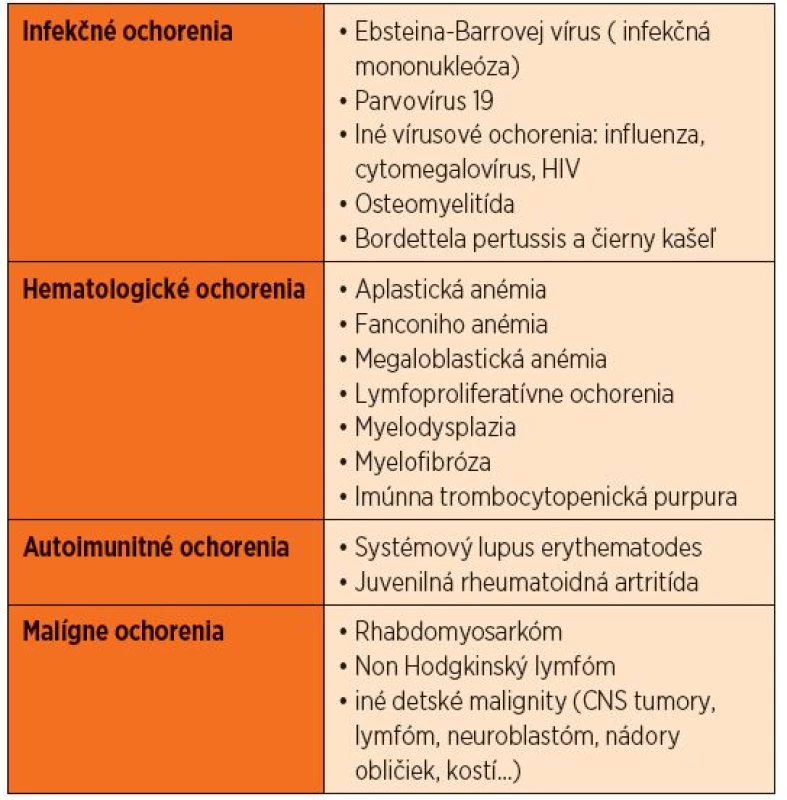
Diagnostika ALL
Prvým krokom pri podozrení na ALL je vyšetrenie krvného obrazu a mikroskopického diferencovaného rozpočtu leukocytov [9]. V prípade, že u pacienta vznikne podozrenie na ALL, je nutné komplexné vyšetrenie na špecializovanom pracovisku detskej hematológie a onkológie. Základom pre stanovenie definitívnej diagnózy leukémie je cytomorfologické a cytochemické vyšetrenie aspirátu kostnej drene. Na zistenie presného podtypu a stanovenie precíznej klasifikácie ALL je v súčasnosti nevyhnutné a zároveň kľúčové zrealizovať z aspirátu kostnej drene aj ďalšie podrobné vyšetrenia imunofenotypu a genotypu leukemických buniek [9, 11].
A. Vyšetrenia aspirátu kostnej drene
Vyšetrenie cytomorfologické: ALL je definovaná nálezom >= 25 % lymfoblastov v aspiráte kostnej drene [1, 8, 9]. Ak je v kostnej dreni menej ako 25 % blastov, najčastejšie ide o ne-hodgkinovský lymfóm alebo o pomaly vývoj leukémie. V takomto prípade je vhodné opakovať vyšetrenie kostnej drene s odstupom času, cca o 2 týž-dne. Klasická morfologická klasifikácia podľa French--American-British (FAB) rozlišuje ALL podtypy L1, L2, L3. Približne 70–80 % detí má ALL typ L1, 20–25 % typ L2 a len 1–2 % typ L3. Moderná klasifikácia a intenzívna liečba potlačila význam tohto prognostického faktora [1, 8, 9].
Vyšetrenie imunofenotypu: Vyšetrenie sa robí pomocou prietokovej cytometrie. Na základe vyšetrenia lymfocytárnych antigénov monoklonálnymi protilátkami sa imunofenotyp ALL zaradí k B alebo T lymfocytárnej bunkovej rade a určí sa štádium prekurzora, z ktorého pochádza leukemický klon [4]. Detská ALL najčastejšie vzniká v nezrelých prekurzoroch B lymfocytoch (80 %), menej často v zrelých T lymfocytoch (15 %), výnimočne v zrelých B lymfocytoch (2 %), alebo naopak vo veľmi nezrelých prekurzoroch krvotvorby pred vývojom do lymfatického radu, tzv. hybridná leukémia [1, 12, 13]. V súčasnosti ma okrem diagnostiky prietoková cytometria nezastupiteľný význam aj v monitorovaní minimálnej reziduálnej choroby vo včasnej fáze indukčnej liečby [14].
Vyšetrenie genotypu: Vyšetrenie sa robí pomocou konvenčnej cytogenetiky, FISH a metódami molekulovej genetiky. Cieľom vyšetrení je určiť karyotyp leukemického klonu a zistiť prítomnosť najčastejších fúznych génov charakteristických pre ALL. Chromozomálne klonálne zmeny sa nachádzajú pri 90 % detských ALL. Zmeny genotypu leukemickej bunky majú zásadný význam pre prognózu [1, 7, 15].
B. Komplexné vyšetrenie pacienta
V čase diagnózy ďalej komplexne hodnotíme a prešetrujeme celkový klinický stav pacienta a závažnosť infiltrácie a postihnutia ostatných orgánov. Zaujíma nás prítomnosť zväčšenia lymfatických uzlín, veľkosť pečene a sleziny, veľkosť mediastína, a u chlapcov infiltrácia testes [4, 8, 16]. K nevyhnutnej súčasti diagnostiky patrí aj vyšetrenie mozgovomiechovo moku na zistenie, či je prítomná leukemická infiltrácia CNS. Tradične je CNS leukémia definovaná prítomnosťou najmenej 5 leukocytov/µl v mozgovomiechovom moku a s prítomnosťou lymfoblastov vo vyšetrení z centrifugovanej vzorky, alebo prítomnosťou ochrnutia hlavových nervov.
Od roku 1993 sa používa nová klasifikácia na zhodnotenie leukemického postihnutia stavu CNS: 1. CNS status I znamená neprítomnosť blastov, 2. CNS status II je prítomnosť blastov vo vzorke, ktorá obsahuje menej ako 5 leukocytov /µl a CNS III status, pri jasnej infiltrácii CNS lymfoblastami [1].
Prognostické faktory a rizikové skupiny ALL
Princípy a stratégie modernej liečby sú založené na úvodnom zhodnotení rizika relapsu podľa prognostických faktorov. Liečba je následne prispôsobená podľa príslušného rizika, a tak je zabezpečené, že pacienti s ALL a najväčším rizikom relapsu dostávajú najagresívnejšiu liečbu a menej intenzívne režimy sú určené pre pacientov s nižším rizikom relapsu [17].
Všetky informácie o pacientovi (vek, úvodná leukocytóza), o jeho podtype leukémie (imunofenotyp a genotyp) a o tom, ako pacient a jeho leukémia odpovedajú na úvodnú liečbu, sa označujú ako rizikové faktory a podľa nich zaradíme pacienta do určitej rizikovej skupiny.
Odpoveď na liečbu sa hodnotí podľa redukcie blastov v periférnej krvi a v kostnej dreni, a to v troch časových bodoch v priebehu prvého mesiaca liečby (na 8. deň v periférnej krvi, na 15. a 33. deň v kostnej dreni) [4, 16].
Na základe vyhodnotenia uvedených prognostických faktorov je možné zaradiť pacientov do jednej z rizikových skupín [16, 17, 18].
- Skupina pacientov s najlepšou prognózou a nízkym rizikom relapsu zahŕňa deti vo veku od 1 do 6 rokov, s počtom leukocytov v úvode diagnózy menej ako 20 000/µl, bez prítomností nepriaznivého genotypu a s priaznivou odpoveďou na úvodnú liečbu.
- Skupina pacientov s tzv. strednou prognózou zahŕňa deti, ktoré sú staršie ako 6 rokov, alebo mali úvodne leukocytózu nad 20 000/µl, ale nemajú prítomný nepriaznivý genotyp a zároveň majú dobrú odpoveď na úvodnú liečbu.
- Skupina pacientov s nepriaznivou prognózou a vysokým rizikom relapsu zahŕňa pacientov so zlou odpoveďou na úvodnú liečbu a s nepriaznivým genotypom (ak je prítomná numerická odchýlka karyotypu – hypodiploidia alebo štrukturálne odchýlky karyotypu – translokácia BCR/ABL, MLL/AF4).
- Najhoršiu prognózu majú dojčatá, a to najmä tie, ktoré sú mladšie ako 6 mesiacov a majú úvodne prítomnú hyperleukocytózu a prestavbu MLL.
Liečba ALL
A. Špecifická liečba
Kombinovaná chemoterapia je primárnou modalitou liečby. Jej intenzitu ovplyvnilo poznanie, že ALL je heterogénna choroba, a že pacienti môžu byť rozdelení do rôznych rizikových skupín. Liečba pacientov s ALL trvá 2–3 roky, podáva sa perorálne, intravenózne (zvyčajne cez centrálne i.v. katétre: porth a cath, Hickman) a intratekálne. Väčšina detí s ALL sa lieči v rámci veľkých medzinárodných skupín a štúdií. Pacienti v Českej a Slovenskej republike sa už dlho liečia podľa nemeckých tzv. BFM protokolov (Berlin-Frankfurt-Münster). Tieto protokoly produkujú veľmi dobré výsledky liečby ALL a už dlhodobo patria k najlepším na svete [23, 25].
Stratégia liečby je vo všetkých moderných terapeutických skupinách podobná a rozdeľuje sa na štyri základne časti [1, 8, 9, 11]. Prvá časť sa označuje ako indukčná liečba a trvá 4 týždne. Jej cieľom je navodenie remisie a obnovenie funkcie kostnej drene. Na konci indukčnej liečby dosiahne remisiu 95–98 % pacientov. Lieky používané v čase indukcie sú: perorálny prednizón alebo dexametazón, intravenózne vinkristín, daunorubicín, l-asparagináza a intratekálne metotrexát. Druhá časť je konsolidačná liečba: podáva sa cytozín-arabinozid, 6-merkaptopurín, cyklofosfamid, vysokodávkovaný a intratekálny metotrexát. Cieľom liečby je konsolidácia leukémie a snaha „zabiť“lymfoblasty, ktoré sa schovávajú v meningoch [1, 11]. Deti s vysokým rizikom relapsu ALL absolvujú po ukončení indukčnej fázy vysoko intenzívnu chemoterapiu v tzv. blokoch s kortikoidmi, metotrexátom, cytozín arabinozidom, etopozidom, cyklofosfamidom, ifosfamidom, antracyklínom a tioguanínom [16]. Asi 6 mesiacov od stanovenia diagnózy nasleduje neskorá intenzifikácia alebo reindukcia. Je skrátenou verziou úvodnej indukcie a pridanie tejto časti do liečby ALL výrazne zlepšilo výsledky dlhodobého prežívania pacientov. Nakoniec sa počas 18 mesiacov podáva udržiavacia liečba. Cieľom udržiavacej liečby je ďalšia stabilizácia remisie ochorenia potlačením rezistentných klonov za kontinuálneho znižovania „poolu“ rezistentných buniek. Podáva sa perorálne kombinácia 6-merkaptopurínu denne a metotrexátu 1-krát týždenne. Dôležitou súčasťou počas celej liečby je aj intratekálne podávanie cytostatík na prevenciu a liečbu leukemickej infiltrácie mozgu. Pre časť pacientov (s T ALL a vysokým rizikom relapsu) sa pridáva aj ožarovanie neurokrania [1, 3, 8, 9, 16].
Transplantácia kostnej drene od HLA identického súrodeneckého alebo nepríbuzenského darcu je v súčasnosti vďaka úspešnosti liečby samotnou chemoterapiou indikovaná len zriedkavo v priebehu prvej línie liečby. Výnimkou sú pacienti s najvyšším rizikom zlyhania liečby, ktorí majú nepriaznivý genotyp a/alebo nepriaznivú odpoveď na liečbu, ktorá sa zisťuje citlivými metódami molekulárnej genetiky. Tento náročný liečebný zákrok stále sprevádza závažná morbidita a mortalita, najmä pre infekcie a chorobu štepu proti hostiteľovi.
Špecifické podskupiny ALL
Dojčenecká ALL je diagnostikovaná v priebehu prvých 12 mesiacov života a zastupuje asi 3–5 % detských ALL. Dojčenská ALL sa vyznačuje jedinečnými biologickými, klinickými a prognostickými znakmi, ktoré sa odlišujú od starších detí. Približne 80 % dojčiat má prítomnú cytogenetickú odchýlku – prestavbu génu mixed-lineage-leukemia (MLL) [19]. Prognóza pre túto skupinu pacientov zostáva aj napriek intenzívnej chemoterapii s vysoko dávkovaným metotrexátom a cytarabínom nepriaznivá. Pre dojčatá s ALL a prestavbou MLL je prežívanie bez udalosti (EFS) len medzi 30–40 % [19, 20]. Na podklade výsledkov a analýzy štúdie Interfant 99 sa demonštrovalo, že iba pacienti s vysoko rizikovými znakmi (MLL+, vek menej ako 6 mesiacov, hyperleukocytózou a s nepriaznivou odpoveďou na deň 8) profitovali z transplantácie kostnej drene v 1. remisii [19].
Philadelphia pozitívna ALL (PhALL) je historicky spojená s veľmi nepriaznivou prognózou, dokonca aj pri použití transplantácie kostnej drene. Nepriaznivá prognóza sa týkala najmä starších pacientov, s hyperleukocytózou alebo pomalou odpoveďou na indukčnú liečbu. Podľa výsledkov americkej štúdie z roku 2009 pridanie kontinuálneho podávania cielenej liečby, inhibítora tyrozín kinázy (imatinibu), k intenzívnej chemoterapii významne zmenilo prežívanie pacientov v porovnaní s historickou kontrolou [21]. Pacientom, ktorí boli liečení intenzívnou chemoterapiou a imatinibom, sa darilo tak dobre, ako tým, ktorí boli liečení chemoterapiou a transplantáciou [22]. V súčasnosti mnohí detskí onkológovia nechávajú transplantáciu rezervovanú pre pacientov s PhALL a relapsom ako druhú líniu liečby. Liečba pacientov sa robí podľa protokolu EsPhALL.
Relaps ALL
Relapsy ALL, ktoré vznikajú asi u 15 % pacientov, sú hlavným problémom, ktoré komplikujú ich liečbu [23, 24, 25]. Zdrojom relapsov sú zvyškové leukemické bunky, ktoré prežívajú po chemoterapii alebo po transplantačnej príprave. Približný celkový počet leukemických buniek v čase stanovenia diagnózy ALL predstavuje 1012 až 1013. Väčšina pacientov dosiahne kompletnú remisiu po 4 týždňoch indukčnej liečby. Kompletná remisia však neznamená, že sú leukemické bunky úplne eradikované z tela chorého pacienta, ale to, že hladina týchto leukemických buniek je pod hladinou citlivosti klasických cytomorfologických metód (tzn. 1–5 %). Prítomnosť týchto reziduálnych leukemických buniek u pacientov, ktorí sú inak v klinickej, hematologickej a väčšinou aj cytogenetickej remisii, označujeme ako minimálna reziduálna choroba [26].
Vďaka rozsiahlym štúdiám za ostatných 15 rokov sa zistilo, že sledovanie hladín minimálnej reziduálnej choroby pomocou molekulárne genetických metód má nezávislý význam pre prognózu pacienta a je možné do určitej miery znížiť výskyt relapsov [27]. Monitorovanie minimálnej reziduálnej choroby vysoko senzitívnymi molekulárnymi metódami je možné už niekoľko rokov pre pacientov s ALL v Českej a od roku 2013 už aj v Slovenskej republike v špičkovom laboratóriu pre výskum detských leukémií (CLIP – Childhood Leukaemia Investigation Prague pod vedením Prof. Jána Trku). Vďaka týmto metódam je možné precíznejšie stratifikovať pacientov do rizikových skupín, optimalizovať liečbu ALL a správne načasovať transplantáciu kostnej drene [2, 28, 29, 30].
Pre prognózu pacientov s relapsom je veľmi dôležitý čas od diagnózy a miesto vzniku relapsu. Relapsy, ktoré vznikajú veľmi skoro, v priebehu 18 mesiacov od stanovenia diagnózy, majú najhoršiu prognózu. Ako najpriaznivejšie sa označujú neskoré a izolované extramedulárne relapsy. CNS a testes sú extramedulárne miesta, kde sa „skrývajú“ leukemické blasty. Asi jedna tretina ALL relapsov je izolovaná a vzniká práve v týchto orgánoch [31]. Systémová liečba nepreniká dobre do týchto miest. Bez intratekálnej liečby by vznikalo viac relapsov v CNS. Väčšina CNS relapsov sa zistí u asymptomatických pa-cientov počas rutinného vyšetrovania likvoru. Príležitostne dôjde k rozvoju klinickej symptomatológie: bolesti hlavy, nauzea, zvracanie, podráždenosť, fotofóbia, stuhnutosť šije, obrna hlavových nervov. U menej ako 5 % chlapcov sa objavuje testikulárny relaps, zvyčaj-ne ako unilaterálne, bezbolestné zväčšenie semenní-kov [31].
Relaps ALL si vyžaduje novú liečbu vo väčšine prípadov spojenú s transplantáciou kostnej drene. V súčasnosti sa liečba podáva podľa moderného medzinárodného protokolu IntreALL [31].
B. Podporná liečba
Podávanie cytostatickej liečby nesie so sebou aj významné akútne a neskoré vedľajšie účinky. Je nutné, aby pacienti boli kontinuálne monitorovaní s cieľom predchádzať toxicite chemoterapie a zabrániť včasným a neskorým komplikáciám liečby.
Sydróm lýzy nádoru. Na začiatku liečby ALL je potrebné počítať s možným rozvojom akútneho syndrómu z rozpadu leukemických buniek. Štandardne sa zabezpečuje:
- udržiavanie dostatočnej diurézy intravenóznym podávaním tekutín,
- alkalinizácia bikarbonátom sodným, podávanie perorálneho alopurinolu,
- pri závažnom stupni rozvoja lýzy nádoru sa podáva razburikáza,
- monitorovanie sérových hladín draslíka, fosforu, kyseliny močovej a kreatinínu.
Hyperleukocytóza (viac ako 100 000/µl) je sprevádzaná hyperviskóznym syndrómom. Na rýchlu redukciu blastov sa môže urobiť leukaferéza alebo výmenná transfúzia, a tým sa zníži riziko trombózy alebo krvácania CNS.
Počas liečby musia byť všetky krvné transfúzne prípravky ožiarené ako prevencia vzniku choroby štepu proti hostiteľovi. Krvné produkty by mali byť aj deleukotizované, aby sa minimalizoval výskyt CMV infekcie a transfúznych reakcií. Vzhľadom na znížený stav imunity u pacientov v čase diagnózy a počas liečby hrozí rozvoj závažných až život ohrozujúcich vírusových, bakteriálnych a mykotických infekcií. Pri febrilnej neutropénii (horúčka nad 38,3 °C a absolútny počet neutrofilov menej ako 500/µl) je nutné neodkladné vyšetrenie klinického stavu pacienta, odobratie hemokultúr z každého lúmenu centrálneho venózneho katétra a rýchle nasa-denie širokospektrálnych antibiotík. V celom priebehu liečby pacienti dostávajú profylakticky trimetoprim-sulfametoxazol proti Pneumocystis jiroveci (v minulosti carinii) a profylaktickú liečbu antimykotikami. Pacienti musia po kontakte s varicelou dostať liečbu acyklovirom [1, 8, 9].
Prognóza
Pravdepodobnosť dlhodobého vyliečenia pacientov s ALL závisí od klinických, laboratórnych, biologických charakteristík a od odpovede na liečbu. Prežívanie detí s ALL bez udalosti (úmrtie, relaps) závisí od rizikovej skupiny a pohybuje sa v rozmedzí od 90 % pre pacientov v štandardnom riziku a klesá na 50 % pre pacientov vo veľmi vysokom riziku. Celkovo sa uvádza šanca na vyliečenie80 %. Až 98 % detí dosiahne remisiu, 1 % sú nonresponderi, 1–2 % zomierajú na komplikácie v indukcii, 2–3 % zomierajú na komplikácie v remisii, u asi 15 % detí vznikne relaps [23, 24, 25]. Napriek výraznému zlepšeniu prognózy v posledných desaťročiach samotné ochorenie a intenzívna liečba prinášajú so sebou mnoho akútnych komplikácií, ktoré si vyžadujú podpornú liečbu a po ukončení liečby aj monitorovanie neskorých následkov (tab. 2).
Tab. 2. Komplikácie liečby v čase stanovenia diagnózy, v priebehu liečby a po jej ukončení. 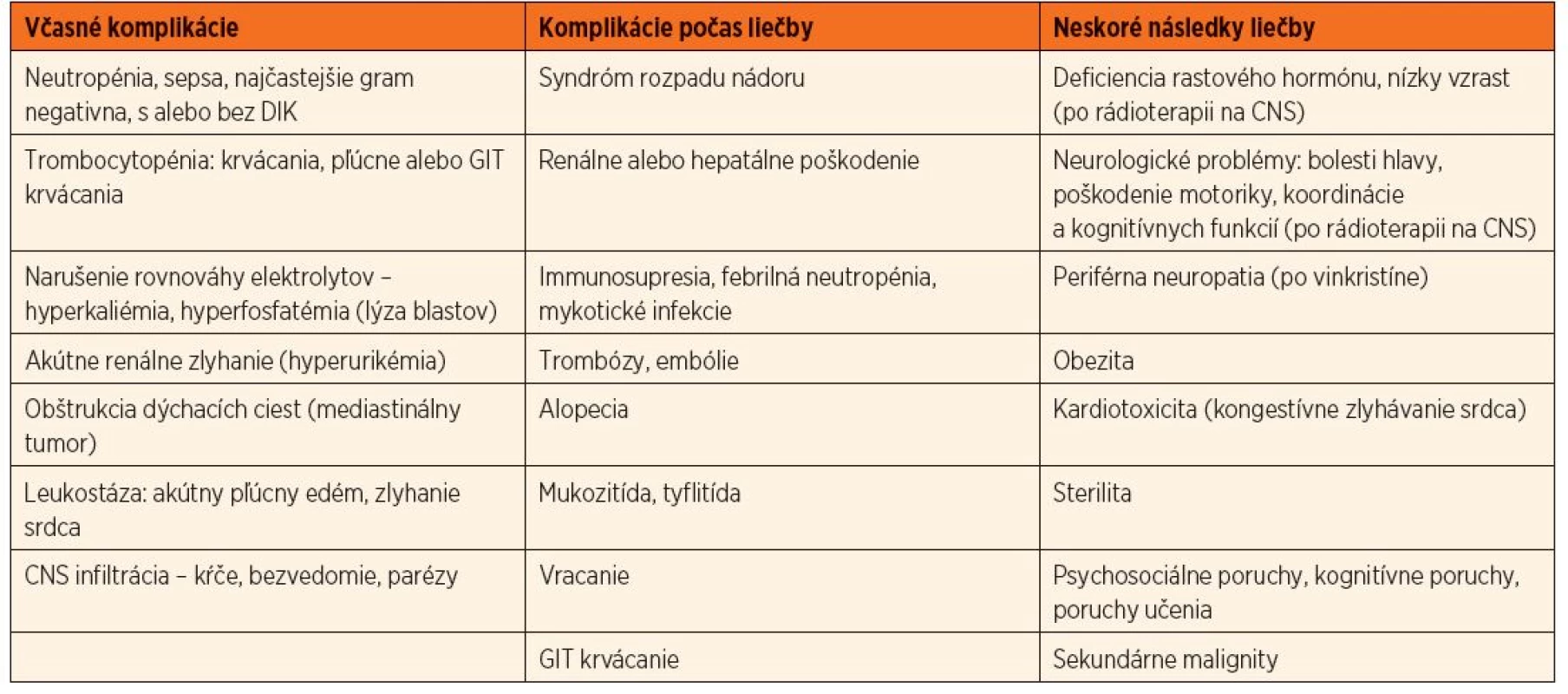
V období rokov 2002–2012 bolo v Slovenskej republike (Bratislava, Banská Bystrica a Košice) diagnostikovaných a liečených 280 pacientov. Pacienti (n = 140) v období 2002–2007 boli liečení v rámci medzinárodnej multicentrickej klinickej štúdie podľa medzinárodného protokolu ALL IC BFM 2002, kde bolo liečených viac ako 5000 pacientov z ďalších 14 krajín z 3 kontinentov. Táto štúdia bolo veľmi úspešne vedená tímom pána Prof. Jána Starého z Českej republiky a celkové výsledky boli uverejnené v prestížnom časopise Journal of Clinical Oncology, v januári 2014 [35].
Výsledky liečby pacientov v Slovenskej republike z obdobia 2002–2012 sú zobrazené na obrázku 1, kde je graficky vyhodnotené celkové prežívanie (OS) a prežívanie bez udalosti (EFS) v celom súbore, na obrázku 2 je celkové prežívanie podľa rizikových skupín. Ako udalosť sa označuje smrť v remisii alebo relaps. Na obrázku 3 je graficky zobrazené zlepšenie výsledkov liečby v Slovenskej republike v porovnaní s predchádzajúcim obdobím. Vyhodnotenie a kompletná analýza výsledkov liečby pacientov s ALL v Slovenskej republike bola prijatá do tlače časopisu Neoplasma.
Obr. 1. Vyhodnotenie celkových výsledkov liečby 280 pacientov s ALL v Slovenskej republike liečených podľa jednotného protokolu ALL IC BFM 2002. <i>OS : pravdepodobnosť celkového prežívania EFS: prežívanie bez udalosti</i> 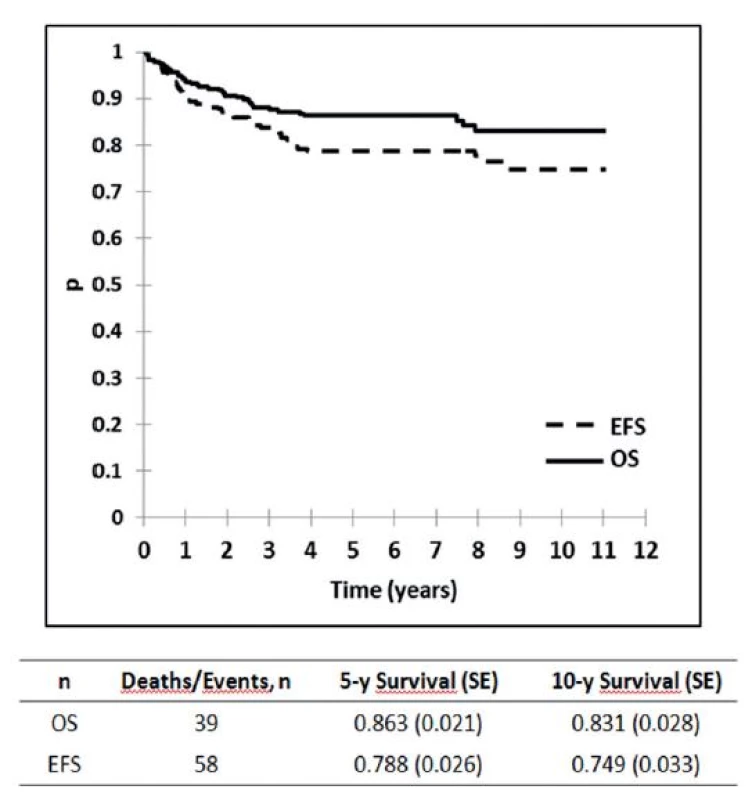
Obr. 2. Vyhodnotenie výsledkov liečby 280 pacientov s ALL podľa rizikových skupín v Slovenskej republike liečených podľa jednotného protokolu ALL IC BFM 2002. <i>pOS : pravdepodobnosť celkového prežívana, pEFS: prežívanie bez udalosti, SR: štandardné riziko, IR: stredné riziko, HR: vysoké riziko</i> 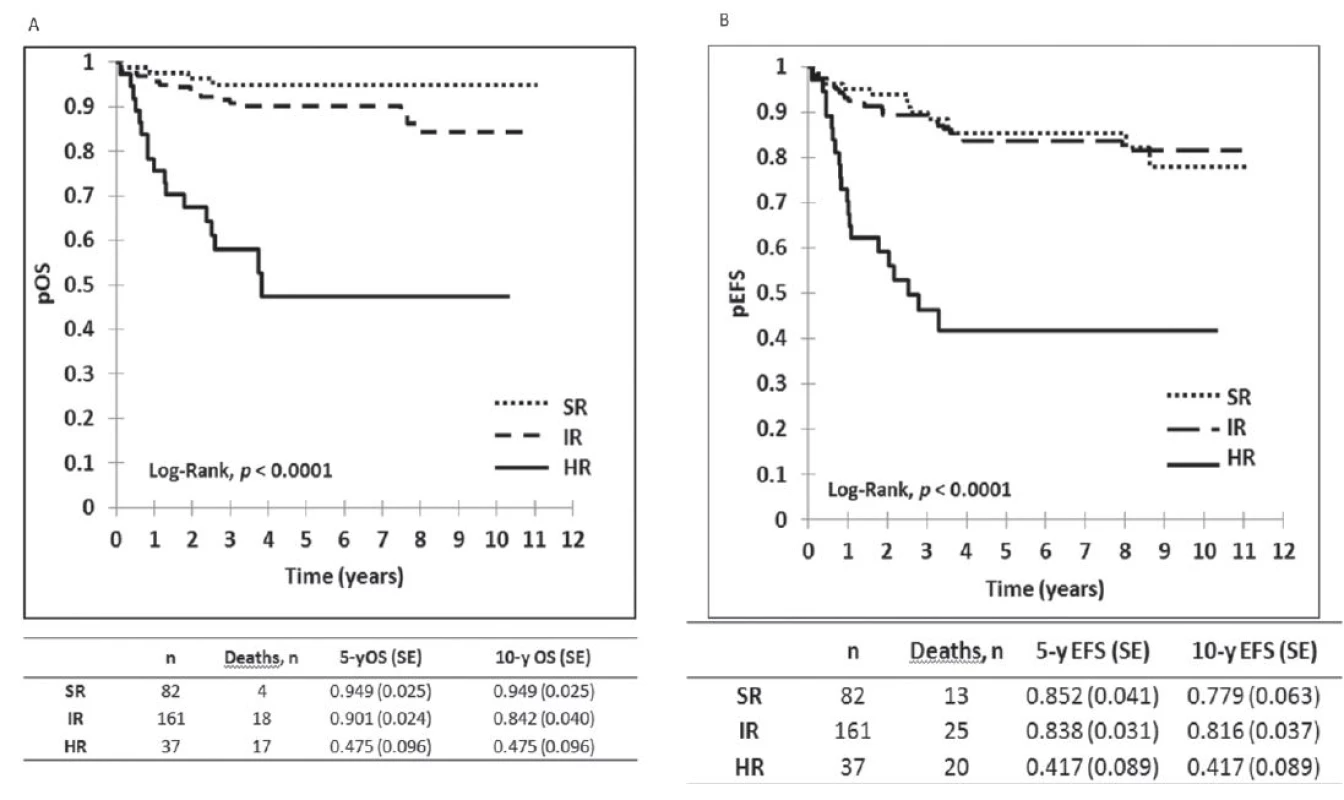
Obr. 3. Porovnanie výsledkov liečby detí s ALL liečených v Slovenskej republike v dvoch časových obdobiach: 2002–2012 podľa protokolu ALL IC BFM 2002 a v období od 1997 do 2001 podľa protokolu ALL BFM 1995. <i>pOS : pravdepodobnosť celkového prežívania, pEFS: prežívanie bez udalosti</i> 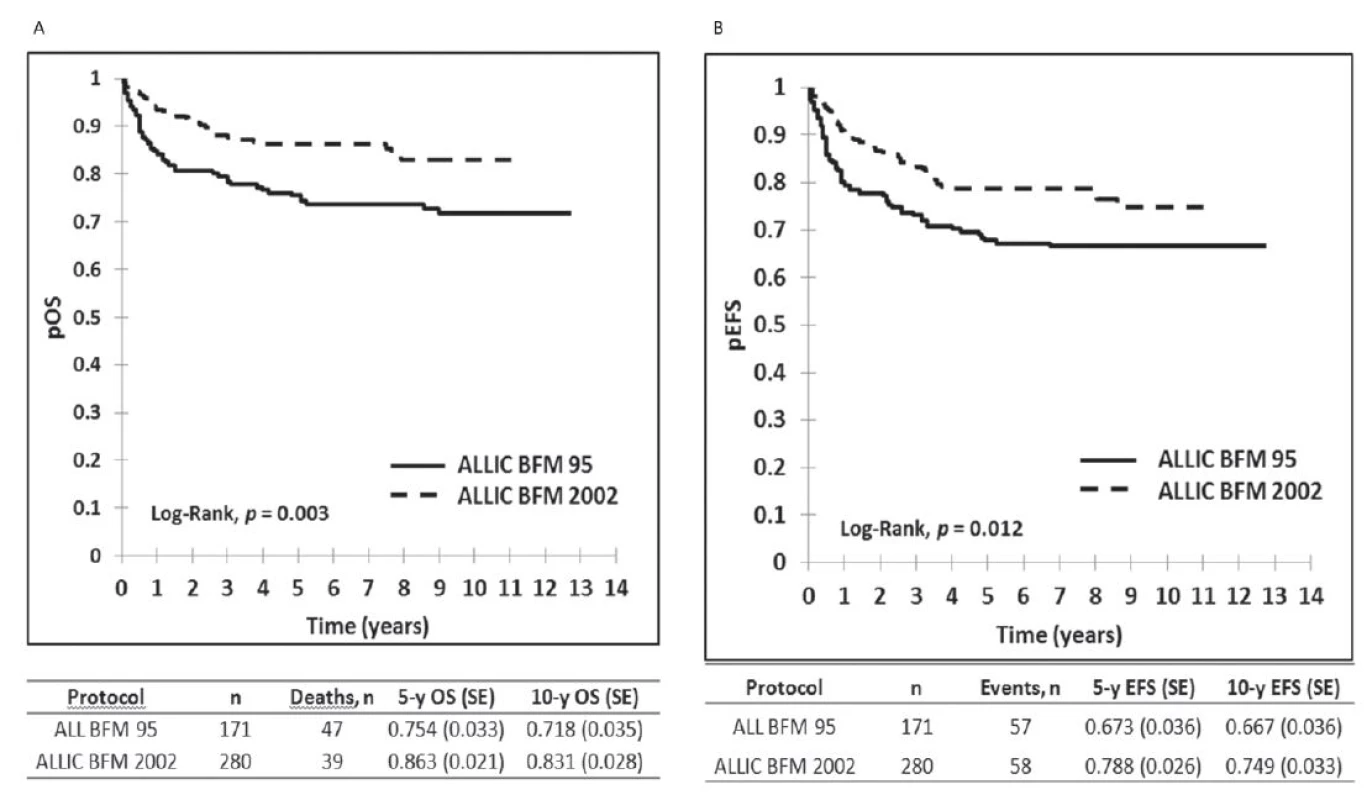
Nové perspektívy v liečbe ALL
Napriek veľkým úspechom v liečbe ALL niektoré podtypy majú stále veľmi nepriaznivú prognózu. Ďalšie zintenzívnenie doterajšej cytostatickej liečby by znamenalo vyššiu a závažnejšiu akútnu aj dlhodobú toxicitu a zrejme by ani neprinieslo zlepšenie celkových výsledkov. Pre skupinu s nízkym rizikom je naopak vhodné preskúmať bezpečné zníženie intenzity liečby. Štúdie neskorých následkov prinesú nový pohľad na toxicitu liečby. Genomika a proteo-nomika prináša nové poznatky o epidemiológii a patogenéze leukémie jednotlivých prípadov ALL, a to umožňuje cielený nový a personalizovaný prístup v liečbe [33, 36].
Na zlepšenie výsledkov ALL s vysokým rizikom je potrebné vytvoriť mechanizmy na včasné identifikovanie týchto pacientov, a to už v čase iniciálnej diagnózy a následne vyvinúť cielenú liečbu. Modelom tohto prístupu je práve detská Ph+ALL. V ére pred imatinibom boli výsledky extrémne nepriaznivé. Cielená liečba imatinibom v rokoch 2000–2006 znamená revolučný pokrok v liečbe ALL. Tieto výsledky podporujú hypotézu, že správne aplikovaná cielená liečba môže priniesť ďalšie dramatické zlepšenie výsledkov liečby ALL s t.č. nepriaznivou prognózou [36]. Jedným z príkladov molekulového terča sú inhibítory rodiny Jánusových kináz, ktoré sú v súčasnosti testované (napr. ruxolitinib) v pediatrických štúdiach pri malignitách s CRLF2 a JAK zmenami. Ďalším príkladom klinického testovania je lestaurtinib pre relaps dojčeneckej ALL s MLL prestavbou (štúdia AALL0631) a bortezomib (AALL07P1) pre relaps ALL [7, 36].
Jeden z veľmi nádejných prístupov v liečbe ALL predstavuje imunoterapia. Lymfoblasty na svojom povrchu exprimujú lymfocytárne antigény, ktoré predstavujú vhodné ciele pre monoklonálne protiláky. Medzi znaky vhodného antigénu ako terapeutické ciele patria: vysoké percento blastov s daným antigénom, vysoká hustota expresie antigénu a neprítomnosť antigénu v zdravých bunkách. Až v 85 % prípadov ALL je zastúpený B-imunofenotyp, a až v 90 % B lymfoblasty exprimuje antigén CD19 a CD22, ktoré sú predmetom záujmu liečebnej stratégie [37]. V súčasnosti prebiehajú klinické skúšky nových liekov (monoklonálne protilátky a tzv. CARs – chimeric antigen receptors T cells). Niektoré z nich sa v budúcnosti môžu ukázať ako účinné v liečbe ALL s nepriaznivou prognózou alebo pri relapsoch ALL [38].
Záver
Detská ALL patrí medzi život ohrozujúce ochorenia a k diagnostike, liečbe a sledovaniu je nutné optimálne vybavenie pracoviska a skúsený zdravotnícky personál. K takému vybaveniu nevyhnutne patrí okrem diagnostiky pomocou cytomorfológie aj kvalitná imunofenotypizácia so širokým panelom protilátok a predovšetkým cytogenetika a metódy molekulovej genetiky. Optimálna liečba podľa moderných protokolov vyžaduje dostupnosť potrebnej antileukemickej a podpornej liečby. Vzhľadom na intenzívnosť liečby je nevyhnutná dostupnosť intenzívnej pediatrickej starostlivosti. Dôležitý je manažment sledovania kvality života prežívajúcich a neskorých následkov liečby.
Veľmi dôležité je podať rodičom a pacientom dôkladné a reálne informácie. Uistiť ich, aby porozumeli tomu, že príčina ochorenia vo väčšine prípadov nie je známa. Je ďalej dôležité, aby pochopili, že liečba musí prebiehať v špecializovanom detskom onkologickom centre, a že zatiaľ nebola dokázaná účinnosť žiadnej inej alternatívnej liečby. Liečba leukémie je beh na dlhú trať, pre deti a rodičov je dôležité vedieť a dôverovať, že sú liečení na optimálne vybavenom pracovisku a tým najlepším spôsobom, ako je v súčasnosti možné. A tiež je podstatné, aby cítili podporu a sprevádzanie zo strany skúseného zdravotníckeho personálu.
Pre ďalšie zlepšenie prognózy detí s leukémiou je nevyhnutné hlbšie pochopenie patogenézy ochorenia a etablovanie nových poznatkov z oblasti molekulovo genetického výskumu do klinickej praxe. Najnovšie pokroky v technikách na skríning genómu, farmakogenetické štúdie a vývoj nových cieľových liekov sú predzvesťou novej éry s jemnou personalizovanou liečbou.
Doc. MUDr. Alexandra Kolenová, PhD.
Klinika detskej hematológie a onkológie
DFNsP a LFUK
Limbová 1
833 40 Bratislava
Slovenská republika
e-mail: sasa.kolenova@gmail.com
Zdroje
1. Pui CH. Acute lymphoblastic leukemia. In: Pui Ch, et al. Childhood Leukemias. Cambridge University Press, 2012 : 332–366.
2. Maloney KW, Giller R, Hunger SP. Recent advances in the understanding and treatment of pediatric leukemias.. Adv Pediatr 2012; 59 (1): 329–358.
3. Kaiserová E. Malígne choroby krvi. In: Šašinka M, Šagát T, et al. Pediatria I. zväzok. 2. vyd. Košice: Satus, 2006 : 723–732.
4. Trka J, Sramkova L. http://zdravi.e15.cz/clanek/postgradualni-medicina/akutni-lymfoblasticka-leukemie-v-detskem-veku-163562.
5. Kaiserová E, Bubánska E, Oravkinová I, et al. Results of acute lympho-blastic leukemia treatment in children in the Slovak Republic. Memo 2011; 4 (3): 190–195.
6. Pui CH, Carroll WL, et al. Biology, risk stratification, and therapy of pediatric acute leukemias: An Update, 2011. J Clin Oncol 2011; 29 (5): 551–565.
7. Inaba H, Greaves M, Mullighan CG. Acute lymphoblastic leukaemia. Lancet 2013; 381 (9881): 1943–1955.
8. Schrappe M. Akute Lymphoblastische Leukämien. In: Gadner H. Pädiatrische Hämatologie und Onkologie. Germany, Heidelberg: Springer Medizin Verlag, 2006 : 656–676.
9. Starý J. Akutní lymfoblastická leukemie v dětském věku. In: Mayer J, Starý J. Leukemie. Praha: Grada, 2002 : 279–297.
10. Šrámková L, Kynčl M, Smíšek P, et al. Bolest kostí a kloubů – častý příznak akutní lymfoblastické leukémie v dětském věku. Čes-slov Pediat 2002; 57 : 232–235.
11. Pieters R, Carroll WL. Biology and treatment of acute lymphoblastic leukemia. Hematol Oncol Clin North Am 2010; 24 (1): 1–18.
12. Mejstříková E, Froňková E, Kalina T, et al. Detection of residual B precursor lymphoblastic leukemia by uniform gating flow cytometry. Pediatr Blood Cancer 2010; 54 (1): 62–70.
13. Babušíková O, Števulová L, Fajtová M. Immunophenotyping parameters as prognostic factors in T-acute leukemia patients. Neoplasma 2009; 56 (6): 508–513.
14. Campana D. Minimal residual disease in acute lymphoblastic leukemia. Semin Hematol 2009, 46 (1): 100–106.
15. Mullighan CG. Genomic profiling of B progenitor acute lymphoblastic leukemia. Best Practice & Research Clinical Haematology 2011; 24 : 489–503.
16. Starý J, et al. ALL IC BFM 2002 – a randomized trial of the I-BFM-SG for the managment of childhood non-B acute lymphoblastic leukemia. Final version of therapy protocol from May 3, 2002.
17. Stanulla M, Schrappe M. Treatment of childhood acute lymphoblastic leukemia. Semin Hematol 2009; 46 (1): 52–63.
18. Nachman JB, Heerema NA, et al. Outcome of treatment in children with hypodiploid acute lymphoblastic leukemia. Blood 2007; 110 (4): 1112–1115.
19. Mann G, Attarbaschi A, Schrappe M, et al. Improved outcome with hematopoietic stem cell transplantation in a poor prognostic subgroup of infants with mixed-lineage-leukemia (MLL) – rearranged acute lymphoblastic leukemia: results from the Interfant-99 Study. Blood 2010; 116 (15): 2644–2650.
20. Brown P. Treatment of infant leukemias: challenge and promise. Hematology Am Soc Hematol Educ Program 2013; 2013 (1): 131–137. doi: 10.1182/asheducation-2013.1.131.
21. Schrappe M, Valsecchi MG, Bartram CR, et al. Late MRD response determines relapse risk overall and in subsets of childhood T-cell ALL: results of the AIEOP-BFM-ALL 2000 study. Blood 2011; 118 (8): 2077–2084.
22. Biondi A, Scrappe M, De Lorenczo P, et al. Imatinib after induction for treatment of children and adolescents with Philadelphia-chromosome-positive acute lymphoblastic leukaemia (EsPhALL): a randomised, open-label, intergroup study. Lancet Oncol 2012; 13 (9): 936–945.
23. Möricke A, Zimmermann M, Reiter A, et al. Long-term results of five consecutive trials in childhood acute lymphoblastic leukemia performed by the ALL-BFM study group from 1981 to 2000. Leukemia 2010; 24 (2): 265–284.
24. Salzer WL, Devidas M, Carroll WL, et al. Long-term results of the pediatric oncology group studies for childhood acute lymphoblastic leukemia 1984–2001: A report from the Children‘s Oncology Group. Leukemia 2010; 24 : 355–370.
25. Conter V, Aricò M, Basso G, et al. Long-term results of the Italian Association of Pediatric Hematology and Oncology (AIEOP) Studies 82, 87, 88, 91 and 95 for childhood acute lymphoblastic leukemia. Leukemia 2010; 24 (2): 255–264.
26. Haškovec C, Trka J. Molekulárni genetika, s. 100. In: Mayer J, a kol. Leukemie. 1. vyd. Praha: Grada Publishing, 2002 : 1–357,
27. Flohr T, Schrauder A, Cazzaniga G, et al. Minimal residual disease-directed risk stratification using real-time quantitative PCR analysis of immunoglobulin and T-cell receptor gene rearrangements in the international multicenter trial AIEOP-BFM ALL 2000 for childhood acute lymphoblastic leukemia. Leukemia 2008; 22 (4): 771–782.
28. Sramkova L, Muzikova K, Fronkova E, et al. Detectable minimal residual disease before allogeneic hematopoietic stem cell transplantation predicts extremely poor prognosis in children with acute lymphoblastic leukemia. Pediatr Blood Cancer 2007; 48 (1): 93–100.
29. Fronkova E, Mejstrikova E, Avigad S, et al. Minimal residual disease (MRD) analysis in the non-MRD-based ALL IC-BFM 2002 protocol for childhood ALL: is it possible to avoid MRD testing? Leukemia 2008; 22 (5): 989–997.
30. Schrappe M, Valsecchi MG, Bartram CR, et al. Late MRD response determines relapse risk overall and in subsets of childhood T-cell ALL: results of the AIEOP-BFM-ALL 2000 study. Blood 2011; 118 (8): 2077–2084.
31. Henze G, von Stackelberg A. Relapsed acute lymphoblastic leukemia. In: Pui Ch, et al. Childhood Leukemias. Cambridge University Press, 2012 : 367–382.
32. Jeha S, Pui Ch. Risk-adapted treatment of pediatric acute lympho - blastic leukemia. Hematol Oncol Clin North Am 2009; 23 (5): 973–990.
33. Hunger SP. Expanding clinical trial networks in pediatric acute lymphoblastic leukemia. J Clin Oncol 2014; 32 (3):169–170.
34. Schrappe M, Nachman J, Masera G, et al. Educational symposium on long-term results of large prospective clinical trials for childhood acute lymphoblastic leukemia (1985–2000). Leukemia 2010; 24 (2): 253–254.
35. Stary J, Zimmermann M, Campbell M, et al. Intensive chemotherapy for childhood acute lymphoblastic leukemia: results of the randomized intercontinental trial ALL IC-BFM 2002. J Clin Oncol 2014; 32 (3): 174–184.
36. Hunger SP, Raetz EA, Loh ML, et al. Improving outcomes for high-risk ALL: translating new discoveries into clinical care. Pediatr Blood Cancer 2011; 56 (6): 984–993.
37. Advani SA. New immune strategies for the treatment of acute lymphoblastic leukemia: antibodies and chimeric antigen receptors. Hematology 2013; 131–137.
38. Hoelzer D. Targeted therapy with monoclonal antibodies in acute lymphoblastic leukemia. Curr Opin Oncol 2013; 25 (6): 701–706.
Štítky
Neonatologie Pediatrie Praktické lékařství pro děti a dorost
Článek vyšel v časopiseČesko-slovenská pediatrie
Nejčtenější tento týden
2015 Číslo 2- Horní limit denní dávky vitaminu D: Jaké množství je ještě bezpečné?
- Isoprinosin je bezpečný a účinný v léčbě pacientů s akutní respirační virovou infekcí
- Syndrom Noonanové: etiologie, diagnostika a terapie
-
Všechny články tohoto čísla
- Akutní myeloidní leukémie v dětském věku
- Transplantace kmenových buněk krvetvorby v terapii akutní lymfoblastické leukémie dětského věku
-
Pavel Kabíček, Jana Hamanová, Ladislav Csémy a kolektiv:
Rizikové chování v dospívání a jeho vztah ke zdraví - Dětské akutní leukémie – Editorial
- Leukémie u dětí ve 21. století
- Etiologie dětských ALL a AML, molekulární genetika a minimální reziduální nemoc
- Imunofenotypizace a jiné využití průtokové cytometrie u akutních leukémií
- Cytogenetika akútnych leukémií u detí
- Akútna lymfoblastová leukémia
- Česko-slovenská pediatrie
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- Akutní myeloidní leukémie v dětském věku
- Akútna lymfoblastová leukémia
- Leukémie u dětí ve 21. století
- Imunofenotypizace a jiné využití průtokové cytometrie u akutních leukémií
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



