-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Vitamín D – nový pohľad na starý vitamín
Vitamin D – an Old Vitamin from a New Perspective
Vitamin D is an essential hormone with a substantial antirachitic effect. In addition to its important role in the homeostasis of calcium and phosphorus, over the last years many physicians have also been focusing on the noncalcemic actions of vitamin D (immunomodulatory, antiproliferative, effect on the blood pressure regulation, etc.). In a review article, the authors summarise the latest information on the physiological effect of vitamin D and its relation to autoimmune and civilization diseases.
The authors point out the significance of 25-hydroxyvitamin D determination in a serum which serves as a “barometer” of vitamin D reserves in the body in order to achieve the optimal supplementation. They re-evaluate the current recommendation in the prevention of vitamin D deficiency and present practical instructions to be used in serving cholecalciferol in 600-800 IU/day dosage from the second week to the third year of a child. An adequate intake of calcium is a part of the hypovitaminosis D prevention.Key words:
vitamin D, calcium homeostasis, noncalcemic actions of vitamin D, vitamin D deficiency, calcidiol, calcitriol, vitamin D requirements, infants, children, adolescents
Autoři: J. Ferenczová; Ľ. Podracká
Působiště autorů: I. Klinika detí a dorastu LF UPJŠ, Košice prednostka prof. MUDr. Ľ. Podracká, CSc.
Vyšlo v časopise: Čes-slov Pediat 2009; 64 (7-8): 344-351.
Kategorie: Přehledový článek
Souhrn
Vitamín D je esenciálny hormón s výrazným antirachitickým účinkom. Okrem jeho dôležitej úlohy v homeostáze vápnika a fosforu sa v ostatných rokoch záujem klinikov sústreďuje aj na nonkalciemické účinky vitamínu D (imunomodulačný, antiproliferatívny, účinok na reguláciu tlaku krvi atď.).
Autori v prehľadnom článku sumarizujú novšie poznatky o fyziologickom účinku vitamínu D a jeho vzťahu k autoimunitným a civilizačným chorobám. Poukazujú na význam stanovenia 25-hydroxyvitamínu D v sére, ktorý slúži ako „barometer“ stavu zásob vitamínu D v organizme na dosiahnutie optimálnej suplementácie. Prehodnocujú doterajšiu prax pri prevencii vitamínu D a uvádzajú praktické návody, podľa ktorých sa odporúča podávať cholekalciferol v dávke 600–800 IU denne od 2. týždňa až do 3. roku života dieťaťa. Súčasťou prevencie hypovitaminózy D je adekvátny príjem vápnika.Kľúčové slová:
vitamín D, kalciemické účinky, nonkalciemické účinky, hypovitaminóza D, kalcidiol, kalcitriol, prevencia u detíÚvod
Historický názov „vitamín D“ pomenúva skupinu chemicky podobných látok s antirachitickým účinkom. V roku 1919 Mellanby objavil „antirachitický faktor“ v potravinách bohatých na vitamín A (treščia pečeň, mlieko, maslo), ktorými liečil zvieratá s indukovanou rachitídou [1]. Paralelne v tom istom období Huldschinsky preukázal hojivé účinky UV-žiarenia u detí s rachitídou [2]. Tým sa začala dnes už takmer storočná éra medicínskeho používania vitamínu D v liečbe a neskôr aj v prevencii hypovitaminózy D.
Historicky sa zaužívalo pomenovanie „vitamín“ D, ale v skutočnosti je aktívny metabolit 1,25-dihydroxyvitamín D3 steroidným hormónom. S objavom nonkalciemických účinkov vitamínu D v 90. rokoch minulého storočia, najmä vo vzťahu k autoimunitným a civilizačným chorobám a potrebou optimalizovať profylaktické dávkovanie, sa „slnečný“ vitamín D znovu dostáva na „výslnie“ medicínskeho záujmu [2, 3, 4, 5].
Metabolizmus vitamínu D
Pre živočíšnu ríšu je charakteristický cholekalciferol – vitamín D3, pre rastlinnú ríšu ergokalciferol – vitamín D2. Oba vitamíny, ktoré sa vzájomne líšia usporiadaním molekuly, radíme ku sekosterolom. Hlavným a fyziologickým zdrojom vitamínu D pre ľudský organizmus je tvorba vitamínu v koži, no v malom množstve ho získavame aj z potravy.
V koži sa účinkom UV-B žiarenia (290–315 nm) mení štruktúra 7-dehydrocholesterolu cez medzistupeň previtamín D3 na vlastný vitamín D3. Vitamín D3 sa pri ďalšej expozícii mení na biologicky inertné metabolity suprasterol 1 a 2 [6]. Organizmus sa takto chráni pred nadmernou tvorbou cholekalciferolu. Inými slovami, vitamínom D vytvoreným v koži sa nemôžeme predávkovať!
Intenzita slnečného žiarenia na jednotlivých miestach planéty sa počas roka značne mení [7]. Množstvo prestupujúceho UV-B žiarenia na zem závisí od zemepisnej šírky, ročného obdobia a dennej doby. Kožný pigment melanín, ako prirodzený ochranný faktor, súperí o fotóny žiarenia so 7-dehydrocholesterolom. Preto jedinci s tmavou pleťou potrebujú dlhšiu slnečnú expozíciu na vytvorenie rovnakého množstva vitamínu D než ľudia so svetlou pleťou [8]. Vekom koncentrácia 7-dehydrocholesterolu v pokožke klesá, preto u starších osôb tvorba vitamínu D v koži výrazne klesá [9]. Z uvedeného vyplýva, že k zníženej tvorbe vitamínu D v koži dochádza pri nedostatočnom slnečnom svite (vplyvom ročného obdobia a zemepisnej šírky) a v starobe. Tvorba vitamínu D tiež výrazne klesá pri potieraní kože krémami s vysokým ochranným faktorom ako aj pri obmedzenej ploche kože vystavenej UV-B žiareniu (napr. nosenie habitu, kancerofóbia, ochrana detského organizmu pred úpalom či dehydratáciou) [7, 10]. Holick a spol. uvádzajú, že pri použití opaľovacieho prostriedku s ochranným faktorom 8 klesá tvorba vitamínu D v koži až o 95 %, resp. až o 98 % pri ochrannom faktore 15 [6].
V koži vzniknutý, alebo potravou prijatý cholekalciferol je biologicky inertný, na jeho aktiváciu sú potrebné ďalšie metabolické premeny v pečeni a obličkách. Po prestupe z kože sa transportuje špecifickým vitamín D viažúcim proteínom (DBP) do pečene, kde podlieha hydroxylácii na 25. uhlíku za vzniku kalcidiolu, ktorý sa naviazaný na DBP transportuje do obličiek. V obličkách sa účinkom 1α-hydroxylázy lokalizovanej v mitochondriách tubulárnych buniek tvorí biologicky aktívny kalcitriol [5, 11]. Tvorba kalcitriolu podlieha prísnej regulácii. Závisí od plazmatických koncentrácií vápnika a fosforu, parathormónu (PTH) aj samotného kalcitriolu, ktorý spätnou väzbou tlmí svoju produkciu a inhibuje expresiu génu pre PTH [5]. Nadbytočný kalcitriol sa v obličkách rýchlo odbúrava 24-hydroxylázou.
V súčasnosti je známych asi 37 metabolitov vitamínu D, druhým najpočetnejším je 24,25(OH)2cholekalciferol [7, 12]. Metabolizmus vitamínu D schematicky znázorňuje obrázok 1.
Obr. 1. Schéma metabolizmu vitamínu D. 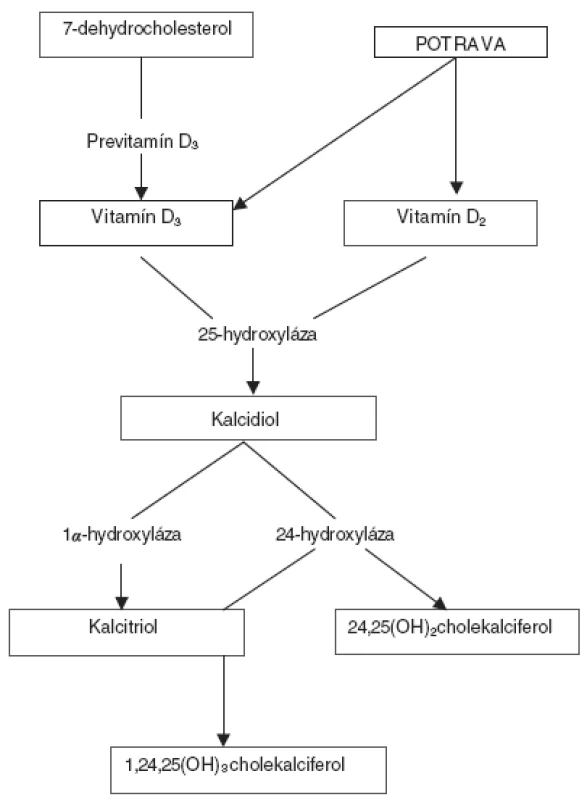
Účinky vitamínu D
Okrem genómového účinku kalcitriolu (vitamín D kontroluje expresiu viac ako 200 génov [2]), je známy aj non-genómový mechanizmus, ktorý sprostredkúva jeho rýchly účinok (sekundy až minúty oproti hodinám až dňom genómového účinku). Príkladom je rýchla absorpcia vápnika v čreve tzv. „transkaltachia“ alebo sekrécia inzulínu β-bunkami pankreasu [13].
Účinok na metabolizmus vápnika a fosforu
Najdôležitejšou biologickou funkciou vitamínu D je spolu s PTH a kalcitonínom udržiavať homeostázu vápnika a fosforu, ktorá je potrebná na primeranú mineralizáciu kostného tkaniva. Hlavným miestom účinku vitamínu D je gastrointestinálny trakt, kde zvyšuje vstrebávanie vápnika a v menšej miere aj fosforu. Pri nízkom prívode vápnika dominuje v tenkom čreve aktívny transportný proces, ktorý riadi kalcitriol zvýšením expresie génov pre transportné proteíny (kalbindín 9K a kalbindín 28K) a vápnikové kanály (TRPV5, TRPV6). V obličkách kalcitriol zvyšuje reabsorbciu fosforu a spolu s PTH sa podieľa aj na aktívnom vstrebávaní vápnika z distálneho tubulu [5, 12].
Vitamín D je nevyhnutný pre normálny rast a vývoj kostí. Priamo podporuje enchondrálnu osifikáciu, vplýva na rast kosti do dĺžky, zväčšuje objem epifýzy, podporuje proliferáciu a diferenciáciu chondrocytov. V epifyzeálnych štrbinách napomáha mineralizácii chrupavky a diferencovaniu novotvoreného kostného tkaniva. Zvyšuje tiež počet osteoblastov a reguluje ich funkciu (aktivita ALP, tvorba osteokalcínu, kolagénu typu I). Tieto účinky, ktoré sa skúmali na PTH-/- a 1-α-hydroxyláza-/- myšacom modele svedčia pre priamy vplyv exogénneho vitamínu D na kostné tkanivo, bez spoluúčasti PTH [14].
Na druhej strane, pri hypokalciémii sa uplatňuje odlišný mechanizmus pôsobenia vitamínu D. V tomto prípade na úpravu koncentrácie vápnika v krvi nepostačuje len zvýšené vstrebávanie vápnika črevom, preto vitamín D mobilizuje resorbčnú aktivitu kosti diferenciáciou kmeňových buniek kostnej drene na osteoklasty. Vitamín D teda pôsobí na kosť nepriamo, a to tým, že stimuluje osteoblasty k tvorbe cytokínov kontrolujúcich aktivitu osteoklastov [12].
Nonkalcemické účinky
V ostatných rokoch sa intenzívne študujú tzv. nonkalcemické účinky vitamínu D sprostredkované vitamín D receptorom (VDR), ktorý sa okrem orgánov zapojených do kalciovofosforovej homeostázy nachádza aj v ďalších bunkách. Medzi najznámejšie nonkalcemické účinky kalcitriolu patria: imunomodulačný a imunoregulačný účinok, selektívny efekt na rast buniek – antiproliferatívný a prodiferenciačný, vplyv na sekréciu inzulínu a reguláciu tlaku krvi.
Kalcitriol môže zasahovať do imunitného systému človeka na viacerých úrovniach:
- inhibuje proliferáciu T lymfocytov potlačením G fázy bunkového cyklu,
- znižuje tvorbu cytokínov,
- bráni prezentácii antigénu,
- stimuluje vrodené imunitné odpovede a
- indukuje diferenciáciu promyelocytov na monocyty a makrofágy [15, 16].
Výskumy na zvieracích modeloch autoimunitných ochorení ukázali, že vitamín D potláča diferenciáciu T lymfocytov na Th1, čo môže modifikovať vznik, priebeh a závažnosť autoimunitného ochorenia [5, 6]. Avšak hlavným impulzom ku skúmaniu asociácií medzi geografickou polohou, podnebím a autoimunitou boli zaujímavé demografické údaje, ktoré pozorovali, že výskyt diabetu I. typu, sklerózy multiplex a reumatoidnej artritídy so severnejšou zemepisnou šírkou narastá [17]. Hypotetický vzťah vitamínu D k cukrovke sa z časti opiera o prítomnosť 1α-hydroxylázy v pankreatických bunkách. V experimentálnych štúdiách sa pri deficite vitamínu D zistil závažnejší nástup diabetu [5]. V klinike sa u diabetičiek II. typu pozorovala asociácia medzi hypovitaminózou D, poruchou funkcie pankreasu a inzulínovou rezistenciou. Je zaujímavé, že po mesačnom podávaní cholekalciferolu sa s úpravou koncentrácie kalcidiolu súčasne znížila aj inzulínová rezistencia v priemere o 21 % [18].
K prekvapivým záverom dospela Hyppönenová so spolupracovníkmi, ktorá pozorovala, že dojčatá suplementované vitamínom D v dávke 2000 IU denne počas prvého roku života mali v dospelosti až o 80 % nižšie riziko výskytu diabetu 1. typu v porovnaní s ostatnou populáciou [19]. Výsledky tejto fínskej štúdie však treba interpretovať veľmi opatrne, lebo ako uvádza Norris v komentári k tejto práci, Fínsko patrí ku krajinám s „extrémne“ limitovanou expozíciou slnka a preto závery nemožno zovšeobecňovať [20].
Otázniky okolo ochranného vplyvu vitamínu D nezodpovedala ani nórska retrospektívna štúdia, v ktorej sa zistilo, že pred výskytom cukrovky chránil len rybí tuk podávaný v prvom roku života. Ak sa na profylaxiu používali iné zdroje vitamínu D ako rybí tuk, protektívny účinok na diabetes sa už nepotvrdil [21]. Preto nemožno vylúčiť, že v skutočnosti sa jedná o priaznivý vplyv ω-3 mastných kyselín pochádzajúcich z rybieho tuku [22]. Relevantné odpovede na otázku vzťahu vitamínu D k autoimunitným chorobám môžu priniesť len prospektívne klinické štúdie vykonané na veľkom počte pacientov.
Tabuľka 1 uvádza najdôležitejšie účinky vitamínu D v jednotlivých tkanivách [5].
Tab. 1. Biologické účinky kalcitriolu [5]. ![Biologické účinky kalcitriolu [5].](https://www.prolekare.cz/media/cache/resolve/media_object_image_small/media/image/afa04cc378d2fa6e1920cf732a1409be.png)
Prevencia vitamínom D
Profylaktické podávanie vitamínu D formou fortifikácie mlieka v 30. rokoch minulého storočia viedlo k ústupu závažných klinických foriem hypovitaminózy D v detskej populácii. V období po 2. svetovej vojne však ešte neboli vyvinuté laboratórne metódy na monitorovanie obsahu vitamínu D v mlieku a často sa vyskytovali intoxikácie z hypervitaminózy, preto sa fortifikácia mlieka v Európe zakázala [23]. Ďalším „extrémom“ bolo podávanie vysokých nárazových dávok vitamínu, ktoré sa preferovalo v 80. rokoch minulého storočia a ako sa neskôr zistilo, viedlo k nežiadúcim najmä renálnym účinkom [24].
Názory na spôsob suplementácie sa ustálili a v súčasnosti sa odporúča podávať vitamín D denne [25, 26].
Hypovitaminóza D
Nedostatok vitamínu D v rastúcom detskom organizmu vedie ku klinickým prejavom hypokalciemickej rachitídy, ktorá sa okrem celkových nešpecifických prejavov manifestuje najmä nedostatočnou mineralizáciou rastúceho skeletu [27]. Vyskytuje sa sporadicky, hlavne u starších dojčiat a batoliat [25]. Hlavným predisponujúcim rizikom pre jej vznik v našich podmienkach je nedostatočný príjem vápnika u detí s malými zásobami D vitamínu [27].
Demografické údaje z USA varovne upozorňujú na zvýšený výskyt rachitídy u dojčených černošských detí spôsobený nedostatočnou suplementáciou vitamínom D [28]. Na druhej strane, ani v Európe nie je rachitída „zabudnutá“ choroba minulého storočia, o čom svedčí ročná incidencia vitamín D dependentnej rachitídy v Nemecku v počte 400 detí [29].
Aj my sme v retrospektívnej analýze, vykonanej na veľkom súbore 5061 hospitalizovaných detí na KDD LF UPJŠ v Košiciach v rokoch 1997–2000, zistili rachitídu až u 102 pacientov (t.j. 2 % súboru). Za prekvapivé zistenie považujeme skutočnosť, že viac ako polovica detí s rachitídou (57 %) mala v anamnéze údaj o podaní nárazových dávok D vitamínu [30].
V tabuľke 2 je uvedená prevalencia rachitídy v niektorých krajinách sveta [31].
Tab. 2. Prevalencia rachitídy [31]. ![Prevalencia rachitídy [31].](https://www.prolekare.cz/media/cache/resolve/media_object_image_small/media/image/d26e9371267bfe2f58139ab7ba2a0dd6.png)
Význam stanovenia koncentrácií kalcidiolu a kalcitriolu
Kalcidiol je hlavnou cirkulujúcou formou vitamínu D, jeho biologický polčas trvá približne 2 mesiace. Koncentrácia kalcidiolu v sére kolíše v závislosti od ročného obdobia, pričom v zime sú jeho hodnoty spravidla nižšie. Normálne rozmedzie kalcidiolu v sére sa udáva od 20 do 75 ng/ml [12]. Tvorba kalcidiolu nie je regulovaná spätnou väzbou, a preto sa pri nadbytku ukladá do tukového a svalového tkaniva. V protiklade k tomu je koncentrácia kalcitriolu rádovo až 1000-krát nižšia, s referenčnými hodnotami od 15 do 60 pg/ml a polčasom rozpadu menej ako 4 hodiny [12]. Kalcidiol sa považuje za najspoľahlivejší biochemický parameter na určenie zásob vitamínu D v organizme [2, 4, 32]. Zatiaľ však nepanuje všeobecná zhoda, aká je optimálna koncentrácia kalcidiolu [4].
Podľa konsenzu expertov ESPE (European Society for Paediatric Endocrinology) z roku 2001 sa za „subnormálnu“ hodnotu považuje koncentrácia kalcidiolu pod 11 ng/ml, ale ďalej sa uvádza, že ani hodnoty pod 25–30 ng/ml nie sú dostatočné na dosiahnutie optimálnych účinkov vitamínu D [33]. Novšie odporúčania expertov z roku 2008 čiastočne sprísnili predchádzajúce závery a za dolnú hranicu normy kalcidiolu pre všetkých jedincov považujú hodnotu 20 ng/ml (resp. 50 nmol/l) [4]. Platí, že udávaná hodnota kalcidiolu 20 ng/ml je aj hranicou terapeutického zásahu [34].
Iní autori upozorňujú, že pre optimálny metabolizmus kostí a prevenciu zlomenín je žiadúca hodnota kalcidiolu až nad 30 ng/ml [2, 35]. Ani intervenčné štúdie u dospelých zamerané na sledovanie asociácie medzi „nízkym statusom“ D vitamínu a kardiovaskulárnymi, autoimunitnými či onkologickými chorobami neurčili „ minimálnu“ hranicu pre kalcidiol, ale predbežné údaje svedčia pre nižšie riziko u ľudí so sérovým kalcidiolom viac ako 30 ng/ml [4].
Vyšetrenie koncentrácií kalcidiolu a kalcitriolu môže odlíšiť jednotlivé štádiá rachitídy, ale nepatrí k základným vyšetreniam. Diagnóza sa opiera o hodnoty vápnika, fosforu a alkalickej fosfatázy v krvi. Aktivita alkalickej fosfatázy je spoľahlivým ukazovateľom, ktorý dobre koreluje s intenzitou sekundárnej hyperparatyreózy [12, 27]. Na druhej strane je dôležité, aby sa koncentrácie kalcidiolu a kalcitriolu interpretovali správne. Pre nedostatok vitamínu D svedčí znížený kalcidiol, ale hladina kalcitriolu sa mení v závislosti od štádia rachitídy, preto kalcitriol môže byť znížený, zvýšený aj normálny.
Treba zdôrazniť, že na posúdenie metabolizmu vitamínu D v organizme nestačí vyšetrovať iba samotnú koncentráciu kalcitriolu. V klinickej praxi je indikované vyšetrenie obidvoch metabolitov vitamínu pri nasledujúcich stavoch: opakovane nameraná hyper/hypokalcémia, hyperkalciúria, metabolické ochorenie skeletu nejasného pôvodu, monitorovanie terapie vitamínom D, podozrenie na geneticky podmienenú rachitídu, renálna osteodystrofia [12].
Fyziologická potreba vitamínu D
Denná potreba vitamínu D nie je u človeka veľká, k jej pokrytiu postačí 10 μg (400 IU) vitamínu D denne, a to po celý detský vek. Ani v období rýchleho rastu kostí nie je dôvod na vyšší príjem vitamínu D, pokiaľ je vytvorená dostatočná zásoba kalcidiolu [12]. Až 90 % fyziologickej potreby vitamínu D si organizmus dokáže syntetizovať sám. Na tvorbu adekvátneho množstva vitamínu D v koži postačuje vystavenie tváre a rúk slnku 5–10 minút denne [7], za predpokladu dostatočného množstva dopadajúceho UV-B žiarenia. Vitamín D prijímame aj v potrave, avšak bežná strava má vo všeobecnosti nízky obsah vitamínu D s výnimkou rýb s vyšším obsahom tuku (losos, makrela, sardinky), vaječného žĺtka, mlieka a mliečnych výrobkov. Aj preto sa obohacujú niektoré potraviny vitamínom D, napr. umelá mliečna výživa, džúsy, margaríny, mlieko či mliečne výrobky. Materské mlieko má nízky obsah vitamínu D (25–80 IU/l) v porovnaní s umelými mliečnymi produktmi, ktoré obsahujú v priemere 400 IU/l vitamínu D [36].
Názory na denné odporúčané dávky vitamínu D nie sú jednotné. V roku 2003 AAP (American Academy of Pediatrics) znížila odporúčaný denný príjem vitamínu D z pôvodných 400 IU na 200 IU pre všetky deti [3]. Medzi pediatrami však stále silneli „hlasy,“ ktoré spochybňovali efekt týchto nízkych dávok [37], vďaka čomu sa AAP v roku 2008 znovu vrátila k pôvodnej dávke 400 IU denne [32].
Zaujímavým príspevkom k prebiehajúcej polemike sú výsledky projektu EURECCA (EURopean micronutrient RECommendation) publikované v roku 2008, ktoré celoplošne mapovali odporúčaný príjem mikronutrientov až v 22 krajinách Európy. Z výsledkov vyplynulo, že vo väčšine európskych krajín sa odporúča podávať 5–10 μg (200–400 IU) vitamínu D denne, a to bez rozdielu pohlavia a veku. Podľa tohto prieskumu 400 IU/deň odporúčajú aj v tehotenstve a počas dojčenia. Je pozoruhodné, že vyššie dávky vitamínu D v prvom roku života sa dávajú iba vo Francúzsku (900 IU, resp. 22,5 μg) a Belgicku (500 IU, resp. 12,5 μg) [38].
Aj závery ESPE publikované v roku 2002 považujú 400 IU vitamínu D denne za dostačujúce pre všetky deti bez ohľadu na farbu pleti a zemepisnú šírku [33]. Najnovšie „gajdlajny“ expertov na osteoporózu z roku 2008 uvádzajú dennú suplementáciu až 800 IU vitamínu D pre všetky vekové kategórie vrátane detí (dávkovacie rozpätie 400–2000 IU závisí od veku, ročného obdobia a východzej koncentrácie kalcidiolu). Toto množstvo vitamínu D dokáže spoľahlivo udržiavať kalcidiol nad 30 ng/ml [4].
V ČR sa pracovná skupina pre osteológiu a fosfokalciový metabolizmus už v roku 1997 uzniesla na odporúčanej dennej dávke 600–800 IU vitamínu D [17]. Avšak v rizikových skupinách detskej populácie je žiadúce dávkovanie D vitamínu adekvátne upraviť (tab. 3) [17].
Tab. 3. Rizikové skupiny ohrozené deficitom vitamínu D [17]. ![Rizikové skupiny ohrozené deficitom vitamínu D [17].](https://www.prolekare.cz/media/cache/resolve/media_object_image_small/media/image/9ca83a719402b266165131ce7ea87cec.png)
Vitamín D v prenatálnom období a u predčasne narodených detí
Zásadným krokom pre priaznivý metabolizmus vitamínu D v postnatálnom období sú dostatočné zásoby vitamínu D, s ktorými sa dieťa narodí. Preto je nevyhnutný primeraný prívod vitamínu D, ale aj vápnika a fosforu počas celého tehotenstva. V odporúčaných dávkovacích postupoch nepanuje jednotnosť. Denné užívanie 400 IU vitamínu sa zvyčajne považuje za postačujúce [38], niektorí však uvádzajú podávať 800 IU vitamínu D denne počas celého trvania gravidity, alebo 1000 IU vitamínu D/deň v poslednom trimestri [7].
U predčasne narodených detí sa na poruche kostného metabolizmu podieľa najmä nedostatok minerálnych látok – predovšetkým fosforu, čím viazne mineralizácia rýchlo rastúcich kostí [12]. Po pôrode je preto nutné podávať fosfor spolu s vápnikom a vitamínom D, čo zohľadňujú špeciálne prípravky umelej mliečnej výživy určenej pre nedonosencov. Pri dojčení predčasne narodených detí sa môže fortifikovať materinské mlieko. Bayer odporúča suplementovať vápnik a fosfor minimálne prvé tri mesiace života, resp. až do obdobia, keď dieťa dosiahne normálnu pôrodnú hmotnosť 3500 g [12]. Potreba vitamínu D u predčasne narodených novorodencov je nižšia, vhodná denná dávka je 200–400 IU [33].
Odporúčania pre prax
Suplementáciu vitamínom D začíname od ukončeného druhého týždňa života. Vitamín D podávame všetkým deťom bez ohľadu na spôsob výživy a ročné obdobie. Vo všeobecnosti sa preferuje denné podávanie 600–800 IU vitamínu D po celý prvý rok života [4, 7, 17], ale v ostatnom čase sú tendencie pokračovať v tejto profylaxii až do troch rokov života [39]. U starších detí je vhodné aplikovať D vitamín v období zimných mesiacov (t.j. od konca októbra do apríla) až do puberty [7, 37].
Vitamín D podávame v lyžičke mlieka, alebo v malom množstve materského mlieka (20–30 ml) [25]. Dojčatám na umelej výžive sa upravuje dávka po treťom mesiaci života, a to podľa obsahu vitamínu D v mlieku [17, 25].
Na trhu sú dostupné dva preparáty vitamínu D v kvapkách, ktoré sú vhodné na prevenciu. Cholekalciferol – Vigantol, jedna kvapka obsahuje približne 500 IU, čo by zodpovedalo 2 kvapkám pri odporúčaní 800 IU denne, a ergokalciferol – Infadin, jedna kvapka obsahuje 800 IU. Pre vyššiu biologickú účinnosť sa uprednostňuje cholekalciferol pred ergokalciferolom [36]. Pri preventívnom podávaní vitamínu D treba vždy pamätať na dostatočný príjem vápnika (tab. 4). Najvhodnejším zdrojom vápnika je mlieko a mliečne výrobky.
Tab. 4. Odporúčaný denný príjem vápnika (mg/deň) [12, 33]. ![Odporúčaný denný príjem vápnika (mg/deň) [12, 33].](https://www.prolekare.cz/media/cache/resolve/media_object_image_small/media/image/92d3e9b0bfb7c2e4c5cfb3f6fd672f7a.png)
Predávkovanie vitamínom D môže viesť k toxicite. Príznaky hypervitaminózy môže vyvolať už dlhodobá denná dávka 1800 IU, alebo nárazová dávka. Najzávažnejšie je postihnutie obličiek s nefrokalcinózou, poruchou koncentračnej schopnosti obličiek, hyperkalciúriou, litiázou až zlyhaním obličiek [24].
Záver
Suplementácia vitamínu D je v podstate hormonálnou terapiou [26]. Základným predpokladom dostatku vitamínu D u dieťaťa v prvých mesiacoch života je optimálny prívod D vitamínu počas tehotenstva.
Aby preventívna aplikácia vitamínu D splnila svoj účel, je potrebné zabezpečiť aj primeraný prívod kalcia v strave vo forme mlieka či mliečnych výrobkov. Je žiadúce pokračovať v substitúcii vitamínom D a vápnikom až do puberty.
V svetle najnovších poznatkov sa dnes intenzívne študujú kauzálne vzťahy medzi adekvátnou saturáciou organizmu vitamínom D a rozvojom autoimunitných a civilizačných chorôb.
Došlo: 5. 1. 2009
Přijato: 15. 5. 2009
MUDr. Juliana Ferenczová
I. klinika detí a dorastu LF UPJŠ
Trieda SNP č. 1
040 66 Košice
Slovenská republika
e-mail: juliana.ferenczova@upjs.sk
Zdroje
1. Rajakumar K. Vitamin D, cod-liver oil, sunlight, and rickets: a historical perspective. Pediatrics 2003;2 : 132–135.
2. Holick M. Resurrection of vitamin D deficiency and rickets. J. Clin. Invest. 2006;8 : 2026–2072.
3. Gartner M, Greer F, et al. Prevention of rickets and vitamin D deficiency: new guidelines for vitamin D intake. Pediatrics 2003;4 : 908–910.
4. Roux C, Bischoff-Ferrari HA, Papapoulos SE, et al. New insights into the role of vitamin D and calcium in osteoporosis management: an expert roundtable discussion. Cur. Med. Res. Opin. 2008;24(5): 1363–1370.
5. Dusso A, Brown AJ, Slatopolsky E. Vitamin D. Am. J. Physiol. Renal. Physiol. 2005;289(1): F8–28.
6. Holick M. Sunlight and vitamin D for bone health and prevention of autoimmune diseases, cancers and cardiovascular disease. Am. J. Clin. Nutr. 2004;4 : 1678S–1688S.
7. Bayer M. Vitaminy rozpustné v tucích. Praktické Lékárenství 2008;4(5): 235–237.
8. Clemens T, Henderson L, Adams S, et al. Increased skin pigment reduced capacity of skin to synthesis vitamin D3. Lancet 1982;1 : 74–76.
9. Holick MF, Matsuoka LY, Wortsman J. Age, vitamin D and solar ultraviolet. Lancet 1989;2 : 1104–1105.
10. Bouillon R, Moody T, Sporn M, et al. NIH deltainoids meeting on vitamin D and cancer. Conclusion and strategic options. J. Steroid. Biochem. Mol. Biol. 2005;97(1–2): 3–5.
11. Valdivielso J, Fernandez E. Vitamin D receptor polymorphism and diseases. Clin. Chim. Acta 2006;1 : 1–12.
12. Bayer M, Kutílek Š, et al. Metabolická onemocnění skeletu u dětí. 1. vyd. Praha: Grada, 2002 : 1–340.
13. Wilczek H. Současnost vitaminu D. Čes.-slov. Pediat. 1999;4 : 197–199.
14. Xue Y, Karaplis AC, Hendy GN, et al. Exogenous 1,25-dihydroxyvitamin D3 exerts a skeletal anabolic effect and improves mineral ion homeostasis in mice that are homozygous for both the 1α-hydroxylase and parathyroid hormone null alleles. Endocrinology 2006;147 : 4801–4810.
15. Griffin M, Xing N, Kumar A. Vitamin D and its analogs as regulators of immune activation and antigen presentation. Annu. Rev. Nutr. 2003;2 : 117–145.
16. Hewison M, Yehnder D, Chakraverty R, et al. Vitamin D and barrier function: a novel role for extra-renal 1α-hydroxylase. Mol. Cell. Endocrinol. 2004;2 : 13–19.
17. Kalvachová B. Vitamin D – nové poznatky a endokrinní mikrosystémy kalcitriolu. Osteologický Bulletin 2007;2 : 62–67.
18. Borissova A, Tankova T, Kirilov G, et al. The effect of vitamin D3 on insulin secretion and peripherial insulin sensitivity in type 2 diabetic patients. Int. J. Clin. Pract. 2003;4 : 258–261.
19. Hypponen E, Laara E, Jarvelin M. Intake of vitamin D and risk of type 1 diabetes: a birth cohort study. Lancet 2001;358 : 1500–1503.
20. Norris JM. Can the sunshine vitamin shed light on type 1 diabetes? Lancet 2001;358 : 1476–1477.
21. Stene LC, Joner G. Norwegian childhood diabetes study group. Use of cod liver oil during the first year of life is associated with lower risk of childhood-onset type 1 diabetes: a large, population-based, case-control study. Am. J. Clin. Nutr. 2003;78 : 1128–1134.
22. Cinek O. Etiologie dětského diabetes mellitus 1. typu. In: Perušičová J. Diabetes mellitus 1. typu. 2. vyd. Praha: Geum, 2008 : 47–72.
23. Holick MF, Chen TC. Vitamin D deficiency: a worldwide problem with health consequences. Am. J. Clin. Nutr. 2008;87(suppl): 1080S–1086S.
24. Janda J, Bláhová K. Nepříznivý efekt vysokých profylaktických dávek vitaminu D na ledviny (přehled). Čes.-slov. Pediat. 1998;Suppl 1 : 29–30.
25. Sedláčková K, Kovács L, Petríková I, et al. Prevencia hypovitaminózy D a rachitídy – ako a čím? Det. Lek. 1995;2 : 32–35.
26. Bayer M. Preventivní podávání vitaminu D u dětí – současné názory na dávkování. Čes.-slov. Pediat. 2000;1 : 48–50.
27. Bayer M. Rachitis v ordinaci praktického lékaře. Čes.-slov. Pediat. 1999;4 : 208–211.
28. Ziegler E, Hollis B, Nelson S, et al. Vitamin D deficiency in breastfed infants in Iowa. Pediatrics 2006;8 : 603–610.
29. Kruse A. Aktuelle aspekte der vitamin D-mengel rachitis. Monatschr. Kinderheilkd. 2000;148(6): 588–595.
30. Ferenczová J, Behúnová J, Podracká Ľ, et al. Je rachitída u našich detí zriedkavá? Det. Lek. 2003;3 : 7–10.
31. Prentice A, Schoenmakers I, Laskey MA, et al. Nutrition and bone growth and development. Proc. Nutr. Soc. 2006;65(4): 348–360.
32. Wagner CL, Greer FR, et al. Prevention of rickets and vitamin D deficiency in infants, children and adolescents. Pediatrics 2008;122 : 1142–1152.
33. Hochberg Z, Bereket A, Davenport M, et al. Consensus development for the supplementation of vitamin D in childhood and adolescence. Horm. Res. 2002;58 : 39–51.
34. Bischoff-Ferrari HA, Giovannucci E, Willett WC, et al. Estimation of optimal serum concentrations of 25-hydroxyvitamin D for multiple health outcomes. Am. J. Clin. Nutr. 2006;84 : 18–28.
35. Dawson-Hughes B, Heaney RP, Holick MF, et al. Estimates of optimal vitamin D status. Osteoporos. Int. 2005;16(7): 713–716.
36. Houghton L, Vieth R. The case against ergocalciferol (vitamin D2) as a vitamin supplementation. Am. J. Clin. Nutr. 2006;84 : 694–697.
37. Greer F. Issues in establishing vitamin D recommendations for infants and children on vitamin D and health in the 21st century: bone and beyond. Am. J. Clin. Nutr. 2004;6 : 1759–1762.
38. Doets EL, deWit LS, Dhonukshe-Rutten RAM, et al. Current micronutrient recommendations in Europe: towards understanding their differences and similarities. Eur. J. Nutr. 2008;47(Suppl 1): 17–40.
39. Wharton B, Bishop N. Rickets. Lancet 2003;10 : 1389–1400.
Štítky
Neonatologie Pediatrie Praktické lékařství pro děti a dorost
Článek Komplikace varicely u dětíČlánek X. TEYSCHLŮV PEDIATRICKÝ DENČlánek XI. Hradecké pediatrické dny
Článek vyšel v časopiseČesko-slovenská pediatrie
Nejčtenější tento týden
2009 Číslo 7-8- Horní limit denní dávky vitaminu D: Jaké množství je ještě bezpečné?
- Isoprinosin je bezpečný a účinný v léčbě pacientů s akutní respirační virovou infekcí
- Syndrom Noonanové: etiologie, diagnostika a terapie
-
Všechny články tohoto čísla
- Komplikace varicely u dětí
- Úloha variací genu ABCB4 v etiologii idiopatické cholelitiázy dětského věku
- Vitamín D – nový pohľad na starý vitamín
- Terapeutické přístupy v léčbě novorozenecké anémie z nezralosti
- Intrauterinní růstová retardace a její vliv na další vývoj extrémně nezralých novorozenců
- Prenatální život z pohledu etiky
- Etický kontext tzv. „baby- boxů“
- Lázně pro děti – léčba nebo rekreace?
- X. TEYSCHLŮV PEDIATRICKÝ DEN
- XI. Hradecké pediatrické dny
- Celostátní konference dětské gastroenterologie a výživy
- Česko-slovenská pediatrie
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- Terapeutické přístupy v léčbě novorozenecké anémie z nezralosti
- Intrauterinní růstová retardace a její vliv na další vývoj extrémně nezralých novorozenců
- Vitamín D – nový pohľad na starý vitamín
- Komplikace varicely u dětí
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



