-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Atopická dermatitida: současná doporučení pro diagnostiku a léčbu. Část II.
Atopic Dermatitis: Current Guidelines for Diagnosis and Treatment. Part II
Atopic dermatitis is a chronic, very itching disease of children and adults that requires intensive local and often systemic treatment. The choice of treatment depends on the age, severity of the disease and associated diseases. Current recommendations in part II contain indications for systemic treatment; summarize the latest available knowledge on conventional systemic, biological and targeted treatment of atopic dermatitis. At the same time, treatment goals (initial, rational, optimal), evaluation of treatment response and treatment failure are defined.
Keywords:
atopic dermatitis – indications for systemic treatment – treatment evaluation – treatment goals – conventional systemic treatment – biological and targeted treatment
Autoři: A. Machovcová 1; P. Cetkovská 2; J. Fialová 3; S. Gkalpakiotis 4; M. Kojanová 3
Působiště autorů: Dermatovenerologické oddělení FN v Motole, Praha, primář MUDr. Alena Machovcová, Ph. D., MBA 1; Dermatovenerologická klinika UK LF a FN Plzeň, Plzeň, přednosta MUDr. Jan Říčař, Ph. D. 2; Dermatovenerologická klinika UK 1. LF a VFN Praha, Praha, přednosta prof. MUDr. Jiří Štork, CSc. 3; Dermatovenerologická klinika UK 3. LF a FNKV, Praha, přednosta prof. MUDr. Petr Arenberger, DrSc., MBA 4
Vyšlo v časopise: Čes-slov Derm, 98, 2023, No. 3, p. 123-149
Kategorie: Souborné referáty (doškolování lékařů)
Souhrn
Atopická dermatitida je chronické, intenzivně svědící onemocnění dětí i dospělých, které vyžaduje intenzivní lokální a často i celkovou léčbu. Výběr léčebné metody závisí na věku, závažnosti onemocnění a přidružených chorobách. Aktuální doporučení v části II obsahují indikace k celkové léčbě, shrnují recentní dostupné poznatky o systémové, biologické a cílené léčbě atopické dermatitidy. Současně jsou definované léčebné cíle (iniciální, racionální, optimální), hodnocení léčebné odpovědi a selhání léčby.
Klíčová slova:
atopická dermatitida – indikace celkové léčby – hodnocení celkové léčby – léčebné cíle – konvenční systémová léčba – biologická a cílená léčba atopické dermatitidy
ÚVOD
Atopická dermatitida (AD) postihuje celosvětově více než 20 % dětí a 2–8 % dospělé populace. Většinou se manifestuje v dětském věku, vznik v prvním roce života se udává u 60–85 % dětí, do 5 let života u více než 85 % případů, avšak AD se může objevit v jakémkoliv věku. Spontánní remise se udávají u dětí starších 5 let ve 40–60 %, pokud jsou projevy mírné. Asi u 20 % pacientů AD ustoupí do doby dospívání, u třetiny případů dochází k perzistenci projevů do dospělosti [88, 90, 92]. Přibližně u 20 % pacientů s atopickou dermatitidou je lokální protizánětlivá léčba nedostatečně účinná a pacienty je třeba léčit celkovou (systémovou) léčbou. Systémová léčba je indikovaná i v případech, kdy je AD doprovázená úporným svěděním, výrazně sníženou kvalitou života, nebo v případech, kdy se k ošetřování rozsáhlých postižených oblastí používá velké množství silně účinných lokálních kortikosteroidů, ošetřují se jimi rezistentní projevy v citlivých či viditelných partiích nebo dochází i přes intenzivní protizánětlivou léčbu k opakovaným relapsům projevů během jednoho roku (> 10 relapsů za rok) [65, 88, 90, 92]. Pro pacienty s AD platí totéž, co platilo v minulosti pro pacienty s psoriázou [47], tedy to, že pacienti se středně závažnou a závažnou AD jsou podléčeni a nedostatečně léčeni celkovou léčbou [48].
V současnosti je cyklosporin (CyA) jediná schválená konvenční systémová imunosupresivní léčba středně těžké až těžké AD v Evropě včetně České republiky (ČR). Bez schválení („off-label“) lze použít metotrexát (MTX), azathioprin (AZA) a mykofenolát mofetil (MMF). Systémové kortikosteroidy (SCS) se sice v léčbě AD hojně používají, ale pro jejich dlouhodobé použití není opodstatnění [88, 90, 92]. CyA spolu s SCS mají rychlý nástup účinku a hodí se k léčbě akutních exacerbací, ostatní imunosupresivní léky (MTX, AZA, MMF) působí pomaleji. Před zahájením jakékoliv celkové léčby je nutné vyloučit diferenciálně diagnosticky jiné kožní choroby imitující AD, zejména primární kožní lymfomy, zvážit všechny relevantní faktory, jako jsou přidružené nemoci, očekávaný nástup účinku, plánované trvání léčby a případné plánování početí [41, 85, 86, 88, 90, 92].
Léčebné možnosti pacientů s AD se výrazně zlepšily zavedením biologické a cílené léčby. Ta je indikovaná u středně těžké až těžké AD u pacientů, kteří jsou kandidáty systémové léčby, některé přípravky je možné použít i u dětí. K biologické léčbě středně těžké až těžké AD jsou v ČR schváleny dupilumab a tralokinumab [1, 24]. Dupilumab je v současné době jediným hrazeným biologikem pro pacienty s těžkou formou AD po splnění úhradových kritérií [25]. K cílené léčbě inhibitory Janusových kináz (JAK) jsou schváleny v ČR abrocitinib, baricitinib a upadacitinib [16, 54, 60]. Baricitinib (od 1. 6. 2022), abrocitinib (od 1. 11. 2022) a upadacitinib (od 1. 3. 2023) jsou hrazené pro pacienty s těžkou formou AD po splnění úhradových kritérií [16, 55, 61].
VÝBĚR A DLOUHODOBÉ VEDENÍ CELKOVÉ LÉČBY
Zahájit a vést celkovou terapii u pacientů s AD by měli lékaři se zkušenostmi s komplexní léčbou AD včetně diferenciální diagnostiky. Komorbidity je třeba léčit ve spolupráci s příslušnými odborníky. Výběr léku má být výsledkem diskuse mezi lékařem a pacientem, který by měl být podrobně informován o všech možnostech léčby, jejích rizicích a přínosech. Vzdělávání pacienta o etiologii, komorbiditách, možnostech léčby, faktorech a vlivech životního stylu spojeného s AD optimalizuje společné rozhodnutí, navozuje vztah mezi pacientem a lékařem; pozitivně ovlivňuje spokojenost pacientů a jejich compliance s léčbou [90, 92].
DOPORUČENÉ POSTUPY
Předkládané doporučené postupy, které vycházejí z mezinárodních doporučených postupů [65, 81, 84, 88, 90, 92], nemohou být považovány za komplexní návod zajišťující úspěšnou léčbu v jednotlivých situacích. Práce nenahrazuje souhrny údajů o léčivých přípravcích (SPC). Protože vědecké informace týkající se celkové léčby neustále přibývají, naším cílem je zajistit recentní doporučení v době publikace a čtenáři jsou laskavě žádáni o sledování nových vědeckých poznatků a z toho vyplývajících upřesnění pokynů. Doporučení budou autory s ohledem na vývoj poznatků v biologické a cílené léčbě pravidelně upravována, doplňována a aktualizována.
Indikace k celkové léčbě v ČR
Celková léčba AD má být zahájena u pacientů se středně těžkou až těžkou AD, která perzistuje déle než 3 měsíce i přes intenzivní lokální protizánětlivou léčbu a splňuje alespoň jedno kritérium z každého oddílu (A, B, C) následujících podmínek (upraveno autory podle [20, 28, 81, 84, 85, 88, 90, 92]).
A. Objektivní hodnocení závažnosti onemocnění
1. závažnost AD hodnocení pomocí indexu „Eczema Area and Severity Score“ (EASI )≥ 15, nebo
2. závažnost AD hodnocení pomocí hodnocení „Scoring Atopic Dermatitis“ (SCORAD) > 25, nebo
3. Postižení tělesného povrchu (Body Surface Area – BSA) > 10 %, nebo
4. globální hodnocení závažnosti lékařem (Investigator Global Assesment – IGA) ≥ 3, nebo
5. postižení citlivých a/nebo viditelných oblastí (genitál, ruce, obličej), nebo
6. vysoká frekvence relapsů (> 10/rok).
B. Subjektivní zátěž nemocného
1. hodnocení kvality života – Dermatology Life Quality Index (DLQI) >10, nebo
2. skórovací systém hodnotící zvládání/kontrolu onemocnění atopickou dermatitidou (ADCT – „Atopic Dermatitis Control Tool“): ADCT > 7 nebo zvýšení o 5 a více bodů od posledního použití ADCT, nebo
3. intenzita svědění > 5 (podle Numeric Rating Scale – NRS), nebo
4. poruchy spánku v důsledku ekzému/svědění podle NRS > 5.
C. Nedostatečná odpověď na předcházející léčbu
1. nedostatečná odpověď na lokální protizánětlivou léčbu
Hodnocení
Celková léčba je indikována, jestliže je splněno jedno kritérium z každého oddílu A, B, C (A + B + C). Výběr celkové léčby podle doporučených postupů se zahajuje zohledněním přínosu a rizika dané léčby u konkrétního pacienta, který je vždy součástí rozhodovacího procesu [84, 85, 90, 92].
Léčebné cíle
Stanovení léčebných cílů je nezbytné k optimální léčbě pacientů s AD. Jejich definování umožní vyvarovat se suboptimální dávky nebo nevhodné léčby. Léčebné cíle musí být dosažitelné (realistické), časově ohraničené (obvykle 3–4 měsíce) a vždy musí být výsledkem diskuse pacienta s lékařem. Splnění léčebných cílů umožní snížit aktivitu onemocnění a intenzitu doprovodných příznaků (např. svědění). Cílem úspěšné léčby je dosažení kontroly nad onemocněním definované minimální aktivitou onemocnění (MDA), tzn. zlepšení stavu do té míry, kdy onemocnění má žádný nebo minimální vliv na každodenní aktivity pacienta. K posouzení efektivity léčby je nezbytné pravidelně hodnotit současně nejméně jednu objektivní (EASI, BSA, IGA, SCORAD) a nejméně dvě subjektivní hodnotící škály (NRS pruritu, kvality spánku, DLQI, ADCT) [20, 81, 84, 85, 90, 92].
Iniciálním léčebným cílem (za 3–4 měsíce od zahájení dané léčebné metody) je redukce IGA o 1 stupeň, nebo snížení hodnoty BSA alespoň o 50 %, nebo dosažení EASI 50, a snížení NRS svědění, kvalita spánku alespoň o 4 body a/nebo DLQI alespoň o 5 bodů a případně i ADCT nejméně o 5 bodů [20, 81].
Racionálním léčebným cílem (každých 6 měsíců) je dosažení IGA maximálně 2, nebo snížení BSA o více než 50 %, nebo dosažení EASI 75 a hodnota NRS (svědění, kvalita spánku) 4 a méně, a/nebo hodnota DLQI 5 a méně, a případně hodnota ADCT 7 bodů a méně [20, 81].
Optimálním terapeutickým cílem je dosažení zhojené nebo prakticky zhojené kůže (MDA) definované IGA 0/1, nebo dosažení BSA 90 %, resp. BSA maximálně do 2 % kožního povrchu, nebo dosažení EASI 90 a minimální vliv onemocnění na kvalitu života (DLQI 0/1, NRS svědění, kvalita spánku 0/1, ADCT 0/1) – tabulka 1 [20, 81]. Během udržovací léčby je nutné v pravidelných intervalech (každých 6 měsíců) monitorování klinického efektu a nežádoucích účinků.
Tab. 1. Hodnocení léčebné odpovědi a stanovení léčebných cílů k dosažení minimální aktivity onemocnění 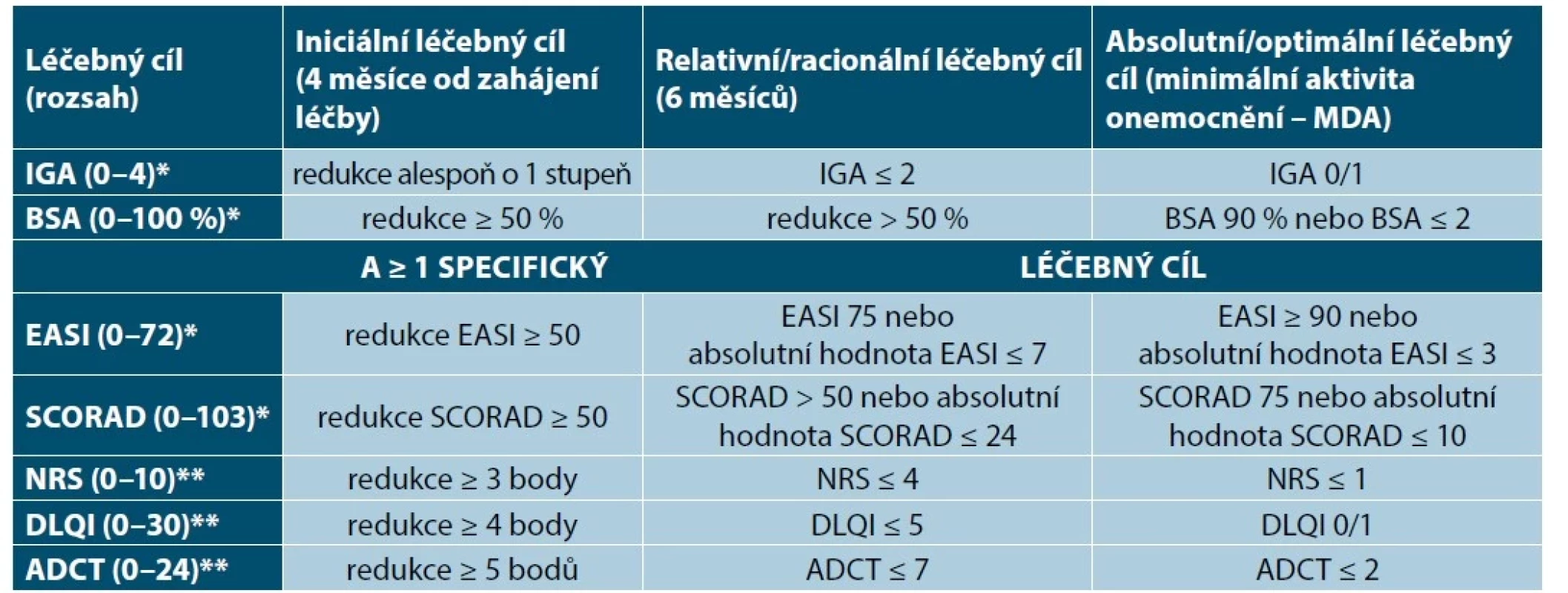
(upraveno podle [20, 81])
ADCT – Atopic Dermatitis Control Tool, BSA – Body Surface Area, DLQI – Dermatology Life Quality Index, EASI – Eczema Area and Severity Index, IGA – Investigator Global Assessment, MDA – Minimal Disease Activity, NRS – Numeric Rating Scale, SCORAD – Scoring of Atopic Dermatitis
*objektivní kritéria
**subjektivní kritéria
K hodnocení léčebné odpovědi je nezbytné 1 objektivní kritérium (IGA, BSA, EASI, SCORAD) a nejméně 2 subjektivní hodnoticí škály (NRS svědění, kvalita spánku, DLQI, ADCT).Za primární selhání léčby se považuje nedosažení iniciálního léčebného cíle (3–4 měsíce) a/nebo racionálního léčebného cíle (6 měsíců). U pacientů s částečnou odpovědí (nedosažení EASI 50, resp. EASI 75 nebo srovnatelného objektivního parametru v objektivních škálách (SCORAD, BSA, IGA) nebo neuspokojivé hodnoty v subjektivních škálách (NRS svědění, kvalita spánku, DLQI, ADCT) doporučujeme změnu, případně optimalizaci léčby [20, 81].
Sekundární selhání léčby (ztráta efektu léčby po předchozím dosažení dostatečné klinické odpovědi během indukční fáze) se definuje jako:
• selhání léčby po předchozím dosažení léčebného cíle kdykoliv v průběhu léčby,
• léčebná odpověď již není považována za dostačující ani lékařem, ani pacientem (schéma 1) [20, 81].
Schéma 1. Algoritmus léčebných cílů u atopické dermatitidy 
(upraveno podle [20, 81])
AD – atopická dermatitida, ADCT – Atopic Dermatitis Control Tool, DLQI – Dermatology Life Quality Index, EASI – Eczema Area and Severity Index, IGA – Investigator Global Assessment, NRS – Numeric Rating Scale, SCORAD – Scoring of Atopic DermatitisPokud nedojde z jakékoliv příčiny k dosažení léčebných cílů nebo dojde ke ztrátě účinku stávající léčebné metody, je možné kromě změny léčby optimalizovat léčbu s cílem zvýšení účinnosti stávající léčby [20, 81]. Ta by měla být volena individuálně:
• opětovné posouzení, zhodnocení, vyloučení a případné léčení faktorů přispívajících k nedostatečné léčebné odpovědi nebo adherenci k léčbě;
• zahájení kombinované léčby:
– přidání/zintenzivnění lokální protizánětlivé léčby
– přidání fototerapie k biologické léčbě nebo léčbě inhibitory JAK
– ke zvládnutí akutního vzplanutí lze přidat k léčbě biologiky nebo inhibitory JAK krátkodobě systémové kortikosteroidy
– dupilumab a tralokinumab lze kombinovat se systémovou imunosupresivní léčbou
– inhibitory JAK se nedoporučuje kombinovat s cyklosporinem pro potenciaci imunosuprese
– inhibitory JAK je možné kombinovat s metotrexátem, protože jsou k dispozici bezpečnostní data z revmatologie (upraveno podle [20, 81]).
SYSTÉMOVÁ IMUNOSUPRESIVNÍ LÉČBA
Cyklosporin
V současnosti je cyklosporin (CyA) jediným schváleným konvenčním imunosupresivním lékem na středně těžkou až těžkou AD v Evropě včetně České republiky (ČR). CyA byl poprvé použitý k terapii AD v roce 1991 [65] a schválený k léčbě je od roku 1997 [85].
Charakteritiska cyklosporinu
CyA inhibuje intracelulární dráhu signálu závisející na kalcineurinu, což vede k supresi prozánětlivých cytokinů (např. IL-2 a interferonu gamma) a k souvisejícímu potlačení aktivace T-buněk. Především v T lymfocytech inhibuje tvorbu významných imunologických mediátorů, ale neovlivňuje funkci fagocytů, takže je považovaný za selektivní imunosupresivum. Pacienti léčení CyA jsou méně náchylní k infekcím než při podávání jiných imunosupresiv. CyA nemá myelotoxické ani mutagenní působení, jeho účinek je reverzibilní [14, 63, 65, 86, 88, 90, 92]. CyA spolu s SCS mají rychlý nástup účinku a hodí se zejména k léčbě akutních exacerbací – tabulka 2 [14, 65, 86, 88, 90, 92].
Tab. 2. Systémová imunosupresivní léčba závažné atopické dermatitidy 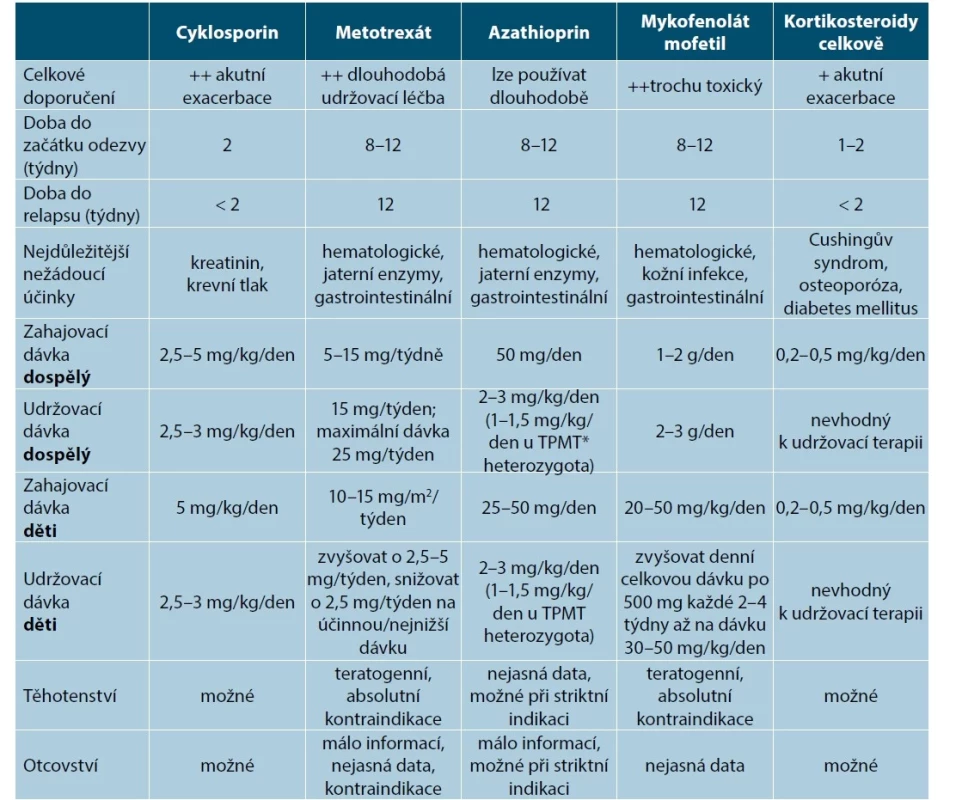
(upraveno podle [88, 92])
*TPMT – thiopurin metyltransferázaÚčinnost cyklosporinu
CyA je velmi účinný v léčbě AD u dospělých i u dětí, snižuje aktivitu onemocnění během dvou až šesti týdnů [6, 65, 90, 92]. Jeho účinnost v porovnání s placebem prokázala metaanalýza 15 randomizovaných kontrolovaných studií (RTC). Po ukončení léčby efekt nebyl dlouhodobý, po osmi týdnech došlo k návratu projevů k výchozím hodnotám. CyA byl účinnější ve srovnání s metotrexátem, prednisolonem, UVA/UVB zářením a intravenózními imunoglobuliny [90, 92] v dosažení remise. Při porovnání intermitentní léčby (osmitýdenní cyklus) cyklosporinu s fototerapií (kombinace UVA/ UVB záření) byli pacienti užívající cyklosporin déle v remisi než při fototerapii [6, 85, 88]. Vyšší dávka CyA (5 mg/kg/den) je spjata s rychlejší a vyšší účinností než nižší dávky (2,5–3 mg/kg/den) [86, 88, 90, 92]. Účinnost CyA byla potvrzená u dětí a dospívajících s AD a u atopické keratokonjunktivitidy [6, 88].
Dávkování cyklosporinu
CyA je indikovaný u pacientů od 16 let se závažnou AD, kteří vyžadují systémovou terapii [6, 63]. Jako „off-label“ může být použitý u dětí do 16 let a těhotných žen (striktní indikace). Počáteční dávka CyA u dětí i dospělých je 2,5–3 mg/kg/den rozdělená do dvou denních dávek, užívá se ve stejnou denní dobu nalačno. Tuto dávku lze při nedostatečné odpovědi do 2 týdnů a při toleranci léčby navýšit na maximální dávku 5 mg/kg/den; není-li ani tato dávka dostatečně účinná, má být léčba ukončena. Při dosažení terapeutické odpovědi se dávka postupně snižuje (o 0,5–1 mg/kg každé 2 týdny) a může se ukončit [6, 63]. Vzhledem k časté intoleranci je v reálné praxi podle shody autorů obvyklá maximální používaná dávka 4 mg/kg/den. Pomalé vysazování léku je spojeno s nižší četností relapsů a delší dobou do relapsu [6]. Při relapsu je možné při předcházející toleranci léčby znovu podat dříve účinnou dávku [6]. Pro léčbu AD se doporučuje krátkodobá či intervalová terapie trvající okolo 3–6 měsíců [85, 88]. Pokud je léčba dobře tolerována, je možná kontinuální léčba nejnižší účinnou dávkou trvající jeden, maximálně dva roky [6, 63]. Dlouhodobá léčba u AD však vzhledem k nežádoucím účinkům (arteriální hypertenze, nefrotoxicita, kožní nemelanomové nádory) není vhodná a nedoporučuje se [6, 63, 85].
Bezpečnost cyklosporinu
Nežádoucí účinky CyA zahrnují nefrotoxicitu, indukci hypertenze, tremor a parestezie, hypertrichózu a další (tabulka 3) [6, 63]. Při léčbě je nutné pečlivě sledovat krevní tlak a funkce ledvin. Riziko nefrotoxicity je zvýšené u dávky nad 5 mg/kg/den, u starších pacientů a při dlouhodobé léčbě [85, 86, 88]. Hladiny CyA se nemusí rutinně během léčby vyšetřovat [88]. Vyšší výskyt infekcí nebo eczema herpeticum při léčbě CyA se ve studii 101 pacientů s AD nepotvrdil [85]. Díky zlepšení kožního nálezu při léčbě CyA se v klinické praxi nepozorují ani častější bakteriální kožní infekce [6]. Přítomnost stafylokokové infekce není kontraindikací léčby, ale infekce by měla být léčena vhodnou antibakteriální léčbou. Aktivní infekce virem herpes simplex by měla odeznít před zahájením léčby CyA, objeví-li se herpes simplex během léčby CyA, není nutné léčbu ukončit, pokud nejde o závažnou infekci [6, 41, 63, 86]. Během léčby CyA může být méně účinná vakcinace, proto je nutné přerušení léčby na 2 týdny před očkováním a 4–6 týdnů po očkování. Očkování živými vakcínami není vhodné a lze je provést až za 3 měsíce po ukončení léčby CyA [6, 41, 63, 77, 86, 90, 92].
Tab. 3. Přehled nežádoucích účinků cyklosporinu 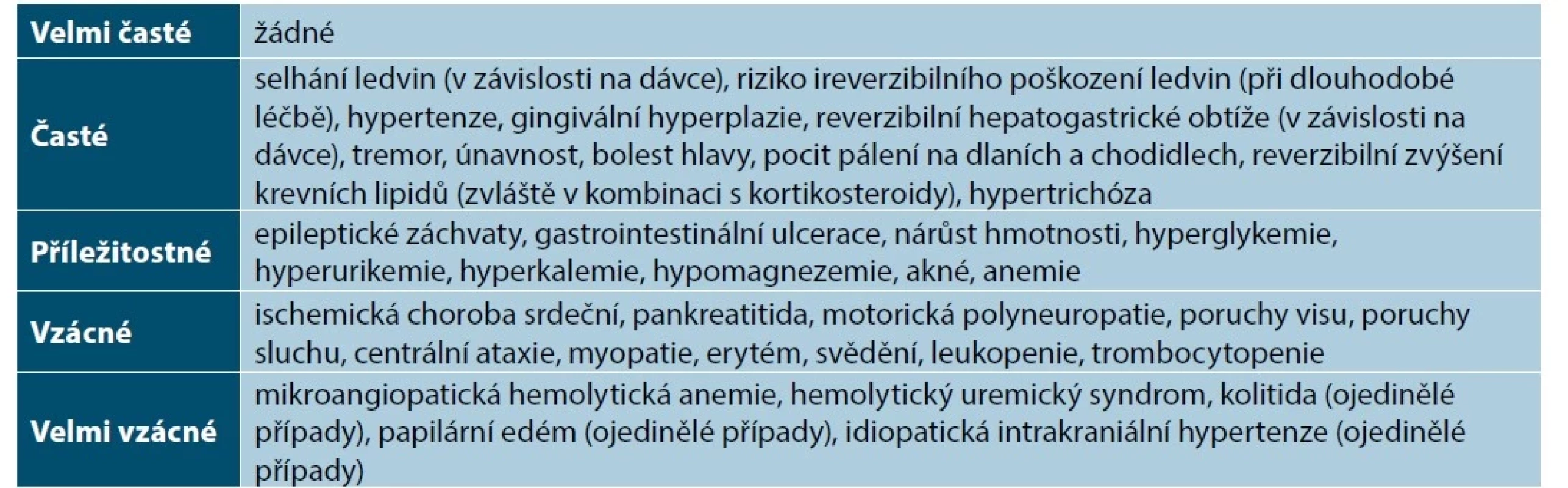
(upraveno podle [14]) Kontraindikace cyklosporinu
Kontraindikacemi CyA jsou hypersenzitivita, kombinace s přípravky obsahujícími třezalku tečkovanou a užívání některých léků, metabolizovanými přes cytochrom P 450, u kterých zvýšené plazmatické koncentrace mohou způsobit závažné anebo život ohrožující stavy (tabulka 4). Pacienty je třeba upozornit na obsah etanolu v kapslích [63].
Tab. 4. Lékové interakce cyklosporinu 
(upraveno podle [14]) Monitoring cyklosporinu
Před zahájením léčby CyA a v pravidelných intervalech je nutné stanovit a sledovat řadu laboratorních parametrů a krevní tlak (tabulka 5). S ohledem na potenciální riziko malignit kůže se pacienti léčení CyA nemají vystavovat přímému slunečnímu záření a musí používat účinnou fotoprotekci [63, 86, 88, 90, 92].
Tab. 5. Doporučené kontroly před zahájením léčby cyklosporinem a v jejím průběhu 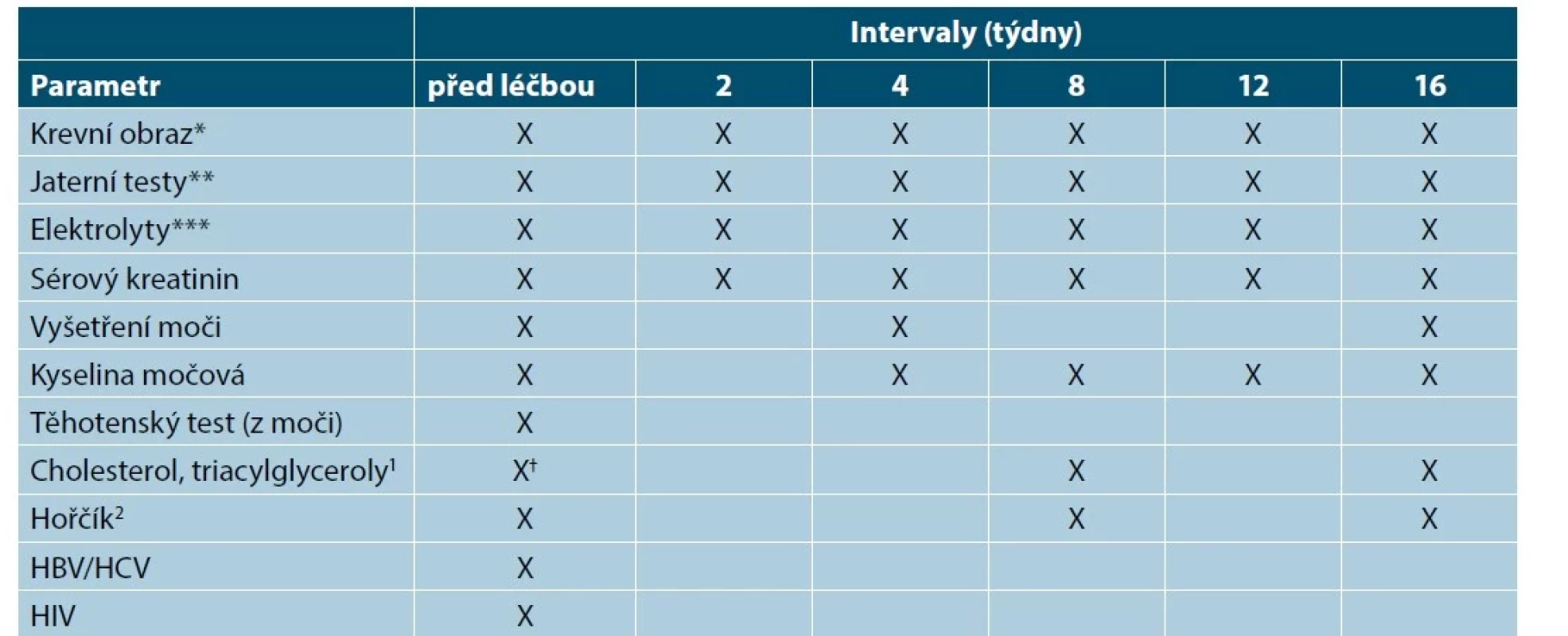
(upraveno podle [14])
Ne všechny testy jsou nezbytné u všech pacientů. Je třeba vzít v úvahu pacientovu anamnézu, míru rizika a pacientovy charakteristiky. Mohou být požadovány další specifické testy podle klinických známek, rizika a expozice.
*Včetně diferenciálního rozpočtu leukocytů
** Transaminázy, ALP (alkalická fosfatáza), GGT (gama-glutamyltransferáza), bilirubin
***Sodík, draslík
1 Doporučuje se dva týdny před léčbou a v den zahájení léčby (nalačno)
2 Je-li indikováno (svalové křeče)
HBV – virus hepatitidy B, HCV – virus hepatitidy C, HIV – Human Immunodeficiency Virus, virus lidské imunitní nedostatečnostiLékové interakce cyklosporinu
Při léčbě CyA je třeba pamatovat na mnohočetné lékové interakce, protože při metabolismu a eliminaci CyA se uplatňuje především systém cytochromu (CY) P450, zejména izoenzym CYP3A4 a P-glykoprotein (viz tab. 4) [63], Doporučení 1.
Doporučení 1. Doporučení k léčbě cyklosporinem
• CyA je možné použít u chronických, závažných případů AD u dospělých a adolescentů od 16 let.
• CyA je možné použít („off-label“) u dětí a adolescentů do 16 let v refrakterních nebo závažných případech AD.
• Pečlivé monitorování nefrotoxicity a dalších závažných nežádoucích účinků u dětí, adolescentů a dospělých je nezbytné.
• Doba trvání léčby CyA se řídí efektem a tolerancí léčby, která je možná v krátkodobém i dlouhodobém režimu.
• Obvyklý doporučený interval léčby je 3–6 měsíců.
• Léčba CyA by neměla při kontinuálním podávání přesáhnout 1 až 2 roky, a to s nejnižší účinnou dávkou.
• Doporučená iniciální dávka CyA je 2,5–3 mg/kg/den rozdělená do dvou denních dávek.
• Maximální dávka CyA je 5 mg/kg/den.
• Po dosažení klinického efektu je doporučená redukce dávky o 0,5–1,0 mg/kg/den každé 2 týdny.
• Hladiny CyA není nutné rutinně sledovat.
• Není dostatek důkazů a klinických studií o účinnosti očkování během léčby CyA, proto se doporučuje přerušení léčby CyA 2 týdny před očkováním a 4–6 týdnů po očkování.
• Kombinace léčby CyA a UV záření se nedoporučuje, během léčby je nutné používat účinnou fotoprotekci.
• CyA je možné kombinovat s biologickou léčbou AD.
(upraveno podle [6, 20, 77, 81, 86, 88, 90, 92])
Metotrexát
Metotrexát (kyselina 4-amino-10-methyllistová, MTX) byl schválen k systémové léčbě psoriázy v roce 1971. Dlouhodobé klinické zkušenosti jsou i u AD [13].
Charakteristika metotrexátu
Nízké dávky MTX snižují proliferaci lymfatických buněk a tento přímý imunosupresivní účinek s následnou redukcí zánětlivých mediátorů vede ke zlepšení zánětu [13].
Účinnost metotrexátu
Účinnost MTX byla doložena pouze několika otevřenými nekontrolovanými studiemi. Účinek nastupuje pomalu, maximální klinická účinnost je dosažena za 8–12 týdnů od zahájení léčby. MTX se považuje za středně účinný, avšak méně účinný než CyA, relativně bezpečný a dobře tolerovaný u dětí i dospělých se závažnou AD [90, 92]. Dlouhodobá studie trvající pět let porovnávala MTX s AZA a neprokázala mezi nimi rozdíly v účinnosti [29].
Dávkování metotrexátu
MTX lze podávat („off-label použití) perorálně nebo subkutánně. U AD se doporučuje podat MTX 1krát týdně u dospělých v dávce mezi 10–15 mg, maximální dávka v refrakterních případech je 25 mg/týdně. U dětí je dávka 0,3–0,4 mg/kg/týden, maximální dávka v dětském věku je 25 mg/týden [92]. Použití u dětí do 3 let se nedoporučuje pro nedostatek informací o účinnosti a bezpečnosti [51]. Po dosažení léčebné odpovědi (za 8–12 týdnů) se doporučuje snížení na nejnižší možnou účinnou dávku nebo ukončení léčby. Pro udržení navozené remise se doporučuje zvýšení frekvence a množství aplikovaného emoliencia a lokální protizánětlivé léčby [51]. MTX se užívá nalačno nebo za 1–2 hodiny po jídle, nejlépe v jedné dávce nebo rozděleně do 2–3 dávek po 12 hodinách. U chronické, závažné AD může být MTX podávaný dlouhodobě. Kvůli lepší snášenlivosti a ke snížení hepatotoxicity se 24 hodin po jeho užití doporučuje podat 1–5 mg kyseliny listové. U starších pacientů je vhodné použít nižší dávky MTX za častějších kontrol renálních parametrů [14, 41, 51, 59, 77, 88, 90, 92].
Bezpečnost metotrexátu
Specifická data o bezpečnosti léčby MTX u AD nejsou k dispozici. Bezpečnostní údaje vycházejí z klinických zkušeností při léčení nízkými dávkami MTX v jiných indikacích, zejména psoriázy [51]. Výskyt a závažnost nežádoucích účinků jsou závislé na dávce a dávkovacím režimu, jejich incidence stoupá při hypalbuminemii a renální insuficienci. K nejčastějším nežádoucím účinkům patří nauzea, únava, elevace transamináz, změny v krevním obraze a další (tabulka 6). Závažnými nežádoucími účinky jsou hepatotoxicita, myelosuprese, popř. intersticiální pneumonie. Kvůli imunosupresivnímu účinku hrozí při léčbě MTX zvýšené riziko infekce a reaktivace latentní tuberkulózy (TBC) či hepatitidy [14, 41, 51, 59, 77, 88, 90, 92]. V průběhu léčby je nutné sledovat symptomy postižení plic (suchý kašel, dušnost, horečka), kontrolovat stav sliznic dutiny ústní a krku, sledovat ostatní užívané léky, vyhnout se hepatotoxickým lékům a alkoholu. U žen v reprodukčním věku je během léčby nezbytná účinná kontracepce. Početí (u žen i mužů) je možné nejdříve za šest měsíců [51] od ukončení terapie MTX. Vzhledem k bezpečnostnímu profilu MTX je před zahájením léčby a před druhou dávkou MTX nutné vyšetřit krevní obraz a diferenciální rozpočet leukocytů k včasnému odhalení možné myelotoxicity. Před zahájením a v pravidelných intervalech je nutné sledovat biochemické a hematologické hodnoty a u žen provádět opakovaně těhotenský test (tabulka 7). V klinicky indikovaných případech je vhodné provést rentgen hrudníku, vyloučit tuberkulózu a intersticiální plicní fibrózu, současně se musí vyloučit hepatitidy typu B a C [41, 51, 59, 77, 88, 90, 92] – Doporučení 2.
Tab. 6. Přehled nežádoucích účinků metotrexátu 
(upraveno podle [14]) Tab. 7. Doporučené kontroly před zahájením léčby metotrexátem a v jejím průběhu 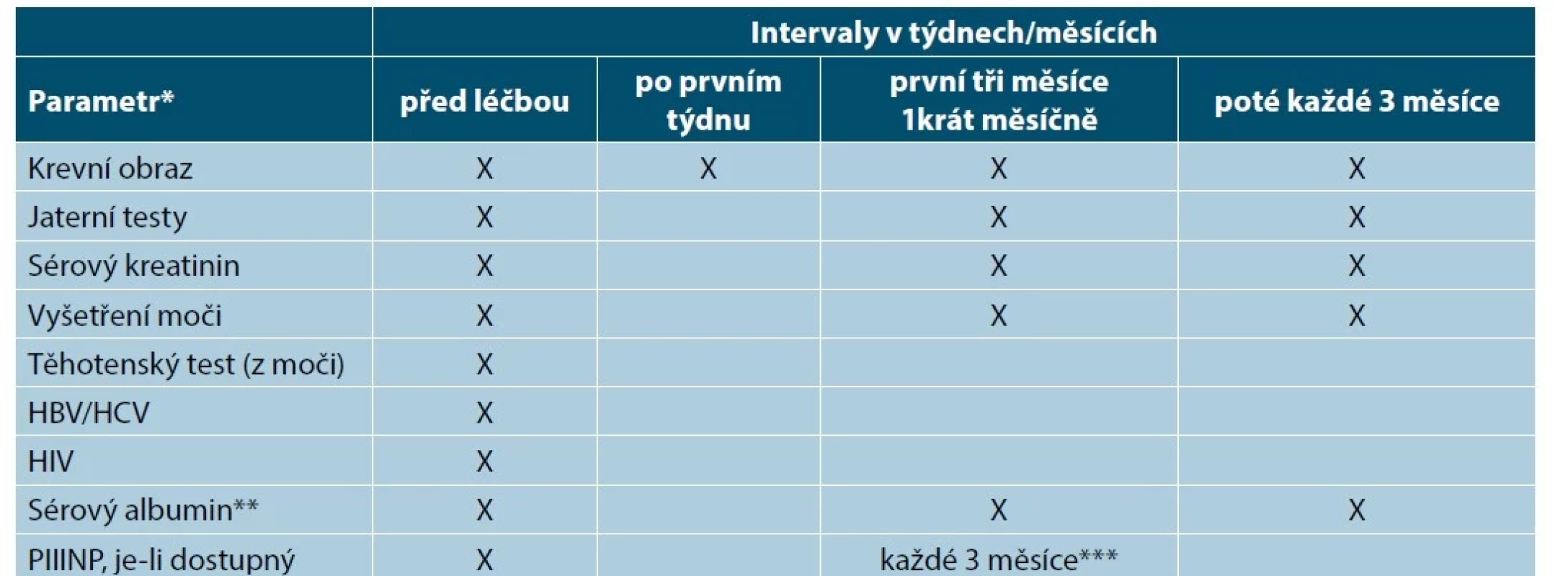
(upraveno podle [14])
Ne všechny testy jsou nezbytné u všech pacientů. Je třeba vzít v úvahu pacientovu anamnézu, míru rizika a pacientovy charakteristiky. Mohou být požadovány další specifické testy podle klinických známek, rizika a expozice.
HBV – virus hepatitidy B, HCV – virus hepatitidy C, HIV – Human Immunodeficiency Virus, virus lidské imunitní nedostatečnosti, PIIINP – peptid prokolagenu III N-terminální
* Jestliže jsou leukocyty < 3,0 (109/l), neutrofily < 1,0 (109/l), trombocyty < 100 (109/l) nebo jaterní enzymy > dvojnásobek výchozí hodnoty, doporučuje se snížit dávku nebo ukončit medikaci.
** Ve vybraných případech (např. při podezření na hypoalbuminemii nebo u pacientů, kteří užívají jiné léky s velkou vazebnou afinitou k sérovému albuminu).
*** Ve vybraných případech biopsie jater, je-li to nezbytné; je třeba o ní uvažovat např. u pacientů s přetrvávající abnormální hodnotou PIIINP (> 4,2 μg/l v nejméně třech vzorcích v průběhu 12 měsíců) či u rizikových pacientů.V červenci 2019 byla Evropskou lékovou agenturou (EMA) vydána doporučení k zamezení potenciálně smrtelných chyb v dávkování MTX při chybném denním užívání. Lék mohou předepisovat pouze lékaři se zkušenostmi s používáním MTX, kteří musí poskytnout pacientovi úplné a jasné pokyny, že se přípravek používá jen jednou týdně. Při každém novém předpisu je nutné pečlivě zkontrolovat, že pacient rozumí, že se lék smí používat jen jednou týdně, spolu s pacientem rozhodnout, který den v týdnu bude lék užívat, informovat jej o příznacích předávkování a poučit o nutnosti vyhledání lékařské pomoci v případě předávkování [51].
Kontraindikace metotrexátu
Kontraindikacemi podání MTX jsou závažná porucha funkce jater či ledvin, závažné infekce a syndromy imunodeficience, předcházející hematologické poruchy, alkoholismus, stomatitidy, afty, aktivní vředová choroba gastroduodenální, současné očkování živými vakcínami a hypersenzitivita na MTX. Nesmí se podávat v těhotenství a během kojení [51].
Doporučení 2. Doporučení k léčbě MTX
• MTX je možné použít („off-label“) k léčbě AD dětí i dospělých.
• Doporučená dávka MTX je 10–15 mg týdně (maximální dávka 25 mg týdně) u dospělých a 0,3–0,4 mg/kg/ týden (maximální dávka 25 mg/týden) u dětí.
• MTX je teratogenní, ženy i muži musí užívat účinnou kontracepci během léčby i šest měsíců po léčbě.
• Před zahájením léčby a před druhou dávkou MTX nutné vyšetřit krevní obraz a diferenciální rozpočet leukocytů.
• Před zahájením a v pravidelných intervalech je nutné sledovat biochemické a hematologické hodnoty.
• V klinicky indikovaných případech je vhodné provést rentgen hrudníku, vyloučit tuberkulózu a intersticiální plicní fibrózu, vyloučit hepatitidy typu B a C.
(upraveno podle [20, 59, 81, 88, 90, 92])
Azathioprin
Azathioprin (AZA) se používá řadu let k léčbě závažné AD dětí a dospělých. Dnes je možné jeho použití zvážit při neúčinnosti, intoleranci či kontraindikaci jiné schválené léčby [85, 88, 90, 92].
Charakteritiska azathioprinu
AZA je purinový analog, který inhibuje syntézu DNA, čímž ovlivňuje vysoce proliferující buňky, jako jsou B a T lymfocyty při zánětlivých nemocech [44, 85, 88, 90, 92].
Účinnost azathioprinu
AZA má pomalý nástup účinku, maximální klinická účinnost je dosažena po 8–12 týdnech. Účinnost se prokázala v placebem kontrolovaných klinických studiích [65] a také ho potvrzuje systematický přehled 43 prací u AD dospělých, dětí a adolescentů. Většina studií byla krátkého trvání, ale k dispozici jsou data, že AZA je účinný a bezpečný až po dobu pěti let [29, 41, 77, 86, 88, 90, 92]. Retrospektivní analýza dětí s AD léčených AZA a mykofenolátem mofetilem (MMF) prokázala zlepšení u více než 60 % pacientů [85]. Krátkodobá 12týdenní studie ukázala stejné zlepšení příznaků AD při léčbě AZA i MTX [41, 77, 86, 88, 90, 92].
Dávkování azathioprinu
U dětí i dospělých („off label“) se používaná dávka pohybuje mezi 1–3 mg/kg/den. U dospělých je možné zahájit léčbu dávkou 2 mg/kg/den rozdělenou do dvou denních dávek po 12 hodinách, lze ho užívat i 1krát denně. Podává se ve formě tablet, nemá se užívát s mlékem nebo mléčnými výrobky [44]. Před zahájením léčby se doporučuje vyšetření aktivity enzymu thiopurin metyltransferázy (TPMT), protože jeho nízká aktivita je spojena s vyšší myelotoxicitou (u heterozygotní mutace je potřeba snížit dávku 1,0 mg/kg/den, u homozygotní mutace by se lék neměl vůbec používat). Pokud tento test není dostupný, počáteční dávka AZA musí být poloviční (1–1,5 mg/kg/den). Nezávisle na aktivitě enzymu se musí dávka snížit na jednu čtvrtinu normální dávky, pokud se současně užívá alopurinol, oxipurinol či thiopurinol (tisopurin) [44, 85]. Při absenci akutních nežádoucích účinků (gastrointestinální obtíže, elevace jaterních enzymů, hematologické abnormality a další) může být dávka po 4 týdnech navýšena na 2–3 mg/kg/den [90, 92]. Po dosažení klinické odezvy (obvykle do 3 měsíců od zahájení) může být dávka AZA snížena nebo léčba ukončena. Pro udržení navozené remise se doporučuje zvýšení frekvence a množství aplikovaného emoliencia a lokální protizánětlivé léčby [44, 65]. AZA lze použít v přísné indikaci v těhotenství [90, 92], podle FDA (Food and Drug Administration – Úřad pro kontrolu potravin a léčiv USA) patří do kategorie D [65].
Bezpečnost azathioprinu
Častými nežádoucími účinky jsou nauzea, zvracení a jiné gastrointestinální symptomy. Méně často se vyskytují bolesti hlavy, hypersenzitivní reakce, zvýšené jaterní enzymy a leukopenie, které vyžadují pravidelné laboratorní sledování [44, 65, 90, 92]. Je třeba myslet na zvýšené riziko infekcí, lymfoproliferativních onemocnění, sarkomů a kožních nemelanomových nádorů [90, 92]. Imunizace živými vakcínami se nedoporučuje po dobu minimálně 3 měsíců po ukončení léčby. V prvních 8 týdnech léčby se doporučuje kontrolovat krevní obraz včetně trombocytů a diferenciální počet leukocytů jednou týdně, později za 1–3 měsíce. Kvůli hepatotoxicitě je nutné sledovat jaterní testy. Fototerapie se při léčbě AZA pro možnou fotokarcinogenitu nedoporučuje, naopak je nutná účinná ochrana před ultrafialovým světlem [65, 84, 85, 90, 92] – Doporučení 3. V retrospektivní analýze dospělých pacientů s AD bylo popsáno vyšší riziko vážných a oportunních infekcí (relativní riziko [RR]: 1,89) v porovnání s MTX a snížené riziko oproti CyA (RR: 0,87) [64], proto by používání AZA v době pandemie covid-19 mělo být omezeno [59].
Kontraindikace azathioprinu
Kontraindikací léčby je hypersenzitivita na AZA, popř. hypersenzitivita na merkaptopurin [44].
Doporučení 3. Doporučení k léčbě azathioprinem
• AZA lze použít („off-label“) k léčbě dospělých i dětských pacientů s AD.
• Před zahájením léčby AZA se doporučuje vyšetřit hladinu/ aktivitu TMPT.
• Doporučená dávka je 1–3 mg/kg/den u dětí i dospělých.
• Při nízké aktivitě TMPT je doporučená počáteční dávka 1 mg/kg/den.
• Počáteční dávka bez vyšetření aktivity TMPT je 50 mg/ den u dospělých a dávku lze pozvolna navyšovat za pečlivého monitorování krevního obrazu a jaterních testů.
• V těhotenství je možné AZA použít pouze ve striktní indikaci.
• AZA se nedoporučuje kombinovat s UV zářením, pacienti musí používat účinnou fotoprotekci.
• Pravidelné monitorování hematologických a biochemických hodnot je nutné (prvních 8 týdnů léčby krevní obraz včetně trombocytů a diferenciální počet leukocytů jednou týdně, poté hematologické a biochemické hodnoty za 1–3 měsíce).
(upraveno podle [88, 90, 92])
Mykofenolát mofetil
Mykofenolát mofetil (MMF) je indikovaný po transplantacích a hrazený i u některých závažných autoimunitních onemocnění [13, 90, 92]. Ve stávajících evropských doporučeních je stále uváděn jako lék, který je možno použít v léčbě atopické dermatitidy, je však, pro nedostatek důkazů, hodnocen neutrálně, tzn. není ani doporučován, ani zatracován [92].
Charakteristika mykofenolát mofetilu
MMF je ester kyseliny mykofenolové, který blokuje biosyntézu purinů inhibicí inosinmonofosfátdehydrogenázy, čímž selektivně ovlivňuje B a T lymfocyty, a může tak být použitý k léčbě zánětlivých nemocí [65, 88, 90, 92].
Účinnost mykofenolát mofetilu
Data o účinnosti MMF u AD jsou nekonzistentní, MMF je možné podat jako alternativní léčbu pro refrakterní AD nebo pro intoleranci systémové léčby 1. linie [90, 92]. MMF má pomalý nástup účinku, je možné ho použít pro udržovací léčbu [(85, 88,92]. Randomizované, kontrolované klinické studie s MMF u AD nebyly provedeny, ale k dispozici jsou četné kazuistiky a otevřené observační studie jak u dospělých, tak u dětí s AD. Studie Haecka et al. [37] ukázala na podobný účinek mykofenolové kyseliny a cyklosporinu, kyselina mykofenolová vykazovala pomalejší, ale následně trvalejší efekt.
Dávkování mykofenolát mofetilu
K léčbě AD dospělých může být MMF použitý („off - -label“) v dávce od 1–3 g denně. MMF lze použít u dětí od 2 let, doporučená dávka je mezi 30–50 mg/kg/den, což odpovídá 600–1200 mg/m2. Podává se ve formě tobolek ve dvou denních dávkách [41, 65, 77, 86, 88, 90, 92].
Bezpečnost mykofenolát mofetilu
Léčba MMF je dobře tolerovaná. V počátku léčby se pozorují bolesti hlavy, mírné gastrointestinální obtíže (nauzea a průjem), hematologické abnormality (snížení počtu leukocytů a trombocytů) a infekce, zejména při dlouhodobé léčbě [85, 88, 90, 92].
Kontraindikace mykofenolát mofetilu
Kontraindikací podání MMF je hypersenzitivita. MMF je teratogenní, je proto kontraindikován u žen v reprodukčním věku, během léčby musí fertilní ženy používat vysoce účinnou antikoncepci, a to ještě šest týdnů po ukončení terapie (Doporučení 4). Léčba u nich nesmí být zahájena bez provedení negativního těhotenského testu. Lék je kontraindikovaný i při kojení [13].
Doporučení 4. Doporučení k léčbě mykofenolát mofetilem
• MMF může být alternativně* použitý („off-label“) k léčbě AD u dětí a dospělých.
• Doporučená dávka u dospělých je 1–3 g/den, u dětí je 30–50 mg/kg/den.
• MMF je teratogenní, ženy a muži musí používat účinnou kontracepci během léčby.
• Pravidelné monitorování hematologických a biochemických hodnot je nezbytné.
*Ve stávajících evropských doporučeních je hodnocen neutrálně, tzn. není ani doporučován, ani zatracován [92].
(upraveno podle [88, 90, 92])
Systémové kortikosteroidy
Systémové kortikosteroidy (SCS) jsou často používané (orálně i parenterálně) v léčbě AD pro rychlý nástup účinku. Při jednorázovém nebo krátkodobém podání (maximálně 2 týdny) jsou vysoce efektivní ve zvládnutí refrakterních nebo rychle recidivujících těžkých forem AD, kdy v kombinaci s intenzivní lokální protizánětlivou léčbou a/nebo s fototerapií pomohou dostat onemocnění pod kontrolu. Svoji roli mají během zahájení a/nebo při úpravě jiné systémové imunosupresivní léčby [10, 41, 65, 86, 88, 90, 92]. Rizikem léčby SCS jsou četné nežádoucí účinky, a proto by se tato léčba měla používat s extrémní opatrností a výhradně pro zcela konkrétní situace [10, 41, 65, 86, 88, 90, 92].
Charakteristika systémových kortikosteroidů
SCS přes aktivovaný glukokortikoidový receptorový komplex potlačují expresi prozánětlivých a zvyšují expresi protizánětlivých proteinů, díky tomu mají silné protizánětlivé vlastnosti [90].
Účinnost systémových kortikosteroidů
Účinnost SCS vychází z klinických zkušeností, protože data z klinických studií u dětí i dospělých, navzdory jejich pravidelnému používání v klinické praxi, jsou velmi limitovaná. Publikováno bylo několik studií u dětí a dospělých s AD, kdy SCS nenavodili dlouhodobou remisi onemocnění a rebound fenomén byl častý [90, 92]. Jediná kontrolovaná klinická studie prokázala nižší účinnost celkově podávaného prednisolonu ve srovnání s CyA u dospělých pacientů s těžkou formou AD. Tato studie byla předčasně ukončena pro relaps onemocnění ve skupině s prednisolonem [41, 65, 86, 88, 92]. Dlouhodobé podávání perorálně nebo často opakované podávání injekční formy SCS se proto nedoporučuje u dospělých ani u dětí [41, 65, 77, 86, 88, 92].
Dávkování systémových kortikosteroidů
U akutního vzplanutí je startovací dávka obvykle 0,5 mg/kg/den. Léčba by měla být ukončena, nebo dávka snížená co nejrychleji [57, 90, 92]. Léčba SCS se nedoporučuje v dlouhodobém ani krátkodobém režimu [90, 92]. SCS se nedoporučují u dětí s AD, pokud to nevyžaduje léčba komorbidit (např. zhoršení, popř. exacerbace astmatu) [65]. SCS je možné podávat v případě další systémové imunosupresivní léčby s emoliencii a pokud je třeba s lokální protizánětlivou léčbou [65, 90, 92].
Bezpečnost systémových kortikosteroidů
Četné nežádoucí účinky jsou dobře známé. Jejich pravidelné monitorování (např. hypertenze, glukózová intolerance, riziko infekcí, glaukom, osteoporóza, adrenální suprese, u dětí potlačení růstu a vývoje a další) je nezbytné (3–6 měsíců podle dávky). Riziko rebound fenoménu a exacerbace projevů při vysazování SCS lze minimalizovat současnou zvýšenou frekvencí aplikace emoliencií a lokální protizánětlivé léčby [90, 92]. Během podávání vysokých dávek SCS je kontraindikované očkování živými vakcínami, pasivní imunizace během terapie je možná, ale odpověď protilátkou je nedostačující [57] – Doporučení 5.
Doporučení 5. Doporučení k léčbě systémovými kortikosteroidy
• Krátkodobá léčba systémovými kortikosteroidy je možná u dospělých pacientů ke zvládnutí akutního vzplanutí těžké AD.
• Startovací dávka by neměla přesáhnout 0,5 mg/kg/den, maximální dávka je 1 mg/kg/den.
• Léčba systémovými kortikosteroidy (perorální, parenterální) v dlouhodobém režimu (nad 2 týdny) se u pacientů s AD nedoporučuje pro riziko četných nežádoucích účinků.
• Podávání systémových kortikosteroidů u dětí se nedoporučuje.
• Pravidelné monitorování hematologických a biochemických hodnot, krevního tlaku je nezbytné.
• Očkování živými vakcínami je během podávání vysokých dávek SCS kontraindikované.
• Při pasivní imunizaci je protilátková odpověď nedostačující.
(upraveno podle [57, 65, 88, 90, 92])
BIOLOGICKÁ LÉČBA ATOPICKÉ DERMATITIDY
Předpokládá se, že patogeneze AD zahrnuje více imunitních cest, které mohou být základem různých podtypů onemocnění. Převaha zánětlivé reakce 2. typu s účastí Th2 lymfocytů a přirozených lymfoidních buněk (ILC2) a jejich cytokinů, zejména interleukinu (IL) 4, IL-5 a IL-13, se v současnosti jeví jako dominantní mechanismus, a proto je zacílení na tuto dráhu logickou terapeutickou strategií [83]. IL-4 zřejmě funguje jako zesilovač zánětlivé reakce 2. typu, zatímco IL-13 je považován za primární efektorový cytokin vyvolávající příznaky onemocnění. IL-4 a IL-13 souvisejí s aktivitou onemocnění AD a blokáda IL-4/13 vede k tlumení zánětlivé reakce [32, 39, 50, 86].
Dostupná biologika či léky zkoumané v klinických studiích lze rozdělit na preparáty cílené na IL-13 a IL-4 či jejich receptory (dupilumab), IL-13 (tralokinumab, lebrikizumab), IL-31 (nemolizumab), IL-22 (fezakinumab), IL-33 (etokimab), thymický stromální lymfopoetin – TSLP (tezepelumab), OX40 (anti-OX40 protilátka) a další léky v klinickém zkoušení. Současně byla pro léčbu AD zkoumána řada biologik používaných v jiných indikacích, obvykle s nedostatečným efektem [2, 7, 41, 52, 68, 77, 85, 86, 88, 90, 92].
Dupilumab
Dupilumab byl schválený v USA v roce 2017 pro léčbu pacientů, jejichž onemocnění není adekvátně kontrolováno lokální léčbou. V Evropě je k dispozici od roku 2019 pro pacienty s AD, kteří jsou kandidáty systémové léčby [24, 52].
Charakteristika dupilumabu
Dupilumab je plně humánní monoklonální protilátka IgG4, která se váže na α podjednotku receptoru IL-4 (IL-4Rα) sdílenou komplexy receptorů IL-4 a IL-13, čímž současně inhibuje signální dráhy IL-4 a IL-13. Současné blokování receptoru typu I (IL-4Rα/γc) a receptoru typu II (IL-4Rα/IL-13Rα) zároveň potlačuje Th2 odpověď závislou na IL-4 a IL-4/IL-13 v hematopoetických a nehematopoetických buňkách [18, 24, 34]. Dupilumab cílí na několik důležitých mechanismů onemocnění v kůži pacientů s AD (včetně defektu kožní bariéry, chronického svědění, změn mikrobiomu a imunopatologického zánětu) [11, 24, 34].
Zkušenosti s léčbou AD dupilumabem potvrdily jeho účinnost a bezpečnost v klinických studiích u dospělé i dětské populace [9, 19, 56, 67, 69, 79, 88, 89, 90, 92].
Účinnost dupilumabu
Účinnost dupilumabu (zlepšení indexů EASI, IGA, SCORAD) byla potvrzená v placebem kontrolovaných studiích SOLO 1, SOLO 2 (hodnoceno v 16. týdnu v monoterapii) u středně závažné a závažné AD [24, 67, 69, 79, 89]. V klinické studii CHRONOS byla povolena lokální terapie kortikosteroidy a byla potvrzená vyšší účinnost než při monoterapii, jak v 16. týdnu, tak i po roce léčby [9, 24, 67, 89]. Léčba dupilumabem vede k významnému snížení svědění, zlepšení kvality spánku a ke zlepšení kvality života, což prokázaly klinické studie [9, 67, 89]. Dupilumab potvrdil účinnost u intrinsických i extrinsických forem AD [90, 92]. Výsledky z uvedených klinických studií jsou zařazeny v tabulce 8.
Tab. 8. Přehled biologických léků v léčbě atopické dermatitidy v klinických studiích 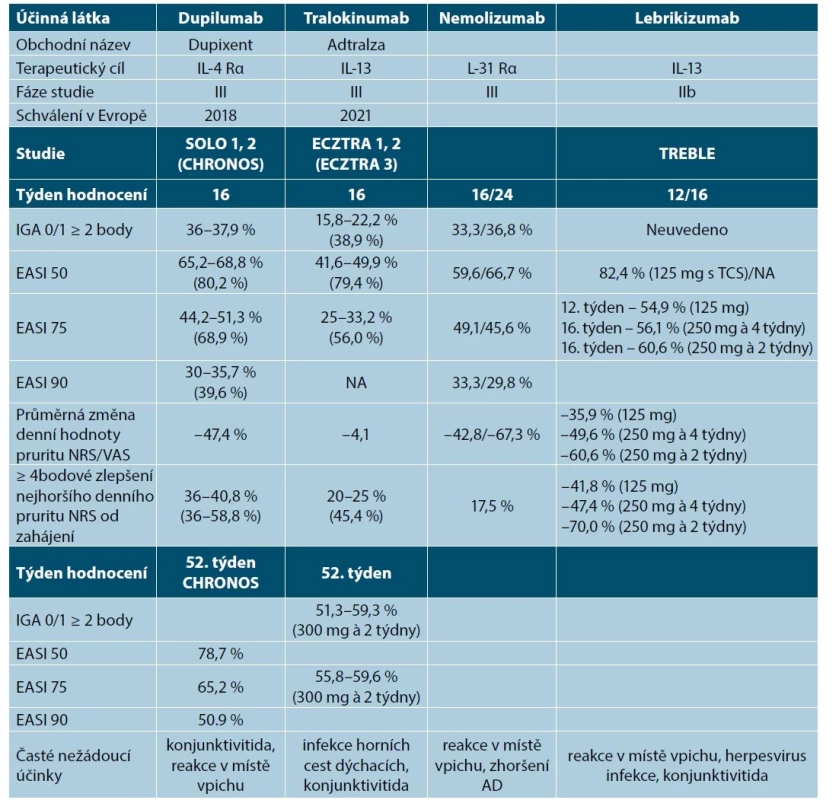
(upraveno podle [9, 24, 45, 46, 66, 68, 79, 88, 90, 92])
AD – atopická dermatitida, EASI – Eczema Area and Severity Index, IGA – Investigator Global Assessment, IL – interleukin, NA – not applicable, neuvedené, NRS – numerická hodnotící škála, TCS – topické kortikosteroidy, VAS – vizuální analogová škálaDávkování dupilumabu
Dupilumab je v ČR lékem registrovaným k terapii středně těžké až těžké AD u dospělých a dětí od 12 let věku, kteří jsou vhodnými kandidáty na systémovou terapii. Současně je indikován k léčbě těžké AD u dětí ve věku od 6 měsíců do 11 let, které jsou kandidáty na systémovou terapii. Podává se subkutánně, u dospělých v dávce 600 mg při zahájení s následným podáním 300 mg každé dva týdny, u dospívajících (12–17 let) s hmotností méně než 60 kg v počáteční dávce 400 mg a následně 200 mg à 2 týdny a při hmotnosti nad 60 kg v dávkování jako u dospělých. U dětí (6–11 let) se podává při hmotnosti od 15 do 60 kg v zahajovací dávce 300 mg, následně 15. den 300 mg a poté 300 mg každé 4 týdny. U této hmotnostní kategorie může být dávka na základě posouzení lékařem zvýšena na 200 mg každé 2 týdny, děti ve věku od 6 měsíců do 5 let při hmotnosti od 5 kg do 15 kg 200 mg v zahajovací dávce a poté 200 mg každé 4 týdny. Při hmotnosti od 15 kg do 30 kg je zahajovací dávka 300 mg a poté 300 mg každé 4 týdny. Účinnost léčby se hodnotí v 16. týdnu a u pacientů, u nichž nebyla zaznamenána žádná odpověď, je třeba zvážit ukončení léčby [24]. Při léčbě dupilumabem je nutné nadále používat emoliencia a podle stavu je možná kombinace s lokálními protizánětlivými léky a/nebo s fototerapií [19, 88, 90, 92]. Kombinace s konvenčními systémovými imunosupresivy je možná v prvních týdnech po zahájení léčby dupilumabem až do dosažení klinického efektu [21].
Kontraindikace dupilumabu
Kontraindikací podání je hypersenzitivita na léčivou látku nebo na kteroukoli pomocnou látku [24].
Bezpečnost dupilumabu
Bezpečnostní profil dupilumabu je příznivý [9, 79] a dupilumab je všeobecně dobře tolerovaný. Nejčastěji hlášeným nežádoucím účinkem během léčby dupilumabem byla konjunktivitida (u 8,6–22,1 % pacientů s AD) při hodnocení 11 klinických studií s dupilumabem [3], s výskytem u 30-40 % podle reálných klinických dat [3, 38, 88, 90, 92]. Většina konjunktivitid je přechodná a lze ji úspěšně zvládnout bez vysazení dupilumabu [3]. Léčba dupilumabem asociované konjunktivitidy zahrnuje umělé slzy pro mírné případy, oční kapky s lokálním 0,1% kortikosteroidem fluorometholonem, masti s inhibitorem kalcineurinu aplikované na oční víčka u středně těžkých projevů a oční kapky nebo masti s obsahem cyklosporinu nebo takrolimu u těžkých forem [4, 80, 87]. Možným nežádoucím projevem při léčbě dupilumabem je výskyt paradoxního erytému hlavy a krku („syndrom červeného obličeje“), který lze léčit lokálními antimykotickými nebo protizánětlivými přípravky [21, 76]. Výsledky otevřené rozšířené studie neprokázaly žádné klinicky významné změny průměrných laboratorních parametrů, což umožňuje dlouhodobé užívání dupilumabu bez pravidelných laboratorních kontrol [5, 86]. Souhrnná data ze sedmi klinických studií s dupilumabem u dospělých se středně těžkou až těžkou AD prokázala podobný výskyt infekcí ve skupině dupilumabu i placeba. Závažné infekce se vyskytovaly méně u léčených dupilumabem (poměr rizika 0,43), stejně jako bakteriální a jiné kožní infekce (poměr rizika 0,44). Přestože výskyt herpesvirových infekcí byl celkově mírně vyšší u dupilumabu než u placeba, klinicky významné herpesvirové infekce (eczema herpeticum, herpes zoster) byly u dupilumabu méně časté (poměr rizika 0,31) a systémové užívání protiinfekčních léků bylo u dupilumabu nižší [26].
Podmínky úhrady dupilumabu
Dupilumab (obchodní název Dupixent) je hrazený dospělým pacientům s těžkou formou AD po selhání (nedostatečné účinnosti) alespoň jednoho ze způsobů systémové imunosupresivní terapie (s výjimkou kortikosteroidů) nebo u pacientů, kteří systémovou terapií nemohou být léčeni z důvodu intolerance nebo kontraindikace. Dupilumab je dále hrazen dětským a dospívajícím pacientům od 6 let věku do dosažení 18 let s těžkou formou atopické dermatitidy, u kterých indikovaná maximalizovaná lokální terapie a dostupné vyšší typy léčby jako je fototerapie nebo balneoterapie nevedly ke kontrole onemocnění. Úspěšnost terapie dětských a dospívajících pacientů od 6 let i dospělých se vyhodnocuje za přesně definovaných podmínek (tabulka 9) [25].
Tab. 9. Dupixent a Adtralza podle SPC [1, 24] ![Dupixent a Adtralza podle SPC [1, 24]](https://www.prolekare.cz/media/cache/resolve/media_object_image_small/media/image_pdf/242b7b09675c18aa66044bab3f282459.jpg)
Pokračování Tabulka 9. 
AD – atopická dermatitida, ATC skupina – Anatomicko-terapeuticko-chemická skupina, EASI – Eczema Area and Severity Index, SPC – Summary of Product Characteristics, SÚKL – Státní ústav pro kontrolu léčiv Doporučení 6. Doporučení k léčbě dupilumabem
• Dupilumab je doporučený k léčbě dětí od 6 měsíců, adolescentů a dospělých se středně závažnou až závažnou AD, kteří jsou kandidáty systémové léčby.
• Léčbu dupilumabem je nutné nadále kombinovat s denní aplikací emoliencií a může se kombinovat s lokální protizánětlivou léčbou, pokud je třeba.
• Dupilumab lze kombinovat s fototerapií.
• Dupilumab lze krátkodobě kombinovat se systémovými kortikosteroidy ke zvládnutí akutního vzplanutí.
• Pravidelné laboratorní kontroly při léčbě dupilumabem nejsou nutné.
(upraveno podle [24, 81, 88, 90, 92])
Tralokinumab
Tralokinumab je lékem schváleným k terapii středně těžké až těžké AD u dospělých, kteří jsou kandidáty systémové léčby [1].
Charakteristika tralokinumabu
Tralokinumab je humánní monoklonální protilátka IgG4, která se specificky váže na IL-13 a způsobuje inhibici jeho interakcí s receptory pro IL-13 [1, 23, 31].
Účinnost tralokinumabu
Účinnost tralokinumabu (zlepšením indexu EASI o 50, resp. 75 %) u středně těžké až těžké AD potvrdily klinické studie ECZTRA v monoterapii v 16. týdnu a 52. týdnu léčby. Vyšší účinnost byla dosažena v kombinaci s lokálními kortikosteroidy [1, 66, 91]. Výsledky z klinických studií jsou uvedeny v tabulce 8.
Dávkování tralokinumabu
Tralokinumab se podává subkutánně v úvodní dávce 600 mg s následným podáním 300 mg každé 2 týdny. U pacientů, kteří se po 16 týdnech léčby zhojí nebo téměř zhojí (IGA 0/1), je možno zvážit podávání každý čtvrtý týden. U pacientů s vysokou tělesnou hmotností (> 100 kg), kteří mají po 16 týdnech léčby kůži zhojenou nebo téměř zhojenou, nemusí být snížení dávky na podávání každý čtvrtý týden vhodné [1] (viz tab. 9).
Bezpečnost tralokinumabu
Bezpečnostní profil tralokinumabu je příznivý a tralokinumab byl v klinických studiích dobře tolerovaný. Nejčastějšími nežádoucími účinky léčby byly infekce horních cest dýchacích, reakce v místě vpichu a konjunktivitida, která se vyskytovala v nižší míře ve srovnání s dupilumabem [1, 66, 72, 90–92]. Léčba tralokinumabem byla spojena s nižší mírou kožních infekcí vyžadujících systémovou léčbu (2,5 % oproti 5,5 % u placeba). Výskyt eczema herpeticum byl u tralokinumabu nižší (0,3 %) oproti placebu (1,5 %) [1, 72]. Popsaný bezpečnostní profil byl konzistentní i při dlouhodobém sledování [66, 91].
Kontraindikace tralokinumabu
Kontraindikací podání je hypersenzitivita na léčivou látku nebo na kteroukoli pomocnou látku [1].
Úhrada ze zdravotního pojištění
Preparát (obchodní název Adtralza) zatím není v ČR dostupný a dosud nebyla stanovená úhrada léčby ze zdravotního pojištění.
Biologika v klinických studiích
K dalším biologikům, která interferují s různými cytokiny a jsou hodnocená v klinických studiích, patří nemolizumab (anti-IL-31Rα), lebrikizumab (anti-IL-13), fezakinumab (anti-IL-22), etokimab (anti-IL-33), tezepelumab (anti-TSLP), anti-OX40 protilátky (protilátka proti ligandu pro OX40 nebo protilátka proti receptoru OX40). Léčiva mohou být dostupná v příštích letech [33, 35, 43, 45, 46, 62, 68, 70, 78, 82, 88, 90, 92].
Lebrikizumab je vysoce afinitní monoklonální protilátka proti IL-13, která zabraňuje tvorbě signálního komplexu heterodimerního receptoru IL-13Rα1/IL-4Rα (75, 82). Výsledky z dostupných klinických studií fáze IIb jsou uvedené v tabulce 8. Ve srovnání s placebem dosáhl lebrikizumab statisticky signifikantní zlepšení v indexech EASI, NRS (svědění, kvalita spánku), POEM a IGA [90, 92]. Dávkovací režim nebyl ještě stanovený, v klinických studiích III. fáze se zkouší dávka 250 mg každé 2 týdny v indukční fázi. V udržovací fázi se testují dávky 250 mg každé 2 nebo 4 týdny. Z nežádoucích účinků byly popsány reakce v místě vpichu, herpesvirové infekce, eozinofilie a konjunktivitidy [31, 68, 90, 92]. U lebrikizumabu se zatím vyskytují méně oční komplikace než u dupilumabu [92].
Nemolizumab je humanizovaná monoklonální protilátka proti α receptoru IL-31 a je určený pro subkutánní podání. V klinické studii fáze II vedl nemolizumab k výraznému snížení intenzity svědění a souběžnému zlepšení klinických příznaků AD, charakterizované indexy EASI, NRS pro svědění a spánek, DLQI (viz tab. 8) [45,46, 62, 74, 88, 92]. Svědění a dermatitida se dále zlepšují při dlouhodobé léčbě [45, 46, 92], proto zejména obtížně léčitelná podskupina pacientů s pruriginózní AD může profitovat při léčbě [46, 74, 78, 90, 92]. Dávkovací režim ještě nebyl stanovený, v klinických studiích byla zkoušená různá dávkovací schémata [45, 46, 74, 78, 90, 92]. Z nežádoucích účinků byly zaznamenané reakce v místě vpichu, muskuloskeletální potíže, infekce horních cest dýchacích, periferní otoky [92].
LÉČBA INHIBITORY JANUSOVÝCH KINÁZ
Charakteristika
Inhibitory Janusových kináz (JAK) jsou malé molekuly, které pronikají do buněk a intracelulárně inhibují fosforylaci JAK/STAT (převaděče signálu a aktivátory transkripce proteinů), čímž blokují tvorbu prozánětlivých cytokinů. Mají imunosupresivní, antiproliferativní a protizánětlivé účinky. Kromě blokády prozánětlivých cytokinů zmírňují chronické svědění a zlepšují kožní bariérové funkce regulací exprese filagrinu [90, 92]. Prozánětlivé cytokiny související s AD (interferon gama [IFN-gama], IL-4, IL-13, IL-31, IL-33, IL-23, IL-22 a IL-17, TSLP) působí patofyziologicky právě prostřednictvím této intracelulární signální dráhy. Po selektivní vazbě cytokinů na odpovídající transmembránový receptor JAK se spustí kaskáda fosforylace vedoucí k vazbě STAT proteinů, které fungují jako transkripční faktory. Po fosforylaci STAT dimerizují, jsou přemístěny do jádra a vážou se na specifické sekvence DNA za účelem regulace transkripce genů ovlivňujících imunitní odpověď. Skupina JAK obsahuje JAK1, JAK2, JAK3 a tyrosinkinázu 2 (TYK2). Skupina STAT obsahuje sedm STAT: STAT1, STAT2, STAT3, STAT4, STAT5A, STAT5B a STAT6. Každý zástupce JAK je prostřednictvím svého receptoru aktivován různými cytokiny a následně spíná odlišné STAT proteiny. Tyto různé kombinace pak určují různý vývoj imunitního procesu. Inhibitory JAK se zaměřují na různé kinázy, což vede k potlačení aktivity jednoho nebo více z těchto cílů. V porovnání s biologickou léčbou, která je zaměřena proti jedinému specifickému cíli, představují inhibitory JAK léčbu nové generace cíleně ovlivňující nitrobuněčný přenos signálu imunitní a zánětlivé odpovědi zprostředkované několika cytokiny najednou. První generace inhibitorů JAK zahrnuje perorální baricitinib, lokální ruxolitinib a delgocitinib, orální i lokální tofacitinib. Do druhé generace inhibitorů JAK patří abrocitinib a upadacitinib, které se označují jako „selektivní inhibitory JAK1“, protože mají vyšší selektivitu k JAK1 [7, 12, 17, 40-42, 86, 92]. V klinickém zkoušení jsou orální gusacitinib a lokální cerdulatinib (duální inhibitory JAK a slezinné tyrosinkinázy [SYK]), brepocitinib, jaktinib a řada dalších JAK inhibitorů [7]. K léčbě AD jsou schváleny abrocitinib, baricitinib a upadacitinib. Inhibitory JAK lze používat k léčbě AD samostatně nebo v kombinaci s lokálními kortikosteroidy či lokálními inhibitory kalcineurinu [15, 54, 60, 90, 92].
Abrocitinib
Abrocitinib je v ČR schválený k léčbě středně těžké až těžké AD u dospělých, kteří jsou kandidáty pro systémovou léčbu [15].
Charakteristika abrocitinibu
Abrocitinib je perorální selektivní inhibitor JAK1 druhé generace [15].
Účinnost abrocitinibu
Účinnost abrocitinibu byla hodnocena v klinických studiích III. fáze JADE-MONO1, JADE MONO2 (12 týdnů, v monoterapii) a JADE-COMPARE (16 týdnů, kombinace s lokální léčbou). Ve 12. týdnu, resp. v 16. týdnu dosáhl obou primárních cílových ukazatelů IGA 0/1 a/ nebo EASI75 významně větsí podíl pacientů při léč bě abrocitinibem (dávka 100 mg, 200 mg) v porovnání s placebem. Ve všech studiích, kde byl použitý abrocitinib, došlo v porovnání s placebem ke zmírnění svědění, zlepšení spánku, kvality života a snížení příznaků úzkosti a depresí [15]. Ve studii COMPARE byla prokázána superiorita abrocitinibu 200 mg v porovnání s dupilumabem ve sledovaných parametrech (IGA 0/1, EASI75, NRS ≥ 4), přičemž svědění se zlepšilo od 4. dne po první dávce (tabulka 10) [15, 40–42, 52, 53, 73, 86, 90, 92].
Tab. 10. Přehled inhibitorů JAK v léčbě atopické dermatitidy v klinických studiích 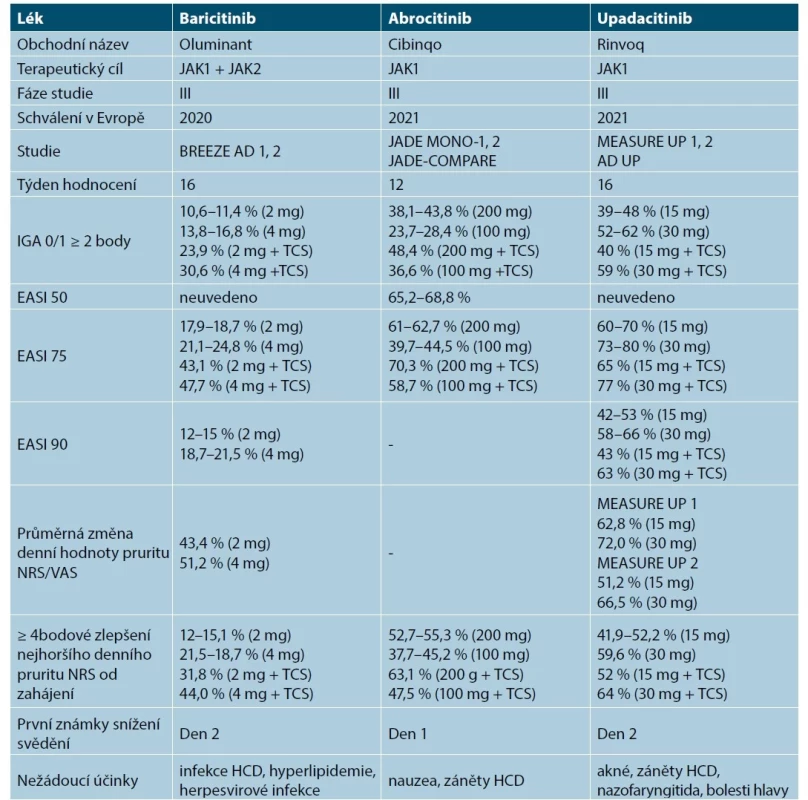
(upraveno podle [15, 27, 52–54, 60, 71, 73, 90, 92])
AD – atopická dermatitida, EASI – Eczema Area and Severity Index, HCD – horní cesty dýchací, IGA – Investigator Global Assessment, JAK inhibitor – inhibitor Janusových kináz, NRS – numerická hodnotící škála, TCS – topické kortikosteroidy, VAS – vizuální analogová škálaDávkování abrocitinibu
Abrocitinib se podává perorálně v tabletách v maximální denní dávce 200 mg jednou denně s jídlem nebo bez jídla, každý den ve stejnou dobu. Zahajovací dávka 100 mg jednou denně se doporučuje u pacientů s vyšším rizikem tromboembolismu (VTE), závažné nežádoucí kardiovaskulární příhody (MACE) a malignity a u pacientů ve věku ≥ 65 let. Během léč by můž e být dávka podle snáš enlivosti a úč innosti sníž ena nebo zvýš ena. Pro udržovací léč bu je nutné zvolit nejnižší úč innou dávku. Abrocitinib lze kombinovat s lokální protizánětlivou léčbou, pokud je to nutné. U pacientů, u kterých se po 24 týdnech léčby nedostaví žádný efekt léčby, je nutno zvážit ukončení léčby abrocitinibem (tabulka 11) [15].
Tab. 11. Oluminant, Cibinqo a Rinvoq podle SPC [15, 54, 60] ![Oluminant, Cibinqo a Rinvoq podle SPC [15, 54, 60]](https://www.prolekare.cz/media/cache/resolve/media_object_image_small/media/image_pdf/02d43492830c897c602272d51ed494b2.jpg)
Pokračování Tabulka 11. 
Poznámka
Riziko malignity – imunomodulační léčivé přípravky mohou zvyšovat riziko maligních onemocnění včetně rizika lymfomu, klinické údaje nejsou pro abrocitinib, baricitinib a upadaticinib dostatečné. V klinických studiích s abrocitinibem byly pozorovány malignity včetně nemelanomových kožních nádorů (NMSC), v klinických studiích s upadacitinibem byly pozorovány malignity. U pacientů se známou malignitou jinou, než je úspěšně léčený NMSC (nemelanomový nádor kůže), je před zahájením léčby nutné zvážit rizika a přínosy této léčby. U pacientů se zvýšeným rizikem kožních nádorů se doporučuje pravidelné vyšetření kůže.
AA – alopecia areata, AD – atopická dermatitida, ALT – alaninaminotransferáza, AS – axiální spondylartritida, AST – aspartátaminotransferáza, CD – Crohnova choroba, CK – kreatinkináza, CYP – cytochrom P, EASI – Eczema Area and Severity Index, MACE – nežádoucí kardiovaskulární příhody, OAT – transportér organických aniontů, PsA – psoriatická artritida, RA – revmatoidní artritida, SPC – summary of product characteristics, UC – ulcerózní kolitida, TBC – tuberkulóza, VTE – žilní tromboembolieBezpečnost abrocitinibu
Nejčastějšími nežádoucími účinky hlášenými ve studiích byly nauzea, průjmy, bolesti hlavy, záněty horních cest dýchacích, nazofaryngitida, přechodná trombocytopenie a akné. Gastrointestinální potíže (nauzea, zvracení) byly jediné nežádoucí účinky související s léčbou. Ze závažných nežádoucích účinků byly hlášené ojediněle plicní embolie, eczema herpeticum a náhlá srdeční příhoda končící úmrtím, která ale neměla souvislost s léčbou (viz tab. 11) [15, 27, 40-42, 52, 53, 73, 86, 90, 92].
Kontraindikace abrocitinibu
Kontraindikacemi k nasazení abrocitinibu je hypersenzitivita na léč ivou látku nebo na kteroukoli pomocnou látku. Léčba nesmí být zahájena při výskytu aktivní závažné systémové infekce včetně tuberkulózy, při těžké poruše funkce jater, v těhotenství a během kojení [15].
Podmínky úhrady
Abrocitinib (obchodní název Cibinqo) je hrazený dospělým pacientům s těžkou formou AD po selhání (nedostatečné účinnosti) alespoň jednoho ze způsobů konvenční systémové imunosupresivní terapie (s výjimkou kortikosteroidů) nebo u pacientů, kteří systémovou terapií nemohou být léčeni z důvodu intolerance nebo kontraindikace. Úspěšnost terapie se vyhodnotí v týdnech 16 a 24 od zahájení léčby a dále nejméně každých 24 týdnů. Pokud nedojde zlepšení ve stanovených parametrech, má být léčba ukončená (nedosažení EASI 50 v týdnu 16, nedosažení EASI 75 v týdnu 24, v případě výskytu nezvládnutelných nežádoucích účinků, při nedostatečné adherenci na terapii, při poklesu účinnosti pod EASI 50 při dvou po sobě následujících kontrolách). Z prostředků veřejného zdravotního pojištění je hrazena jedna tableta o síle 200 mg, nebo 100 mg, nebo 50 mg denně [16].
Baricitinib
Baricitinib je v ČR schválený k léčbě středně těžké až těžké AD u dospělých, kteří jsou kandidáty pro systémovou léčbu [54].
Charakteristika baricitinibu
Baricitinib je perorální inhibitor JAK první generace (JAK1, JAK2) [54].
Účinnost baricitinibu
Baricitinib se podává perorálně v tabletách v dávce 2 mg nebo 4 mg v jedné denní dávce. Doporučená denní dávka baricitinibu je 4 mg. Dávka 2 mg denně je doporučena pro pacienty s vyšším rizikem VTE, MACE a malignit, pro pacienty ≥ 65 let a je vhodná pro pacienty s chronickými nebo recidivujícími infekcemi v anamnéze. Dávku 2 mg jednou denně lze rovněž zváž it u pacientů, u kterých bylo dosaženo trvalé kontroly aktivity onemocnění při dávce 4 mg jednou denně [54]. Baricitinib lze kombinovat s lokální protizánětlivou léčbou. U pacientů, u nichž se po 8 týdnech léč by neprokáž e žá dný léč ebný pří nos, je třeba zváž it ukončení léč by (viz tab. 11) [54].
Dávkování baricitinibu
Baricitinib se podává perorálně v tabletách v dávce 2 mg nebo 4 mg v jedné denní dávce. Doporučená denní dávka baricitinibu je 4 mg. Dávka 2 mg denně je doporučena pro pacienty s vyšším rizikem VTE, MACE a malignit a je vhodná pro pacienty s chronickými nebo recidivujícími infekcemi v anamnéze. Dávku 2 mg jednou denně lze rovněž zváž it u pacientů, u kterých bylo dosaženo trvalé kontroly aktivity onemocnění při dávce 4 mg jednou denně [54]. Baricitinib lze kombinovat s lokální protizánětlivou léčbou. U pacientů, u nichž se po 8 týdnech léč by neprokáž e žá dný léč ebný pří - nos, je třeba zváž it ukončení léč by (viz tab. 11) [54].
Bezpečnost baricitinibu
Nejčastěji hlášenými nežádoucími účinky byly hypercholesterolemie, infekce horních cest dýchacích, bolesti hlavy a asymptomatické zvýšení hladiny sérové kreatinkinázy. Hlášenými infekcemi byly herpes simplex a infekce močových cest (viz tab. 11). Nebyla zaznamenána žádná úmrtí, žádné případy hluboké žilní trombózy, plicní embolie, kardiovaskulární příhody, tuberkulóza, gastrointestinální perforace nebo významné hematologické abnormality [52–54, 71, 90, 92].
Podmínky úhrady
Baricitinib (obchodní název Olumiant) je hrazený dospělým pacientům s těž kou formou AD po selhání (nedostatečné úč innosti) alespoň jednoho ze způsobů konvenční systémové imunosupresivní terapie (s výjimkou kortikosteroidů) nebo u pacientů, kteří systémovou terapií nemohou být léč eni z důvodu intolerance nebo kontraindikace. Úspěš nost terapie u dospělých se vyhodnotí po 8, 16 a 24 týdnech od zahájení léč by a dále nejméně každých 24 týdnů . Pokud nedojde ke zlepšení ve stanovených parametrech, má být léčba ukončená (nedosažení EASI 50 v týdnu 16, nedosažení EASI 75 v týdnu 24, v případě výskytu nezvládnutelných nežádoucích účinků, při nedostatečné adherenci na terapii, při poklesu účinnosti pod EASI 50 při dvou po sobě následujících kontrolách) [55]).
Upadacitinib
Upadacitinib je v ČR schválený k terapii středně těžké až těžké AD u dospělých a dospívajících ve věku od 12 let, kteří jsou kandidáty pro systémovou léčbu [60].
Charakteristika upadacitinibu
Upadacitinib je perorální selektivní inhibitor JAK1 druhé generace [60].
Účinnost upadacitinibu
Účinnost upadacitinibu byla hodnocena v klinických studiích III. fáze MEASURE UP 1, MEASURE UP 2 (v monoterapii) a AD UP (s lokálními kortikosteroidy) u pacientů od 12 let se středně těžkou až těžkou AD. Primárních cílových parametrů v 16. týdnu (vIGA-AD 0/1, EASI 75, zlepšení NRS o ≥ 4 body) dosáhl výrazně vyšš í podíl pacientů léč ených upadacitinibem 15 mg nebo 30 mg v porovnání s placebem. Ústup svědění byl zaznamenaný již 3. den (15 mg), resp. 2. den léčby (30 mg) u pacientů léčených upadacitinibem (viz tab. 10) [17, 27, 36, 41, 42, 52, 53, 60, 86, 88, 90, 92]. V klinické studii AD UP při podávání upadacitinibu s lokálními kortikosteroidy byly výsledky podobné těm, kterých bylo dosaženo v monoterapii s upadacitinibem (viz tab. 10) [58]. V přímém srovnání s dupilumabem dosáhlo EASI 75 71 % pacientů na upadacitinibu a 61,1 % pacientů na dupilumabu. Upadacitinib prokázal superioritu ve škálách NRS v týdnu 1, EASI 75 v týdnu 2 a EASI 100 v týdnu 16 [60, 90, 92].
Dávkování upadacitinibu
U dospělých pacientů je doporučená dávka upadacitinibu 15 mg nebo 30 mg jednou denně. Dávka 30 mg jednou denně je vhodná u pacientů s vysokou zátěží způsobenou nemocí, u kterých není vyšší riziko VTE, MACE a malignit nebo u pacientů s nedostatečnou léč ebnou odpovědí na dávku 15 mg. Dávka 15 mg je doporučována u pacientů s vyšším rizikem VTE, MACE a malignit. U pacientů ve věku ≥ 65 let je doporučená dávka 15 mg jednou denně. Pro udržovací léč bu má být zvolená nejnižší úč inná dávka. U dospívajících ve věku od 12–17 let s tělesnou hmotností nejméně 30 kg je doporučená dávka upadacitinibu 15 mg jednou denně. Upadacitinib lze používat s lokální protizánětlivou léčbou. U pacientů, u kterých se neprojeví terapeutický efekt po 12 týdnech léčby, je nutné zvážit ukončení léčby upadacitinibem (viz tab. 11) [60].
Bezpečnost upadacitinibu
Nejčastějšími nežádoucími účinky upadacitinibu byly akné, infekce horních cest dýchacích, nazofaryngitida, bolesti hlavy, elevace sérové kreatinkinázy a relaps AD [60].
Kontraindikace
Upadacitinib je kontraindikovaný v případě hypersenzitivity na účinnou látku nebo na kteroukoli pomocnou látku. Léčba nesmí být zahájena při výskytu aktivní tuberkulózy nebo aktivní závažné infekce, při těžké poruše funkce jater, v těhotenství a během kojení [60].
Podmínky úhrady
Úhrada léčby ze zdravotního pojištění byla stanovená od 1. 3. 2023. Upadacitinib je hrazený dospělým pacientům s těž kou formou atopické dermatitidy po selhání (nedostatečné úč innosti) alespoň jednoho ze způsobů konvenční systémové imunosupresivní terapie (s výjimkou kortikosteroidů) nebo u pacientů, kteří systémovou terapií nemohou být léč eni z důvodu intolerance nebo kontraindikace. Upadacitinib je dále hrazený dospívajícím pacientům od 12 let věku do dosažení 18 let s těž kou formou atopické dermatitidy, u kterých indikovaná maximalizovaná lokální terapie a dostupné vyšš í typy léč by, jako je fototerapie nebo balneoterapie nevedly ke kontrole onemocnění [61]. Úspěš nost terapie adolescentů od 12 let i dospělých se vyhodnotí po 16 a po 24 týdnech od zahájení léč - by a dále nejméně každých 24 týdnů . Pokud nedojde ke zlepšení ve stanovených parametrech (nedosažení nejméně EASI 50 v týdnu 16, nedosažení nejméně EASI 75 v týdnu 24, v pří padě výskytu nezvládnutelných nežá doucích úč inků , při nedostatečné adherenci na terapii, při poklesu úč innosti pod EASI 50 při dvou po sobě následujících kontrolách), má být léčba ukončena. U již léč ených dospívajících pacientů pokračuje léč ba upadacitinibem po dovršení 18 let věku bez podmínky předchozí konvenční systémové terapie [61].
Bezpečnost inhibitorů JAK ve zvláštních situacích
Inhibitory JAK a tuberkulóza
Před zahájením léčby perorálními inhibitory JAK (abrocitinibem, baricitinibem, upadacitinibem) musí být u pacienta provedeno screeningové vyšetření na tuberkulózu. Léky nesmí být podávány pacientům s aktivní tuberkulózou. U pacientů s dříve neléčenou latentní tuberkulózou nebo u pacientů s přítomností rizikových faktorů infekce je nutné před zahájením léčby perorálními inhibitory JAK zvážit podání protituberkulózní léčby a je doporučena konzultace s lékařem se zkušenostmi s léčbou tuberkulózy. Všichni pacienti mají být pravidelně vyšetřováni a sledováni v průběhu léčby, zda se u nich nevyskytují známky a příznaky tuberkulózy (tabulka 12) [12, 15, 17, 27, 40–42, 52–54, 60, 86, 88, 90, 92].
Tab. 12. Monitorování léčby inhibitory JAK 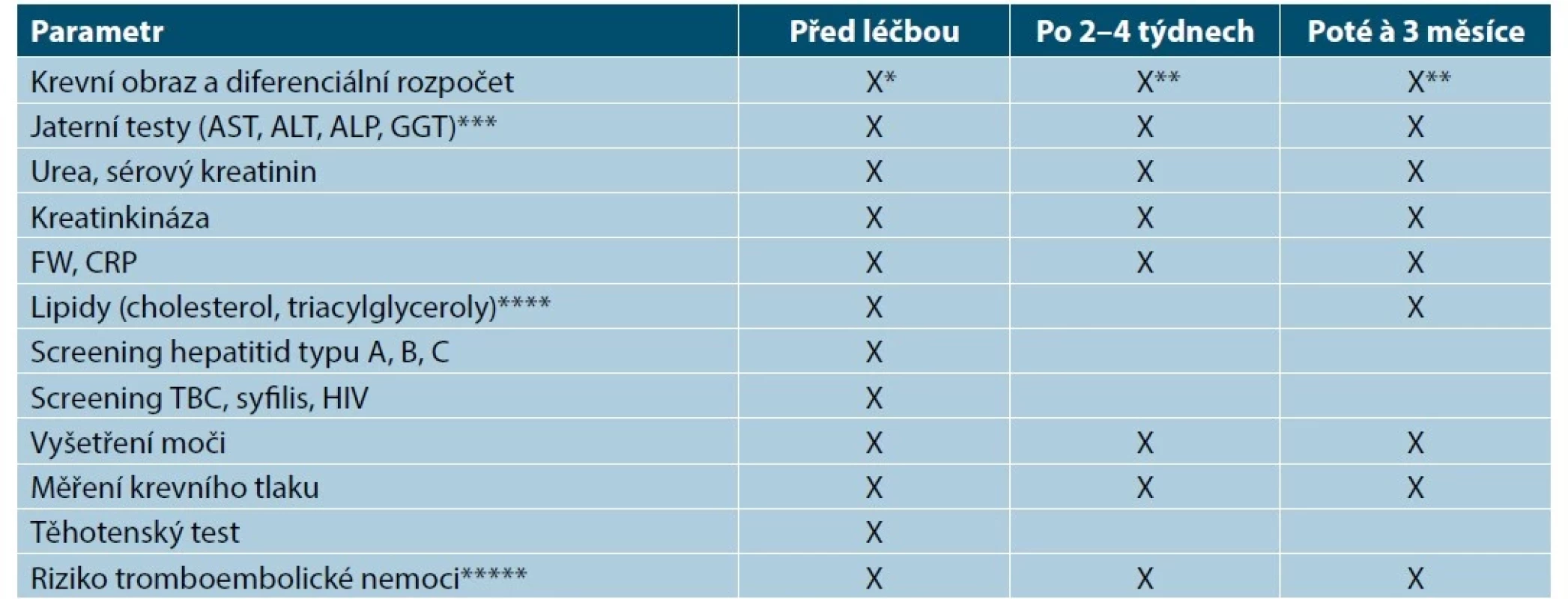
(upraveno podle [15, 54, 60])
ALT – alaninaminotransferáza, ALP – alkalická fosfatáza, AST – aspartátaminotransferáza, CRP – C-reaktivní protein, FW – sedimentace erytrocytů, GGT – gama-glutamyltransferáza, HIV – human immunodeficiency virus, virus lidské imunitní nedostatečnosti
* Léčba abrocitinibem nemá být zahájena u pacientů s počtem trombocytů < 150 x 103/mm3, s absolutním počtem lymfocytů (ALC) < 0,5 x 109/l, s absolutním počtem neutrofilů (ANC) < 1,2 x 109/l, s hodnotou hemoglobinu < 100 g/l. Léčba upadacitibem a baricitinibem nemá být zahájena u pacientů s ALC < 0,5 x 109/l, s ANC < 1 x× 109/l, s hodnotou hemoglobinu < 80 g/l.
** Pokud je ANC < 1 x 109/l nebo ALC < 0,5 x 109/l nebo hodnota hemoglobinu < 80 g/l, má být léčba přerušena a může být znovu zahájena, jakmile se parametry vrátí nad uvedené hodnoty. Pokud je při léčbě abrocitinibem počet trombocytů < 50 × 109/l, je nutné ukončit léčbu.
*** Je-li zvýšená hodnota ALT nebo AST, existuje podezření na polékové poškození jater, léčba upadacitinibem/baricitinibem má být přerušena, dokud tato diagnóza není vyloučena.
**** V případě abnormáních hodnot mají být pacienti léčeni podle mezinárodních klinických postupů pro hyperlipidemie.
***** Pacientům s vysokým rizikem hluboké žilní trombózy/plicní embolie mají být upadacitinib/abrocitinib/baricitinib podávány se zvýšenou opatrností. Mezi rizikové faktory jsou zahrnuty vyšší věk, obezita, hluboká žilní trombóza/plicní embolie v anamnéze, velká operace, kterou pacient podstupuje, a prodloužená imobilizace, u žen používání hormonální antikoncepce nebo hormonální substituční léčby. Pokud se vyskytnou klinické příznaky hluboké žilní trombózy/plicní embolie, léčba upadacitinibem/baricitinibem má být ukončena a pacienti mají být neprodleně vyšetřeni s následnou odpovídající léčbou.Inhibitory JAK a virové hepatitidy
U všech pacientů před zahájením léčby perorálními inhibitory JAK je třeba provést screening virových hepatitid typu B a C a musí být pravidelně monitorována reaktivace infekce. U pacientů s prokázanou aktivní hepatitidou B nebo C by se léčba neměla zahajovat. U pacientů s nově zjištěnými pozitivními testy na protilátky proti hepatitidě typu B a C má být konzultován hepatolog, zda je odůvodněné přerušení léčby (viz tab. 12) [12, 15, 17, 27, 40–42, 52–54, 60, 86, 88, 90, 92].
Inhibitory JAK a ostatní infekce
Pacienti musí být před léčbou, během léčby a po léčbě pečlivě monitorováni z hlediska vývoje známek a příznaků infekce. U pacientů s aktivními, chronickými nebo recidivujícími infekcemi je nutno před zahájením léčby inhibitory JAK pečlivě zvážit její rizika a přínosy (viz tab. 12). Objevíli se infekce včetně lokální během léčby, musí být pacient pečlivě sledován, a pokud neodpovídá na standardní léčbu, je třeba léčbu dočasně přerušit. Léčba nesmí být znovu zahájena před odezněním infekce. Pokud se objeví herpes zoster, doporučuje se dočasné přerušení léčby až do odeznění projevů [12, 15, 17, 27, 40–42, 52–54, 60, 86, 88, 90, 92].
Inhibitory JAK u rizikové populace
Výsledky klinické studie bezpečnosti tofacitinibu (inhibitor pan-JAK) v léčbě revmatoidní artritidy ukázaly zvýšené riziko trombózy, plicní embolie a úmrtí [95]. Evropská agentura pro léčivé přípravky (EMA) proto přehodnotila bezpečnosti léčivých přípravků obsahujících inhibitory JAK používaných na léčbu závažných chronických zánětlivých onemocnění (revmatoidní artritida, psoriatická artritida, juvenilní idiopatická artritida, ankylozující spondylitida, ulcerózní kolitida, Grohnova choroba a atopická dermatitida), EMA vydala závěrečné doporučení ke zvážení přínosů a rizik pro konkrétní pacienty před zahájením léčby JAK inhibitory [94] a dospěla k závěru, že identifikovaná rizika se týkají všech inhibitorů JAK schválených k léčbě chronických zánětlivých poruch. Tyto přípravky mají být používány u následujících skupin pacientů pouze v případech, kdy nejsou k dispozici žádné vhodné alternativy léčby: pacienti ve věku od 65 let; pacienti, kteří jsou současnými nebo bývalými dlouhodobými kuřáky; pacienti s anamnézou aterosklerotických kardiovaskulárních onemocnění nebo s jinými kardiovaskulárními rizikovými faktory (současní nebo bývalí dlouholetí kuřáci), nebo pacienti, kteří mají rizikové faktory pro malignity (např. malignita v současnosti nebo malignita v anamnéze). Opatrnost se také doporučuje u pacientů se známými rizikovými faktory pro hlubokou žilní trombózu.
Rizikové faktory zahrnují vyšší věk, obezitu, hlubokou žilní trombózu/plicní embolii v anamnéze, velkou operaci a prodlouženou imobilizaci, používání hormonální antikoncepce nebo hormonální substituční léčbu [94, 95]. V případě použití inhibitorů JAK u pacientů s těmito rizikovými faktory lze doporučit nižší dávku v závislosti na použitém léku, indikaci a specifickém rizikovém faktoru. U pacientů léčených JAK inhibitory, zejména pokud mají zvýšené riziko kožních malignit, jsou doporučena pravidelná dermatologická vyšetření za účelem kontroly kožních malignit [94], Doporučení 7.
Doporučení 7. Doporučení k léčbě inhibitory JAK
• Inhibitory JAK jsou doporučeny k léčbě dospělých, v případě upadacitinibu k léčbě dospívajících ve věku od 12 let se středně závažnou až závažnou AD, kteří jsou kandidáty pro systémovou léčbu.
• Léčbu inhibitory JAK je nutné nadále kombinovat s denní aplikací emoliencií a může se kombinovat s lokální protizánětlivou léčbou, pokud je třeba.
• JAK inhibitory lze kombinovat s fototerapií.
• JAK inhibitory lze kombinovat krátkodobě se systémovými kortikosteroidy při akutním vzplanutí AD.
• JAK inhibitory lze kombinovat s metotrexátem.
• Před léčbou a během léčby inhibitory JAK je nutné pravidelně provádět laboratorní kontroly a vyloučit aktivní infekce.
• U rizikových skupin pacientů je léčba JAK inhibitory možná pouze v případech, kdy nejsou k dispozici žádné vhodné alternativy léčby. Doporučené jsou nižší dávky v závislosti na použitém léku.
(upraveno podle [15, 54, 60, 81, 90, 92, 94])
ZÁVĚR
Atopická dermatitida je závažné chronické heterogenní onemocnění provázené intenzivním svěděním. Má pestrý klinický obraz, je doprovázeno řadou různých komorbidit a má výrazný dopad na kvalitu života pacientů. Léčba AD musí být komplexní, vyžaduje dodržování režimových opatření, intenzivní lokální a často i celkovou léčbu. Výběr léčebné metody závisí na závažnosti onemocnění, přidružených chorobách a dalších specifikách u konkrétního pacienta. Doporučení k systémové léčbě AD shrnuje aktuálně dostupné poznatky o systémové konvenční, biologické a cílené léčbě. Uvádí indikační kritéria pro zahájení celkové léčby AD, stanovuje iniciální, racionální a optimální léčebné cíle. Při používání jakékoliv celkové léčby AD je nezbytné nadále používat lokální léčbu (základní a protizánětlivou), která je primární léčbou AD. Od pacientů je třeba vyžadovat dodržování preventivních a režimových opatření, která je nutné opakovaně pacientům vysvětlovat a připomínat. V léčbě je nezbytné (efektivně a včas) využívat celé terapeutické spektrum ke zvládnutí onemocnění vedoucí ke zlepšení kvality života pacientů, zabránění vzniku komplikací a rozvoje komorbidit.
Prohlášení o střetu zájmů
1AM přednáší pro firmy Abbvie, Amgen, Eli Lilly, Herbacos Recordati, LEO Pharma, Novartis, Pfizer, Sanofi, UCB, Pierre Fabre, je investigátorem klinických studií Abbvie, Eli Lilly, UCB, LEO Pharma je členem poradního sboru Abbvie, Allmiral, Eli Lilly, LEO Pharma, Novartis, Pfizer, Sanofi a UCB.
2PC přednáší pro firmy Abbvie, Amgen, Eli Lilly, Janssen - Cilag, LEO Pharma, Novartis, Pfizer, Sanofi, UCB, je investigátorem klinických studií Abbvie, Janssen, Novartis, LEO Pharma, je členem poradního sboru Abbvie, Allmiral, Eli Lilly, LEO Pharma, Novartis, Pfizer, Sanofi a UCB.
3JF přednáší pro firmy Abbvie, Eli Lilly, Janssen-Cilag, LEO Pharma, Novartis, Sanofi, je subinvestigátorem klinických studií pro firmy Abbvie, Amgen, Janssen, Novartis, LEO Pharma, je členem poradního sboru pro firmy Abbvie, Allmiral, Amgen, Eli Lilly, LEO Pharma, Novartis.
4SG přednáší pro firmy Abbvie, Amgen, Eli Lilly, Janssen, LEO Pharma, Novartis, Pfizer, Sanofi, UCB, je investigátorem klinických studií Abbvie, Janssen, Novartis, LEO Pharma, Sanofi, El-lilly, je členem poradního sboru Abbvie, Eli Lilly, LEO Pharma, Novartis, Pfizer, Sanofi a UCB.
3MK přednáší pro firmy Abbvie, Amgen, Eli Lilly, Janssen-Cilag, LEO Pharma, Novartis, Pfizer, Sanofi, UCB, je investigátorem klinických studií Abbvie, Janssen-Cilag, Novartis, LEO Pharma, je členem poradního sboru Abbvie, Allmiral, Eli Lilly, LEO Pharma, Novartis, Pfizer, Sanofi a UCB.
Do redakce došlo dne 28. 4. 2023.
Adresa pro korespondenci:
MUDr. Alena Machovcová, Ph.D., MBA
Dermatovenerologické oddělení FN v Motole
150 06 Praha 5
e-mail: alena.machovcova@fnmotol.cz
Zdroje
1. ADTRALZA. https://www.ema.europa.eu/en/documents/product-information/adtralza-epar-product-information_cs.pdf, dostupné 1. 1. 2022.
2. AGACHE, I., AKDIS, CA., AKDIS, M. et al. EAACI Biologicals Guidelines – dupilumab for children and adults with moderate-to-severe atopic dermatitis. Allergy, 2021, 4, p. 988–1009.
3. AKINLADE, B., GUTTMAN-YASSKY, E., BRUIN-WELLER, M. et al. Conjunctivitis in dupilumab clinical trials. Br J Dermatol, 2019, 3, p. 459–473.
4. ASZODI, N., THURAU, S., SEEGRABER, M. et al. Management of dupilumab-associated conjunctivitis in atopic dermatitis. J Dtsch Dermatol Ges, 2019, 17, p. 488–491.
5. BECK, LA., THACI, D., DELEURAN, M. et al. Laboratory safety of dupilumab for up to 3 years in adults with moderate-to-severe atopic dermatitis: results from an open-label extension study. J Dermatolog Treat, 2021, 8, p. 1–9.
6. BERTH-JONES, J., EXTON, L. S., LADOYANNI, E. et al. British Association of Dermatologists guidelines for the safe and effective prescribing of oral ciclosporin in dermatology 2018. Br J Dermatol, 2019, 180, p. 1312–1338.
7. BIEBER, T. Atopic dermatitis: an expanding therapeutic pipeline for a complex disease. Nat Rev Drug Discov, 2022, 21, p. 21–40.
8. BILSBOROUGH, J., LEUNG, DY., MAURER, M. et al. IL-31 is associated with cutaneous lymphocyte antigen positive skin homing T cells in patients with atopic dermatitis. J Allergy Clin Immunol, 2006, 2, p. 418–425.
9. BLAUVELT, A., DE BRUIN-WELLER, M., GOODERHAM, M. et al. Long-term management of moderate-to-severe atopic dermatitis with dupilumab and concomitant topical corticosteroids (LIBERTY AD CHRONOS): a 1-year, randomised, double-blinded, placebo-controlled, phase 3 trial. Lancet, 2017, 10086, p. 2287–2303.
10. BOGUNIEWICZ, M., FONACIER, L., GUTTMAN-YASSKY, E. et al. Atopic dermatitis yardstick: Practical recommendations for an evolving therapeutic landscape. Ann Allergy Asthma Immunol, 2018, 20(1), p. 10–22.
11. CALLEWAETR, C., NAKATSUJI, T., KNIGHT, R. et al. IL-4Rα blockade by dupilumab decreases Staphylococcus aureus colonization and increases microbial diversity in atopic dermatitis. J Invest Dermatol, 2020, 1, p. 191–202.
12. CARTRON, AM., NGUYEN, MH., ROH, YS. et al. Janus kinase inhibitors for atopic dermatitis: a promising treatment modality. Clin Exp Dermatol, 2021, 46 (5), p. 820–824.
13. CELLCEPT. https://www.ema.europa.eu/en/documents/product-information/cellcept-epar-product-information_cs.pdf.
14. CETKOVSKÁ, P., KOJANOVÁ, M., ARENBERGER, P. et al. Přehled současných doporučených postupů pro systémovou „nebiologickou“ léčbu psoriázy. Čes-slov Derm, 2017, roč. 92, s. 3–17.
15. CIBINQO. https://www.ema.europa.eu/en/documents/product-information/cibinqo-epar-product-information_en.pdf, dostupné 1. 1. 2022.
16. CIBINQO. https://www.sukl.cz/modules/medication/detail.php_kod=0255385.
17. COTTER, DG., SCHAIRER, D., EICHENFIELD, L. Emerging therapies for atopic dermatitis: JAK inhibitors. J Am Acad Dermatol, 2018, 78(3 Suppl 1), S53–S62.
18. D´ERME, AM., ROMANELLI, M., CHIRICOZZI, A. Spotlight on dupilumab in the treatment of atopic dermatitis: design, development, and potential place in therapy. Drug Des Devel Ther, 2017, 11, p. 1473–1480.
19. DE BRUIN-WELLER, M., THACI, D., SMITH, C. et al. Dupilumab with concomitant topical corticosteroid treatment in adults with atopic dermatitis with an inadequate response or intolerance to ciclosporin A or when this treatment is medically inadvisable: a placebo-controlled, randomized phase III clinical trial (LIBERTY AD CAFE). Br J Dermatol, 2018, 178(5), p. 1083–1101.
20. DE BRUIN-WELLER, M., BIEDERMANN, T., BISSONNETTE, R. et al. Treat-to-target in atopic dermatitis: an international consensus on a set of core decision points for systemic therapies. Acta Derm Venereol, 2021, 101(2), adv00402. doi: 10.2340/00015555-3751.
21. DE WIJS, LEM., BOSMA, AL., ERLER, NS. et al. Effectiveness of dupilumab treatment in 95 patients with atopic dermatitis: daily practice data. Br J Dermatol, 2019, 182(2), p. 418–426.
22. DE WIJS, LEM., NGUYEN, NT., KUNKELER, ACM. et al. Clinical and histopathological characterization of paradoxical head and neck erythema in patients with atopic dermatitis treated with dupilumab: a case series. Br J Dermatol, 2020, 183 (4), p. 745–749.
23. DUGGAN, S. Tralokinumab: first approval. Drugs, 2021, 81(14), p. 1657–1663.
24. DUPIXENT. https://www.ema.europa.eu/en/documents/product-information/dupixent-epar-product-information_cs.pdf, dostupné 1. 1. 2022.
25. DUPIXENT. https://www.sukl.cz/modules/medication/detail.php?code=0238479&tab=prices.
26. EICHENFIELD, LF., BIEBER, T., BECK, LA. et al. Infections in dupilumab clinical trials in atopic dermatitis: a comprehensive pooled analysis. Am J Clin Dermatol, 2019, 20(3), p. 443–456.
27. FERREIRA, S., GUTTMAN-YASSKY, E., TORRES, T. Selective JAK1 inhibitors for the treatment of atopic dermatitis: focus on upadacitinib and abrocitinib. Am J Clin Dermatol, 2020, 21(6), p. 783–798.
28. FUTAMURA, M., LESHEM, YA., THOMAS, KS. et al. A systematic review of Investigator Global Assessment (IGA) in atopic dermatitis (AD) trials: Many options, no standards. J Am Acad Dermatol, 2016, 74(2), p. 288–294.
29. GERBENS, LAA., HAMANN, SAS., BROUWER, MWD. et al. Methotrexate and azathioprine for severe atopic dermatitis: a 5year follow-up study of a randomized controlled trial. Br J Dermatol, 2018, 178 (6), p. 1288–96.
30. GITTLER, JK., SHEMER, A., SUÁREZ-FARINAS, M. et al. Progressive activation of T(H)2/T(H)22 cytokines and selective epidermal proteins characterizes acute and chronic atopic dermatitis. J Allergy Clin Immunol, 2012; 130(6), p. 1344–1354.
31. GONCALVES, F., FREITAS, E., TORRES, T. Selective IL-13 inhibitors for the treatment of atopic dermatitis. Drugs Context, 2021; 10, p. 2021–1–7.
32. GOODERHAM, MJ., HONG, HC., ESHTIAGHI, P. et al. Dupilumab: A review of its use in the treatment of atopic dermatitis. J Am Acad Dermatol, 2018; 78(3 Suppl. 1), p. S28–36.
33. GUTTMAN-YASSKY, E., BRUNNER, PM., NEUANN, AU. et al. Efficacy and safety of fezakinumab (an IL-22 monoclonal antibody) in adults with moderate-to-severe atopic dermatitis inadequately controlled by conventional treatments: a randomized, double-blind, phase 2a trial. J Am Acad Dermatol, 2018; 78(5), p. 872–881.
34. GUTTMAN-YASSKY, E., BISSONNETTE, R., UNGAR, B. et al. Dupilumab progressively improves systemic and cutaneous abnormalities in patients with atopic dermatitis. J Allergy Clin Immunol, 2019; 143(1), p. 155–172.
35. GUTTMAN-YASSKY, E., PAVEL, AB., ZHOU, L. et al. GBR 830, an anti-OX40, improves skin gene signatures and clinical scores in patients with atopic dermatitis. J Allergy Clin Immunol, 2019; 144(2), p. 482–493.
36. GUTTMAN-YASSKY, E., TEIXEIRA, H. D., SIMPSON, E. L. et al. Once-daily upadacitinib versus placebo in adolescents and adults with moderate-to-severe atopic dermatitis (Measure Up 1 and Measure Up 2): results from two replicate double-blind, randomised controlled phase 3 trials. Lancet, 2021, 397(10290), p. 2151–2168.
37. HAECK, IM., KNOL, MJ., TEN BERGE, O. et al. Enteric-coated mycophenolate sodium versus cyclosporin A as long-term treatment in adult patients with severe atopic dermatitis: A randomized controlled trial. J Am Acad Dermatol, 2011, 64(6), p. 1074–1084.
38. HALLING, AS., LOFT, N., SILVERBERG, JI. et al. Real-world evidence of dupilumab efficacy and risk of adverse events: A systematic review and meta-analysis. J Am Acad Dermatol, 2021, 84(1), p. 139–147.
39. HAMILTON, JD., SUÁREZ-FARINAS, M., DHINGRA, N. et al. Dupilumab improves the molecular signature in skin of patients with moderate-to-severe atopic dermatitis. J Allergy Clin Immunol, 2014, 134(6), p. 1293–1300.
40. HE, H., GUTTMAN-YASSKY, E. JAK inhibitors for atopic dermatitis: an update. Am J Clin Dermatol, 2018, 20(2), p. 181–192.
41. HOWE W, DELLAVALLE RP., LEVY ML., FOWLER J. Treatment of atopic dermatitis (eczema). https://www.uptodate.com/contents/treatment-of-atopic-dermatitis eczema.
42. HOWELL, MD., KUO, FI., SMITH, PA. Targeting the Janus kinase family in autoimmune skin diseases. Front Immunol, 2019, 10, 2342–2342.
43. CHEN, YL., GUTOWSKA-OWSIAK, D., HARDMAN, CS. et al. Proof-of-concept clinical trial of etokimab shows a key role for IL-33 in atopic dermatitis pathogenesis. Sci Transl Med, 2019, 11(515), eaax2945.
44. IMURAN. https://www.ema.europa.eu/en/documents/product-information/cellcept-epar-product-information_cs.pdf.
45. KABASHIMA, K., FURUE, M., HANIFIN, JM. et al. Nemolizumab in patients with moderate-to-severe atopic dermatitis: randomized, phase II, long-term extension study. J Allergy Clin Immunol, 2018, 142(4), p. 1121–1130.
46. KABASHIMA, K., MATSUMURA, T., KOMAZAKI, H. et al. Nemolizumab-JP01 Study Group. Trial of nemolizumab and topical agents for atopic dermatitis with pruritus. N Engl J Med, 2020, 383(2), p. 141–150.
47. KOJANOVÁ, M., FIALOVÁ, J., CETKOVSKÁ, P. et al. Účinnost biologické léčby středně těžké až těžké psoriázy – analýza z registru BIOREP. Čes-slov Derm, 2021, roč. 2, s. 73–79.
48. KOJANOVÁ, M., FIALOVÁ, J., CETKOVSKÁ, P. et al. Atopická dermatitida v registru BIOREP. Čes-slov Derm, 2021, roč. 3, s. 134–141.
49. LAW PING MAN, S., BOUZILLÉ, G., BENETON, N. et al. Drug survival and post-drug survival of first-line immunosuppressive treatments for atopic dermatitis: comparison between methotrexate and cyclosporine. J Eur Acad Dermatol Venereol, 2018, 32(8), p. 1327–1335.
50. LEUNG, DY., GUTTMAN-YASSKY, E. Deciphering the complexities of atopic dermatitis: shifting paradigms in treatment approaches. J Allergy Clin Immunol, 2014, 134(4), p. 769–779.
51. METHOTREXAT. https://www.sukl.cz. trexan-neospc.pdf.
52. NEWSOM, M., BASHYAM, AM., BALOGH, EA. et al. New and emerging systemic treatments for atopic dermatitis. Drugs, 2020, 80(11), p. 1041–1052.
53. NEZAMOLOLAMA, N., FIELDHOUSE, K., METZGER, K. et al. Emerging systemic JAK inhibitors in the treatment of atopic dermatitis: a review of abrocitinib, baricitinib, and upadacitinib. Drugs Context, 2020, 9, 2020-8-5.
54. OLUMIANT. https://www.ema.europa.eu/en/documents/product-information/olumiant-epar-product-information_cs.pdf, dostupné 1. 1. 2022.
55. OLUMIANT. https://www.sukl.cz/modules/medication/detail.php?code=0219354&tab=prices.
56. PALLER, AS., SIEGFRIED, EC., THACI, D. et. al. Efficacy and safety of dupilumab with concomitant topical corticosteroids in children 6 to 11 years old with severe atopic dermatitis: a randomized, double-blinded, placebo-controlled phase 3 trial. J Am Acad Dermatol, 2020, 83(5), p. 1282–1293.
57. PREDNISON. https://www. sukl.cz, prednison-leciva-spc.pdf.
58. REICH, K., TEIXEIRA, HD., DE BRUIN-WELLER, M. et al. Safety and efficacy of upadacitinib in combination with topical corticosteroids in adolescents and adults with moderate-to-severe atopic dermatitis (AD Up): results from a randomised, double-blind, placebo-controlled, phase 3 trial. Lancet, 2021, 397(10290), p. 2169–2181.
59. RICARDO, JW., LIPNER, SR. Considerations for safety in the use of systemic medications for psoriasis and atopic dermatitis during the COVID-19 pandemic. Dermatol Ther, 2020, 33(5), p. e13687.
60. RINVOQ. https://www.ema.europa.eu/en/documents/product-information/rinvoq-epar-product-information_cs.pdf, dostupné 1. 1. 2022.
61. RINVOQ. https://www.sukl.cz/Rozhodnutí_Rinvoq_SUKLS311431_2021.pdf.
62. RUZICKA, T., HANIFIN, JM., FURUE, M. et al. Anti-interleukin-31 receptor a antibody for atopic dermatitis. N Engl J Med, 2017, 37(9), p. 826–835.
63. SANDIMMUN NEORAL. https://www.sukl.cz, sandimmun-neoral-spc-4.pdf.
64. SCHNEEWEISS, MC., PEREZ-CHADA, L., MEROLA, JF. Comparative safety of systemic immuno-modulatory medications in adults with atopic dermatitis. J Am Acad Dermatol, 2021, 85(2), p. 321–329.
65. SIDBURY, R., DAVIS, DM., COHEN, DE. et al. Guidelines of care for the management of atopic dermatitis: section 3. Management and treatment with phototherapy and systemic agents. J Am Acad Dermatol, 2014, 71(2), p. 327–349.
66. SILVERBERG, JI., TOTH, D., BIEBER, T. et al. Tralokinumab plus topical corticosteroids for the treatment of moderate-to-severe atopic dermatitis: results from the double-blind, randomized, multicentre, placebo-controlled phase III ECZTRA 3 trial. Br J Dermatol, 2021, 184(3), p. 450–463.
67. SIMPSON, EL., BIEBER, T., GUTTMAN-YASSKY E. et al. Two phase 3 trials of dupilumab versus placebo in atopic dermatitis. N Engl J Med, 2016, 375(24), p. 2335–2348.
68. SIMPSON, EL., FLOHR, C., EICHENFIELD, LF. et al. Efficacy and safety of lebrikizumab (an anti-IL-13 monoclonal antibody) in adults with moderateto-severe atopic dermatitis inadequately controlled by topical corticosteroids: a randomized, placebo-controlled phase II trial (TREBLE). J Am Acad Dermatol, 2018, 78(5), p. 863–871.
69. SIMPSON, EL., PALLER, AS., SIEGFRIED, EC. et al. Efficacy and safety of dupilumab in adolescents with uncontrolled moderate to severe atopic dermatitis: a phase 3 randomized clinical trial. JAMA Dermatol, 2020, 156(1), p. 44–56.
70. SIMSPON, EL., PARNES, JR., SHE, D. et al. Tezepelumab, an anti-thymic stromal lymphopoietin monoclonal antibody, in the treatment of moderate to severe atopic dermatitis: A randomized phase 2a clinical trial. J Am Acad Dermatol, 2019, 80(4), p. 1013–1021.
71. SIMPSON, EL., LACOUR, JP., SPELMAN, L. et al. Baricitinib in patients with moderate-to-severe atopic dermatitis and inadequate response to topical corticosteroids: results from two randomized monotherapy phase III trials. British J Dermatol, 2020, 183(2), p. 242–255.
72. SIMPSON, EL., MEROLA, JF., SILVERBERG, JI. et al. Safety of tralokinumab in adult patients with moderate-to-severe atopic dermatitis: pooled analysis of five randomized, double-blind, placebo-controlled phase II and phase III trials. Br J Dermatol, 2022, 187(6), p. 888–899.
73. SIMPSON, EL., SINCLAIR, R., FORMAN, S. et al. Efficacy and safety of abrocitinib in adults and adolescents with moderate-to-severe atopic dermatitis (JADE MONO-1): a multicentre, double-blind, randomised, placebo-controlled, phase 3 trial. Lancet, 2020, 396(10246), p. 255–266.
74. SNAST, I., REITER, O., HODAK, E. et al. Are biologics efficacious in atopic dermatitis? A systematic review and meta-analysis. Am J Clin Dermatol, 2018, 19(2), p. 145–165.
75. SONG, CH., LEE, JK. Lebrikizumab treatment in adults with asthma. N Engl J Med, 2011, 365(25), p. 2432–2434.
76. SORIA, A., DU-THANH, A., SENESCHAL, J. et al. Development or exacerbation of head and neck dermatitis in patients treated for atopic dermatitis with dupilumab. JAMA Dermatol, 2019, 155(11), p. 1312–1315.
77. SPERGEL JM, LIO PA. Management of severe atopic dermatitis (eczema) in children. https://www.uptodate. com/contents/management-of-severe-atopic-dermatitis-eczema-in children?
78. STANDER, S., YOSIPOVITCH, G., LEGAT, FJ. et al. Trial of nemolizumab in moderate-to-severe prurigo nodularis. N Engl J Med, 2020, 382(8), p. 706–716.
79. THACI, D., SIMPSON, E., DELEURAN, M. et al. Efficacy and safety of dupilumab monotherapy in adults with moderate-to-severe atopic dermatitis: a pooled analysis of two phase 3 randomized trials (LIBERTY AD SOLO 1 and LIBERTY AD SOLO 2). J Dermatol Sci, 2019, 94(2), p. 266–275.
80. THYSSEN, JP., DE BRUIN-WELLER, MS., PALLER, AS. et al. Conjunctivitis in atopic dermatitis patients with and without dupilumab therapy – international eczema council survey and opinion. J Eur Acad Dermatol Venereol, 2019, 33(7), p. 1224–1231.
81. TORRES, T., GONÇALO, M., PAIVA LOPES, MJ. et al. Portuguese recommendations for the treatment of atopic dermatitis with biologic therapy and JAK inhibitors in adult patients. Drugs Context, 2021, 10, p. 2021-9-5.
82. ULTSCH, M., BEVERS, J., NAKAMURA, G. et al. Structural basis of signaling blockade by anti-IL-13 antibody lebrikizumab. J Mol Biol, 2013, 425(8), p. 1330–1339.
83. WEIDINGER, S., BECK, LA., BIEBER, T. et al. Atopic dermatitis. Nat Rev Dis Primers, 2018; 4(1), p. 1.
84. WERFEL, T., HERATIZADEH, A., ABERER, W. et al. S2k guideline on diagnosis and treatment of atopic dermatitis – short version. J Dtsch Dermatol Ges, 2016, 14(1), p. 92–106.
85. WERFEL, T., HERATIZADEH, A., ABERER, W. et al. Update „Systemic treatment of atopic dermatitis“ of the S2k-guideline on atopic dermatitis. J Dtsch Dermatol Ges, 2021, 19(1), p. 151–168.
86. WESTON, WL., HOWE, W. Treatment of atopic dermatitis (eczema). https://www.uptodate.com/contents/treatment-of-atopic-dermatitis-eczema.
87. WOLLENBERG, A., ARIENS, L., THURAU, S. et al. Conjunctivitis occurring in atopic dermatitis patients treated with dupilumab-clinical characteristics and treatment. J Allergy Clin Immunol Pract, 2018, 6(5), p. 1778–1780.
88. WOLLENBERG, A., BARBAROT, S., BIEBER, T., et al. Consensus-based European guidelines for treatment of atopic eczema (atopic dermatitis) in adults and children: Part II. J Eur Acad Dermatol Venereol, 2018, 32(6), p. 850–878.
89. WOLLENBERG, A., BECK, LA., BLAUVELT, A. et al. Laboratory safety of dupilumab in moderate-to-severe atopic dermatitis: results from three phase III trials (LIBERTY AD SOLO 1, LIBERTY AD SOLO 2, LIBERTY AD CHRONOS). Br J Dermatol, 2020, 182(5), p. 1120–1135.
90. WOLLENBERG, A., CHRISTEN-ZACH, S., TAIEB, A. et al. European Task Force on Atopic Dermatitis/EADV Eczema Task Force. ETFAD/EADV Eczema task force 2020 position paper on diagnosis and treatment of atopic dermatitis in adults and children. J Eur Acad Dermatol Venereol, 2020, 34(12), p. 2717–2744.
91. WOLLENBERG, A., BLAUVELT, A., GUTTMAN-YASSKY, E. et al. Tralokinumab for moderate-to-severe atopic dermatitis: results from two 52-week, randomized, double-blind, multicentre, placebo-controlled phase III trials (ECZTRA 1 and ECZTRA 2). Br J Dermatol, 2021, 184(3), p. 437–449.
92. WOLLENBERG, A., KINBERGER, M., ARENTS, B. et al. European guideline (EuroGuiDerm) on atopic eczema: part I – systemic therapy. J Eur Acad Dermatol Venereol. 2022 Sep;36(9):1409–1431.
93. WORM, M., SIMPSON, EL., THACI, D. et al. Efficacy and safety of multiple dupilumab dose regimens after initial successful treatment in patients with atopic dermatitis: a randomized clinical trial. JAMA Dermatol, 2020, 156(2), p. 131–143.
94. www.sukl.cz/inhibitory-janus-kinaz-zaverecna-doporuceni-z-evropskeho?highlightWords=JAK+inhibitory, 1. 11. 2022.
95. YTTERBERG, SR., BHATT, DL., MIKULS, TR. et al. ORAL Surveillance Investigators. Cardiovascular and cancer risk with tofacitinib in rheumatoid arthritis. N Engl J Med, 2022, 386(4), p. 316–326.
Štítky
Dermatologie Dětská dermatologie
Článek vyšel v časopiseČesko-slovenská dermatologie
Nejčtenější tento týden
2023 Číslo 3- Isoprinosin je bezpečný a účinný v léčbě pacientů s akutní respirační virovou infekcí
- Condylomata accuminata a jejich prevence i léčba
- Proces hojení ran krok za krokem a co ho může zkomplikovat
- Fexofenadin – nesedativní a imunomodulační antihistaminikum v léčbě alergických projevů
- Miniinvazivní léčba pilonidálního sinu: laserová a podtlaková terapie jako šetrná a účinná modalita
-
Všechny články tohoto čísla
- Atopická dermatitida: současná doporučení pro diagnostiku a léčbu. Část II.
- KONTROLNÍ TEST
- Syfilis s očným postihnutím: analýza štyroch prípadov a prehľad problematiky
- Mnohočetné papuly na tvářích. Stručný přehled
- Zápis ze schůze výboru ČDS konané dne 6. 4. 2023
- Zápis ze schůze výboru ČDS konané dne 11. 5. 2023
- Odborné akce 2023
- Česko-slovenská dermatologie
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- Atopická dermatitida: současná doporučení pro diagnostiku a léčbu. Část II.
- Syfilis s očným postihnutím: analýza štyroch prípadov a prehľad problematiky
- Mnohočetné papuly na tvářích. Stručný přehled
- Odborné akce 2023
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání




